Похожие презентации:
Электролиз. Электролиз расплавов
1.
ТЕМА №10: ЭЛЕКТРОЛИЗРассматриваемые вопросы:
1. Электролиз.
2. Электролиз расплавов.
3. Электролиз водных растворов электролитов. Анодное
окисление и катодное восстановление.
4.
Электролиз
водных
растворов
электролитов
нерастворимыми и растворимыми анодами.
с
5. Потенциал разложения, перенапряжение.
6. Законы электролиза.
7. Практическое использование процесса электролиза.
1
2.
1. ЭлектролизЭлектролиз
–
окислительно-восстановительный
процесс,
протекающий на электродах при прохождении постоянного
электрического тока через раствор или расплав электролита.
При электролизе энергия электрического тока превращается в
энергию химической реакции.
На аноде протекает процесс окисления, на катоде – восстановления.
Анодом является положительный электрод, катодом – отрицательный.
При пропускании тока через раствор (расплав) электролита
положительно заряженные ионы перемещаются к катоду, а отрицательно
заряженные – к аноду.
2
3.
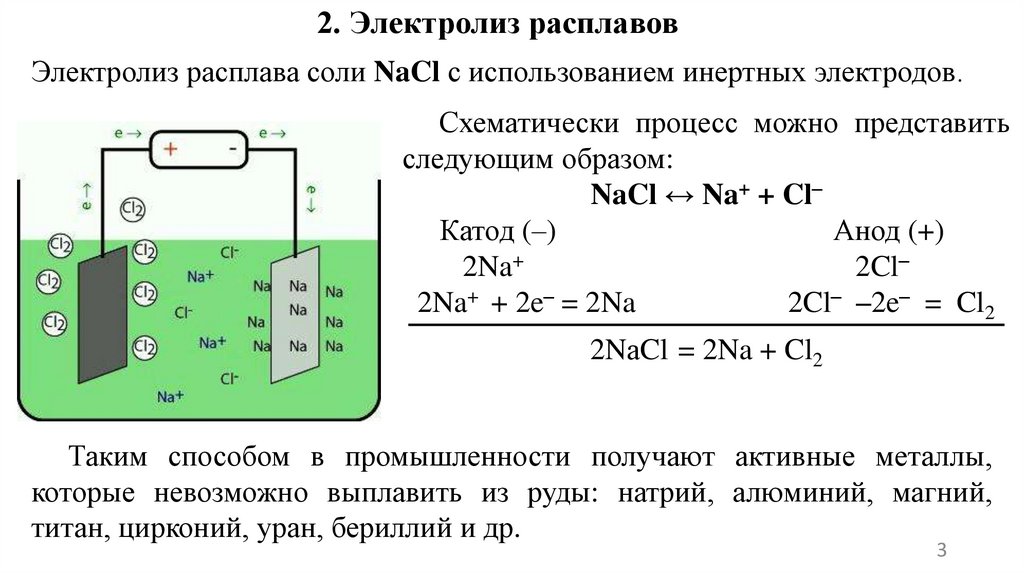
2. Электролиз расплавовЭлектролиз расплава соли NaCl с использованием инертных электродов.
Схематически процесс можно представить
следующим образом:
NaCl ↔ Na+ + Cl–
Катод (–)
Анод (+)
2Na+
2Cl–
2Na+ + 2e– = 2Na
2Cl– –2e– = Cl2
2NаCl = 2Na + Cl2
Таким способом в промышленности получают активные металлы,
которые невозможно выплавить из руды: натрий, алюминий, магний,
титан, цирконий, уран, бериллий и др.
3
4.
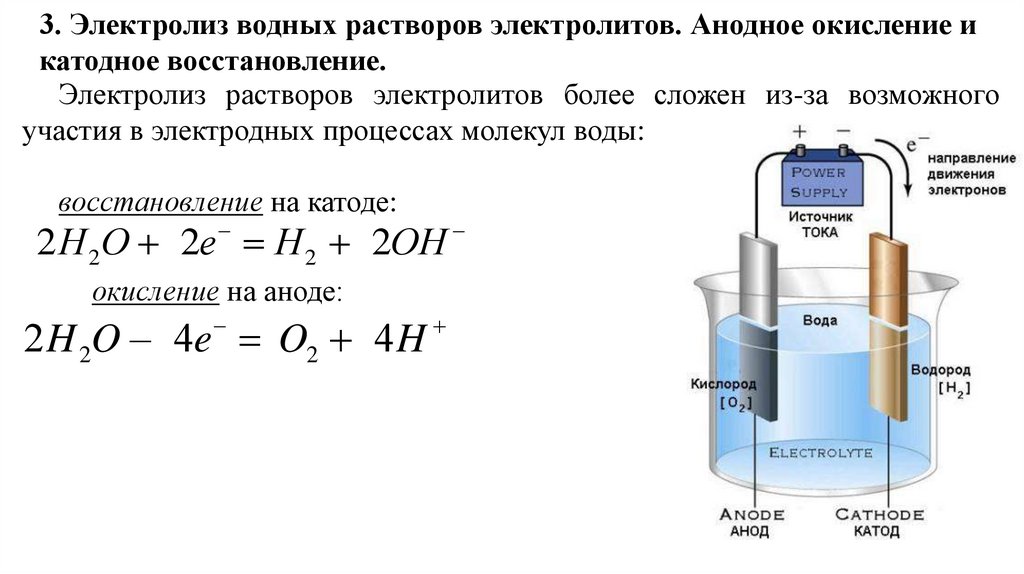
3. Электролиз водных растворов электролитов. Анодное окисление икатодное восстановление.
Электролиз растворов электролитов более сложен из-за возможного
участия в электродных процессах молекул воды:
восстановление на катоде:
2 Н 2O 2e H 2 2OH
окисление на аноде:
2 H 2O – 4e O2 4 H
4
5.
Катодные процессы:В зависимости от стандартного электродного потенциала (φ0) выделяют
3 зоны.
1 зона: Катионы металлов Li, K, Ba, Ca, Na, Mg, Al не
восстанавливаются, а восстанавливаются молекулы воды:
2 Н 2O 2e H 2 2OH
2 зона: Катионы металлов Mn, Cr, Zn, Fe, Cd, Co, Ni, Sn, Pd
восстанавливаются одновременно с молекулами воды:
Men+ + ne– = Me
2 Н 2O 2e H 2 2OH
3 зона: Катионы металлов Bi, Cu, Hg, Ag, Pt, Au легко восстанавливаются:
Men+ + ne– = Me
(Cu2+ + 2e– = Cu)
5
6.
Анодные процессы:Характер реакций, протекающих на аноде, зависит от присутствия
молекул воды и материала анода. При использовании инертных анодов (из
графита, угля, платины) следует учитывать следующее:
1. В первую очередь окисляются простые анионы бескислородных кислот
(S 2–, I –, Br –, Cl –, CN – и др.):
2Cl – – 2e– = Cl2
2. В щелочных растворах на аноде окисляются ионы ОН – :
4OH – 4e O2 2 H 2O
3. Анионы кислородосодержащих кислот (CO32–, NO3–, SO42–, PO43– и др.)
на аноде не окисляются, а окисляются молекулы воды:
2 Н 2O 4e 4 H O2
6
7.
При использовании растворимых анодов (из Cu, Zn, Ag, Ni и др.металлов) растворимый анод сам подвергается окислению, т. е.
посылает электроны во внешнюю цепь и постепенно анод сам
окисляется – растворяется.
Me – ne– = Men+
7
8.
4. Электролиз водных растворов электролитовнерастворимыми и растворимыми анодами
с
Электролиз водного раствора NaCl на инертных электродах.
NaCl ↔ Na + + Cl –
Катод (–) (инертный)
2Na+, Н2О
2Н2O + 2e – = H2 + 2OH –
Анод (+) (инертный)
2Cl–, Н2О
2Cl– –2e– = Cl2
2H2O + 2NaCl = H2 + 2NaOH + Cl2
8
9.
Электролиз водного раствора ZnSO4 на инертных электродах.ZnSO4 ↔ Zn 2+ + SO4 2–
Катод (–) (инертный)
Анод (+) (инертный)
Zn 2+, Н2О
SO4 2–, Н2О
Zn 2+ + 2e– = Zn
2H2O – 4e– = O2 + 4H +
2Н2O + 2e – = H2 + 2OH –
2
Zn 2+ + 2H2O + 2H2O = Zn↓ + H2 + O2 + 2OH – + 4H + + SO4 2–
ZnSO4 + 2H2O = Zn↓ + H2 + O2 + H 2SO4
9
10.
Электролиз водного раствора CuSO4 на инертных электродах.CuSO4 ↔ Cu 2+ + SO4 2–
Катод (–) (инертный)
Анод (+) (инертный)
Cu 2+, Н2О
SO4 2–, Н2О
Cu 2+ + 2e– = Cu
2H2O – 4e– = O2 + 4H +
2CuSO4 + 2H2O = 2Cu + O2 + 2H2SO4
10
11.
Электролиз водного раствора CuCl2 c растворимым (активныммедным анодом).
CuCl2 ↔ Cu 2+ + 2Cl –
Катод (–) (инертный)
Анод (+) (медный)
Cu 2+, Н2О
2Cl –, Н2О
Cu 2+ + 2e– = Cu
Cu – 2e– = Cu 2+
CuCl2+ Cu = Cu + CuCl2
Электролиз сводится к растворению анода, и выделению
металла на катоде.
11
12.
5. Потенциал разложения, перенапряжениеПод действием постоянного электрического тока происходит изменение
равновесных потенциалов вследствие электродной поляризации (φпол). В
результате возникает внутренний ГЭ, ЭДС которого имеет направление
противоположное внешней ЭДС источника тока. Электролиз возможен при
условии компенсации внутренней ЭДС внешним напряжением. Электролиз
начинает протекать при внешнем напряжении, равном напряжению
разложения Uр. Напряжение разложения электролита рассчитывается как
разность равновесных потенциалов выделения веществ на аноде (φА) и катоде
(φК): Uр = φА – φК.
Реально необходимое напряжение разложения электролиза оказывается
больше теоретического на величину перенапряжения (η): η = Uр – φпол.
Перенапряжение зависит от вида материала электрода, природы
выделяемого вещества, плотности тока.
12
13.
6. Законы электролизаЗаконы Фарадея.
I закон
Масса веществ, выделившихся на электродах при электролизе,
прямо пропорциональна количеству электричества, прошедшего
через раствор или расплав электролита:
MЭ I t
m
F
где m – масса вещества, выделившегося на электродах, г;
МЭ – эквивалентная масса выделившегося вещества, г/моль;
I – сила тока, А;
t – время электролиза, с;
F – постоянная Фарадея (F = 96485 А·с/моль; F = 26,8 А·ч/моль).
13
14.
Для газов I закон Фарадея запишется следующим образом:VЭ I t
V
F
3
где V – объем выделившегося газа, дм ;
VЭ = Vm /ne- – эквивалентный объем выделившегося газа, дм3;
Vm =22,4 дм3 / моль – молярный объем идеального газа;
ne- – число электронов, участвующих в реакции на электроде
Показателем эффективности электролиза является выход по току η,
определяемый как отношение массы вещества mпракт, фактически
полученной в данных условиях электролиза, к массе вещества mтеор,
теоретически вычисленной на основании закона Фарадея:
η
mпракт
mтеор
100 %
mпракт 96500
Э I t
100 %.
14
15.
II законПри пропускании одинакового количества электричества через
растворы или расплавы различных электролитов массы веществ,
выделившихся на электродах, пропорциональны молярным массам
их эквивалентов:
m1
m2
m3
const
MЭ1 MЭ 2
MЭ 3
15
16.
7. Практическое использование процесса электролиза.Важнейшее применение электролиз находит в металлургической и
химической промышленности и в гальванотехнике. В металлургической
промышленности электролизом расплавленных соединений и водных
растворов получают металлы, а также производят элетролитическое
рафинирование – очистку металлов от вредных примесей и извлечение
ценных компонентов.
Электролизом расплавов получают металлы, имеющие сильно
отрицательные электродные потенциалы, и некоторые их сплавы.
К гальванотехнике относятся гальваностегия и гальванопластика.
Процессы гальваностегии это нанесение путем электролиза на
поверхность металлических изделий слоев других металлов для
предохранения этих изделий от коррозии, для придания их поверхности
твердости, а также в декоративных целях. Самые распространенные
хромирование, цинкование и никелирование.
16
17.
Гальванопластикой это процессы получения точных металлическихкопий с рельефных предметов электроосаждением металла. Так изготовляют
матрицы для прессования изделий, матрицы для тиснения кожи и бумаги.
Пожарная опасность процессов электролиза:
– электролиз из расплавов предполагает присутствие высоких температур,
что требует выполнения правил пожарной безопасности;
– процессы очень энергоемкие, с использованием электричества, что требует
выполнения правил электробезопасности;
– возможность образования при протекании процессов водорода и кислорода,
которые представляют собой пожароопасные и поддерживающие горение
вещества;
– возможность образования кислот и щелочей, способных вызвать активную
коррозию металлических конструкций электролизера;
– возможность образования хлора, который является химически опасным
веществом.
17















 Химия
Химия








