Похожие презентации:
Электролиз
1.
Электролиз2.
Электролиз – ОВ процесс,протекающий при прохождении постоянного электрического тока через раствор или
расплав электролита.
3.
Электролизная система состоит из:электролизер (электролитическая
ванна),
электроды (инертные или
активные),
электролит (раствор или расплав),
источник постоянного тока.
4.
Катод – электрод, подключенныйк «–» полюсу внешнего источника
тока, на нем идут процессы
восстановления.
Анод – электрод, подключенный к
«+» полюсу внешнего источника
тока, на нем идут процессы
окисления.
5.
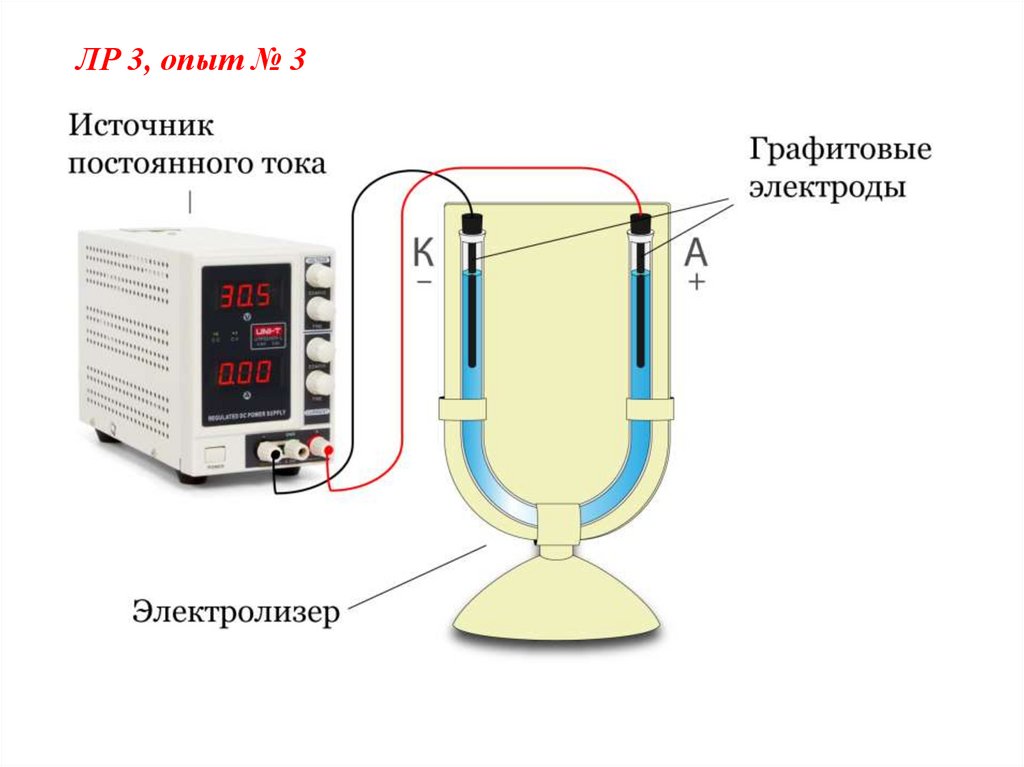
ЛР 3, опыт № 36.
При отсутствии внешнего электрическогополя ионы находятся в беспорядочном
движении.
При
прохождении
постоянного
электрического тока через раствор или
расплав электролита движение ионов
станет направленным: положительные
ионы (катионы) будут двигаться к
катоду, отрицательные (анионы) – к
аноду.
7.
Характерпротекания электродных
процессов при электролизе зависит от:
состава электролита;
pH среды;
концентрации ионов электролита;
материала электродов;
режима электролиза (температуры,
напряжения, плотности тока).
8.
Электролиз растворов электролитовВ процессах на электродах могут участвовать частицы
вещества, молекулы или ионы воды.
ПРАВИЛА ЭЛЕКТРОЛИЗА
Катодные процессы:
1. Катионы активных Ме от Li до Al из водных
растворов
не
восстанавливаются.
Происходит
выделение Н2 из молекул Н2О или ионов Н+ (в
зависимости от рН).
2. Катионы Ме средней активности от Мn до Н
восстанавливаются, но одновременно с молекулами
Н2О или ионами Н+.
Происходит осаждение металла и выделение Н2.
Процесс
выделения
металла
является
преобладающим.
9.
3. Катионы малоактивных Ме, расположенные вряду напряжений после Н , восстанавливаются.
Примечание:
Если
в
р-ре
или
расплаве
электролита
одновременно находятся катионы нескольких Ме и
их концентрации примерно одинаковы, то при
электролизе первыми восстанавливаются катионы
Ме с большим значением φ.
Так, из смеси катионов Ag+, Cu2+, Fe2+ сначала будут восстанавливаться Ag+ (φ0 = 0,79 В), затем Cu2+
(φ0 = 0,34 В) и последними Fe2+ (φ0 = –0,44 В).
10.
Анодные процессы:Характер анодных процессов определяется
материалом анода.
При
использовании
активного
анода
(любой Ме, кроме Au и Pt) окисляется
материал анода вне зависимости от характера
частиц, находящихся у электрода.
Инертные электроды (C, Pt, Au) в процессе
электролиза химически не изменяются, а
служат лишь для передачи электронов во
внешнюю цепь.
11.
При использовании инертного анодана нем идут процессы окисления.
–
–
–
2–
1. Простые анионы (Сl , I , Br , S )
окисляются без участия кислорода.
2. Сложные
кислородсодержащие
–
анионы и анион F из водных растворов
не окисляются. Происходит выделение
–
О2 из молекул Н2О или ионов ОН .
12.
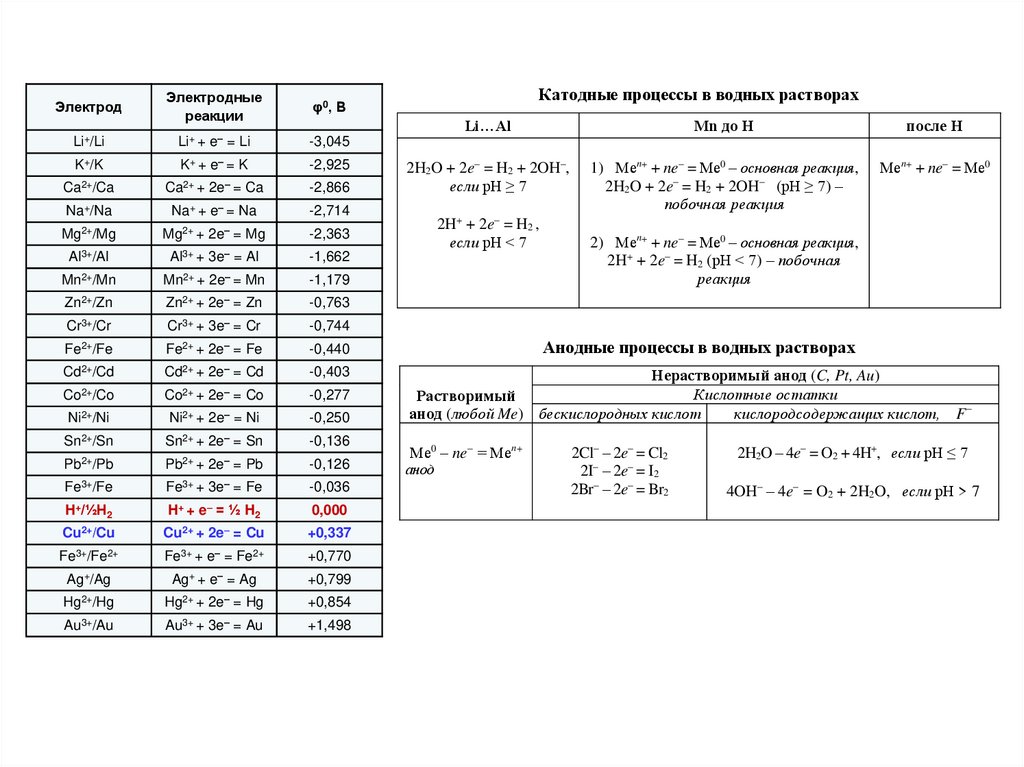
Катодные процессы в водных растворахLi…Al
Мn до Н
после Н
2H2O + 2e– = H2 + 2OH–,
если рН ≥ 7
1) Меn+ + ne– = Ме0 – основная реакция,
2H2O + 2e– = H2 + 2OH– (рН ≥ 7) –
побочная реакция
Меn+ + ne– = Ме0
2H+ + 2e– = H2 ,
если рН < 7
2) Меn+ + ne– = Ме0 – основная реакция,
2H+ + 2e– = H2 (рН < 7) – побочная
реакция
Анодные процессы в водных растворах
Нерастворимый анод (C, Pt, Au)
Кислотные остатки
Растворимый
бескислородных кислот
кислородсодержащих кислот,
анод (Me)
Ме0 – ne– = Меn+
2Cl– – 2e– = Cl2
2Br– – 2e– = Br2
2I– – 2e– = I2
S2– – 2e– = S
F–
2H2O – 4e– = O2 + 4H+, если рН ≤ 7
4OH– – 4e– = O2 + 2H2O, если рН > 7
13.
!!!Катодный процесс:
зависит
только
катиона металла.
от
активности
Анодный процесс:
зависит в первую очередь от
материала анода;
если анод нерастворимый – зависит
от кислотного остатка.
14.
При записи схемы электролиза указываетсяматериал электродов, заряды электродов.
Отрицательный электрод (катод) принято
изображать слева, положительный (анод) –
справа.
Вертикальная
черта
обозначает
границу раздела фаз «электрод – раствор».
Указывается состав раствора электролита,
значение рН.
Если в исходных данных не указано
значение рН водного раствора соли, раствор
считается нейтральным (рН = 7).
15.
ЭлектродЭлектродные
реакции
φ0, В
Li+/Li
Li+ + e– = Li
-3,045
K+/K
K+ + e– = K
-2,925
Ca2+/Ca
Ca2+ + 2e– = Ca
-2,866
Na+/Na
Na+ + e– = Na
-2,714
Mg2+/Mg
Mg2+ + 2e– = Mg
-2,363
Al3+/Al
Al3+ + 3e– = Al
-1,662
Mn2+/Mn
Mn2+ + 2e– = Mn
-1,179
Zn2+/Zn
Zn2+ + 2e– = Zn
-0,763
Cr3+/Cr
Cr3+ + 3e– = Cr
-0,744
Fe2+/Fe
Fe2+ + 2e– = Fe
-0,440
Cd2+/Cd
Cd2+ + 2e– = Cd
-0,403
Co2+/Co
Co2+ + 2e– = Co
-0,277
Ni2+/Ni
Ni2+ + 2e– = Ni
-0,250
Sn2+/Sn
Sn2+ + 2e– = Sn
-0,136
Pb2+/Pb
Pb2+ + 2e– = Pb
-0,126
Fe3+/Fe
Fe3+ + 3e– = Fe
-0,036
H+/½H
H+ + e– = ½ H
2
0,000
Cu2+/Cu
Cu2+ + 2e– = Cu
+0,337
Fe3+/Fe2+
Fe3+ + e– = Fe2+
+0,770
Ag+/Ag
Ag+ + e– = Ag
+0,799
Hg2+/Hg
Hg2+ + 2e– = Hg
+0,854
Au3+/Au
Au3+ + 3e– = Au
+1,498
2
Катодные процессы в водных растворах
Li…Al
Мn до Н
после Н
2H2O + 2e– = H2 + 2OH–,
если рН ≥ 7
1) Меn+ + ne– = Ме0 – основная реакция,
2H2O + 2e– = H2 + 2OH– (рН ≥ 7) –
побочная реакция
Меn+ + ne– = Ме0
2H+ + 2e– = H2 ,
если рН < 7
2) Меn+ + ne– = Ме0 – основная реакция,
2H+ + 2e– = H2 (рН < 7) – побочная
реакция
Анодные процессы в водных растворах
Нерастворимый анод (C, Pt, Au)
Кислотные остатки
Растворимый
кислородсодержащих кислот,
анод (любой Me) бескислородных кислот
Ме0 – ne– = Меn+
анод
2Cl– – 2e– = Cl2
2I– – 2e– = I2
2Br– – 2e– = Br2
F–
2H2O – 4e– = O2 + 4H+, если рН ≤ 7
4OH– – 4e– = O2 + 2H2O, если рН > 7
16.
Катодные процессы в водных растворахЭлектрод
Электродные
реакции
φ0, В
Li+/Li
Li+ + e– = Li
-3,045
K+/K
K+ + e– = K
-2,925
Ca2+/Ca
Ca2+ + 2e– = Ca
-2,866
Na+/Na
Na+ + e– = Na
-2,714
Mg2+/Mg
Mg2+ + 2e– = Mg
-2,363
Al3+/Al
Al3+ + 3e– = Al
-1,662
Mn2+/Mn
Mn2+ + 2e– = Mn
-1,179
Zn2+/Zn
Zn2+ + 2e– = Zn
-0,763
Cr3+/Cr
Cr3+ + 3e– = Cr
-0,744
Fe2+/Fe
Fe2+ + 2e– = Fe
-0,440
Cd2+/Cd
Cd2+ + 2e– = Cd
-0,403
Co2+/Co
Co2+ + 2e– = Co
-0,277
Ni2+/Ni
Ni2+ + 2e– = Ni
Ме0 – ne– = Меn+
-0,250
анод
Sn2+/Sn
Sn2+ + 2e– = Sn
-0,136
Pb2+/Pb
Pb2+ + 2e– = Pb
-0,126
Fe3+/Fe
Fe3+ + 3e– = Fe
-0,036
H+/½H
H+ + e– = ½ H
2
0,000
Cu2+/Cu
Cu2+ + 2e– = Cu
+0,337
Fe3+/Fe2+
Fe3+ + e– = Fe2+
+0,770
Ag+/Ag
Ag+ + e– = Ag
+0,799
Hg2+/Hg
Hg2+ + 2e– = Hg
+0,854
Au3+/Au
Au3+ + 3e– = Au
+1,498
2
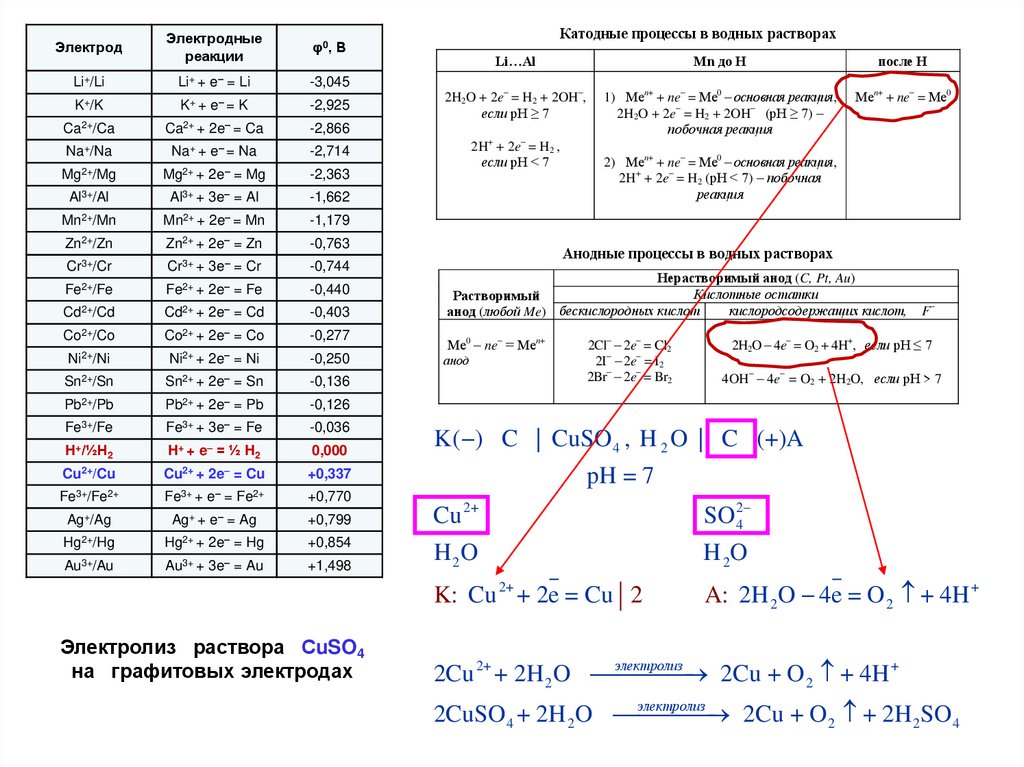
Электролиз раствора СuSO4
на графитовых электродах
Li…Al
Мn до Н
после Н
2H2O + 2e– = H2 + 2OH–,
если рН ≥ 7
1) Меn+ + ne– = Ме0 – основная реакция,
2H2O + 2e– = H2 + 2OH– (рН ≥ 7) –
побочная реакция
Меn+ + ne– = Ме0
2H+ + 2e– = H2 ,
если рН < 7
2) Меn+ + ne– = Ме0 – основная реакция,
2H+ + 2e– = H2 (рН < 7) – побочная
реакция
Анодные процессы в водных растворах
Нерастворимый анод (C, Pt, Au)
Кислотные остатки
Растворимый
кислородсодержащих кислот,
анод (любой Me) бескислородных кислот
2Cl– – 2e– = Cl2
2I– – 2e– = I2
2Br– – 2e– = Br2
F–
2H2O – 4e– = O2 + 4H+, если рН ≤ 7
4OH– – 4e– = O2 + 2H2O, если рН > 7
K( ) C | CuSO 4 , H 2 O | C (+)A
pH = 7
Cu 2+
SO 42
H 2O
H 2O
K: Cu 2+ + 2e = Cu 2
A: 2H 2 O 4e = O 2 + 4H +
электролиз
2Cu 2+ + 2H 2 O
2Cu + O 2 + 4H +
электролиз
2CuSO 4 + 2H 2 O
2Cu + O 2 + 2H 2SO 4
17.
Электролиз раствора СuSO4на инертных (графитовых) электродах:
K( ) C | CuSO 4 , H 2 O | C (+)A
pH = 7
Cu 2+
SO 24
H 2O
H 2O
K: Cu 2+ + 2e = Cu 2
A: 2H 2 O 4e = O 2 + 4H +
электролиз
2Cu 2+ + 2H 2 O
2Cu + O 2 + 4H +
электролиз
2CuSO 4 + 2H 2 O
2Cu + O 2 + 2H 2SO 4
18.
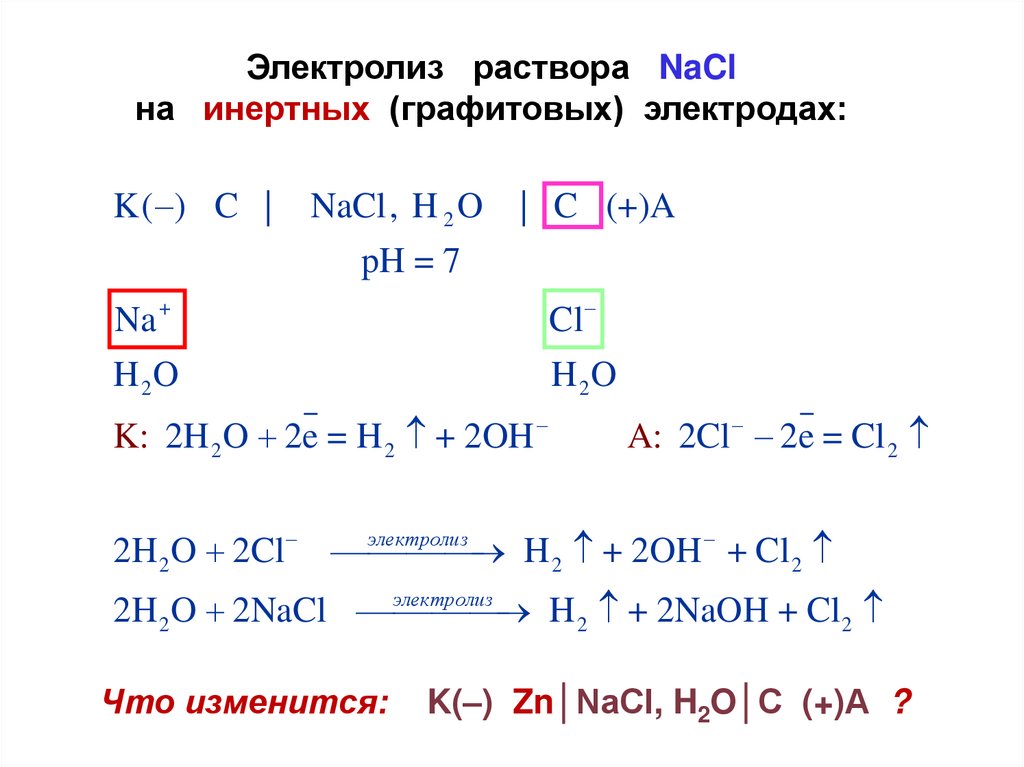
Электролиз раствора NaClна инертных (графитовых) электродах:
K( ) C |
NaCl, H 2 O
| C (+)A
pH = 7
Cl
H 2O
Na +
H 2O
K: 2H 2 O 2e = H 2 + 2OH
A: 2Cl 2e = Cl 2
электролиз
2H 2 O 2Cl
H 2 + 2OH + Cl 2
электролиз
2H 2 O 2NaCl
H 2 + 2NaOH + Cl2
Что изменится:
K(–) Zn│NaCl, H2O│C (+)А ?
19.
В результатереакций, идущих у
электродов, возможно изменение pH
раствора у этих электродов:
C H + pH
C OH pH
Этот
факт
используется
как
экспериментальное
доказательство
реакций, идущих на электродах.
20.
ЛР 3, опыт № 3Электролиз NaCl
На катоде выделяется газ Н2 и образуется
щелочь NaОН. Увеличение СОН_ обусловило
изменение
окраски
фенолфталеина
в
малиновый цвет.
На аноде выделяется газ Cl2. Качественная
реакция на молекулярный хлор:
Cl2 + 2KI = 2KCl + I2 ;
I2 + крахмал синий цвет.
21.
Электролиз раствора Na2SO4на инертных (платиновых) электродах:
K( ) Pt | Na 2SO 4 , H 2 O | Pt (+)A
pH = 7
Na +
SO 42
H 2O
H 2O
K: 2H 2 O 2e = H 2 + 2OH 2
A: 2H 2O 4e = O 2 + 4H +
электролиз
4H 2 O + 2H 2 O
2H 2 + 4OH + O 2 + 4H +
электролиз
2H 2 O
2H 2 + O 2
Вторичные процессы:
Na + + OH = NaOH
2H + + SO 42 = Н 2SO 42
22.
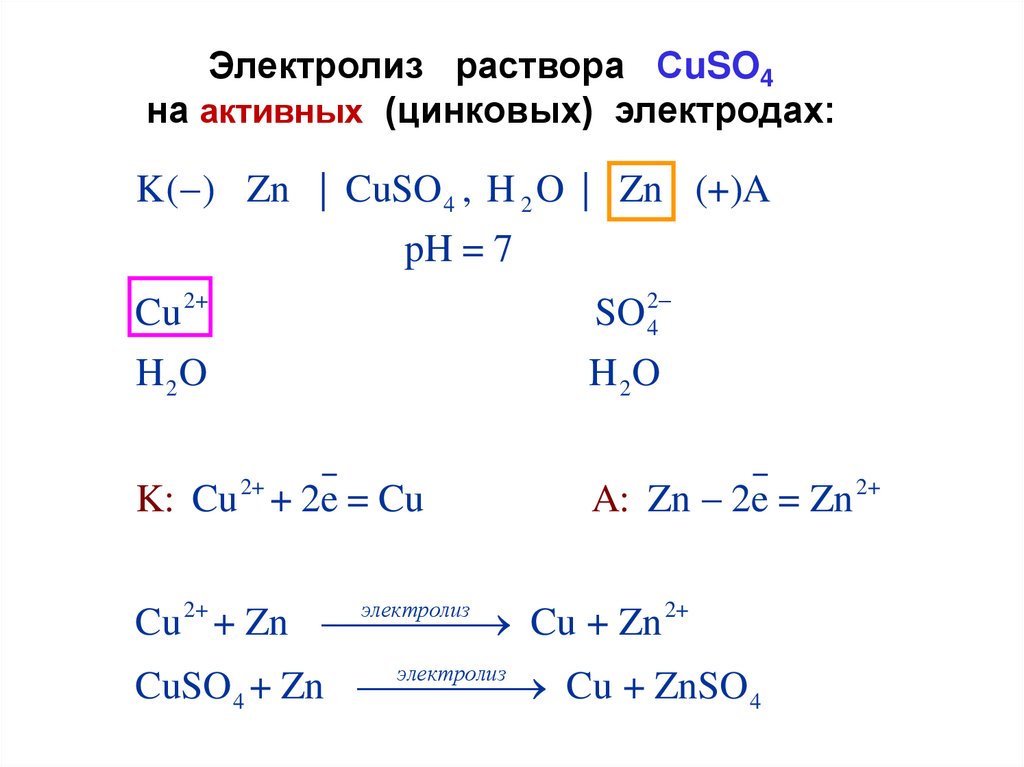
Электролиз раствора СuSO4на активных (цинковых) электродах:
K( ) Zn | CuSO 4 , H 2 O | Zn (+)A
pH = 7
Cu 2+
SO 24
H 2O
H 2O
K: Cu 2+ + 2e = Cu
A: Zn 2e = Zn 2+
электролиз
Cu 2+ + Zn
Cu + Zn 2+
электролиз
CuSO 4 + Zn
Cu + ZnSO 4
23.
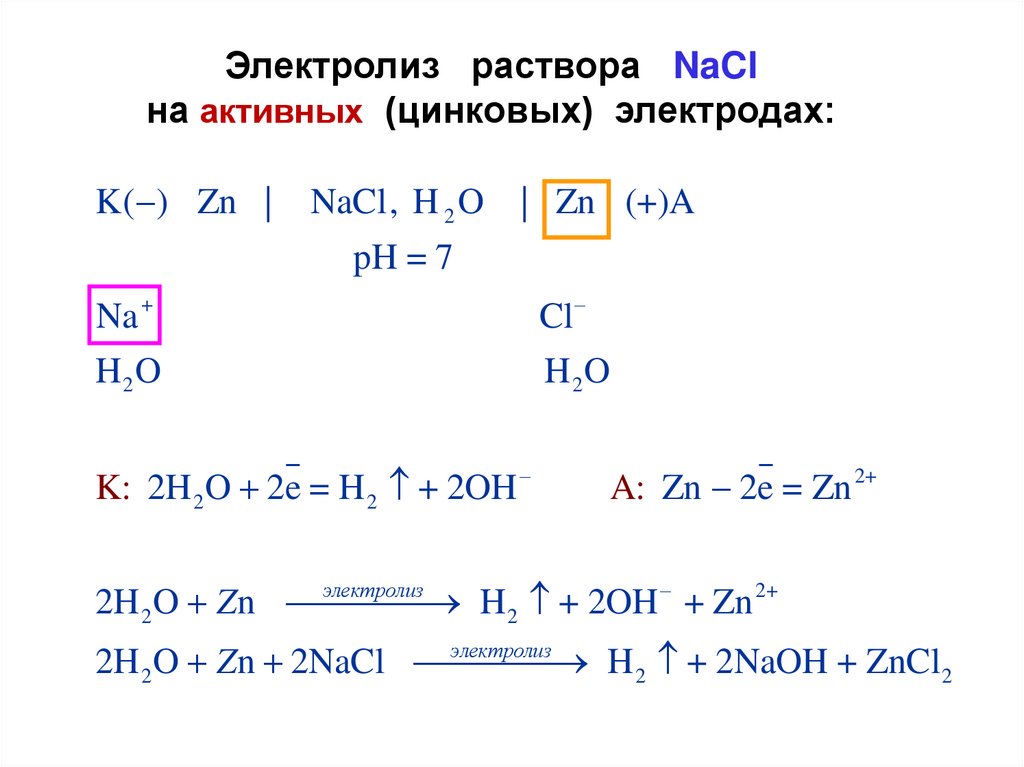
Электролиз раствора NaClна активных (цинковых) электродах:
K( ) Zn |
NaCl, H 2 O
| Zn (+)A
pH = 7
Na +
H 2O
K: 2H 2 O 2e = H 2 + 2OH
Cl
H 2O
A: Zn 2e = Zn 2+
электролиз
2H 2 O Zn
H 2 + 2OH + Zn 2+
электролиз
2H 2 O Zn 2NaCl
H 2 + 2NaOH + ZnCl2
24.
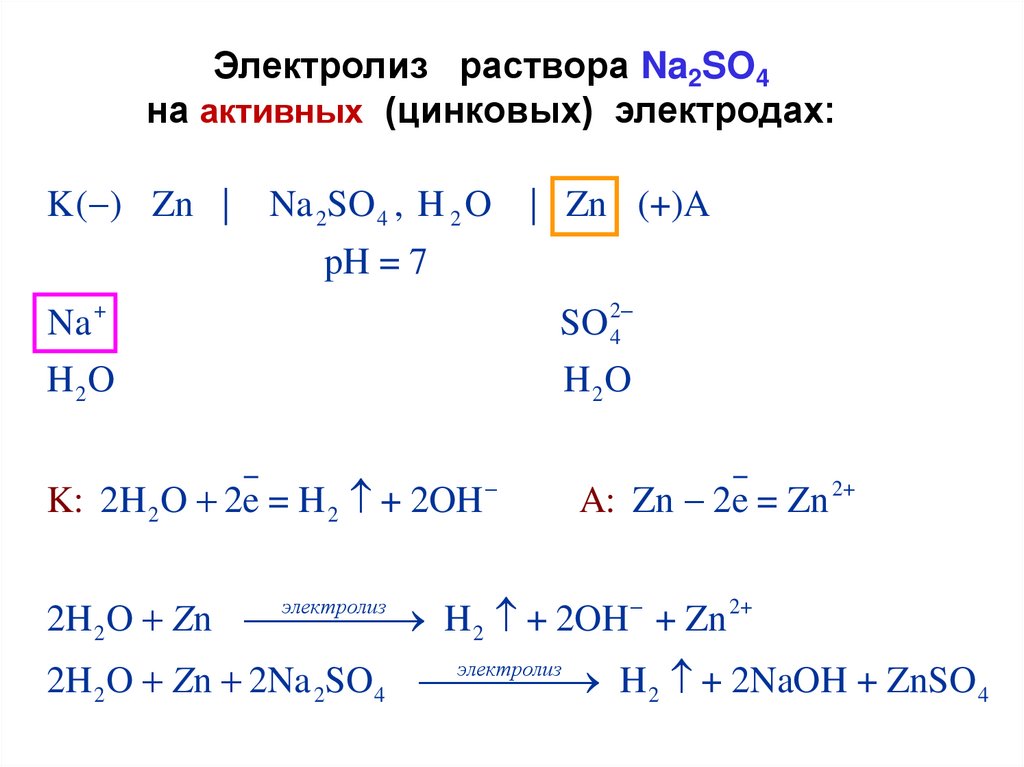
Электролиз раствора Na2SO4на активных (цинковых) электродах:
K( ) Zn |
Na 2SO 4 , H 2 O
| Zn (+)A
pH = 7
Na +
SO 24
H 2O
H 2O
K: 2H 2 O 2e = H 2 + 2OH
A: Zn 2e = Zn 2+
электролиз
H 2 + 2OH + Zn 2+
2H 2 O Zn
электролиз
H 2 + 2NaOH + ZnSO 4
2H 2 O Zn 2Na 2SO 4
25.
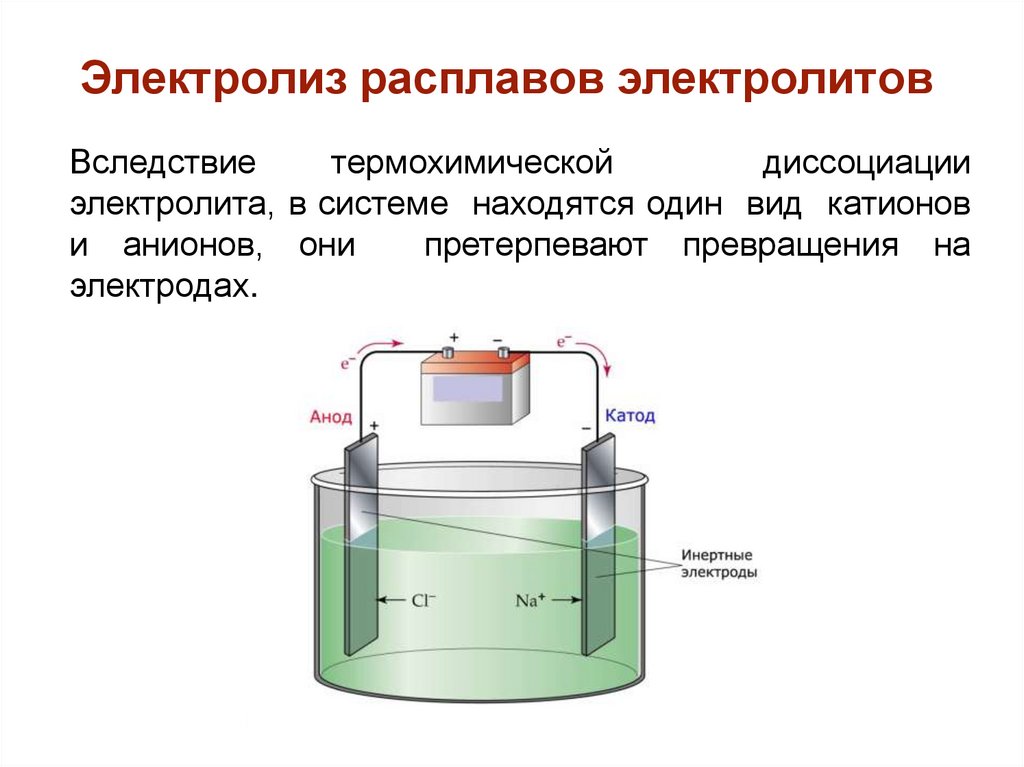
Электролиз расплавов электролитовВследствие
термохимической
диссоциации
электролита, в системе находятся один вид катионов
и анионов, они
претерпевают превращения на
электродах.
26.
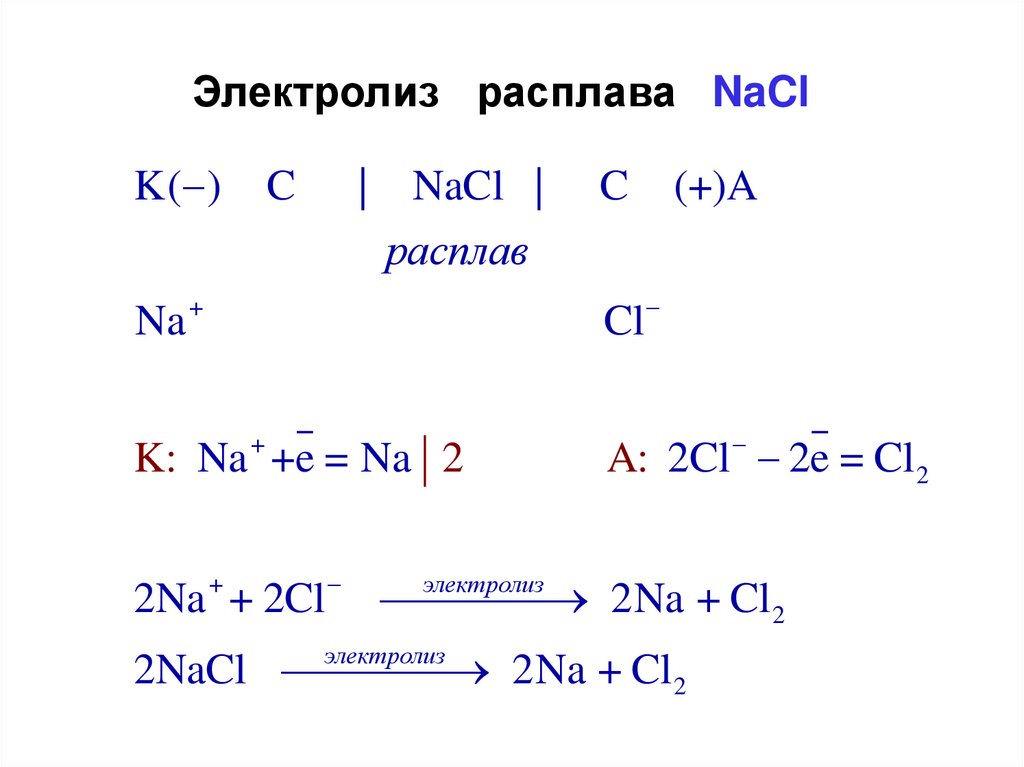
Электролиз расплава NaClK( )
C
|
NaCl |
расплав
C
(+)A
Na +
Cl
K: Na + +e = Na 2
A: 2Cl 2e = Cl 2
электролиз
2Na + + 2Cl
2Na + Cl2
электролиз
2NaCl
2Na + Cl2
27.
Количественные характеристики процессов электролизаустанавливаются
законами
Фарадея:
I закон Фарадея;
II закон Фарадея.
28.
I закон ФарадеяМасса или объём вещества, претерпевшего
изменение на электродах, прямо пропорциональна
количеству прошедшего
через раствор или
расплав электролита электричества:
m = k·Q или V = k·Q ,
где m – масса образовавшегося или подвергшегося
превращению вещества, г;
V – объем вещества, выделившегося на электродах, л;
k
–
электрохимический
эквивалент
вещества
(коэффициент пропорциональности), г/Кл или л/Кл;
Q = I·τ – количество электричества, Кл (ампер·секунда);
I – сила тока, A;
τ – время прохождения тока, с.
29.
II закон ФарадеяПри прохождении одинакового количества электричества
через растворы (расплавы) электролитов массы (объемы)
выделяющихся
веществ
пропорциональны
их
эквивалентным массам (объемам):
m1 = m 2 ;
Э1
Э2
V1 = V2 ;
VЭ1 VЭ 2
m1 = V2
Э1 VЭ 2
где m1, m2 и V1, V2 – массы и объемы веществ,
выделившихся на электродах, г (л);
Э1, Э2 и VЭ1, VЭ2 – эквивалентные массы и эквивалентные
объёмы веществ, г/моль (л/моль).
!!!
Э(H2) = 1 г/моль; VЭ(H2) = 11,2 л/моль;
Э(О2) = 8 г/моль; VЭ(О2) = 5,6 л/моль.
30.
Следствия из II закона Фарадея:При
прохождении
через
электролит
количества
электричества Q=F масса превращенного вещества m=Э
(или V=VЭ). Тогда Э = k·F или VЭ = k·F, откуда
k=Э,
F
Vэ
k= .
F
Объединенное уравнение законов Фарадея:
Vэ
Э
A
m = k Q I τ =
I τ или V =
I τ
F
В F
F
где Э = А / В;
А – атомная масса, г/моль;
В – валентность элемента в соединении;
F = 96500 Кл = 26,8 А·ч – постоянная Фарадея (заряд,
который несет на себе один моль электронов или
один моль однозарядных ионов).
31.
Количество вещества эквивалента nэ (или числоэквивалентов в-ва) определяется:
m
nЭ =
,
Э
V
nЭ =
.
VЭ
Из II закона Фарадея получаем: nэ1 = nэ2 .
Одинаковые
количества
электричества
преобразуют на электродах одинаковое число
эквивалентов любых веществ.
При
прохождении количества электричества 1F
выделяется 1 моль эквивалентов любых веществ.
След-но, для получения nэ моль эквивалентов
необходимо nF зарядов электричества.
32.
Пример. При электролизе раствора AgNO3 на анодевыделилось 0,28 л O2. Сколько серебра выделилось на
катоде и какое количество электричества для этого
потребовалось?
Решение.
V(О2) = 0,28 л, Vэ(О2) = 5,6 л/моль, след-но, на аноде
выделилось nЭ = V / VЭ = 0,28 / 5,6 = 0,05 моль
эквивалентов О2 .
Согласно II закону Фарадея на катоде восстановилось
столько
же
эквивалентов
серебра,
т.е.
масса
выделившегося металла составила:
mAg = nЭ·ЭAg = 0,05·108 = 5,4 г, где
ЭAg = A / n = 108 / 1 = 108 г/моль.
Для этого потребовалось 0,05F зарядов электричества,
т.е. Q = nЭ · F = 0,05 ∙ 96500 = 4825 Кл.
33.
Массы выделившихся при электролизевеществ
зависят
от
количества
прошедшего
электричества
и
эквивалентов этих веществ и не зависят
от
давления,
температуры
и
концентрации электролита.
34.
Выход по току ВтПоказателем
эффективности
электролиза является величина
выхода по току:
m
BТ = mпракт 100%
теор
Q
или BТ = теор 100%
Qпракт
Qпракт > Qтеор из-за явления поляризации и перенапряжения.
Вт < 100%
35.
Вреальных
электролизных
системах
накопление
продуктов
электролиза
на
электродах изменяет их природу и величину
электродных
потенциалов
(наблюдается
явление
химической
поляризации).
В
результате между электродами возникает
разность потенциалов, направленная против
внешней ЭДС (внутренний гальванический
элемент). Катод становится анодом, анод –
катодом. Процессы на электродах идут в
противоположных электролизу направлениях.
ЭДС внутреннего гальванического элемента
называется ЭДС поляризации (Eполяр).
36.
Для преодоления поляризации на электродыизвне
подается
избыточное
напряжение,
называемое перенапряжением (η – «эта»):
ηk – перенапряжение выделения в-ва на катоде;
ηa – перенапряжение выделения в-ва на аноде.
Перенапряжение зависит от:
природы выделяемого вещества,
материала электрода,
плотности тока и др. факторов.
Перенапряжение Ме при их выделении на катоде
невелико,
им
обычно
пренебрегают.
Велики
перенапряжения при выделении газов, особенно H2 и О2.
37.
Минимальная разность потенциалов,при которой процесс электролиза
становится возможным, называется
ЭДС
разложения
электролита
(Еразл):
E разл = Е поляр + η к + η а
38.
ПРИМЕНЕНИЕ ЭЛЕКТРОЛИЗА1. Электрохимическое производство химических
продуктов:
получение Сl2 и NaOH (электролиз водного р-ра NaCl);
получение Н2 и О2 (электролиз воды) и т.д.
2. Электрометаллургия:
электроэкстракция – выделение Ме из р-ра электрохимическим путем. Руду или концентрат растворяют,
затем ведется электролиз с нерастворимыми анодами.
получение щелочных и щелочноземельных Ме и Аl
электролизом расплавов;
электрорафинирование Ме – электролизная очистка
металлов от примесей. Процесс состоит в анодном
растворении загрязненного металла и в последующем
его катодном осаждении.
39.
3. Гальванотехника:гальваностегия – нанесение Ме-х покрытий;
гальванопластика – получение изделий
электролиза.
путем
4. Электрохимическая обработка металлов и сплавов.
Для изменения размеров и формы, а также состояния
поверхности Ме-х изделий используют Э/Х способы
обработки:
электрохимическая размерная обработка,
электролитическое
травление,
электролитическое
полирование, анодирование.
5. Электрохимические преобразователи информации –
хемотроны – электрохимические диоды. Позволяют
осуществить
восприятие,
хранение, переработку,
воспроизведение и
передачу информации и могут
функционировать в качестве элементов
или
блоков
вычислительных и управляющих устройств.
40.
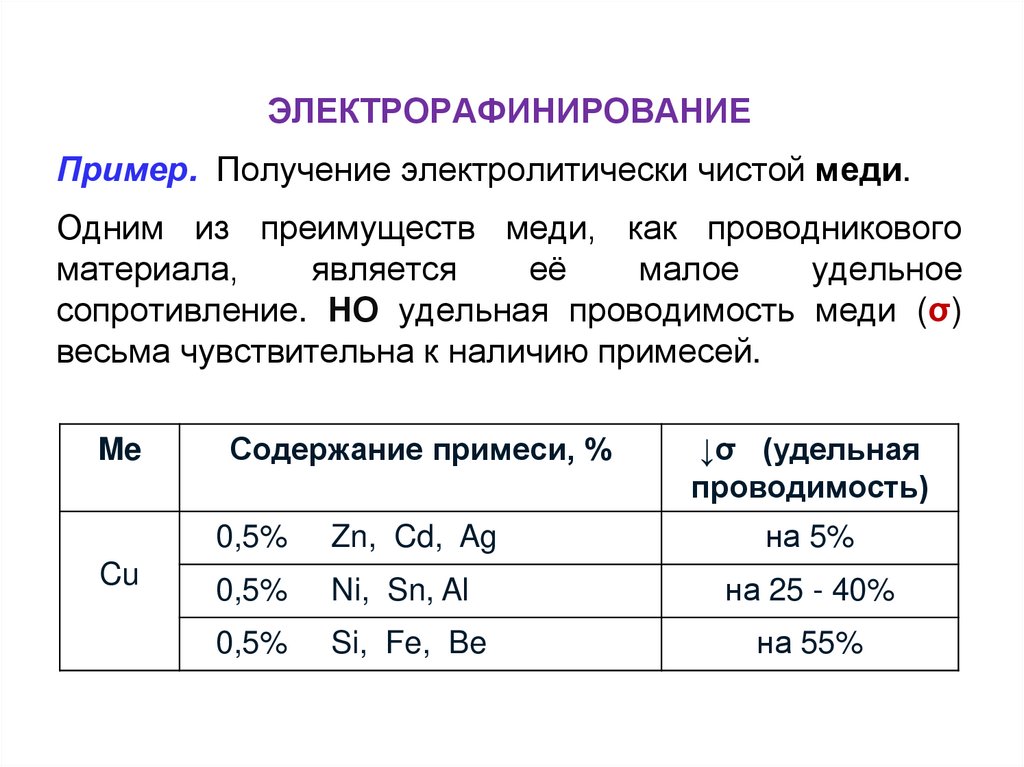
ЭЛЕКТРОРАФИНИРОВАНИЕПример. Получение электролитически чистой меди.
Одним из преимуществ меди, как проводникового
материала,
является
её
малое
удельное
сопротивление. НО удельная проводимость меди (σ)
весьма чувствительна к наличию примесей.
Me
Cu
Содержание примеси, %
↓σ (удельная
проводимость)
0,5%
Zn, Cd, Ag
на 5%
0,5%
Ni, Sn, Al
на 25 - 40%
0,5%
Si, Fe, Be
на 55%
41.
Электрорафинирование медиK(–) Cu CuSO4, H2O Cu
φ
↓
(чистая медь)
0
+0,34
К: Cu2+ + 2e = Cu
( Fe,
↓
(черновая)
Pb,
Ag ) (+)А
(примеси)
+0,34 (–0,44; –0,126;
А: Fe – 2e = Fe2+
Pb – 2e = Pb2+
Сu – 2e = Cu2+
+0,8)
в растворе
Ag0 – в осадке (шлам)
Вместе с окислением медного анода окисляются примеси более
активных Ме, чем Cu. Окисление идет тем быстрее, чем меньше φ
Ме. Ионы Fe2+ и Pb2+ остаются в р-ре, на катоде восстанавливаются
только ионы Cu2+. Примеси менее активных Ме (Ag) не окисляются
(составляют электролизный шлам).
42.
ГАЛЬВАНОСТЕГИЯПример. Э/Х система для получения никелевого покрытия
на стальной подложке (Fe – сталь):
К(–) Fe NiSO4, H2O Ni (+)A
2+
2+
К: Ni + 2e = Ni
А: Ni – 2e = Ni
Железный катод покрывается Ni. Р-р истощается ионами
Ni2+ (т.к. Ni оседает на катоде), поэтому для пополнения
р-ра ионами Ni2+ нужно брать растворимый Ni-вый анод.
На практике рН подбирается индивидуально, поэтому в
схеме его не пишем.
!!!
Приведенная выше схема является модельной схемой
получения любого Ме-го покрытия.
Покрываемое изделие должно быть катодом.
Используют растворимые аноды и электролит,
содержащий ионы металла покрытия.
































 Химия
Химия








