Похожие презентации:
Органические соединения (тема 11)
1.
Модуль №3ТЕМА №11: ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Рассматриваемые вопросы:
1. Общие представления.
2. Теория химического строения органических соединений
А.М. Бутлерова. Изомерия.
3. Номенклатура органических соединений:
– алканы,
– алкены, алкадиены,
– алкины,
– карбо- и гетероциклические углеводороды.
1
2.
1. Общие представления, область примененияорганических соединений
Органические вещества – это соединения углерода. Отличаются от
неорганических многочисленностью и многообразием превращений.
Неорганических соединений насчитывается порядка 500 тысяч,
органических соединений известно свыше 100 миллионов.
Атомы углерода способны соединяться друг с другом в прочные
длинные цепи и замкнутые циклы.
Цепи атомов O, N, P, S, B, Si и других элементов малоустойчивы.
В состав цепей и циклов молекул органических соединений могут
входить О, S, N, P, As, Si, Ge, Sn, Pb, B, Ti и другие элементы.
2
3.
Области применения• Лекарственные вещества.
• Высокомолекулярные соединения: синтетические смолы и
органическое стекло; пластмассы и синтетические волокна;
синтетический каучук.
• Красящие вещества (красители).
• Гербициды (вещества, уничтожающие сорняки).
• Инсектициды и фунгициды (вещества, уничтожающие,
соответственно насекомых и грибки).
• Ферменты (сложные органические соединения, являющиеся
биологическими катализаторами, вызывающими процессы
брожения, расщепления жиров, белков и т.п.)
3
4.
• Десиканты (соединения, способствующие высушиванию растенийна корню).
• Дефолианты (вещества, ускоряющие опадение
применение их облегчает машинную уборку).
листьев;
• Витамины (сложные физиологически активные органические
вещества, присутствие которых в пище человека необходимо для
нормальных функций организма).
• Консерванты (органические вещества, предохраняющие от
закисания и порчи вина, соки, варенья, маринады и другие пищевые
продукты).
• Переработка каменного угля, нефти и природного газа: получение
различных видов топлива, многочисленных
органических
соединений для синтеза ВМС, красителей, лекарственных и
взрывчатых веществ и т.п.
4
5.
2. Теория химического строения органических соединений.Изомерия.
Основные положения теории химического строения
органических веществ сформулированы А.М. Бутлеровым:
1) молекулы веществ
представляют собой реально
существующие
материальные
частицы,
обладающие
определенным химическим строением (т.е. атомы, образующие
их,
соединяются
друг
с
другом
в
определенной
последовательности и взаимно влияют друг на друга).
2) строение молекул вещества познаваемо и может быть
установлено путем изучения его свойств, продуктов его
превращений, а также путем его разложения и синтеза;
5
6.
3) свойства вещества определяются его качественным иколичественным составом и химическим строением его молекул.
4) взаимное влияние атомов, образующих молекулу,
определяет реакционную способность каждого из них;
химический характер одних и тех же атомов в различных
молекулах зависит от того, с какими атомами они связаны в
данной молекуле;
5) углерод в органических соединениях, как правило,
4-валентен; атомы его способны соединяться не только с другими
атомами, но и друг с другом, образуя цепи; последние могут
замыкаться с образованием циклов.
6
7.
Изомеры – это вещества одинаковые по атомномусоставу и молекулярной массе, но различающиеся по
строению или расположению атомов в пространстве и,
вследствие этого, по свойствам.
Виды изомерии:
1) углеродного скелета;
2) положение кратных связей;
3) положение функциональных групп;
4) пространственная изомерия (цис-; транс- изомеры);
5) межклассовая.
7
8.
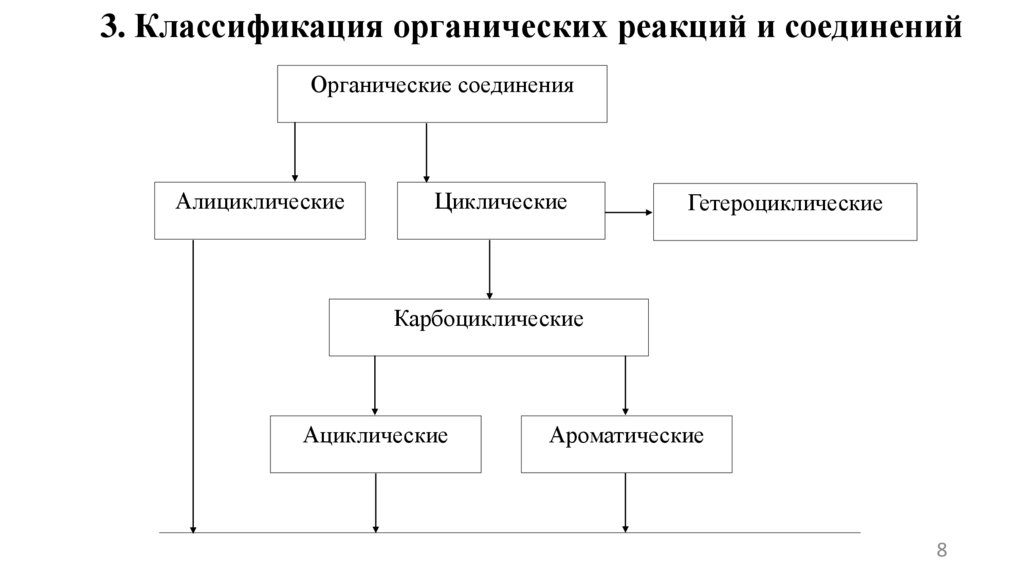
3. Классификация органических реакций и соединенийОрганические соединения
Алициклические
Циклические
Гетероциклические
Карбоциклические
Ациклические
Ароматические
8
9.
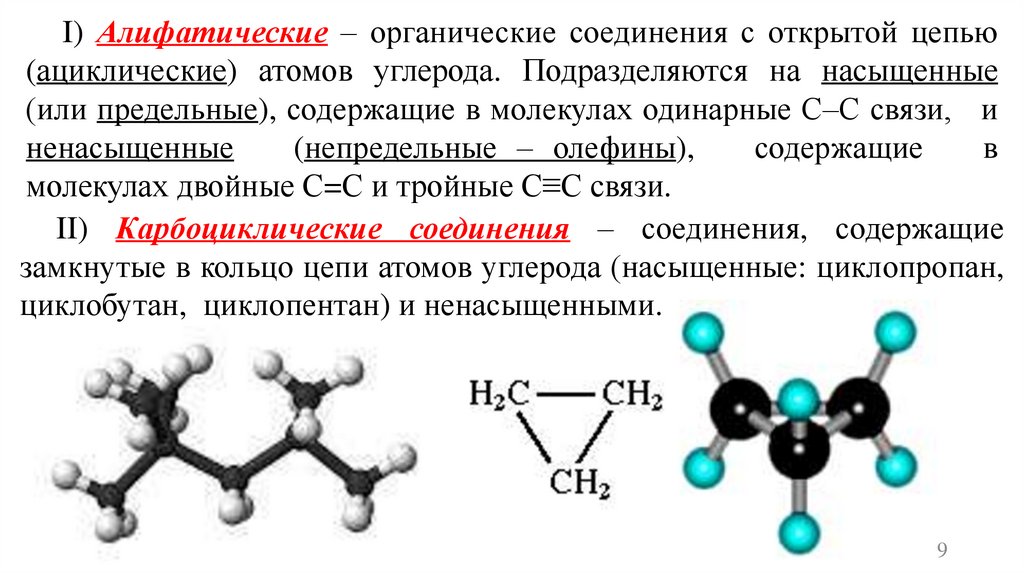
I) Алифатические – органические соединения с открытой цепью(ациклические) атомов углерода. Подразделяются на насыщенные
(или предельные), содержащие в молекулах одинарные С–С связи, и
ненасыщенные
(непредельные – олефины),
содержащие
в
молекулах двойные С=С и тройные С≡С связи.
II) Карбоциклические соединения – соединения, содержащие
замкнутые в кольцо цепи атомов углерода (насыщенные: циклопропан,
циклобутан, циклопентан) и ненасыщенными.
9
10.
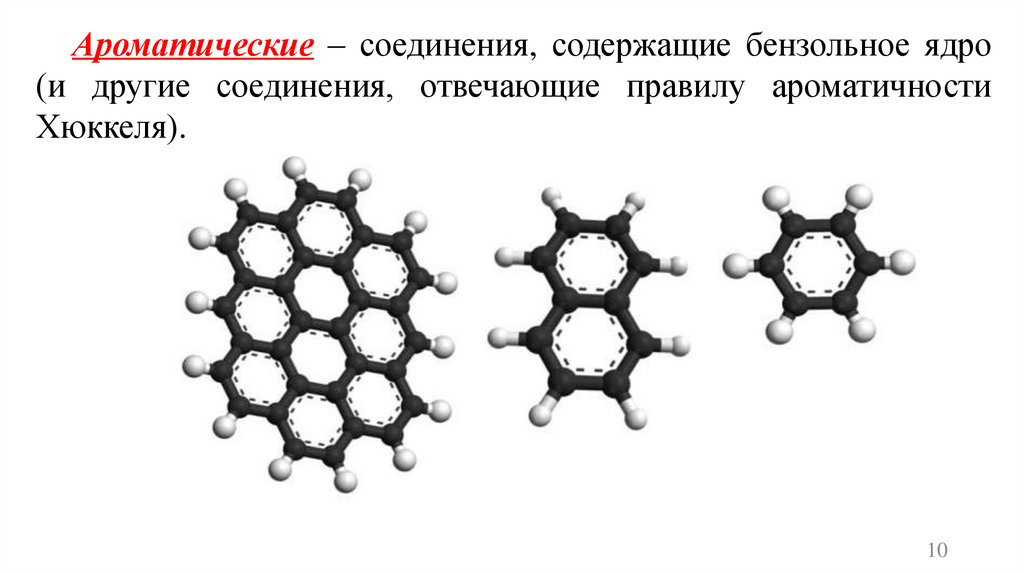
Ароматические – соединения, содержащие бензольное ядро(и другие соединения, отвечающие правилу ароматичности
Хюккеля).
10
11.
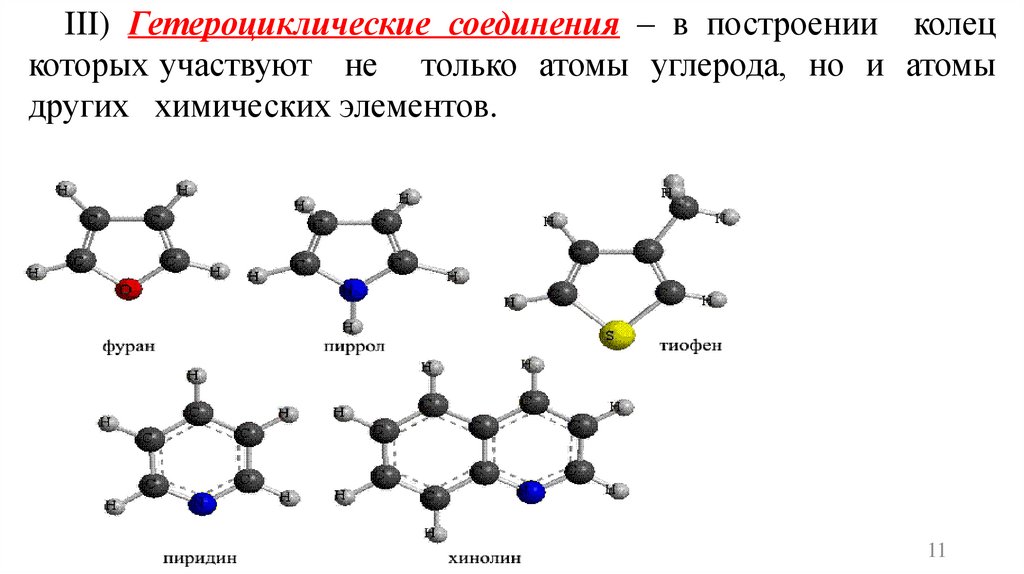
III) Гетероциклические соединения – в построении колецкоторых участвуют не только атомы углерода, но и атомы
других химических элементов.
11
12.
Классификация органических реакций.I) По результатам реакции:
1) реакции присоединения (характерны для ненасыщенных
соединений) R—CH=CH2 + Br2 R—CHBr—CH2Br
2) реакции отщепления (элиминирования) (в результате
отщепляются простые или сложные вещества)
R—CHBr—CH2—R' + KOH R—CH = CH—R' +KBr + H2O
3) реакции замещения (атом или группа атомов в соединении
замещаются на другой атом или группу атомов)
RH + Cl2 RCl + HCl
4) реакции изомеризации
CH3—CH2—CH2—CH3 CH3—CH—CH3
CH3
12
13.
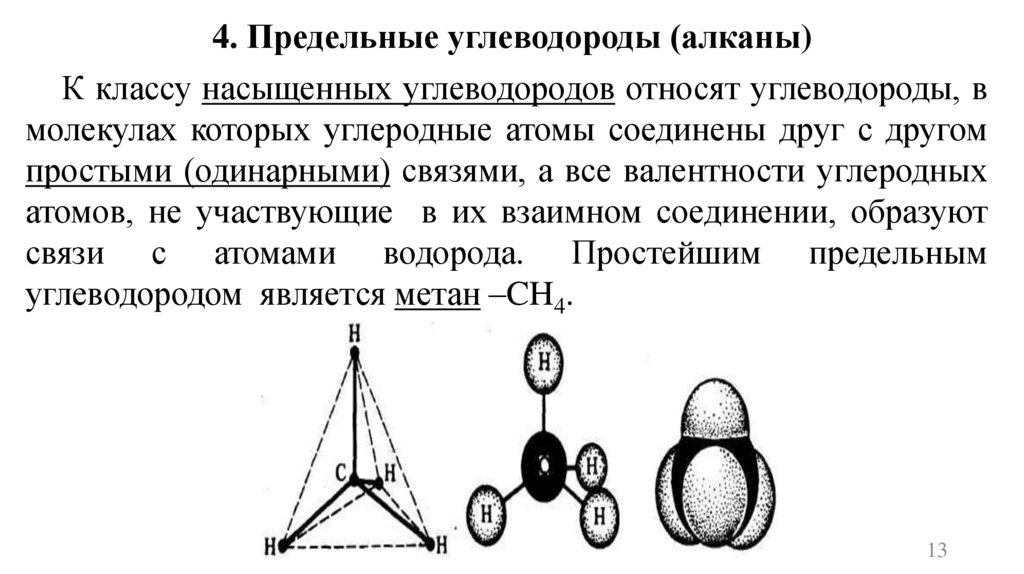
4. Предельные углеводороды (алканы)К классу насыщенных углеводородов относят углеводороды, в
молекулах которых углеродные атомы соединены друг с другом
простыми (одинарными) связями, а все валентности углеродных
атомов, не участвующие в их взаимном соединении, образуют
связи с атомами водорода. Простейшим предельным
углеводородом является метан –CH4.
13
14.
CHC10
H
8
95
3
76
42 H
3417
19
11
16
10
15
13
18
12
8
714
20
56
9
21
22
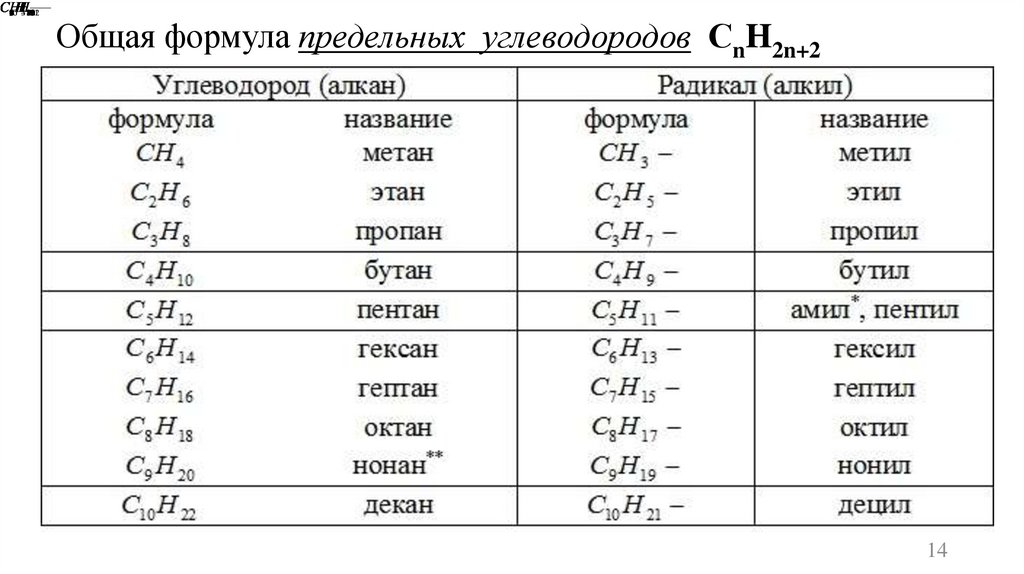
Общая формула предельных углеводородов СnH2n+2
14
15.
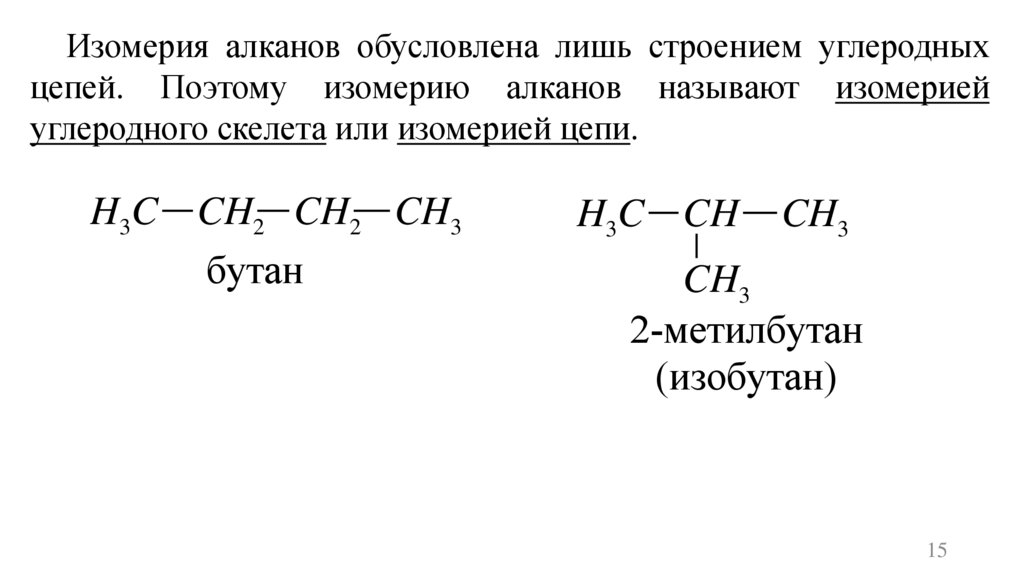
Изомерия алканов обусловлена лишь строением углеродныхцепей. Поэтому изомерию алканов называют изомерией
углеродного скелета или изомерией цепи.
H3C CH2 CH2 CH3
бутан
H3C CH
CH3
CH3
2-метилбутан
(изобутан)
15
16.
Заместительная номенклатура ИЮПАК для алкановПо номенклатуре ИЮПАК алканы изостроения рассматриваются как
производные неразветвленных алканов, в цепи которых атомы водорода
замещены простыми углеводородными радикалами, образующими
боковые цепи.
1) В формуле алкана выбирают основу, т. е. самую длинную цепь
углеродных атомов.
2) Атомы углерода последовательно нумеруют, начиная с того конца
главной цепи, к которому ближе боковое ответвление.
3) В названии соединения цифрами указывают номера углеродных
атомов, при которых находятся боковые радикалы, через дефис указывают
названия радикалов
4) В конце указывают название неразветвленного алкана, имеющего
столько же углеродных атомов, сколько их содержится в самой длинной
цепи.
16
17.
13
2
4
5
1
3
2
4
5
H3C CH CH2 CH2 CH3
H3C CH2 CH CH2 CH3
CH3
(1)
2-метилпентан
CH3
(2)
3-метилпентан
1
2
H3C CH
CH3
3
4
1
CH
CH3
H3 C C
CH3 CH3 (3)
2,3-диметилбутан
2
3
4
CH2 CH3
CH3
(4)
2,2-диметилбутан
17
18.
Химические свойстваАлканы трудно вступают в реакции при обычных температурах.
При определенных условиях они вступают в реакции замещения, в
результате которых атомы водорода замещаются другими атомами
(например, галогенами Cl, Br, I, F) или группами (нитро –NO2
(реакция Коновалова), сульфо –SO2H) и образуются производные
углеводородов.
Токсические свойства алканов
Низшие алканы обладают сильнейшим наркотическим
действием, увеличивающимся с длиной цепи, вызывают острые
отравления при вдыхании паров. Гептан и нонан – яды наркозного
действия.
18
19.
5. Непределные углеводороды (алкены, алкины)Ненасыщенные (непредельные) углеводороды – соединения,
состав которых, характеризуется меньшим содержанием
водорода по сравнению с соответствующими по числу
углеродных атомов предельными углеводородами, т.к. в их
молекулах имеются пары углеродных атомов, соединенные
кратными – двойными или тройными – связями.
Алкены
Алкены – ненасыщенные углеводороды, строение которых
отличается наличием в их молекулах одной двойной связи между
углеродными атомами, т. е. группировки >С=С<. Общая формула
алкенов: СnH2n
19
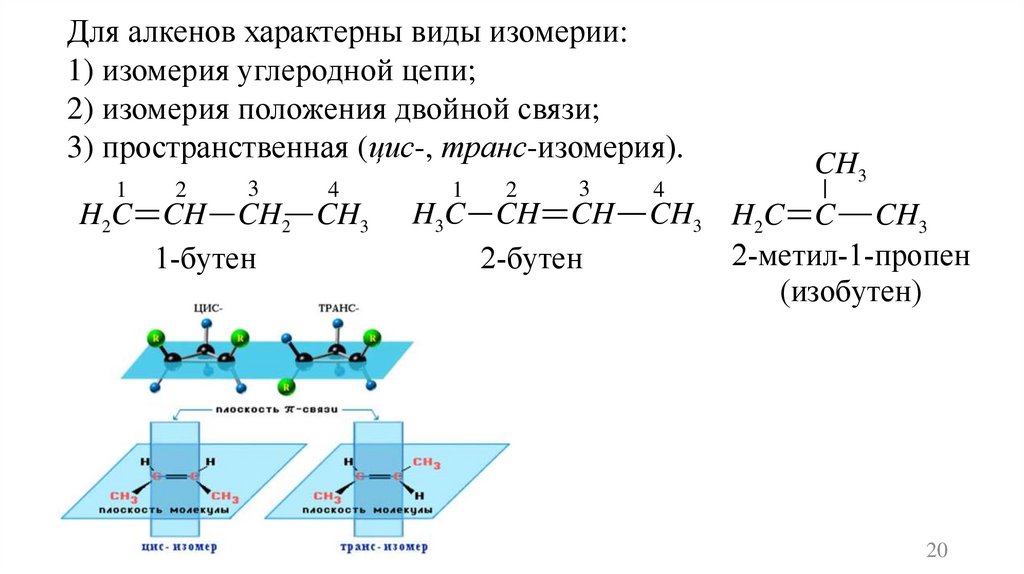
20.
Для алкенов характерны виды изомерии:1) изомерия углеродной цепи;
2) изомерия положения двойной связи;
3) пространственная (цис-, транс-изомерия).
1
2
3
4
H2C CH CH2 CH3
1-бутен
1
2
3
H3C CH CH
2-бутен
4
CH3
CH3 H2C C CH3
2-метил-1-пропен
(изобутен)
20
21.
Заместительная номенклатура ИЮПАК для алкенов1) выбирается наиболее длинная углеродная цепь, содержащая двойную связь;
2) нумерацию атомов главной цепи начинают с того конца, к краю которого
ближе расположена двойная связь;
3) если выбор нумерации неоднозначен, то применяют правило наименьших
локантов
4) в названии соединения цифрами указывают номера углеродных атомов, при
которых находятся боковые радикалы, через дефис указывают названия
радикалов;
5) перед наименованием основы (главной цепи) соединения ставят цифру,
обозначающую номер того углеродного атома, за которым следует двойная связь,
окончание основы заменяется с –ан на –ен.
H3C CH2
6
5
4
CH3
3
2
1
H3C CH2 C CH CH CH3
2-метил-4-этил-3-гексен
21
22.
Химические свойства алкеновАлкены являются более химически активными веществами по
сравнению с алканами в следствии наличия двойной связи, которая
является менее прочной.
Для алкенов характерны реакции:
1) присоединения по месту разрыва двойной связи водорода;
галогенов; галогеноводородов, воды;
2) полимеризации.
22
23.
Токсические свойства алкеновНизшие алкены обладают сильным наркотическим действием. При
концентрации пропена ~35-40 об. % потеря сознания происходит
через 20 сек. Этилен может использоваться для наркоза при
операциях.
Гексен, гептен, октен наряду с наркотическим проявляют
судорожное действие при вдыхании паров. Соединения с
разветвленной цепью действуют слабее нормальных.
При
необходимости входить в замкнутые помещения с утечкой алкенов
обязательно использовать изолирующие противогазы.
23
24.
АлкиныАлкины – ненасыщенные углеводороды, строение которых
отличается наличием в их молекулах одной тройной связи между
углеродными атомами, т. е. группировки –С≡С–. Общая формула
алкенов: СnH2n-2
Для алкинов характерны виды изомерии:
1) изомерия углеродной цепи;
2) изомерия положения тройной связи;
3) межклассовая с алкадиенами.
24
25.
Заместительная номенклатура ИЮПАК для алкинов1) выбирается наиболее длинная углеродная цепь, содержащая тройную связь;
2) нумерацию атомов главной цепи начинают с того конца, к краю которого
ближе расположена тройная связь;
3) если выбор нумерации неоднозначен, то применяют правило наименьших
локантов
4) в названии соединения цифрами указывают номера углеродных атомов, при
которых находятся боковые радикалы, через дефис указывают названия
радикалов;
5) перед наименованием основы (главной цепи) соединения ставят цифру,
обозначающую номер того углеродного атома, за которым следует тройна связь,
1
2
3
4
5
окончание основы заменяется с –ан на –ин.
H3C C C CH CH3
CH3
4-метил-2-пентин
25
26.
Химические свойства алкиновАлкены являются еще более химически активными веществами
чем алкены в следствии наличия тройной связи, которая является
менее прочной.
Для алкинов характерны реакции:
1) присоединения по месту разрыва тройной связи водорода;
галогенов; галогеноводородов, воды;
2) полимеризации;
3) замещения: атома водорода при углеродном атоме с тройной
связью на галоген
26
27.
Токсические свойства алкиновУ алкинов наркотическое действие усиливается с увеличением
числа углеродных атомов. Средние члены гомологического ряда
алкинов оказывают заметное судорожное действие. Например,
ацетилен – слабый наркотик. В смеси в воздухом он вызывает
удушье вследствие уменьшения содержания кислорода во
вдыхаемом воздухе. При значительной концентрации ацетилена
возможна потеря сознания и паралич дыхания.
27
28.
6. АреныАроматические углеводороды представляют собой производные
бензола, образованные в результате замещения атомов водорода
бензольного ядра насыщенными углеводородными заместителями;
состав их также выражается формулой СnH2n-6
A
а
б
A
CH3
CH2 CH3
28
29.
Химические свойства ареновБензол, несмотря на то, что является ненасыщенным
соединением, проявляет склонность преимущественно к реакциям
замещения; бензольное ядро очень устойчиво. В этом заключаются
свойства бензола, которые называют ароматическими свойствами.
Последние характерны и для других ароматических соединений;
однако различные заместители в бензольном ядре влияют на его
устойчивость и реакционную способность; в свою очередь,
бензольное ядро оказывает влияние на реакционную способность
соединенных с ним заместителей.
29
30.
Токсические свойства ареновПары ароматических углеводородов в высоких концентрациях
обладают судорожным действием. При остром отравлении
наблюдаются головная боль, тошнота, рвота, возбуждение,
подобно алкогольному, затем постепенное угнетение, изредка
судорогт; смерть наступает от остановки дыхания. Для
хронических отравлений характерны тяжелые поражения крови и
кроветворных
органов,
сопровождающиеся
снижением
содержания в крови эритроцитов, лейкоцитов и тромбоцитов,
расстройства функции нервной системы, поражения печени и
органов внутренней секреции.
30
31.
7. Спирты, простые эфирыСпирты – производные углеводородов, представляющие собой
продукты замещения атома (атомов) водорода в углеводородной
молекуле гидроксильной группой –ОН. Общая формула спиртов:
СnH2n+1OH
Для спиртов характерны виды изомерии:
1) изомерия углеродной цепи;
2) изомерия положения функциональной группы (–ОН);
3) межклассовая с простыми эфирами.
31
32.
Заместительная номенклатура ИЮПАК для спиртовК заместительному названию углеводорода, производным
которого является спирт, добавляют окончание -ол. Локант
указывает номер атома углерода, при котором расположена
гидроксильная группа. Главная углеродная цепь выбирается таким
образом, чтобы она включала углерод, связанный с гидроксильной
группой.
Начало
нумерации
цепи
также
определяет
гидроксильная группа.
4
3
2
1
H3C CH CH2 CH2 OH
CH3
3-метил-1-бутанол
32
33.
Химические свойства спиртовДля спиртов характерны реакции:
1) замещения: атомов водорода в группа –ОН на щелочной металл;
2) замещения: группы –ОН на галогены;
3) отщепления (дегидратации) молекул воды;
Токсические свойства спиртов
Одноатомные
предельные
спирты
обладают
сильным
физиологическим действием (наркотическим), причем это действие
возрастает с увеличением их молекулярной массы. Предельные
спирты оказывают сильное раздражающее действие, особенно на
глаза. Являются ядами. Вызывают поражения нервной, сердечнососудистой систем, органов желудочно-кишечного тракта, поражение
печени.
33
34.
Фенол – производное ароматических углеводородов, у которых однагидроксильная группа связана непосредственно с ароматическим ядром.
Фенол и его производные содержатся в сточных водах. Кроме того, они
входят в состав выхлопных газов бензиновых и дизельных двигателей,
образуются при сгорании дерева, угля и коксовании.
Токсические свойства фенола. Фенол имеет класс опасности II –
высоко опасное вещество. Попадает в организм через слизистые оболочки,
органы дыхания и кожу, а выделяется — через почки и легкие. Пыль и пары
поражают нервную систему (вплоть до паралича дыхательного центра),
вызывают раздражение и химический ожог. Смертельная доза фенола при
внутреннем разовом приеме для взрослого от 1 до 10 г, для детей – от 0,05 г
до 0,5 г. Ингаляционное воздействие в производственных условиях
вызывает головную боль, головокружение, слабость, потливость,
нарушение сна, одышку, усиленное сердцебиение, поражение верхних
дыхательных путей, нарушение функций печени, белкового обмена. 34
35.
Простые эфирыПростые эфиры – кислородсодержащие соединения, в молекулах
которых два углеводородных остатка связаны с атомом кислорода, т. е.
представляют собой соединения с общей формулой СnH2n+2O или
R–O–R1.
Химические свойства простых эфиров.
Они обладают ограниченной реакционной способностью. Устойчивы
к действию разбавленных растворов кислот и оснований, окислителей
и восстановителей. Благодаря этому низшие эфиры часто
используются в качестве инертных растворителей во многих
химических процессах. Реакции с участием простых эфиров
немногочисленны. Они являются слабыми основаниями и поэтому
могут образовывать соли только с сильными кислотами в безводной
среде.
35
36.
Токсические свойства эфировПростые эфиры обладают раздражающим действием на слизистые
оболочки глаз и верхних дыхательных путей.
Действуют раздражающе на структуры всех уровней центральной
нервной системы. Вдыхание воздуха с парами диэтилового эфира в
концентрации около 100 мг/дм3 в течение 30–40 минут приводит к
потере сознания. Жидкий диэтиловый эфир вызывает ощущение
жжения.
36
37.
8. Альдегиды и кетоныАльдегиды и кетоны – это производные углеводородов,
которые содержат в молекуле карбонильную функциональную
альдегидо- или кето- группы соответственно строения:
R C H
R C R/
O
альдегид
O
кетон
Общая формула альдегидов и кетонов СnH2n+2O.
37
38.
Заместительная номенклатура ИЮПАК для альдегдовНазвания альдегидов производят от заместительных названий
соответствующих по углеродному скелету углеводородов,
добавляя окончание –аль. Выбирая в формуле наиболее длинную
(главную) углеродную цепь, в нее включают альдегидный
углерод. Нумерацию цепи начинают с альдегидного углерода; при
этом, поскольку альдегидная группа всегда находится при
первичном углероде и, следовательно, в начале цепи, цифру 1,
относящуюся к альдегидной группе, перед названием основы
можно и не ставить.
3
2
4
1
H3C CH CH2 CH
CH3
O
3-метилбутаналь
38
39.
Заместительная номенклатура ИЮПАК для кетоновНазвания кетонов производят от заместительных названий
соответствующих углеводородов, добавляя к ним окончания –он.
Нумерацию цепи начинают с того конца, к которому ближе
кетонная группа. Цифру, обозначающую положение этой группы,
ставят перед названием основы (главной цепи).
1
2
3
4
H3C C CH CH3
O CH3
3-метил-2-бутанон
39
40.
Для альдегидов характерны виды изомерии:1) изомерия углеродной цепи;
2) межклассовая с кетонами.
Для кетонов характерны виды изомерии:
1) изомерия углеродной цепи;
2) изомерия положения карбонильной группы;
3) межклассовая с альдегидами.
Химические свойства альдегидов и кетонов
Для альдегидов и кетонов характерны реакции:
1) замещения: атома кислорода в карбонильной группе;
2) замещения: водорода в α-положении в углеводородном радикале
на галогены;
3) присоединения по месту разрыва двойной связи С=О в
карбонильной группе.
40
41.
Токсические свойства альдегидовАльдегиды оказывают раздражающее действие на слизистые
оболочки глаз и дыхательных путей. С увеличением числа углеродных
атомов в молекуле раздражающее действие ослабевает. Среди
альдегидов особое место занимает формальдегид, который обладает
сильно раздражающими свойствами и общей токсичностью, а при
попадании на кожу может вызвать образование нарывов с
поверхностным некрозом. Ацетальдегид, кротоновый альдегид,
бензальдегид и акролеин раздражают слизистые оболочки глаз и
дыхательных путей.
41
42.
Токсические свойства кетоновКетоны, в частности, ацетон поражает все отделы центральной
нервной системы. Пары ацетона проникают через кожу. При
отравлении организма ацетоном наблюдается: коматозное состояние,
судороги, синюшность кожных покровов, учащение дыхания,
повышение кровяного давления; возможен летальный исход при
явлениях сердечно-легочной недостаточности.
42
43.
9. Карбоновые кислоты, сложные эфирыКарбоновые кислоты – органические соединения, молекулы
которых содержат одну или несколько карбоксильных групп –СООН,
связанных с углеводородным радикалом. Общая формула карбоновых
кислот СnH2n+1СООH
Заместительная номенклатура ИЮПАК для карбоновых кислот
Кислоты называют, образуя прилагательное из заместительного
названия, соответствующего по количеству атомов углерода и по
строению углеводорода. Для заместительных названий
одноосновных кислот характерно окончание – овая кислота.
H3C CH2 CH C OH
CH3 O
2-мелитбутановая кислота
43
44.
Для карбоновых кислот характерны виды изомерии:1) изомерия углеродной цепи;
2) межклассовая со сложными эфирами.
Химические свойства карбоновых кислот
Для карбоновых кислот характерны реакции:
1) замещения: атома водорода в карбоксильной группе;
2) замещения: карбоксильной (–ОН) группы в карбонильной группе;
3) замещения: атома водорода в α-положении в углеводородном
радикале на галогены.
44
45.
Токсические свойства карбоновых кислотКарбоновые кислоты проявляют общую токсичность: влияют на
нервную систему, повреждают почки, печень, легкие, вызывают
дистрофические изменения в печени и почках. В жидком состоянии
вызывают химические ожоги, а их пары – слезотечение, насморк,
чихание, кашель. Кожные ожоги вызывают системное отравление.
45
46.
Сложные эфирыСложные эфиры – это производные карбоновых кислот,
образующиеся при замещении ОН-группы карбоксила на
алкоксигруппу –OR. Общая формула сложных эфиров СnH2n+2О2 или
H3C C O C2H5
O
R C O R/
O
этилацетат
(этиловый эфир
уксусной кислоты)
Названия сложных эфиров обычно производят от наименований
образующих их спирта и кислоты. Часто употребляют также
названия, которые выводят из наименования углеводородного
радикала спирта и корня латинского наименования кислоты (или, что
тоже, корня названия радикала этой кислоты) с добавлением к
последнему окончания – ат.
46
47.
Токсические свойства сложных эфировСложные эфиры сильно раздражают слизистые оболочки глаз и
дыхательных путей. Сложные эфиры непредельных кислот, например,
метилакрилат,
этилакрилат,
метилхлоракрилат,
обладают
общетоксическим и раздражающим действием; бутилакрилат
вызывает глубокие нарушения липоидно-жирового обмена;
метилметакрилат – специфически действующий яд.
47









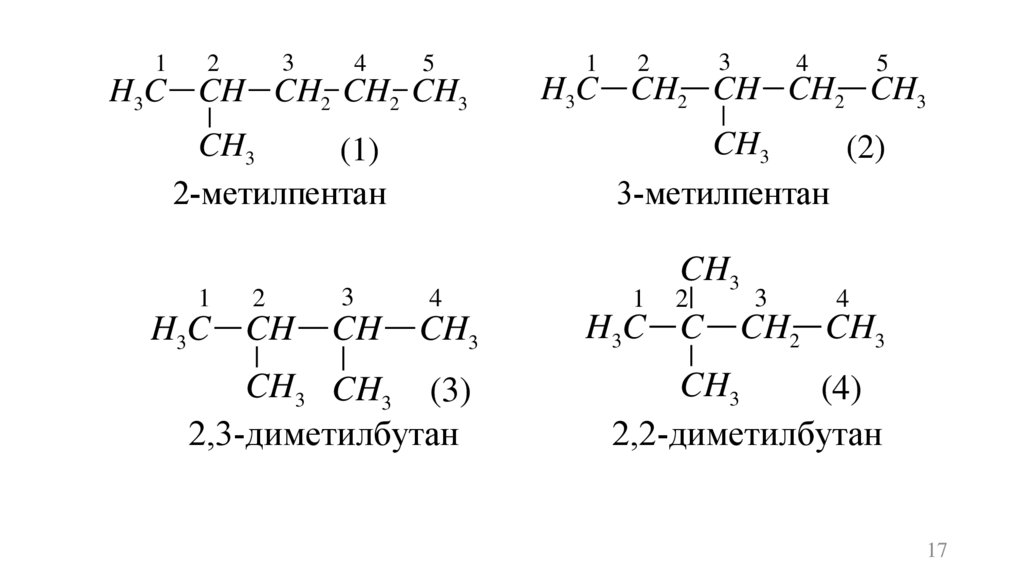





























 Химия
Химия








