Похожие презентации:
Основы строения, классификация и номенклатура органических соединений
1.
ОМСКИЙ ГОСУДАРСТВЕННЫЙМЕДИЦИНСКИЙ УНИВЕРСИТЕТ
Основы строения, классификация и
номенклатура органических
соединений
1. Предмет органической химии
2. Классификация органических соединений
3. Заместительная номенклатура IUPAC
4. Классификация органических реакций
Лектор: Степанова Ирина Петровна, доктор
биологических наук, профессор, зав. кафедрой химии
2.
ЦЕЛИ ЛЕКЦИИОБУЧАЮЩАЯ: сформировать знания об основах
строения, классификации и номенклатуре
органических соединений.
РАЗВИВАЮЩАЯ: расширить кругозор
обучающихся на основе интеграции знаний, развить
логическое мышление.
ВОСПИТАТЕЛЬНАЯ: содействовать формированию
у обучающихся устойчивого интереса к изучению
дисциплины.
3.
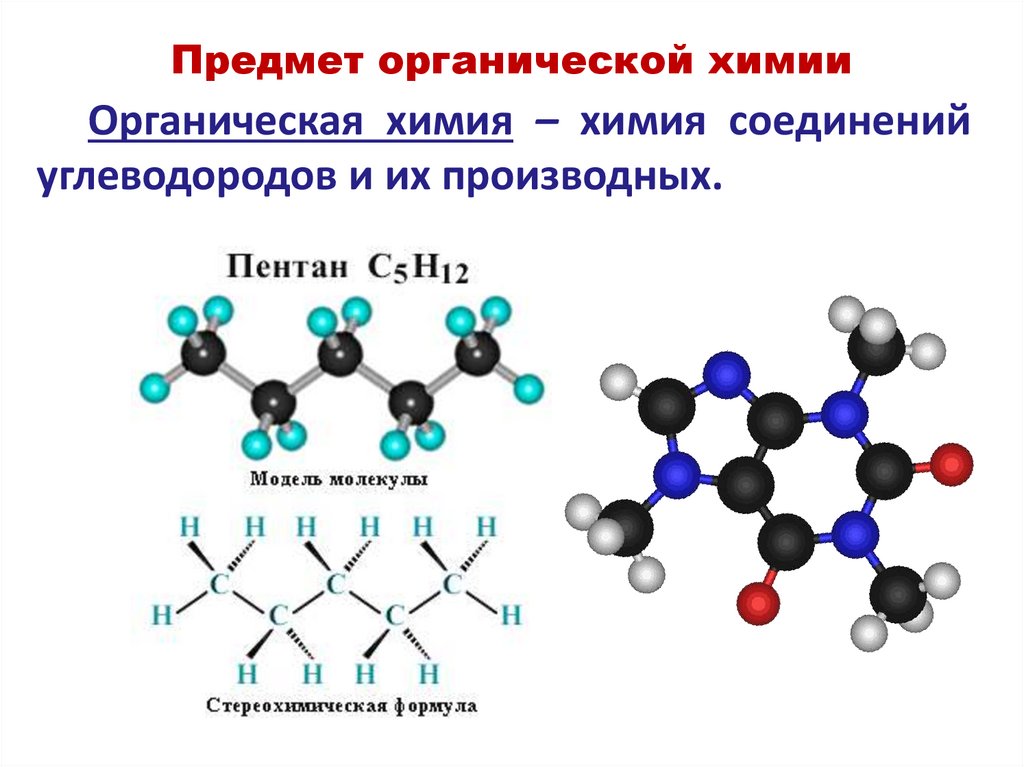
Предмет органической химииОрганическая химия – химия соединений
углеводородов и их производных.
4.
Предмет органической химииОсобенности органических веществ:
1. Многообразие в природе: около 27 млн
(неорганических веществ – около 100 тысяч).
2. Образуются небольшим количеством
атомов-неметаллов, которые получили
названия органогены: С,Н,О,N, (реже S, Р,
галогены).
5.
Предмет органической химии«…Как бы ни была
совершенна теория, она
только приближение к
истине»
А. М. Бутлеров
А. М. Бутлеров
6.
Предмет органической химииАтомы в составе молекулы соединены
между собой в определенном порядке, в
соответствии с их валентностью.
Атом углерода четырехвалентен:
С
Химическая связь
(общая электронная
пара) изображается
черточкой.
7.
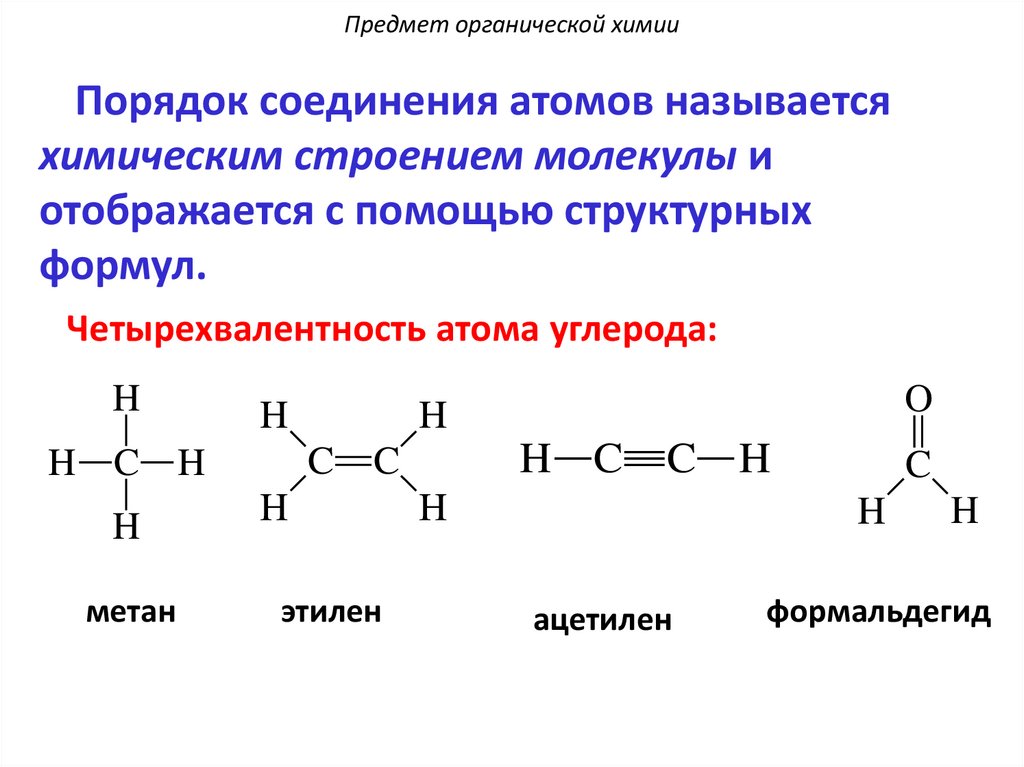
Предмет органической химииПорядок соединения атомов называется
химическим строением молекулы и
отображается с помощью структурных
формул.
Четырехвалентность атома углерода:
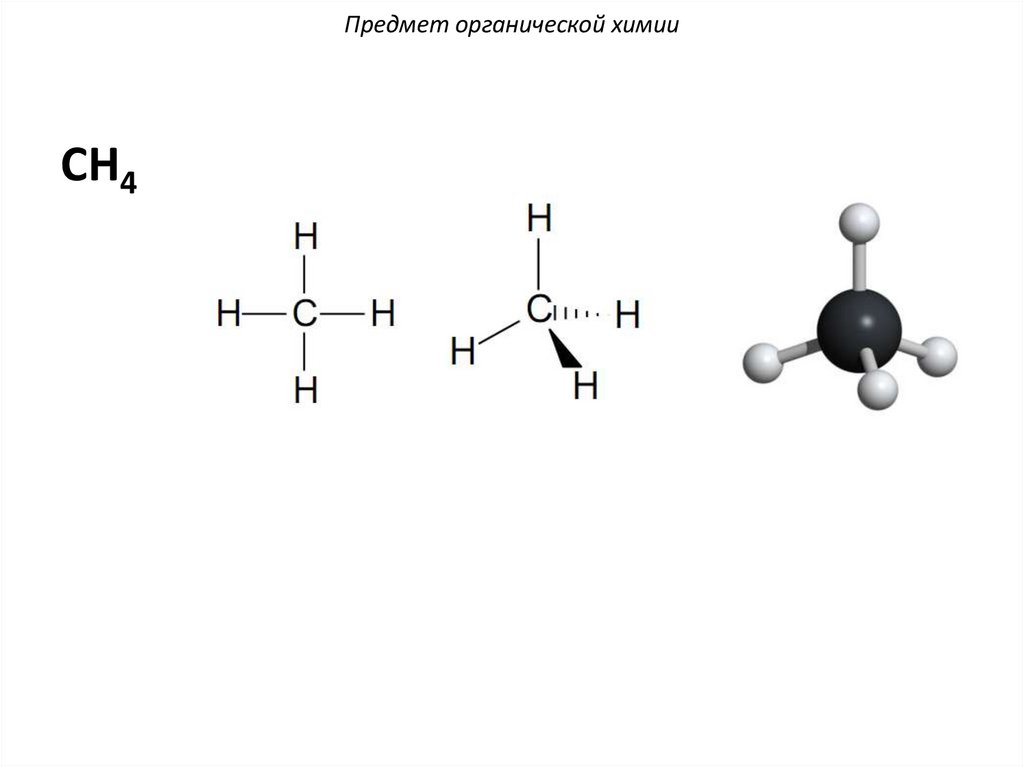
H
H
C
H C H
H
метан
O
H
H C
C
H
этилен
C H
H
C
H
ацетилен
H
формальдегид
8.
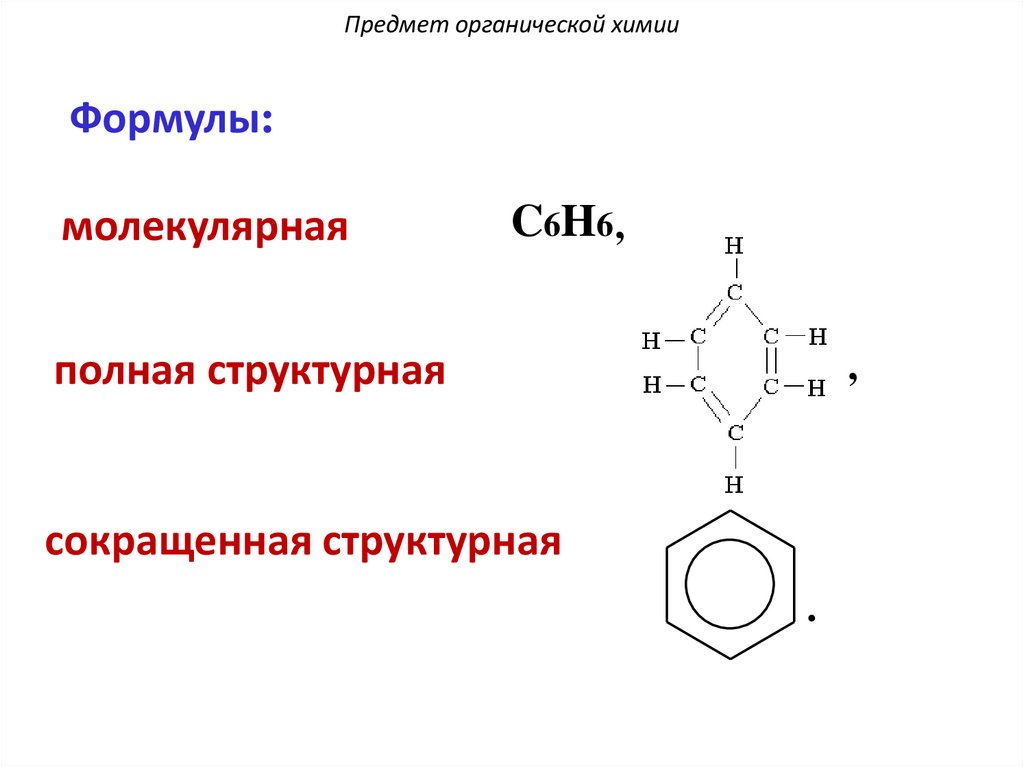
Предмет органической химииФормулы:
молекулярная
C6H6 ,
полная структурная
,
сокращенная структурная
.
9.
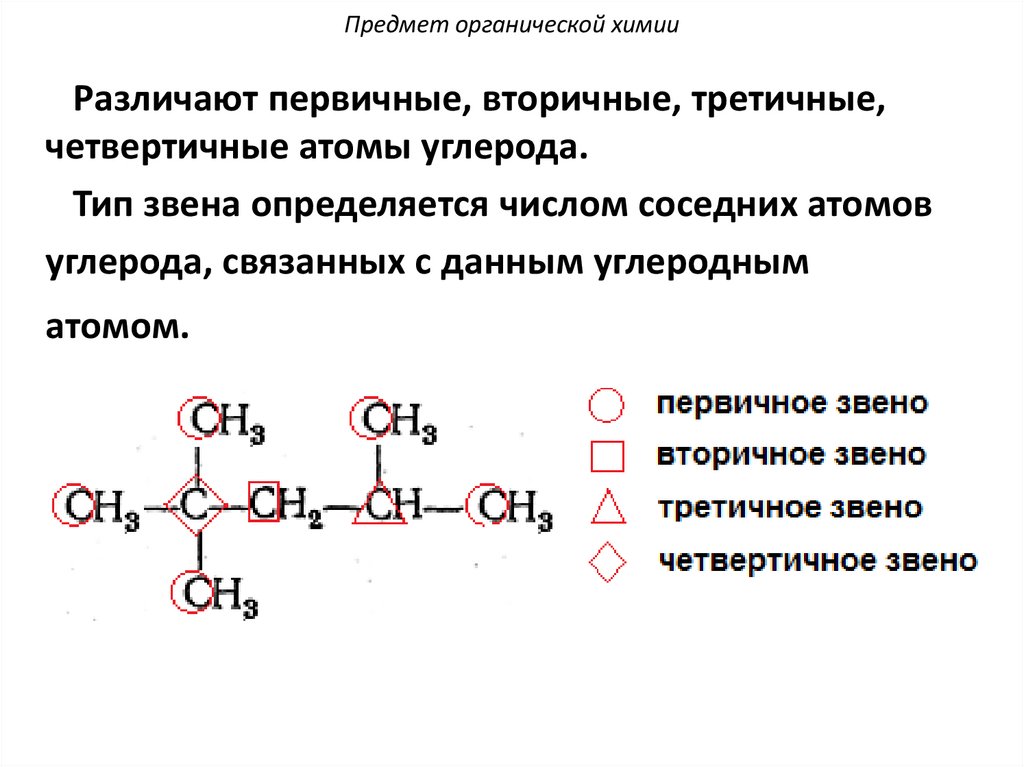
Предмет органической химииРазличают первичные, вторичные, третичные,
четвертичные атомы углерода.
Тип звена определяется числом соседних атомов
углерода, связанных с данным углеродным
атомом.
10.
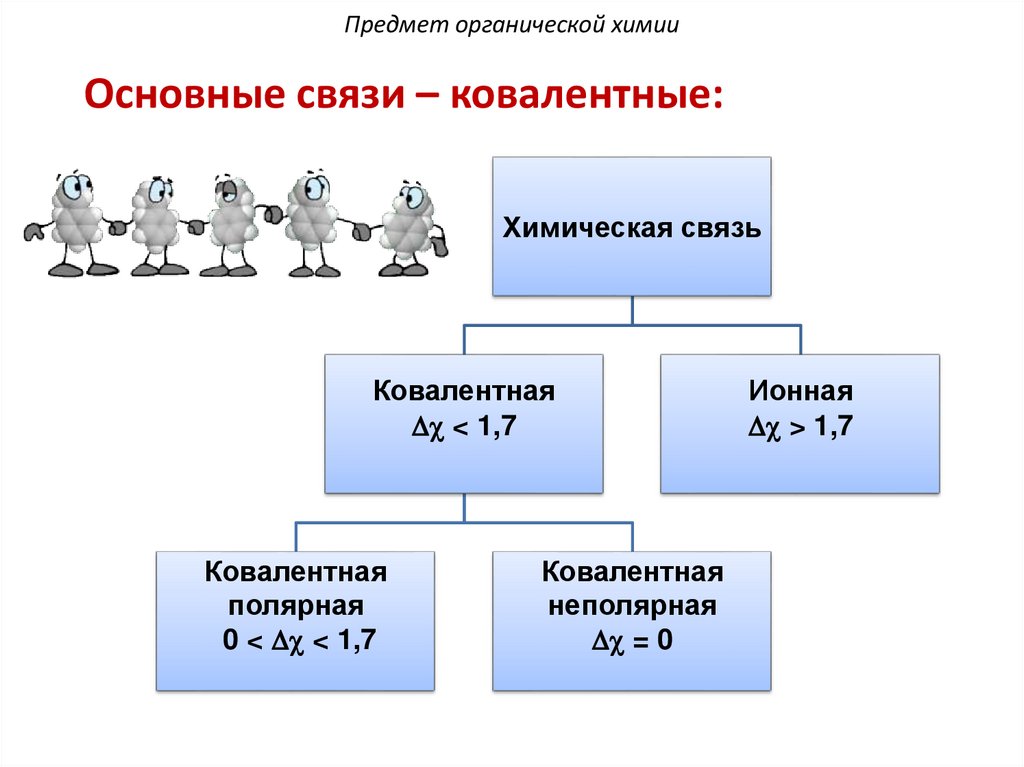
Предмет органической химииОсновные связи – ковалентные:
Химическая связь
Ковалентная
Dc < 1,7
Ковалентная
полярная
0 < Dc < 1,7
Ковалентная
неполярная
Dc = 0
Ионная
Dc > 1,7
11.
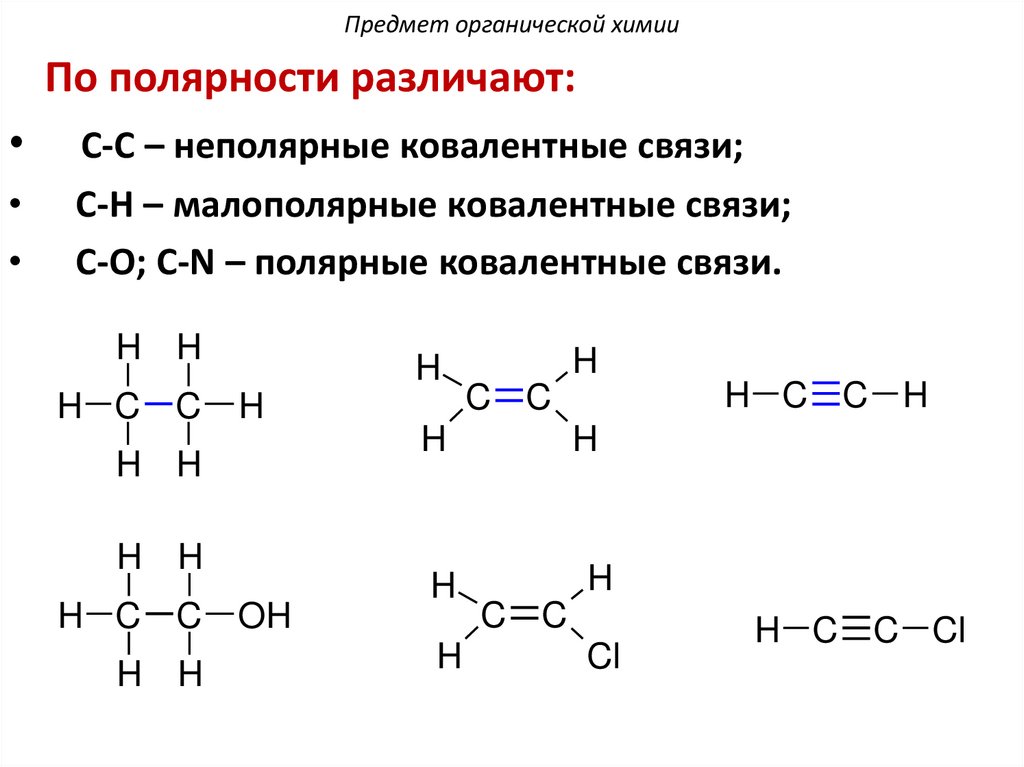
Предмет органической химииПо полярности различают:
С-С – неполярные ковалентные связи;
С-Н – малополярные ковалентные связи;
С-О; С-N – полярные ковалентные связи.
H H
H C C
H
H
H H
H H
H C C
H H
OH
H
H C C H
C C
H
H
H
H
H
C C
Cl
H C C Cl
12.
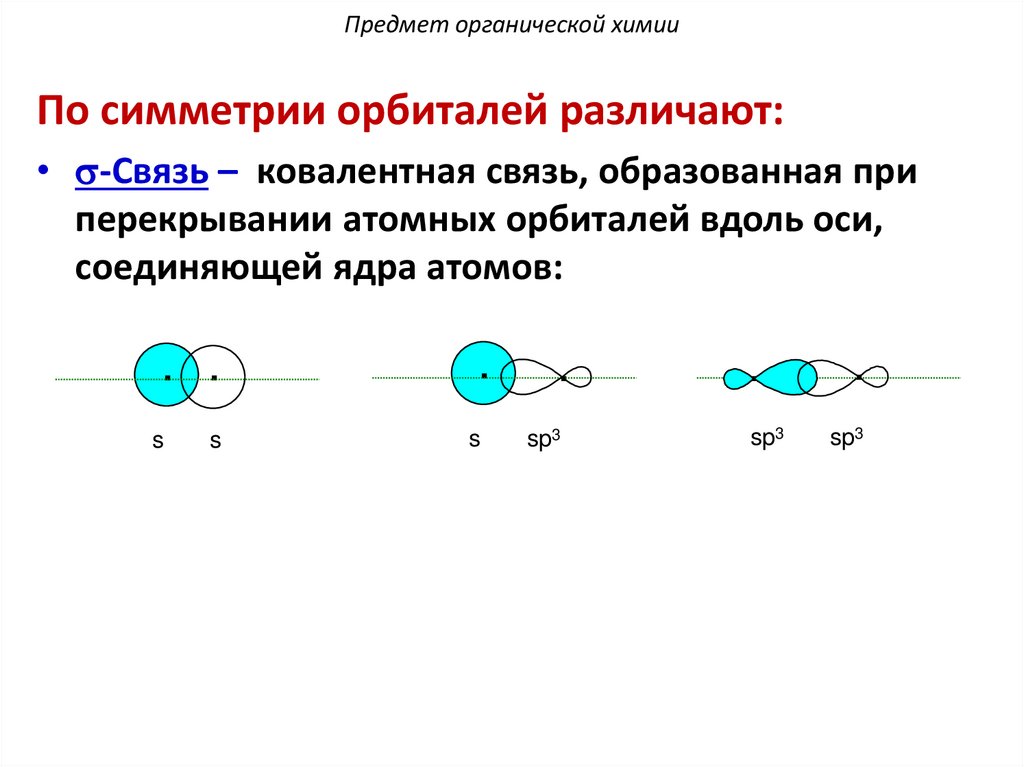
Предмет органической химииПо симметрии орбиталей различают:
• s-Cвязь – ковалентная связь, образованная при
перекрывании атомных орбиталей вдоль оси,
соединяющей ядра атомов:
. .
.
.
s
s
sp3
s
.
.
sp3
sp3
13.
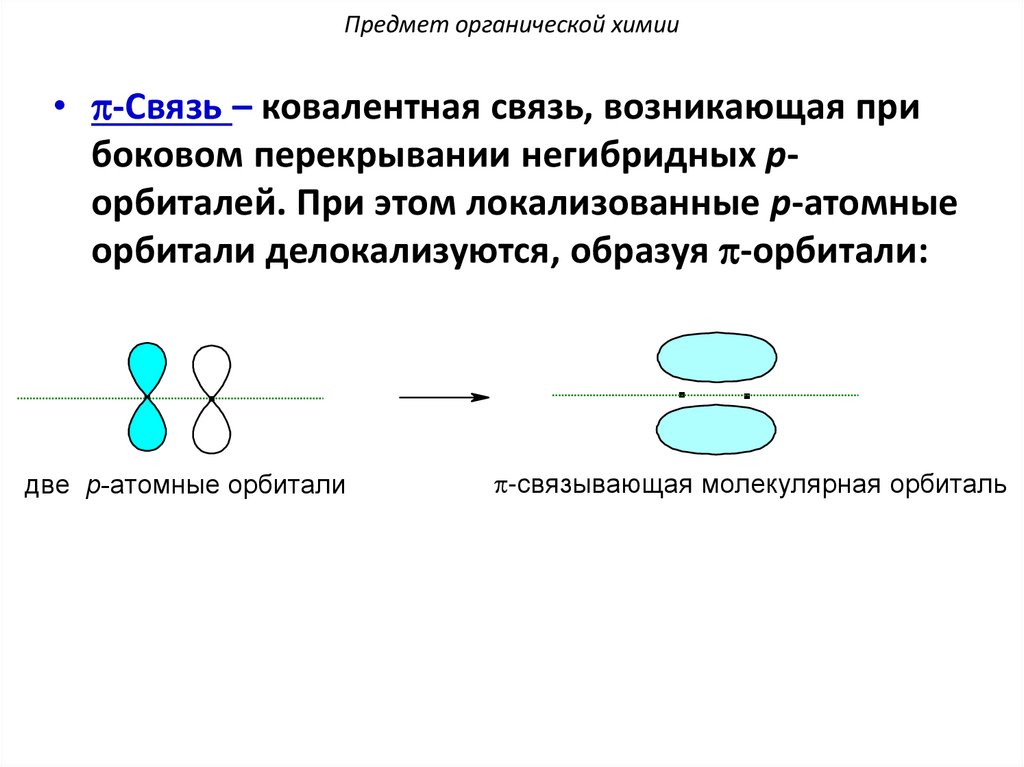
Предмет органической химии• p-Связь – ковалентная связь, возникающая при
боковом перекрывании негибридных pорбиталей. При этом локализованные p-атомные
орбитали делокализуются, образуя p-орбитали:
. .
двe p-атомныe орбитали
. .
p-связывающая молeкулярная орбиталь
14.
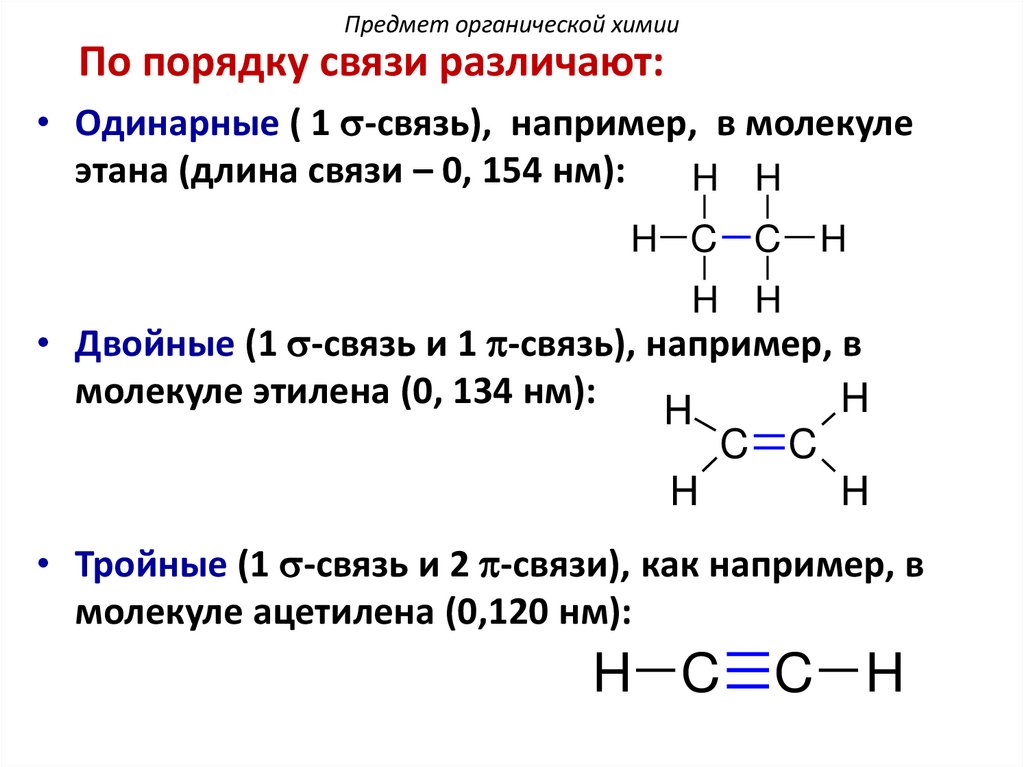
Предмет органической химииПо порядку связи различают:
• Одинарные ( 1 s-связь), например, в молекуле
этана (длина связи – 0, 154 нм):
H H
H C C
H
H H
• Двойные (1 s-связь и 1 p-связь), например, в
молекуле этилена (0, 134 нм):
H
H
C C
H
H
• Тройные (1 s-связь и 2 p-связи), как например, в
молекуле ацетилена (0,120 нм):
H C C H
15.
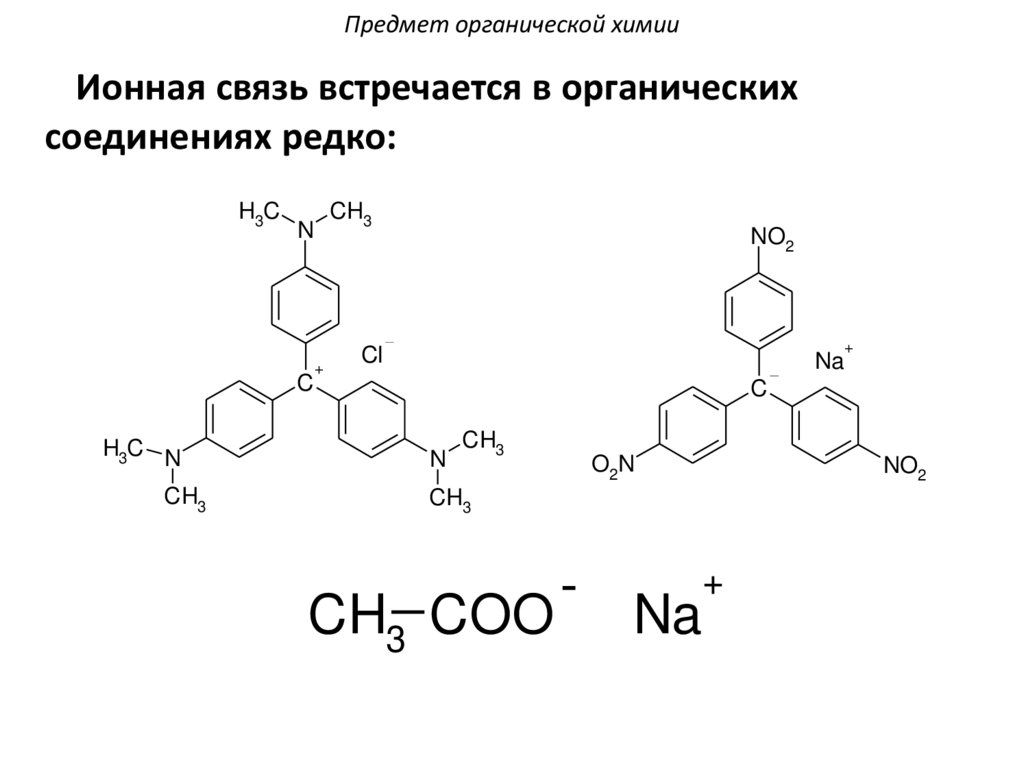
Предмет органической химииИонная связь встречается в органических
соединениях редко:
H3C
C
H3C N
CH3
CH3
N
+
NO2
Cl
Na
+
C
N
CH3
O2N
NO2
CH3
CH3 COO
-
Na
+
16.
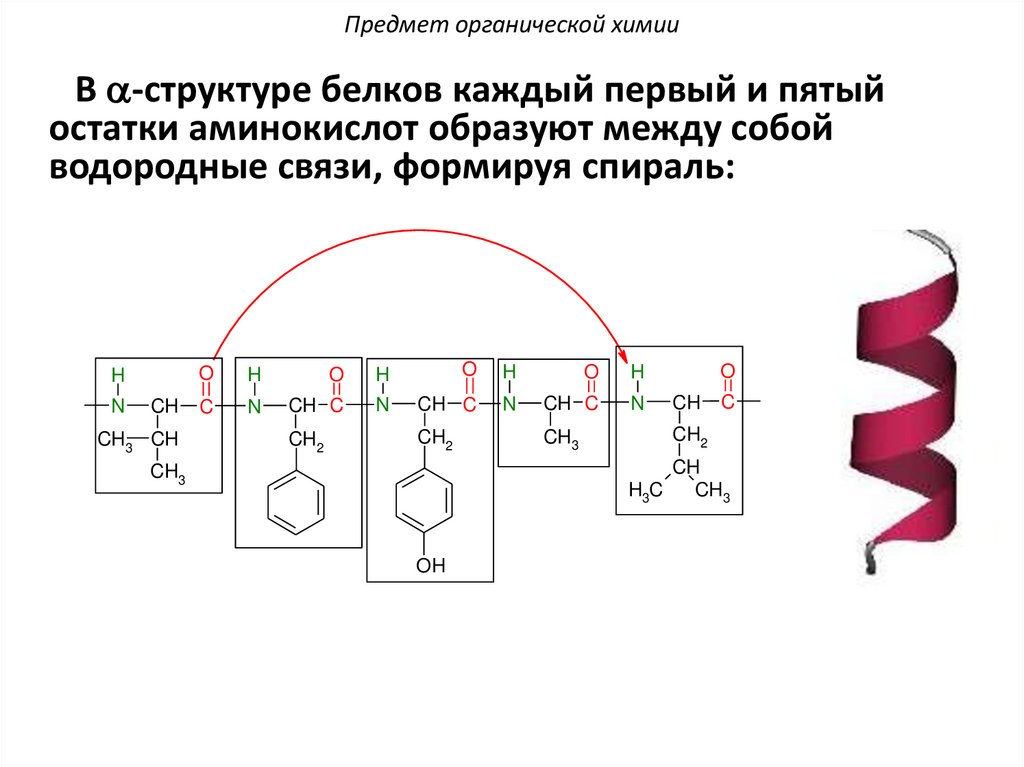
Предмет органической химииВ a-структуре белков каждый первый и пятый
остатки аминокислот образуют между собой
водородные связи, формируя спираль:
H
N
CH
CH3 CH
O
H
O
H
O
H
O
H
C
N
CH C
N
CH C
N
CH C
N
CH2
CH2
CH3
O
CH
C
CH2
CH
H3C
CH3
CH3
OH
17.
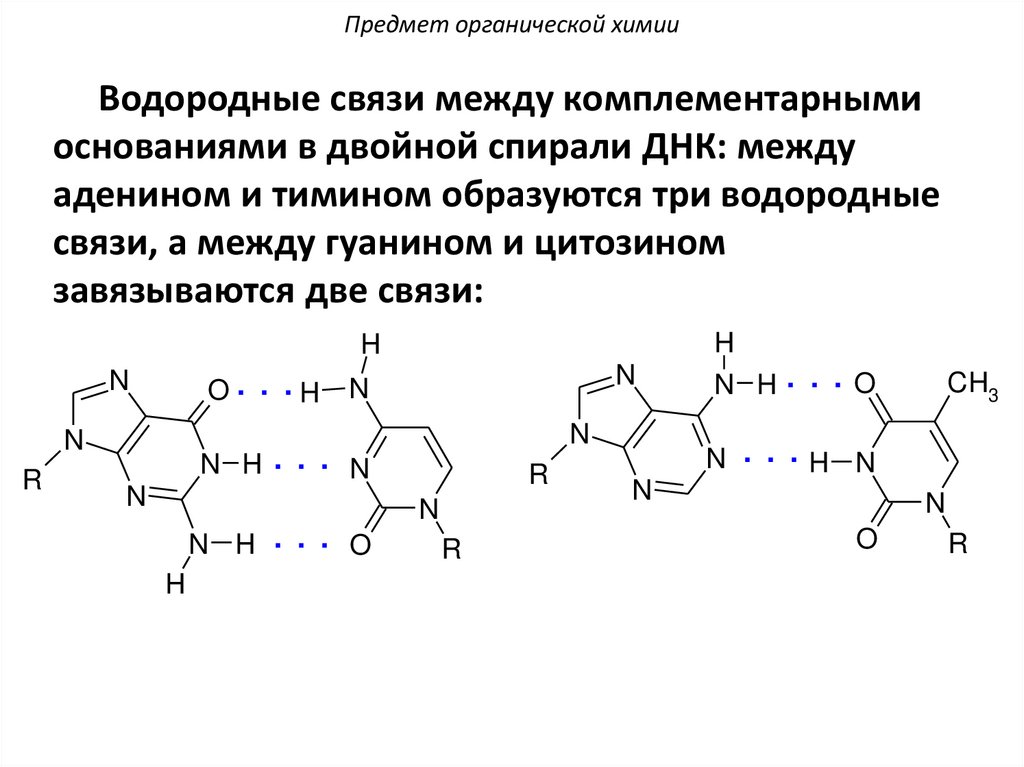
Предмет органической химииВодородные связи между комплементарными
основаниями в двойной спирали ДНК: между
аденином и тимином образуются три водородные
связи, а между гуанином и цитозином
завязываются две связи:
H
O. . .H
N
N
R
N
N
N
N H. . . N
N
N H . . . O
H
R
N
R
H
N H. . .O
CH3
N . . .H N
N
N
O
R
18.
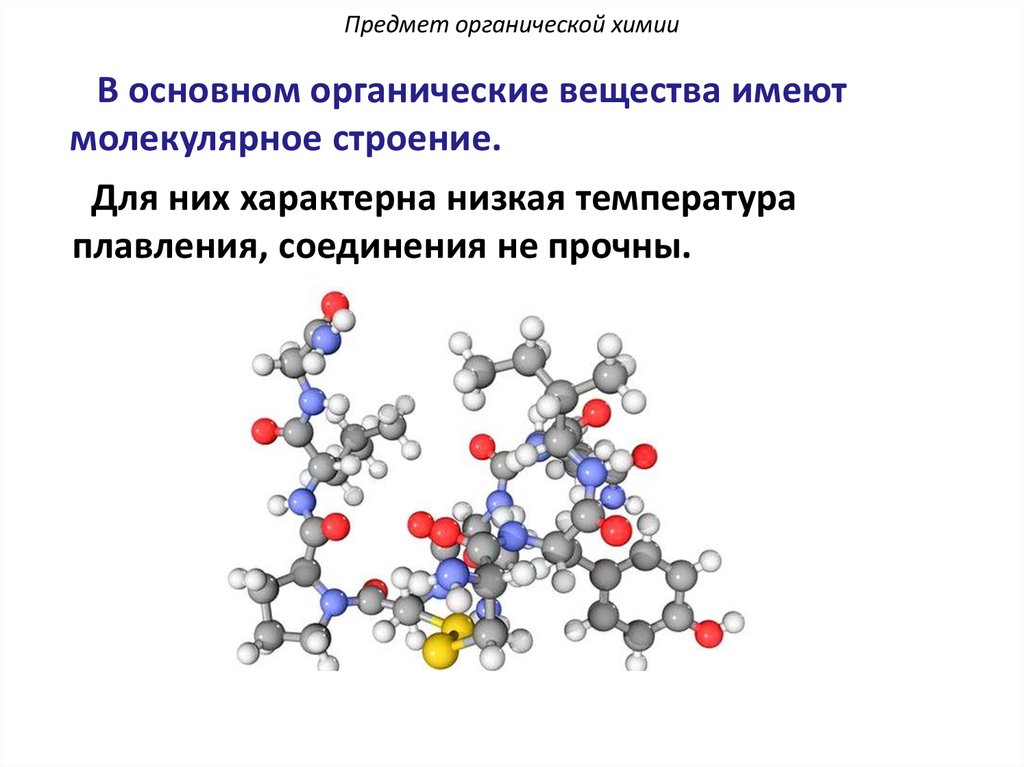
Предмет органической химииВ основном органические вещества имеют
молекулярное строение.
Для них характерна низкая температура
плавления, соединения не прочны.
19.
Предмет органической химииАтом углерода образует связи в
состоянии:
sp3-гибридизации (характерна
для алканов): С-С;
sp2-гибридизации (характерна
для алкенов): С=С;
sp-гибридизации (характерна для
алкинов): С≡С.
20.
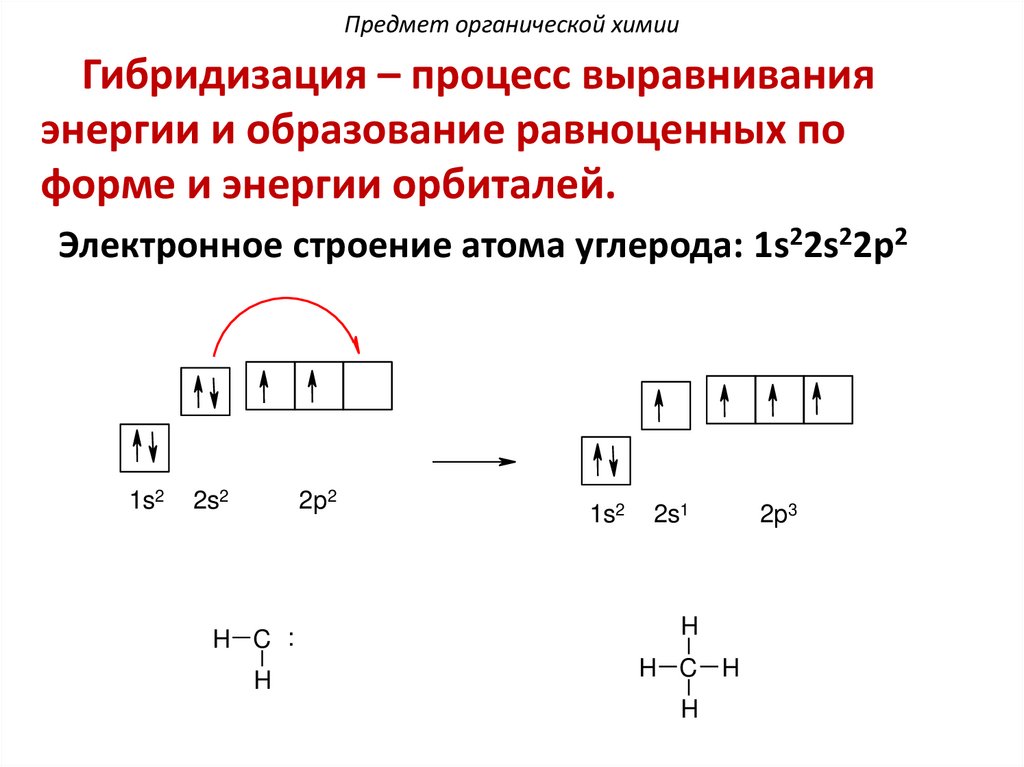
Предмет органической химииГибридизация – процесс выравнивания
энергии и образование равноценных по
форме и энергии орбиталей.
Электронное строение атома углерода: 1s22s22p2
1s2
2s2
2p2
1s2
2s1
H C :
H
H
H C H
H
2p3
21.
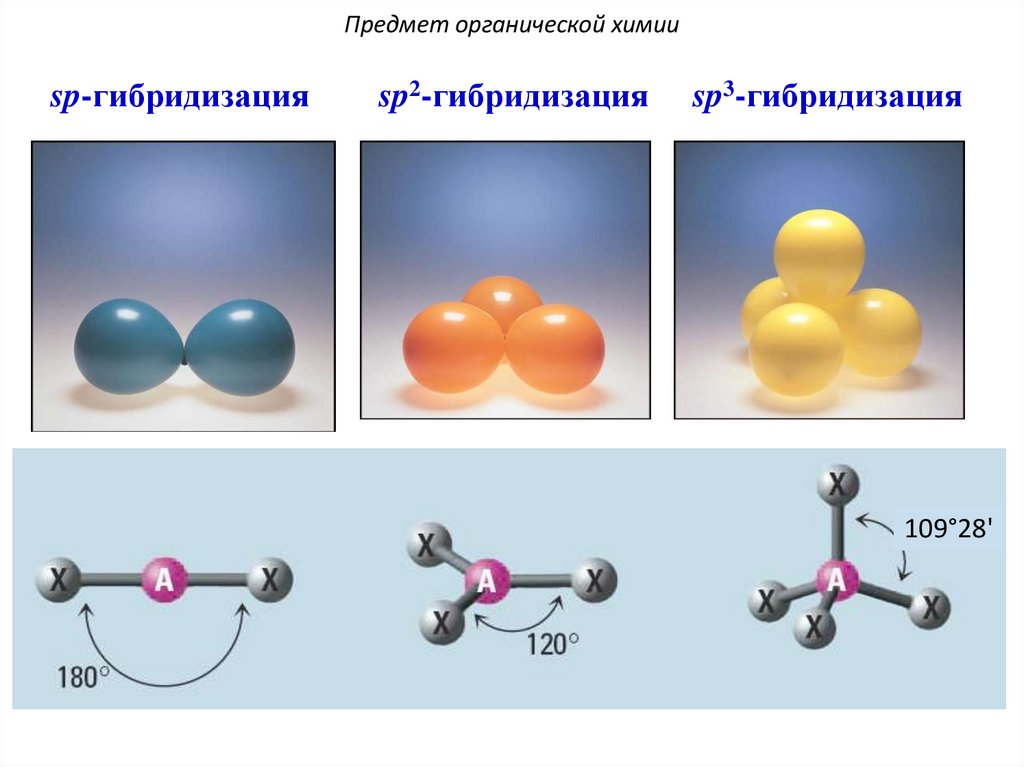
Предмет органической химииsp-гибридизация
sp2-гибридизация
sp3-гибридизация
109°28'
22.
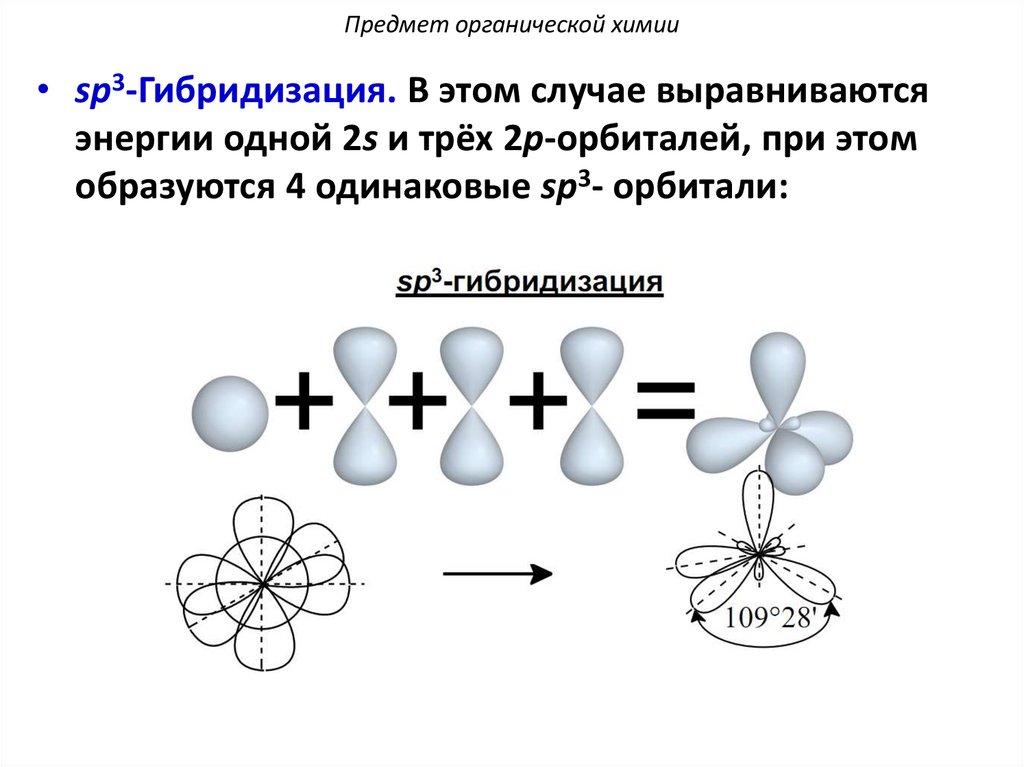
Предмет органической химии• sp3-Гибридизация. В этом случае выравниваются
энергии одной 2s и трёх 2p-орбиталей, при этом
образуются 4 одинаковые sp3- орбитали:
23.
Предмет органической химииСH4
24.
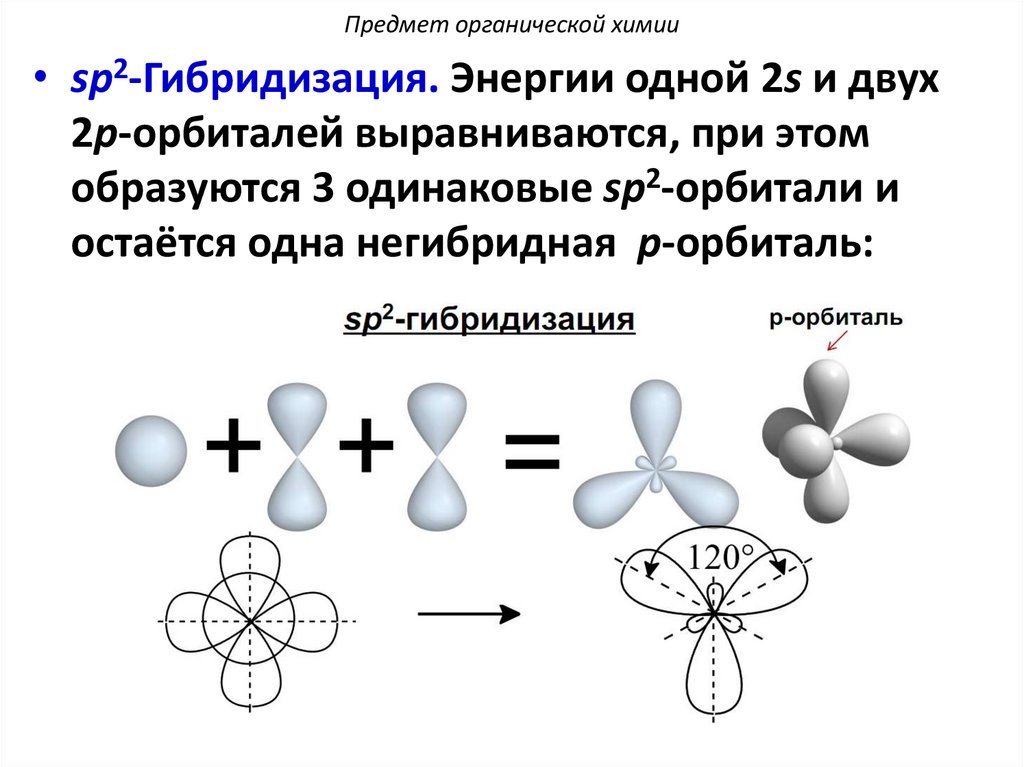
Предмет органической химии• sp2-Гибридизация. Энергии одной 2s и двух
2p-орбиталей выравниваются, при этом
образуются 3 одинаковые sp2-орбитали и
остаётся одна негибридная p-орбиталь:
25.
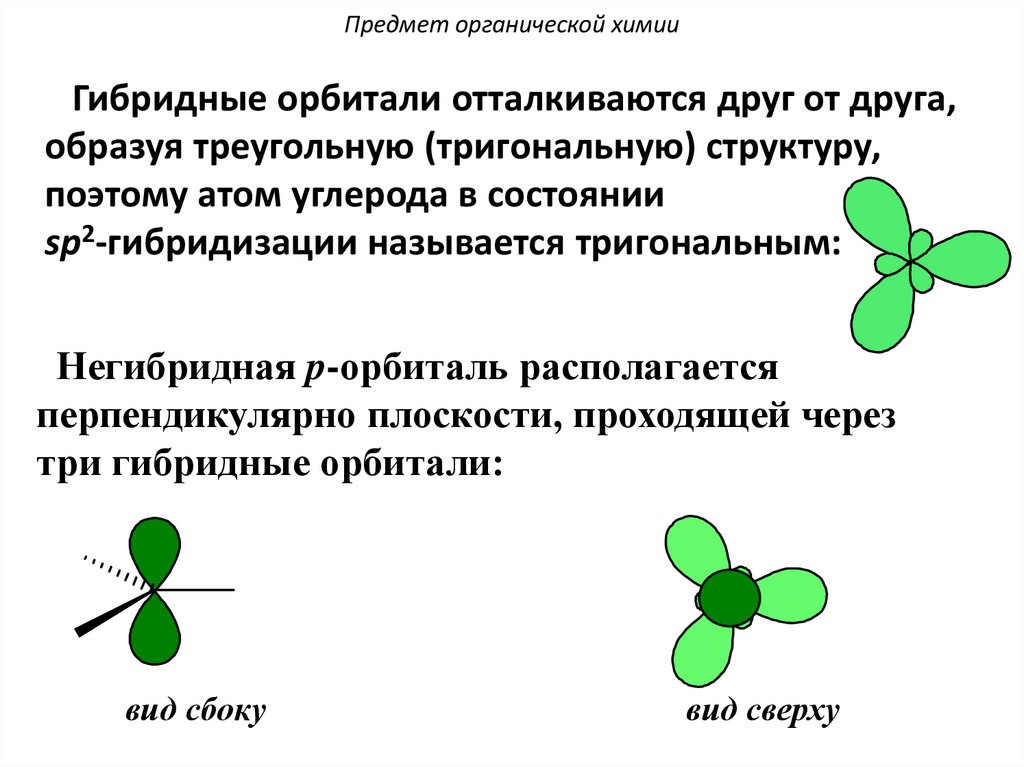
Предмет органической химииГибридные орбитали отталкиваются друг от друга,
образуя треугольную (тригональную) структуру,
поэтому атом углерода в состоянии
sp2-гибридизации называется тригональным:
Негибридная p-орбиталь располагается
перпендикулярно плоскости, проходящей через
три гибридные орбитали:
вид сбоку
вид сверху
26.
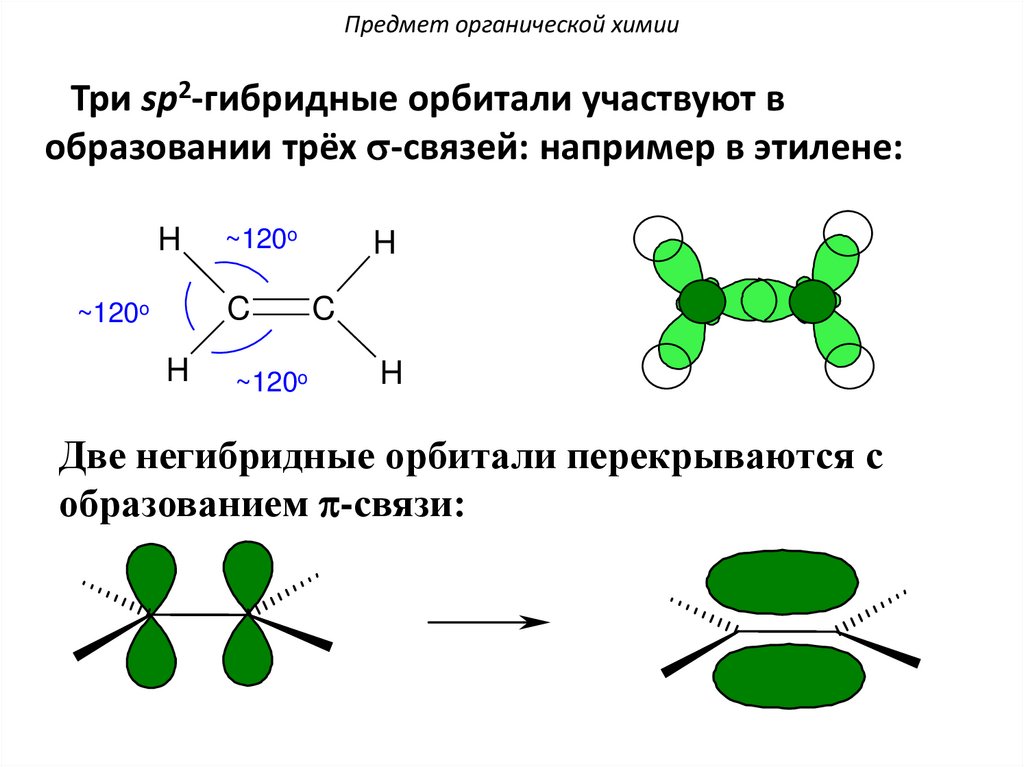
Предмет органической химииТри sp2-гибридные орбитали участвуют в
образовании трёх s-связей: например в этилене:
H
~120o
C
~120o
H
~120o
H
C
H
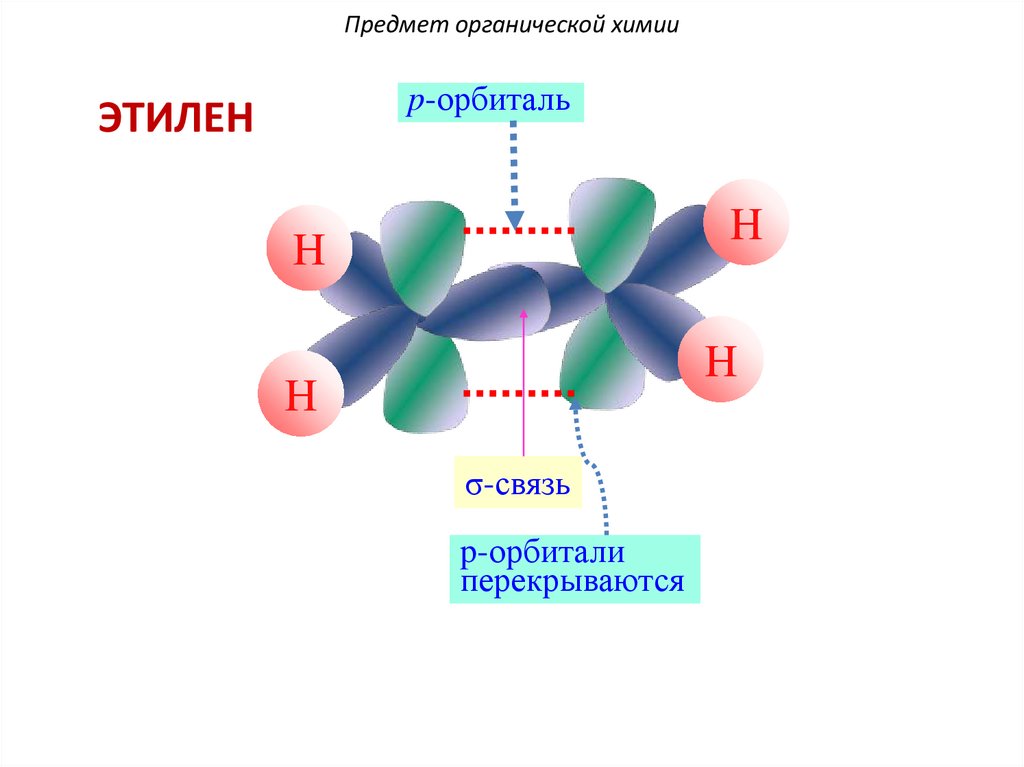
Две негибридные орбитали перекрываются с
образованием p-связи:
27.
Предмет органической химииp-орбиталь
ЭТИЛЕН
H
H
H
H
σ-связь
p-орбитали
перекрываются
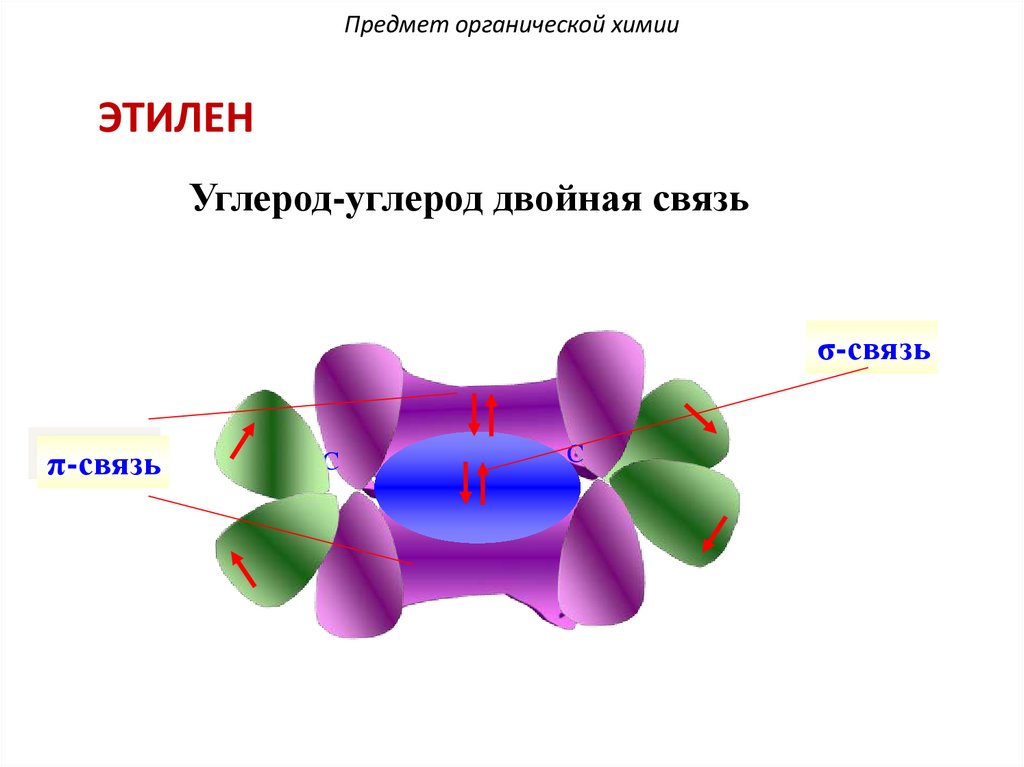
28.
Предмет органической химииЭТИЛЕН
Углерод-углерод двойная связь
σ-связь
π-связь
C
C
29.
Предмет органической химииЭТИЛЕН
30.
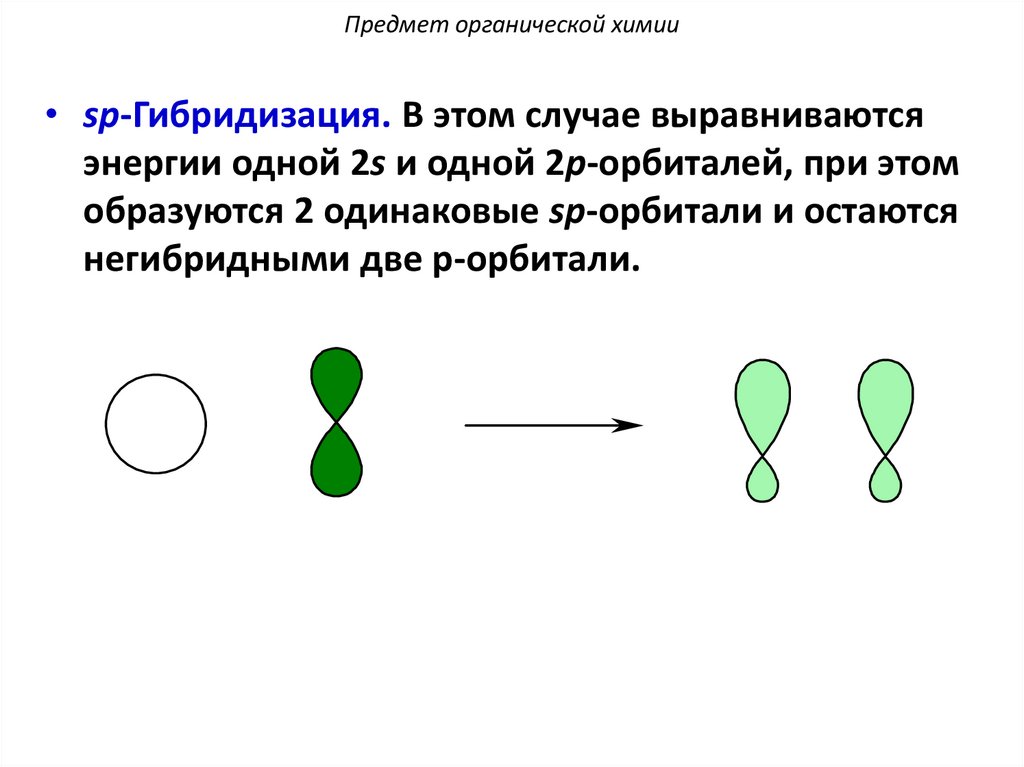
Предмет органической химии• sp-Гибридизация. В этом случае выравниваются
энергии одной 2s и одной 2p-орбиталей, при этом
образуются 2 одинаковые sp-орбитали и остаются
негибридными две p-орбитали.
31.
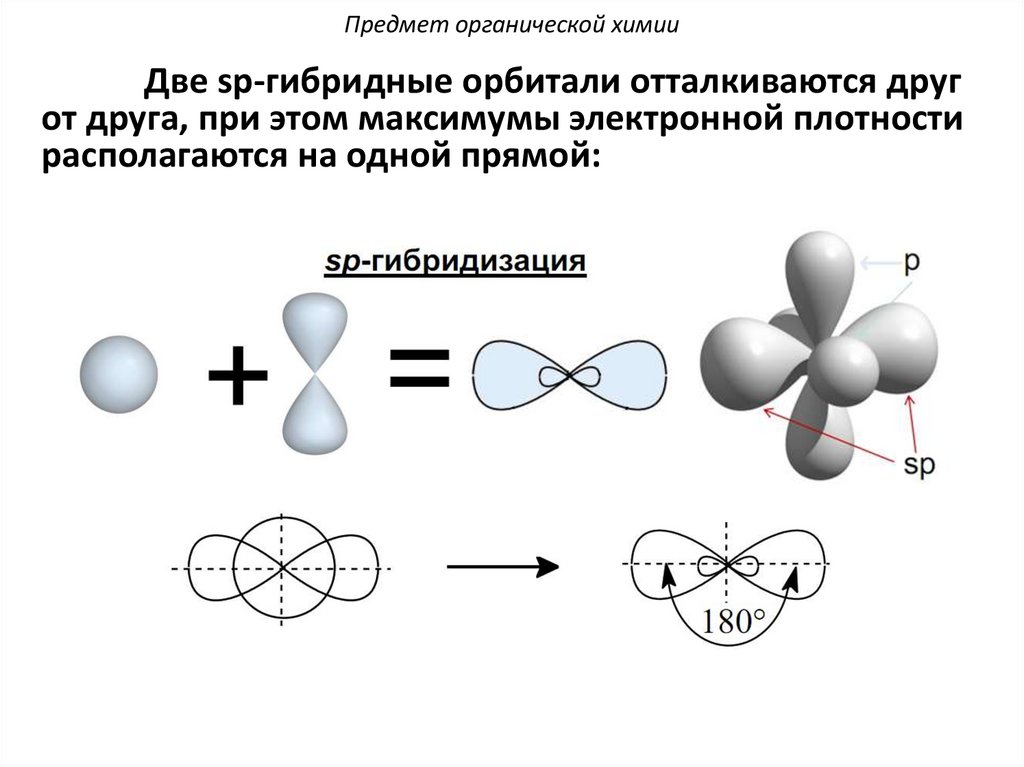
Предмет органической химииДве sp-гибридные орбитали отталкиваются друг
от друга, при этом максимумы электронной плотности
располагаются на одной прямой:
32.
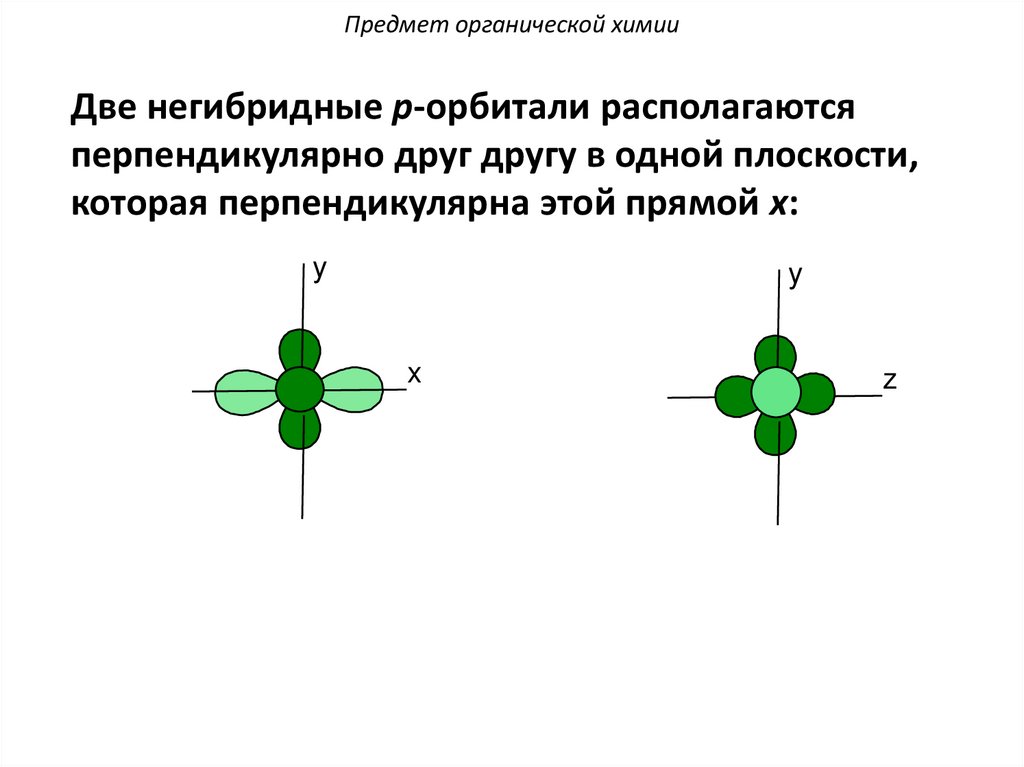
Предмет органической химииДве негибридные p-орбитали располагаются
перпендикулярно друг другу в одной плоскости,
которая перпендикулярна этой прямой x:
y
y
x
z
33.
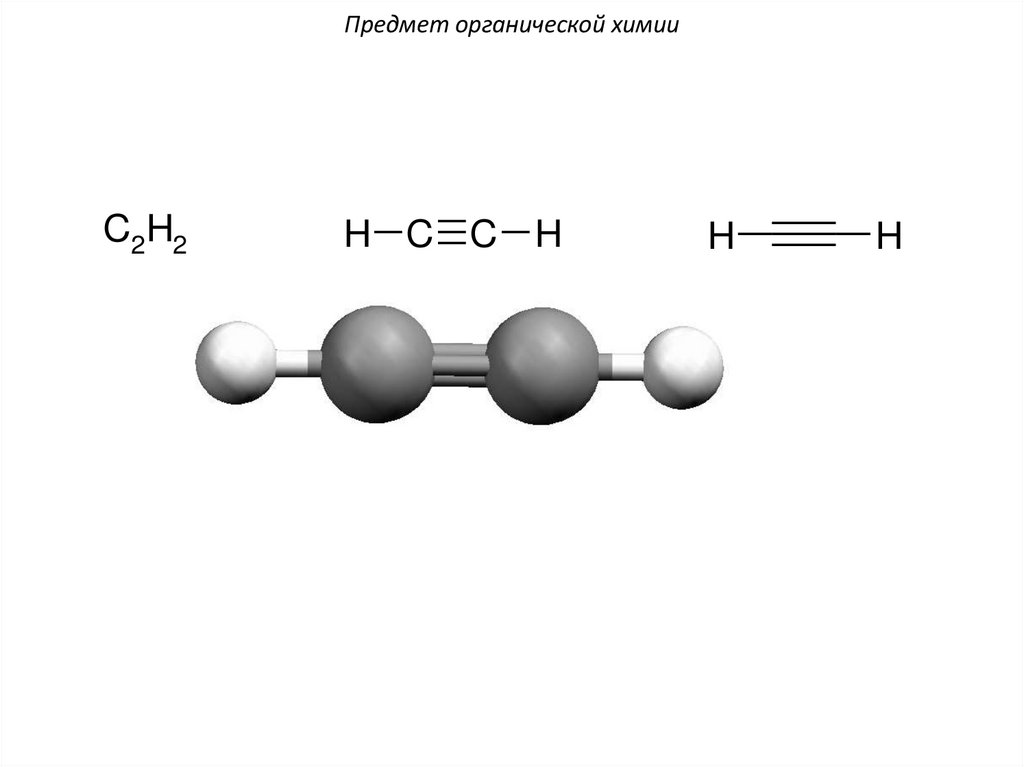
Предмет органической химииC2H2
H C C H
H
H
34.
Классификацияорганических
соединений
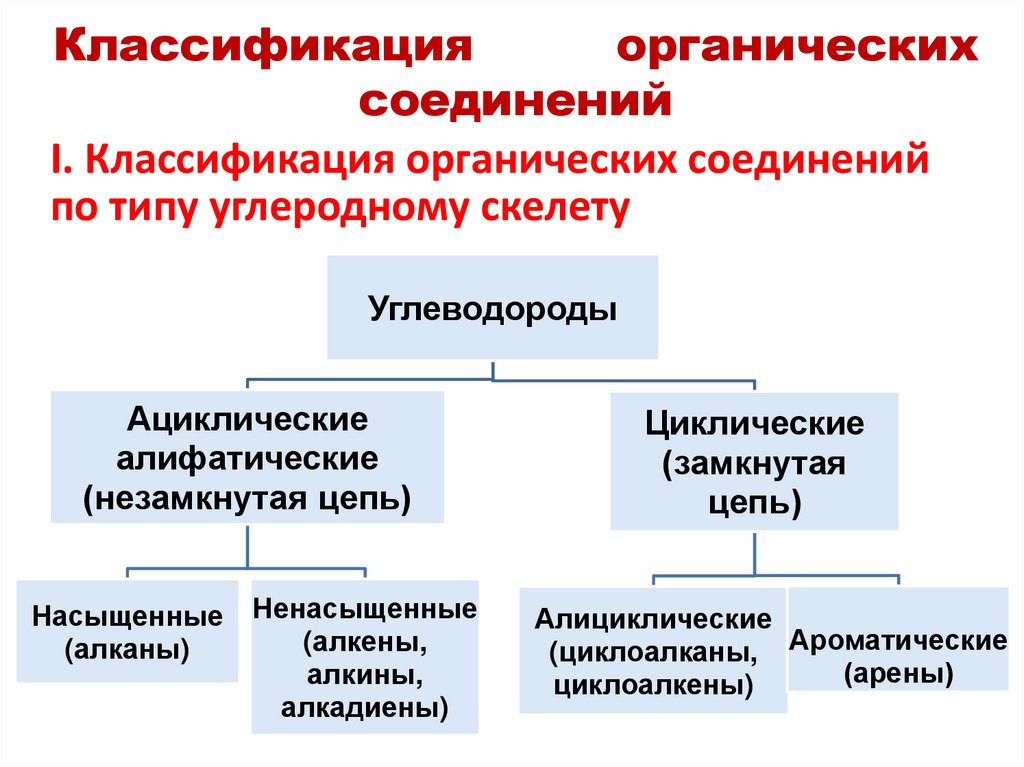
I. Классификация органических соединений
по типу углеродному скелету
Углеводороды
Ациклические
алифатические
(незамкнутая цепь)
Насыщенные
(алканы)
Ненасыщенные
(алкены,
алкины,
алкадиены)
Циклические
(замкнутая
цепь)
Алициклические
(циклоалканы, Ароматические
(арены)
циклоалкены)
35.
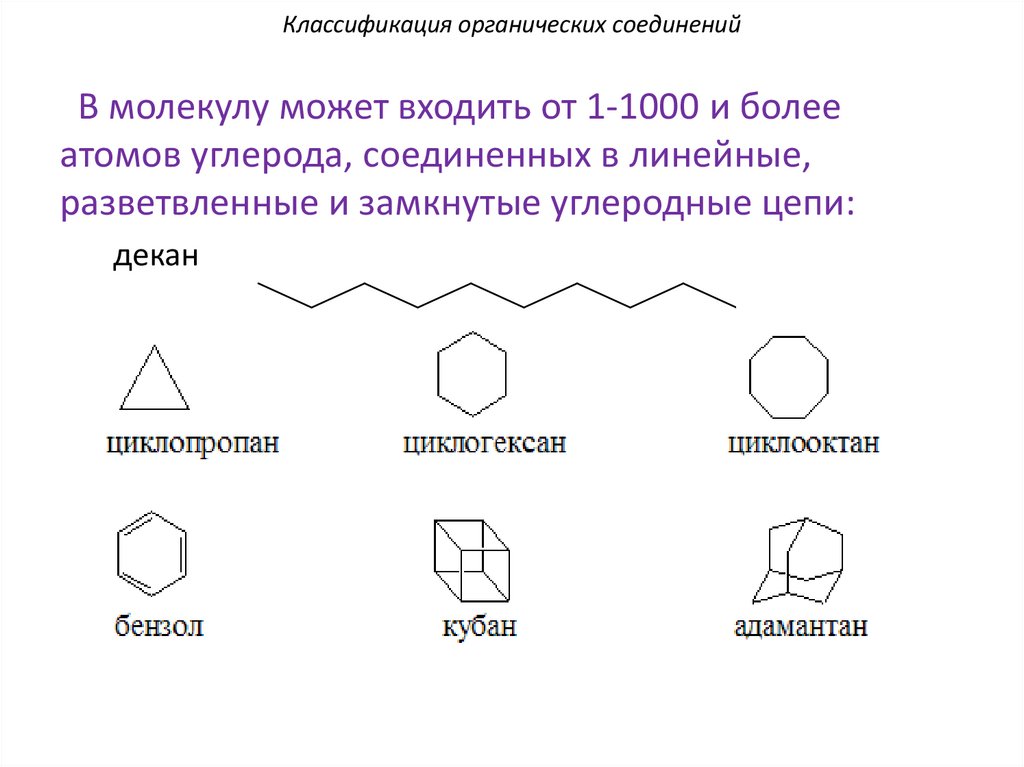
Классификация органических соединенийВ молекулу может входить от 1-1000 и более
атомов углерода, соединенных в линейные,
разветвленные и замкнутые углеродные цепи:
декан
36.
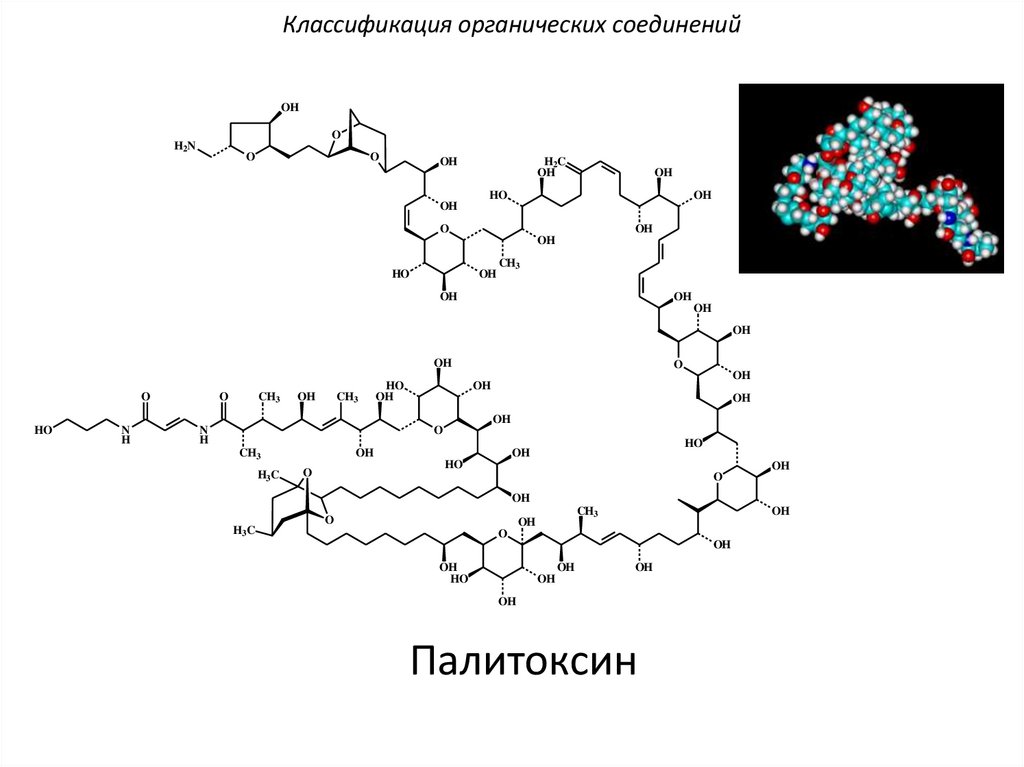
Классификация органических соединенийOH
O
H2N
O
O
OH
H2C
OH
OH
HO
OH
OH
O
OH
OH
HO
OH
CH3
OH
OH
OH
OH
OH
O
O
CH3
OH
CH3
HO
OH
O
OH
OH
OH
OH
HO
N
H
N
H
O
CH3
H3C
OH
HO
OH
HO
O
OH
O
OH
H3C
O
CH3
OH
OH
O
OH
OH
HO
OH
OH
OH
OH
Палитоксин
37.
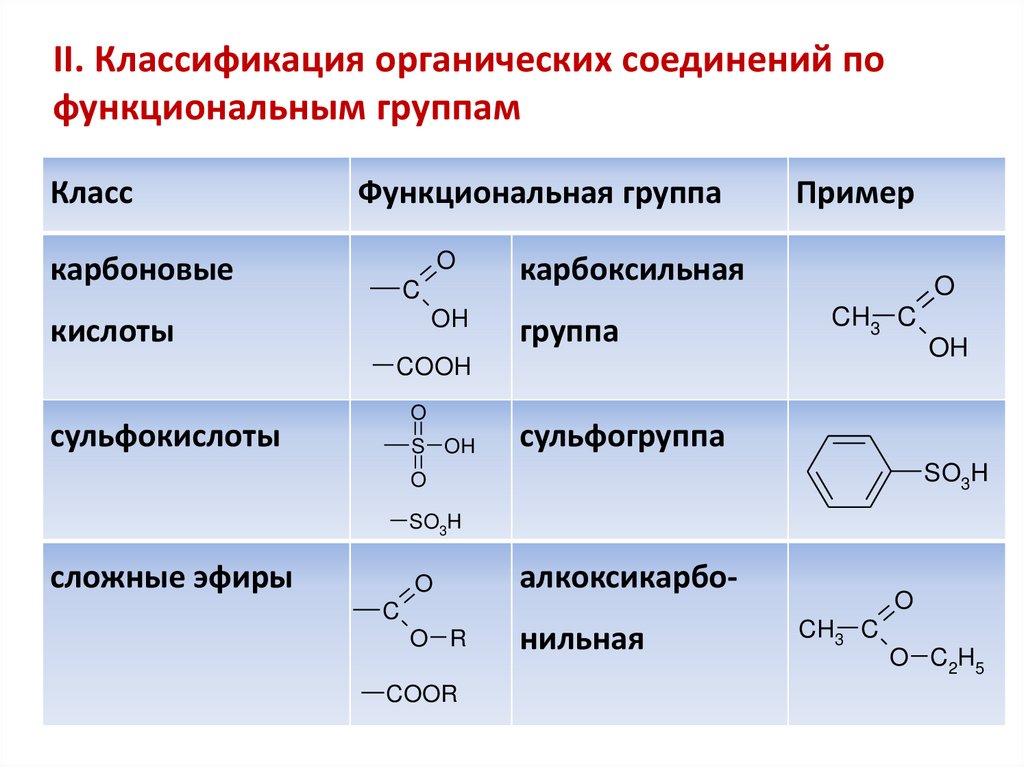
Классификация органических соединенийII. Классификация органических соединений
по типу связи
Органические соединения делятся на два типа:
насыщенные:
CH3 — CH2 — CH2 — COOH
бутановая кислота
• ненасыщенные:
CH3 — CH = CH — COOH
бутен-2-овая кислота
38.
II. Классификация органических соединений пофункциональным группам
Класс
Функциональная группа
O
карбоновые
C
OH
кислоты
Пример
карбоксильная
группа
O
CH3 C
COOH
O
сульфокислоты
S OH
OH
сульфогруппа
SO3H
O
SO3H
сложные эфиры
O
алкоксикарбо-
O R
нильная
C
COOR
O
CH3 C
O C2H5
39.
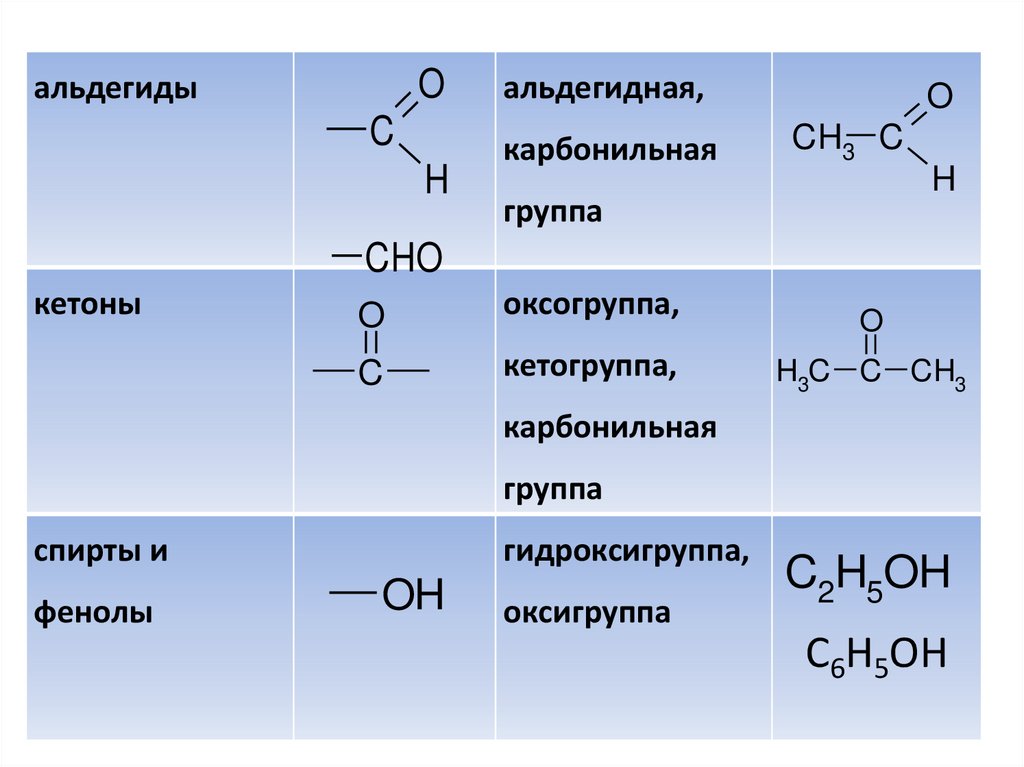
Oальдегиды
C
H
альдегидная,
карбонильная
O
CH3 C
H
группа
CHO
кетоны
O
оксогруппа,
O
C
кетогруппа,
H3C C CH3
карбонильная
группа
спирты и
фенолы
гидроксигруппа,
OH
оксигруппа
C2H5OH
C6H5OH
40.
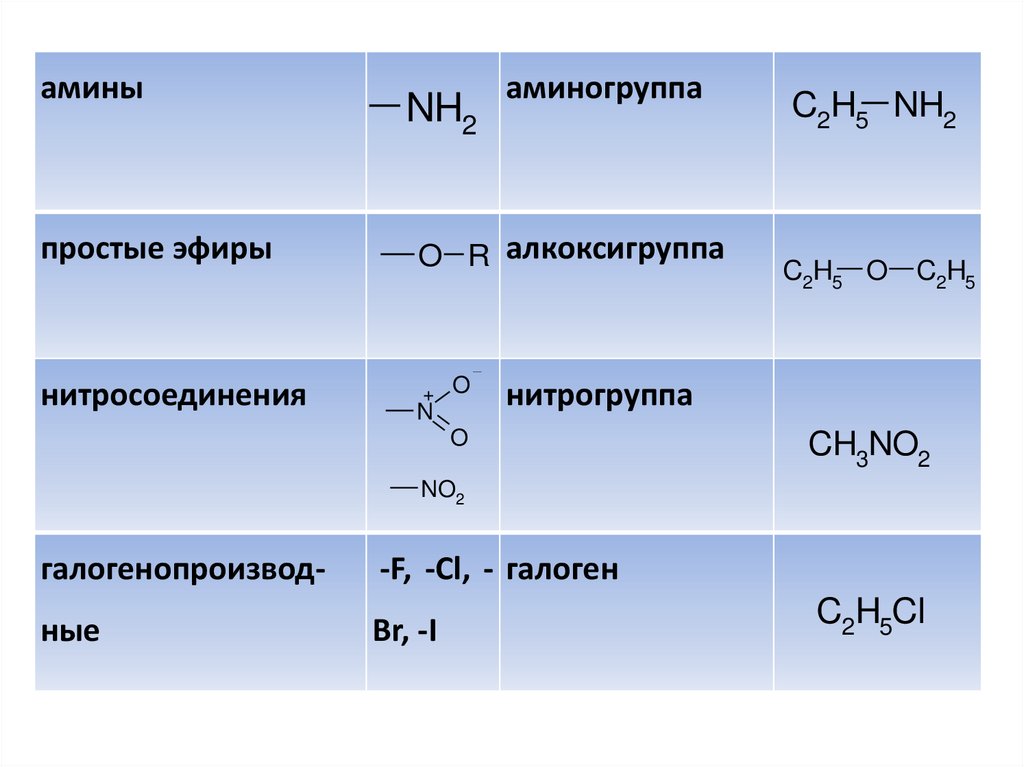
аминыNH2
аминогруппа
простые эфиры
O R алкоксигруппа
нитросоединения
+ O
N
C2H5 NH2
C2H5 O
C2H5
нитрогруппа
O
CH3NO2
NO2
галогенопроизвод-
-F, -Cl, - галоген
ные
Br, -I
C2H5Cl
41.
ГомологиДля удобства изучения по строению и свойствам
органические вещества объединяют в
гомологические ряды.
Гомологический ряд – ряд веществ,
расположенных в порядке возрастания
молекулярной массы, имеющих сходное
строение, свойства и отличающиеся друг
от друга на одну или несколько групп СН2.
42.
ГомологиГомологи – вещества, имеющие сходное
строение и свойства, отличающиеся между
собой на гомологическую разность CH2.
Общие формулы гомологических рядов:
СnН2n + 2 – алканы
СnН2n – алкены и циклоалканы
СnН2n -2 – алкадиены и алкины
СnН2n - 6 – арены
43.
Гомологический ряд метана• CH4 метан
• C2H6 этан
• C3H8 пропан
• C4H10 бутан
• C5H12 пентан
• C6H14 гексан
• C7H16 гептан
• C8H18 октан
• C9H20 нонан
• C10H22 декан
• C11H24 ундекан
• C12H26 додекан
• C13H28 тридекан
• C14H30 тетрадекан
• C15H32 пентадекан
• C16H34 гексадекан
• C17H36 гептадекан
• C18H38 октадекан
• C19H40 нонадекан
• C20H42 эйкозан
44.
Заместительная номенклатура IUPACI.Выбор главной углеродной цепи
(родоначальной структуры).
II.Нумерация цепи.
III.Составление названия.
Характеристическая (функциональная) группа –
атомы или группы атомов, определяющие
химические свойства соединения и принадлежность
его к определенному классу.
45.
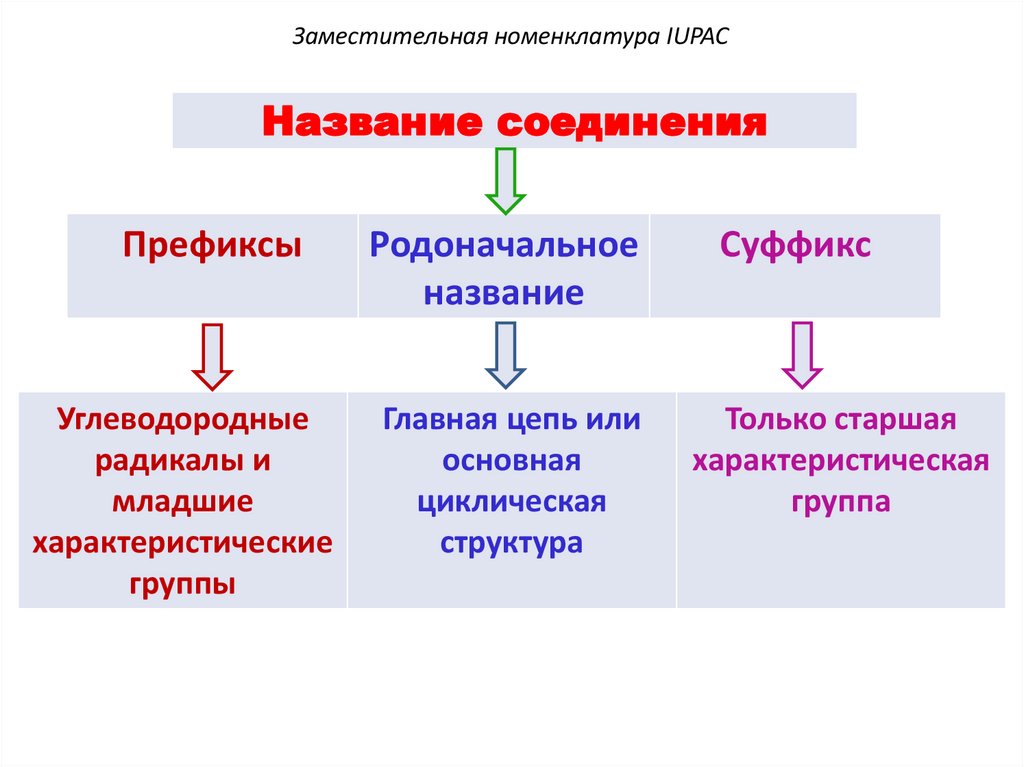
Заместительная номенклатура IUPACНазвание соединения
Префиксы
Углеводородные
радикалы и
младшие
характеристические
группы
Родоначальное
название
Главная цепь или
основная
циклическая
структура
Суффикс
Только старшая
характеристическая
группа
46.
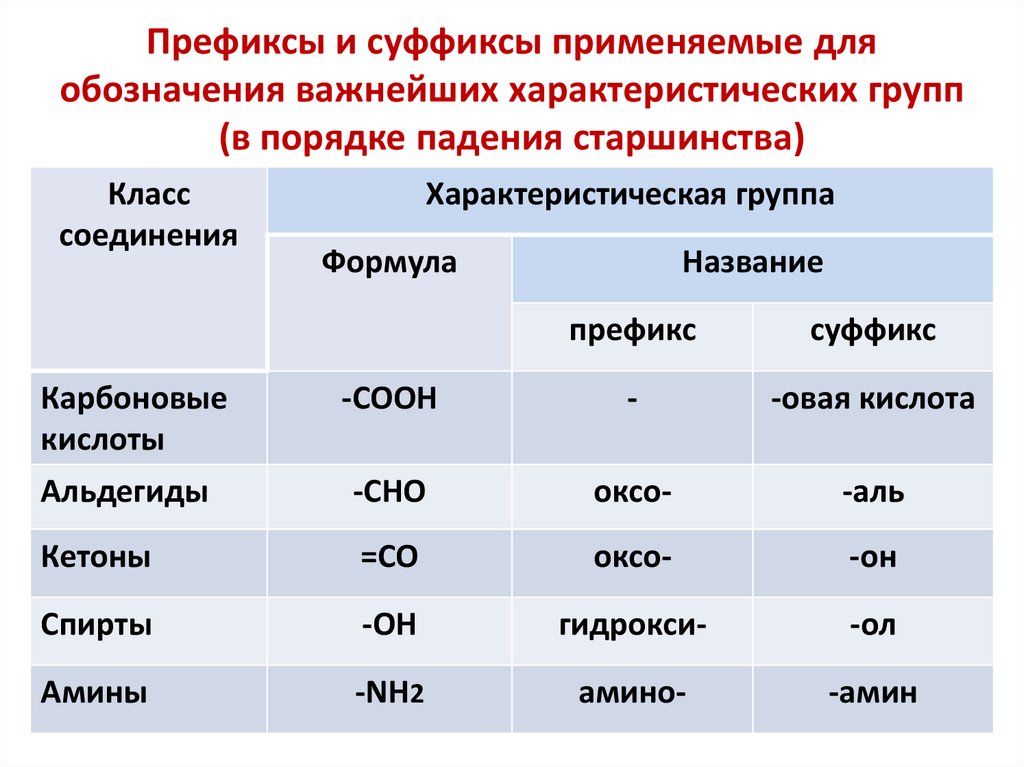
Префиксы и суффиксы применяемые дляобозначения важнейших характеристических групп
(в порядке падения старшинства)
Класс
соединения
Характеристическая группа
Формула
Название
префикс
суффикс
Карбоновые
кислоты
-COOH
-
-овая кислота
Альдегиды
-CHO
оксо-
-аль
Кетоны
=CO
оксо-
-он
Спирты
-OH
гидрокси-
-ол
Амины
-NH2
амино-
-амин
47.
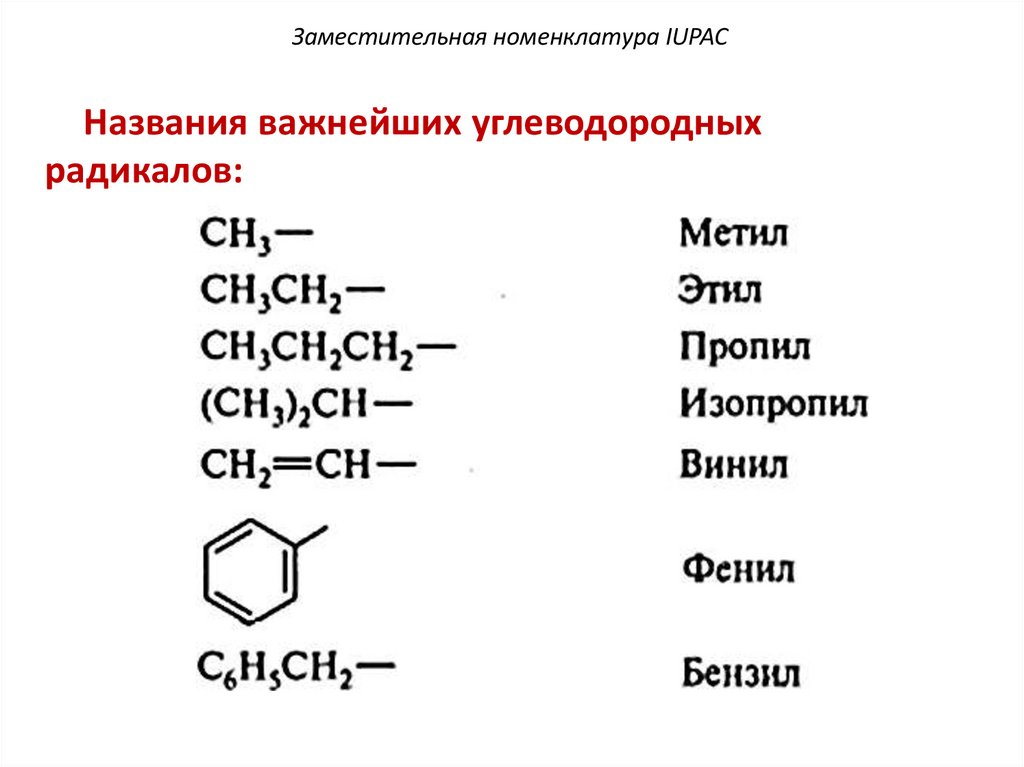
Заместительная номенклатура IUPACНазвания важнейших углеводородных
радикалов:
48.
Номенклатура алканов1. Найти самую длинную углеводородную цепь.
2. Пронумеровать цепь, начиная с того конца цепи,
к которому ближе находится разветвление.
3. Назвать алкан, перечисляя алкильные
заместители, указывая их количество и
положение.
CH3
CH3 CH CH3
метилпропан
49.
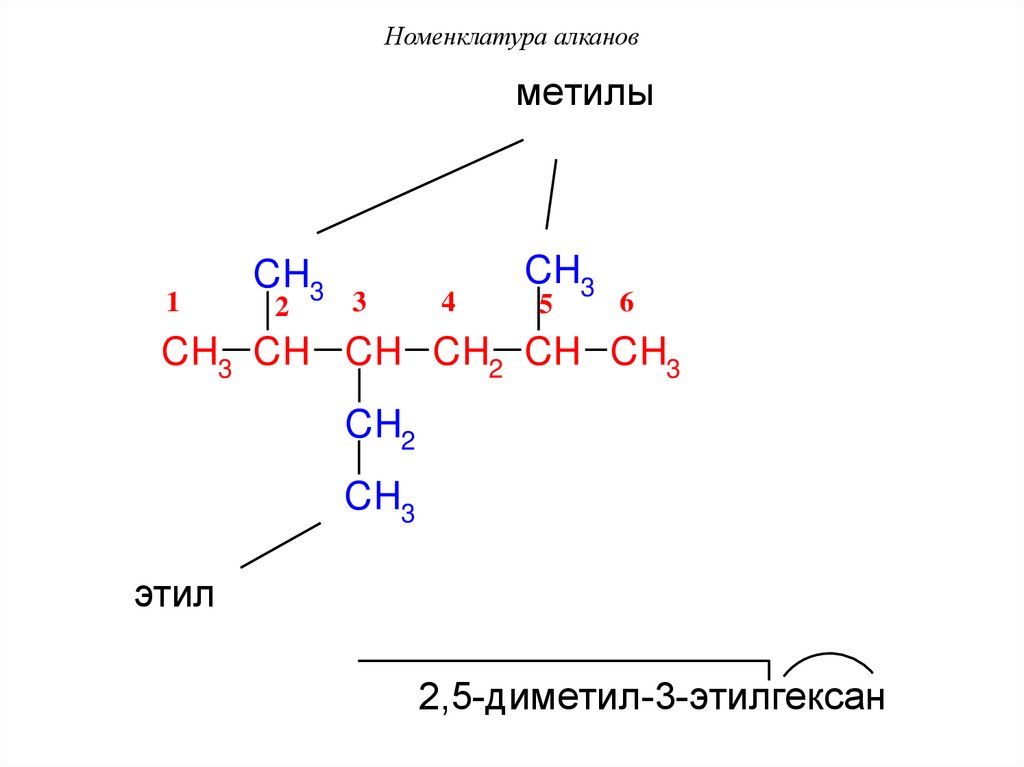
Номенклатура алкановмeтилы
1
CH3
2
3
4
CH3
5
6
CH3 CH CH CH2 CH CH3
CH2
CH3
этил
2,5-димeтил-3-этилгeксан
50.
Номенклатура алкеновэтан → этен (этилен)
пропан → пропен (пропилен)
1. Главная цепь обязательно должна включать в
себя двойную связь, поэтому она может быть и не
самой длинной.
2.Нумерацию начинают с того конца цепи,
который ближе к двойной связи. Цифра,
обозначающая положение двойной связи, ставится
после суффикса -ен.
51.
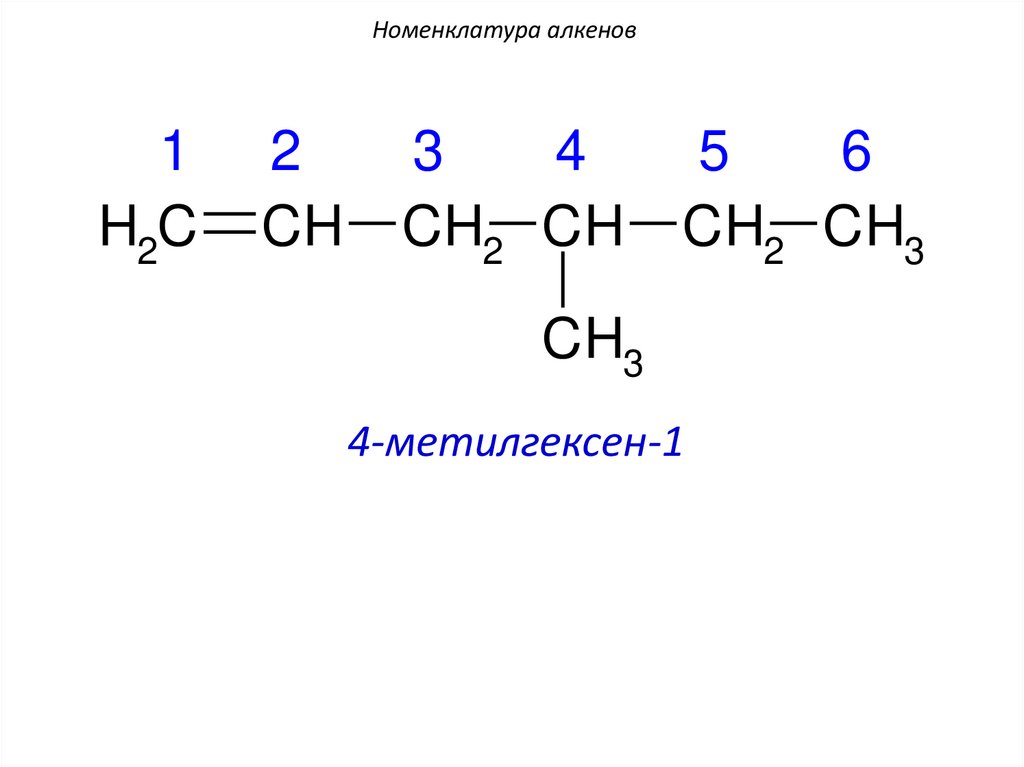
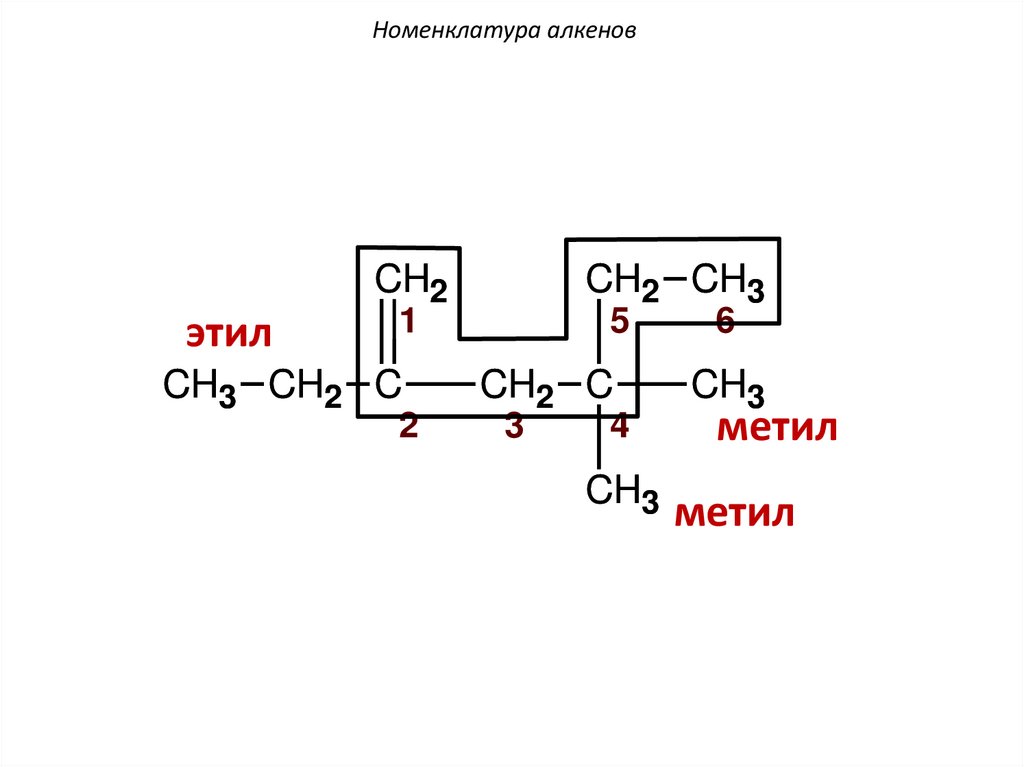
Номенклатура алкенов1
H2C
2
CH
3
4
CH2 CH
5
6
CH2 CH3
CH3
4-метилгексен-1
52.
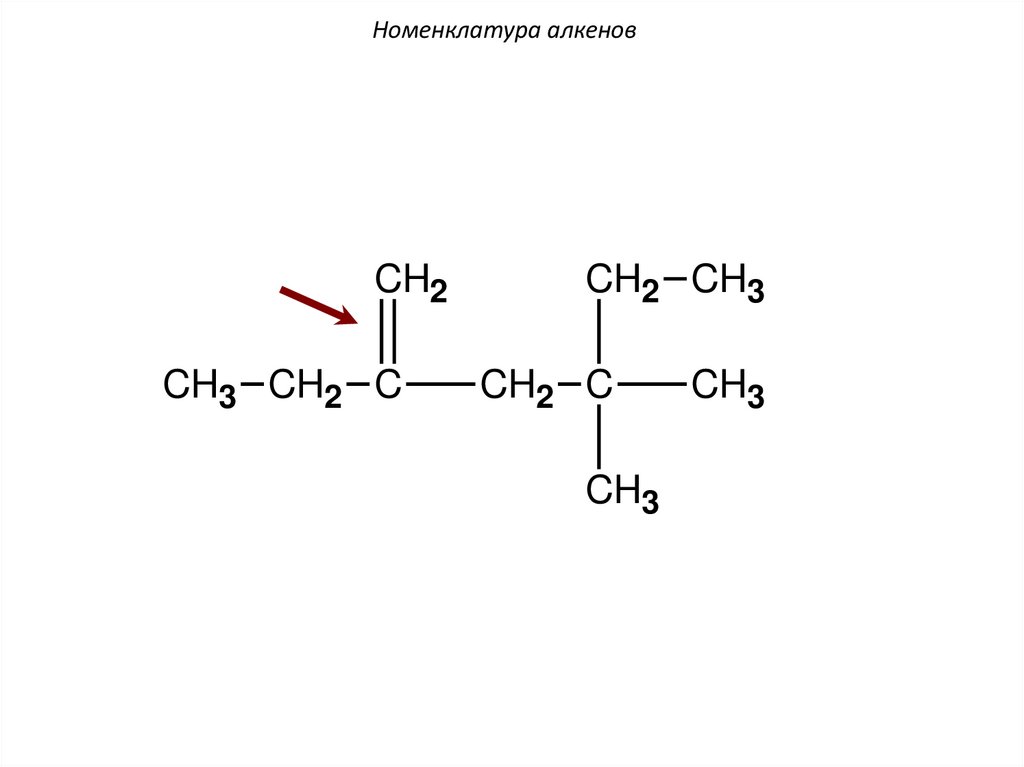
Номенклатура алкеновCH2
CH3 CH2 C
CH2 CH3
CH2 C
CH3
CH3
53.
Номенклатура алкеновCH2
CH3 CH2 C
CH2 CH3
CH2 C
CH3
CH3
54.
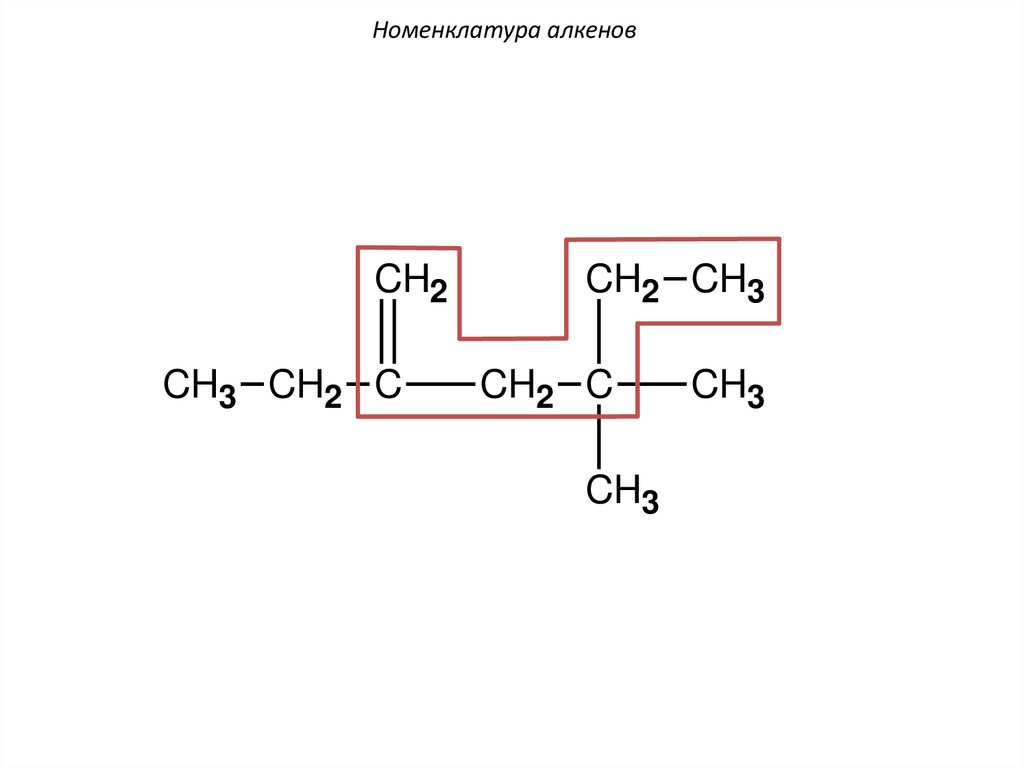
Номенклатура алкеновCH2
этил
CH2 CH3
1
CH3 CH2 C
2
5
CH2 C
3
4
CH3
6
CH3
метил
метил
55.
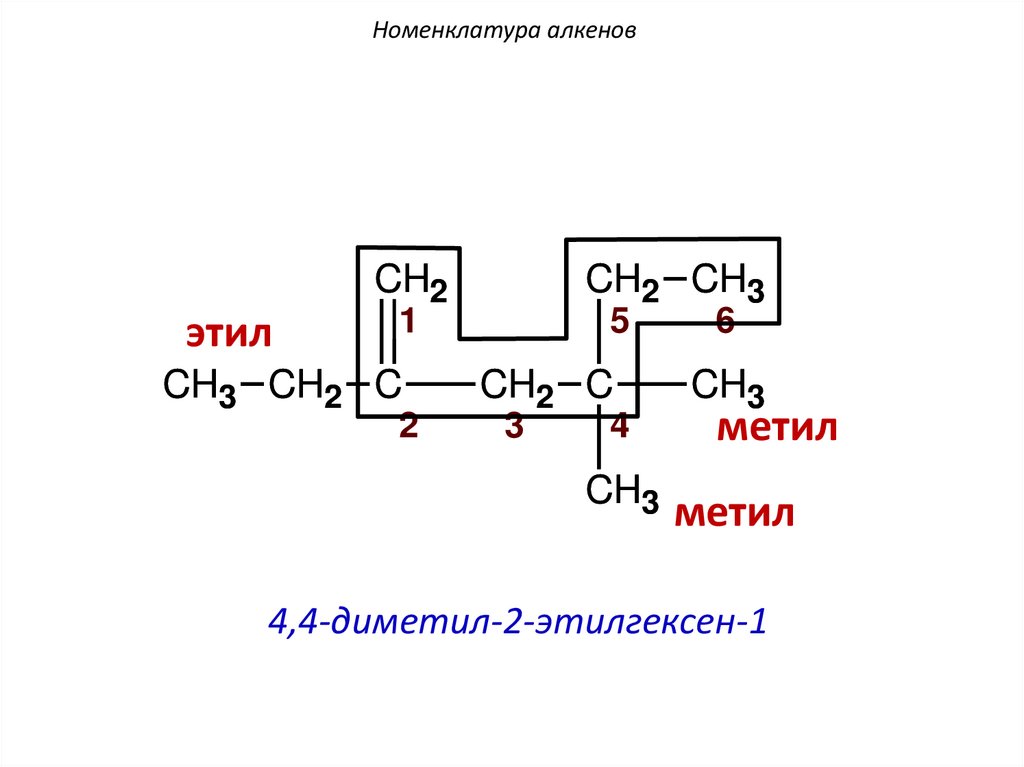
Номенклатура алкеновCH2
этил
CH2 CH3
1
CH3 CH2 C
2
5
CH2 C
3
4
CH3
6
CH3
метил
метил
4,4-диметил-2-этилгексен-1
56.
Номенклатура алкиновэтан → этин (этилен)
пропан → пропин (пропилен)
1. Главная цепь обязательно должна включать в
себя тройную связь, поэтому она может быть и не
самой длинной.
2.Нумерацию начинают с того конца цепи,
который ближе к тройной связи. Цифра,
обозначающая положение двойной связи, ставится
после суффикса -ин.
57.
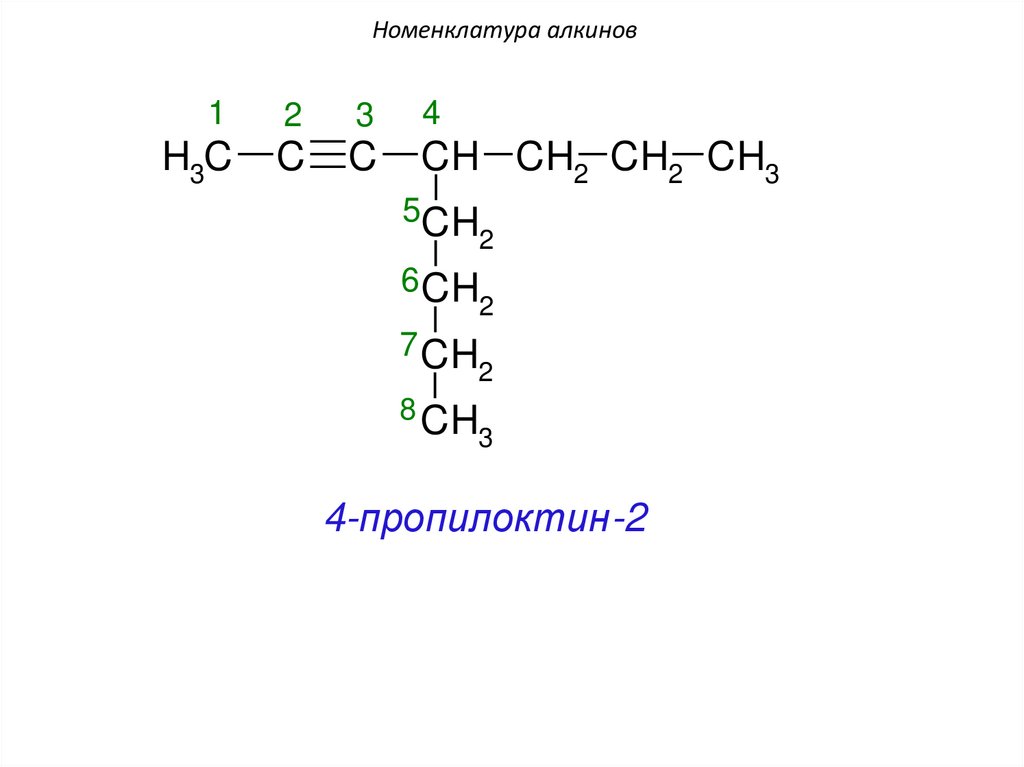
Номенклатура алкинов1
2
3
4
H3C
C
C
CH CH2 CH2 CH3
5CH
2
6 CH
2
7 CH
2
8 CH
3
4-пропилоктин-2
58.
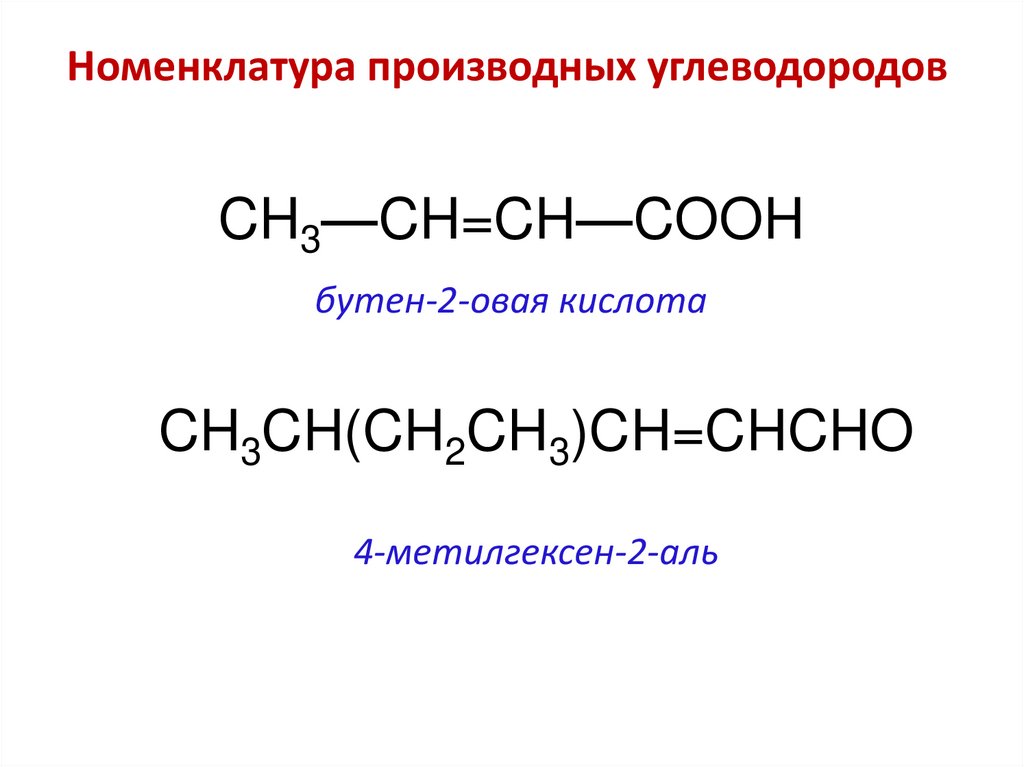
Номенклатура производных углеводородовCH3—CH=CH—COOH
бутен-2-овая кислота
CH3CH(CH2CH3)CH=CHCHO
4-метилгексен-2-аль
59.
Номенклатура производных углеводородовCH3C(CH3)2COCH3
3,3-диметилбутанон-2
CH3C(CH3)2CHNH2CH3
3,3-диметилбутанамин-2
60.
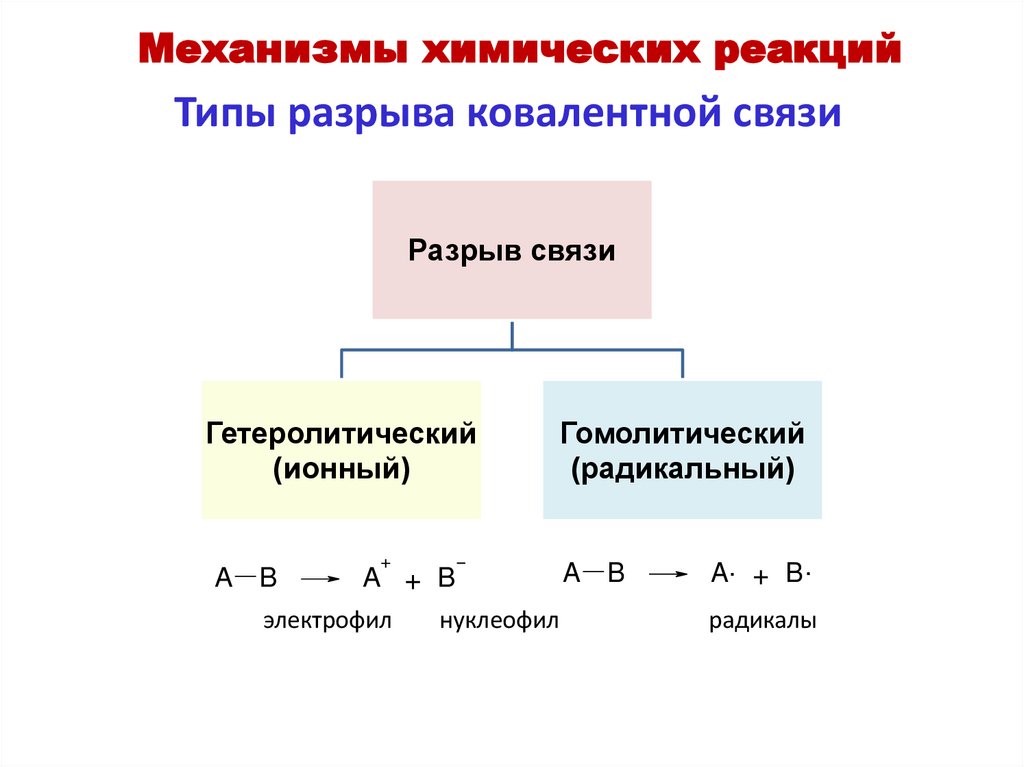
Механизмы химических реакцийТипы разрыва ковалентной связи
Разрыв связи
Гетеролитический
(ионный)
+
Гомолитический
(радикальный)
A B
A + B
электрофил
нуклеофил
A B
A. + B .
радикалы
61.
Механизмы химических реакций62.
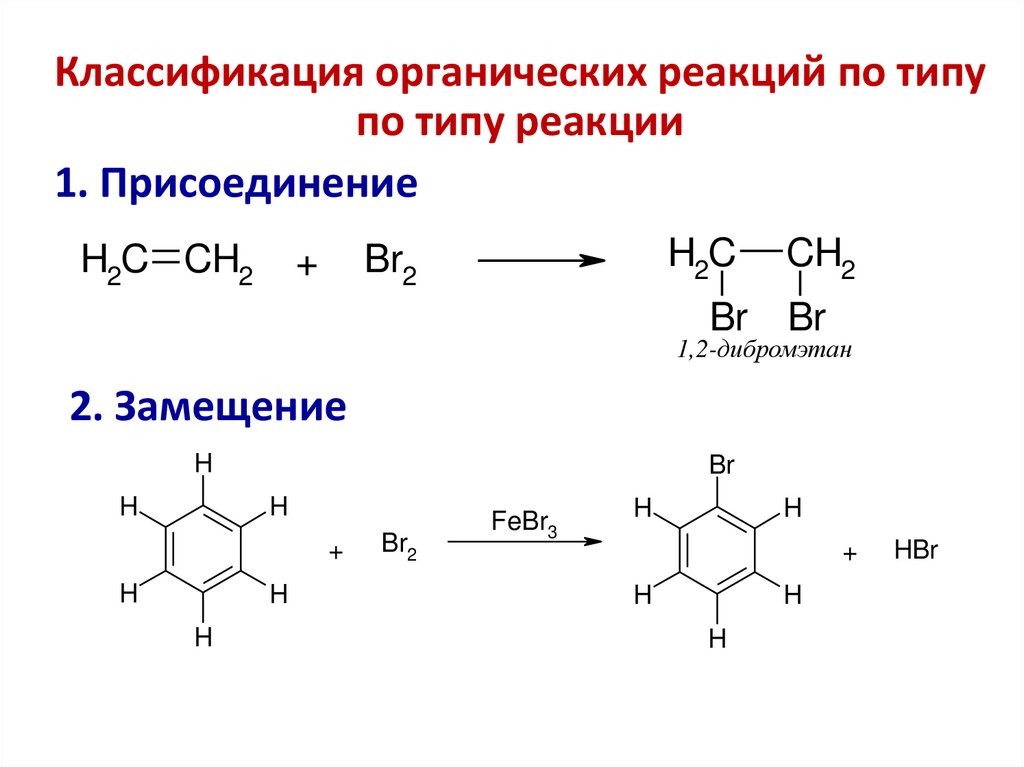
Классификация органических реакций по типупо типу реакции
1. Присоединение
H2C CH2
Br2
+
H2C
CH2
Br
Br
1,2-дибромэтан
2. Замещение
H
Br
H
H
+
H
H
H
Br2
FeBr3
H
H
+
H
H
H
HBr
63.
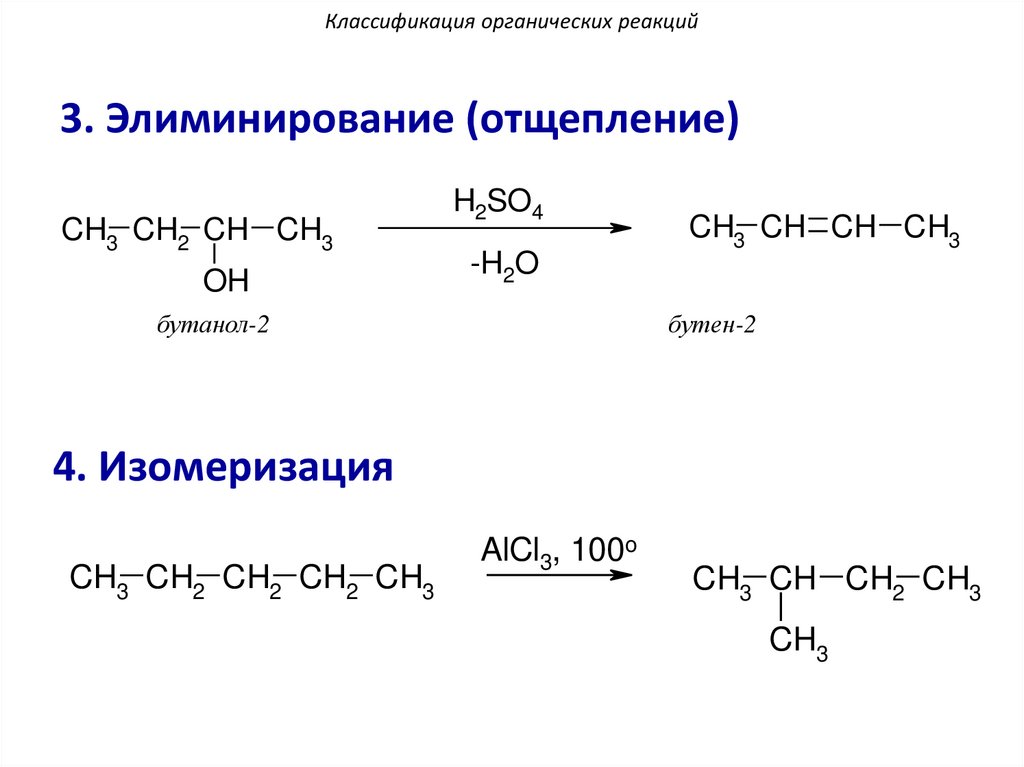
Классификация органических реакций3. Элиминирование (отщепление)
CH3 CH2 CH CH3
OH
H2SO4
-H2O
бутанол-2
CH3 CH CH CH3
бутен-2
4. Изомеризация
CH3 CH2 CH2 CH2 CH3
AlCl3, 100o
CH3 CH CH2 CH3
CH3
64.
СПАСИБО ЗАВАШЕ
ВНИМАНИЕ!

















 Химия
Химия








