Похожие презентации:
Пниктогены элеметы VA группы
1.
2.
3.
4.
5.
6.
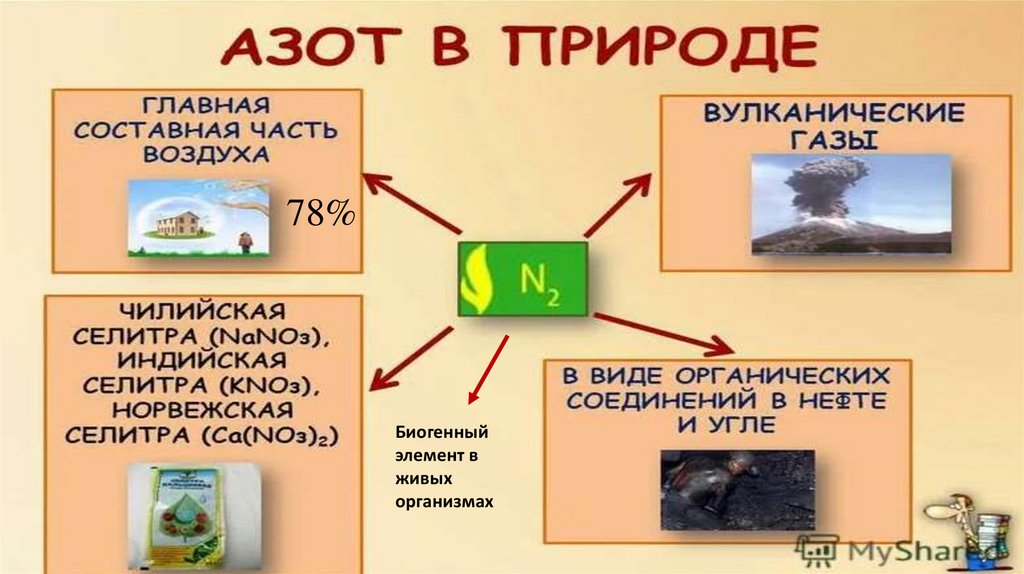
78%Биогенный
элемент в
живых
организмах
7.
8.
9.
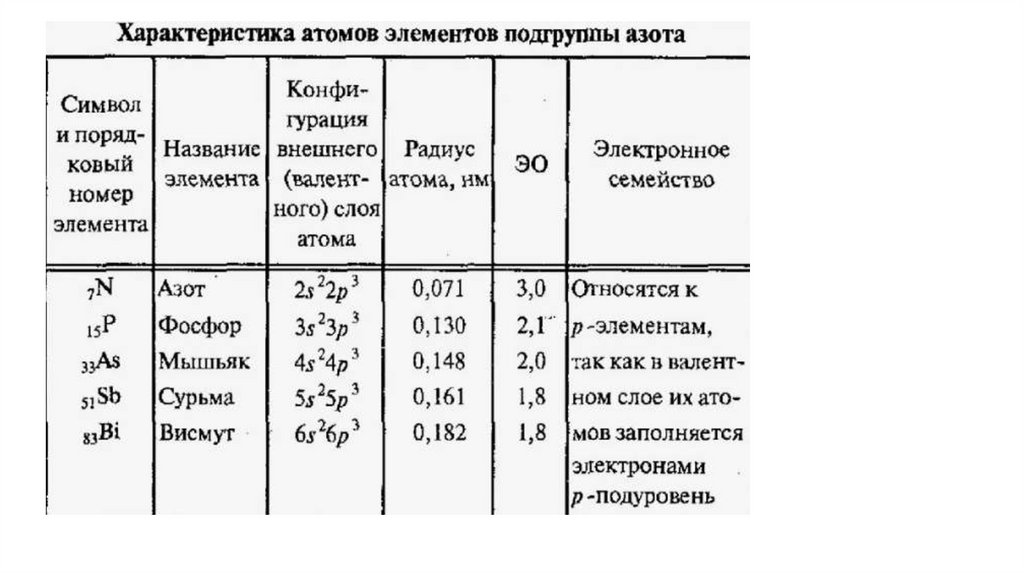
Положение химического элемента азота в Периодической системеД. И. Менделеева
Период 2
Группа V
Подгруппа A «ПНИКТОГЕНЫ»
Порядковый номер (N) = 7
р=7
ē = 7, количество неспаренных электронов 3
+ Z = +7
Ar = 14
n (нейтроны) = 7
Валентность = I,II, III, IV
Степени окисления: -3, -2 (N2H4 гидразин), -1(NH2OH гидроксиламин)
0 +1, +2, +3, +4,+5
10.
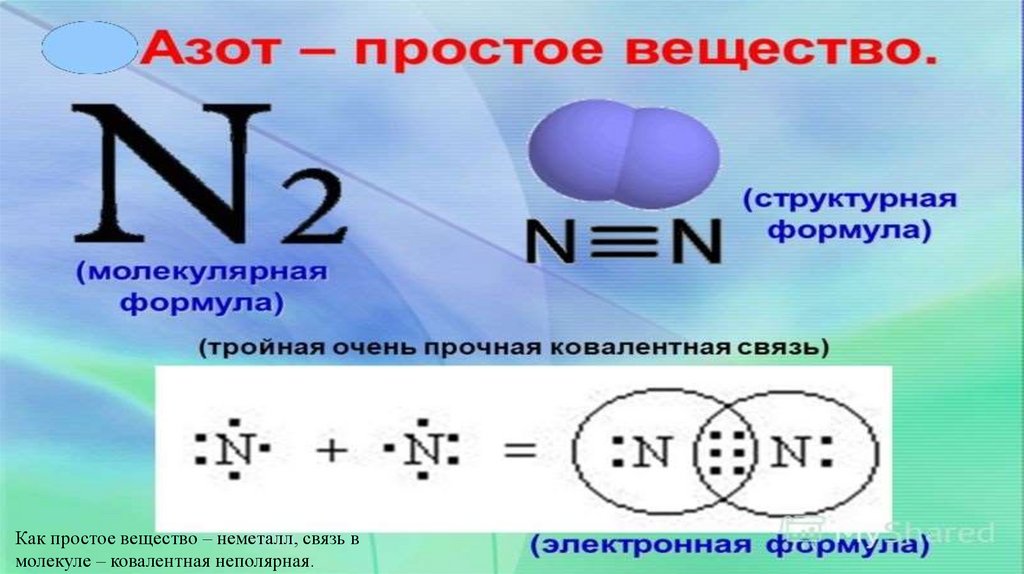
Как простое вещество – неметалл, связь вмолекуле – ковалентная неполярная.
11.
12.
13.
Химические свойства азотаПростое вещество азот химически малоактивно и, как правило, вступает в химические реакции
только при высоких температурах.
Окислительные свойства азота проявляются в реакциях с водородом и активными металлами.
При обычных условиях азот реагирует только с литием, с остальными только при нагревании
Li + N2= Li3N (нитрид лития)
3H2 + N2 = 2NH3 (аммиак)
2В +N2= 2ВN (нитрид бора)
3Ca +N2= Ca3N2
14.
Восстановительные свойства азота проявляются при еговзаимодействии с кислородом и фтором. Азот реагирует с
кислородом при температуре около 3000 °С, образуя
оксид азота(II):
О2 + N2 = 2NО
3F2 + N2 = 2NF3



















 Химия
Химия








