Похожие презентации:
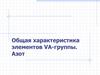
Пниктогены р-элементы V группы; VA группа; 15 группа
1.
ПНИКТОГЕНЫр-элементы V группы;
VA группа; 15 группа
увеличение
Московий
+115
Mc
2.
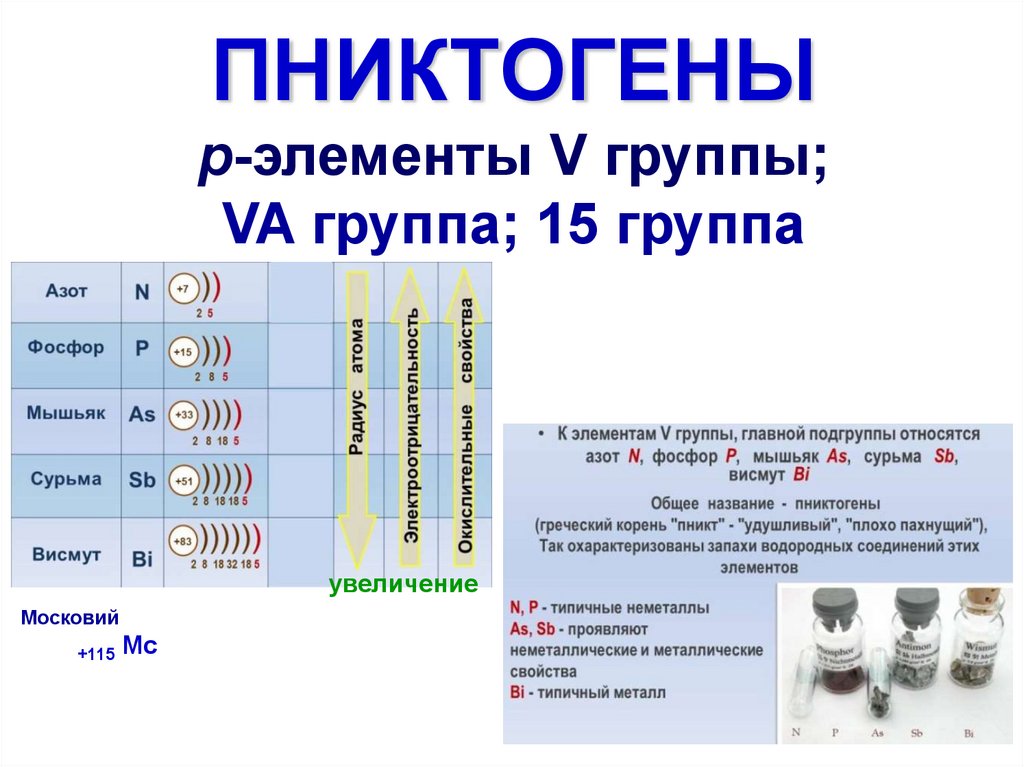
3.
Простые вещества4. N, P, As, Sb, Bi электронная конфигурация
23
2s
2p
2s 2p
ns
2
np
3
ns np
Э III; 3
Э* V; +5
N II,III,IV;
3; +4; +5
N* ?
nd
5. Азот: примеры соединений
Устойчивые ст. ок.: –3; 0; +5–3
–2
–1
0
+1
+2
+3
+4
+5
NH3, NH4X, KNH2, Mg3N2
N2H4, N2H5Cl
NH2OH, NH2Cl, (HN3)
N2, (HN3)
N2O, (H2N2O2)
NO, (H2N2O3)
NOCl, NCl3; N2O3, HNO2
NO2, N2O4
N2O5, HNO3; Me(NO3)n, NH4NO3
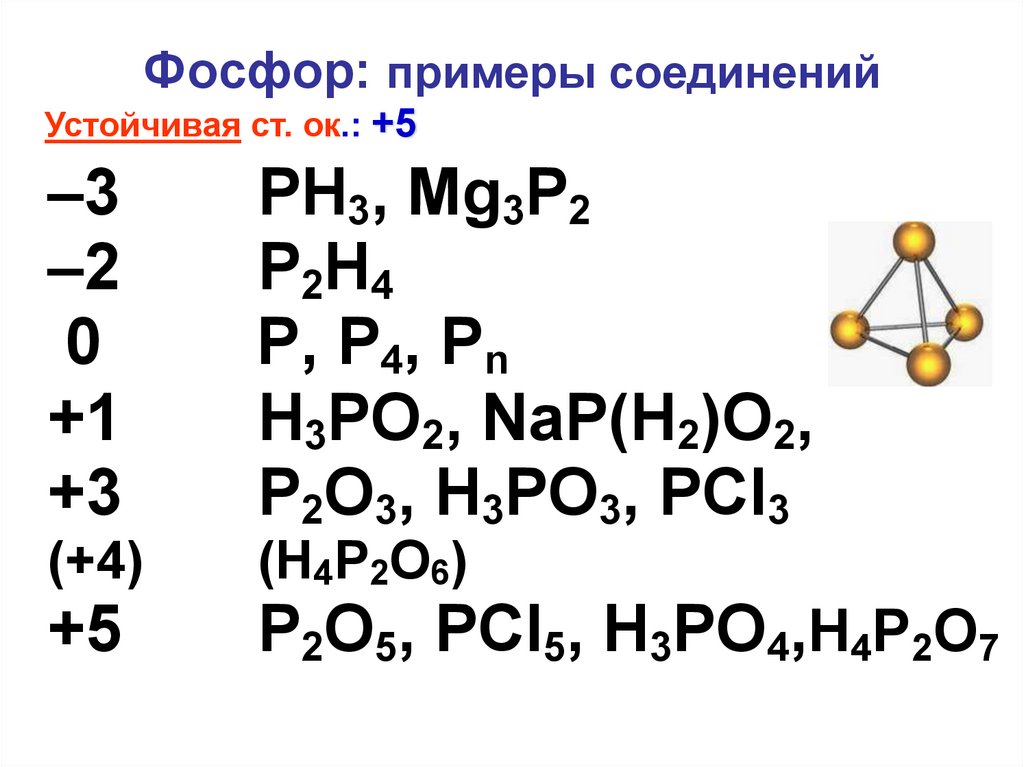
6. Фосфор: примеры соединений
Устойчивая ст. ок.: +5–3
–2
0
+1
+3
PH3, Mg3P2
P2H4
P, P4, Рn
H3PO2, NaP(H2)O2,
P2O3, H3PO3, PCl3
(+4)
(H4P2O6)
+5
P2O5, PCl5, H3PO4,H4P2O7
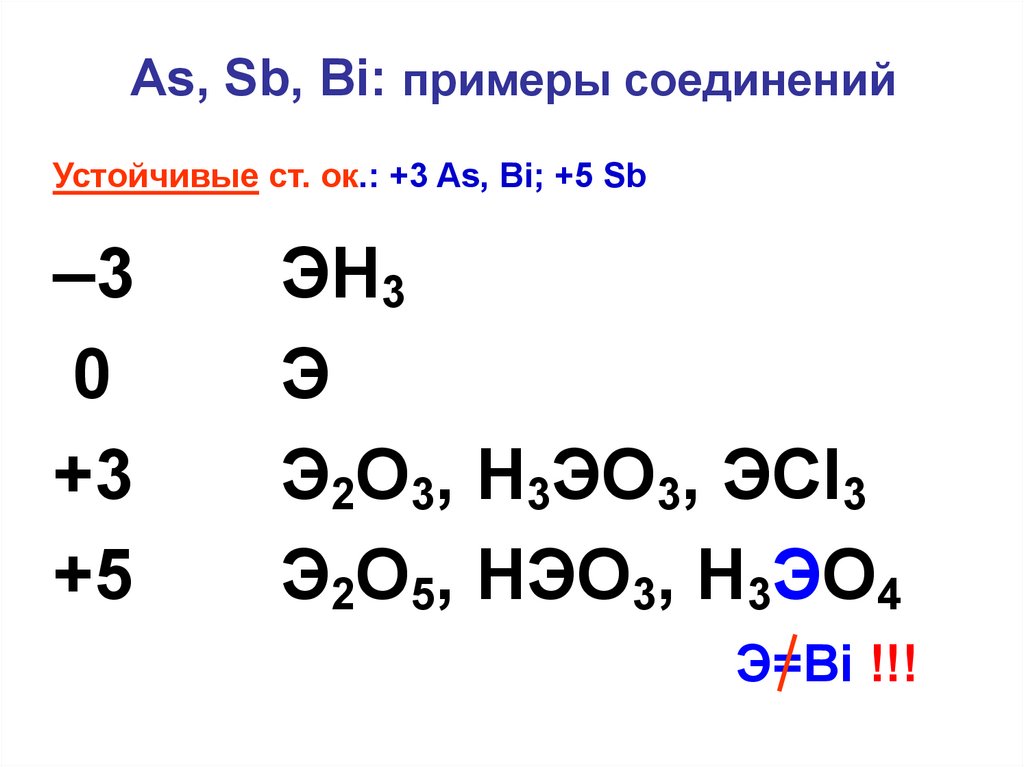
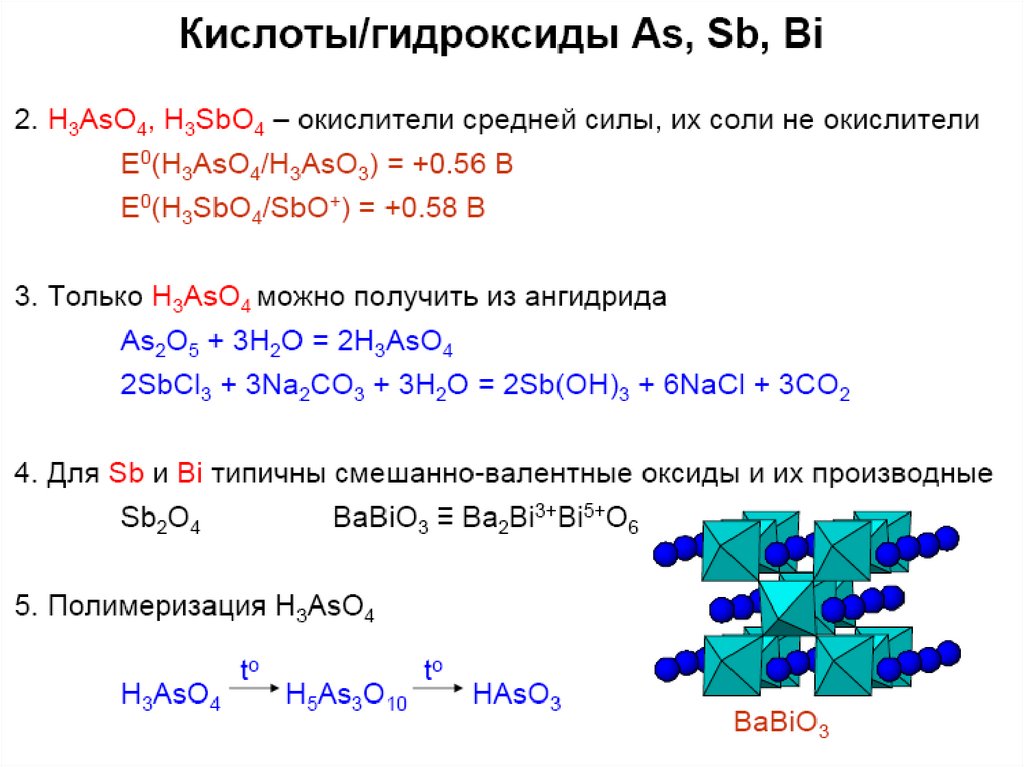
7. As, Sb, Bi: примеры соединений
Устойчивые ст. ок.: +3 As, Bi; +5 Sb–3
0
+3
+5
ЭH3
Э
Э2O3, H3ЭO3, ЭCl3
Э2O5, НЭО3, H3ЭO4
Э=Bi !!!
8.
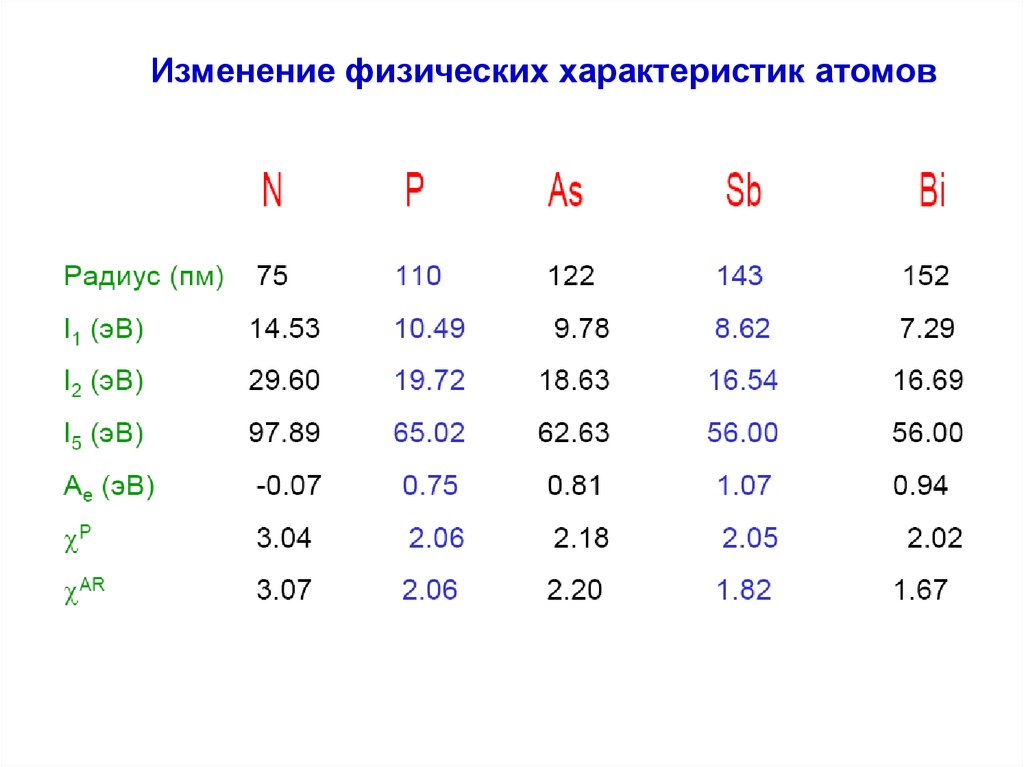
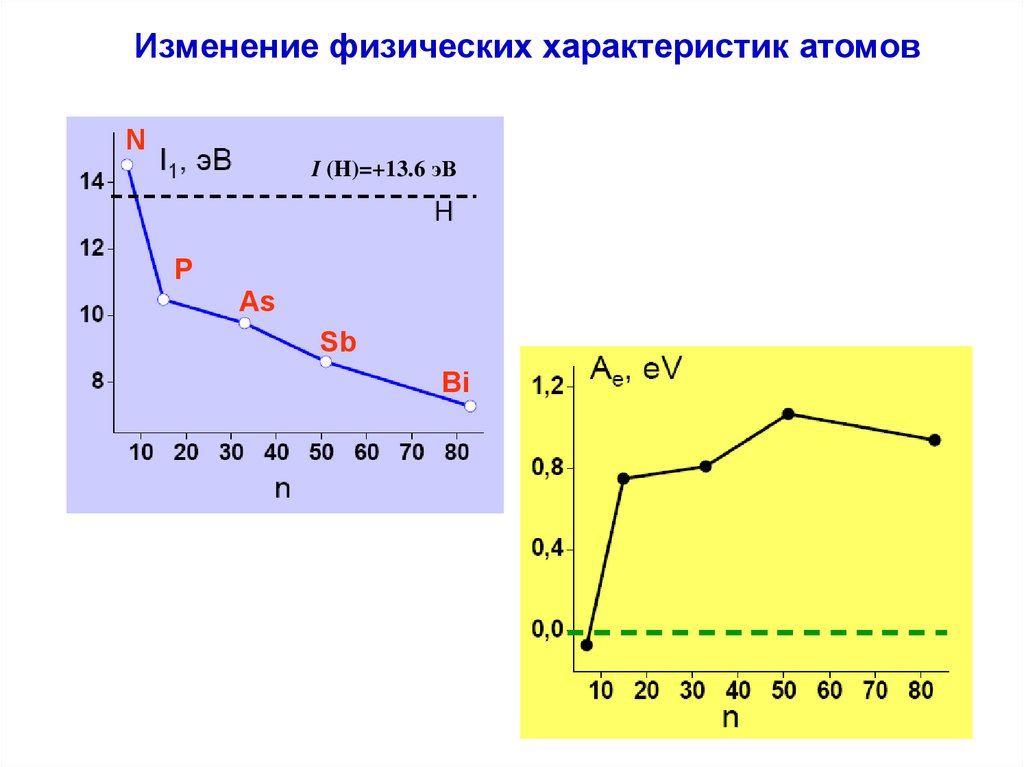
Изменение физических характеристик атомов9.
Изменение физических характеристик атомовN
I (H)=+13.6 эВ
P
As
Sb
Bi
10.
Изменение физических характеристик атомовЭлектроотрицательность
1) Характерна катенация: P, As,Sb;
2) Устойчивые кратные связи: N2.
Энергия одинарной и
тройной связи
11. Простые вещества пниктогенов
P4Pn
P
Asn
Sbn
As4
Sb4
Bi
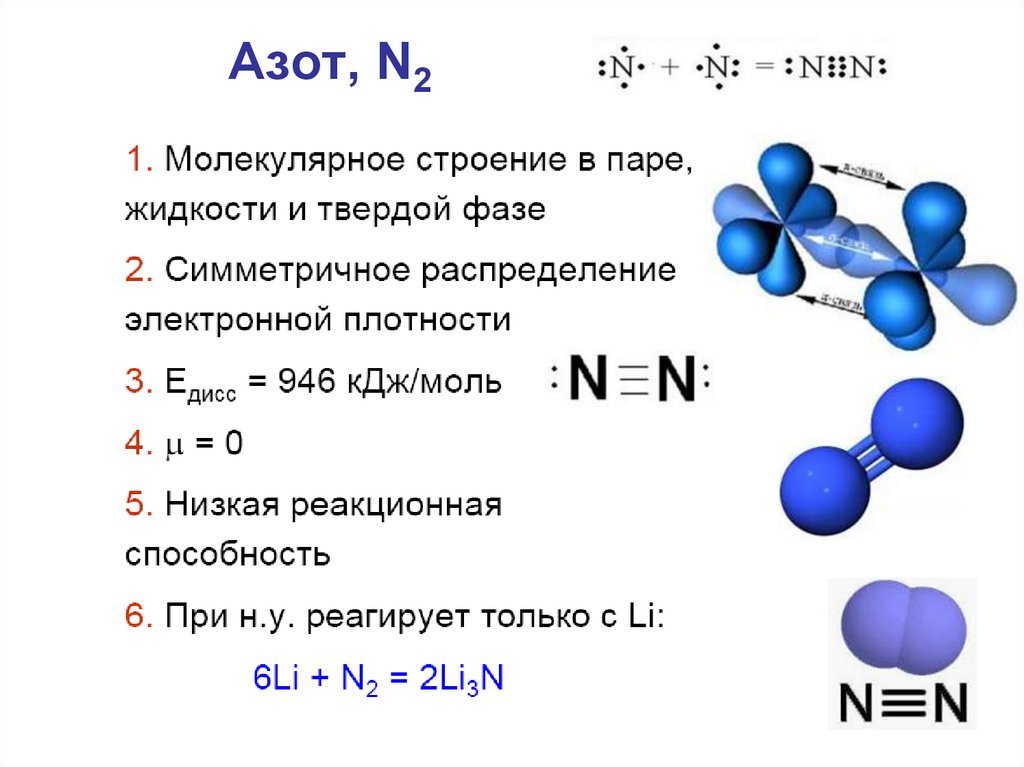
12. Азот, N2
13.
Дополнительно: фиксация N214.
!!!15. Фосфор: P4, Pn, P
Фосфор: P4, Pn, P16. Фосфор: P4, Pn, P
Фосфор: P4, Pn, PБелый (1), красный (2) и черный (3) фосфор
и их кристаллические структуры.
17.
P4Pn
P
18.
Хим. свойства фосфораP + O2 P2O5 + P2O3 (изб. / недост. О2)
19.
20.
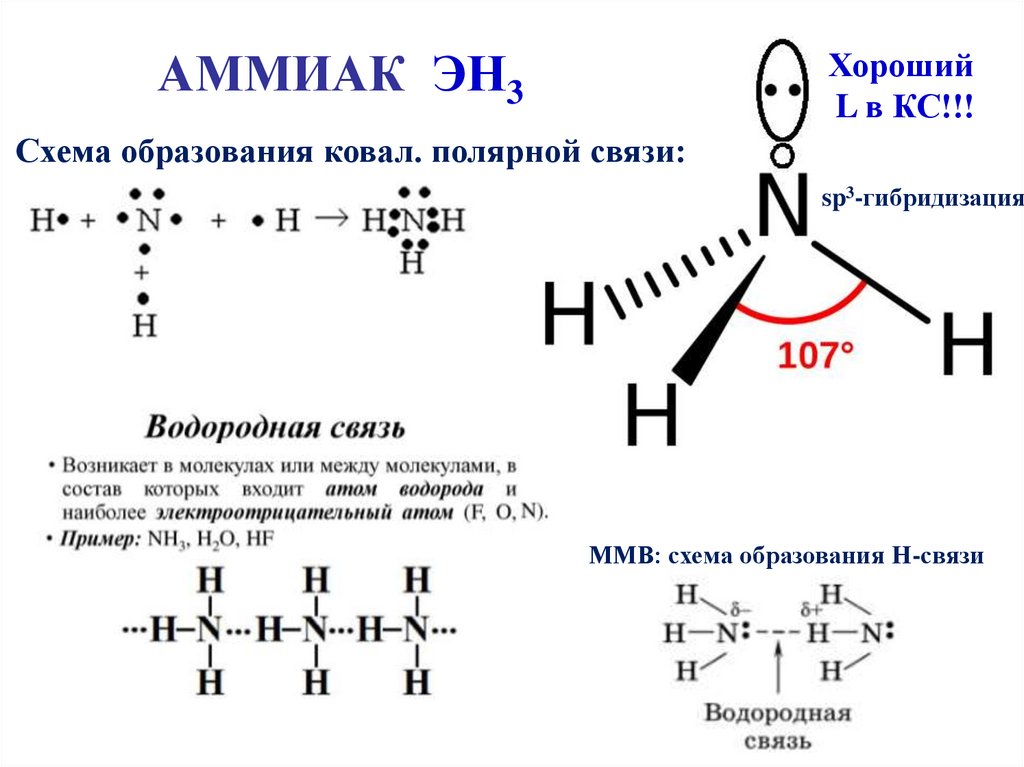
АММИАК ЭН3Хороший
L в КС!!!
Схема образования ковал. полярной связи:
sp3-гибридизация
ММВ: схема образования Н-связи
21.
Соединения Э с водородомNH3 – аммиак
N2H4 – гидразин
+1
–1
0
0
N3H (HN3) – азидоводород; H–N :N N:
NH2OH – гидроксиламин
PH3 – фосфин
AsH3 – арсин
SbH3 – стибин
22.
Восстановительная способность ЭН3:NH3 <<PH3 < AsH3 < SbH3
Получение гидридов:
NH4Cl + NaOH NaCl + H2O + NH3
Mg3P2 + HCl MgCl2 + PH3
[As] + Zn + HCl ZnCl2 + AsH3
(As2O3, AsCl3, Na3AsO3,…)
Реакция Марша
23.
Оксиды азота+1 N2O
+2 NO
+3 N2O3
+4 NO2 (N2O4)
+5 N2O5
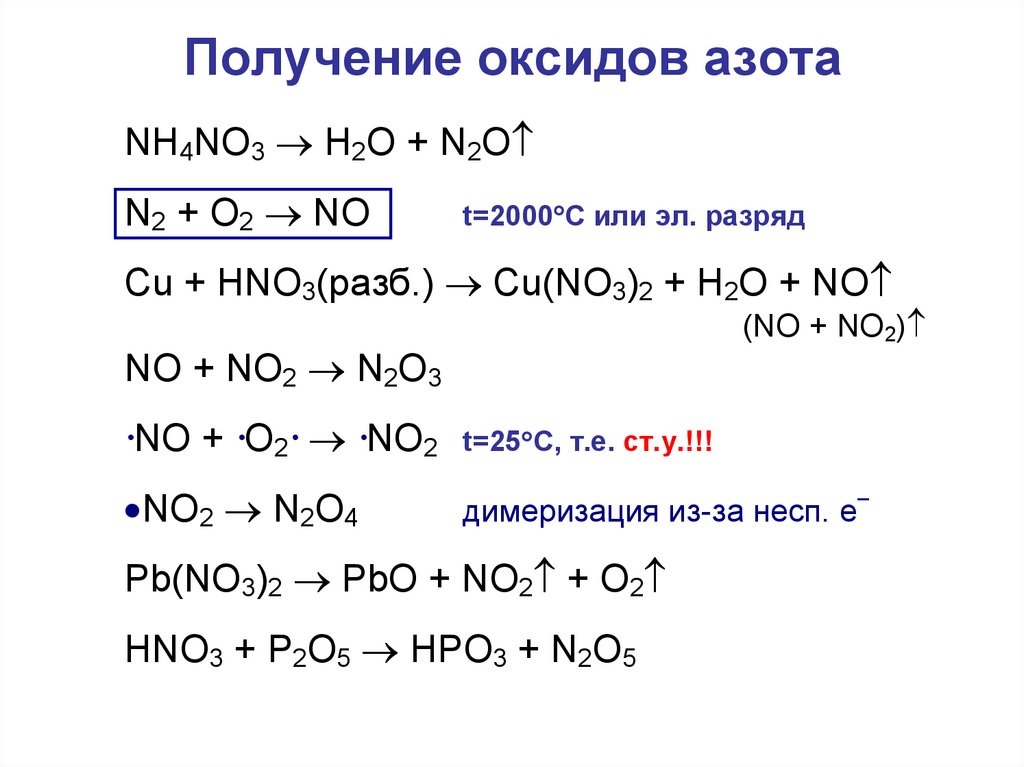
24. Получение оксидов азота
NH4NO3 H2O + N2ON2 + O2 NO
t=2000 C или эл. разряд
Cu + HNO3(разб.) Cu(NO3)2 + H2O + NO
(NO + NO2)
NO + NO2 N2O3
·NO + ·O2· ·NO2
t=25 C, т.е. ст.у.!!!
NO2 N2O4
димеризация из-за несп. е
Pb(NO3)2 PbO + NO2 + O2
HNO3 + P2O5 HPO3 + N2O5
–
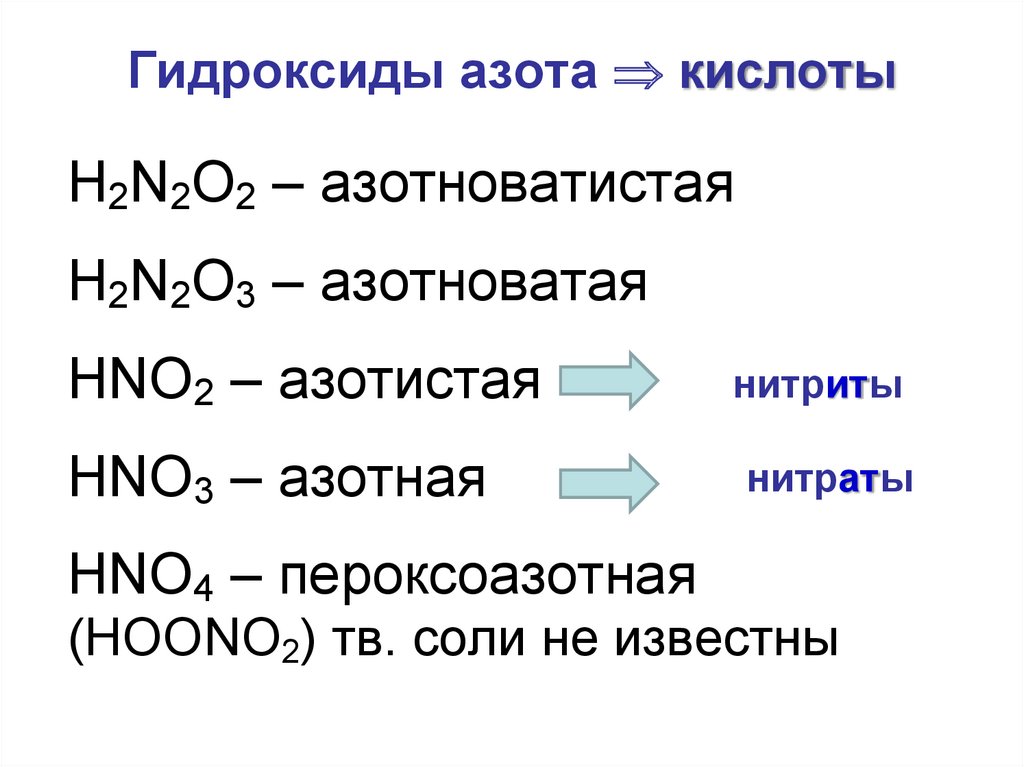
25. Гидроксиды азота кислоты
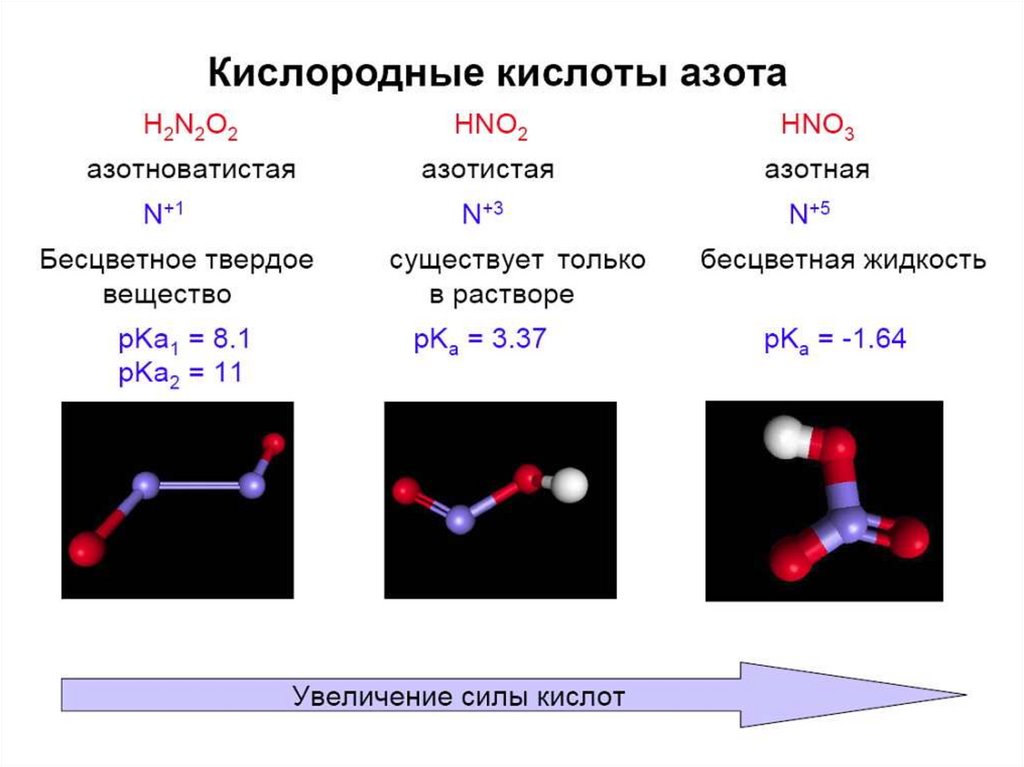
Гидроксиды азота кислотыH2N2O2 – азотноватистая
H2N2O3 – азотноватая
HNO2 – азотистая
HNO3 – азотная
HNO4 – пероксоазотная
нитриты
нитраты
(НОONO2) тв. соли не известны
26.
27.
Особые св-ва азотной кислоты1) Автопротолиз в б/в состоянии
(т.е. самоионизация):
+
–
+
HNO3 + 2 HNO3 NO2 + 2 NO3 + H3O
2) Нитрующая смесь – смесь конц. к-т:
–
+
H2SO4 + HNO3 HSO4 + NO2 + H2O
+
NO2
– катион нитроила, N(+5);
окислитель и нитрующий агент
28.
29.
30.
31.
Реакции HNO3 с простыми веществамиHNO3 + P, C, S, As, B, I2, Se HmЭOn + …
HNO3 + Me Me (NO3)n + X + H2O
+n
Конц./разб.
–3
+
0
+1
+2
+3
+4
X = NH4 , N2, N2O, NO, N2O3, NO2
Продукт восст-я Х зависит от: 1) конц. к-ты; 2) активности Ме.
Общая установка: чем меньше конц-я HNO3 и больше активность
металла (меньше E ), тем глубже восстанавливаются атомы N(+5).
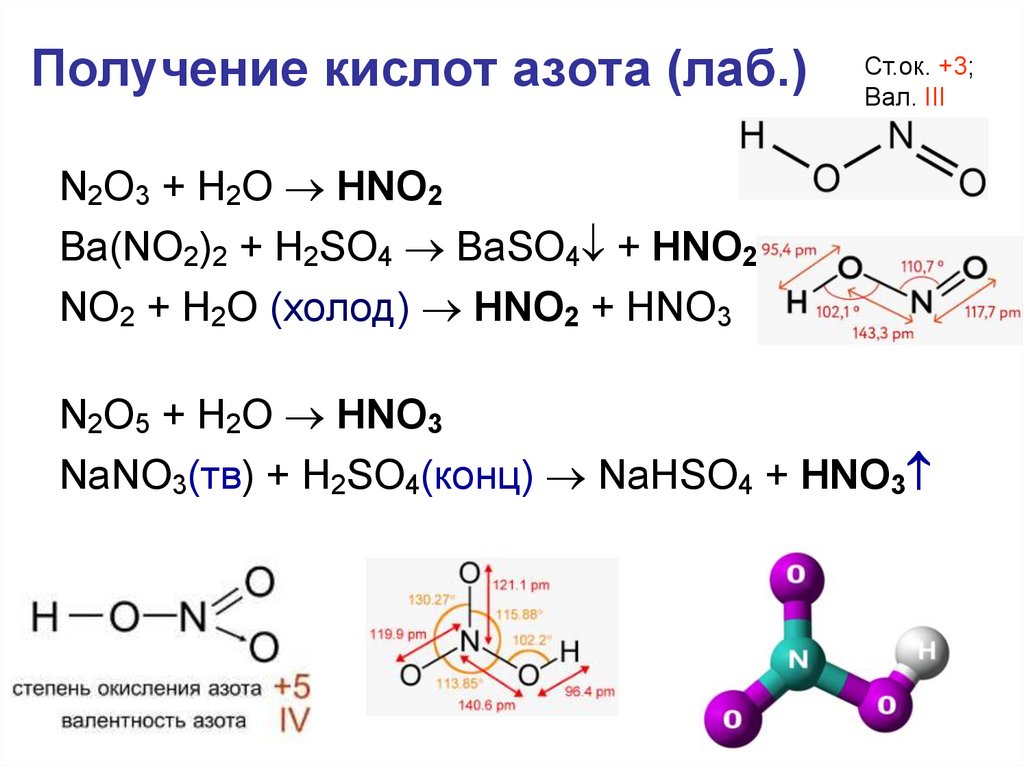
32. Получение кислот азота (лаб.)
Ст.ок. +3;Вал. III
N2O3 + H2O HNO2
Ba(NO2)2 + H2SO4 BaSO4 + HNO2
NO2 + H2O (холод) HNO2 + HNO3
N2O5 + H2O HNO3
NaNO3(тв) + H2SO4(конц) NaHSO4 + HNO3
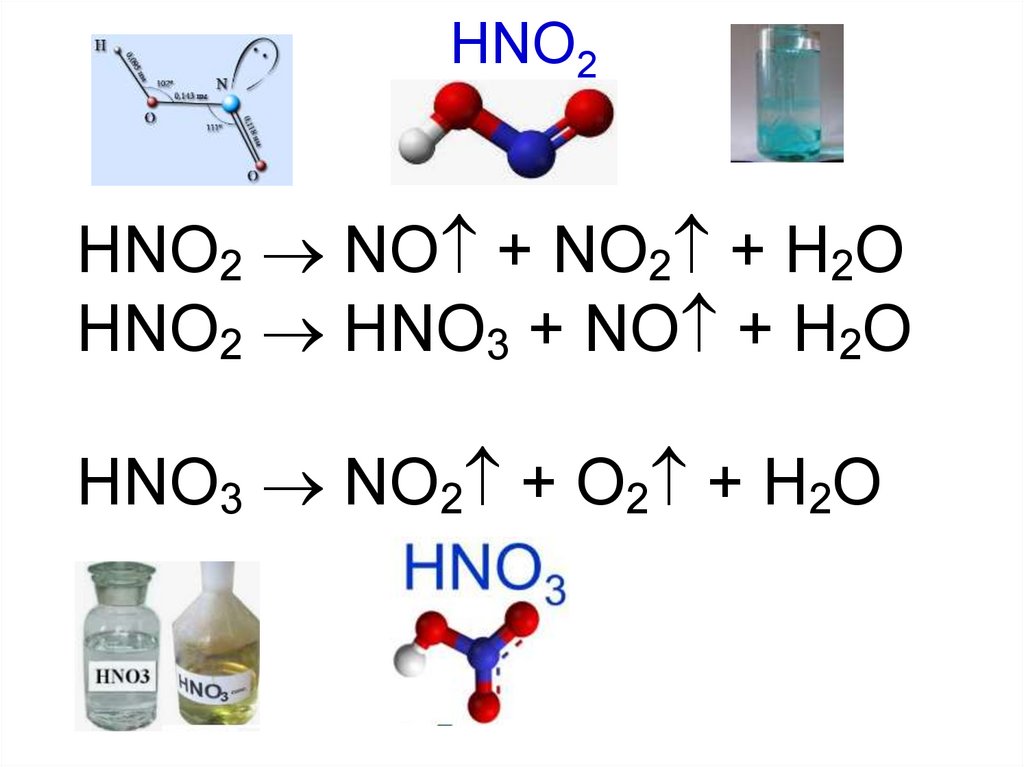
33.
HNO2HNO2 NO + NO2 + H2O
HNO2 HNO3 + NO + H2O
HNO3 NO2 + O2 + H2O
34.
Получение азотной кислоты в пром-тиN2 NH3 NO NO2 HNO3
N2 + H2 NH3
NH3 + O2 NO + H2O
NO + O2 NO2
NO2 + O2 + H2O HNO3
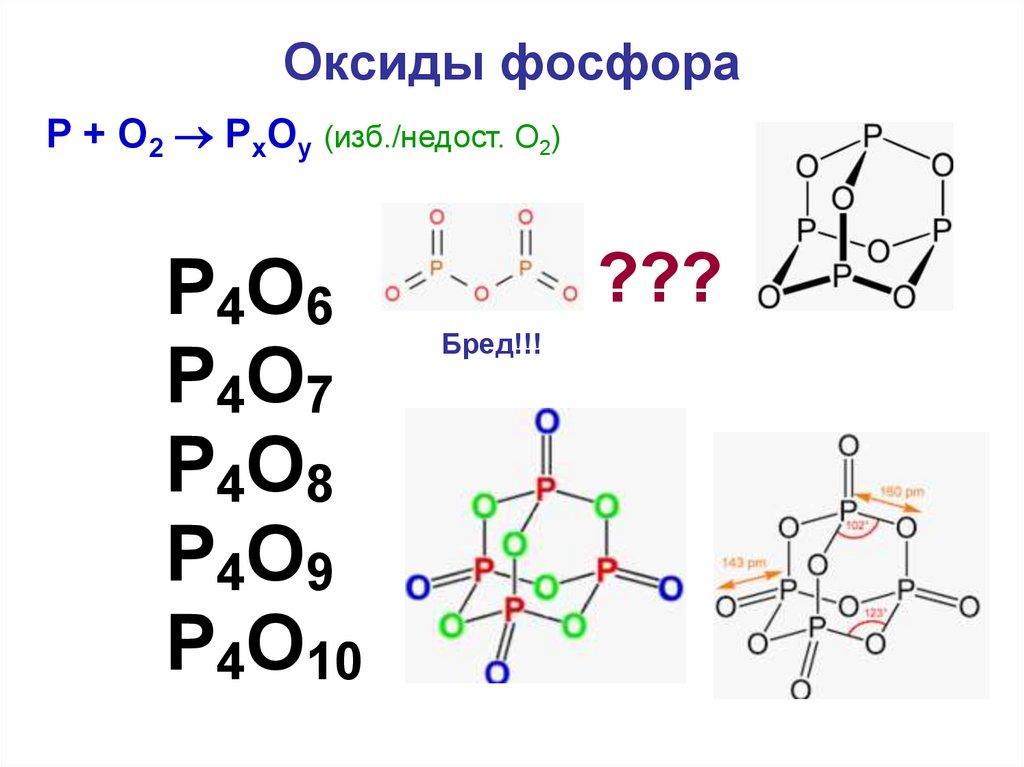
35. Оксиды фосфора
P + O2 PхOу (изб./недост. О2)P4O6
P4O7
P4O8
P4O9
P4O10
???
Бред!!!
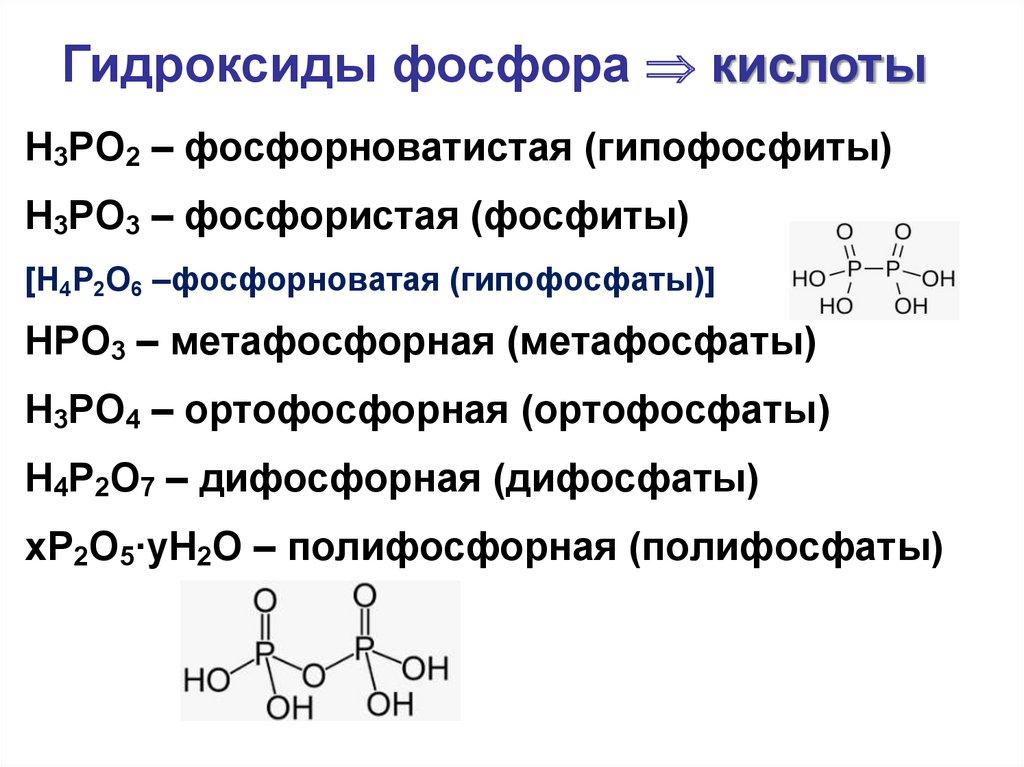
36.
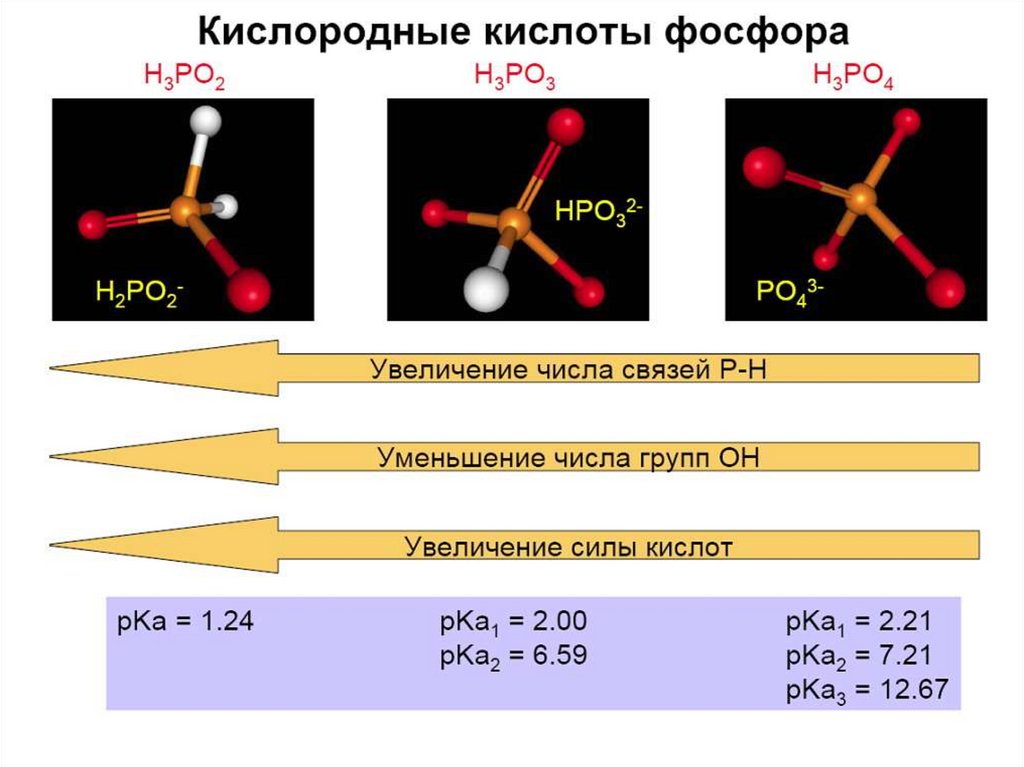
Гидроксиды фосфора кислотыH3PO2 – фосфорноватистая (гипофосфиты)
H3PO3 – фосфористая (фосфиты)
[H4P2O6 –фосфорноватая (гипофосфаты)]
HPO3 – метафосфорная (метафосфаты)
H3PO4 – ортофосфорная (ортофосфаты)
H4P2O7 – дифосфорная (дифосфаты)
xP2O5·yH2O – полифосфорная (полифосфаты)



























 Химия
Химия