Похожие презентации:
Химия элементов VA группы
1. Химия элементов VA группы
2.
Здесь нет металлическогоПростые вещества,
фосфора.
и основные
Есть «желтый»
степени
- смесь
окисления
красного и белого!
Периодическая система элементов Д. И. Менделеева (длинная форма)
Группы
элементов
Химия
азота
богата на количество соединений
8
9
10
11
12
13
14
15
16
17
18
с
различными
степенями
окисления.
N
N≡N
VIIIB
IB
IIB
IIIA
IVA
VA
VIA
VIIA
VIIIA
P4 – белый фосфор (куб./ромб.), пары.
1 (1H)
1H +5.
2He
9 степеней окисления! От – 3 до
2 3Li 4Be
5B
6C
7N
8O
9F 10Ne
Pn – красный фосфор, черный фосфор.
3 11Na 12Mg
13Al 14Si 15P 16S 17Cl 18Ar
-)
Основные:
+5
(нитраты
–
NO
4 19K 20Ca 21Sc 22Ti 23V 24Cr 25Mn 26Fe 27Co 28Ni 29Cu 30Zn 31
Ga 332Ge
33As 34Se 35Br 36Kr
5 37Rb 38Sr 39Y 40Zr 41Nb 42Mo 43Tc 44Ru +4
45Rh(NO
46Pd 2
47)Ag 48Cd 49In 50Sn 51Sb 52Te 53I 54Xe
6 55Cs 56Ba 57La 72Hf 73Ta 74W 75Re 76Os 77Ir 78Pt 79Au 80Hg 81Tl 82-Pb 83Bi 84Po 85At 86Rn
+3 (нитриты – NO )
7 87Fr 88Ra 89Ac 104Db 105Jl 106Rf 107Bh 108Hn 109Mt 110 111 112 … 2…
s1
s2
d1
d2
d3
d4
d5
d6 +2
d7 (NO)
d8
d9
d10
p1
p2
p3
p4
p5
p6
s
d
p
+1 (N2O)
*Лантаноиды
0 (N2)
3
-3 65(NH
Tb 366)Dy 67Ho 68Er 69Tm 70Yb 71Lu
ns2np
58Сe 59Pr
60Nd 61Pm 62Sm 63Eu 64Gd
**
Металлический фосфор
Актиноиды
10
При
8,3·10
Па чёрный
фосфор
переходит
ещё более плотную
Pa азота
Для
нет94Pu
валентности
- ? 98Cf 99вEsновую,
95Am 96Cm 97Bk
100Fm 101Md 192No 103Lr
90Th 91
92U
93Np
и инертную металлическую фазу с плотностью 3,56 г/см³, а при
11 Па — ещё более
дальнейшем
повышении
до 1,25·10
5 не бывает!
Потому давления
что, валентность
это количество
уплотняется
и приобретает
кубическую
кристаллическую решётку, при
обобществленных
заполненных
орбиталей.
этомАего
плотность
возрастает
до 3,83 г/см³.
Металлический
фосфор
у азота
их только
4! Максимальная
валентность
4!
очень хорошо проводит электрический ток.
Пе
ри
од
ы
1
IA
2
IIA
3
4
IIIB 2IVB
*
**
5
VB
6
7
VIB VIIB
3.
Простые вещества, и основные степени окисленияns2np3
+5
H3PO4, PF5
+3
Na2HPO3, PCl3
+1
KH2PO2
0
P4
-3
Ca3P2, PH3
4.
Простые вещества, и основные степени окисленияAsn, Sbn - полимеры.
As – мышьяк, arsenicum
Соли – арсениды, арсениты, арсенаты.
+5
H3AsO4, SbCl5
Sb – сурьма, stibium (лат), antimony (англ)
+3
AsCl3
0
Asn
Соли – стибиды,
стибиты,
стибаты.
-3
ns2np3
Na3Sb, AsH3
Неправильно – антимонаты.
5.
Простые вещества, и основные степени окисленияBi – висмут, bismuthum.
Самый «тяжелый» нерадиоактивый металл.
ns2np3
+5
NaBiO3 (сильный окислитель в кислой среде)
+3
Bi2S3, BiOCl
0
Bi
-3
BiH3
6. Распространение на Земле
NP
As
Sb
Bi
Место
18
13
51
59
60
Где
Содержится
Воздух,
биосфера,
Ca3(PO4)2 фосфорит
Ca5(PO4)3X
(X=F,OH)
– аппатит
As2S3
аурипигментит
FeAsS
арсенопирит
Sb2S3
антимонит
Bi2S3
висмутин
Bi2O3
бисмутит
С античных
времен
XV век
1. Мышь
2. Мужской
Мазь
Белая масса
2,2
1,8
1,7
Биоминералы
(капролиты).
Открыт
1772
Кавендиш
Азот –
ЭО
1669 Бранд С античных
Времен
Безжизненный
(греч) Лаувазье
Свет
несущий
3,1
2,1
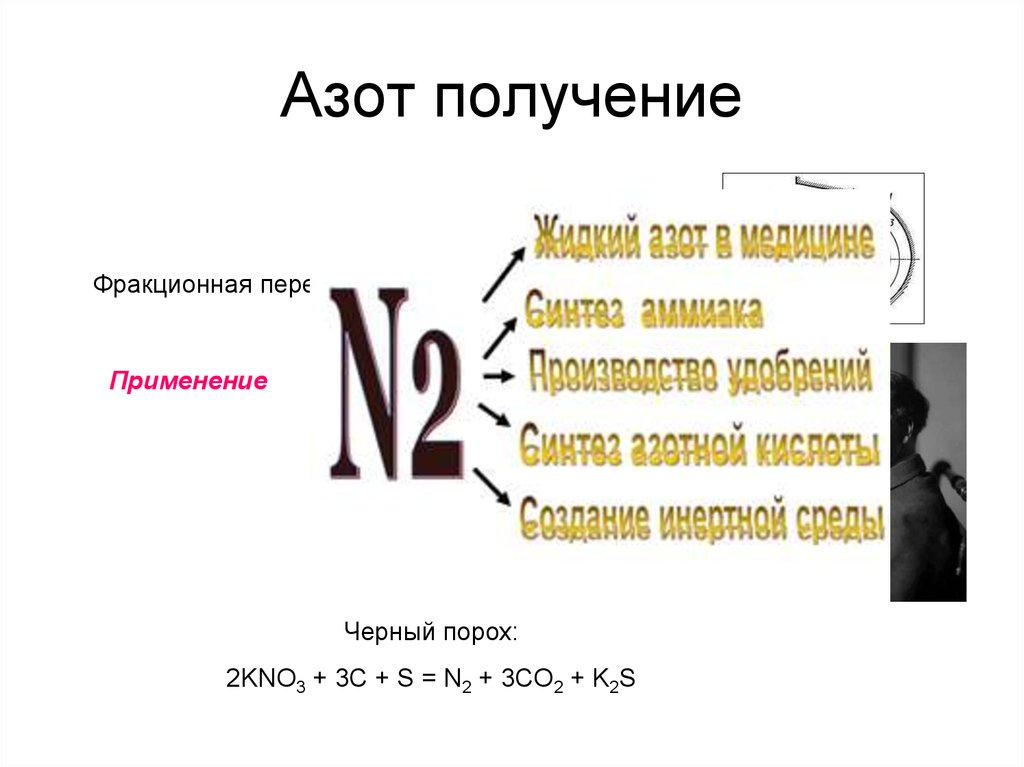
7. Азот получение
ПромышленноеФракционная перегонка жидкого воздуха
Применение
Черный порох:
2KNO3 + 3C + S = N2 + 3CO2 + K2S
8.
Азот получениеЛабораторное
NH4NO2 → N2↑ + 2H2O + Q
K2Cr2O7 + (NH4)2SO4 = (NH4)2Cr2O7 + K2SO4
(NH4)2Cr2O7 →(t) Cr2O3 + N2↑ + 4H2O
2NaN3 →(t) 2Na + 3N2↑
O2+ 4N2 (воздух)+ 2C → 2CO + 4N2
Очистка:
O2+ x N2 (воздух)+ Cu → 2CuO + 4N2
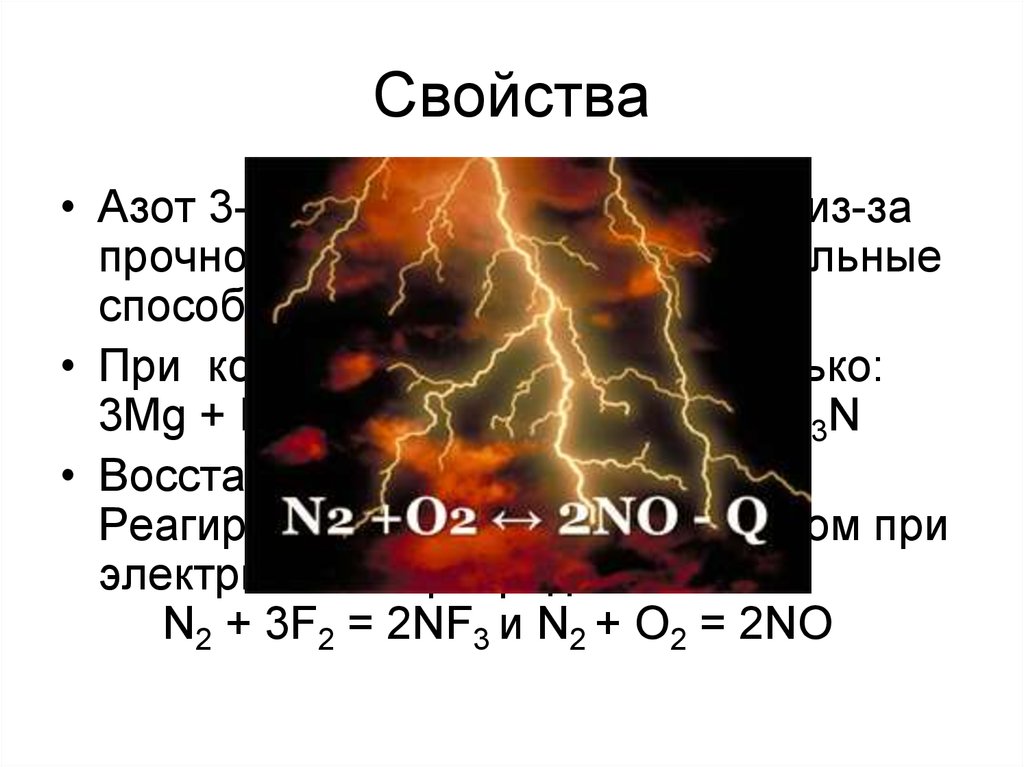
9. Свойства
• Азот 3-ий по ЭО после F и О! Но из-запрочности молекулы N2 окислительные
способности плохо выражены.
• При комнатной температуре только:
3Mg + N2 = Mg3N2 и 6Li + N2 = 2Li3N
• Восстановительные свойства.
Реагирует со фтором и кислородом при
электрическом разряде:
N2 + 3F2 = 2NF3 и N2 + O2 = 2NO
10.
Свойства• Бинарные соединения – нитириды.
• Делятся на ионные и ковалентные.
Примеры:
TiN
(ковалентный, куб. алмазоподоб.)
+H2O
AlN
(ионный, но бывает и вторая
модификация - ковалентный)
+H2O
Al(OH)3 + NH3
11.
Свойства12.
СвойстваПри нагревании:
6Ti + N2 → 2TiN,
Сложный в2B
исполнении,
но дешевый
+ N2 →2BN,
CaC2 + N2 → CaCN2 + C. (используется в пром.)
Связывание азота однаЗН
из2 великих
стоявших перед
+ N2—> проблем
2NН3
человечеством
и решенная
Катализатор
= Pt, Fe им.
Температура около 400° С и давление
300—400 атмосфер
Фриц Габер
Карл Бош
1913 год
13. Аммиак
Аммиа́к — NH3, нитрид водорода, при нормальныхусловиях — бесцветный газ с резким характерным
запахом (запах нашатырного спирта), почти вдвое
легче воздуха.
NH3 + H2O → NH4+ + OH−; Kb=1,8·10−5
NaNH2 + H2O → NaOH + NH3
Катализатор = Pt
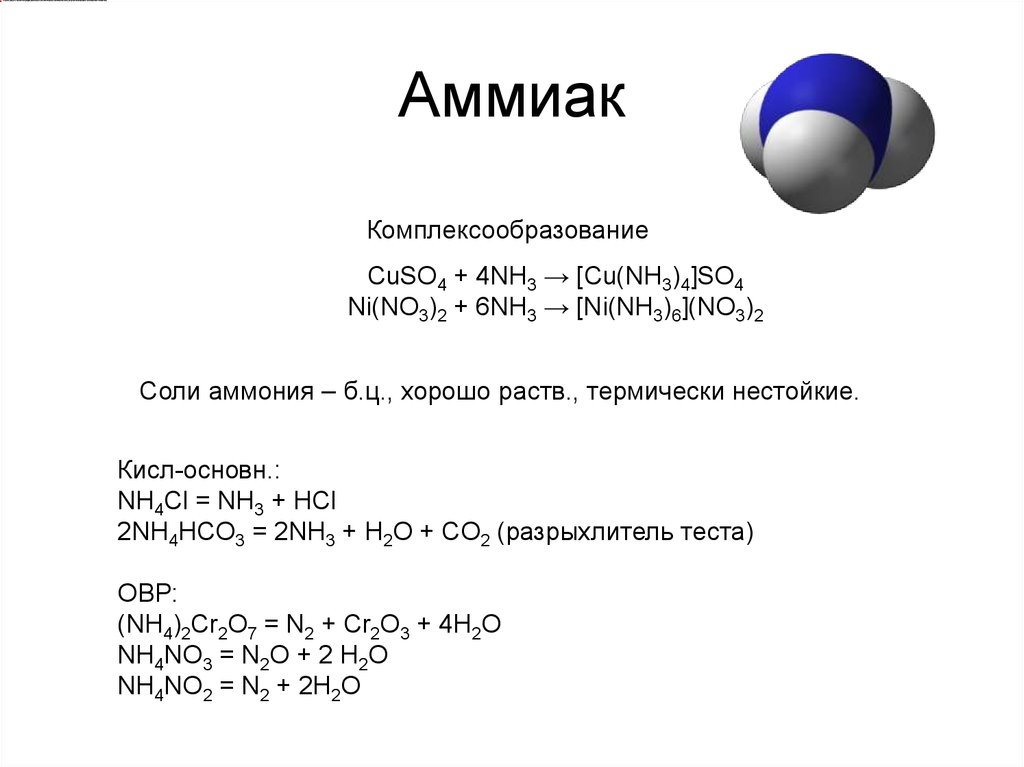
14. Аммиак
КомплексообразованиеCuSO4 + 4NH3 → [Cu(NH3)4]SO4
Ni(NO3)2 + 6NH3 → [Ni(NH3)6](NO3)2
Соли аммония – б.ц., хорошо раств., термически нестойкие.
Кисл-основн.:
NH4Cl = NH3 + HCl
2NH4HCO3 = 2NH3 + H2O + CO2 (разрыхлитель теста)
ОВР:
(NH4)2Cr2O7 = N2 + Cr2O3 + 4H2O
NH4NO3 = N2O + 2 H2O
NH4NO2 = N2 + 2H2O
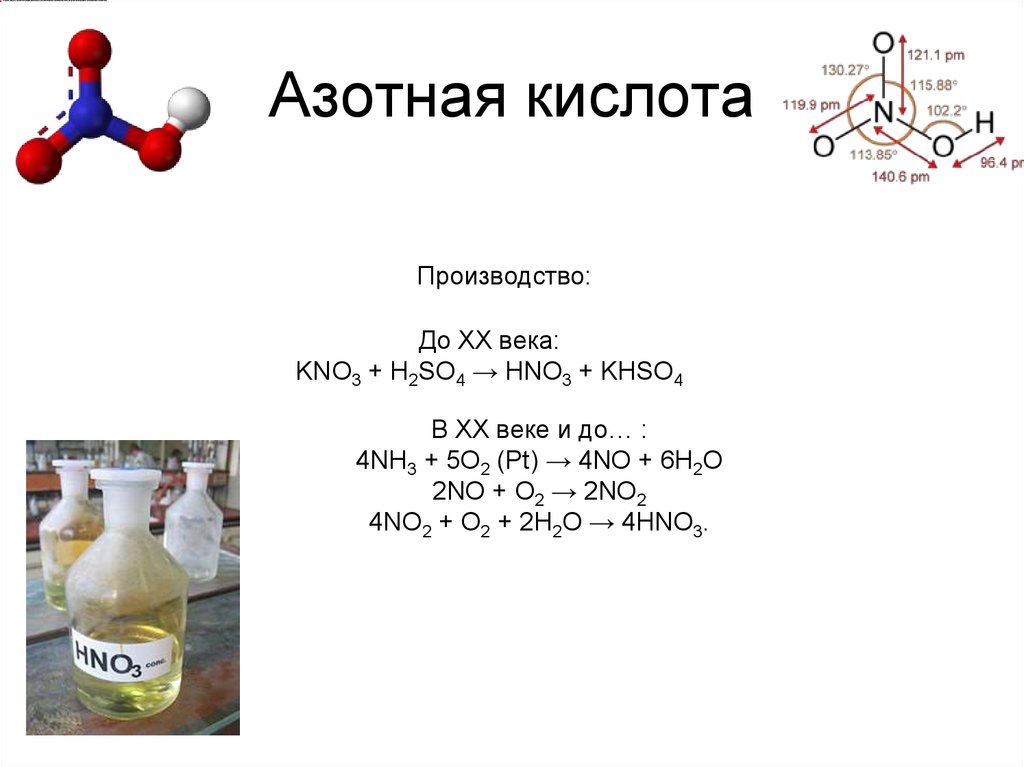
15. Азотная кислота
Производство:До XX века:
KNO3 + H2SO4 → HNO3 + KHSO4
В XX веке и до… :
4NH3 + 5O2 (Pt) → 4NO + 6H2O
2NO + O2 → 2NO2
4NO2 + O2 + 2H2O → 4HNO3.
16. Азотная кислота
• Применение• в производстве минеральных удобрений;
• в производстве красителей и лекарств
(нитроглицерин)
• в военной промышленности (дымящая — в
производстве взрывчатых веществ, как
окислитель ракетного топлива,
разбавленная — в синтезе различных
веществ, в том числе отравляющих);
• в ювелирном деле — основной способ
определения золота в золотом сплаве;
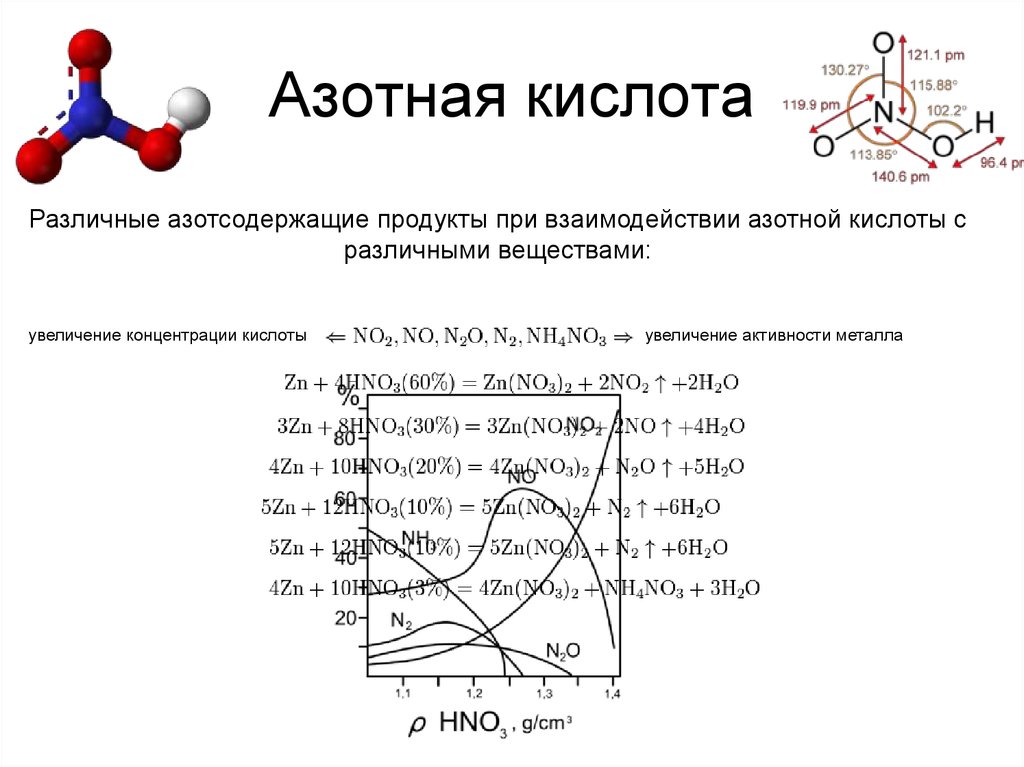
17. Азотная кислота
Различные азотсодержащие продукты при взаимодействии азотной кислоты сразличными веществами:
увеличение концентрации кислоты
увеличение активности металла
18. Азотная кислота
Различные азотсодержащие продукты при взаимодействии азотной кислоты сразличными веществами:
увеличение концентрации кислоты
увеличение активности металла
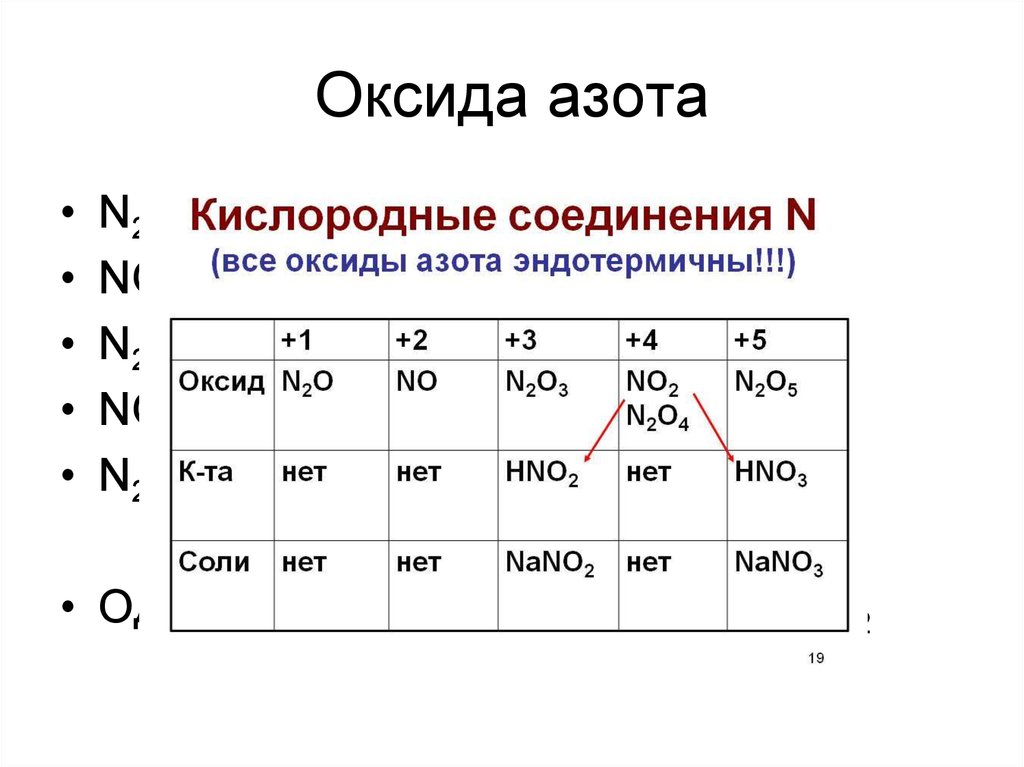
19. Оксида азота
N2O – несолеобразующий
NO – несолеобразующий
N2O3 – кислый
NO2 – несолеобразующий
N2O5 – кислый
• Однако! 2NO2 + H2O = HNO3 + HNO2
20. Хим. свойства P, As, Sb, Bi
• Степень окисления (– 3). PH3, AsH3,SbH3, BiH3.
• 3Mg + 2P → Mg3P2
↓+Н2О
Mg(OH)2 +PH3 (устойчив к темп)
• 2AsH3 = (t) 2As + 3H2
• В отличии от NH3 не проявляет
кисл.-основ. свойств (размеры)
21. Хим. свойства P, As, Sb, Bi
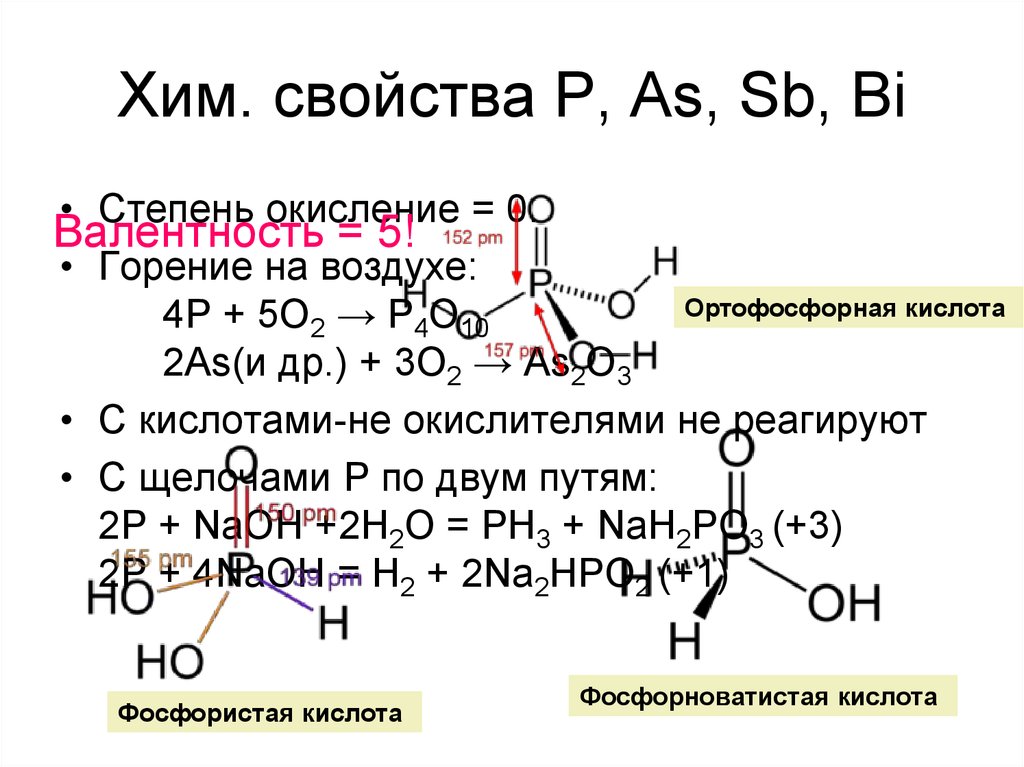
• Степень окисление = 0.Валентность = 5!
• Горение на воздухе:
Ортофосфорная кислота
4P + 5O2 → P4O10
2As(и др.) + 3O2 → As2O3
• С кислотами-не окислителями не реагируют
• С щелочами P по двум путям:
2P + NaOH +2H2O = PH3 + NaH2PO3 (+3)
2P + 4NaOH = H2 + 2Na2HPO2 (+1)
Фосфористая кислота
Фосфорноватистая кислота
22. Получение
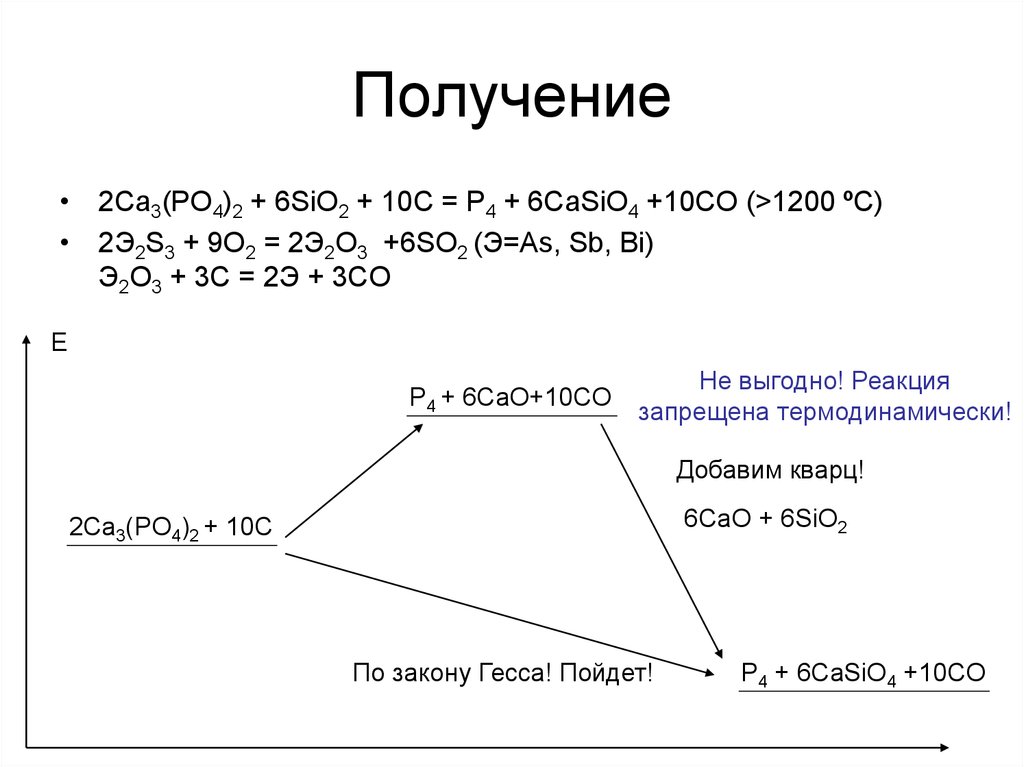
• 2Ca3(PO4)2 + 6SiO2 + 10C = P4 + 6CaSiO4 +10CO (>1200 ºC)• 2Э2S3 + 9O2 = 2Э2O3 +6SO2 (Э=As, Sb, Bi)
Э2O3 + 3C = 2Э + 3CO
Е
P4 + 6CaO+10CO
Не выгодно! Реакция
запрещена термодинамически!
Добавим кварц!
6CaO + 6SiO2
2Ca3(PO4)2 + 10C
По закону Гесса! Пойдет!
P4 + 6CaSiO4 +10CO
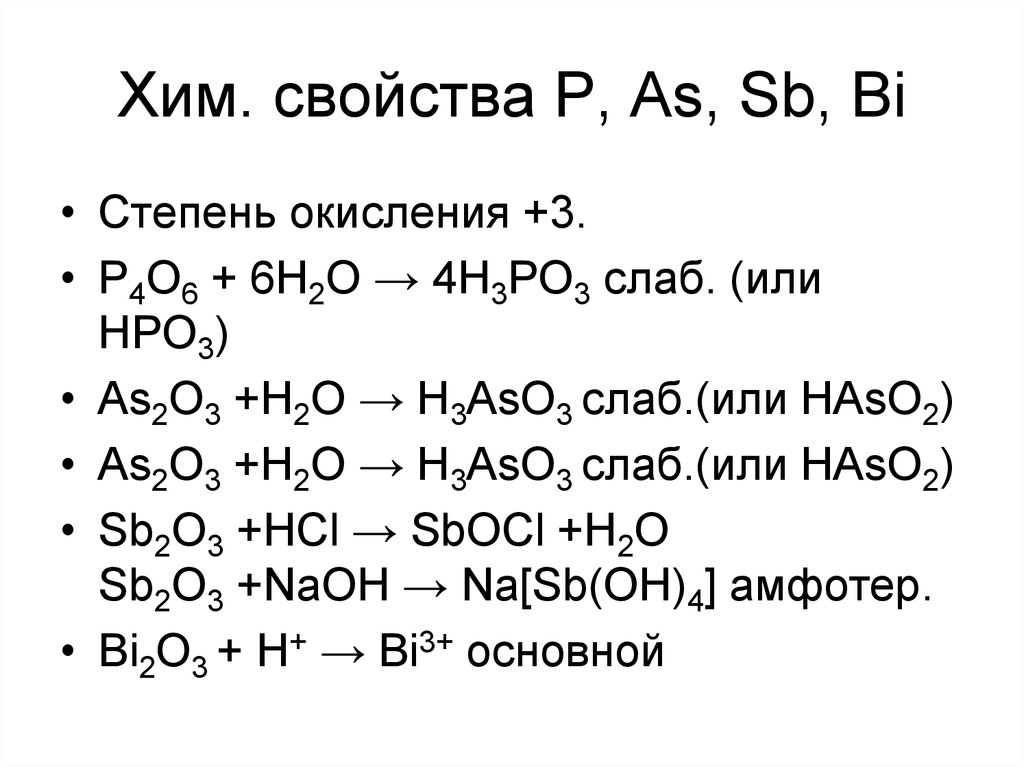
23. Хим. свойства P, As, Sb, Bi
• Степень окисления +3.• P4O6 + 6H2O → 4H3PO3 слаб. (или
HPO3)
• As2O3 +H2O → H3AsO3 слаб.(или HAsO2)
• As2O3 +H2O → H3AsO3 слаб.(или HAsO2)
• Sb2O3 +HCl → SbOCl +H2O
Sb2O3 +NaOH → Na[Sb(OH)4] амфотер.
• Bi2O3 + H+ → Bi3+ основной
24. Хим. свойства P, As, Sb, Bi
Степень окисления +5
P4O10 + 6H2O → 4H3PO4 (или HPO3)
As2O5 + H2O → H3AsO3 (или HAsO2)
Sb2O5 +HF → [SbF6]- +H2O
Sb2O5 +NaOH → Na[Sb(OH)6]
Sb2O5 +HCl → SbOCl +Cl2 +H2O (амфотерный,
окислитель)
• Bi2O5 + NaOH → NaBiO3 (сплавлен), (Сильный
окислитель, основной)
• Висмутат окисляет Mn2+ до MnO4-:
5NaBiO3 + 2Mn2+ + 14H+ → 5Bi3+ + 2MnO4- + 7H2O
25. Хим. свойства P, As, Sb, Bi
• Bi2O3 + 2Cl2 + 4KOH = Bi2O5 + 4KCl +2H2O (100 C)• Sb2O3 + O2 (давл) = Sb2O5
Соединения с серой и тиосоли:
As2S3 + Na2S → NaAsS2 (Sb) кислый
As2S5 + 3Na2S → 2Na3AsS4 (Sb) кислый
Bi2S3 +Na2S → X
Bi2S5 – не существует.















 Химия
Химия