Похожие презентации:
Обмен азота
1.
Обмен азота2.
Переваривание белков и всасываниеаминокислот в ЖКТ
Белки пищи поэтапно гидролизуются до свободных АК под действием
ферментов пищеварительных соков, относящихся к классу гидролаз,
п/кл пептидаз:
а) Желудок (желудочный сок):
белки --HCl, пепсин пептоны
б) Полость тонкого кишечника (панкреатический сок):
пептоны --трипсин, химотрипсин, эластаза олигопептиды + АК
карбоксипептидазы А и B
в) пристеночно на энтероцитах (кишечный сок):
олигопептиды –аминопептидазы, ди- и трипептидазы АК
3.
2) Пептидазы обладают относительной субстратнойспецифичностью,
3) В зависимости от положения пептидной связи, которую
ферменты расщепляют они делятся на: эндопептидазы (пепсин,
трипсин, химотрипсин, эластаза,) и экзопептидазы
(карбоксипептидазы А и В, аминопептидазы);
3) Пепсин и панкреатические ферменты вырабатываются в
неактивной форме (защита тканей). Механизм их активации частичный протеолиз: отщепляется концевой олигопептид,
измененяется конформация, формируется активный центр.
4) Кишечные ферменты синтезируются в энтероцитах сразу в
активной форме.
4.
5) От пептидаз СОЖ и кишечника защищают муцины, образующиегидратированный слой слизи, а снаружи клеток СО гетерополисахариды, которые не расщепляются пептидазами.
6) АК всасываются в тонком кишечнике (как и в клетках др. тканей)
вторично-активным транспортом
7) Часть АК – в лимфу, а остальные в кровь.
8) Из крови АК захватываются клетками, где поддерживается пул LАК
5.
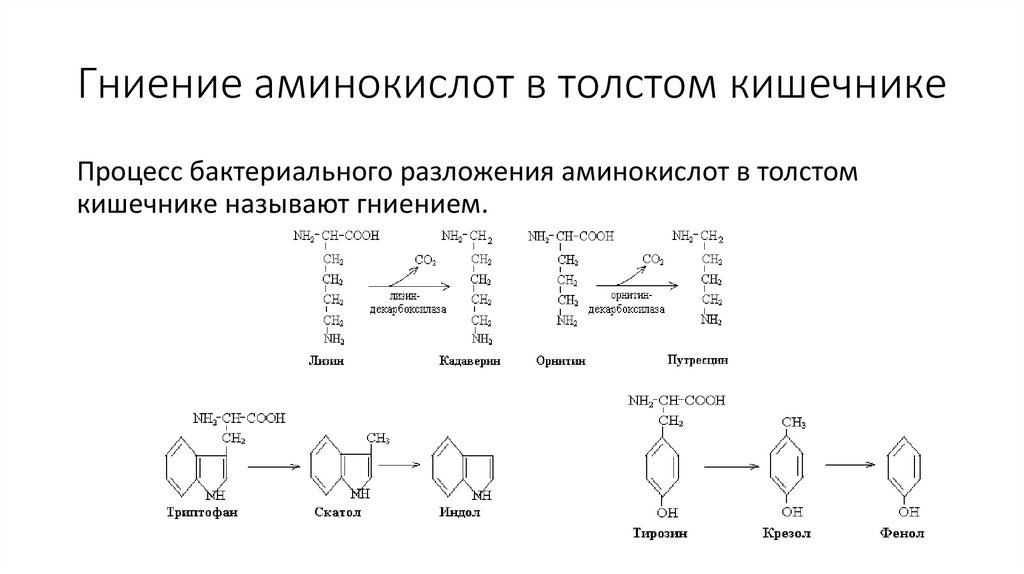
Гниение аминокислот в толстом кишечникеПроцесс бактериального разложения аминокислот в толстом
кишечнике называют гниением.
6.
Продукты гниения обладают токсичными свойствами.Обезвреживание большинства этих токсичных соединений
происходит в печени. В основе обезвреживания лежит реакция
конъюгации, то есть присоединения гидрофильной группы. В
результате конъюгации повышается растворимость продуктов
гниения и они легко выводятся с мочой.
7.
Проба Квика-ПытеляПробу Квика-Пытеля проводят для оценки функционального
состояния печени. Больному натощак дают выпить 1 г. бензойной
кислоты и затем измеряют количество выделенной с мочой
гиппуровой кислоты. В норме количество гиппуровой кислоты не
должно быть ниже 0,7 г.
8.
Аминокислоты: метаболизм и путииспользования
ИСТОЧНИКИ ПОСТУПЛЕНИЯ АК:
1) белки пищи; 2) белки тканей 3) синтез заменимых АК
ПУТИ ИСПОЛЬЗОВАНИЯ АК:
1) синтез белков тканей, ферментов, гормонов, антител и др.;
2) синтез пептидов ( Гл-SH, ансерин, карнозин, и др.);
3) синтез небелковых азотсодержащих в-в (гем, пурины, пиримидины, ниацин, НАД+, креатин,
холин, меланины и др.);
4) образование биогенных аминов (ГАМК, гистамин и др.);
5) гормонов - производных АК ( Т3, Т4, катехоламинов, мелатонина);
6) синтез других АК;
7) получение энергии (через дезаминирование АК АТФ);
8) синтез глюкозы (глюконеогенгез), липидов, кетоновых тел;
9) реакции детоксикации ( используются Глу, Асп, Глн, Гли, Мет).
9.
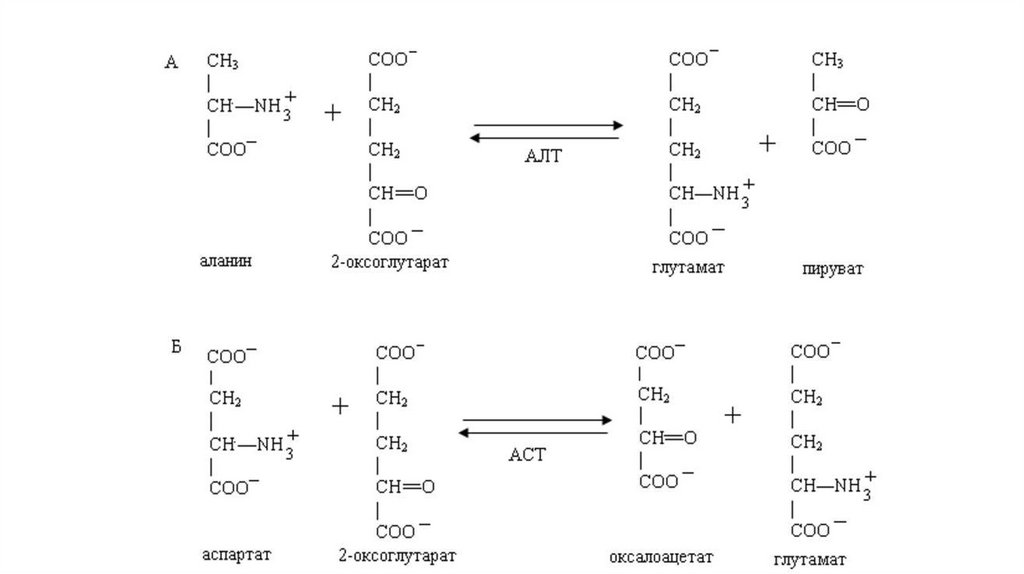
ТрансаминированиеУниверсальными реакциями для всех живых организмов являются реакции трансаминирования. В
этих реакциях осуществляется межмолекулярный перенос аминогруппы от аминокислоты на αкетокислоту без промежуточного освобождения свободного аммиака.
Они протекают при участии специфических цитозольных и митохондриальных ферментов,
называемых аминотрансферазами либо трансаминазами.
В реакциях трансаминирования участвуют почти все аминокислоты, исключение составляют лизин,
треонин и пролин.
Основными α-кетокислотами, принимающими участие в трансаминировании, являются пируват,
оксалоацетат и 2-оксоглутарат.
В активном центре трансаминаз коферментом является пиридоксаль-5-фосфат (производное
витамина В6).
Наиболее
активны
две
трансаминазы
аспартатаминотрансфераза (АСТ).
–
аланинаминотрансфераза
(АЛТ)
и
10.
11.
Биологическая роль трансаминирования1) Образование заменимых АК из α-кетокислот
(Глу - универсальный донор α-аминогрупп).
2) Является реакцией 1-го этапа непрямого окислительного
дезаминирования
12.
Прямое дезаминирование аминокислотПрямым называют дезаминирование, в котором отщепление аммиака происходит в одну
реакцию. Прямое дезаминирование бывает окислительное и неокислительное.
В прямое окислительное дезаминирование вступают аминокислоты глутамат и глицин.
Окислительное дезаминирование начинается с дегидрирования субстрата с образованием
иминокислоты, которая в присутствии воды распадается на аммиак и α-кетокислоту.
13.
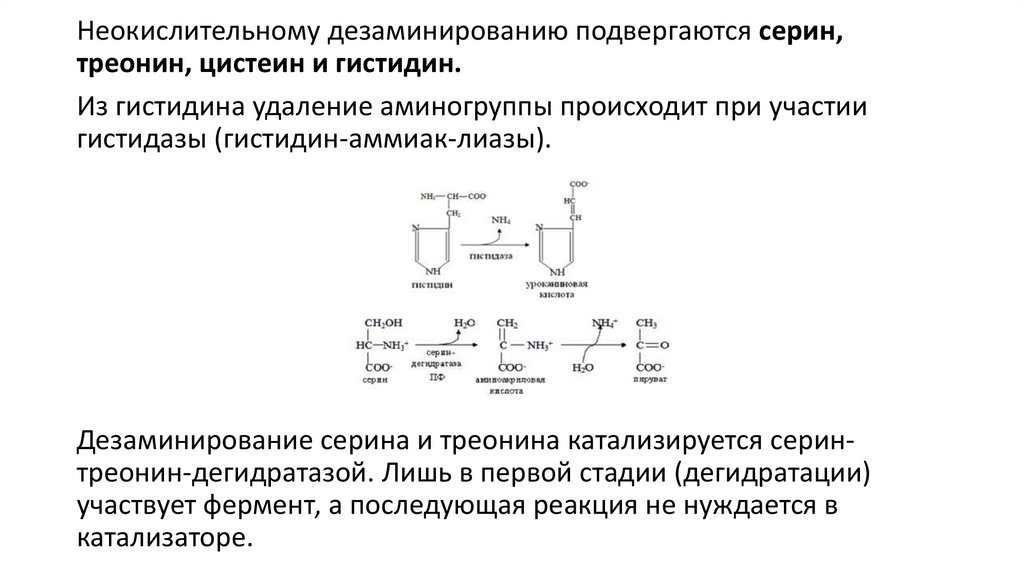
Неокислительному дезаминированию подвергаются серин,треонин, цистеин и гистидин.
Из гистидина удаление аминогруппы происходит при участии
гистидазы (гистидин-аммиак-лиазы).
Дезаминирование серина и треонина катализируется серинтреонин-дегидратазой. Лишь в первой стадии (дегидратации)
участвует фермент, а последующая реакция не нуждается в
катализаторе.
14.
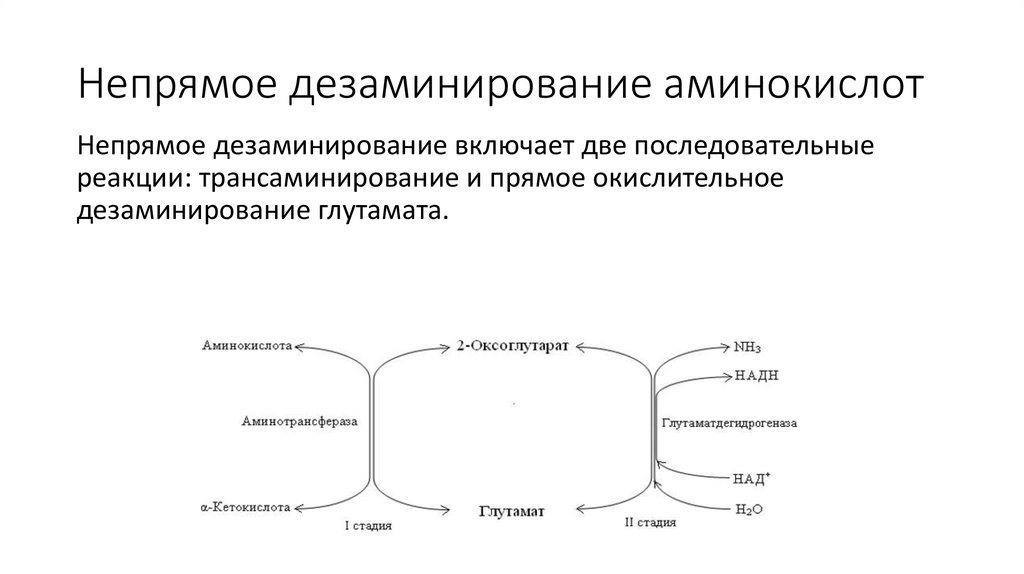
Непрямое дезаминирование аминокислотНепрямое дезаминирование включает две последовательные
реакции: трансаминирование и прямое окислительное
дезаминирование глутамата.
15.
При длительном голодании активируется распад белков.Увеличивается количество свободных аминокислот, которые
подвергаются дезаминированию в печени. Освободившиеся αкетокислоты могут использоваться как для получения энергии, так
и в реакциях глюконеогенеза.
16.
Метаболизм аммиакаОсновными источниками аммиака в организме человека являются
процессы дезаминирования аминокислот и биогенных аминов, а
также катаболизм азотистых оснований.
Избыточное накопление аммиака в организме приводит к ряду
метаболических нарушений. В результате взаимодействия аммиака
с водой происходит сдвиг рН внутренней среды в щелочную
сторону, т.е. развивается алкалоз.
17.
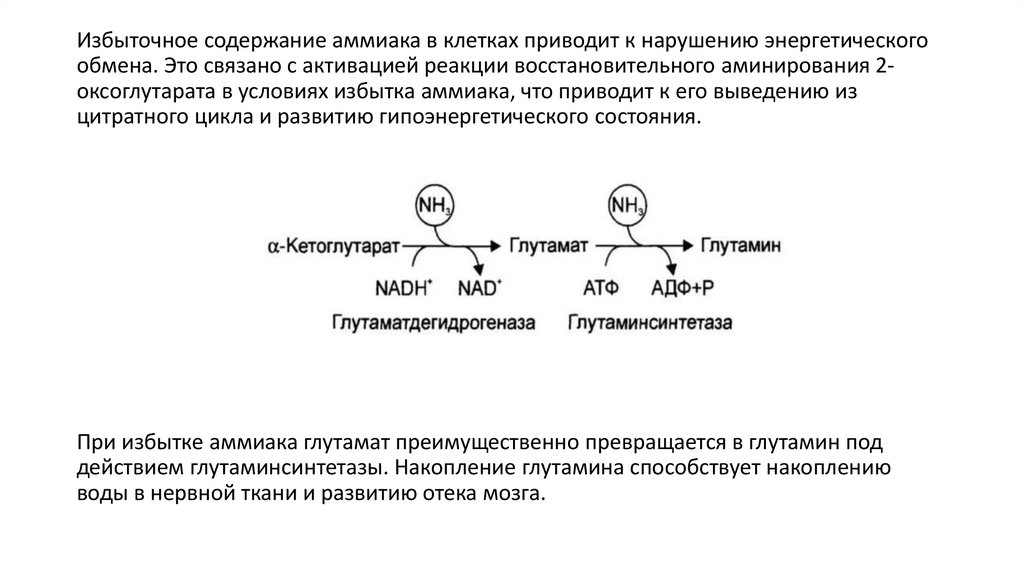
Избыточное содержание аммиака в клетках приводит к нарушению энергетическогообмена. Это связано с активацией реакции восстановительного аминирования 2оксоглутарата в условиях избытка аммиака, что приводит к его выведению из
цитратного цикла и развитию гипоэнергетического состояния.
При избытке аммиака глутамат преимущественно превращается в глутамин под
действием глутаминсинтетазы. Накопление глутамина способствует накоплению
воды в нервной ткани и развитию отека мозга.
18.
Снижение активности ферментов, участвующих в синтеземочевины в печени, сопровождается накоплением аммиака в
тканях и плазме крови – гипераммониемией.
Это может происходить при гепатите, циррозе печени и
наследственных дефектах ферментов орнитинового цикла.
Клинически это проявляется нарушениями функций нервной
системы в виде приступов рвоты, дискоординации движения,
раздражительности, сонливости.
19.
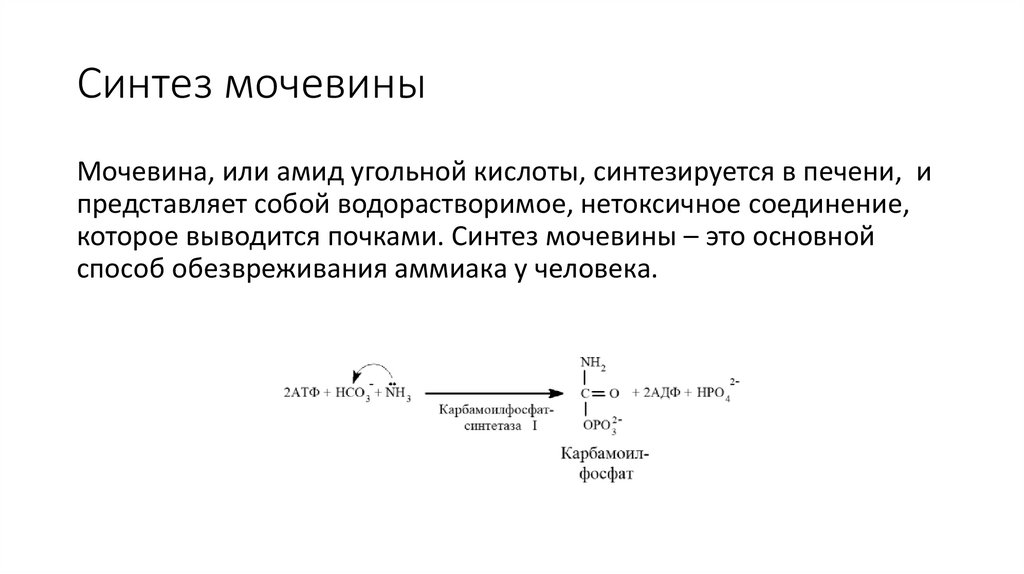
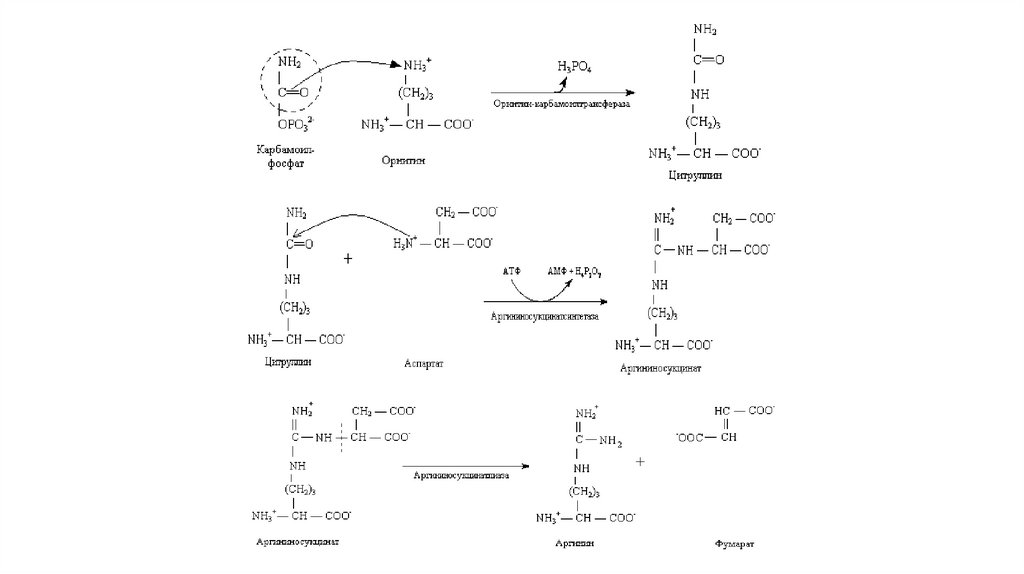
Синтез мочевиныМочевина, или амид угольной кислоты, синтезируется в печени, и
представляет собой водорастворимое, нетоксичное соединение,
которое выводится почками. Синтез мочевины – это основной
способ обезвреживания аммиака у человека.
20.
21.
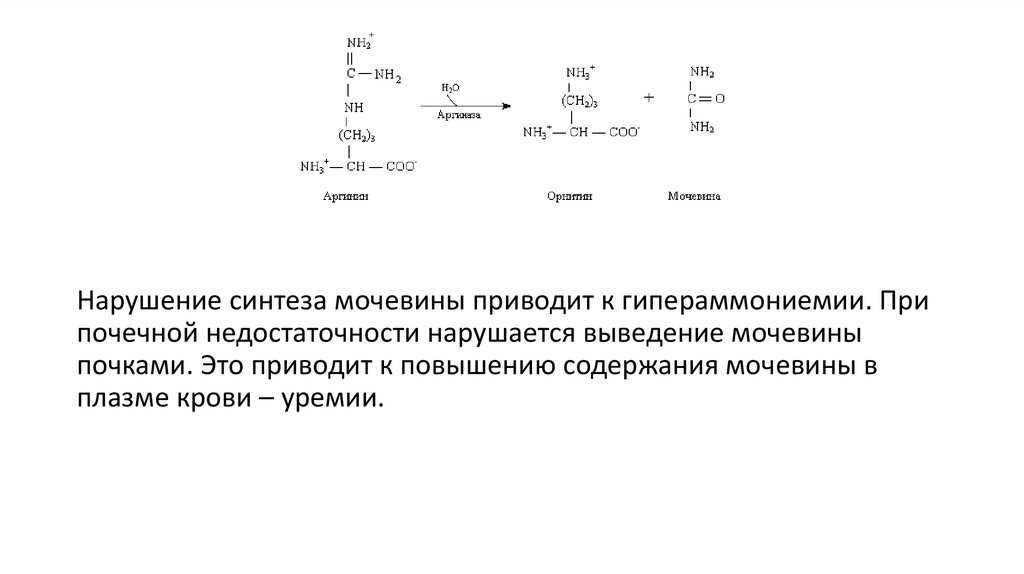
Нарушение синтеза мочевины приводит к гипераммониемии. Припочечной недостаточности нарушается выведение мочевины
почками. Это приводит к повышению содержания мочевины в
плазме крови – уремии.
22.
Гликогенные и кетогенные аминокислотыПротеиногенные аминокислоты в зависимости от метаболизма их
безазотистых остатков подразделяются на гликогенные и
кетогенные. Гликогенные аминокислоты способны превращаться в
глюкозу. Большинство аминокислот относятся к гликогенным, они
способны превращаться в промежуточные продукты цикла Кребса
или пируват, и через оксалоацетат вступать в глюконеогеназ.
Аминокислоты, способные превращаться в кетоновые тела,
относятся к кетогенным. Исключительно кетогенными являютя
аминокислоты лизин и лейцин, их безазотистые остатки
превращаются в ацетоацетат и ацетилКоА. Аминокислоты
фенилаланин, тирозин, изолейцин, триптофан относятся к
гликокетогенным.
23.
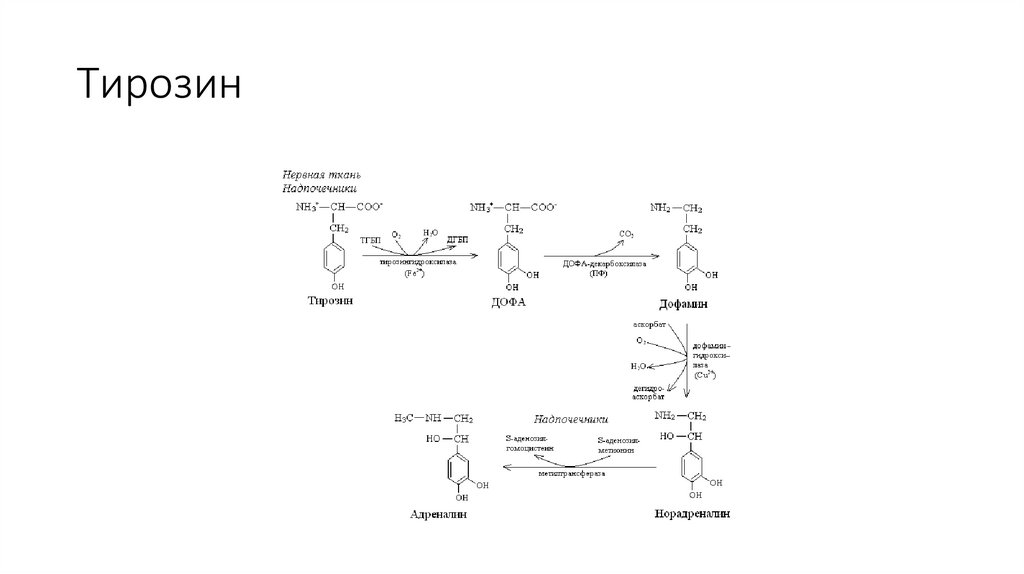
Тирозин24.
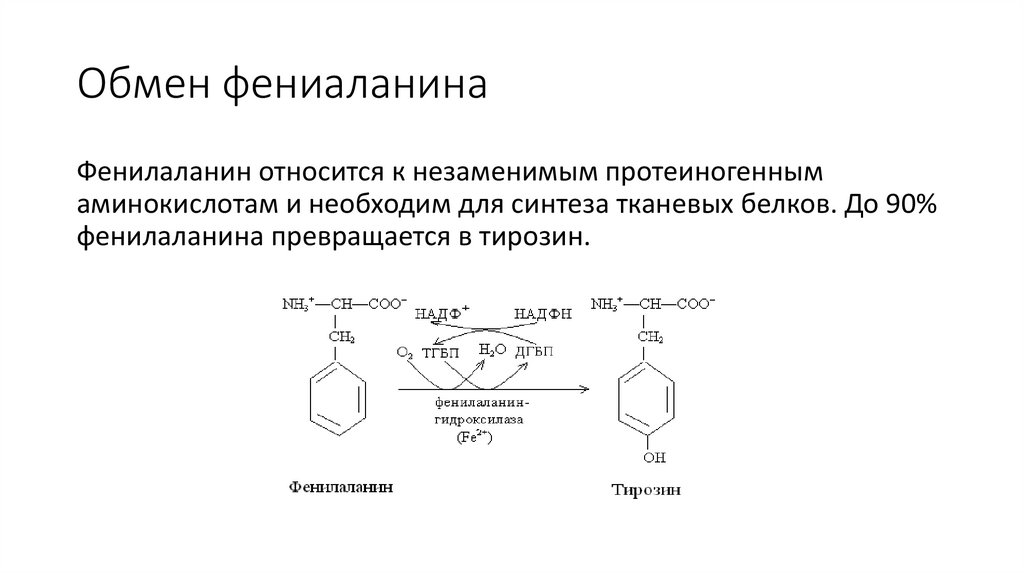
Обмен фениаланинаФенилаланин относится к незаменимым протеиногенным
аминокислотам и необходим для синтеза тканевых белков. До 90%
фенилаланина превращается в тирозин.
25.
АльбинизмВ пигментных клетках (меланоцитах) кожи, волос, радужки глаза
тирозин превращается в тёмные пигменты (меланины). Благодаря
меланинам осуществляется защита клетки от воздействия
ультрафиолетовых лучей. Дефект гена тирозиназы и других
ферментов синтеза меланинов проявляется в виде отсутствия
пигментов в коже, волосах, радужной оболочке глаза. Данная
патология получила название альбинизм.
26.
Тирозин в нервной ткани и мозговом слое надпочечников являетсяпредшественником катехоламинов – дофамина, норадреналина и
адреналина.
У пожилых людей при снижении активности тирозингидроксилазы
или ДОФА-декарбоксилазы уменьшается количество дофамина в
чёрной субстанции мозга, что приводит к развитию болезни
Паркинсона.
27.
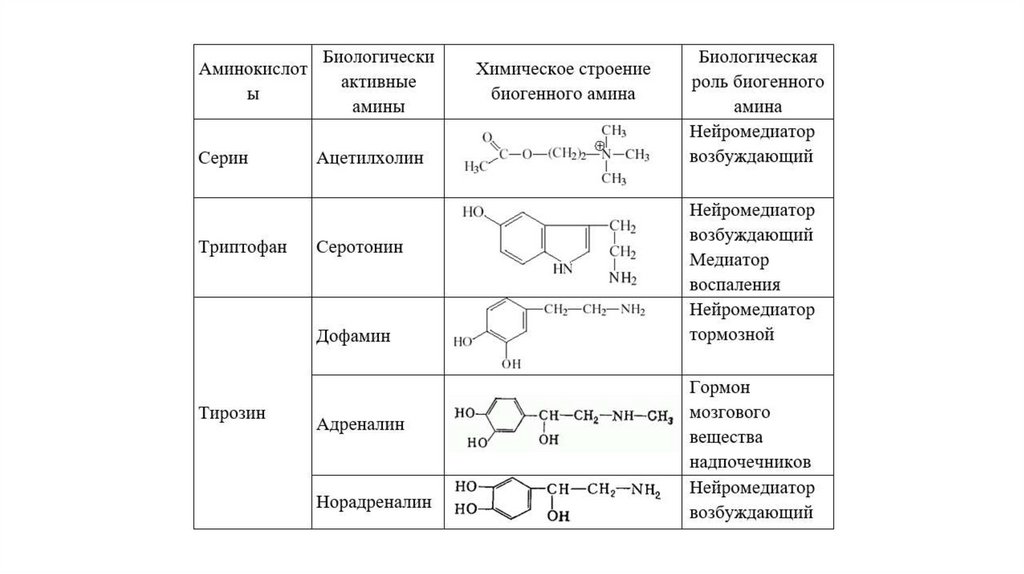
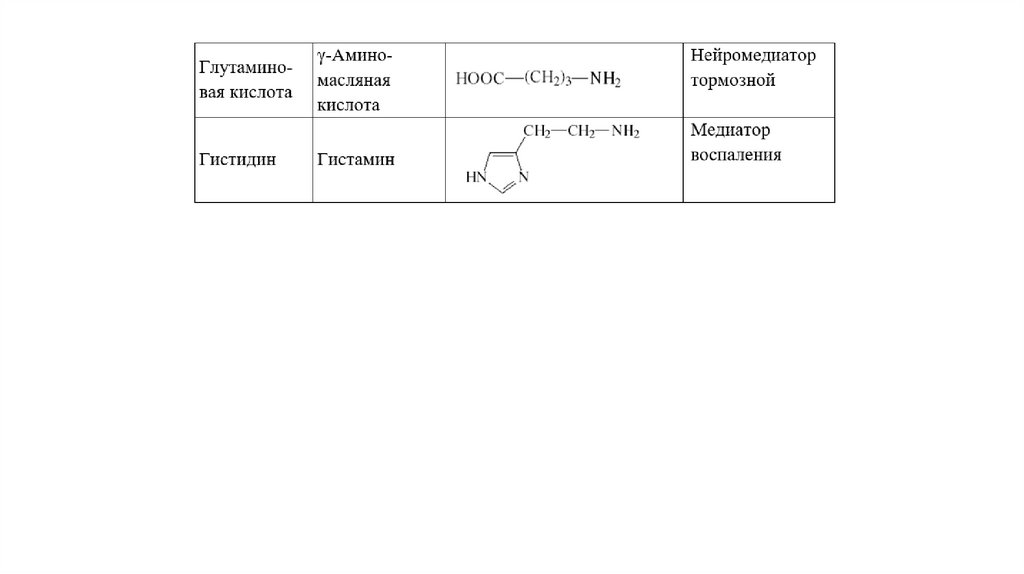
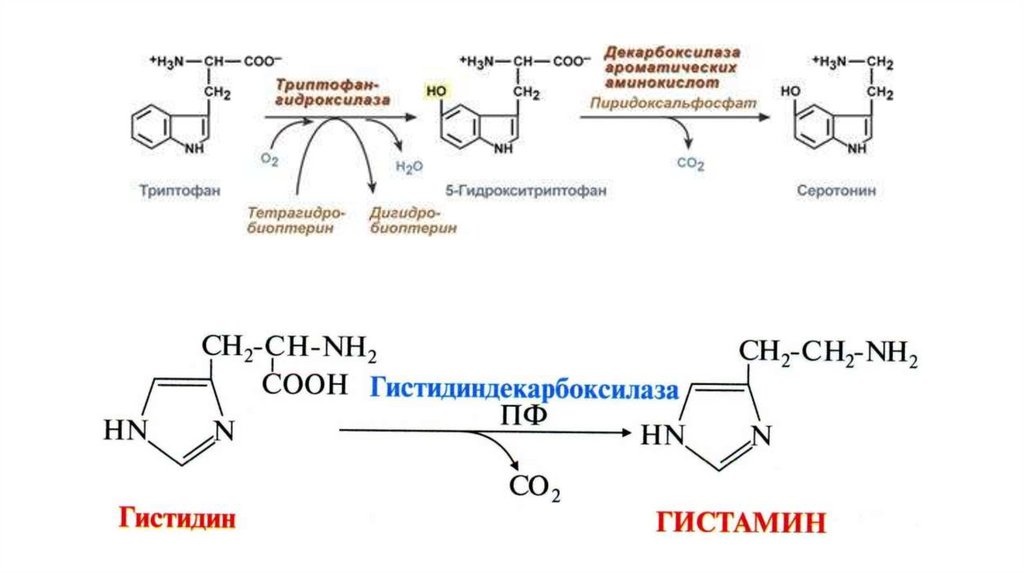
Декарбоксилирование аминокислотОдним из важных путей превращения аминокислот является отщепление карбоксильной
группы – декарбоксилирование. Эти реакции необратимы и катализируются
декарбоксилазами. Функцию кофермента декарбоксилаз выполняет пиридоксальфосфат.
Образовавшиеся в реакции декарбоксилирования амины оказывают, как правило, сильное
фармакологическое действие на физиологические функции организма и поэтому они
получили название биогенных аминов.
28.
29.
30.
31.
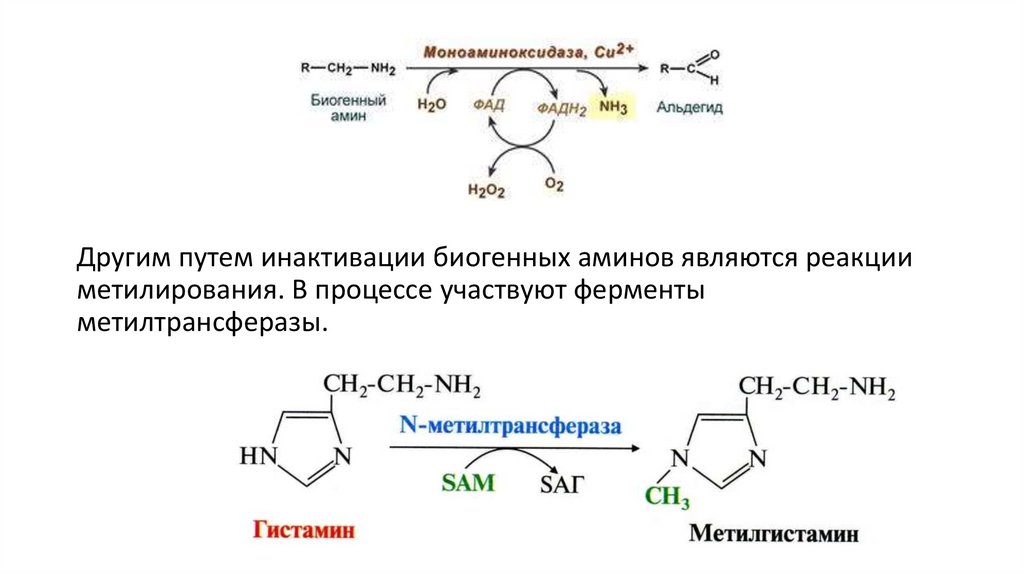
Инактивация биогенных аминовОдним из механизмов инактивации биогенных аминов является их
окислительное дезаминирование с образованием альдегида и
молекулы аммиака. Эти реакции катализируют моно- (МАО) и
диаминооксидазы (ДАО), которые присутствуют во всех органах и
тканях живых организмов. Моноаминооксидазы инактивируют
первичные, вторичные и третичные амины, а
диаминомонооксидазы – путресцин, кадаверин, гистамин и
алифатические амины. Коферментом МАО является ФАД
(кофермент витамина В2), а ДАО – пиридоксальфосфат (кофермент
витамина В6).
32.
Другим путем инактивации биогенных аминов являются реакцииметилирования. В процессе участвуют ферменты
метилтрансферазы.
33.
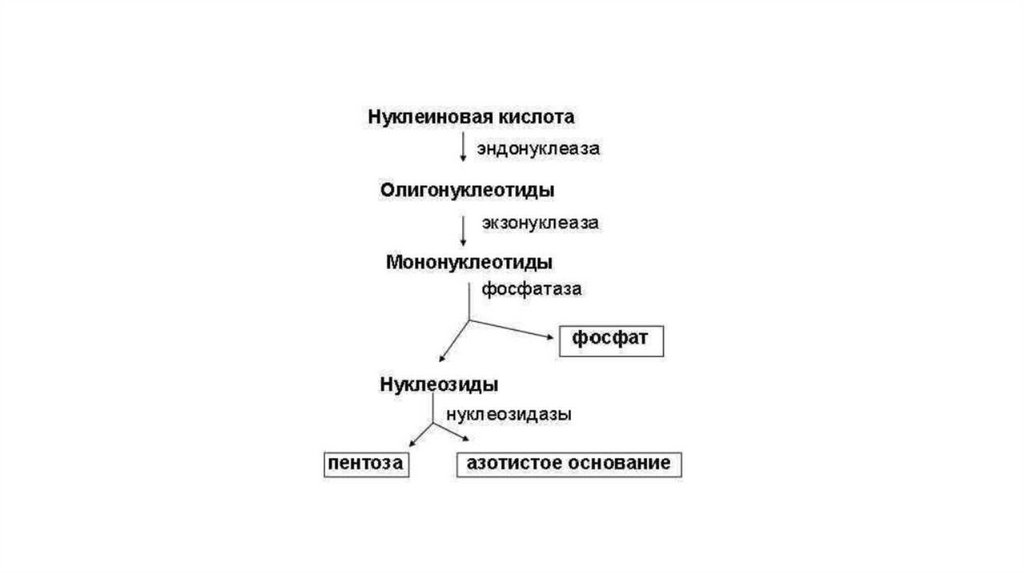
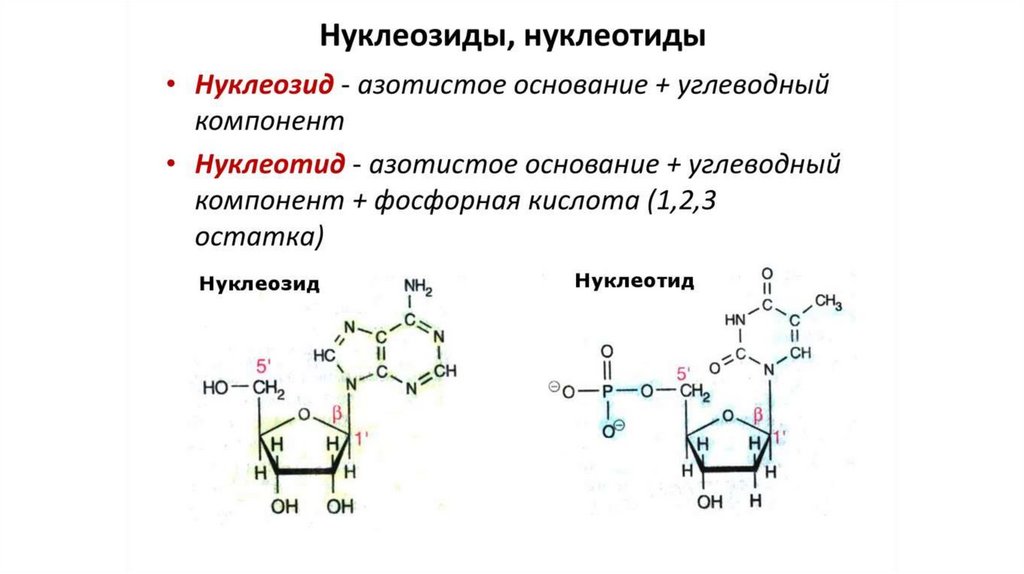
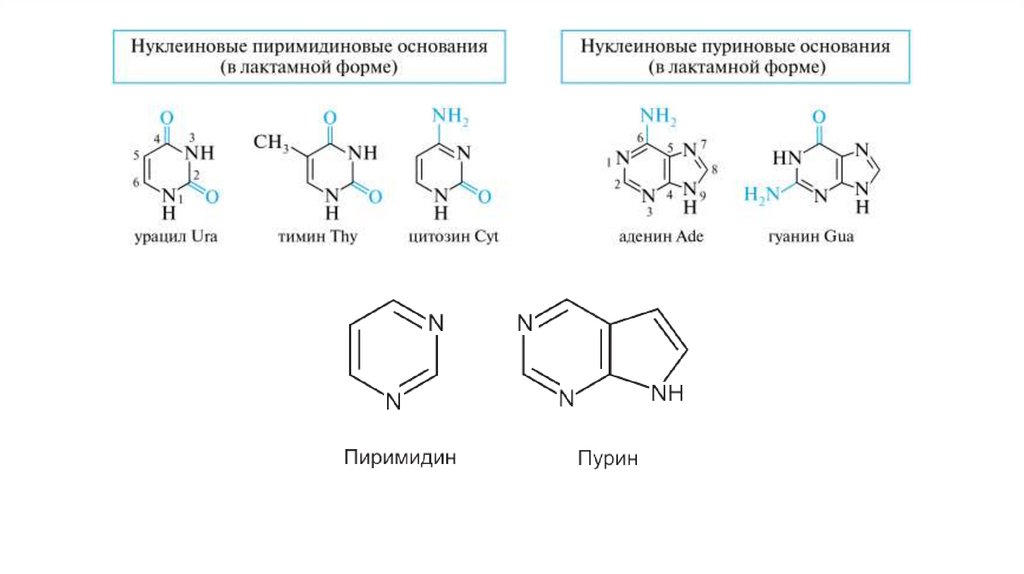
Распад нуклеиновых кислот в клеткеРаспад нуклеиновых кислот в клетке осуществляют нуклеазы:
ДНКазы расщепляют ДНК, РНКазы — РНК.
Сначала эндонуклеаза гидролизует ДНК и РНК до
олигонуклеотидов, а затем экзонуклеаза расщепляет их до
мононуклеотидов.
Последние гидролизуются фосфатазами и нуклеотидазами до
нуклеозидов.
34.
35.
36.
37.
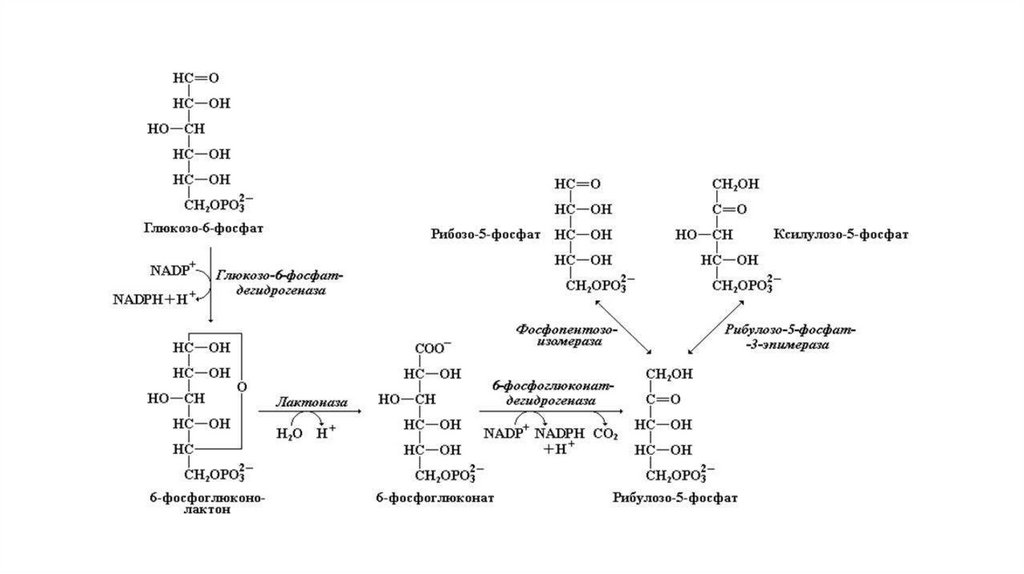
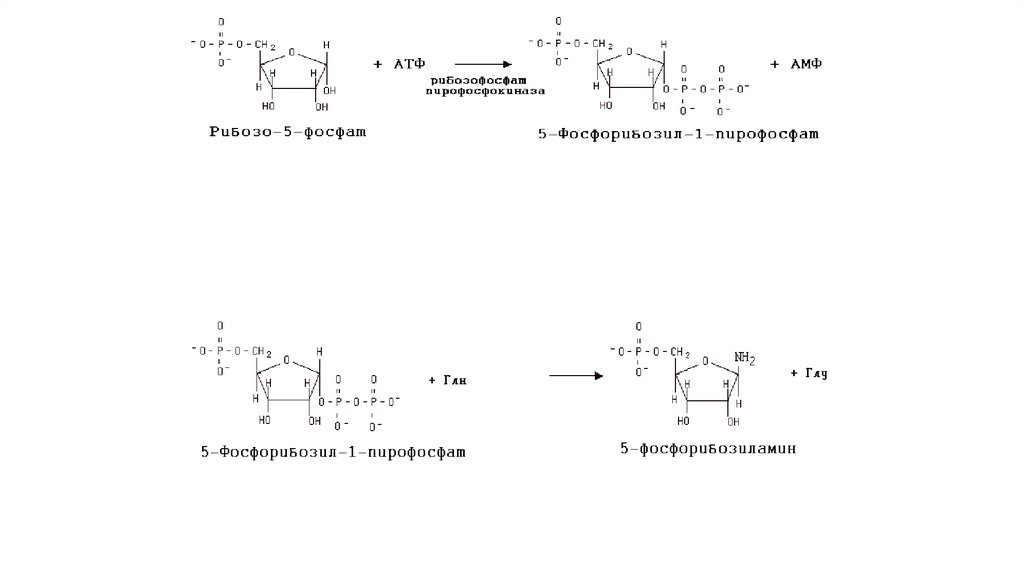
Синтез пуриновых нуклеотидовПуриновый цикл собирается путем последовательного
присоединения необходимых компонентов к рибозо-5-фосфату.
38.
39.
40.
В течение последующих 9 реакций на молекуле 5фосфорибозиламина происходит «сборка» пуринового кольца. Врезультате первым пуриновым нуклеотидом является
инозинмонофосфат (ИМФ), основанием которого служит
гипоксантин.
41.
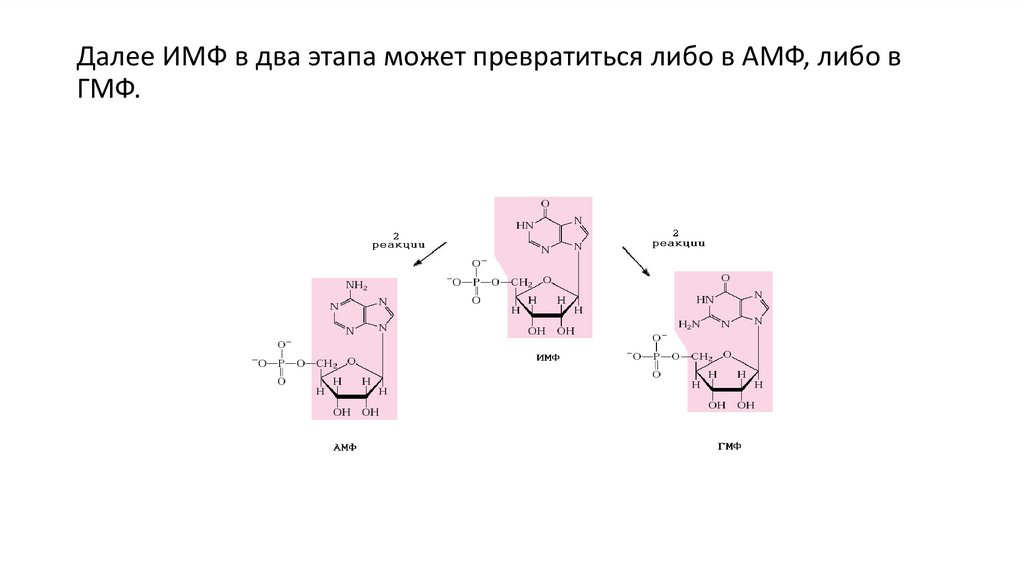
Далее ИМФ в два этапа может превратиться либо в АМФ, либо вГМФ.
42.
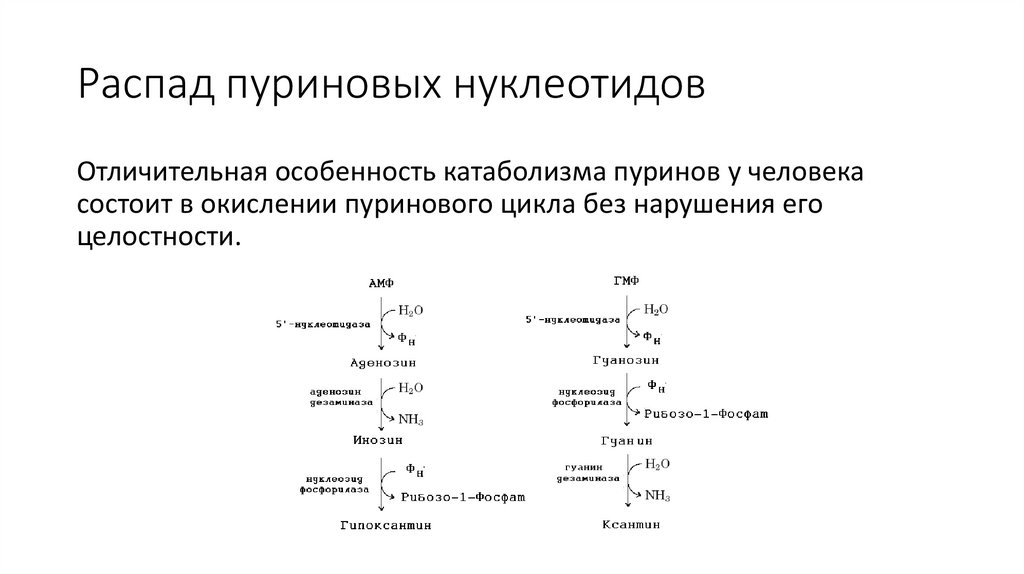
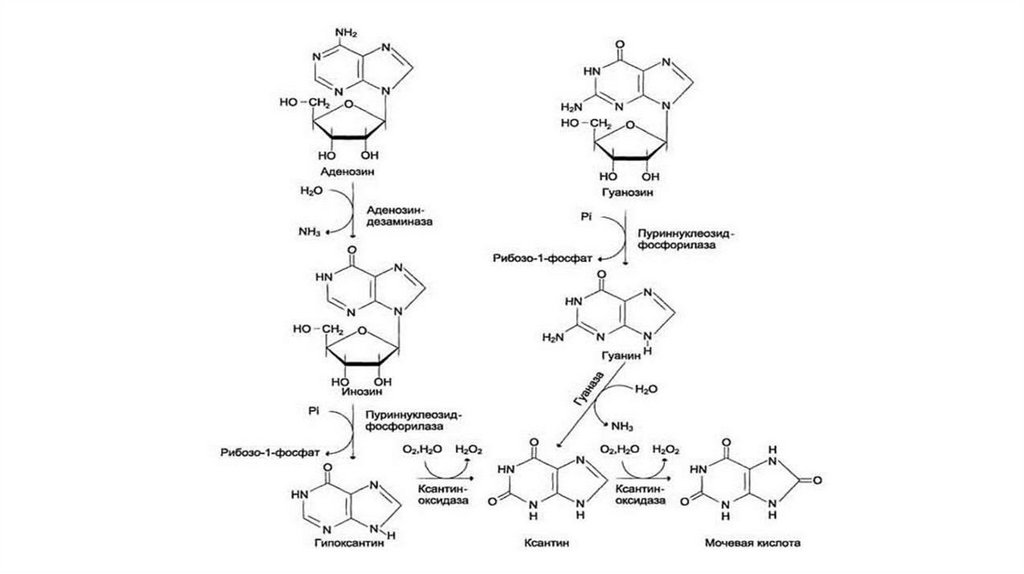
Распад пуриновых нуклеотидовОтличительная особенность катаболизма пуринов у человека
состоит в окислении пуринового цикла без нарушения его
целостности.
43.
44.
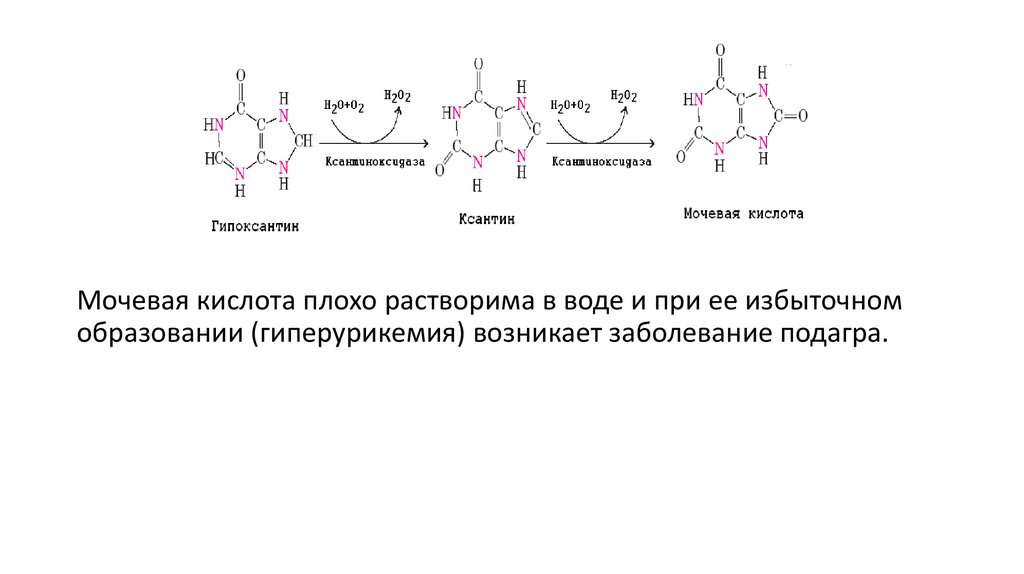
Мочевая кислота плохо растворима в воде и при ее избыточномобразовании (гиперурикемия) возникает заболевание подагра.
45.
Нарушение обмена нуклеотидовНарушение обмена пуриновых нуклеотидов приводит у человека к
гиперурикемии. Причинами повышения содержания мочевой кислоты могут
быть:
а) гиперактивация синтеза ФРПФ
б) недостаточность гипоксантин-гуанин-фосфорибозилтрансферазы;
в) избыточное потребление пуриновых азотистых оснований и
нуклеопротеинов с пищей, сопряженное с малоподвижным образом жизни
г) гликогеноз Гирке
46.
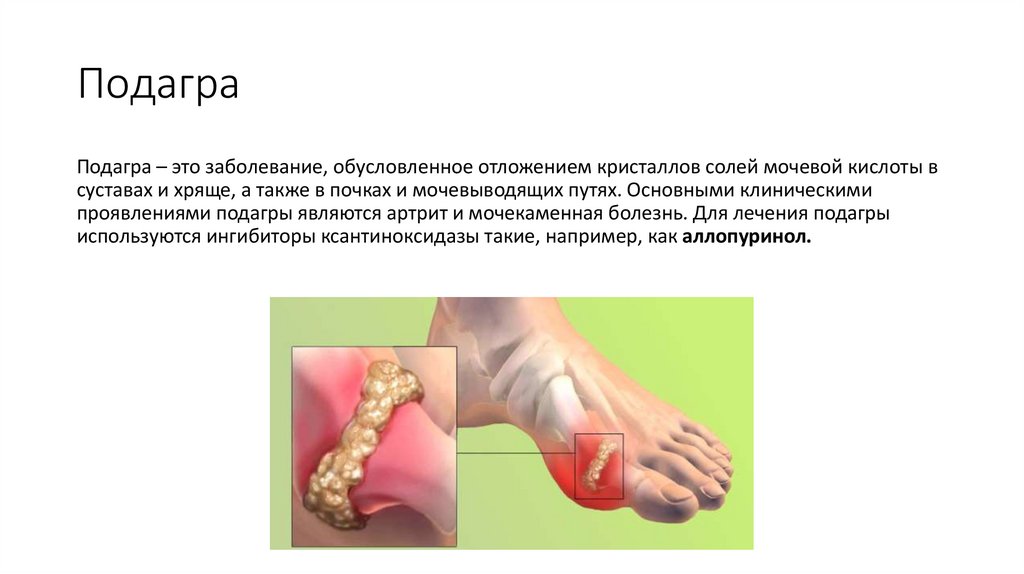
ПодаграПодагра – это заболевание, обусловленное отложением кристаллов солей мочевой кислоты в
суставах и хряще, а также в почках и мочевыводящих путях. Основными клиническими
проявлениями подагры являются артрит и мочекаменная болезнь. Для лечения подагры
используются ингибиторы ксантиноксидазы такие, например, как аллопуринол.
47.
Синдром Леша-НихенаПри полном отсутствии в организме гипоксантин-гуанинфосфорибозилтрансферазы развивается синдром Леша-Нихена,
который сопровождается подагрой, тяжелой формой
мочекаменной болезни и умственной отсталостью. Для болезни
характерно рецессивное Х-сцепленое наследование, поэтому она
проявляется только у мужчин. Больные склоны к аутоагрессии, и
чаще всего не доживают до 10 лет.
48.
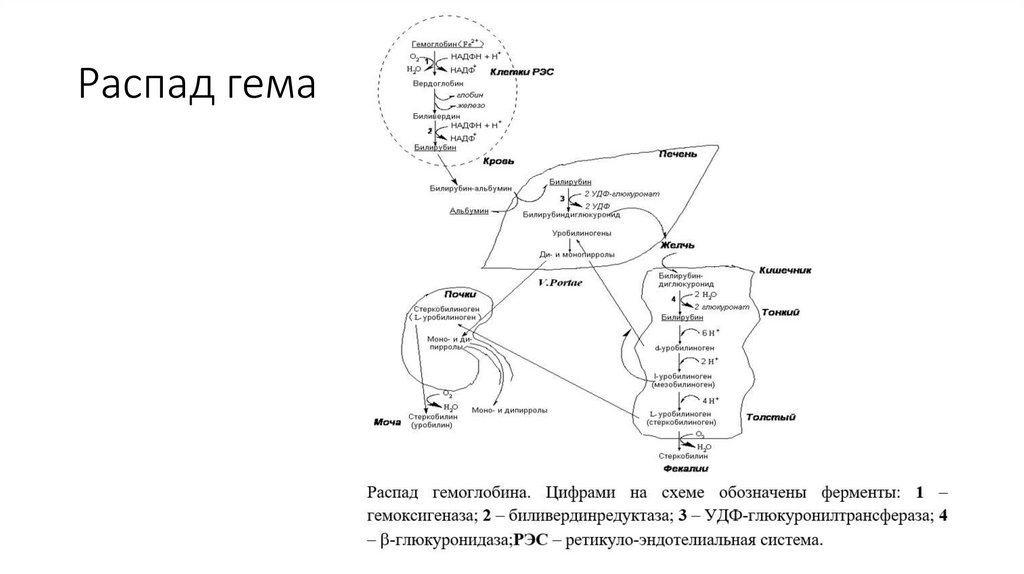
Распад гема49.
Конечный продукт распада гема – билирубин – практическинерастворим в воде. В комплексе с альбумином он
транспортируется в печень, где подвергается конъюгации с
глюкуроновой кислотой.
Конъюгированный билирубин растворим в воде, он легко
выводится с желчью в кишечник, где подвергается трансформации
под действием ферментов микрофлоры
50.
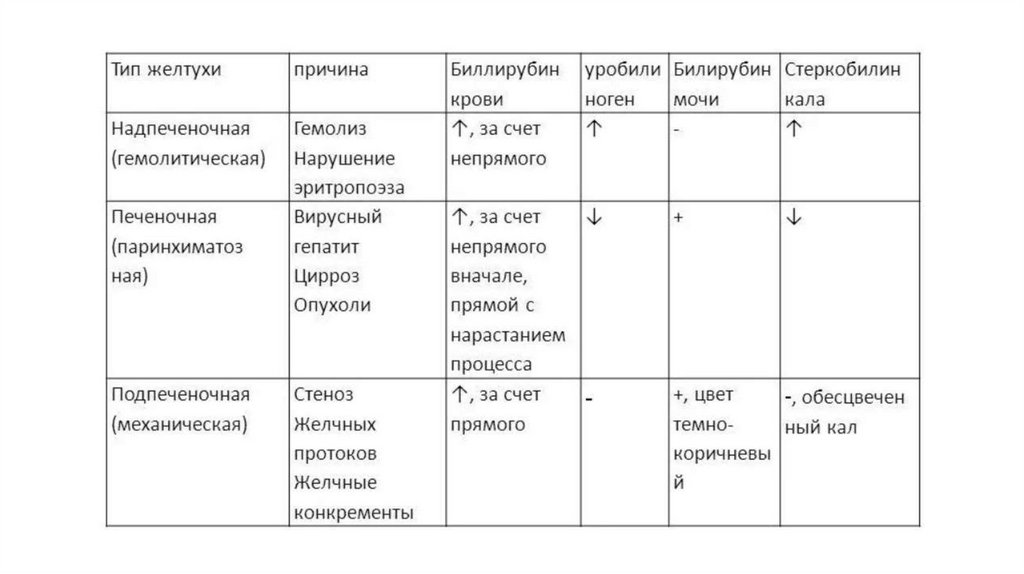
Нарушения обмена билирубинаПовышение содержания билирубина в крови выше 35 мкмоль/л
ведет к отложению его в тканях, в том числе в коже и слизистых,
которые окрашиваются в желтый цвет. Такое состояние называется
желтухой и может быть вызвано разными причинами. Выделяют
несколько видов желтух.
51.
Гемолитическая (надпеченочная) желтухаВозникает при усиленном распаде эритроцитов. В результате
образуется большое количество свободного билирубина,
утилизировать который печень не успевает. При данной форме
желтухи в крови увеличивается содержание общего билирубина за
счет неконъюгированного. В моче билирубин отсутствует, а
каловые массы содержат избыточное количество стеркобилина и
потому окрашены в темнокоричневый цвет.
52.
Печеночная (паренхиматозная) желтухаОбусловлена повреждением клеток печени вирусами,
токсическими препаратами. На начальных этапах процесс
присоединения глюкуроновой кислоты к билирубину сохраняется,
однако, образующийся прямой билирубин частично попадает в
большой круг кровообращения. Экскреция желчи также нарушена
и в кишечник билирубина попадает меньше, чем в норме. Меньше
обычного образуется мезобилиногена, но и это небольшое его
количество не распадается в печени. Поэтому мезобилиноген
попадает в кровь, а затем выделяется с мочой.
53.
Количество образующегося стеркобилиногена снижается, и калобесцвечивается. Таким образом, при паренхиматозной желтухе в
плазме крови определяется повышение количества общего
билирубина, в основном за счёт конъюгированного. В фекалиях
снижено содержание стеркобилиногена.
54.
Механическая (обтурационная,подпеченочная) желтуха
Связана с прекращением поступления желчи в кишечник при
остром воспалении желчевыводящих протоков, их закупоркой
камнями (желчнокаменная болезнь), наличием опухоли головки
поджелудочной железы, сдавливающей общий выводной проток.
Нарушение оттока желчи в кишечник сопровождается выходом
конъюгированного билирубина в кровь. Фекалии обесцвечены, а
реакция на уробилиноген в моче отрицательная.
Таким образом, при обтурационной желтухе в плазме крови
повышено количество общего билирубина за счёт прямого, а в
моче определяется высокий уровень прямого билирубина.





























 Биология
Биология








