Похожие презентации:
Серная кислота и ее соли
1.
Определение темы и целей урока• При Петре I это вещество привозили в
Россию из-за границы. Но уже в 1798 г.
Купец Муромцев «выварил» 125 пудов
(около двух тонн) нагреванием железного
купороса. «Купоросная кислота»,
«купоросное масло», «серное масло»,
«купоросный спирт» так называли в XVIIXVIII веке это вещество. Как вы думаете,
какое современное название этого
вещества?
2.
Тема урока:Серная кислота и ее соли
Цели обучения:
-9.2.1.14 -исследовать физические и
химические свойства раствора серной
кислоты и ее солей
3.
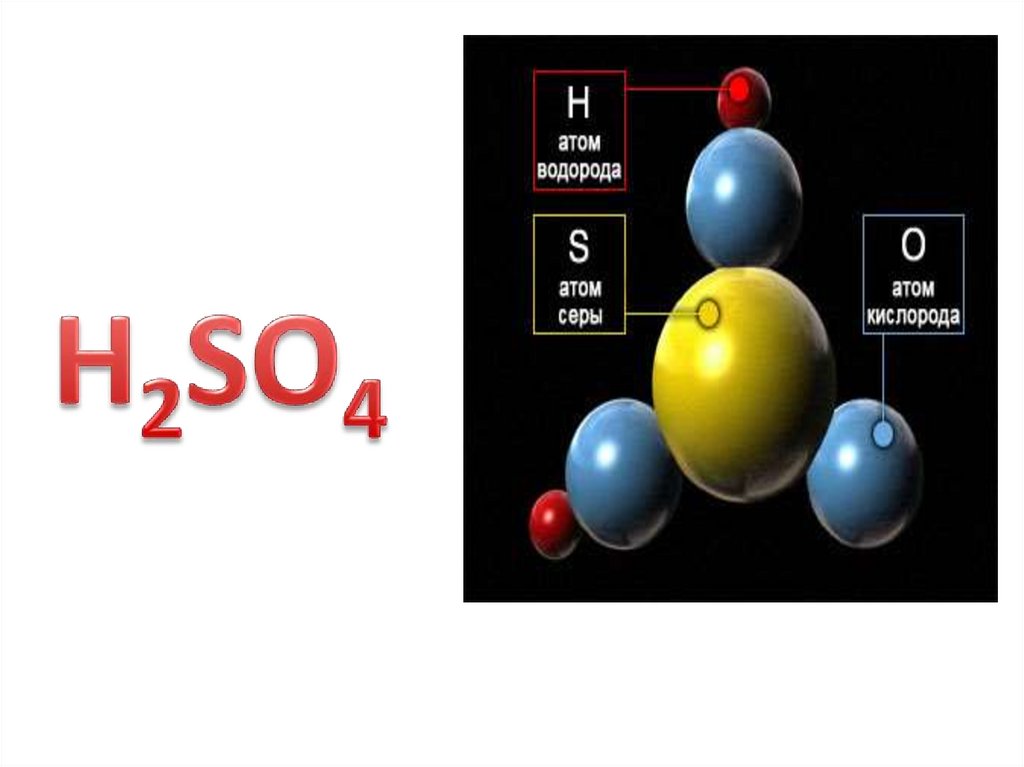
Задание№1• запишите молекулярную формулу кислоты;
• - расставьте степени окисления каждого химического элемента в
формуле;
• - определите заряды ионов в кислоте;
• - дайте характеристику кислоте по всем известным признакам
• – по основности
• - по степени электролитической диссоциации (т.е. по силе)
• - по содержанию атомов кислорода в молекуле.
Дескриптор:
1.Записывают формулу кислоты
2.определяют степени окисления элементов в серной кислоте
3.дают характеристику серной кислоте по основности и составу
4.записывают уравнение диссоциации серной кислоты
4.
5.
• Серная кислота-двухосновнаякислородсодержащая сильная кислота
т.е. в водных растворах полностью
распадается на ионы:
H2SO4 = 2H+ +SO42- (заряды ионов)
Растворы не имеют запаха
6.
Задание №2 (работа с учебникам вгруппах)
• 1 группа “Физические свойства серной
кислоты
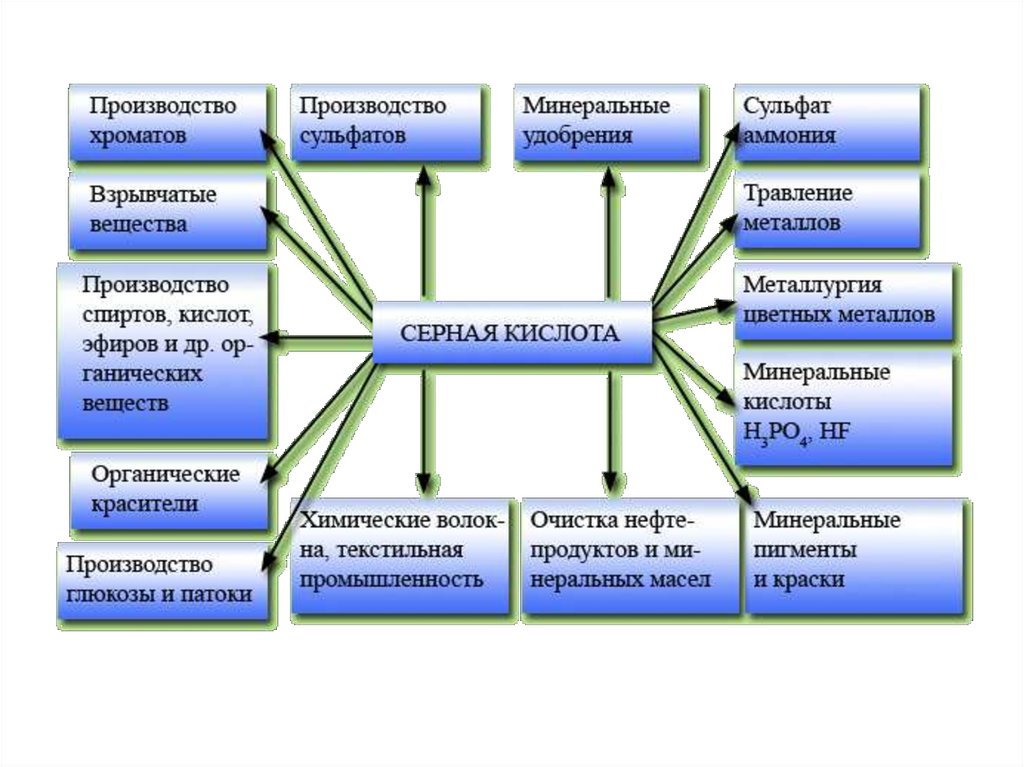
• 2 группа “Области применения серной
кислоты”, “Получение”
• 3 группа “Соли серной кислоты”
• 4 группа “Техника безопасности при работе
с серной кислотой
7.
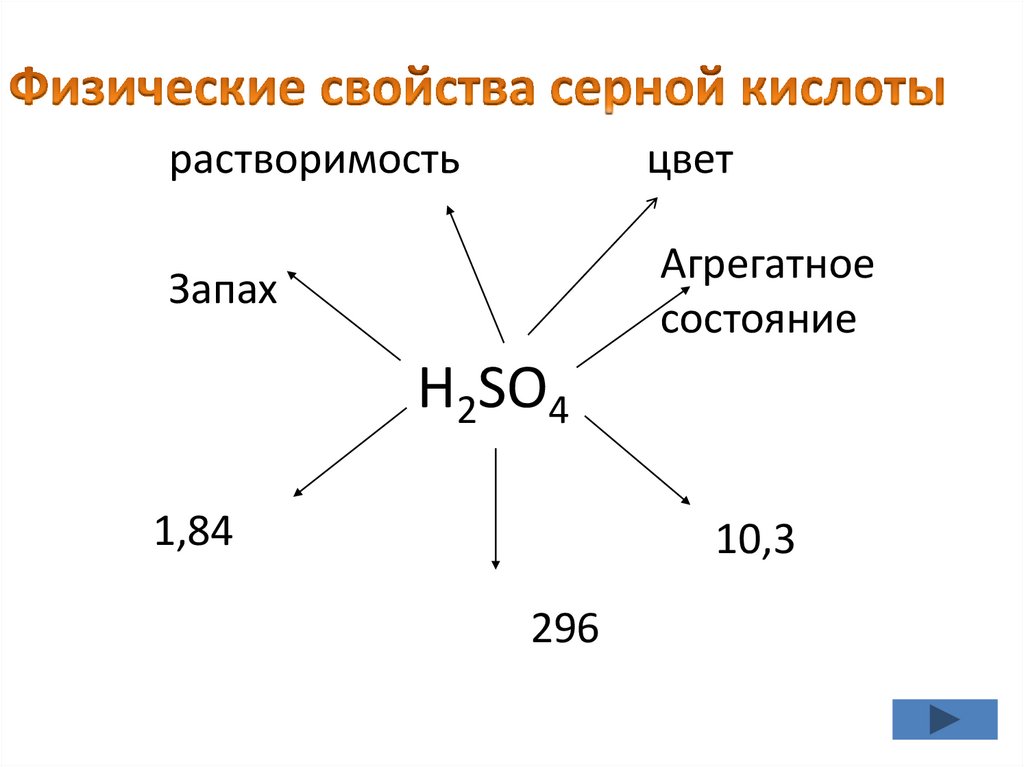
растворимостьцвет
Запах
Агрегатное
состояние
H2SO4
1,84
10,3
296
8.
• тяжелая бесцветнаямаслянистая нелетучая
жидкость;
• без цвета и запаха;
• ρ (96% H2SO4) = 1,84 г/см3;
• хорошо растворяется в воде с
выделением тепла.
9.
10.
Образуется при взаимодействииоксида серы (VI) c водой
11.
Сопоставьте формулы солей сназваниями
Формулы сульфатов
Названия солей
• 1)Na2SO4*10H2O
• 2) MgSO4*7H2O
• 3)CaSO4*2H2O
• 4)CuSO4*5H2O
• 5)FeSO4*7H2O
• A)горькая соль
• B)глауберова соль
• C)медный купорос
• D)гипс
• E)железный
купорос
12.
Сульфат натрия Na2SO4* 10H2O –глауберовасоль (применяется при производстве соды,
стекла, в медицине и ветеринарии.
13.
СuSO4*5H2O –медный купорос(применяется в сельском хозяйстве).Сульфат меди СuSO4*5H2O – медный купорос
(применяется в сельском хозяйстве).
14.
Расшифруй картинку15.
А как правильно растворять серную кислоту?Сначала вода,
Потом кислота.
Иначе будет
большая беда!
Никогда
не добавляйте воду в
кислоту!
16.
Дескриптор:• определяют физические свойства серной
кислоты
• определяют области применения кислоты
• изучают правила ТБ при работе с серной
кислотой
• сопоставляют формулы солей с их
названиями
17.
Физминутка• Две минутки отдыхаем, но урок не забываем
• Если я называю формулу основного оксида –
• Наклоняем голову влево, кислотного – вправо,
• Кислоты – вперед, основания – назад,
• Формулу соли – вращаем головой.
• CuO, N2O5 – вспомним классы мы опять,
• H2S, KOH - лучше думай, мозг, ты наш,
• NaCl и KBr - голова идет кругом.
• Взгляд налево, взгляд направо,
• ведь разминка – не забава,
• покачали головой – и усталость с нас долой!
18.
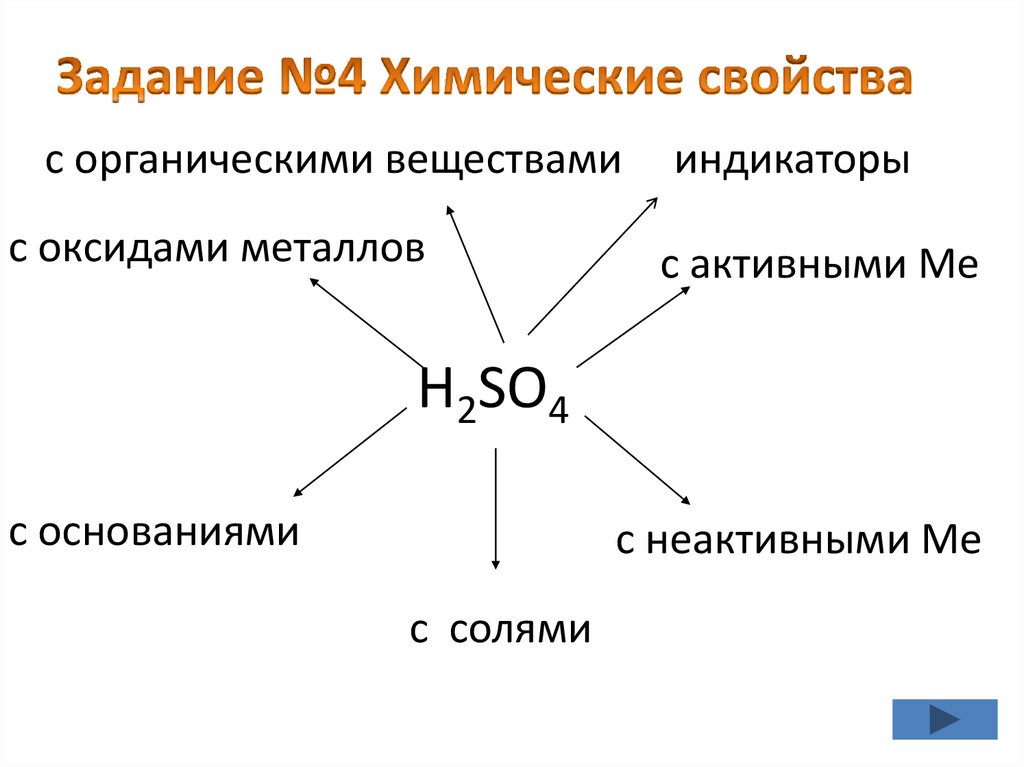
с органическими веществамис оксидами металлов
индикаторы
с активными Ме
H2SO4
с основаниями
с неактивными Ме
с солями
19.
Задание№4• Группа№1: Действие на индикаторы
• Группа№2: а)Качественная реакция на
сульфат-ионы, б) взаимодействие с
основаниями
• Группа№3:Взаимодействие с оксидами
металлов
• Группа№4: а)Взаимодействие с металлами
б) солями
20.
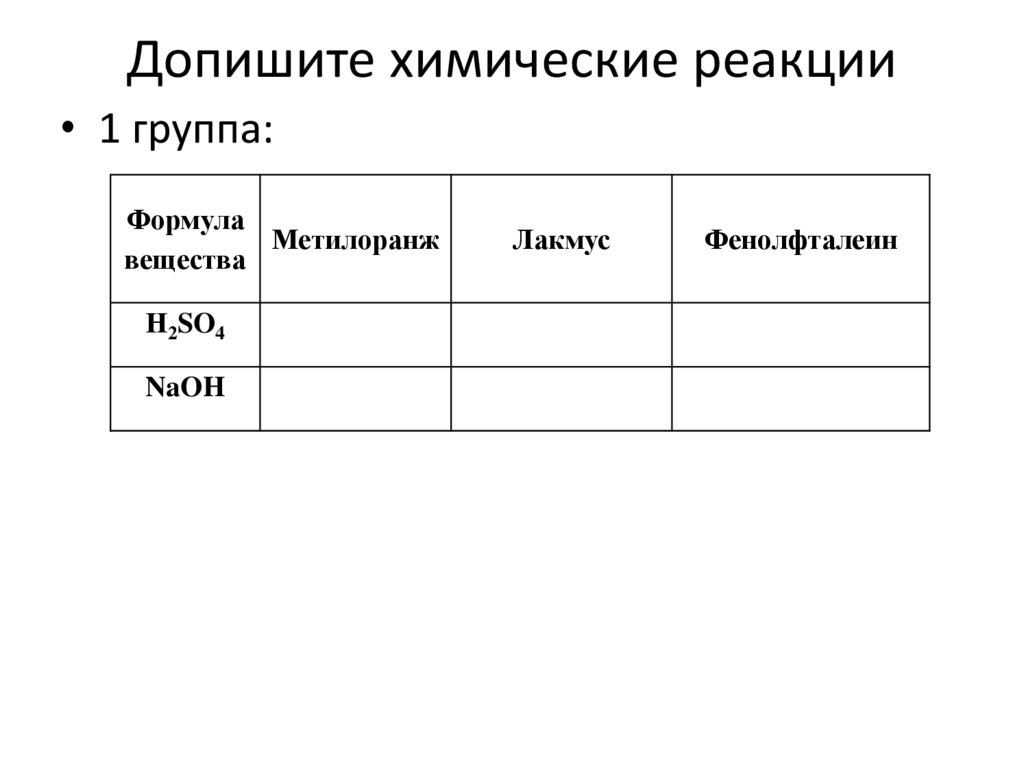
Допишите химические реакции• 1 группа:
Формула
Метилоранж
вещества
Н2SO4
NaOH
Лакмус
Фенолфталеин
21.
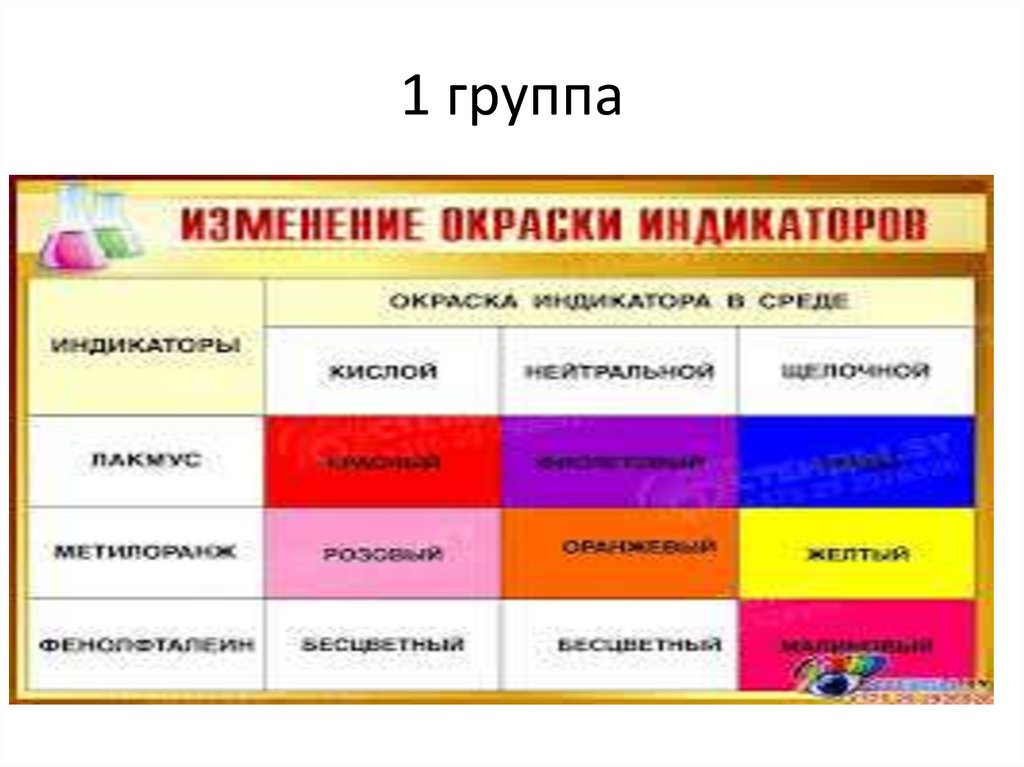
1 группа22.
2 группа а)Качественная реакция насульфат-ионы, б) взаимодействие с
основаниями
• H2SO4 + BaCI2 →
• H2SO4 + NaOH →
23.
3 группа 3:Взаимодействие соксидами металлов
• H2SO4 + CuO =
24.
Группа№4: а)Взаимодействие сметаллами б) солями
А) H2SO4 + Zn =
H2SO4 + Cu =
Б) H2SO4 + Na2CO3 →
25.
26.
27.
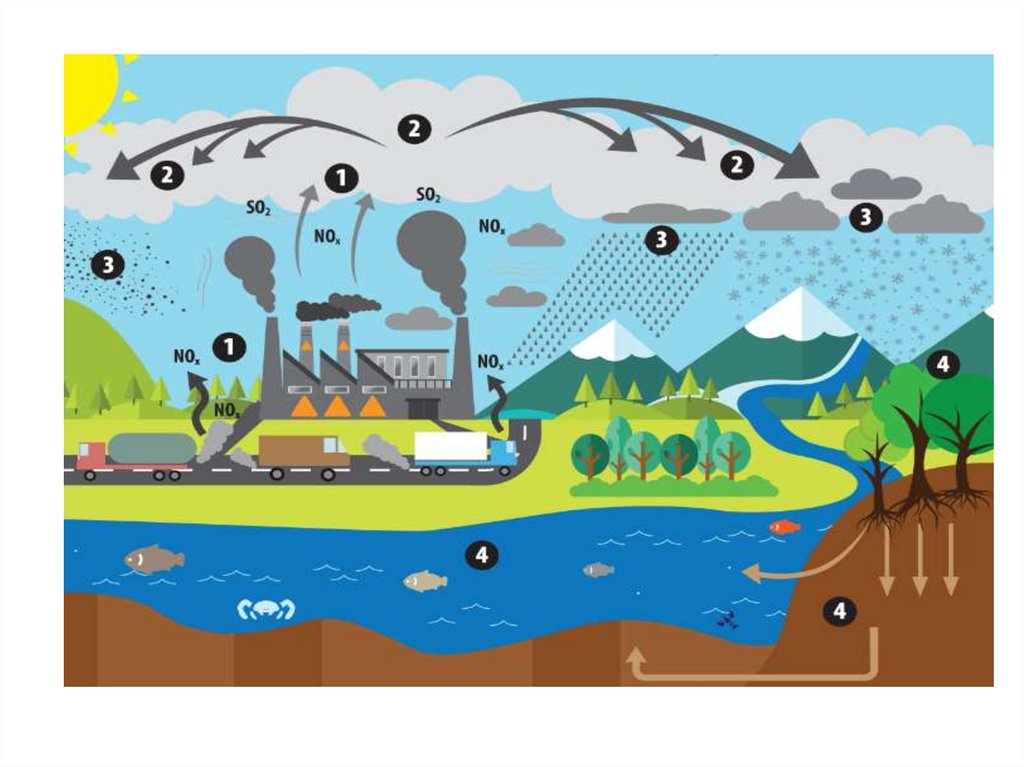
• Серная кислота и сульфаты замедляют рост с/х культур.Закисление водоемов (весной при таянии снега, вызывает
гибель икр и молоди рыб. Помимо экологического ущерба
налицо экономический ущерб - громадные суммы каждый
год теряются при раскисление почв.
28.
H2SO4 + Na2CO3 →29.
Рефлексивный экран• я научился…
сегодня я узнал…
• у меня получилось … было интересно…
• я смог…
было трудно…
• я попробую…
я выполнял задания…
• меня удивило…
я понял, что…
• урок дал мне для
теперь я могу…
жизни…
я почувствовал, что…
• мне захотелось…
я приобрел…
30.
31.
Окончен урок, и выполнен план.Спасибо, ребята, огромное вам.
За то, что упорно и дружно трудились,
И знания точно уж вам пригодились.
























 Химия
Химия