Похожие презентации:
Коррозия металлов. Реферат
1.
государственное бюджетное профессиональное образовательное учреждение«Пермский политехнический колледж имени Н.Г. Славянова»
Реферат
на тему «Коррозия металлов»
Просовский Арсений
Пучков Кирилл
Ca-24/2k
2.
Тема выступленияВВЕДЕНИЕ
Коррозия металлов представляет собой одно из наиболее значимых
явлений в промышленности и повседневной жизни, наносящее
огромный ущерб экономике и безопасности эксплуатации
технических устройств. В современном мире проблема коррозии
металлов стоит особенно остро, так как большинство конструкций,
механизмов и оборудования изготавливаются из различных
металлических сплавов.
Объектом исследования являются металлы и их сплавы,
подверженные коррозии, а предметом — факторы, вызывающие
коррозию, виды коррозии, ингибиторы коррозии и принцип
действия данного процесса.
Просовский Арсений Пучков Кирилл
3.
Тема выступленияКоррозия металлов
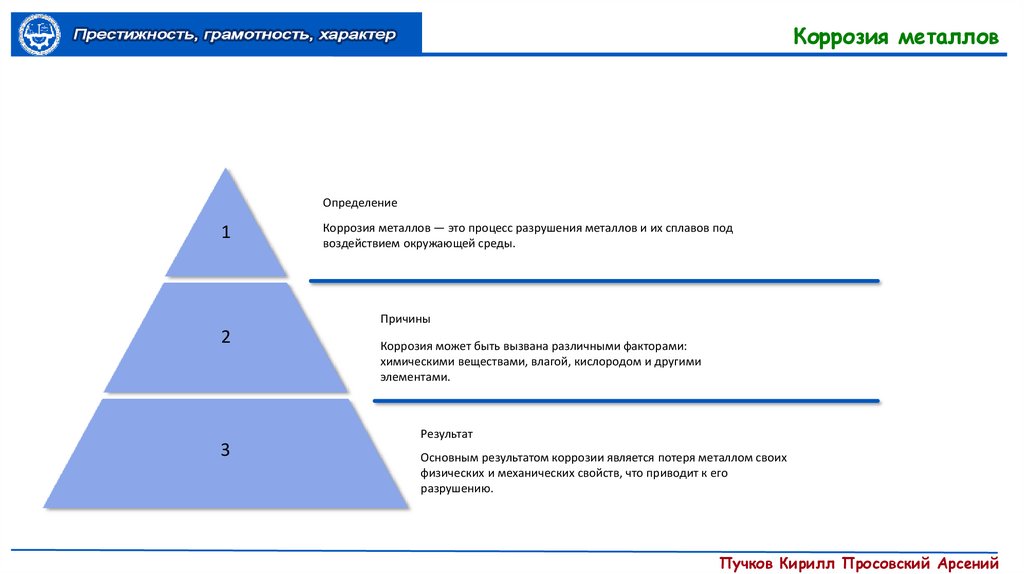
Определение
1
Коррозия металлов — это процесс разрушения металлов и их сплавов под
воздействием окружающей среды.
Причины
2
Коррозия может быть вызвана различными факторами:
химическими веществами, влагой, кислородом и другими
элементами.
Результат
3
Основным результатом коррозии является потеря металлом своих
физических и механических свойств, что приводит к его
разрушению.
Пучков Кирилл Просовский Арсений
4.
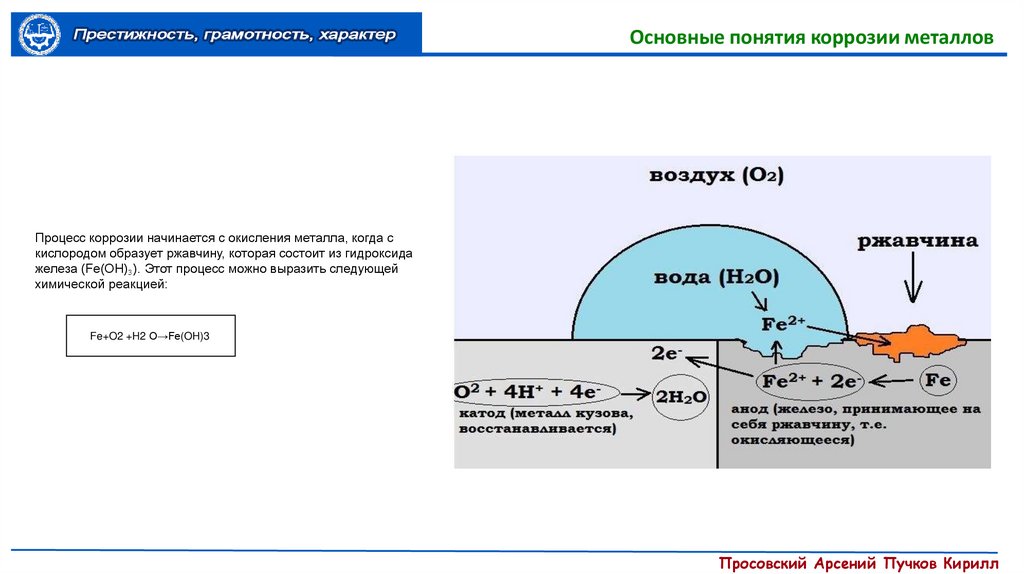
Основные понятия коррозии металловПроцесс коррозии начинается с окисления металла, когда с
кислородом образует ржавчину, которая состоит из гидроксида
железа (Fe(OH)₃). Этот процесс можно выразить следующей
химической реакцией:
Fe+O2 +H2 O→Fe(OH)3
Просовский Арсений Пучков Кирилл
5.
Факторы, влияющие на процесс коррозииВнешние факторы
Внутренние факторы
- Температура окружающей среды.
- Химический состав металла.
- Влажность воздуха.
- Его структуру и состояние поверхности.
- Концентрация агрессивных веществ в окружающей среде.
Например, углеродистая сталь более подвержена коррозии,
чем нержавеющая сталь, поскольку она содержит меньше
легирующих элементов, таких как хром и никель, которые
создают защитную пленку на поверхности металла.
Пучков Кирилл Просовский Арсений
6.
Виды коррозииЭлектрохимическая коррозия
Межкристаллитная коррозия
происходит при наличии двух
разных металлов в электролите.
Разница потенциалов между
металлами приводит к образованию
анодного и катодного участков, что
вызывает коррозию менее
благородного металла.
происходит вдоль границ зерен
металла, где концентрация
примесей выше.
Пораженная коррозия
Усталостная коррозия
характеризуется образованием
пор на поверхности металла,
через которые коррозия
распространяется глубже в
материал.
возникает при совместном
действии нагрузок и
агрессивной среды.
Просовский Арсений Пучков Кирилл
7.
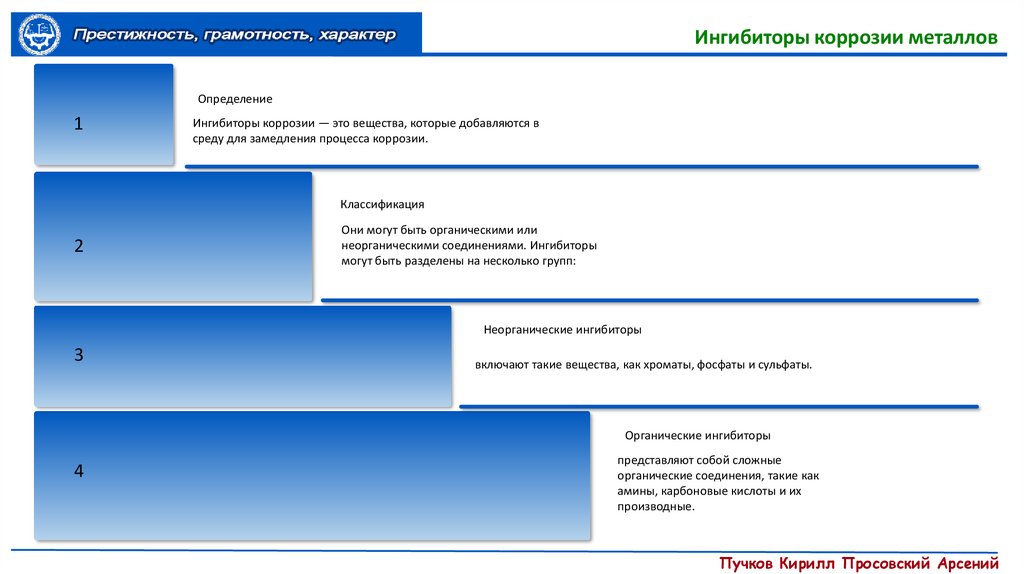
Ингибиторы коррозии металловОпределение
1
Ингибиторы коррозии — это вещества, которые добавляются в
среду для замедления процесса коррозии.
Классификация
2
Они могут быть органическими или
неорганическими соединениями. Ингибиторы
могут быть разделены на несколько групп:
Неорганические ингибиторы
3
включают такие вещества, как хроматы, фосфаты и сульфаты.
Органические ингибиторы
4
представляют собой сложные
органические соединения, такие как
амины, карбоновые кислоты и их
производные.
Пучков Кирилл Просовский Арсений
8.
Принцип действ ияингибиторов
Принцип действия ингибиторов основан на их способности образовывать
защитную пленку на поверхности металла, препятствуя контакту металла с
агрессивной средой. Например, хроматы образуют тонкую оксидную пленку на
поверхности металла, которая предотвращает дальнейшее разрушение
материала.
Другие ингибиторы, такие как амины, адсорбируются на поверхности металла,
блокируя активные центры коррозии и снижая скорость электрохимических
реакций.
Просовский Арсений Пучков Кирилл
9.
Принцип действия коррозии1
2
Химическая природа
Электрохимические процессы
Химическая коррозия металлов происходит при
Электрохимическая коррозия металлов
взаимодействии металла с химически активными веществами,
основана на процессах окисления и
такими как кислород, сера и хлор. Этот процесс можно описать восстановления, которые происходят на
следующей общей реакцией:
поверхности металла. Эти процессы могут
быть описаны следующими уравнениями:
M+nX→MXn
Anode:M→Mn++ne−
Cathode:nX+ne−→Xn
Пучков Кирилл Просовский Арсений
10.
Тема выступленияЗаключение
Спасибо за внимание!
Просовский Арсений Пучков Кирилл







 Химия
Химия








