Похожие презентации:
Самостоятельная работа “Спирты”
1.
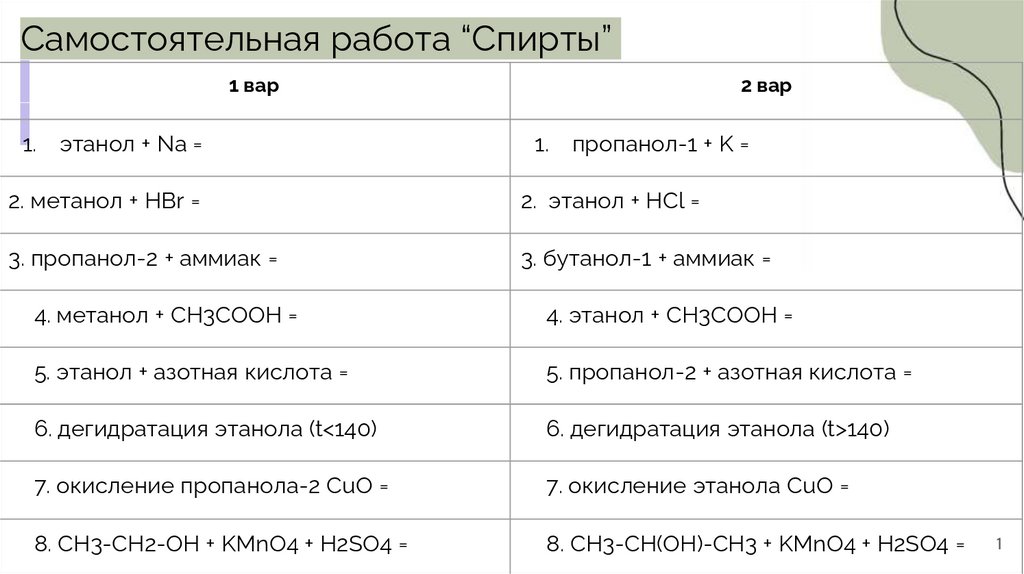
Самостоятельная работа “Спирты”1 вар
1.
этанол + Na =
2 вар
1.
пропанол-1 + K =
2. метанол + HBr =
2. этанол + HCl =
3. пропанол-2 + аммиак =
3. бутанол-1 + аммиак =
4. метанол + CH3COOH =
4. этанол + CH3COOH =
5. этанол + азотная кислота =
5. пропанол-2 + азотная кислота =
6. дегидратация этанола (t<140)
6. дегидратация этанола (t>140)
7. окисление пропанола-2 CuO =
7. окисление этанола CuO =
8. CH3-CH2-OH + KMnO4 + H2SO4 =
8. CH3-CH(OH)-CH3 + KMnO4 + H2SO4 =
1
2.
ФенолПодготовила: учитель химии Окунева В.Е.
3.
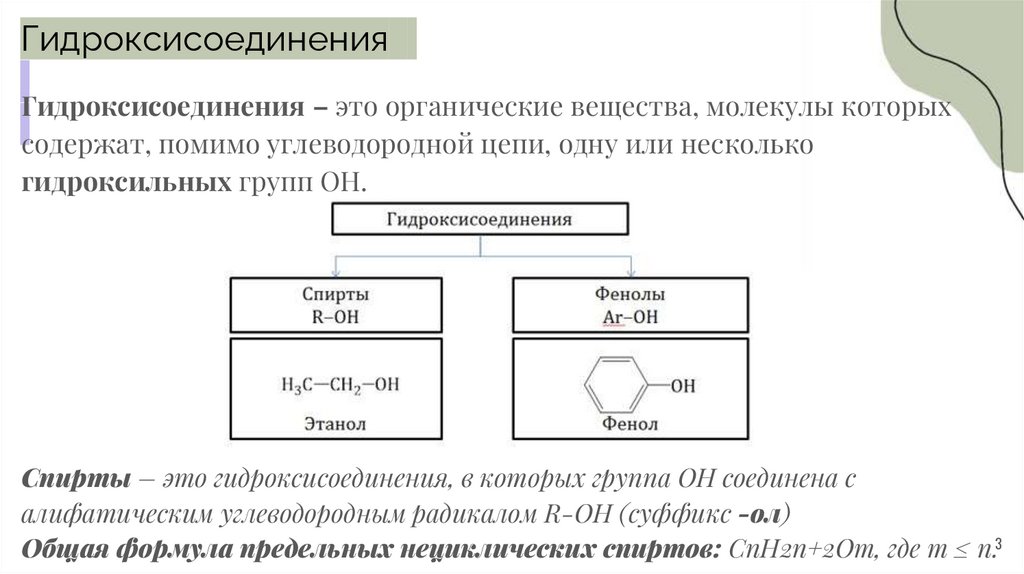
ГидроксисоединенияГидроксисоединения – это органические вещества, молекулы которых
содержат, помимо углеводородной цепи, одну или несколько
гидроксильных групп ОН.
Спирты – это гидроксисоединения, в которых группа ОН соединена с
алифатическим углеводородным радикалом R-OH (суффикс -ол)
Общая формула предельных нециклических спиртов: CnH2n+2Om, где m ≤ n.3
4.
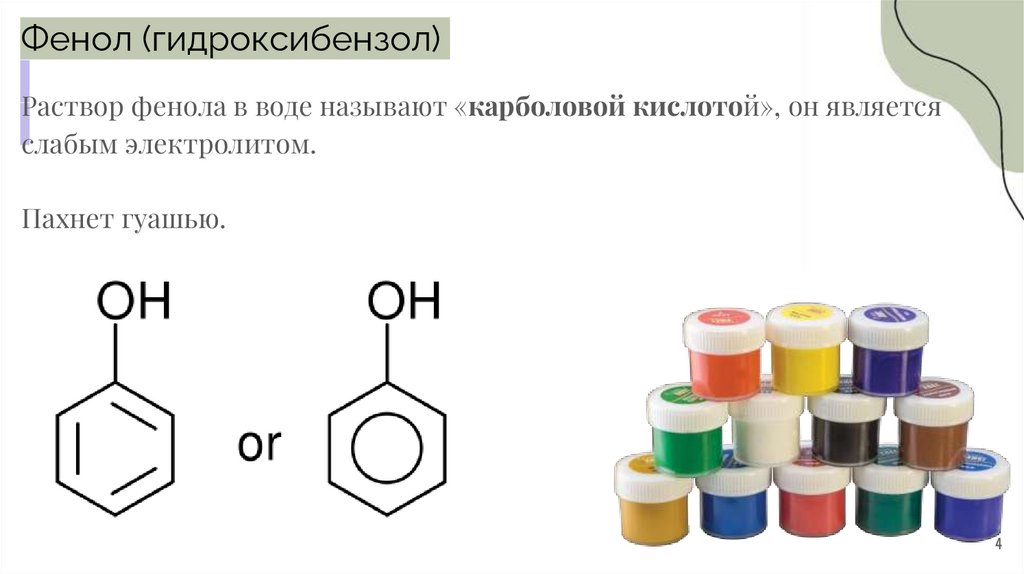
Фенол (гидроксибензол)Раствор фенола в воде называют «карболовой кислотой», он является
слабым электролитом.
Пахнет гуашью.
4
5.
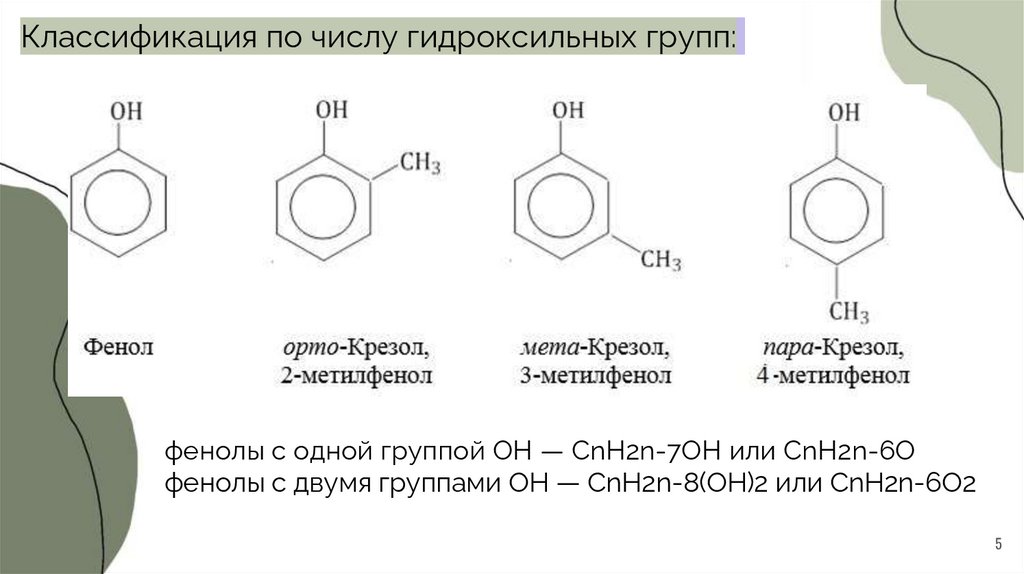
Классификация по числу гидроксильных групп:фенолы с одной группой ОН — CnH2n-7OH или CnH2n-6O
фенолы с двумя группами ОН — CnH2n-8(OH)2 или CnH2n-6O2
5
6.
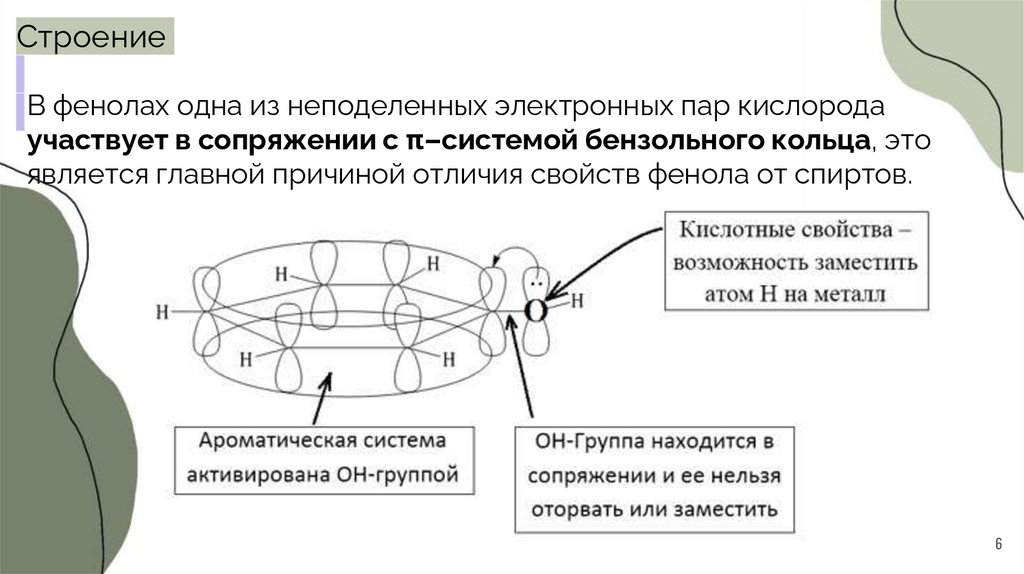
СтроениеВ фенолах одна из неподеленных электронных пар кислорода
участвует в сопряжении с π–системой бензольного кольца, это
является главной причиной отличия свойств фенола от спиртов.
6
7.
Отличия и сходства со спиртамиСходство: как фенол, так и спирты реагируют с
щелочными металлами с выделением водорода.
Отличия:
● не реагирует с галогеноводородами
● не вступает в реакцию этерификации, эфиры
фенола получают косвенным путем;
не вступает в реакции дегидратации.
● фенол обладает более сильными кислотными
свойствами и вступает в реакцию со
щелочами.
7
8.
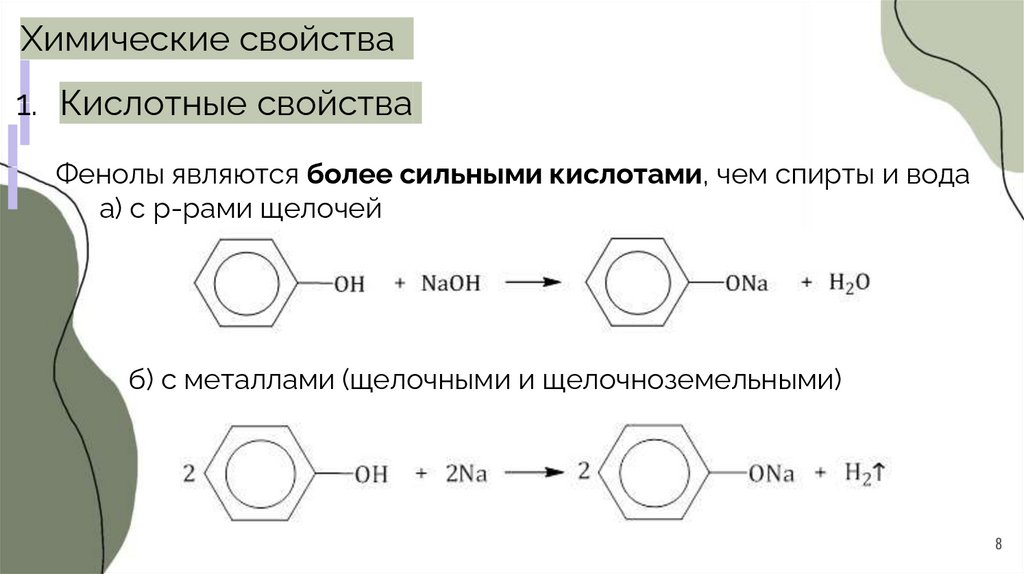
Химические свойства1. Кислотные свойства
Фенолы являются более сильными кислотами, чем спирты и вода
а) с р-рами щелочей
б) с металлами (щелочными и щелочноземельными)
8
9.
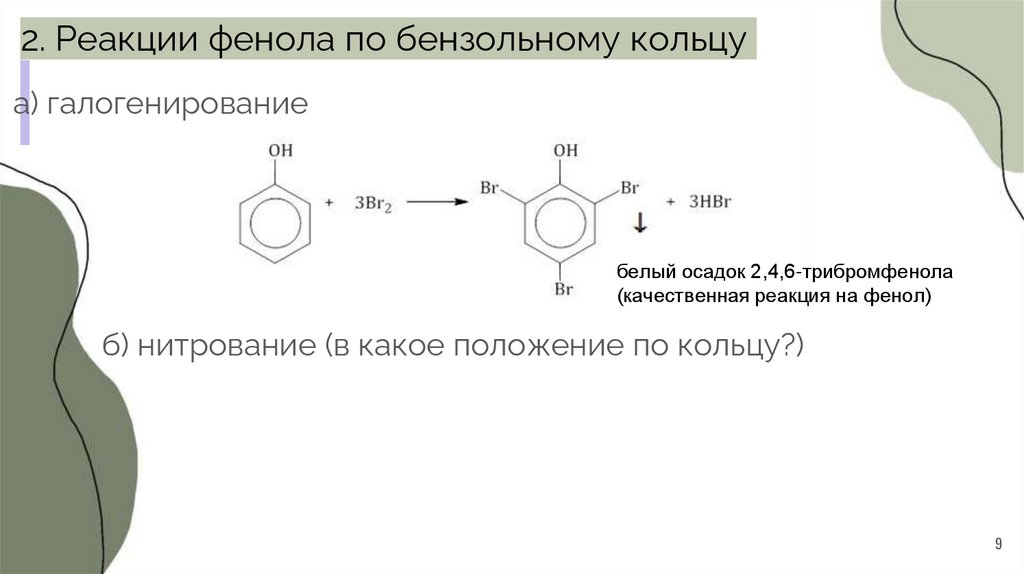
2. Реакции фенола по бензольному кольцуа) галогенирование
белый осадок 2,4,6-трибромфенола
(качественная реакция на фенол)
б) нитрование (в какое положение по кольцу?)
9
10.
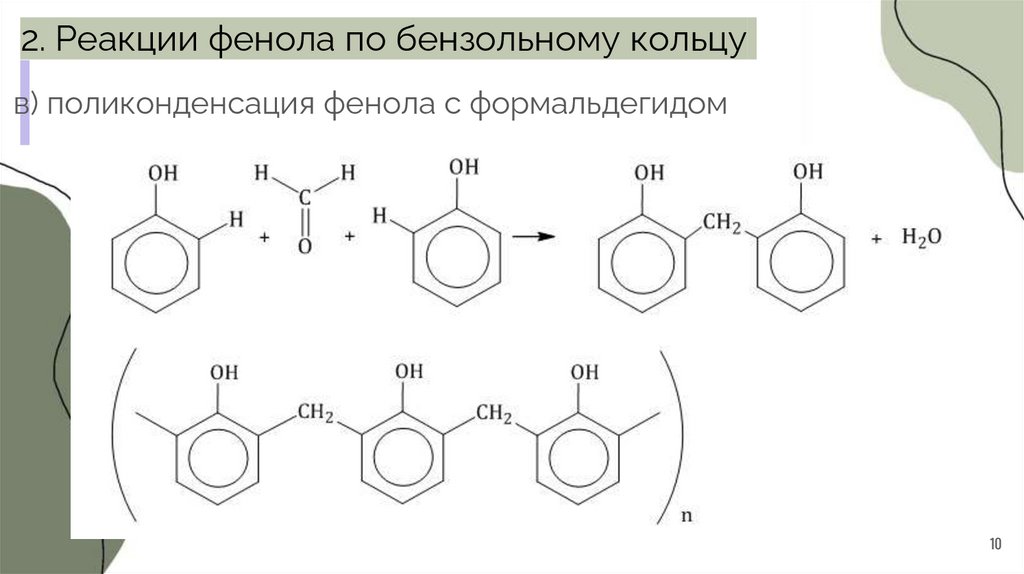
2. Реакции фенола по бензольному кольцув) поликонденсация фенола с формальдегидом
10
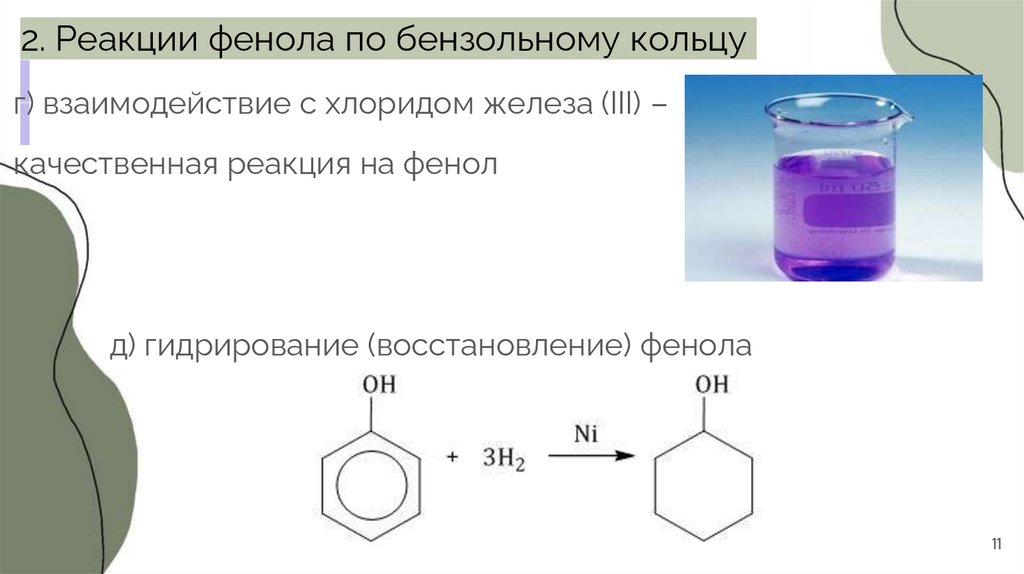
11.
2. Реакции фенола по бензольному кольцуг) взаимодействие с хлоридом железа (III) –
качественная реакция на фенол
д) гидрирование (восстановление) фенола
11
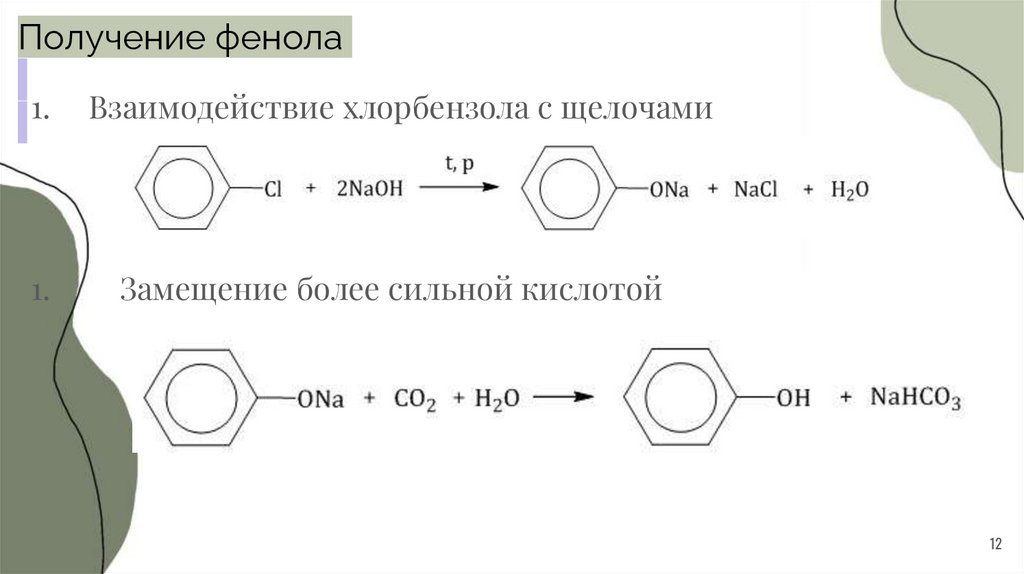
12.
Получение фенола1.
Взаимодействие хлорбензола с щелочами
1.
Замещение более сильной кислотой
12
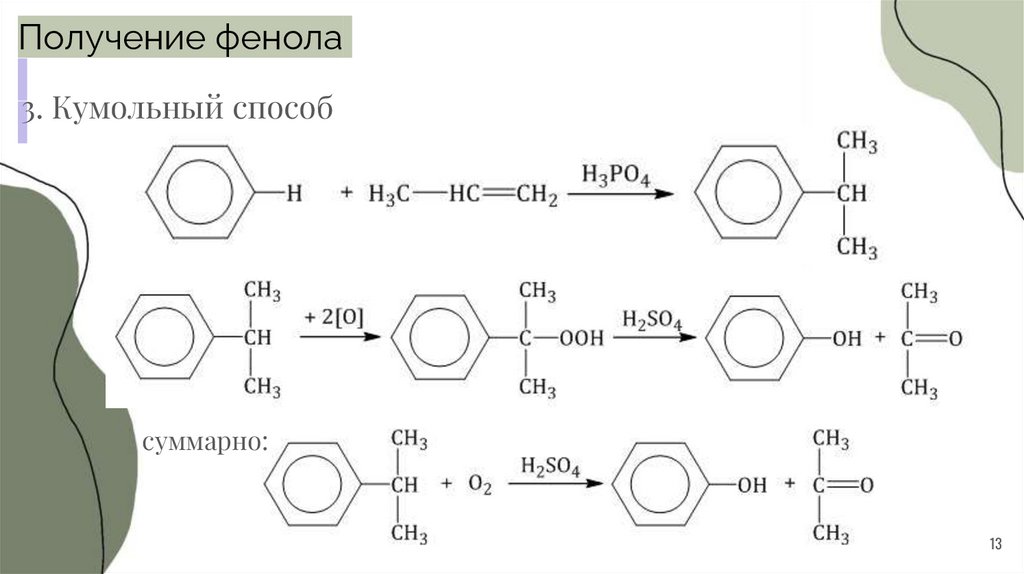
13.
Получение фенола3. Кумольный способ
суммарно:
13
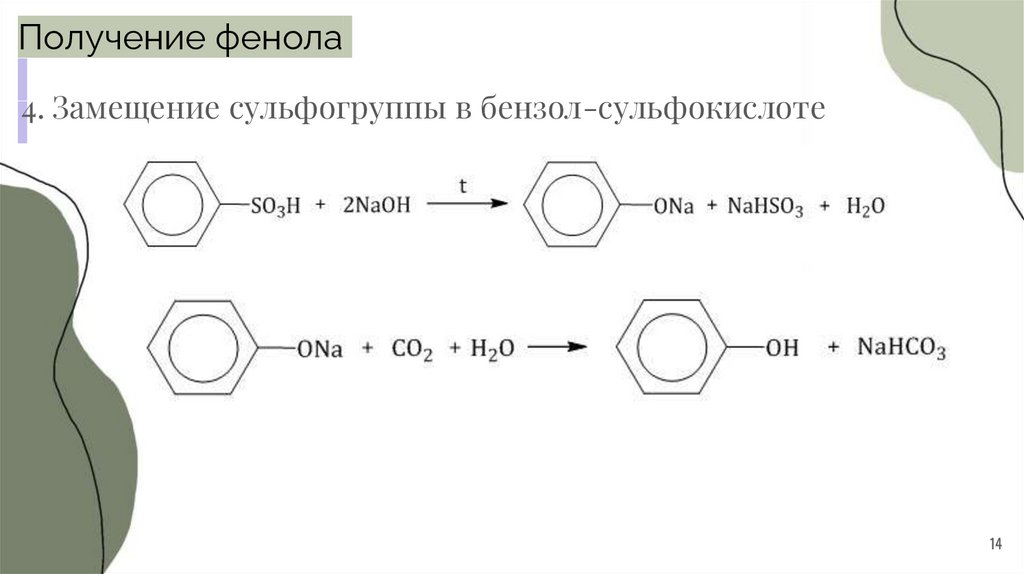
14.
Получение фенола4. Замещение сульфогруппы в бензол-сульфокислоте
14
15.
Применение фенола- составьте конспект самостоятельно, при помощи учебника
или проверенных интернет-ресурсов
15
16.
Задания16




 Химия
Химия








