Похожие презентации:
Спирты. Фенолы
1.
Тема № 4. Спирты и фенолы2.
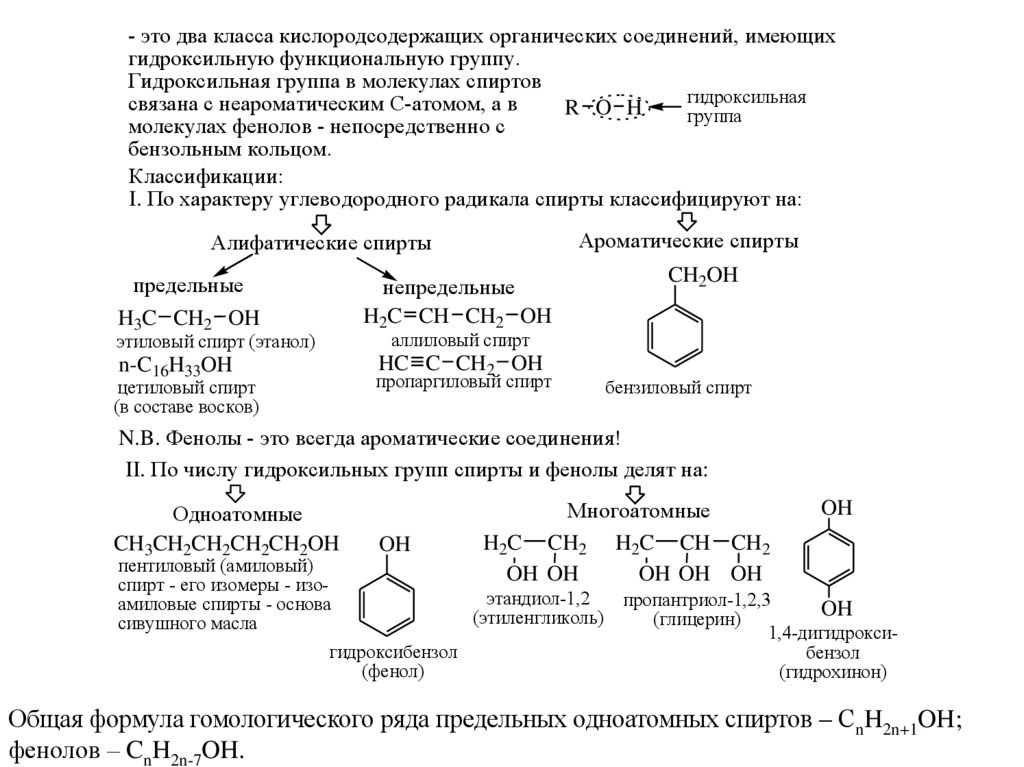
- это два класса кислородсодержащих органических соединений, имеющихгидроксильную функциональную группу.
Гидроксильная группа в молекулах спиртов
гидроксильная
связана с неароматическим С-атомом, а в
R O H
группа
молекулах фенолов - непосредственно с
бензольным кольцом.
Классификации:
I. По характеру углеводородного радикала спирты классифицируют на:
Ароматические спирты
Алифатические спирты
предельные
H3C CH2 OH
непредельные
H2C CH CH2 OH
CH2OH
аллиловый спирт
этиловый спирт (этанол)
HC C CH2 OH
n-C16H33OH
пропаргиловый спирт
цетиловый спирт
(в составе восков)
бензиловый спирт
N.B. Фенолы - это всегда ароматические соединения!
II. По числу гидроксильных групп спирты и фенолы делят на:
Одноатомные
CH3CH2CH2CH2CH2OH
пентиловый (амиловый)
спирт - его изомеры - изоамиловые спирты - основа
сивушного масла
OH
гидроксибензол
(фенол)
Многоатомные
H2C CH2 H2C CH CH2
OH OH OH
OH OH
этандиол-1,2
(этиленгликоль)
OH
пропантриол-1,2,3
OH
(глицерин)
1,4-дигидроксибензол
(гидрохинон)
Общая формула гомологического ряда предельных одноатомных спиртов – СnH2n+1OH;
фенолов – CnH2n-7OH.
3.
Номенклатура. Спирты называют от соответствующих углеводородов с окончанием«ол». Цифрой указывают номер С-атома, при котором находится OH-группа. Главную
цепь нумеруют с конца, ближайшего к OH- группе.
В фенолах атомы кольца нумеруют от ОН-группы к ближайшему заместителю.
Цифрами указывают положение заместителей, затем сами заместители и прибавляют
слово «фенол»: 4-метилфенол.
Изомерия спиртов (структурная). Например, брутто-формуле С4Н10O соответствуют
4 спирта 2 простых эфира:
1. Спирты (C4H10O)
а) первичные
4
3
2
б) вторичные
1
4
3
2
1
H3C CH2 CH2 CH2 OH
H3C CH2 CH CH3
бутанол-1 CH3
OH
3 2
1
бутанол-2
H3C CH CH2 OH
в) третичные
CH3
3
2 1
H3C C CH3
OH
2-метилпропанол-2
2-метилпропанол-1
2. Простые эфиры (C4H10O): H3C CH2 CH2 O CH3
метилпропиловый эфир
H3C
H3C CH2 O CH2 CH3
диэтиловый эфир
CH O CH3
H3C метилизопропиловый эфир
Спирты и простые эфиры – это межклассовые изомеры.
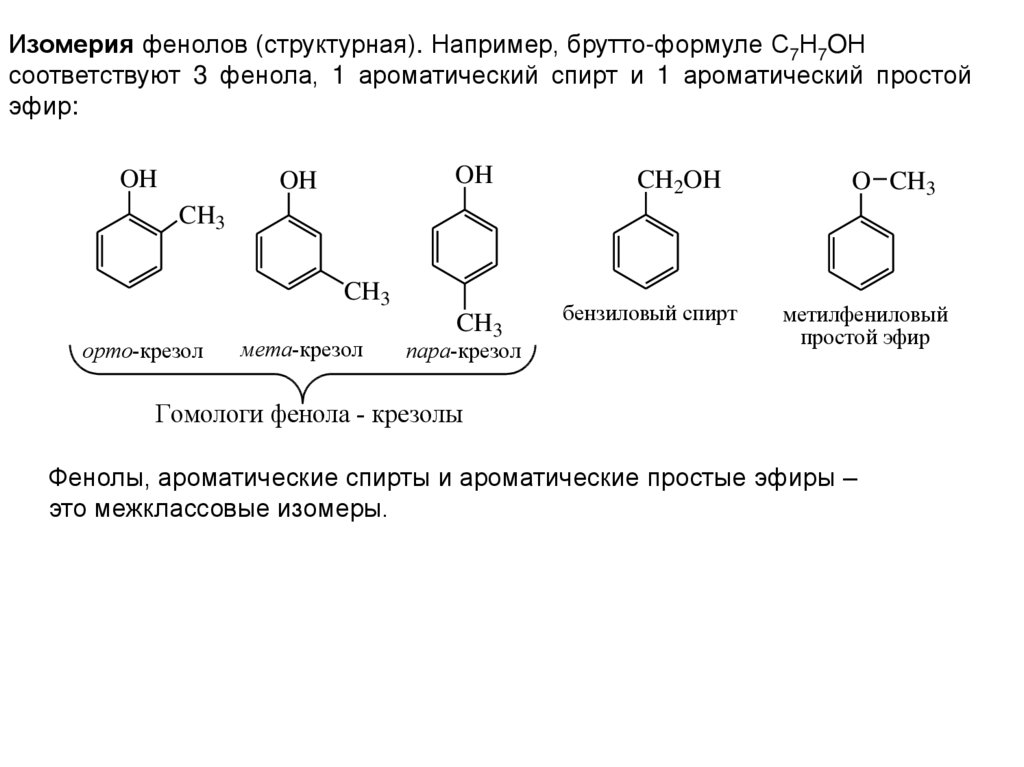
4.
Изомерия фенолов (структурная). Например, брутто-формуле С7Н7OНсоответствуют 3 фенола, 1 ароматический спирт и 1 ароматический простой
эфир:
OH
OH
OH
CH2OH
O CH3
CH3
CH3
орто-крезол
мета-крезол
CH3
пара-крезол
бензиловый спирт
метилфениловый
простой эфир
Гомологи фенола - крезолы
Фенолы, ароматические спирты и ароматические простые эфиры –
это межклассовые изомеры.
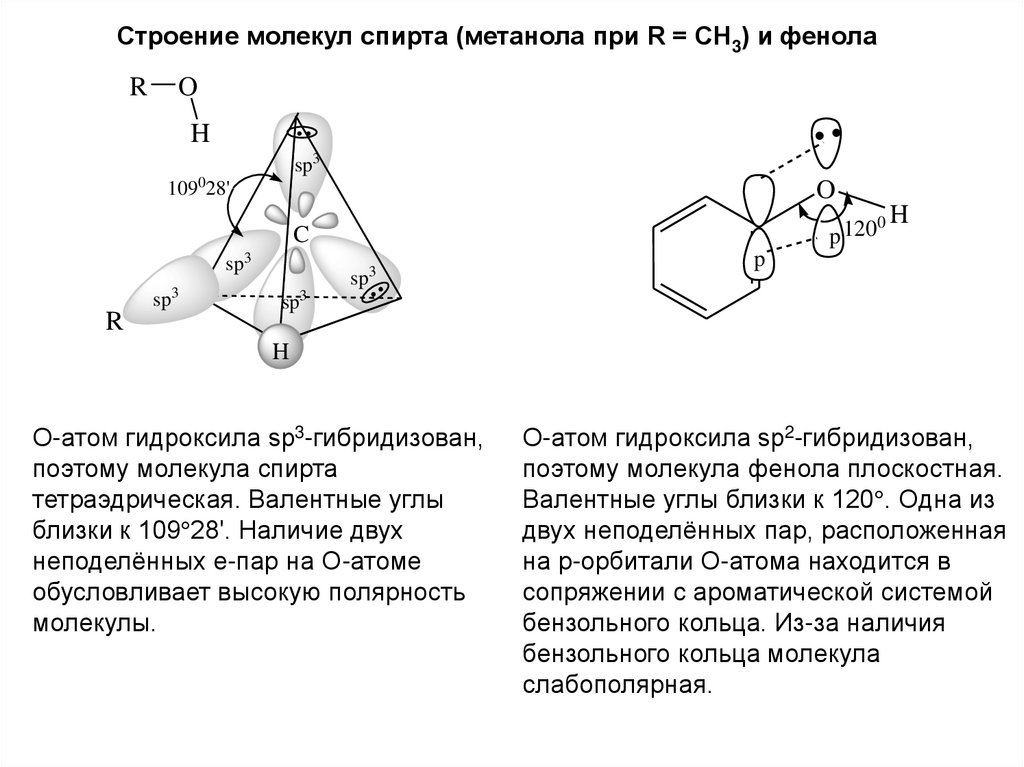
5.
Строение молекул спирта (метанола при R = CH3) и фенолаR
O
H
sp3
109028'
O
0H
p 120
C
sp3
sp3
R
sp
sp
3
p
3
H
О-атом гидроксила sp3-гибридизован,
поэтому молекула спирта
тетраэдрическая. Валентные углы
близки к 109 28'. Наличие двух
неподелённых е-пар на О-атоме
обусловливает высокую полярность
молекулы.
О-атом гидроксила sp2-гибридизован,
поэтому молекула фенола плоскостная.
Валентные углы близки к 120 . Одна из
двух неподелённых пар, расположенная
на р-орбитали О-атома находится в
сопряжении с ароматической системой
бензольного кольца. Из-за наличия
бензольного кольца молекула
слабополярная.
6.
Физические свойства.Спирты (С1-С11) – жидкости, начиная с С12 – кристаллические вещества.
Фенол и его низшие гомологи – низкоплавкие б/ц крист. вещества (искл. мкрезол – это жидкость). С увеличением С-цепи растут Т. кип. и Т. пл. У спиртов
и фенолов Т. кип. и Т. пл. выше, чем у соответствующих им углеводородов.
Причина в том, что между их молекулами присутствуют водородные связи.
O
R
H
O
R
H
O
R
H
O
R
H
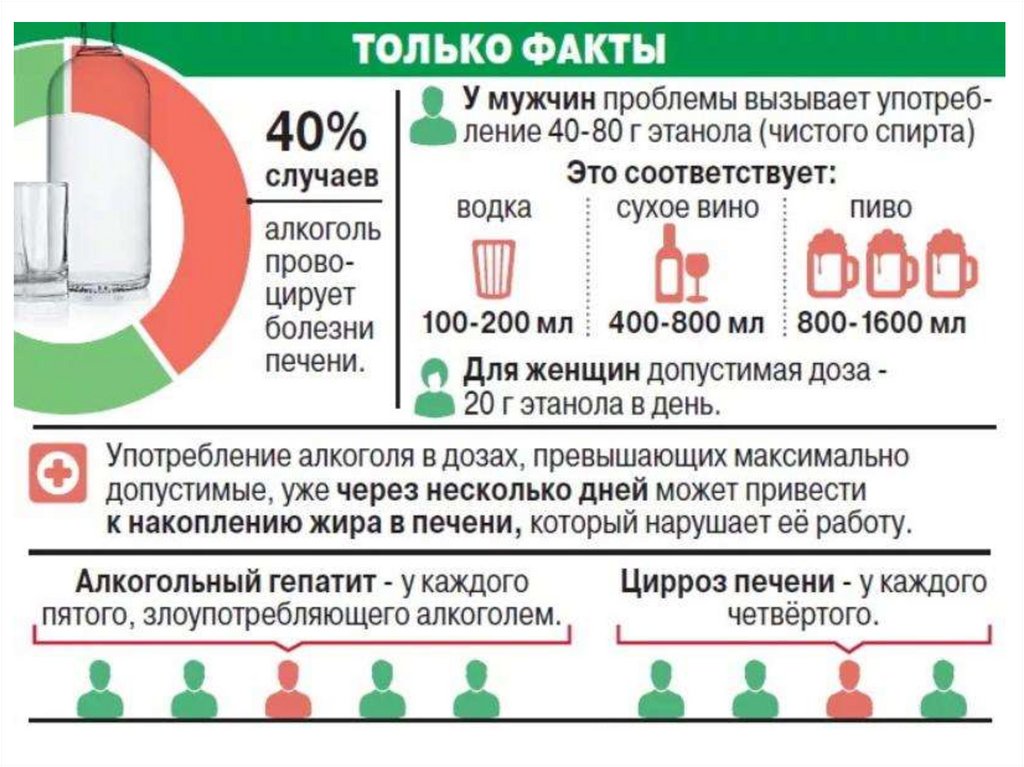
Спирты С1 – С3 и все фенолы ядовиты и имеют характерные запахи.
Фенол имеет резкий запах (им пахнет гуашь, т.к. фенол добавляют в гуашь в
качестве антисептика). Многоатомные фенолы не пахнут.
Спирты неограниченно растворяются в воде. С увеличением С-цепи
(неполярной части молекулы) растворимость в воде уменьшается. Так,
цетиловый спирт в воде не растворяется. Ароматические спирты и фенолы
плохо растворимы в воде, из-за наличия в их молекулах неполярного
бензольного кольца. 40%-Ный водный раствор фенола – это карболовая
кислота («карболка»), которую используют для дезинфекции поверхностей.
Многоатомные фенолы растворяются в воде лучше одноатомных из-за
дополнительных водородных связей.
7.
8.
Химические свойства.Спирты - амфотерные соединения, так как могут проявлять как свойства кислот,
так и свойства оснований. Фенолы – это органические кислоты.
Сравним их кислотные свойства в следующем ряду:
H2C OH H2C OH
-I
HC OH
C2H5 O H O H2C O
CH O
H HC O H
H
H
H
H3C
2
H3C
O H
полярность связи О-Н растёт, кислотные свойства увеличиваются
Кислотные свойства тем выше, чем выше полярность связи О-Н. Донорные
радикалы уменьшают полярность связи О-Н и кислотные свойства, а
акцепторные, наоборот, увеличивают. В молекуле фенола неподелённая
пара электронов О-атома находится в сопряжении с -электронами
бензольного кольца. Поэтому электронная плотность смещается в сторону
бензольного кольца, что повышает полярность связи –О Н и увеличивает
кислотные свойства. Кислотные свойства у фенолов выражены сильнее,
чем у воды и спиртов!
9.
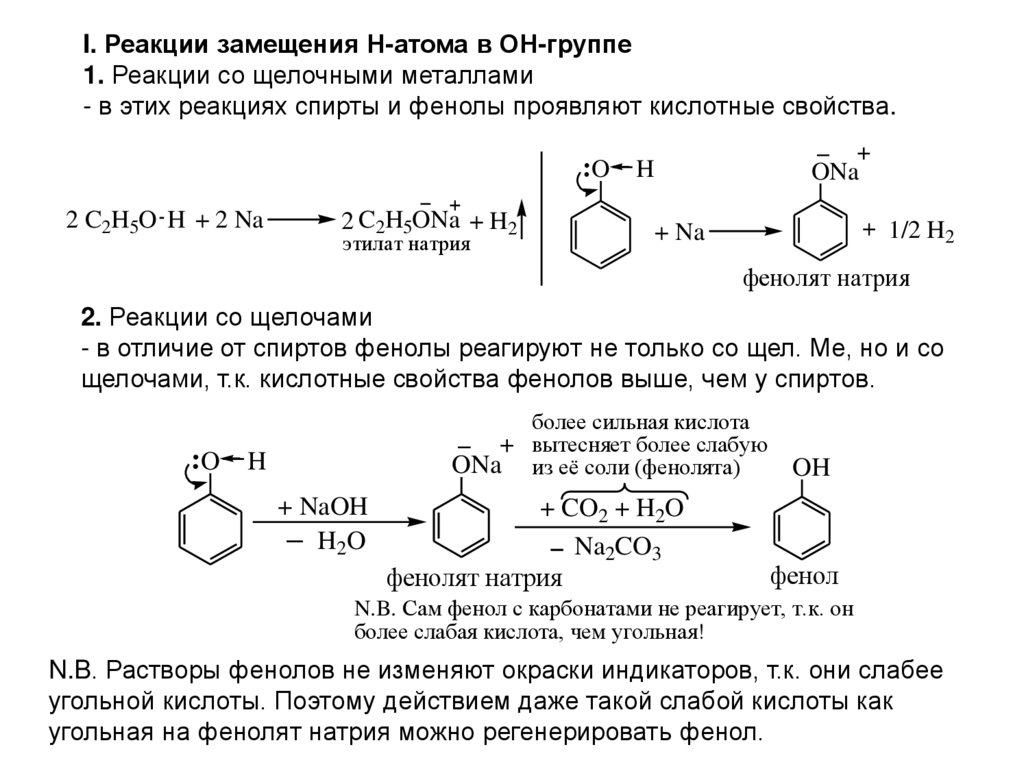
I. Реакции замещения Н-атома в ОН-группе1. Реакции со щелочными металлами
- в этих реакциях спирты и фенолы проявляют кислотные свойства.
O
2 C2H5O H + 2 Na
2 C2H5ONa + H2
этилат натрия
H
ONa
1/2 H2
+ Na
фенолят натрия
2. Реакции со щелочами
- в отличие от спиртов фенолы реагируют не только со щел. Ме, но и со
щелочами, т.к. кислотные свойства фенолов выше, чем у спиртов.
O
H
ONa
+ NaOH
H2O
более сильная кислота
вытесняет более слабую
из её соли (фенолята)
+ CO2 + H2O
Na2CO3
фенолят натрия
OH
фенол
N.B. Сам фенол с карбонатами не реагирует, т.к. он
более слабая кислота, чем угольная!
N.B. Растворы фенолов не изменяют окраски индикаторов, т.к. они слабее
угольной кислоты. Поэтому действием даже такой слабой кислоты как
угольная на фенолят натрия можно регенерировать фенол.
10.
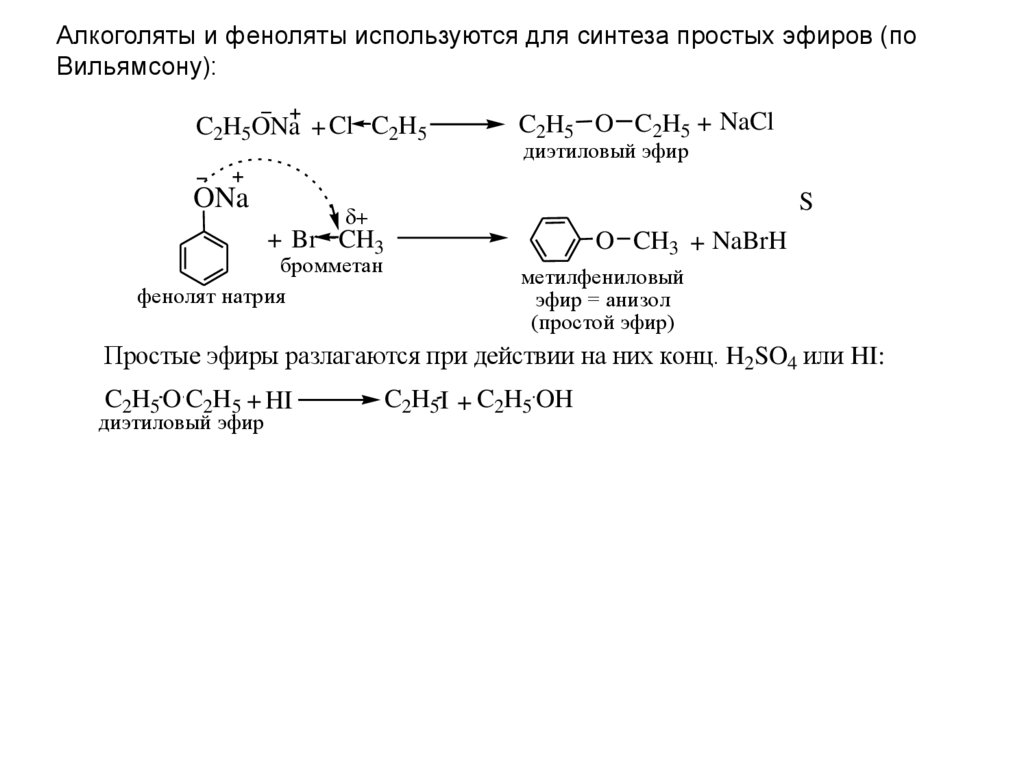
Алкоголяты и феноляты используются для синтеза простых эфиров (поВильямсону):
C2H5ONa + Cl C2H5
ONa
C2H5 O C2H5 + NaCl
диэтиловый эфир
S
+ Br CH3
бромметан
фенолят натрия
O CH3 + NaBrH
метилфениловый
эфир = анизол
(простой эфир)
Простые эфиры разлагаются при действии на них конц. H2SO4 или HI:
C2H5 O C2H5 + HI
диэтиловый эфир
C2H5I + C2H5 OH
11.
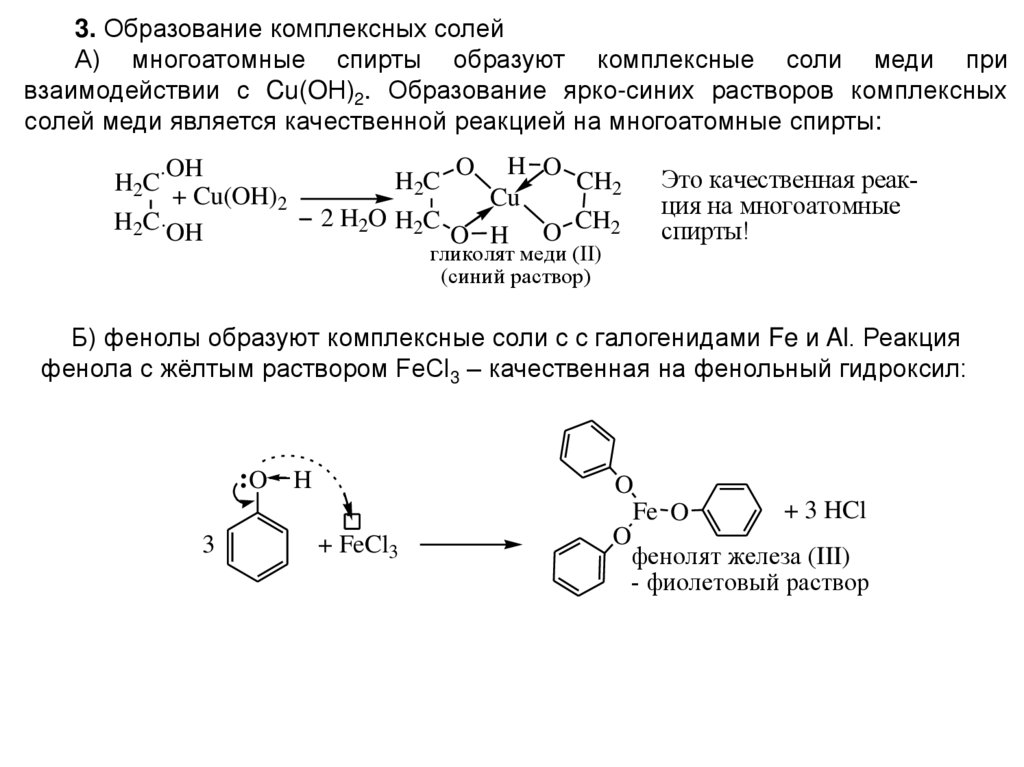
3. Образование комплексных солейА) многоатомные спирты образуют комплексные соли меди при
взаимодействии с Cu(OН)2. Образование ярко-синих растворов комплексных
солей меди является качественной реакцией на многоатомные спирты:
H O
CH2
Cu
2 H2O H2C
CH2
O H O
OH
+ Cu(OH)2
H2C OH
H2C
H2C
O
гликолят меди (II)
(синий раствор)
Это качественная реакция на многоатомные
спирты!
Б) фенолы образуют комплексные соли с с галогенидами Fe и Al. Реакция
фенола с жёлтым раствором FeCl3 – качественная на фенольный гидроксил:
O
3
H
+ FeCl3
O
+ 3 HCl
Fe O
O
фенолят железа (III)
- фиолетовый раствор
12.
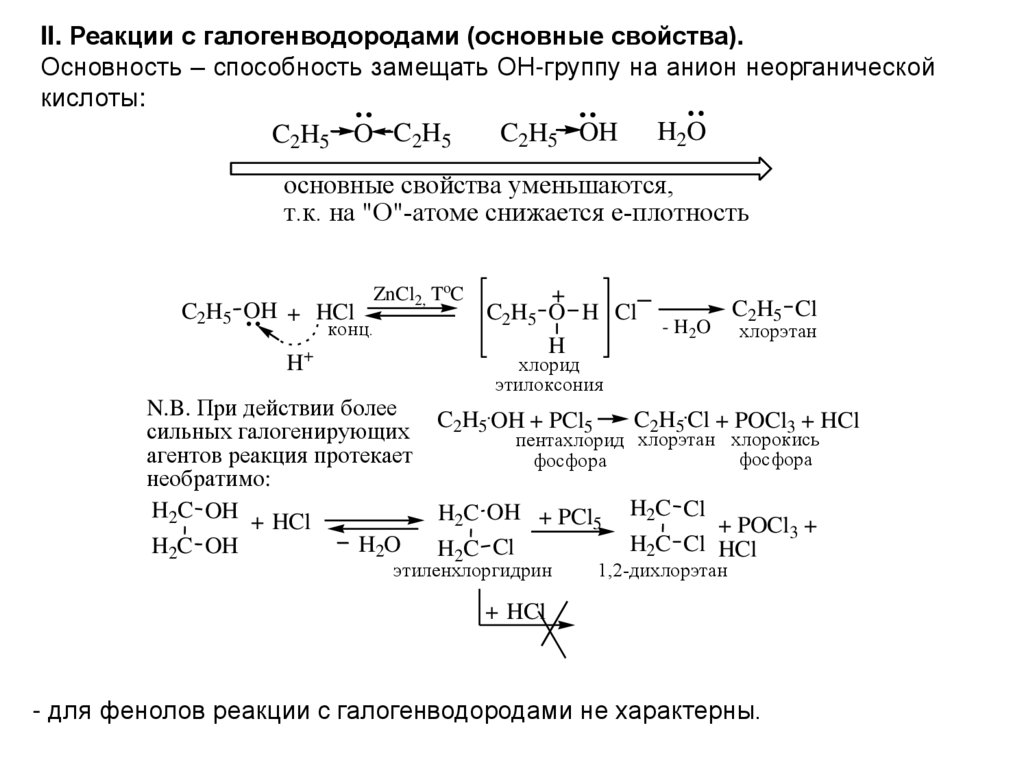
II. Реакции с галогенводородами (основные свойства).Основность – способность замещать ОН-группу на анион неорганической
кислоты:
C2H5 OH H2O
C2H5 O C2H5
основные свойства уменьшаются,
т.к. на "О"-атоме снижается е-плотность
C2H5 OH + HCl
ZnCl2, ToC
конц.
H+
N.B. При действии более
сильных галогенирующих
агентов реакция протекает
необратимо:
H2C OH + HCl
H2O
H2C OH
+
C2H5 O H Cl
H
- H2O
C2H5 Cl
хлорэтан
хлорид
этилоксония
C2H5 OH + PCl5
C2H5 Cl + POCl3 + HCl
H2C OH + PCl5
H2C Cl
H2C Cl
+ POCl3 +
H2C Cl HCl
пентахлорид хлорэтан хлорокись
фосфора
фосфора
этиленхлоргидрин
1,2-дихлорэтан
+ HCl
- для фенолов реакции с галогенводородами не характерны.
13.
III. Этерификация спиртов неорганическими и органическими кислотами:А) спирт + кислородсодержащая неорганическая кислота
Пропитывая нитроглицерином
разные наполнители, получают
H2C OH + HONO2
H2C O NO2
H2SO4
динамит (изобрёл А. Нобель).
HC OH + HONO2
HC O NO2 + 3 H2O Раствор нитроглицерина
используют как лекарственH2C OH + HONO2
H2C O NO2
ный препарат для лечения
азотная кислота
тринитрат глицерина
болезней сердца.
(нитроглицерин)
Из письма А. Нобеля:
«Разве не ирония судьбы, что мне
прописали принимать нитроглицерин?».
А. Нобель
(1833 - 1896)
Б) спирт + карбоновая кислота
O
C2H5OH + C CH3
HO
H+, T0C
H3C C
O
+ H2O
O C2H5
этилацетат (сложный эфир)
- фенолы с карбоновыми кислотами не реагируют
Памятник А. Нобелю
на Петроградской
набережной СПб
(этерификация)
14.
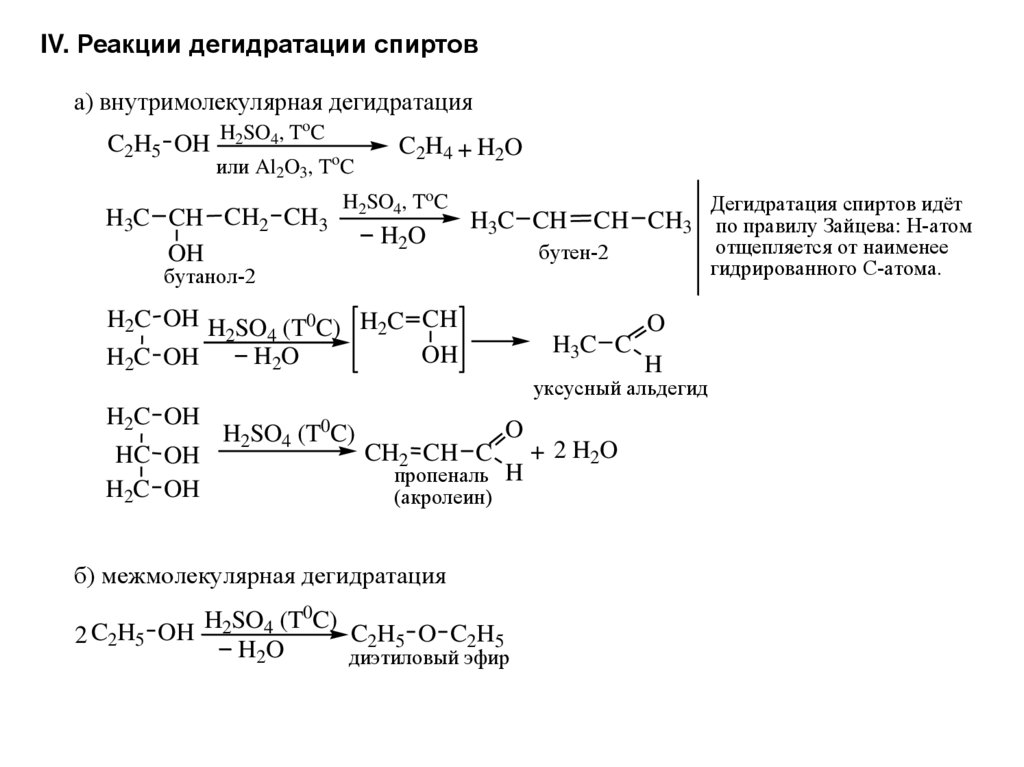
IV. Реакции дегидратации спиртова) внутримолекулярная дегидратация
o
C2H5 OH H2SO4, T C
или Al2O3, ToC
H3C CH CH2 CH3
OH
C2H4 + H2O
H2SO4, ToC
H2O
H3C CH
Дегидратация спиртов идёт
CH CH3 по правилу Зайцева: Н-атом
отщепляется от наименее
гидрированного С-атома.
бутен-2
бутанол-2
H2C OH H SO (T0C) H2C CH
2
4
OH
H2O
H2C OH
H3C C
O
H
уксусный альдегид
H2C OH
HC OH
H2C OH
H2SO4 (T0C)
O
CH2 CH C
пропеналь H
(акролеин)
б) межмолекулярная дегидратация
0
H
SO
(T
C)
2
4
C2H5 O C2H5
2 C2H5 OH
H2O
диэтиловый эфир
+ 2 H2O
15.
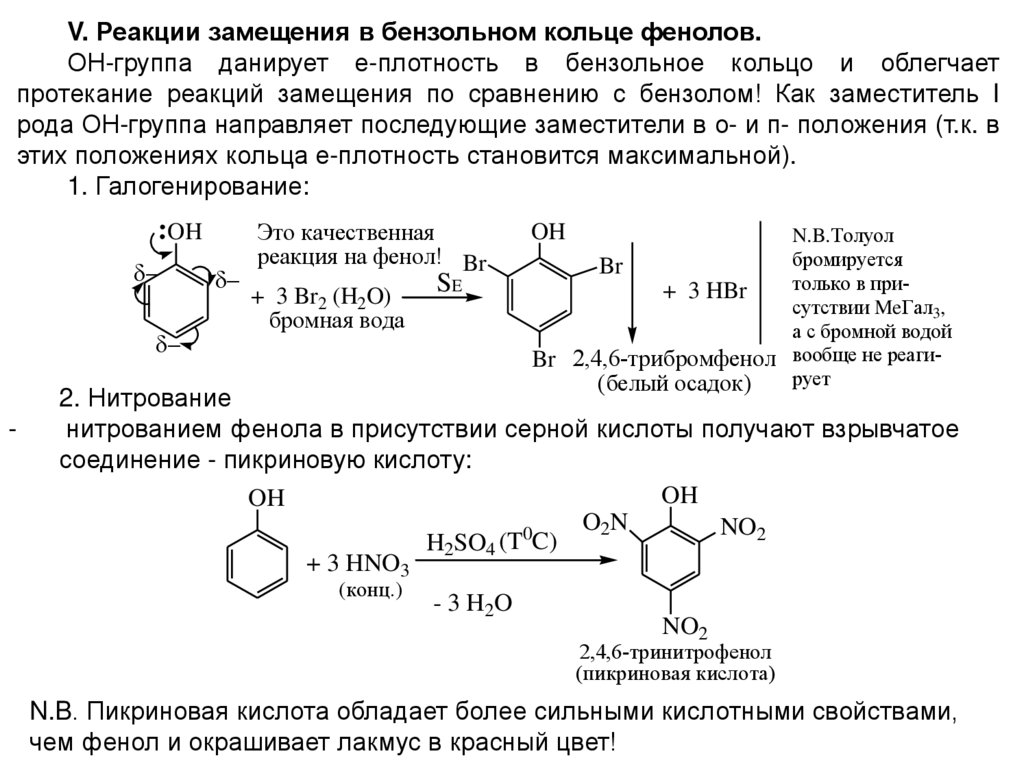
V. Реакции замещения в бензольном кольце фенолов.ОН-группа данирует е-плотность в бензольное кольцо и облегчает
протекание реакций замещения по сравнению с бензолом! Как заместитель I
рода ОН-группа направляет последующие заместители в о- и п- положения (т.к. в
этих положениях кольца е-плотность становится максимальной).
1. Галогенирование:
OH
-
Это качественная
реакция на фенол! Br
SE
+ 3 Br2 (H2O)
бромная вода
OH
N.B.Толуол
бромируется
Br
только в при+ 3 HBr
сутствии MeГал3,
а с бромной водой
Br 2,4,6-трибромфенол вообще не реагирует
(белый осадок)
2. Нитрование
нитрованием фенола в присутствии серной кислоты получают взрывчатое
соединение - пикриновую кислоту:
OH
OH
O2N
NO2
H2SO4 (T0C)
+ 3 HNO3
(конц.)
- 3 H2O
NO2
2,4,6-тринитрофенол
(пикриновая кислота)
N.B. Пикриновая кислота обладает более сильными кислотными свойствами,
чем фенол и окрашивает лакмус в красный цвет!
16.
VI. Окисление спиртов и фенолов-по продуктам окисления спирта можно сделать вывод о его строении:
[O]
[O]
первичные спирты
альдегиды вторичные спирты
кетоны
0
O
0
T
C H C C CH
T
C
H3C CH CH3 + CuO
H3C C
C2H5 OH + CuO
3
3
Cu
Cu
H
этанол
уксусный
OH
O
H2O диметилкетон
H2O альдегид
изопропиловый
спирт
При действии более сильных окислителей возможно окисление первичных спиртов
до карбоновых кислот (вторичные спирты и в этом случае окислятся до кетонов):
O
N.B. Качественная реакция!
[KMnO4 + H2SO4]
H3C C
C2H5 OH
Наблюдается обесцвечивание
OH
уксусная
этанол
фиолет. р-ра KMnO
4
кислота
O
o
T
C
3
+ 2 Cr2(SO4)3 + 2 K2SO4 + 11 H2O
H
C
C
3 C2H5 OH + 2 K2Cr2O7 + 8 H2SO4
3
уксусная OH синий окрас
этанол
кислота
N.B. Качественная реакция ГИБДД! Наблю"Трубочка посинела дается посинение сорбента, пропитанного хромовой смесью.
водитель пьян"
При окислении диолов образуются двухосновные карбоновые кислоты:
H2C OH [KMnO4 + H2SO4] COOH
H2C OH
этиленгликоль
COOH
щавелевая кислота
17.
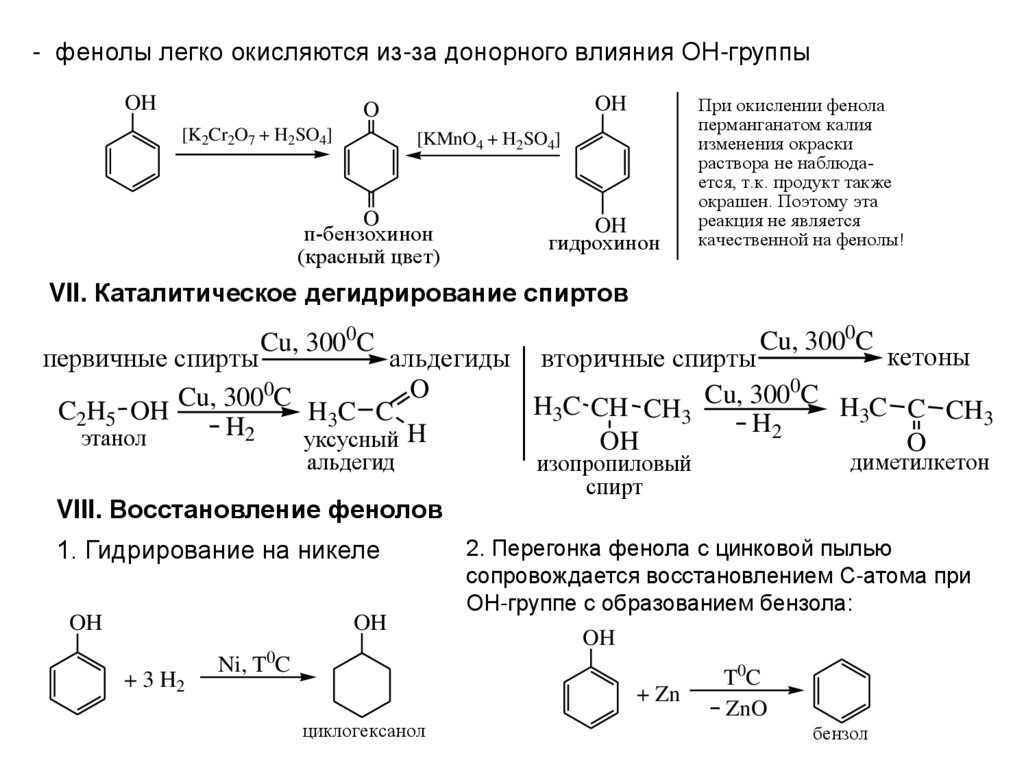
- фенолы легко окисляются из-за донорного влияния ОН-группыOH
OH
O
[K2Cr2O7 + H2SO4]
[KMnO4 + H2SO4]
O
п-бензохинон
(красный цвет)
OH
гидрохинон
При окислении фенола
перманганатом калия
изменения окраски
раствора не наблюдается, т.к. продукт также
окрашен. Поэтому эта
реакция не является
качественной на фенолы!
VII. Каталитическое дегидрирование спиртов
Cu, 3000C
Cu, 3000C
кетоны
первичные спирты
альдегиды вторичные спирты
0
O
Cu,
300
C HC
Cu, 3000C
H
C
C CH3
C2H5 OH
H3C C
3 CH CH3
3
H
H
2
2
этанол
уксусный H
OH
O
альдегид
VIII. Восстановление фенолов
1. Гидрирование на никеле
OH
OH
2. Перегонка фенола с цинковой пылью
сопровождается восстановлением С-атома при
ОН-группе с образованием бензола:
OH
0
+ 3 H2
Ni, T C
+ Zn
циклогексанол
диметилкетон
изопропиловый
спирт
T0C
ZnO
бензол
18.
Получение и применение спиртов и фенолов.I. Получение спиртов
1. Общие способы получения
а) Гидратация алкенов (см. тему «Алкены»).
б) Щелочной гидролиз галогеналканов: H2C Cl
+ 2 NaOH
C2H5Cl + NaOH
водный
C2H5OH + NaCl H2C Cl
хлорэтан
водный
раствор
этанол
H2C OH
+ 2 NaCl
H2C OH
1,2-дихлорэтан раствор этиленгликоль
2. Частные способы получения.
а) Метанол получают из синтез-газа или в результате неполного окисления
метана:
CO + 2 H2
ZnO/Al2O3 (P, T0C)
CH3OH
2 CH4 + O2
Mn2+ (T0C)
синтез-газ
2 CH3OH
б) Этанол может быть получен в результате ферментативного гидролиза
крахмала (брожение) или смешанного гидролиза целлюлозы:
(C6H10O5)n
крахмал или
целлюлоза
+ n H2O
(дрожжи или H+)
спиртовое
брожение
n C6H12O6 (ферменты
глюкоза дрожжей)
2n C2H5OH + 2n CO2
пищевой этанол
19.
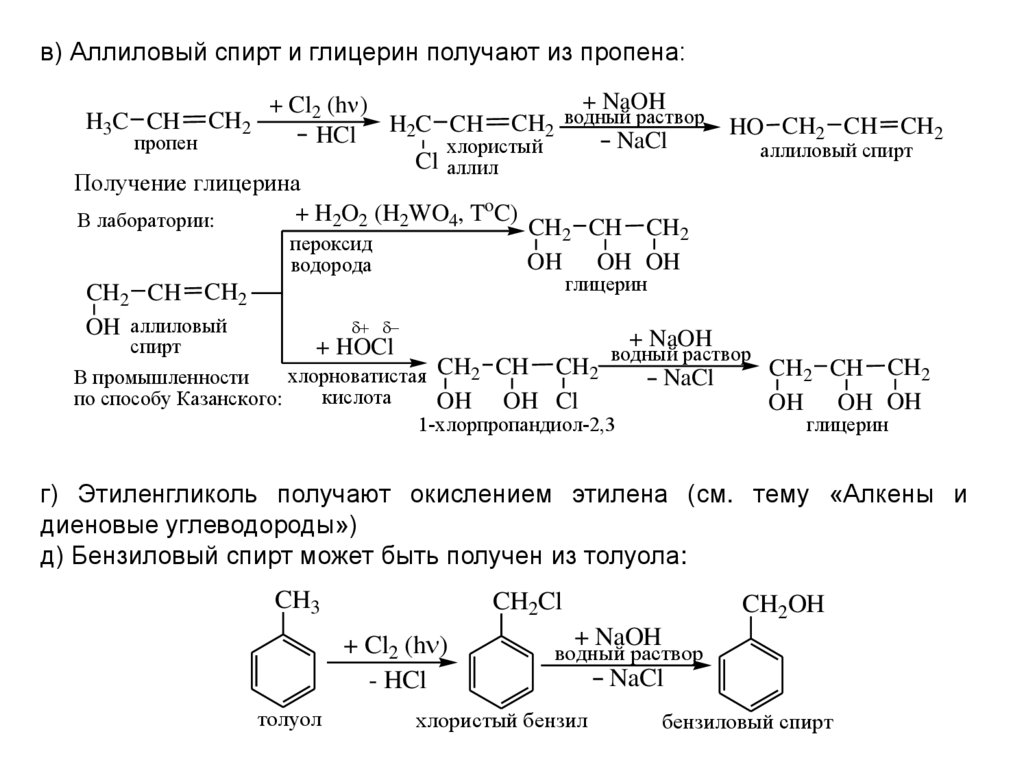
в) Аллиловый спирт и глицерин получают из пропена:+ NaOH
+ Cl2 (h )
водный
раствор
CH
H
C
CH
HO CH2 CH CH2
2
2
HCl
NaCl
пропен
хлористый
аллиловый спирт
Cl аллил
Получение глицерина
+ H2O2 (H2WO4, ToC)
В лаборатории:
CH2 CH CH2
пероксид
OH OH OH
водорода
глицерин
CH2 CH CH2
OH аллиловый
+ NaOH
спирт
+ HOCl
водный раствор
CH2 CH CH2
хлорноватистая CH2 CH CH2
В промышленности
NaCl
кислота
по способу Казанского:
OH OH Cl
OH OH OH
H3C CH
CH2
1-хлорпропандиол-2,3
глицерин
г) Этиленгликоль получают окислением этилена (см. тему «Алкены и
диеновые углеводороды»)
д) Бензиловый спирт может быть получен из толуола:
CH3
CH2Cl
+ Cl2 (h )
- HCl
толуол
CH2OH
+ NaOH
водный раствор
хлористый бензил
NaCl
бензиловый спирт
20.
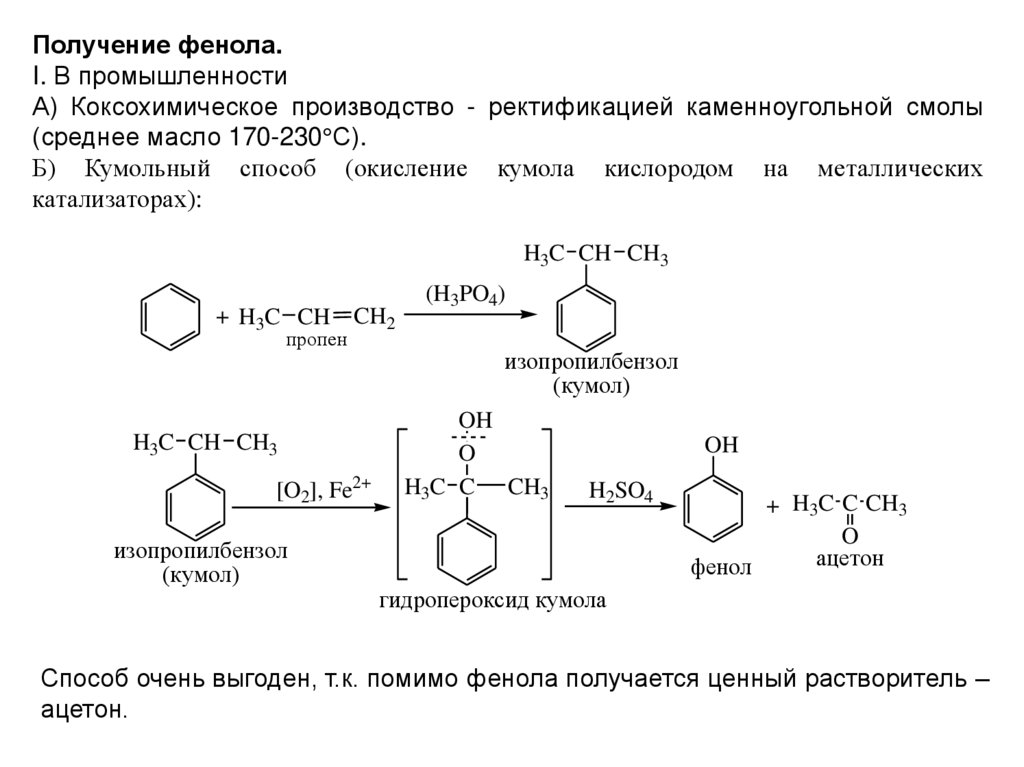
Получение фенола.I. В промышленности
А) Коксохимическое производство - ректификацией каменноугольной смолы
(среднее масло 170-230 С).
Б) Кумольный способ (окисление кумола кислородом на металлических
катализаторах):
H3C CH CH3
+ H3C CH CH2
пропен
H3C CH CH3
[O2], Fe2+
изопропилбензол
(кумол)
(H3PO4)
изопропилбензол
(кумол)
OH
O
H3C C CH3
OH
H2SO4
+ H3C C CH3
O
ацетон
фенол
гидропероксид кумола
Способ очень выгоден, т.к. помимо фенола получается ценный растворитель –
ацетон.
21.
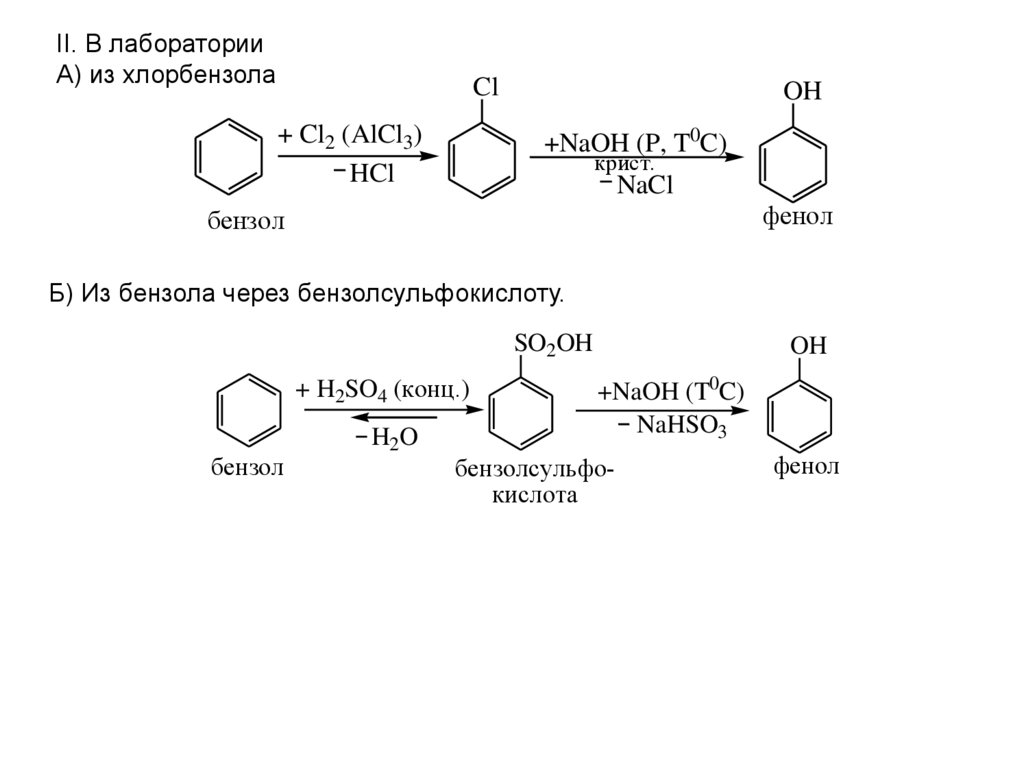
II. В лабораторииА) из хлорбензола
Cl
+ Cl2 (AlCl3)
HCl
OH
+NaOH (P, T0C)
крист.
NaCl
фенол
бензол
Б) Из бензола через бензолсульфокислоту.
SO2OH
+ H2SO4 (конц.)
бензол
H2O
OH
+NaOH (T0C)
NaHSO3
бензолсульфокислота
фенол
22.
Применение спиртов и фенолов.Одноатомные спирты используют как растворители, добавки,
улучшающих свойства бензина, сырьё в орг. синтезе. Так, этанол – основное
сырьё при производстве каучука (см. тему «Алкены и диены»), уксусной
кислоты, алкогольных напитков. Двухатомный спирт этиленгликоль антифриз и исходное вещество для получения искусственных волокон
(лавсан). Глицерин применяется в пищевой промышленности, парфюмерии и
медицине. На его основе получают взрывчатые и лекарственные вещества.
Фенол – один из ключевых синтонов для получения красителей (см. тему
«Амины»),
взрывчатых
веществ
(пикриновая
кислота),
фенолформальдегидных смол, полиамидных синтетических волокон (капрон
и найлон) (см. тему «Волокна»), салициловой кислоты и лекарственных
препаратов на её основе (аспирин).
Роль спиртов и фенолов в природе.
Производные спиртов входят в состав жиров (глицерин), липидов
клеточных мембран, нейромедиаторов (холин).








 Химия
Химия