Похожие презентации:
Спирты и простые эфиры
1.
Спирты и простые эфиры.Классификация, номенклатура и изомерия. Способы получения.
Физические свойства: влияние водородной связи на температуры кипения и
растворимость спиртов. Характеристика связей С–О и О–Н: полярность, поляризуемость,
способ разрыва.
Кислотные свойства. Взаимодействие со щелочными металлами, сильными
основаниями, образование алкоголятов.
Основные свойства, взаимодействие с минеральными кислотами и кислотами Льюиса с
образованием оксониевых солей.
Реакции нуклеофильного замещения гидроксильной группы. Роль кислотного катализа.
Реакции внутримолекулярной и межмолекулярной дегидратации с образованием алкенов и
простых эфиров. Реакции спиртов и алкоголятов щелочных металлов как нуклеофильных
реагентов:
алкилирование
и
ацилирование,
получение
сложных
эфиров
кислородсодержащих минеральных и карбоновых кислот. Реакция этерификации.
Окисление первичных и вторичных спиртов. Физиологическое действие метилового и
этилового спиртов. Применение спиртов.
Многоатомные спирты. Особенности кислотных свойств α-гликолей – реакция с
гидроксидами металлов. Изменение кислотности в ряду одноатомных и многоатомных
спиртов.
Простые эфиры. Номенклатура. Получение дегидратацией спиртов и реакцией
Вильямсона. Физические и химические свойства: образование оксониевых солей с
протонными и апротонными кислотами; расщепление эфирной связи С–О; автоокисление с
образованием гидроперекисей. Диэтиловый эфир, эфиры диэтиленгликоля, диоксан. Их
применение в органическом синтезе и промышленности.
2.
Спирты – производныеуглеводородов у которых
один или несколько атомов
водорода замещены на
гидроксильную группу ОН.
3.
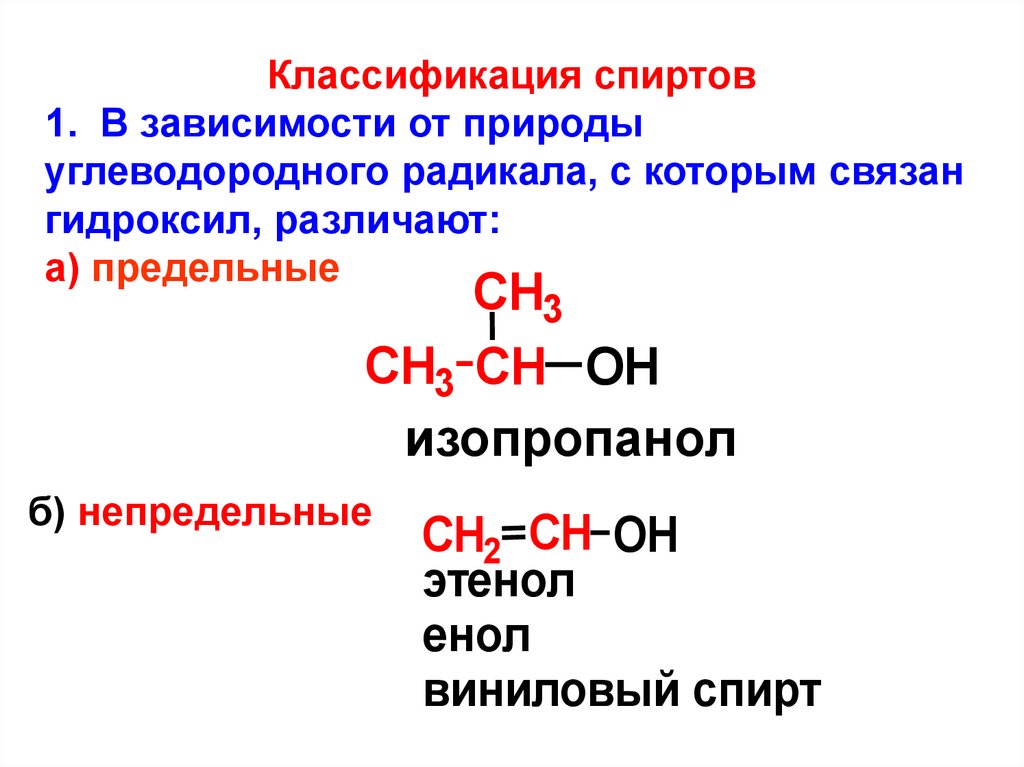
Классификация спиртов1. В зависимости от природы
углеводородного радикала, с которым связан
гидроксил, различают:
а) предельные
CH3
СH3 CH OH
изопропанол
б) непредельные
СH2 CH OH
этенол
енол
виниловый спирт
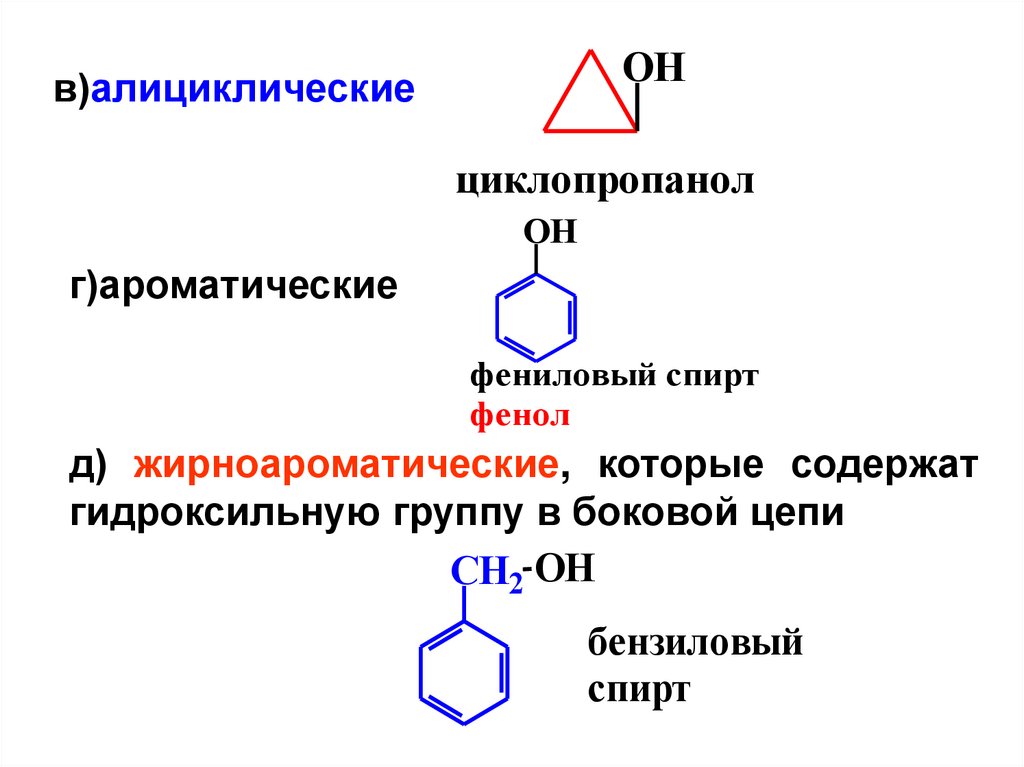
4.
OHв)алициклические
циклопропанол
OH
г)ароматические
фениловый спирт
фенол
д) жирноароматические, которые содержат
гидроксильную группу в боковой цепи
CH2 OH
бензиловый
спирт
5.
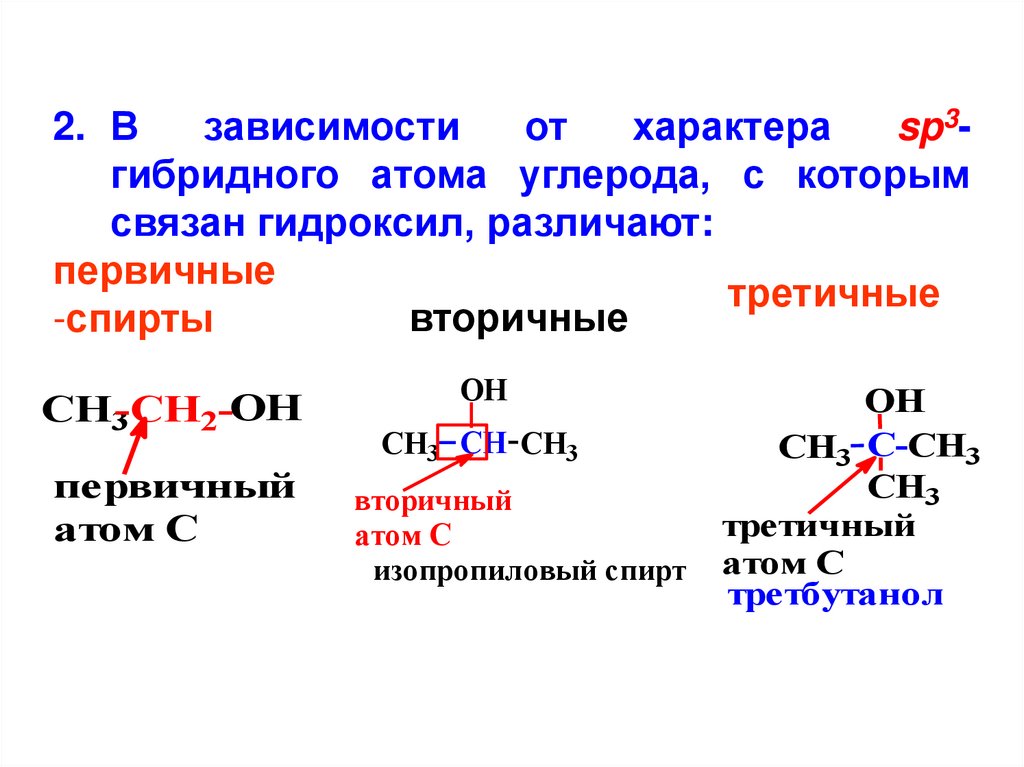
2. Взависимости
от
характера
sp3гибридного атома углерода, с которым
связан гидроксил, различают:
первичные
третичные
вторичные
-спирты
СH3-СH2-OH
первичный
атом С
OH
СH3 CH CH3
вторичный
атом С
изопропиловый спирт
OH
СH3 С-CH3
CH3
третичный
атом С
третбутанол
6.
7.
3. В зависимости от числа гидроксильныхгрупп различают:
-одноатомные спирты
OH
СH3 CH CH2 CH3
-двухатомные
OH OH
СH3 CH CH CH3
бутандиол-2,3
- многоатомные – тема «Углеводы»
8.
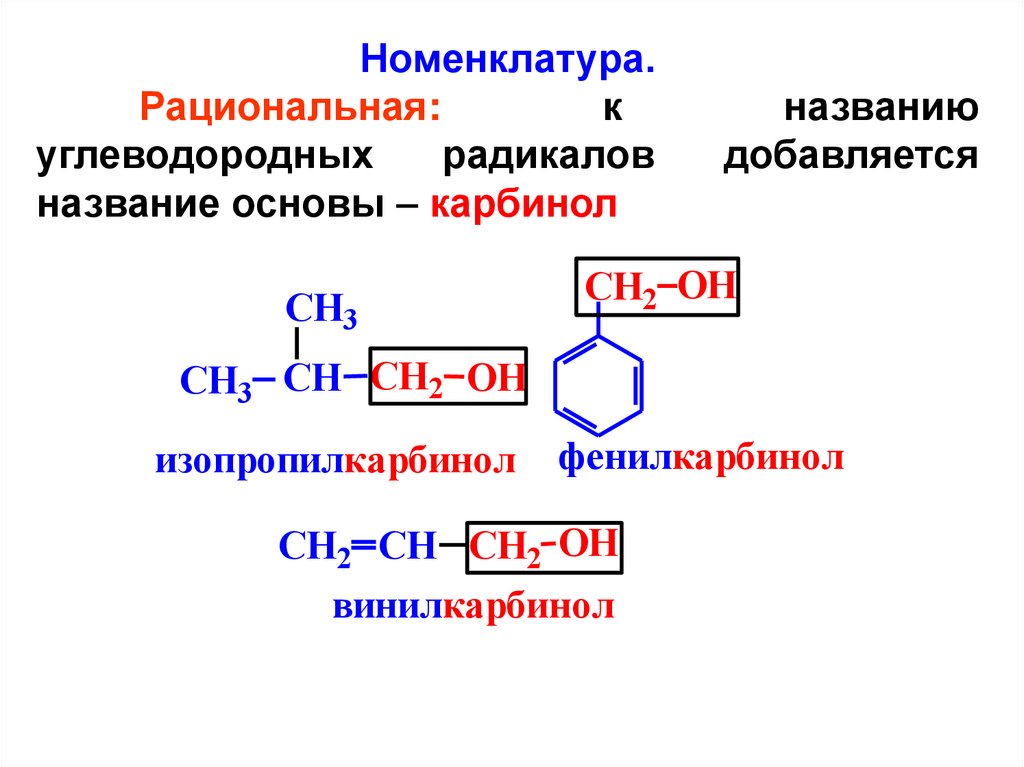
Номенклатура.Рациональная:
к
углеводородных
радикалов
название основы – карбинол
CH3
названию
добавляется
CH2 OH
СH3 CH CH2 OH
изопропилкарбинол
фенилкарбинол
CH2 CH CH2 OH
винилкарбинол
9.
Систематическая: -к названию главнойцепи, добавляют суффикс – ол, с указанием
номера
атома
углерода,
указывающего
положение гидроксила;
-если есть более старшие функциональные
группы
(например,
карбонильная),
то
присутствие
ОН
группы
обозначают
приставкой – гидрокси
6
5
4
CH2 CH3
3
2
1
СH2 CH CH2 C CH CH3
OH
3-этилгексен-5-ол-3
5 4 OH 3
2 1 O
СH3 CH CH2 CH C
OH
Cl
10.
Способы получения1. Реакции гидролиза галогенопроизводных
углеводородов
CH3 CH CH2 CH3
+ NaOH
-NaCl
CH3 CH CH2 CH3
OH
Cl
2. Гидратация алкенов (присоединение воды)
CH3 C CH CH3 + HOH
CH3
H2SO4
OH
CH3 C CH2 CH3
CH3
2-метилбутанол-2
11.
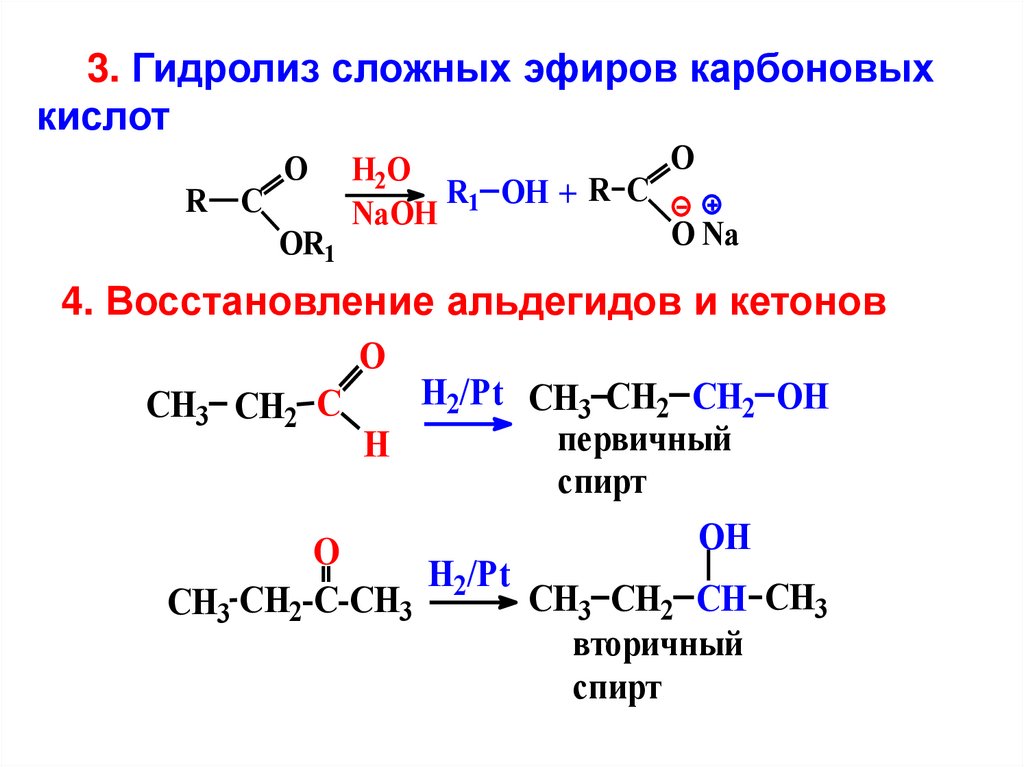
3. Гидролиз сложных эфиров карбоновыхкислот
O
H2O
R1 OH + R C
R C
NaOH
O Na
OR1
O
4. Восстановление альдегидов и кетонов
O
H2/Pt CH3 CH2 CH2 OH
CH3 CH2 C
первичный
H
спирт
OH
O
H2/Pt
CH3 CH2 CH CH3
CH3 CH2-C-CH3
вторичный
спирт
12.
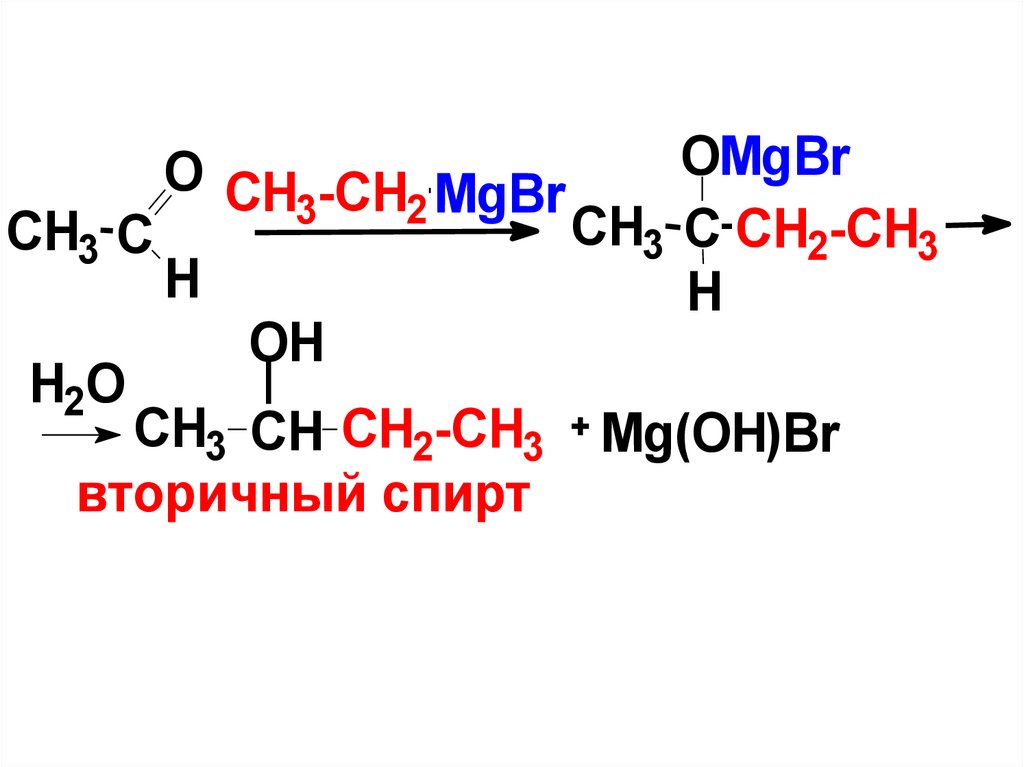
5Реакции
соединениями.
с
O
H С
магнийорганическими
OMgBr
CH3 MgBr
H C CH3
H
H
CH3-CH2-OH + Mg(OH)Br
первичный спирт
H2O
13.
CH3 СH2O
O CH -CH MgBr
3
2
H
OH
CH3 CH CH2-CH3
вторичный спирт
OMgBr
CH3 C CH2-CH3
H
Mg(OH)Br
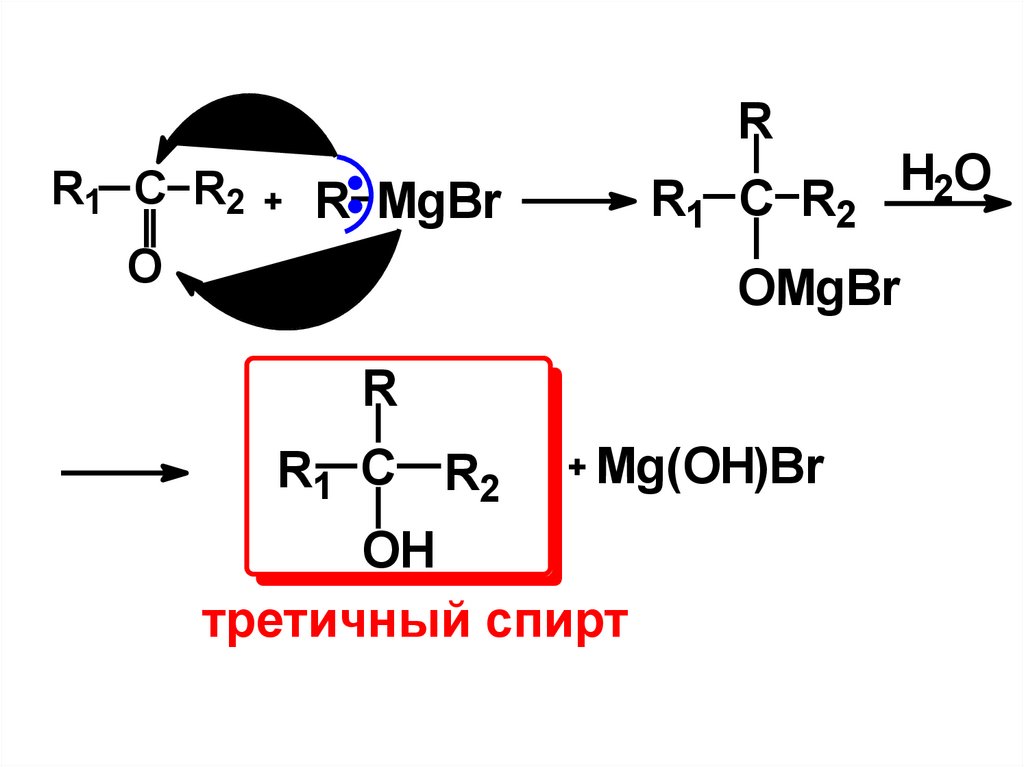
14.
RR1 C R2
R1 C R2
R MgBr
O
H2O
OMgBr
R
R1 C R2
Mg(OH)Br
OH
третичный спирт
15.
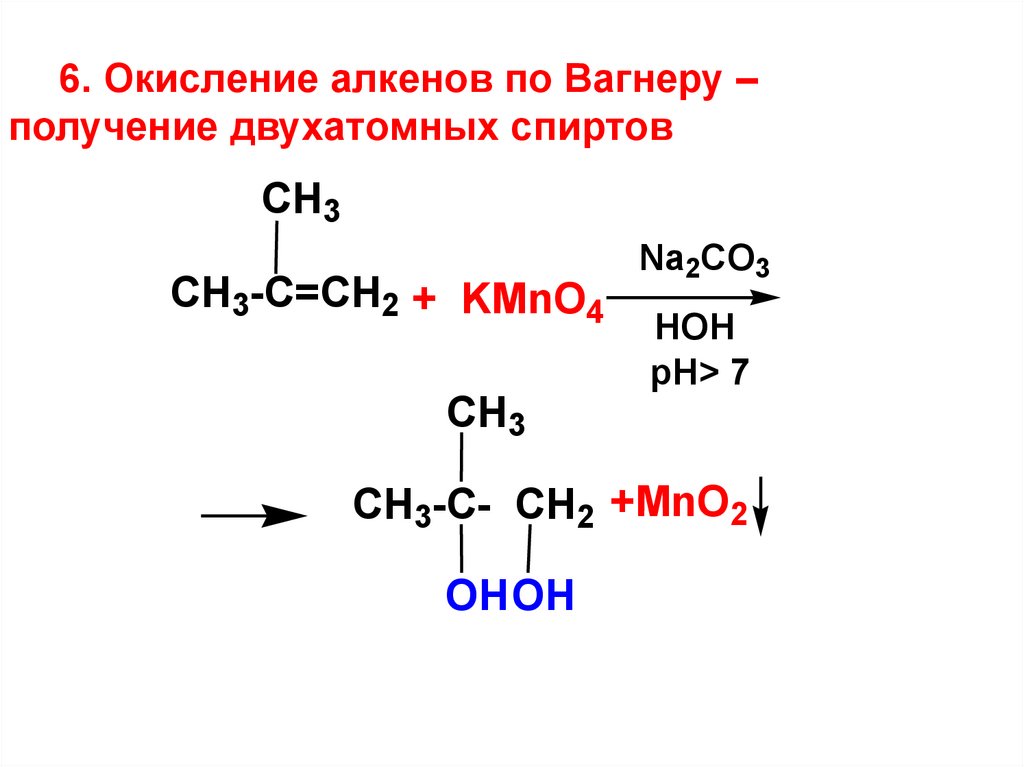
6. Окисление алкенов по Вагнеру –получение двухатомных спиртов
CH3
CH3-C=CH2 + KMnO4
CH3
Na2CO3
HOH
pH> 7
CH3-C- CH2 +MnO2
OHOH
16.
Физические свойства спиртовС1–С11 - жидкости
С12 и выше – твердые вещества
Ткип
спиртов
выше,
чем
соответствующих
алканов
галогенопроизводных УВ.
СН3-СН3 – 88,6оС (газ)
СH3Сl
– 24,2оС (газ)
CH3OH
64,7 (жидкость)
НО-СН2-СН2-ОН 197 оС
НО-СН2СН(ОН)-СН2ОН 290оС
у
или
17.
Высокие температуры кипения спиртовможно объяснить образованием между
молекулами
водородных
связей
(электростатическое
взаимодействие).
Требуется дополнительная энергия на разрыв
ассоциированных молекул.
CH3 OH
O CH3
H O CH3
H
18.
Образование водородных связей спиртамиобуславливает растворимость их в воде.
Низшие спирты хорошо растворимы, с
увеличением
молекулярной
массы
растворимость падает.
19.
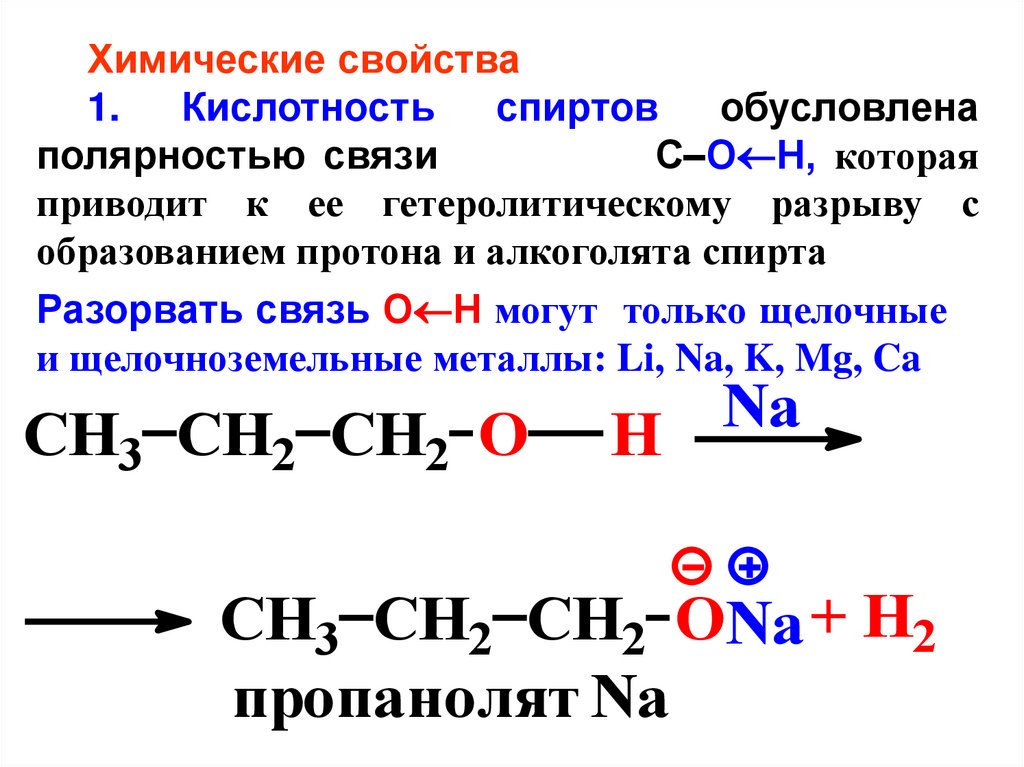
Химические свойства1.
Кислотность
спиртов
обусловлена
полярностью связи
С–О Н, которая
приводит к ее гетеролитическому разрыву с
образованием протона и алкоголята спирта
Разорвать связь О Н могут только щелочные
и щелочноземельные металлы: Li, Na, K, Mg, Ca
CH3 CH2 CH2 O
Na
H
CH3 CH2 CH2 ONa + H2
пропанолят Na
20.
Спирты – слабыекислоты:
pKa CH3OH = 16
pKa H2O = 14
pKa CH3COOH = 4,7
pKa HCl < 1
21.
22.
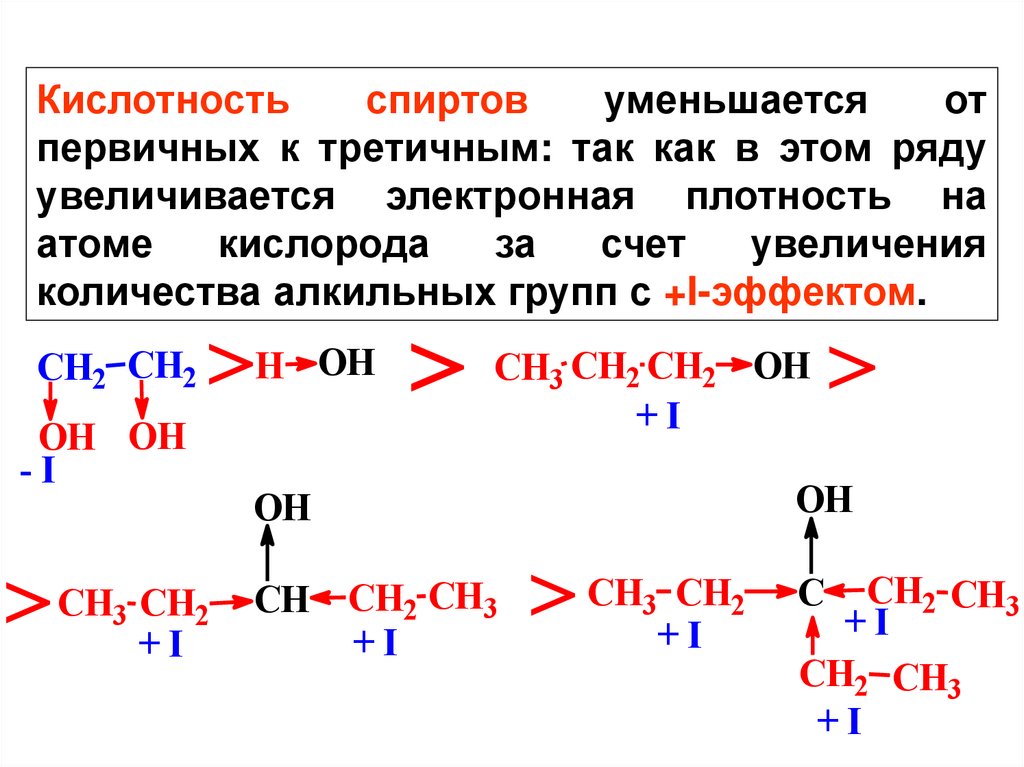
Кислотностьспиртов
уменьшается
от
первичных к третичным: так как в этом ряду
увеличивается электронная плотность на
атоме
кислорода
за
счет
увеличения
количества алкильных групп с +I-эффектом.
CH2 CH2
OH OH
-I
>
>H OH > CH CH +CHI OH >
CH3 CH2
+I
3
2
2
OH
OH
CH CH2 CH3
+I
>
CH3 CH2
+I
CH2 CH3
+I
CH2 CH3
+I
C
23.
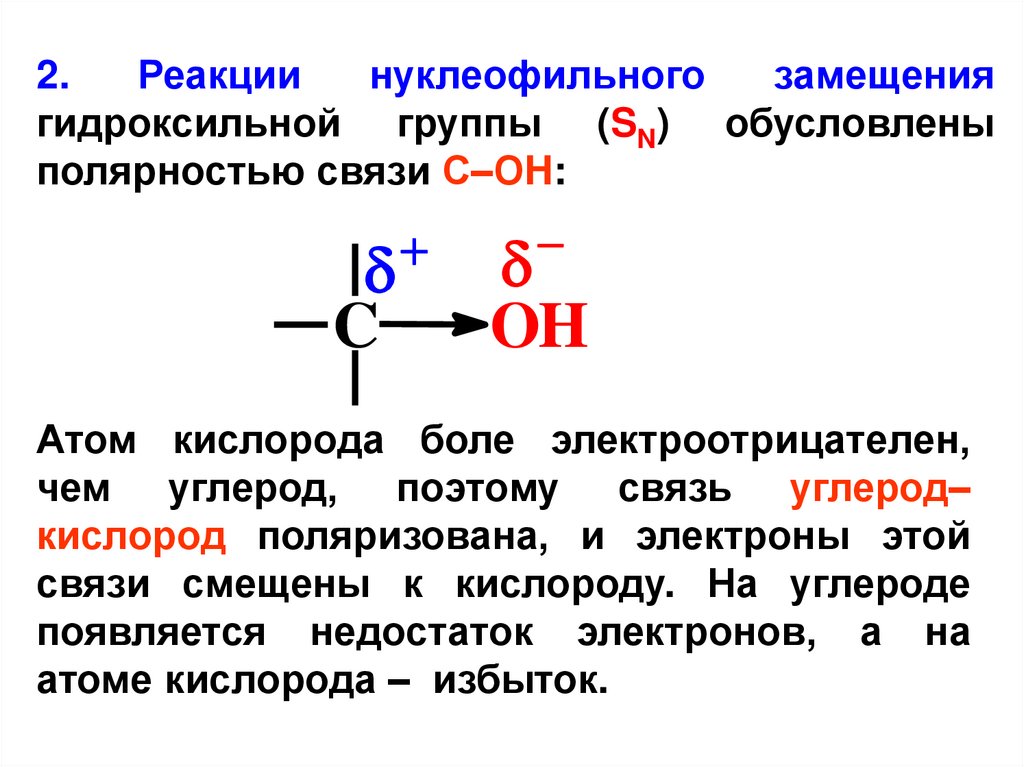
2.Реакции
нуклеофильного
замещения
гидроксильной группы (SN) обусловлены
полярностью связи С–ОH:
C
OH
Атом кислорода боле электроотрицателен,
чем углерод, поэтому связь углерод–
кислород поляризована, и электроны этой
связи смещены к кислороду. На углероде
появляется недостаток электронов, а на
атоме кислорода – избыток.
24.
Такой атом углерода может атаковатьтолько нуклеофильный реагент, который
вытесняет гидроксильную группу, замещая
ее. А реакции такого типа называются
реакциями нуклеофильного замещения SN.
В качестве нуклеофилов используют:
- галогеноводородные кислоты: HBr, HCl, HI;
- галогениды фосфора: PBr3, PCl3, PBr5, PCl5
- Тионилхлорид SOCl2
- спирты- R-OH
25.
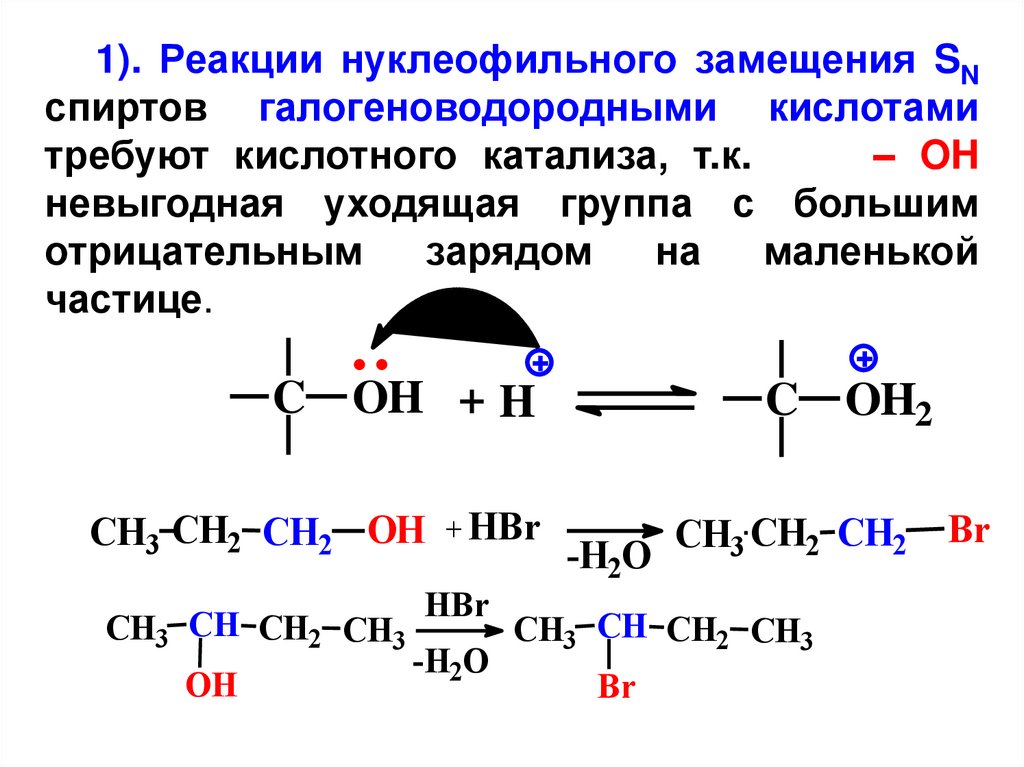
1). Реакции нуклеофильного замещения SNспиртов галогеноводородными кислотами
требуют кислотного катализа, т.к.
– OH
невыгодная уходящая группа с большим
отрицательным
зарядом
на
маленькой
частице.
C OH + H
CH3 CH2 CH2 OH + HBr
CH3 CH CH2 CH3
OH
HBr
-H2O
C OH2
-H2O
CH3 CH2 CH2 Br
CH3 CH CH2 CH3
Br
26.
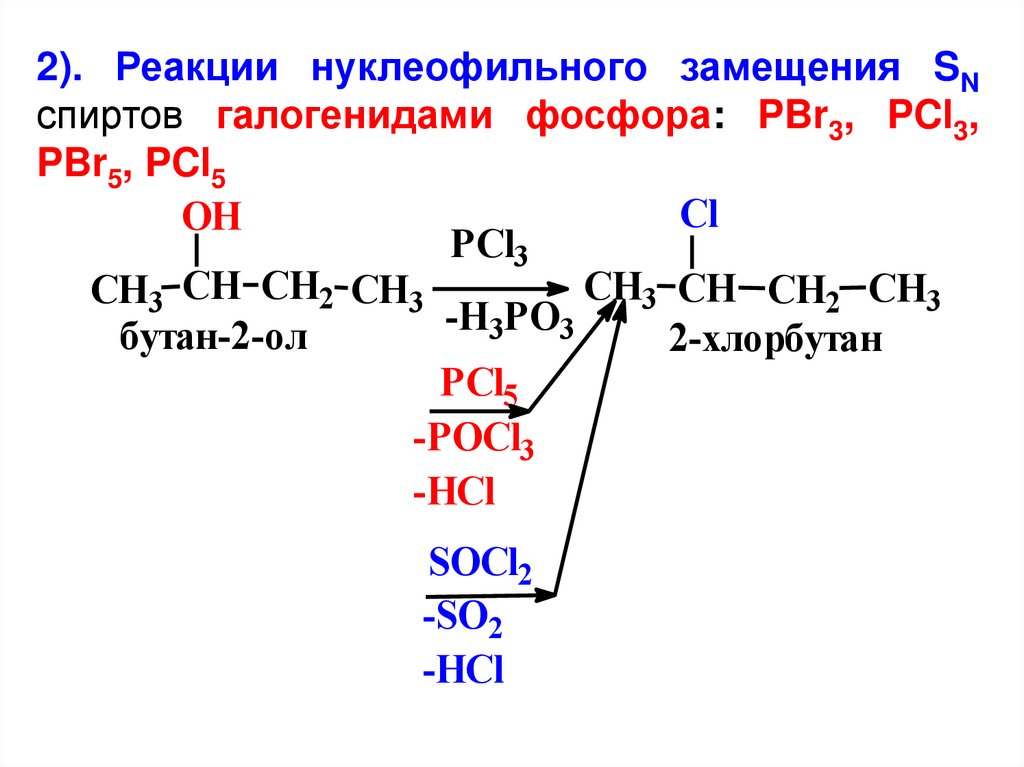
2). Реакции нуклеофильного замещения SNспиртов галогенидами фосфора: PBr3, PCl3,
PBr5, PCl5
Cl
OH
PCl3
CH3 CH CH2 CH3
CH3 CH CH2 CH3
-H3PO3
бутан-2-ол
2-хлорбутан
PCl5
-POCl3
-HCl
SOCl2
-SO2
-HCl
27.
3). Реакции нуклеофильного замещения SNспиртов со спиртами – реакция межмолекулярной дегидратации
с образованием
простых эфиров.
В
качестве
водоотнимающих
средств
используют H2SO4, H3PO4, Al2O3, P2O5.
H2SO4, 130oC
CH3 CH2 CH2 OH + HO CH2 CH2 CH3
-H2O
реагент N
субстрат
CH3 CH2 CH2 O CH2 CH2 CH3
дипропиловый
эфир
28.
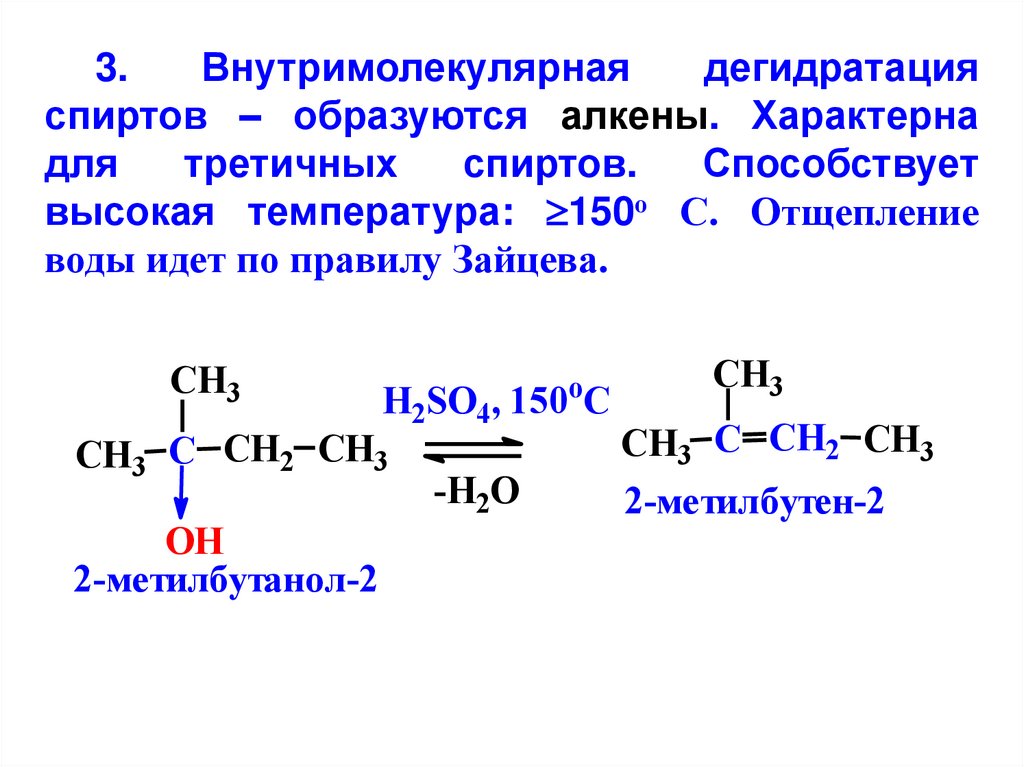
3.Внутримолекулярная
дегидратация
спиртов – образуются алкены. Характерна
для
третичных
спиртов.
Способствует
высокая температура: 150о С. Отщепление
воды идет по правилу Зайцева.
CH3
H2SO4, 150 C
CH3 C CH2 CH3
OH
2-метилбутанол-2
o
-H2O
CH3
CH3 C CH2 CH3
2-метилбутен-2
29.
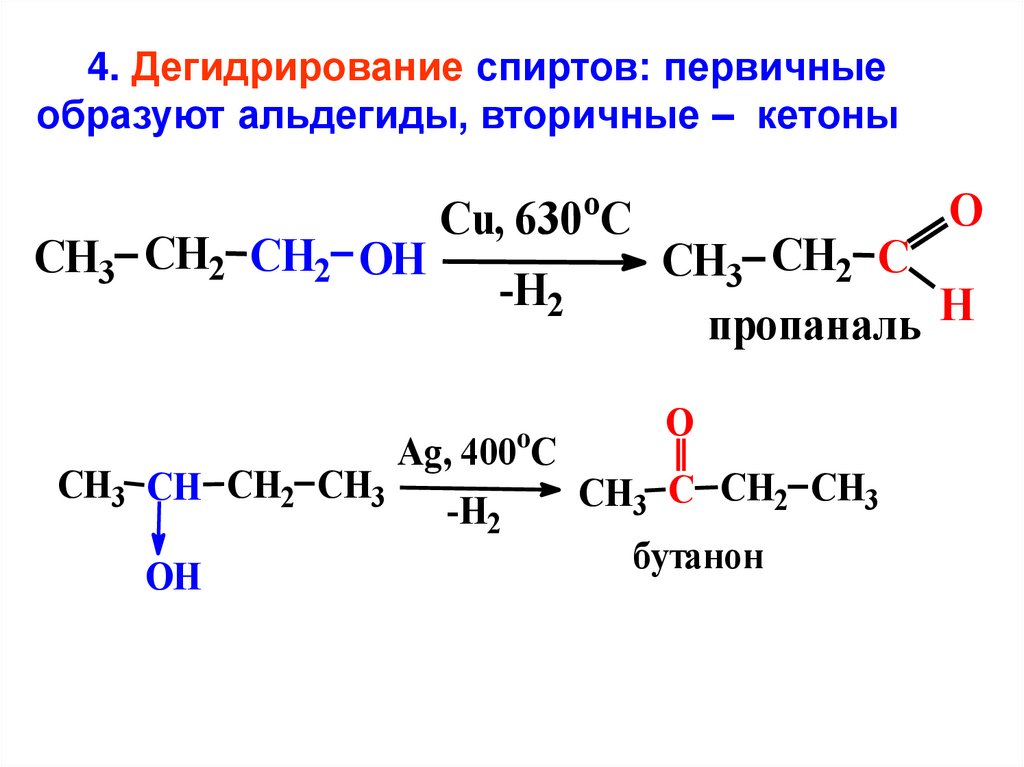
4. Дегидрирование спиртов: первичныеобразуют альдегиды, вторичные – кетоны
o
O
Cu, 630 C
CH3 CH2 CH2 OH
CH3 CH2 C
-H2
пропаналь H
o
O
Ag, 400 C
CH3 CH CH2 CH3
C CH2 CH3
CH
3
-H2
бутанон
OH
30.
5. Реакции этерификацииспиртов с
органическими и неорганическими кислотами
– образование сложных эфиров кислот:
O
O
R
С
R'OH
O H
H
С
R' + H2O
R
O
сложный эфир
H OSO3H CH3 CH2 CH2 OSO3H
CH3 CH2 CH2 OH
пропилсерная
-H2O
кислота
HONO2
CH3 CH2 CH2 OH
-H2O
CH3 CH2 CH2 ONO2
пропилнитрат
31.
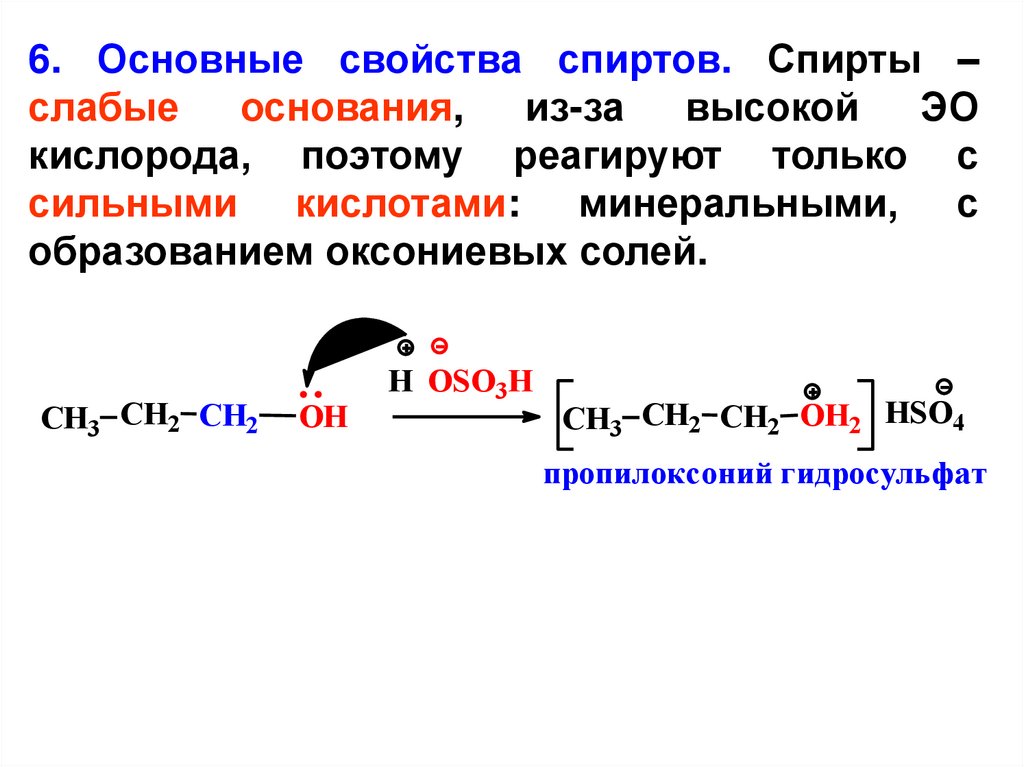
6. Основные свойства спиртов. Спирты –слабые
основания,
из-за
высокой
ЭО
кислорода, поэтому реагируют только с
сильными кислотами: минеральными, с
образованием оксониевых солей.
CH3 CH2 CH2
OH
H OSO3H
CH3 CH2 CH2 OH2 HSO4
пропилоксоний гидросульфат
32.
Представители спиртов и их применениеCH3OH – метанол, сильный яд, в малых
количествах вызывает слепоту, в больших –
смерть.
-Применяют в качестве растворителя, а
также для получения метилтретбутилового
эфира (антидетонатор), формальдегида,
C2H5OH – этанол, применяют -в производстве
бутадиенового каучука по Лебедеву,
- растворитель
- консервант анатомических препаратов
-в
парфюмерной
и
лекарственной
промышленности
33.
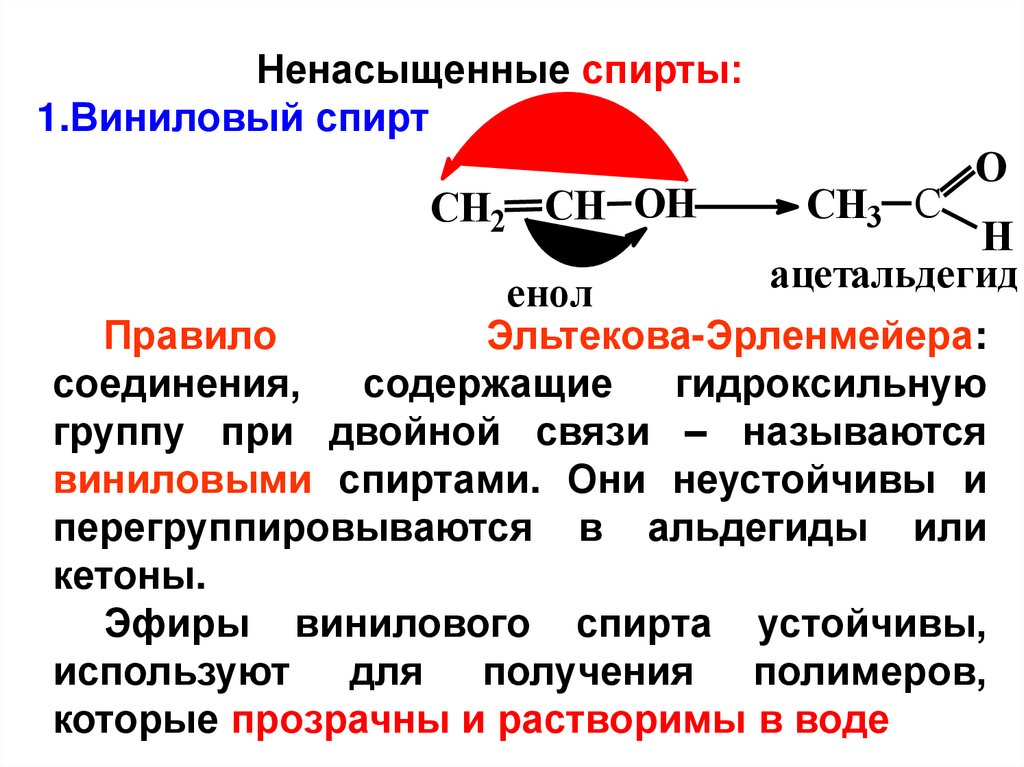
Ненасыщенные спирты:1.Виниловый спирт
CH2 CH OH
енол
CH3 C
O
H
ацетальдегид
Правило
Эльтекова-Эрленмейера:
соединения,
содержащие
гидроксильную
группу при двойной связи – называются
виниловыми спиртами. Они неустойчивы и
перегруппировываются в альдегиды или
кетоны.
Эфиры винилового спирта устойчивы,
используют для получения полимеров,
которые прозрачны и растворимы в воде
34.
2. Аллиловый спирт– применяют в синтезетрехатомного спирта- глицерина
CH2
KMnO4/Na2CO3 CH CH CH
2
2
CH CH2 OH
-MnO2
OH OH OH
Многоатомные
спирты
–
называют
гликолями.
Двухатомные
–диолы,
трехатомные –триолы.
Подобно одноатомным, проявляют такие
же химические свойства, только участие в
реакциях принимают одна или несколько
гидроксильных групп, образуя неполные или
полные производные.
CH2 CH2 CH2
OH
OH
пропандиол-1,3
35.
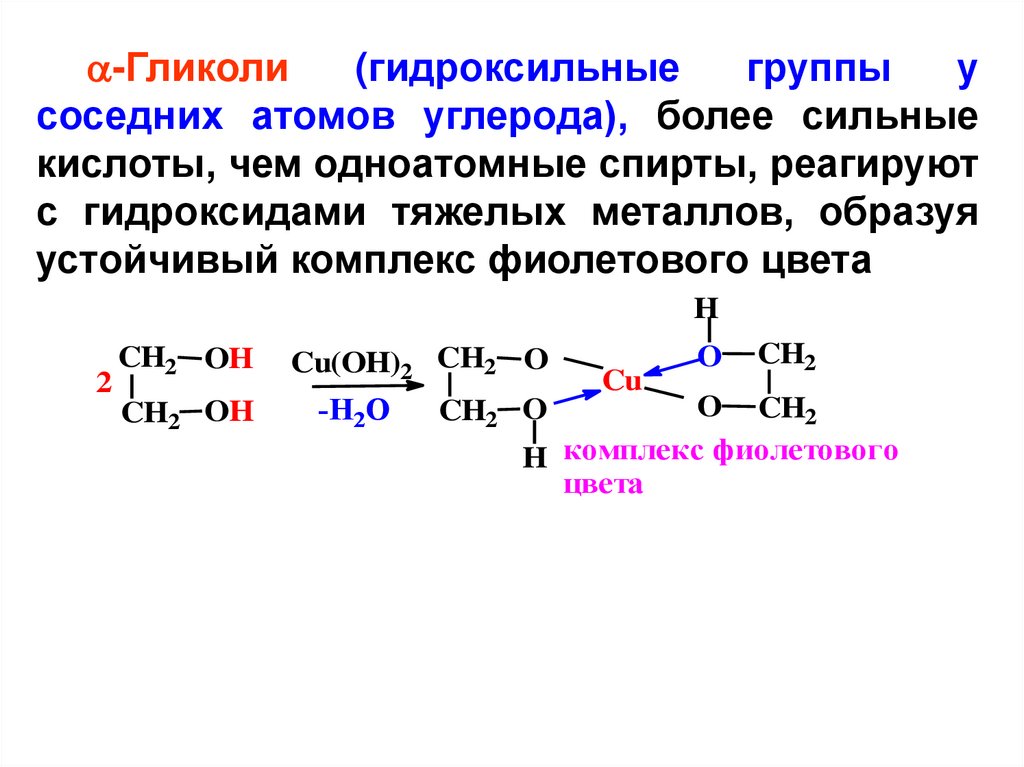
-Гликоли(гидроксильные
группы
у
соседних атомов углерода), более сильные
кислоты, чем одноатомные спирты, реагируют
с гидроксидами тяжелых металлов, образуя
устойчивый комплекс фиолетового цвета
H
2
CH2 OH
CH2 OH
Cu(OH)2 CH2 O
-H2O
Cu
O
CH2
O CH2
H комплекс фиолетового
цвета
CH2 O
36.
37.
Применение многоатомных спиртов1. Этиленгликоль (этандиол-1,2):
– в производстве антифризов – веществ с
низкой температурой замерзания
- в качестве растворителей лаков
- в производстве волокна «лавсан»
2. Глицерин (пропантриол-1,2,3):
-парфюмерии
-кондитерском производстве
- получении нитроглицерина
-в производстве бездымного пороха
38.
Простые эфиры – это производныеспиртов,
у
которых
атом
водорода
гидроксильной
группы
замещен
углеводородным
радикалом.
Общая
структурная формула R-O-R1.Общая формула
CnH2n+2O
Номенклатура:
Систематическая
–
к
названию старшего (наиболее длинного) УР в
качестве приставки прибавляют название
алкоксигруппы R-O.
Либо, название простого эфира строят в
порядке
увеличения
старшинства
углеводородных
радикалов,
добавляя
название основы «эфир»
39.
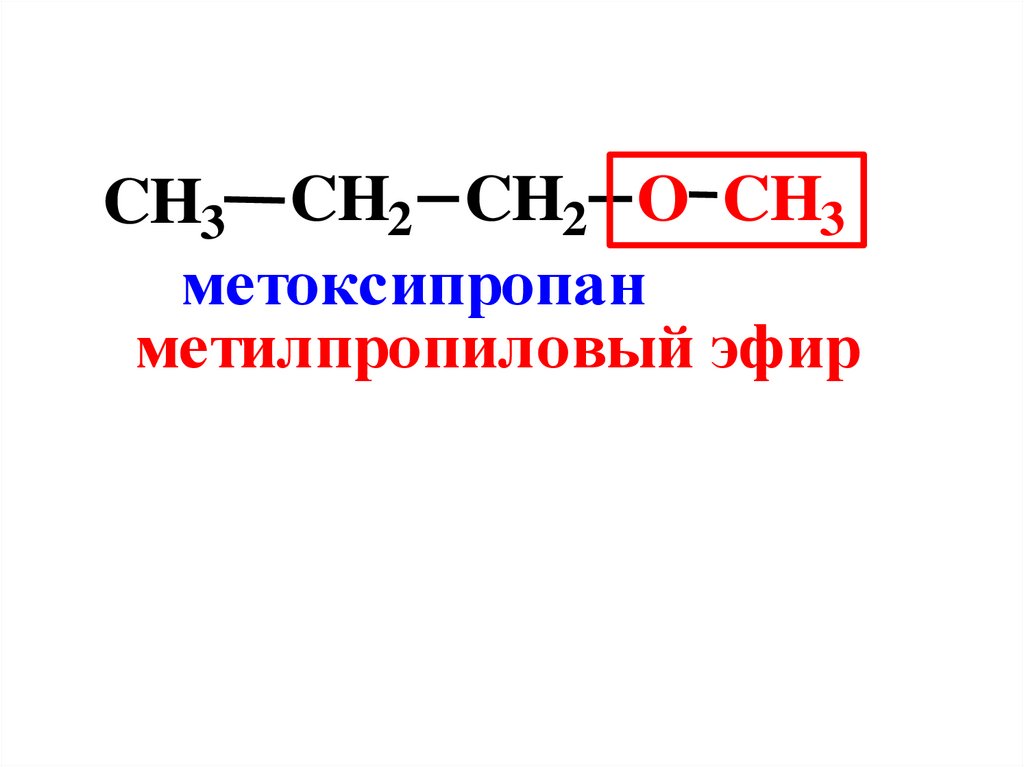
CH3 CH2 CH2 O CH3метоксипропан
метилпропиловый эфир
40.
Методы получения1. Дегидратация спиртов (межмолекулярная) – удобен для получения симметричных простых эфиров из первичных спиртов.
H2SO4, toC
CH3 CH2 CH2 O CH2 CH2 CH3
CH3 CH2 CH2 OH + HO CH2 CH2 CH3
-H2O
субстрат
дипропиловый
реагент N
эфир
2. Реакция Вильямсона – взаимодействие
алкоголятов
с
галогеналканами
(р.
алкилирования).
Можно
получать
симметричные и несимметричные эфиры.
CH3 CH2 CH2
CH3 CH2 CH2 O CH2 CH3
ONa + Cl CH2 CH3
этилпропиловый
-NaCl
эфир
41.
Физические свойстваТкип. простых эфиров меньше Ткип.
соответствующих
спиртов,
хотя
молекулярная
масса
выше.
Это
объясняется отсутствием подвижного
водорода при кислороде. Т.о. простые
эфиры не образуют водородных связей.
Плохо растворимы в воде, хорошо в
органических растворителях.
42.
Химические свойства1.
Основность
эфиров
(способность
присоединять
протон
Н )
обусловлена
наличием на кислороде электронной пары,
поэтому эфиры способны образовывать
оксониевые соли с сильными протонными
кислоты или кислотами Льюиса.
CH3 CH2 O CH2 CH3
H OSO3H
холод
CH3 CH2 O CH2 CH3 HSO4
H
диэтилоксоний гидросульфат
43.
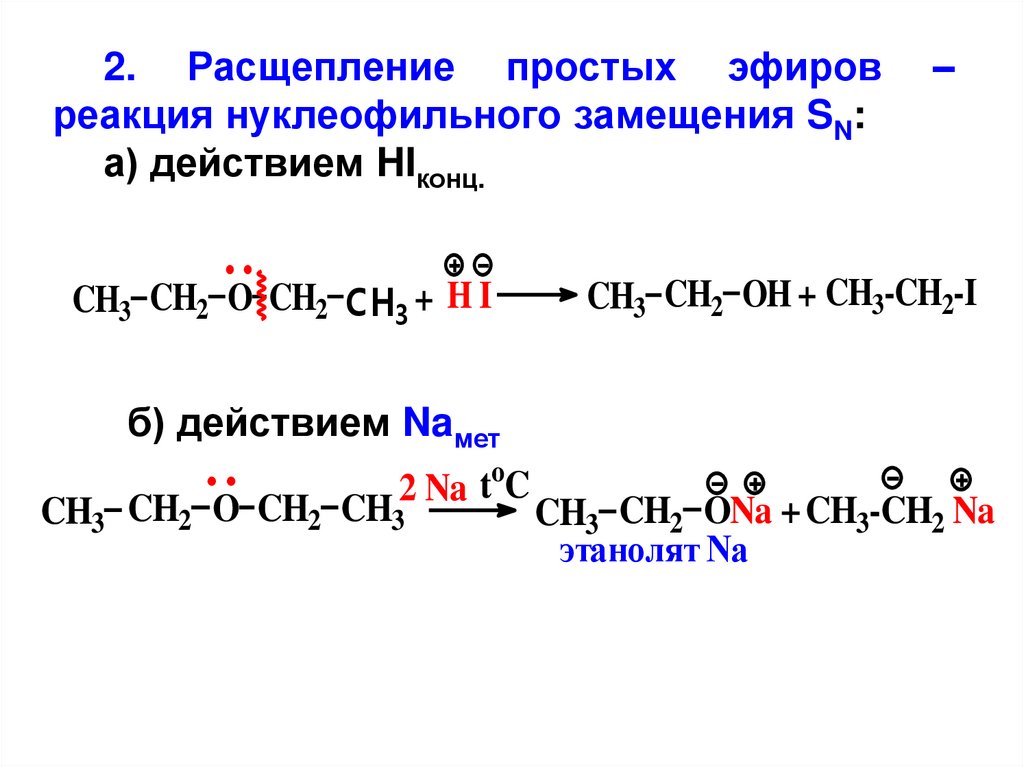
2. Расщепление простых эфировреакция нуклеофильного замещения SN:
а) действием HIконц.
CH3 CH2 O CH2 CH3 + H I
–
CH3 CH2 OH + CH3-CH2-I
б) действием Naмет
2 Na toC
CH3 CH2 O CH2 CH3
CH3 CH2 ONa + CH3-CH2 Na
этанолят Na
44.
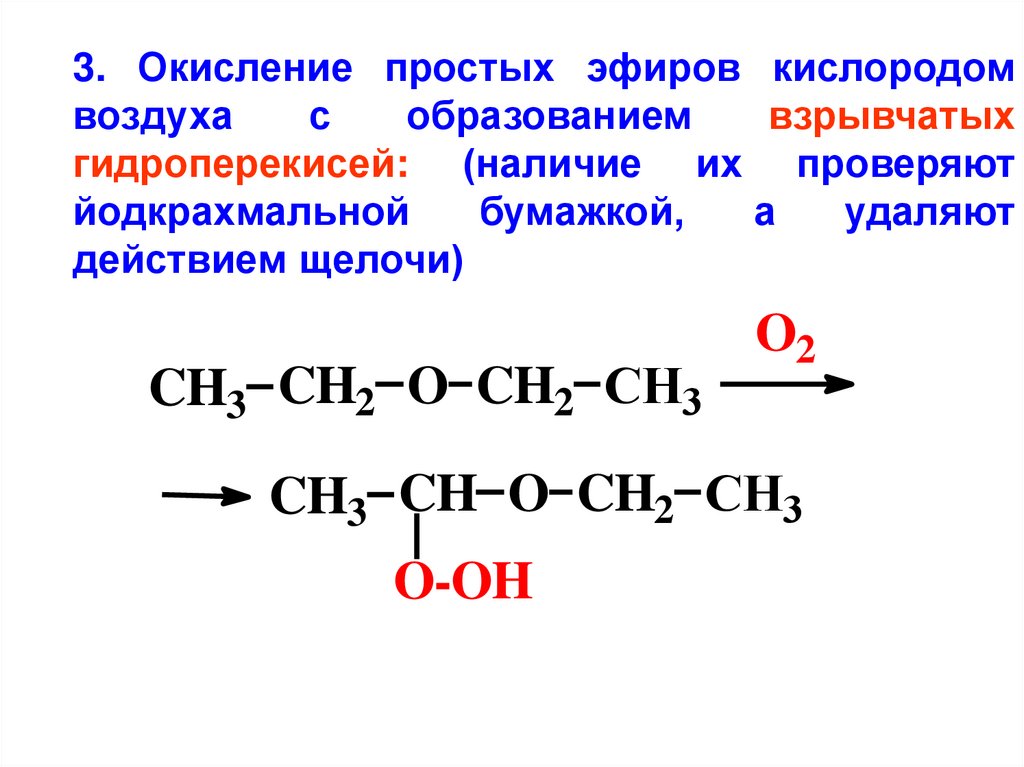
3. Окисление простых эфиров кислородомвоздуха
с
образованием
взрывчатых
гидроперекисей: (наличие их проверяют
йодкрахмальной
бумажкой,
а
удаляют
действием щелочи)
CH3 CH2 O CH2 CH3
O2
CH3 CH O CH2 CH3
O-OH
45.
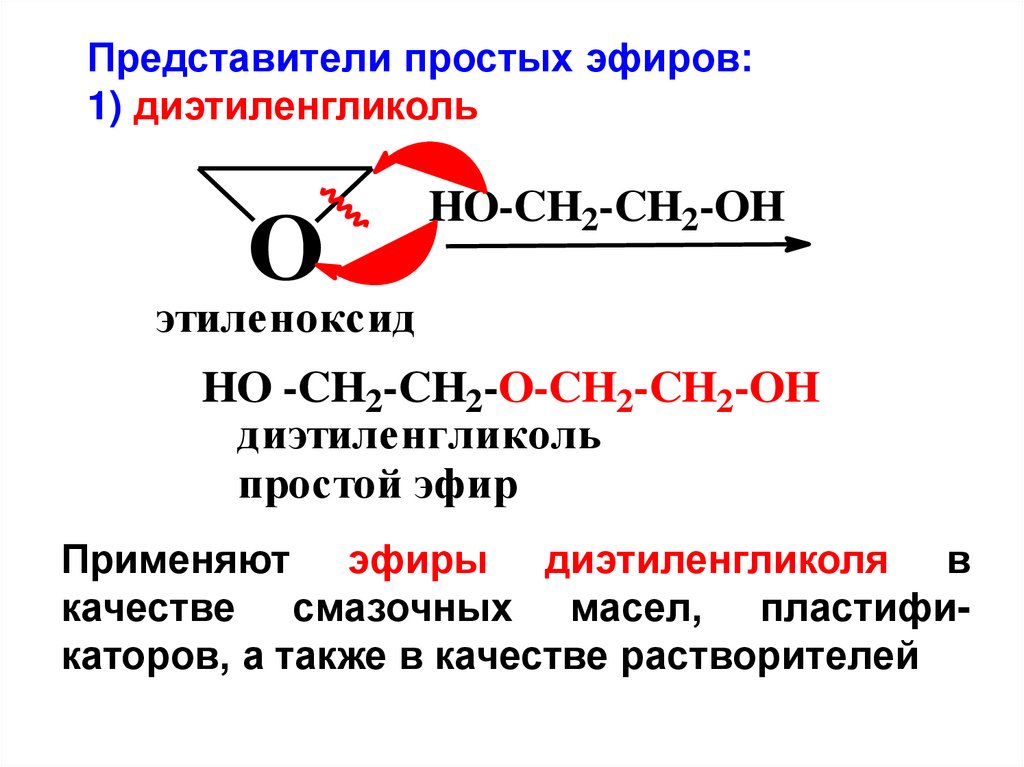
Представители простых эфиров:1) диэтиленгликоль
O
HO-CH2-CH2-OH
этиленоксид
HO -CH2-CH2-O-CH2-CH2-OH
диэтиленгликоль
простой эфир
Применяют эфиры диэтиленгликоля в
качестве смазочных масел, пластификаторов, а также в качестве растворителей
46.
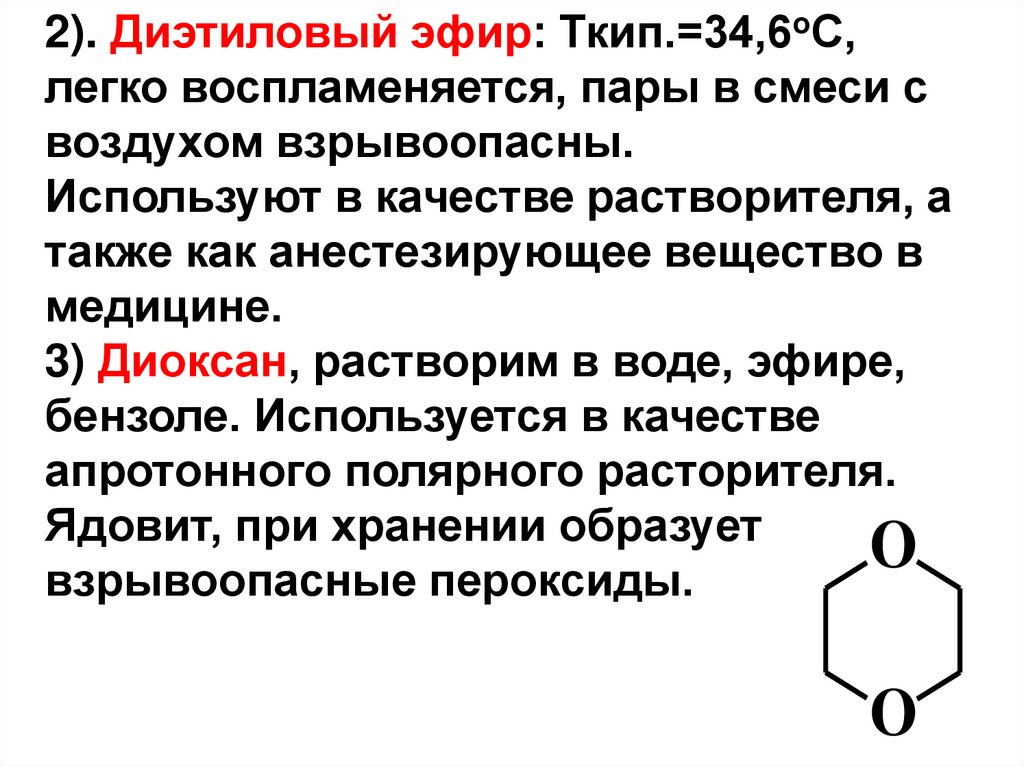
2). Диэтиловый эфир: Ткип.=34,6оС,легко воспламеняется, пары в смеси с
воздухом взрывоопасны.
Используют в качестве растворителя, а
также как анестезирующее вещество в
медицине.
3) Диоксан, растворим в воде, эфире,
бензоле. Используется в качестве
апротонного полярного расторителя.
Ядовит, при хранении образует
O
взрывоопасные пероксиды.
O
47.
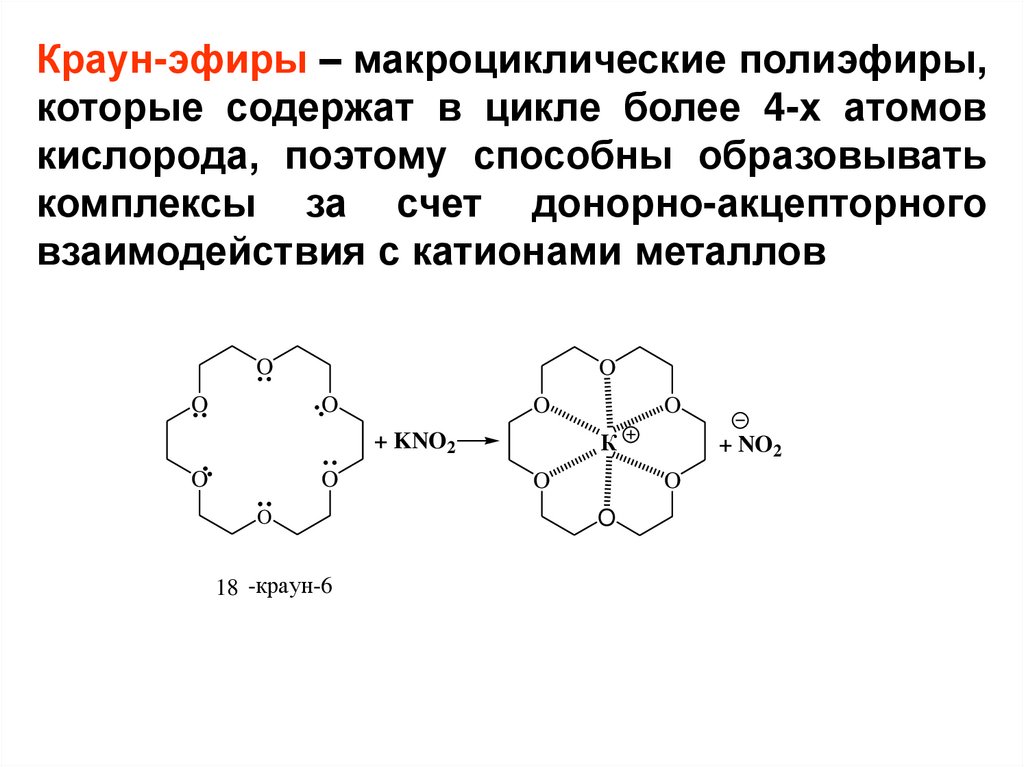
Краун-эфиры – макроциклические полиэфиры,которые содержат в цикле более 4-х атомов
кислорода, поэтому способны образовывать
комплексы за счет донорно-акцепторного
взаимодействия с катионами металлов
O
O
O
O
O
К
+ KNO2
O
O
O
18 -краун-6
O
O
+ NO2
O
O
48.
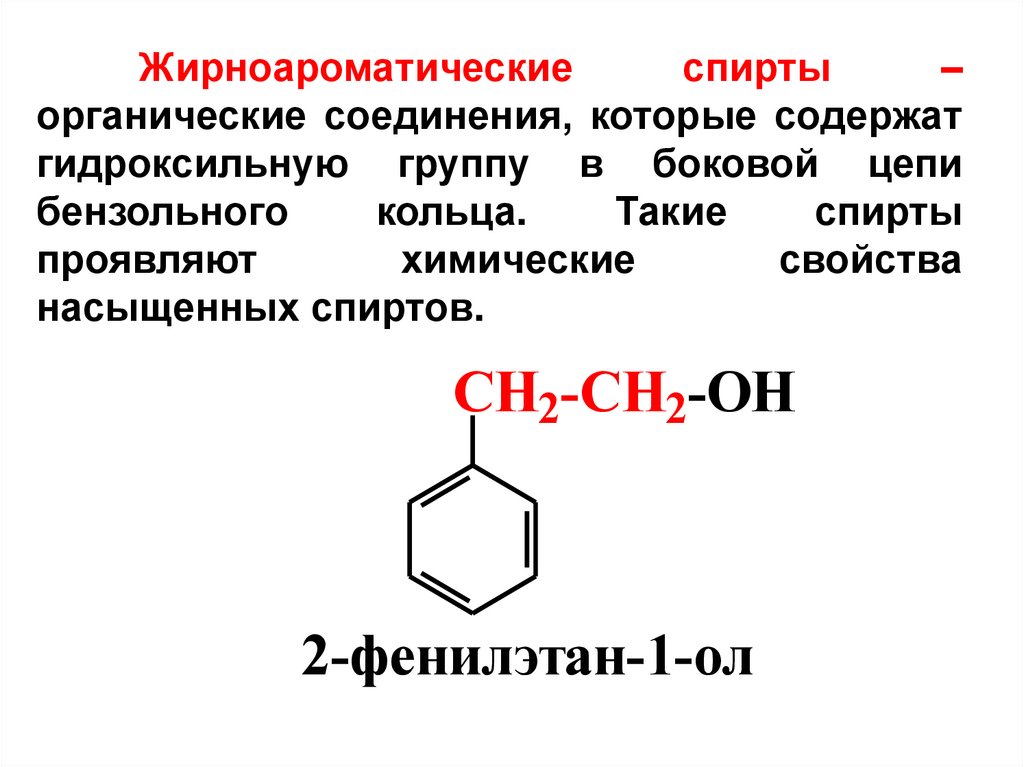
Жирноароматическиеспирты
–
органические соединения, которые содержат
гидроксильную группу в боковой цепи
бензольного
кольца.
Такие
спирты
проявляют
химические
свойства
насыщенных спиртов.
СH2-CH2-OH
2-фенилэтан-1-ол
49.
Фенолы.Классификация, номенклатура, изомерия, физические
свойства.
Способы получения: кумольный метод, сплавление солей
ароматических
сульфокислот
со
щелочью,
гидролиз
арилгалогенидов, разложение солей диазония.
Химические свойства. Кислотные свойства фенолов,
сравнение со спиртами. Образование фенолятов с водными
растворами щелочей. Реакции фенолятов щелочных
металлов как нуклеофильных реагентов.
Реакции электрофильного замещения фенолов.
Качественные реакции фенолов.
Реакция фенола с формальдегидом и ее практическое
значение. Токсичность фенолов.
50.
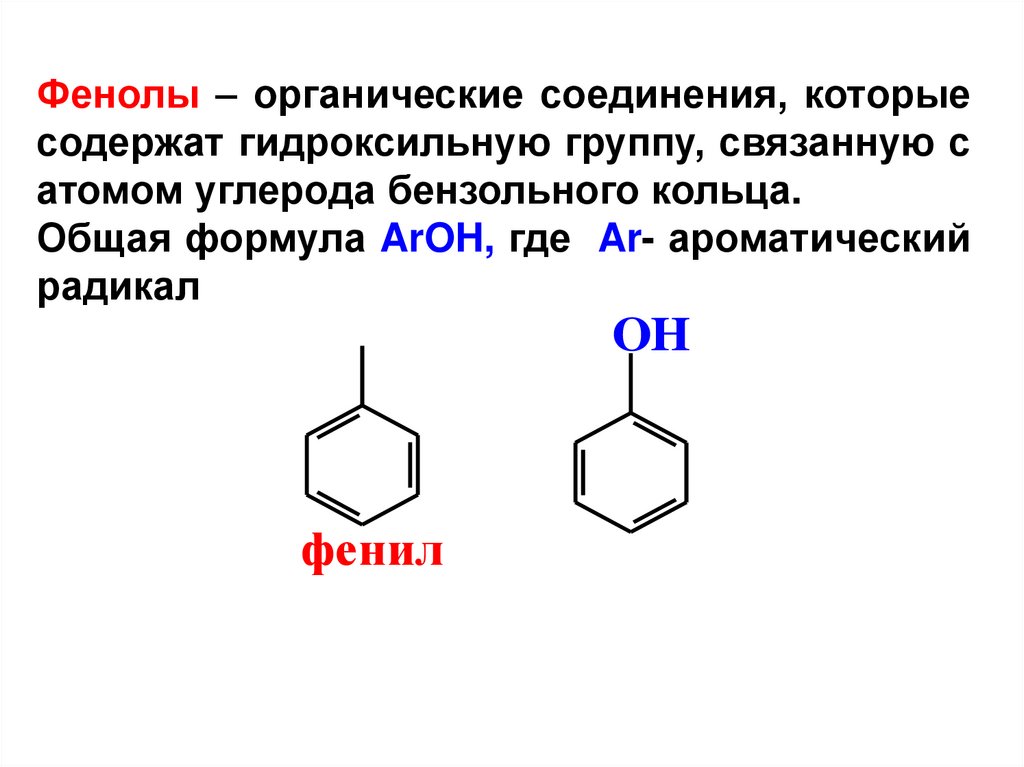
Фенолы – органические соединения, которыесодержат гидроксильную группу, связанную с
атомом углерода бензольного кольца.
Общая формула ArOH, где Ar- ароматический
радикал
OH
фенил
51.
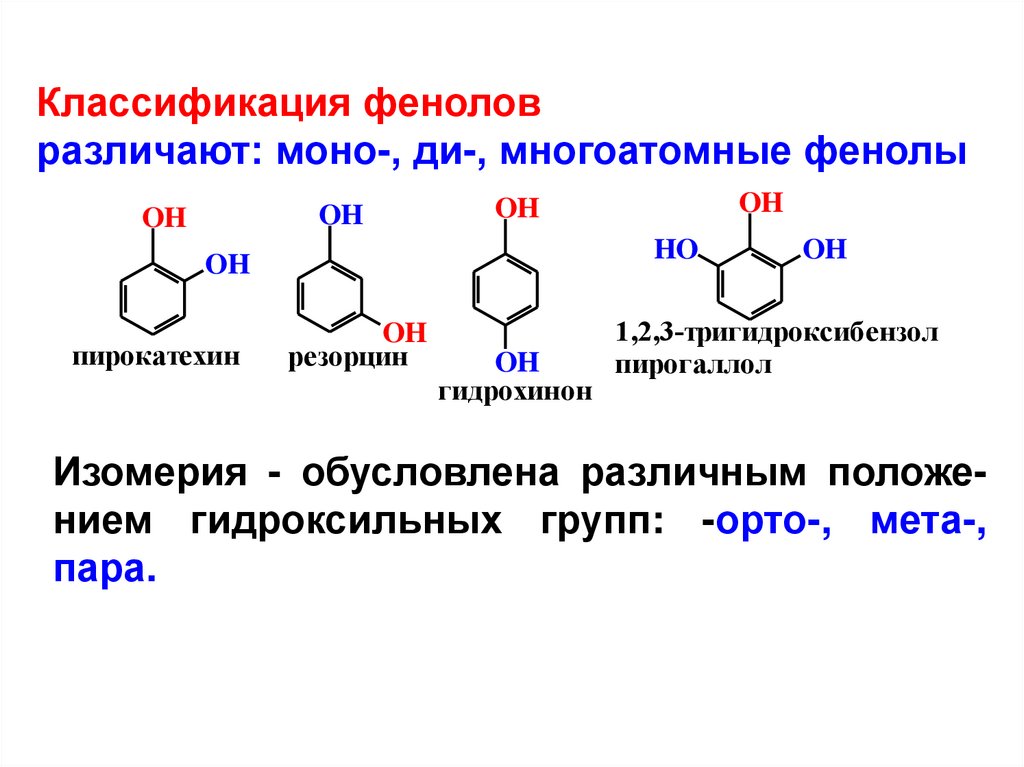
Классификация феноловразличают: моно-, ди-, многоатомные фенолы
OH
OH
HO
OH
пирокатехин
OH
OH
OH
резорцин
OH
гидрохинон
OH
1,2,3-тригидроксибензол
пирогаллол
Изомерия - обусловлена различным положением гидроксильных групп: -орто-, мета-,
пара.
52.
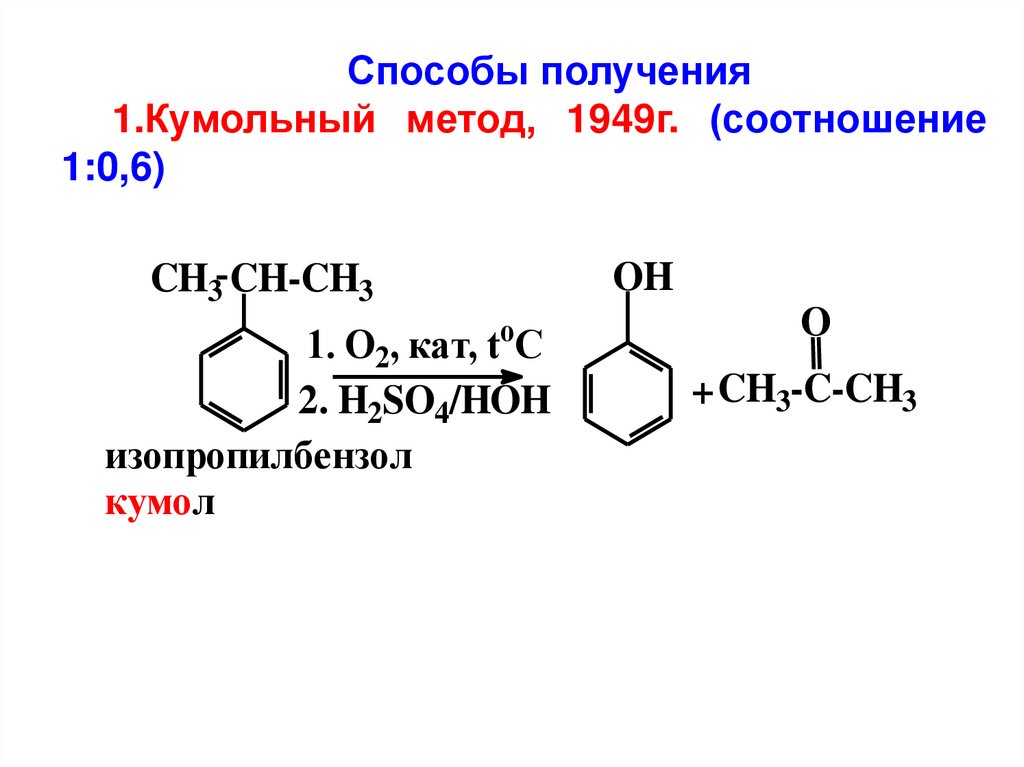
Способы получения1.Кумольный метод, 1949г. (соотношение
1:0,6)
OH
CH3 CH-CH3
o
1. O2, кат, t C
2. H2SO4/HOH
изопропилбензол
кумол
O
+ CH3-C-CH3
53.
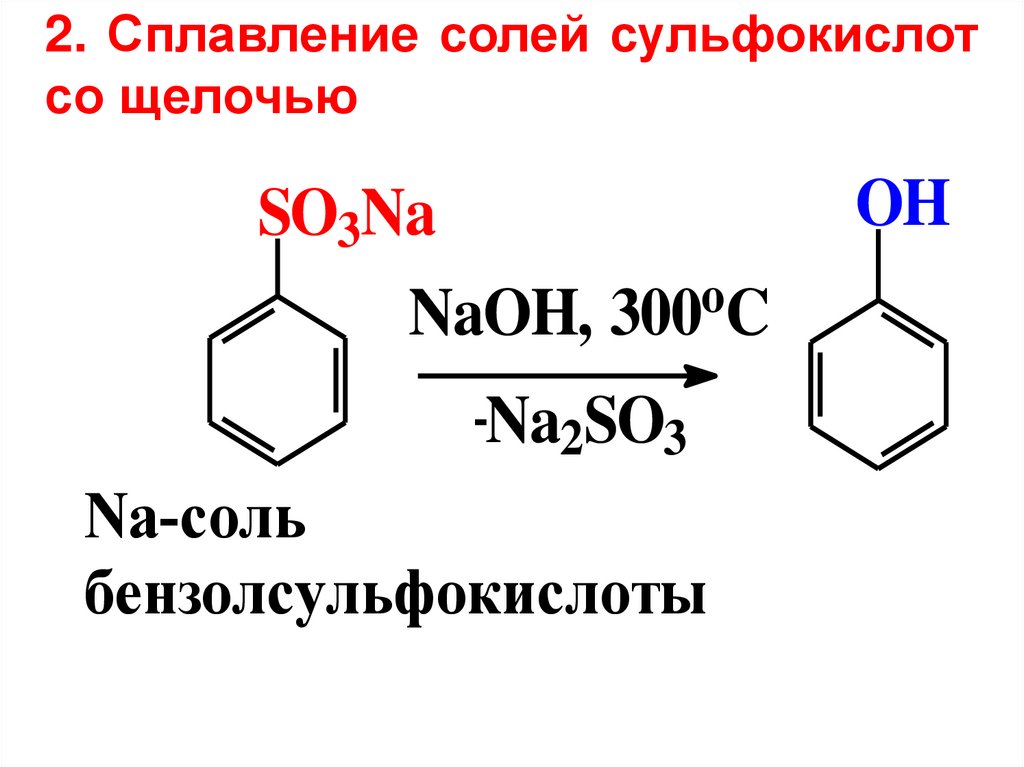
2. Сплавление солей сульфокислотсо щелочью
SO3Na
o
NaOH, 300 C
-Na2SO3
Na-соль
бензолсульфокислоты
OH
54.
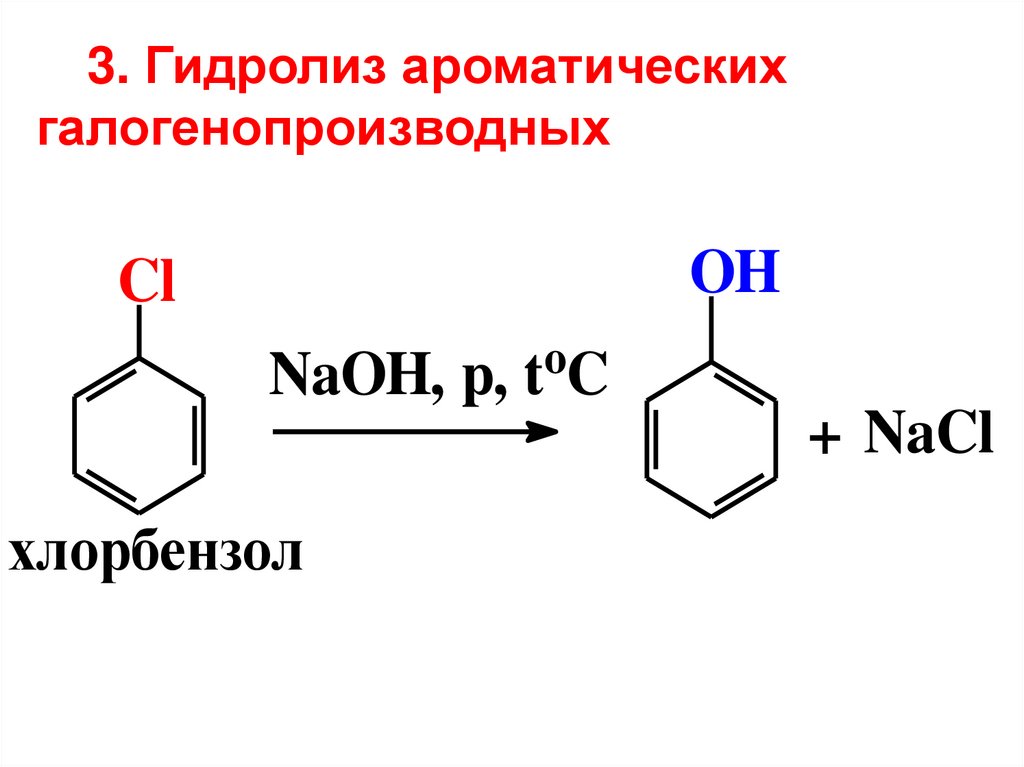
3. Гидролиз ароматическихгалогенопроизводных
OH
Cl
o
NaOH, p, t C
+ NaCl
хлорбензол
55.
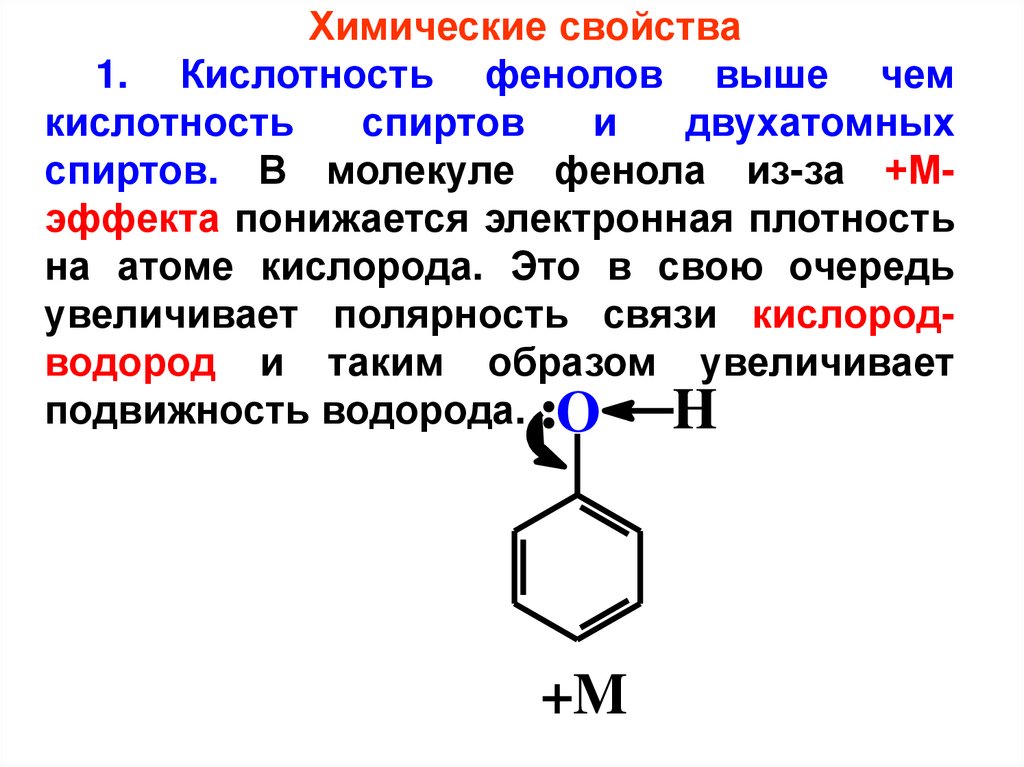
Химические свойства1. Кислотность фенолов выше чем
кислотность
спиртов
и
двухатомных
спиртов. В молекуле фенола из-за +Мэффекта понижается электронная плотность
на атоме кислорода. Это в свою очередь
увеличивает полярность связи кислородводород и таким образом увеличивает
подвижность водорода. O
H
+M
56.
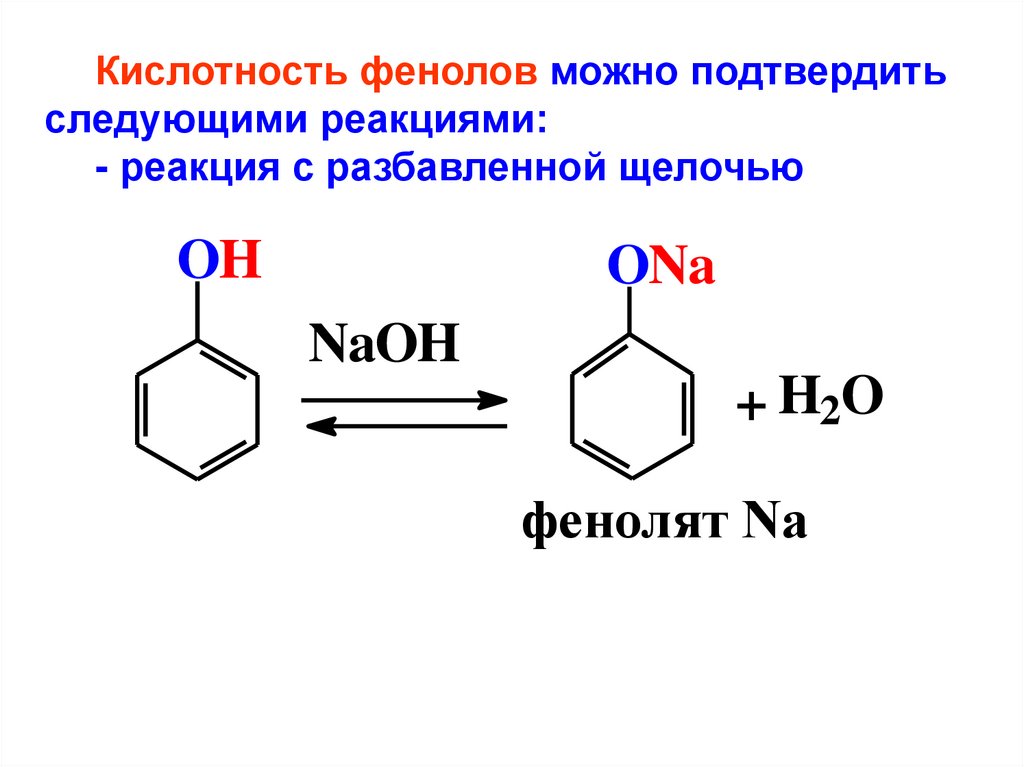
Кислотность фенолов можно подтвердитьследующими реакциями:
- реакция с разбавленной щелочью
OH
ONa
NaOH
+ H2O
фенолят Na
57.
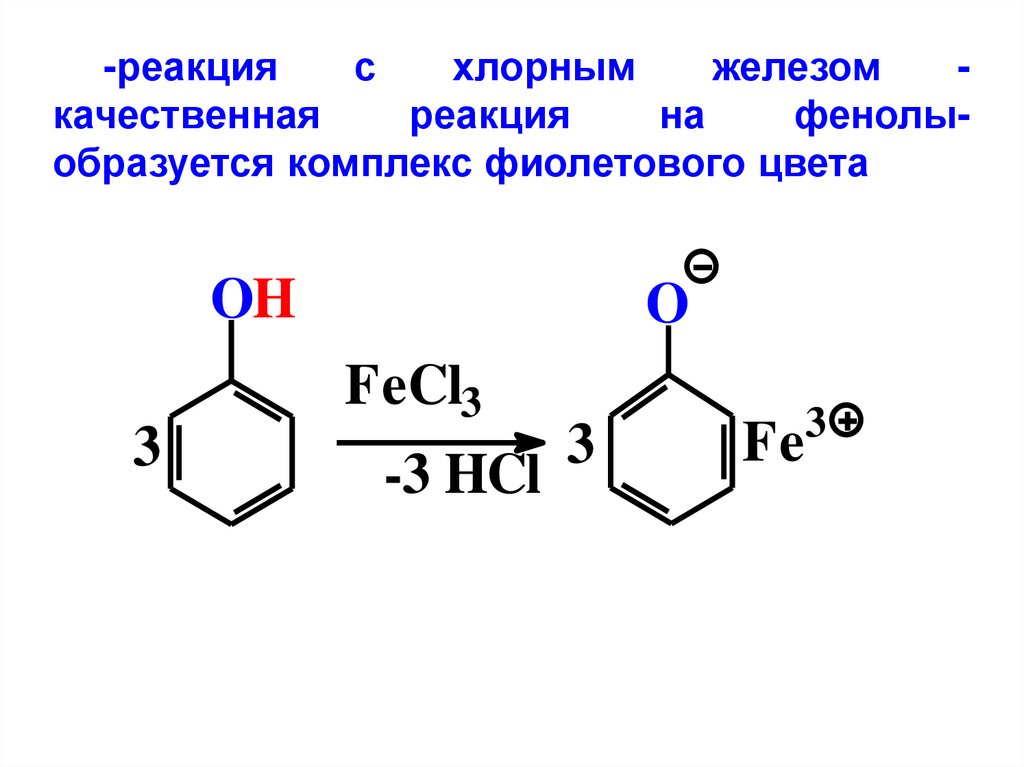
-реакцияс
хлорным
железом
качественная
реакция
на
фенолыобразуется комплекс фиолетового цвета
OH
3
O
FeCl3
-3 HCl
3
Fe
3
58.
59.
OH>
CH2 CH2
>
H OH
OH OH
-I
OH
>
CH3 CH2
+I
CH CH2 CH3
+I
>
CH3 CH2 CH2 OH
+I
>
OH
>
CH3 CH2
+I
CH2 CH3
+I
CH2 CH3
+I
C
60.
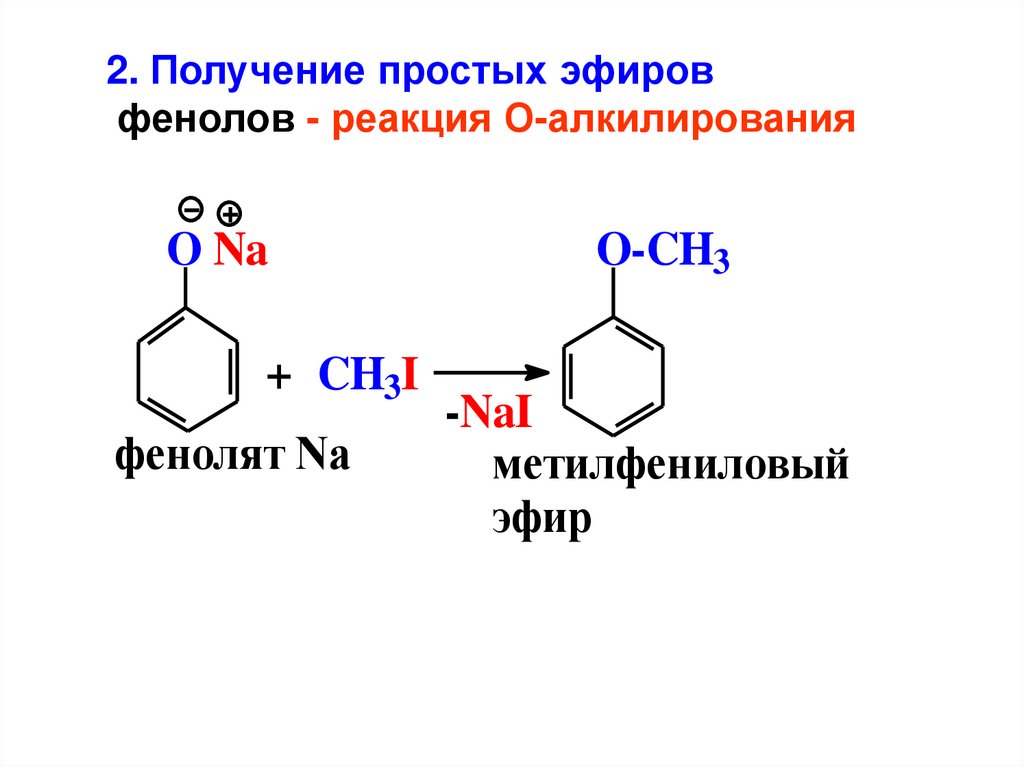
2. Получение простых эфировфенолов - реакция О-алкилирования
O Na
+ CH3I
фенолят Na
O-CH3
-NaI
метилфениловый
эфир
61.
3. Получение сложных эфиров феноловреакцией О-ацилирования ангидридами или
галогенангидридами карбоновых кислот
O
OH
O
CH3-C
O-C CH3
Cl
+ HCl
NaOH, H2O, холод
хлорангидрид
фениловый
уксусной кислоты эфир уксусной
кислоты
62.
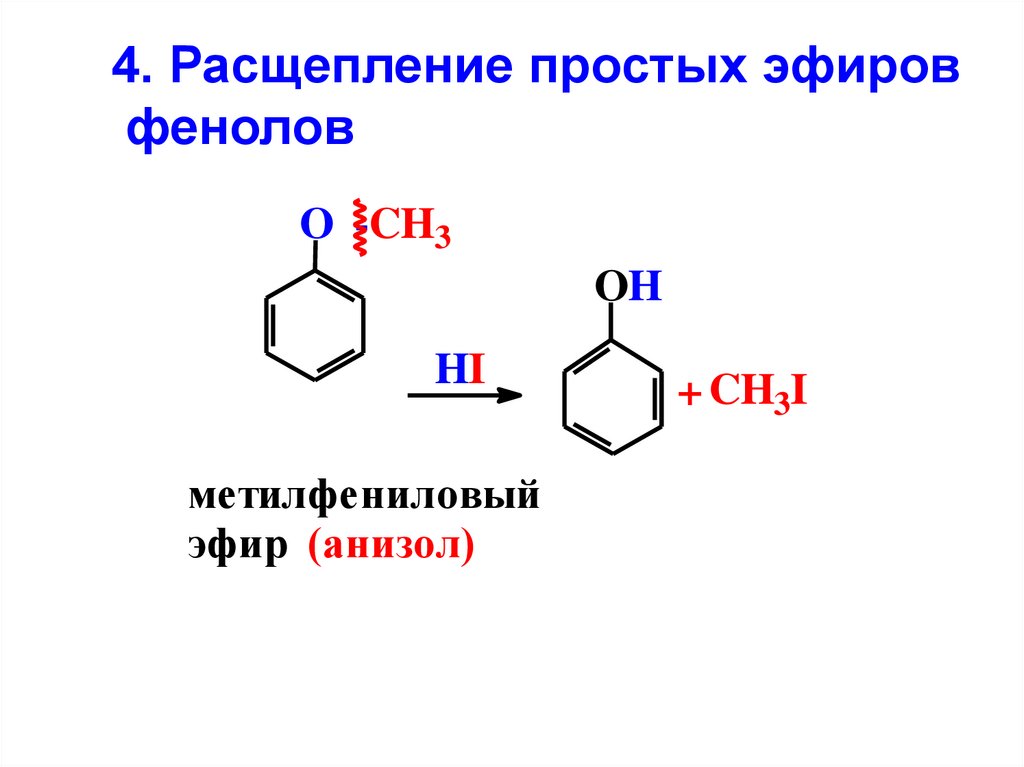
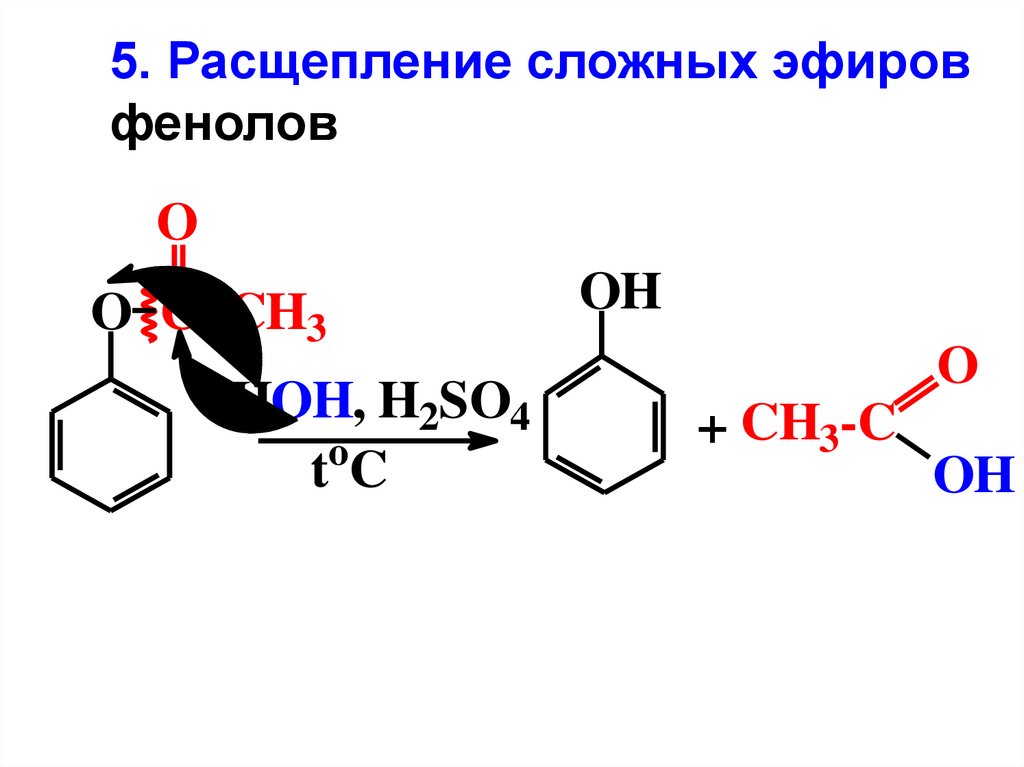
4. Расщепление простых эфировфенолов
O -CH3
OH
HI
метилфениловый
эфир (анизол)
+ CH3I
63.
5. Расщепление сложных эфировфенолов
O
O C CH3
HOH, H2SO4
o
tC
OH
O
+ CH3-C
OH
64.
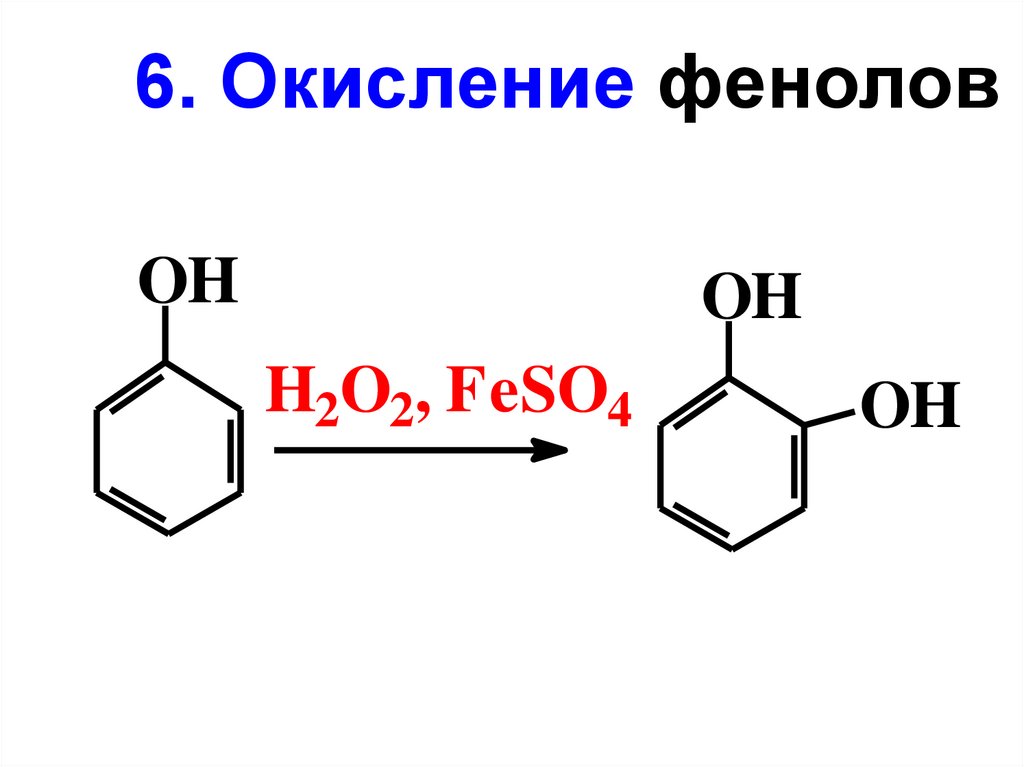
6. Окисление феноловOH
OH
H2O2, FeSO4
OH
65.
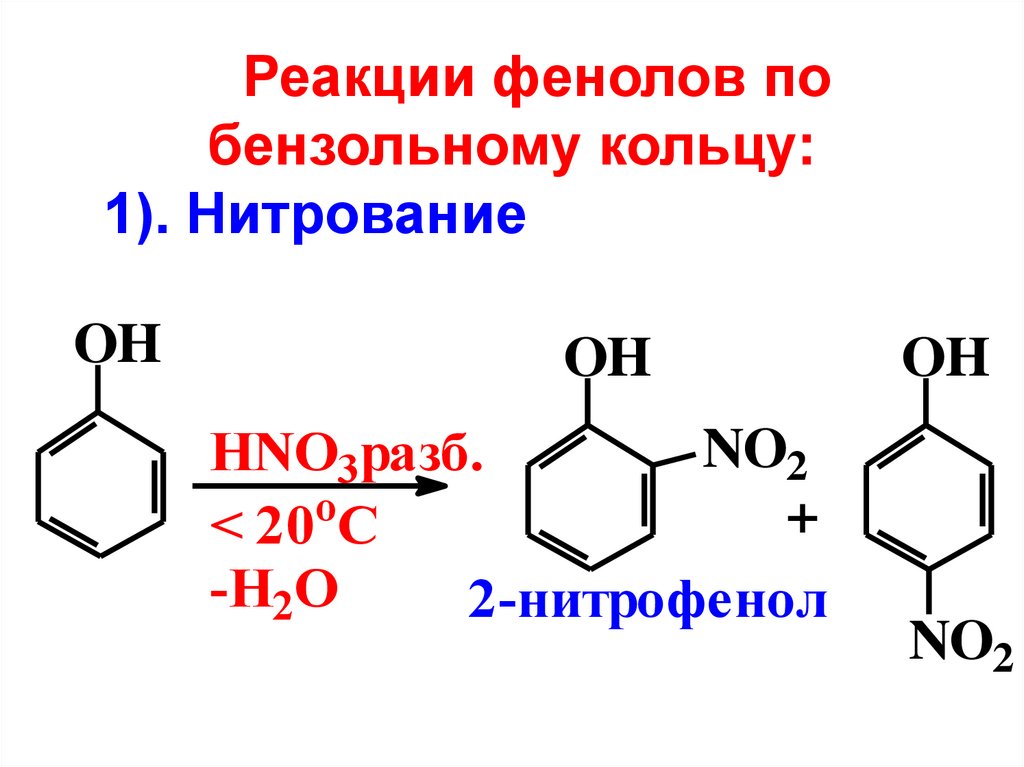
Реакции фенолов побензольному кольцу:
1). Нитрование
OH
OH
NO2
HNO3разб.
o
+
< 20 C
-H2O
2-нитрофенол
OH
NO2
66.
Продуктом полинитрованияобразуется пикриновая кислота –
взрывчатое вещество, особенно ее
соли – пикраты
OH
O2N
NO2
NO2
пикриновая кислота
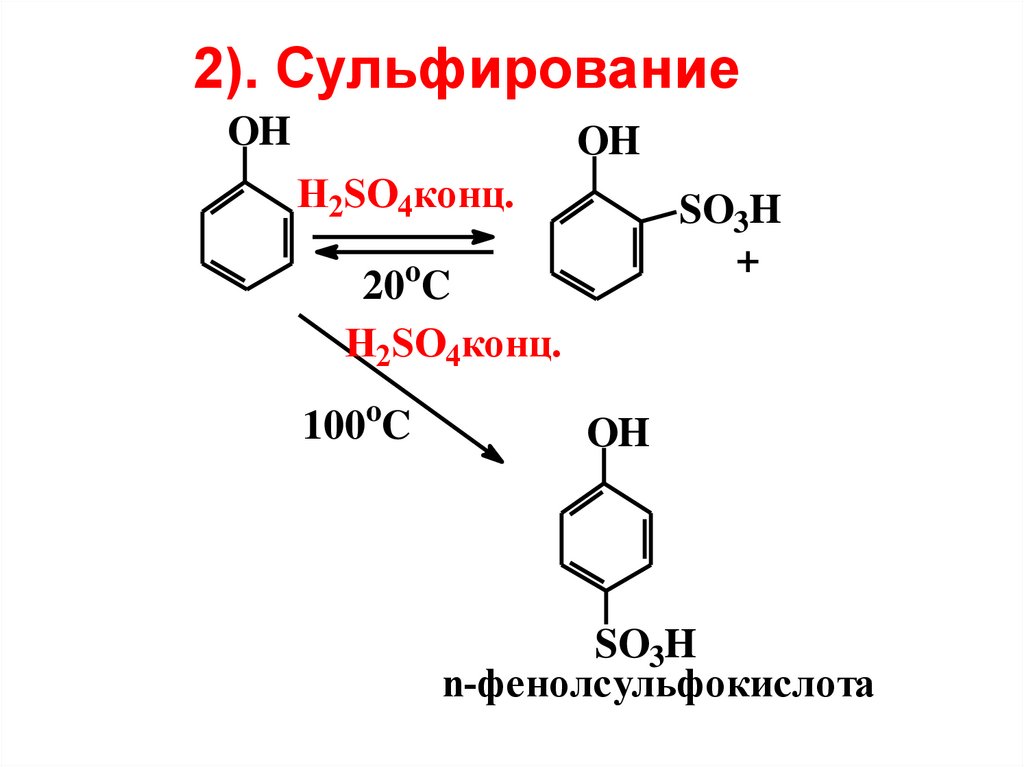
67.
2). СульфированиеOH
OH
H2SO4конц.
SO3H
+
20oC
H2SO4конц.
100oC
OH
SO3H
n-фенолсульфокислота
68.
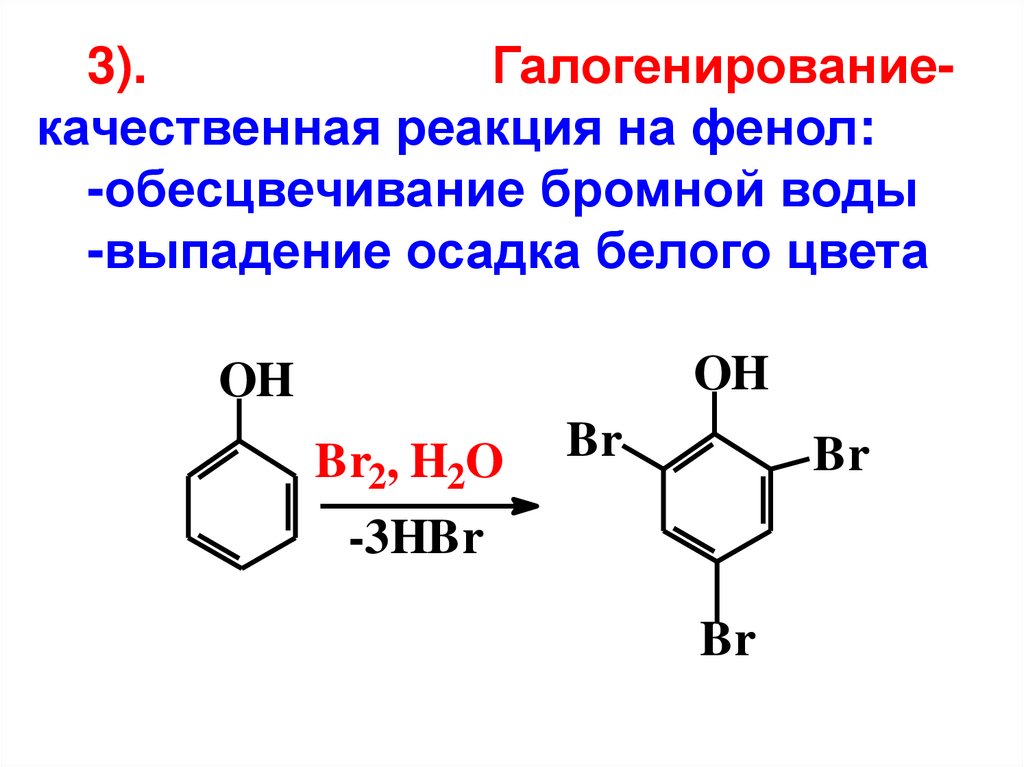
3).Галогенированиекачественная реакция на фенол:
-обесцвечивание бромной воды
-выпадение осадка белого цвета
OH
OH
Br2, H2O
Br
Br
-3HBr
Br
69.
70.
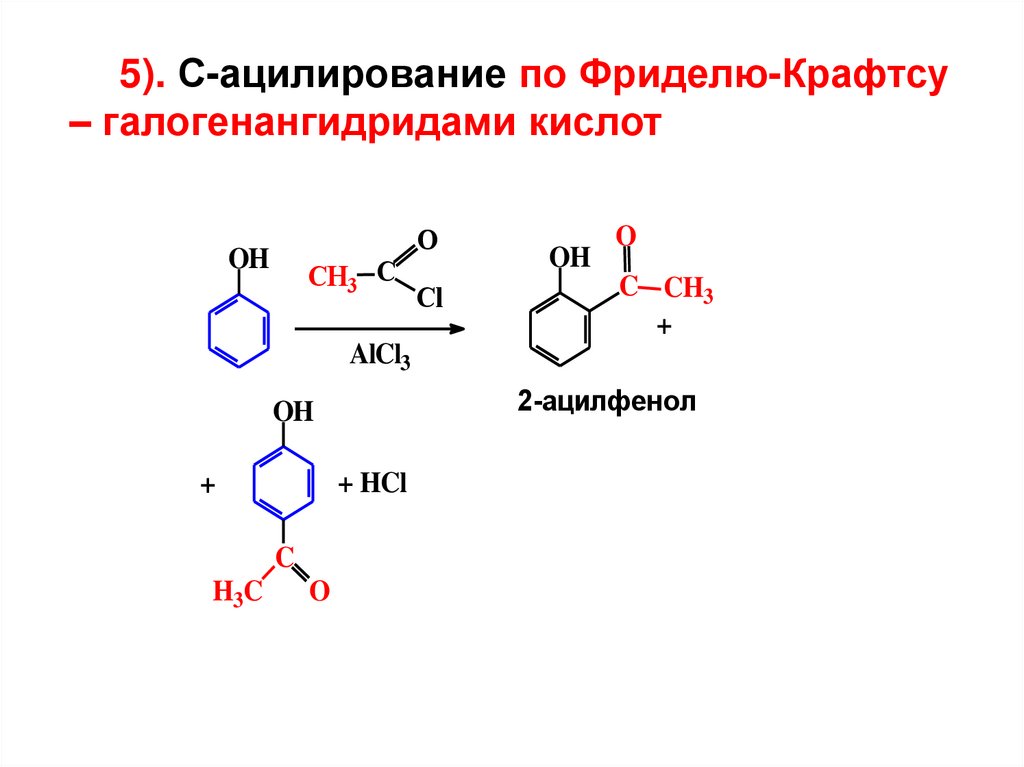
5). С-ацилирование по Фриделю-Крафтсу– галогенангидридами кислот
OH
CH3 С
O
Cl
OH
O
C CH3
+
AlCl3
2-ацилфенол
OH
+ HCl
+
C
H3C
O
71.
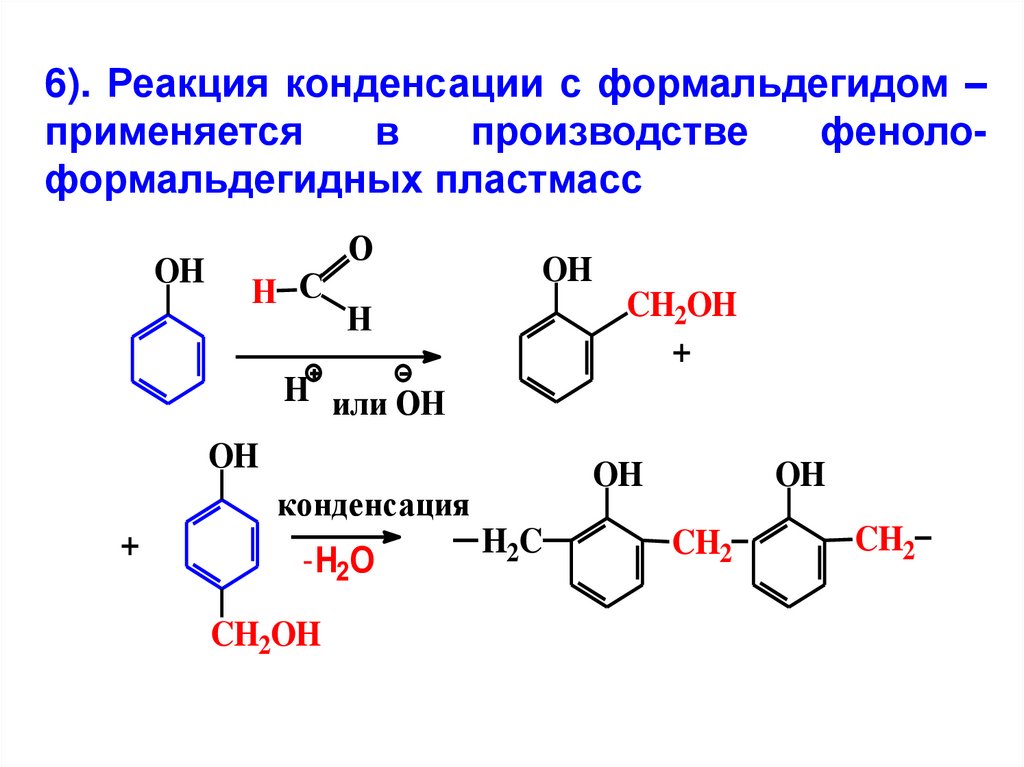
6). Реакция конденсации с формальдегидом –применяется
в
производстве
фенолоформальдегидных пластмасс
OH
H С
O
OH
CH2OH
+
H
H или OH
OH
конденсация
+
-H2O
CH2OH
OH
OH
H2C
CH2
CH2
72.
Полимер(ФФС) молекулярной массой 700-1000резол, твердая, хрупкая масса, похожая наянтарь. Применяют для производства лаков.
При нагревании до 60-90оС резол плавится.
Полученную смолу смешивают с наполнителем
(древесная мука, кварц или графит), добавляют
краситель и придают различную форму –
получают текстолит с гладкой поверхностью, не
требующей окраски.
Полимер применяют также для получения
асбеста, стекловолокна, пенопласта.
Полученные изделия обладают химической и
механической прочностью.
73.
Применение фенолов:-в производстве пластмасс, пикриновой
кислоты, салициловой кислоты, красителей,
инсектицидов, в медицине в качестве
сильного бактерицидного средства,
антиоксиданта и ингибитора окисления
Токсичность
Фенол токсичен, вызывает ожоги. Фенол и
его гомологи поражает нервную систему,
вызывает сильное раздражение слизистой
оболочки глаз, слезоточение, сухость и
першение в горле, кашель.
Полихлорарены - диоксины, обладают
мутарогенными свойствами.






























 Химия
Химия








