Похожие презентации:
Физические и химические свойства алканов
1. Физические и химические свойства алканов
2. Физические свойства алканов
tпл и t кип алканов увеличиваются с ростом молекулярноймассы.Всеалканы легчеводы, в ней не растворимы, однако растворимы в неполярных
растворителях (например,в бензоле) и самиявляются хорошимирастворителями.
3. Химические свойства алканов
1. Реакции замещенияSRСвязи между атомами углерода – сигма (прочные
ковалентные, малополярные) ⇨ для разрыва связей
необходимы большие затратыэнергии.
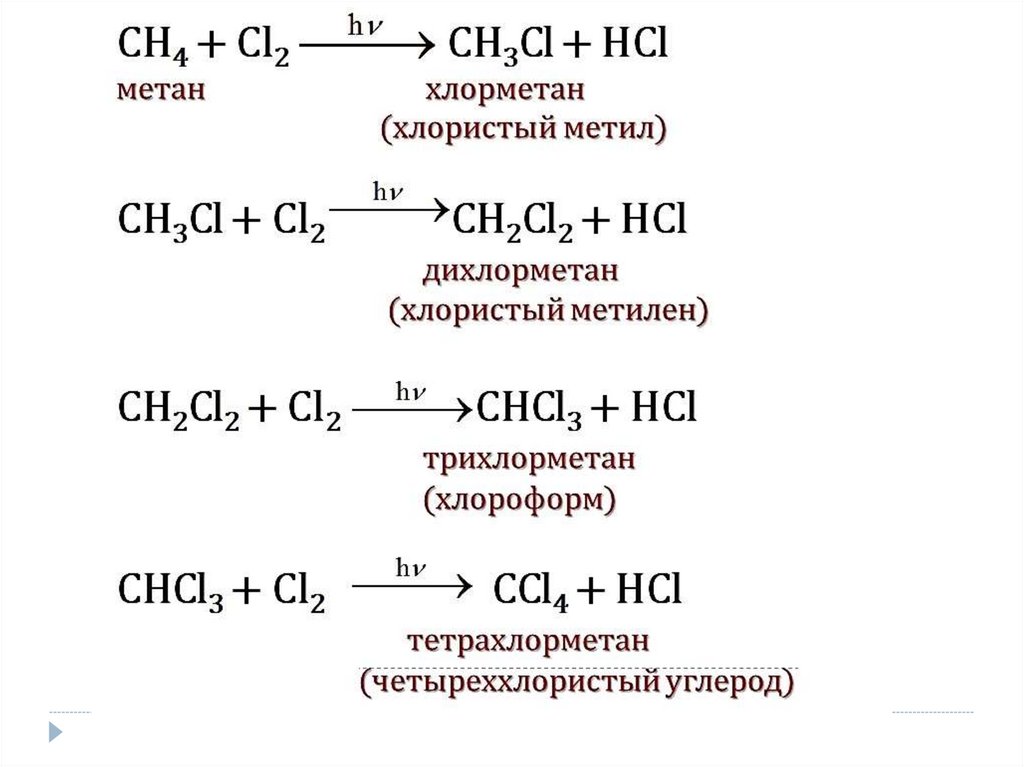
а) Галогенирование
При действии света hν или нагревании
(свободнорадикальный цепноймеханизм).
Со фтором реакция идёт со взрывом.
С хлором и бромом требуется инициатор.
Йодирование происходит обратимо, поэтому
требуется окислитель для удаления HIиз реакции.
4.
5. Радикальные реакции имеют цепной механизм, включающий стадии: зарождение, развитие и обрыв цепи
Радикальные реакцииимеют цепной механизм,включающийстадии: зарождение, развитие и
обрыв цепи
(свободнорадикальные цепные реакции)
1. Зарождение цепи (инициирование):
Cl2 → Cl . + Cl.
2. Рост (развитие) цепи:
СН4+ Cl . → СН3. +НCl
CH.3+ Cl2 → CH-3 Cl+ Cl .
3. Обрыв цепи:
CH.+ Cl. → CHCl
3
3
CH. + CH. → CH- CH
3
Cl . +
3
Cl. → Cl2
3
3
6. Лауреат Нобелевской премии по химии
за разработкутеории цепных
реакций.
СемёновНиколайНиколаевич
7.
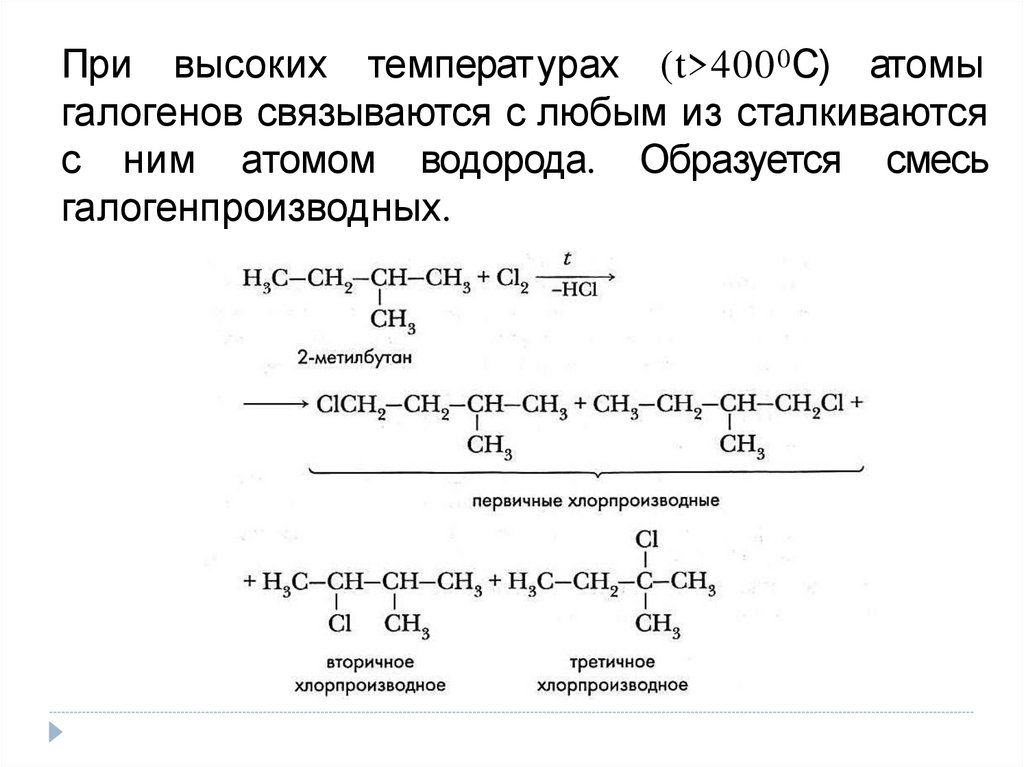
При высоких температурах (t>400 0 С) атомыгалогенов связываются с любым из сталкиваются
с ним атомом водорода. Образуется смесь
галогенпроизводных.
8.
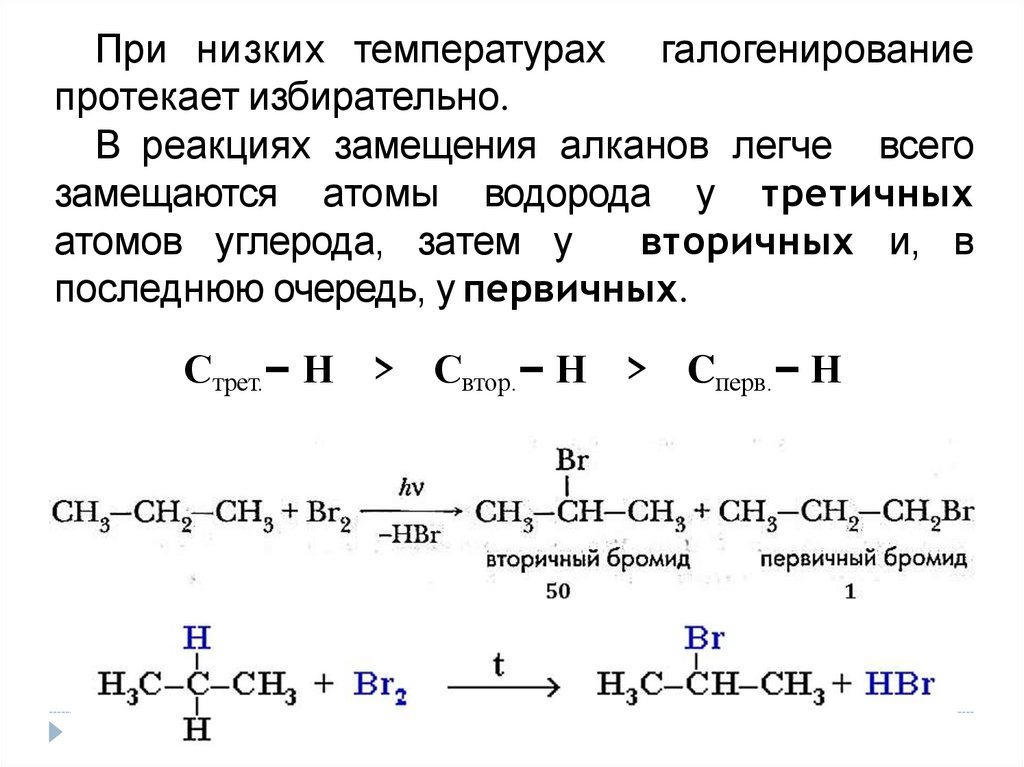
При низких температурах галогенированиепротекает избирательно.
В реакциях замещения алканов легче всего
замещаются атомы водорода у третичных
атомов углерода, затем у
вторичных и, в
последнюю очередь, у первичных.
Стрет.– Н > Свтор.– Н > Cперв.– Н
9. 1. Реакции замещения SR
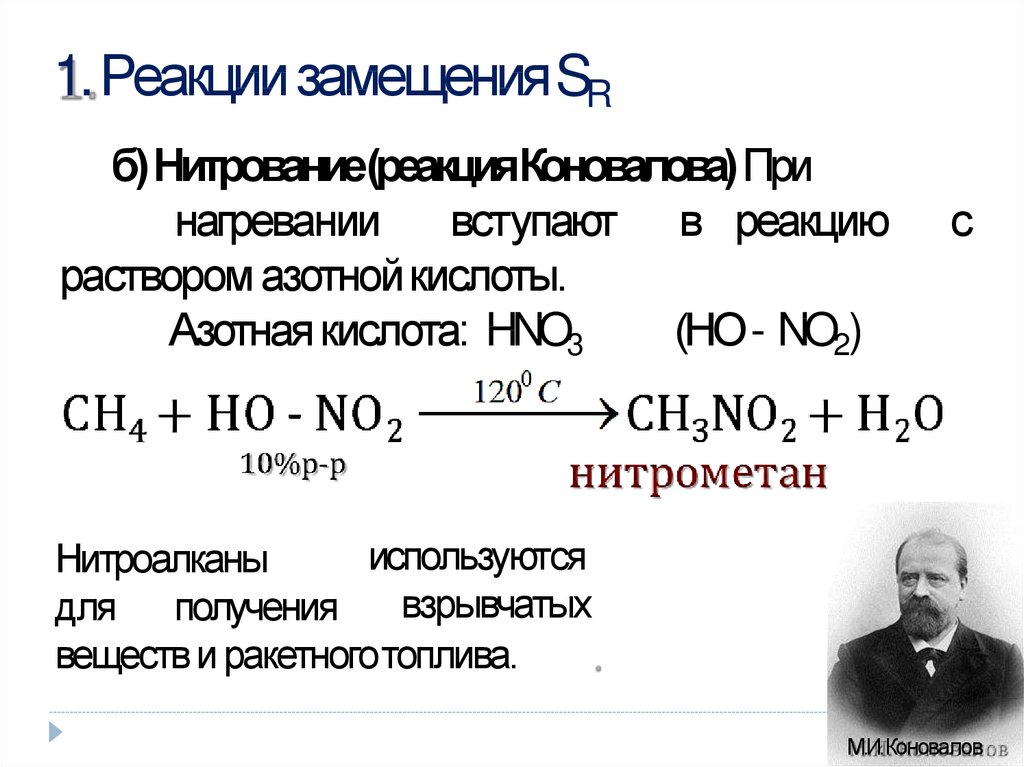
1. Реакции замещенияSRб) Нитрование(реакцияКоновалова) При
нагревании вступают в реакцию
раствором азотнойкислоты.
Азотнаякислота: HNO3
(НО - NO2)
с
используются
Нитроалканы
взрывчатых
для получения
веществ и ракетноготоплива.
М.И.Коновалов
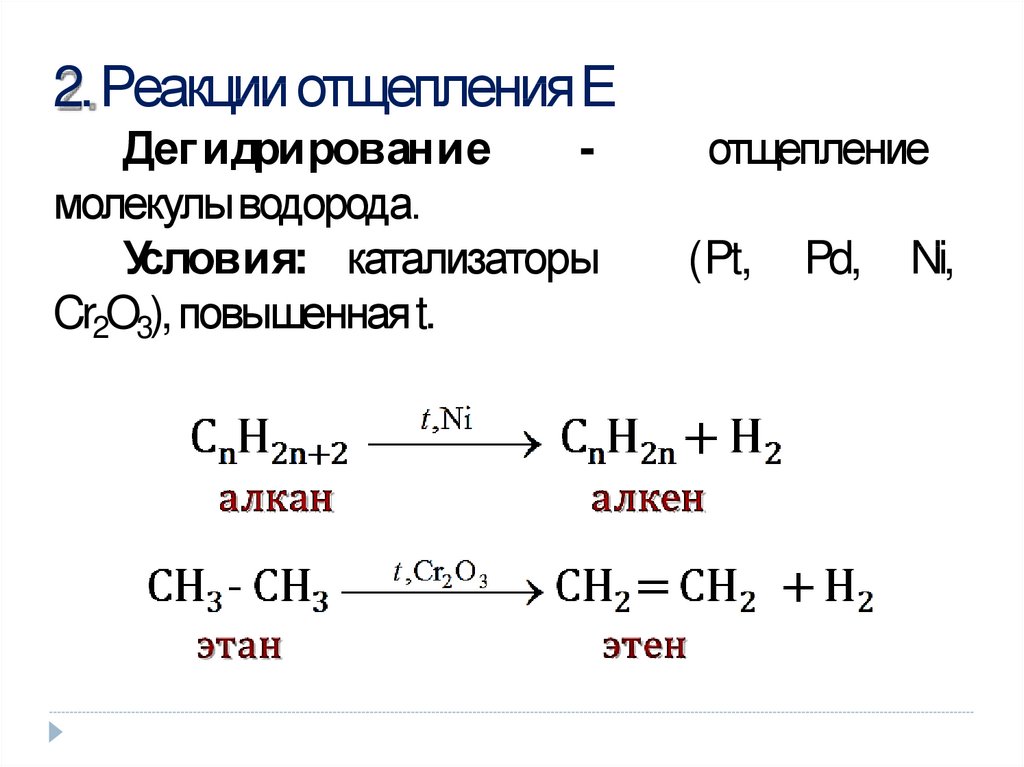
10. 2. Реакции отщепления Е
2. Реакции отщепленияЕДег идрирование
молекулыводорода.
Условия: катализаторы
Cr2O3), повышеннаяt.
отщепление
(Pt,
Pd,
Ni,
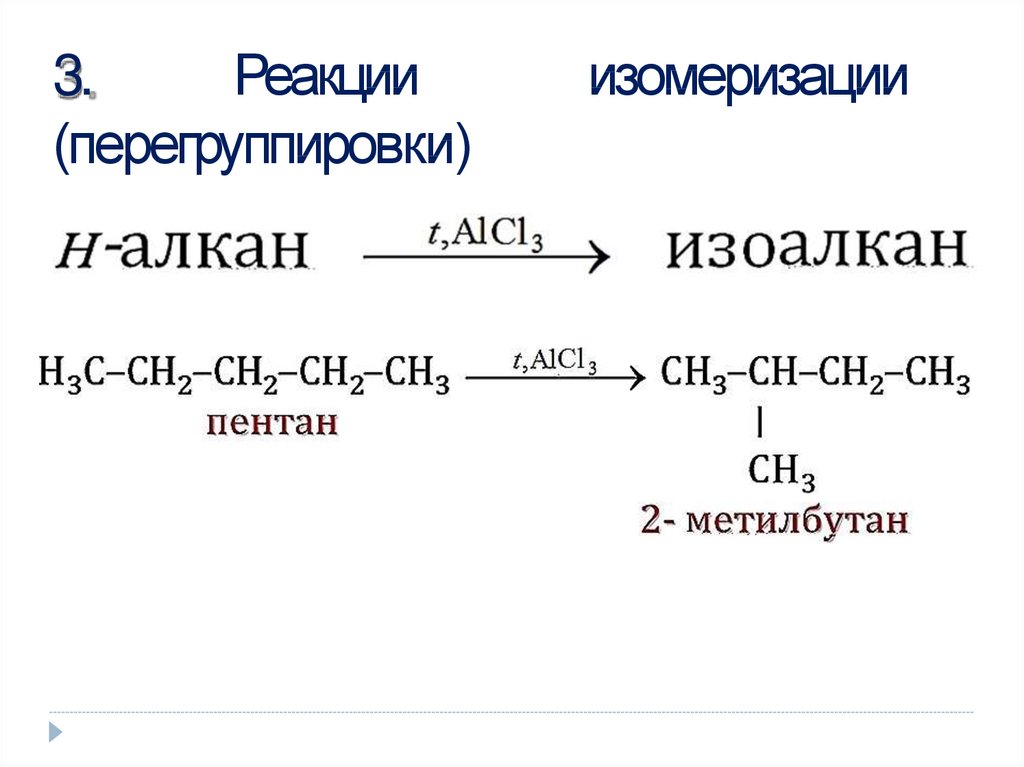
11. изомеризации
3.Реакции
(перегруппировки)
изомеризации
12. 4. Реакции разложения
4. Реакцииразложенияа) Крекинг- разложение алкановпри
высокой температуре (с разрывом -С- Ссвязей):
-термическийкрекинг
- каталитическийкрекинг
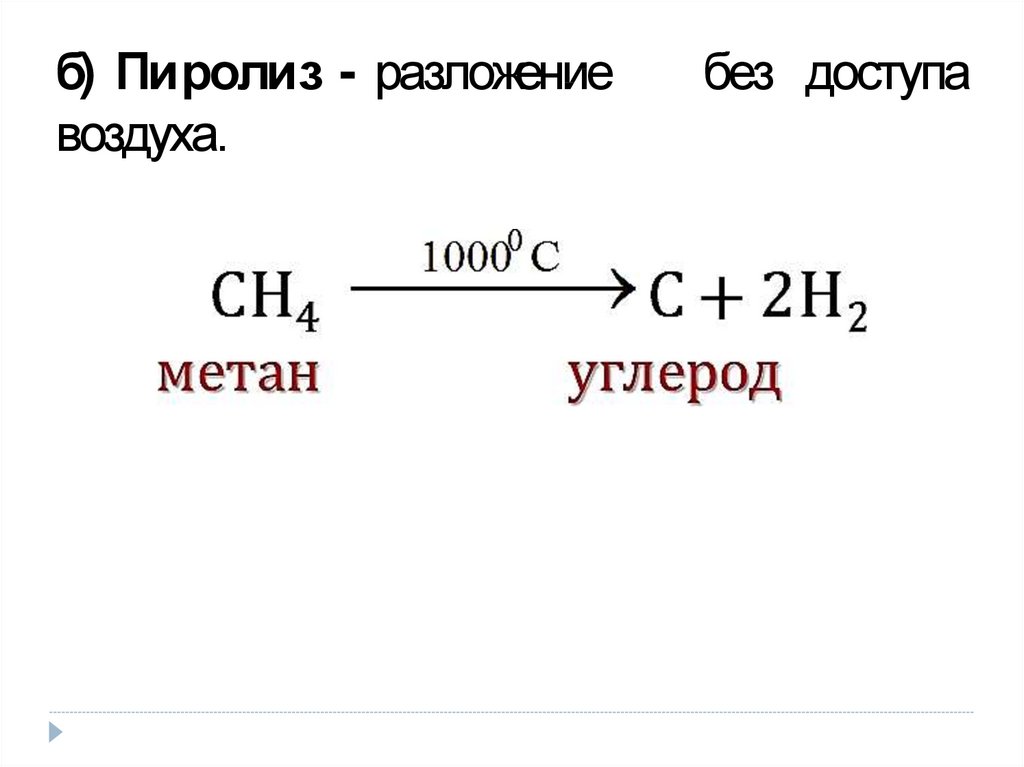
13. б) П и р о л и з - разложение без доступа воздуха.
б) Пиролиз - разложениевоздуха.
без доступа
14.
в)При
происходит
водорода:
нагревании
образование
до 15000С
ацетилена и
15. г) К о н в е р с и я м е т а н а - взаимодействие
г) Конверсия метана - взаимодействиеметана с нагретым
водяным паром в
присутствии
никелевого
катализатора
с
образованием синтез– газа(смесьСОиН2). Синтезгаз
используют
для
получения
кислородсодержащих
органических
веществ и синтетическогобензина.
16. 5. Реакции горения -
при горенииалканов выделяется большое количество
теплоты, многие алканы используются в качестве
топлива.
Метан, этан, пропан, бутан горят бесцветным
пламенем;при горении гексана и гептана образуется
многокопоти.
17.
Помните!Смесь метана с воздухом и
кислородом взрывоопасна
V(CH4) :V(O2) =1: 2
V(CH4) :V(воздуха) =1 :10
18. Взаимное влияние атомов в молекулах галогенпроизводных алканов
Взаимное влияние атомоввмолекулах галогенпроизводных
алканов
I. Индуктивный эффект (I)- смещение
электронной плотности по σ-связям за счет
различныхзначенийЭОсвязанных атомов.
Индуктивный эффект заместителя быстро
затухает по мере увеличения длины цепи.
19. –I (отрицательный индуктивный эффект) - обладают атомы или группы атомов, которые смещают электронную плотность от атома
–I (отрицательный индуктивный эффект) обладают атомы или группы атомов, которыесмещают электронную плотность от атома
углеродав свою сторону (-F,-Cl,-Br,-OH,-NH2)
20. +I (положительный индуктивный эффект) - обладают атомы или группы атомов, которые смещают электронную плотность в сторону более
+I (положительный индуктивный эффект) обладают атомы или группы атомов, которыесмещают электронную плотность в сторону
более ЭОатома (CH3-,H-).
21. §12 стр.82-86 упр. 4
Домашнее задание:§12
стр.82-86 упр. 4














 Химия
Химия








