Похожие презентации:
Пароксизмальная ночная гемоглобинурия: патогенез и лечение
1.
Межрегиональная научно -практическая конференция« Актуальные вопросы гематологии. Реальная клиническая практика и современные тренды
терапии».
г.Казань
« Пароксизмальная ночная гемоглобинурия:
Патогенез и лечение»
Шамсутдинова Алина Фаридовна
ГКБ №16 , врач -гематолог
Лекция при поддержке компании АстраЗенека
Представлена информация только в рамках зарегистрированных в РФ показаний
Мнение лектора не всегда может совпадать с точкой зрения компании АстраЗенека
Номер одобрения
Дата одобрения :
Дата истечения:
2.
Что такое ПНГ?ПНГ – это хроническое жизнеугрожающее редкое заболевание крови, характеризующееся
комплемент-опосредованным внутрисосудистым гемолизом1,2
ПНГ поражает мужчин и женщин всех возрастов и в основном диагностируется в возрасте
от 30 до 35 лет.1,3 Расчетная распространенность ПНГ составляет 16 случаев на миллион,
а заболеваемость данной патологией составляет 1,3 на миллион всего населения4
Исторически до 35% пациентов с ПНГ умирали в течение пяти лет после постановки диагноза
по причине осложнений данного заболевания, несмотря на проведение наилучшей
поддерживающей терапии2
С момента введения таргетной терапии, прицельно воздействующей на систему комплемента,
которая является частью иммунной системы, выживаемость пациентов с ПНГ улучшилась
до уровня, аналогичного выживаемости в общей популяции5
ПНГ – пароксизмальная ночная гемоглобинурия.
1. Hill A, Richards SJ, Hillmen P. Br J Haematol. 2007 May;137(3):181–92; 2. Hillmen P, Lewis SM, Bessler M et al. N Engl J Med.1995 Nov 9;333(19):1253–8; 3. Socié G et al. Lancet. 1996 Aug
31;348(9027):573-7. doi: 10.1016/s0140-6736(95)12360-1; 4. Hill A et al. Eur J Haematol. 2021 Aug;107(2):211-218. doi: 10.1111/ejh.13640.; 5. Kelly RJ, et al. Blood. 2011 Jun 23;117(25):6786-92. doi:
10.1182/blood-2011-02-333997
3.
Признаки и симптомы ПНГ• При ПНГ пациенты могут испытывать ряд
симптомов, которые у разных людей могут
отличаться1
• Пациенты с высокой активностью заболевания
(ЛДГ >1,5x ВГН) и 1 или более клиническими
симптомами имеют повышенный риск ТЭ2
Усталость4
Анемия3
Дисфагия4
Одышка4
Боль в животе4
Эректильная дисфункция4
Крайне важно регулярно оценивать
уровни ЛДГ и отслеживать
клинические признаки и симптомы ПНГ2
Гемоглобинурия4
40% - 67%
ПНГ – пароксизмальная ночная гемоглобинурия.
ТЭ – тромбоэмболии
ВГН – верхняя граница нормы
ЛДГ – лактатдегидрогеназа
смертей от ПНГ
обусловлены венозным
или артериальным
тромбозом3
8% - 18%
47%
смертей от ПНГ,
вызваны почечной
недостаточностью3
страдают легочной
гипертензией4
1. Morado M, Freire Sanders A, Colado E, et al. Cytometry Part B (Clinical Cytometry) 2017;92B:361–70; 2. Lee JW, Jang JH, Kim JS, et al. IInt J Hematol. 2013 Jun;97(6):749-57. doi: 10.1007/s12185013-1346-4. 3. Nishimura et al, Medicine (Baltimore). 2004 May;83(3):193-207. doi: 10.1097/01.md.0000126763.68170.46. 4. Hill et al, Br J Haematol, 2006;133(Suppl (1):119 Abstract 316
https://onlinelibrary.wiley.com/doi/epdf/10.1111/j.1365-2141.2006.06027.x (Data access 24.07.2023)
4.
Диагностика ПНГ5.
КРИТЕРИИ УСТАНОВЛЕНИЯДИАГНОЗА/СОСТОЯНИЯ:
Диагноз ПНГ устанавливается на основании:
Характерной клинической и лабораторной картины вну трисосудистого
гемолиза
Выявления в периферической крови ПНГ-клона методом проточной
цитометрии.
Российские клинические рекомендации МЗ РФ по ПНГ 2021 Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
6.
ДИАГНОЗ ПНГ СЛЕДУЕТ ЗАПОДОЗРИТЬ У ПАЦИЕНТОВСО СЛЕДУЮЩИМИ КЛИНИЧЕСКИМИ И
ЛАБОРАТОРНЫМИ ПРОЯВЛЕНИЯМИ ЗАБОЛЕВАНИЯ:
Нал ичие признаков вну трис ос удис т ого г емол иза
Нал ичие признаков г емол иза в комбинац ии с:
Гипохромной и/или микроцит арной анемией
Абдоминальными болями
Дисфаг ией
Тромбозами
Нейтро- или тромбоц ит опенией
Тромбозы редких л ок ал изац ий ил и с необычными проявл ениями:
Тромбозы собс твенных вен печени (синдром Бадда-Киари ), тромбозы сосудов портальной сис темы,
венозных синусов головног о мозга, вен кожи
Сопу тс твующая гемолитическ ая анемия
Неясная цитопения
Признаки кос тномозг овой недос таточнос ти
Предпол аг аемая или доказанная АА ( аплас тическ ая анемия)
Предпол аг аемый или доказанный МДС ( миелодиспл ас тический синдром)
Цитопенические синдромы, этиология которых ос талась не ясной после полноценног о гематолог ическог о
обследования.
Российские клинические рекомендации МЗ РФ по ПНГ 2021Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
7.
ДИАГНОСТИКА АНЕМИИ И ВНУ ТРИСОСУДИСТОГОГЕМОЛИЗА
Рекомендуется всем пациентам с подозрением на ПНГ или впервые установленным
диагнозом ПНГ исследование ру тинных лабораторных показателей:
• общий (клинический) анализ крови разверну тый;
• анализ крови биохимический общетерапевтический (определение активности
аланинаминотрансферазы, аспартатаминотрансферазы, ЛДГ, креатинина,
мочевины, билирубина связанного (конъюгированного), билирубина свободного
(неконъюгированного), ферритина, исследование железосвязывающей
способности сыворотки, железа, исследование уровня свободного гемоглобина в
плазме крови, при дост упности – исследование уровня гаптоглобина крови);
• прямой антиглобулиновый тест (прямая проба Кумбса);
• непрямой антиглобулиновый тест (тест Кумбса) - только пациентам, получающим
заместительные гемотрансфузии;
• общий (клинический) анализ мочи с определением гемосидерина в моче.
Для активного вну трисосудистого гемолиза характерно повышение
активности ЛДГ, общего билирубина за счет непрямой фракции,
свободного гемоглобина плазмы, а также истощение гаптоглобина и
появление гемосидерина в моче.
Российские клинические рекомендации МЗ РФ по ПНГ 2021 Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
8.
ЛАБОРАТОРНЫЕ ДИАГНОСТИЧЕСКИЕ ИССЛЕДОВАНИЯ ПРИПНГ
Стандартом диагностики ПНГ у пациентов с клинической и лабораторной
картиной вну трисосудистого гемолиза является определение GPIсвязанных гликопротеинов на поверхности эритроцитов (С D59),
нейтрофилов (СD24/FLAER), моноцитов (СD14/FLAER) методом проточной
цитометрии.
Ранее использовавшиеся пробы Хема (кислотная проба) и Хартмана
(сахарозная проба) в настоящее время имеют лишь историческое
значение и не рекомендуются к применению.
Российские клинические рекомендации МЗ РФ по ПНГ 2021Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
9.
ОПРЕДЕЛЕНИЕ ПНГ-КЛОНА МЕТОДОМ ПРОТОЧНОЙЦИТОМЕТРИИ
Проточная цитометрия позволяет выявить процент клеток с дефицитом или
полным отсу тствием GPI-связанных гликопротенинов (GPI-АР). Выделяют 3
типа эритроцитов: эритроциты с нормальной экспрессией GPI-АР (I типа),
эритроциты с частичным дефицитом GPI-АР (II типа), эритроциты с полным
отсу тствием GPI-АР (III типа). Ответ дается лабораторией в виде процентного
содержания того или иного типа клеток в периферической крови.
Российские клинические рекомендации МЗ РФ по ПНГ 2021Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
10.
Лечение ПНГ• Поддерживающая терапия
• Патогенетическая терапия (антикомплементарная терапия)
• Эрадикация ПНГ клона – трансплантация гемопоэтических
стволовых клеток.
Российские клинические рекомендации МЗ РФ по ПНГ 2021Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
11.
Патогенетическая терапия экулизумабом у пациентов с ПНГрекомендована пациентам с активным внутрисосудистым
гемолизом (уровень общей ЛДГ более 1,5 ВГН) в следующих
клинических ситуациях:
• Наличие в анамнезе тромботических осложнений, в развитии
которых ведущую роль играет внутрисосудистый гемолиз
• Трансфузионная зависимость вследствие хронического гемолиза
• Наличие симптомов гладкомышечной дистонии, обусловленных
гемолизом (дисфагия, абдоминальные боли, боли в груди и др.)
• Нарушения функциональной способности почек, обусловленные
внутрисосудистым гемолизом, включая эпизоды острого
повреждения почек и критерии хронической болезни почек.
Российские клинические рекомендации МЗ РФ по ПНГ 2021Доступно онлайн от 01.09.2024 https://cr.minzdrav.gov.ru/
12.
УЛТОМИРИС ®Механизм действия
13.
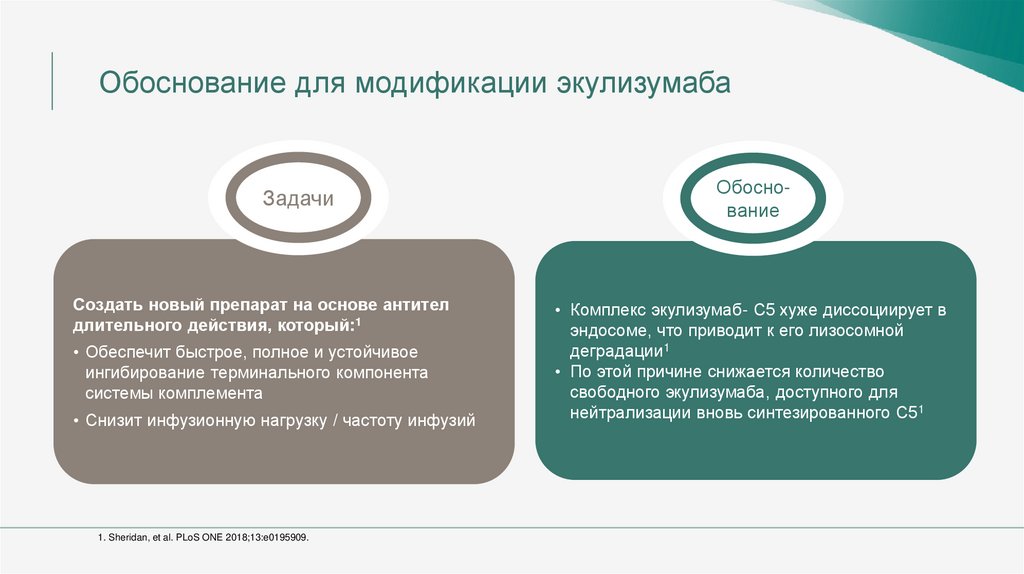
Обоснование для модификации экулизумабаЗадачи
Создать новый препарат на основе антител
длительного действия, который:1
• Обеспечит быстрое, полное и устойчивое
ингибирование терминального компонента
системы комплемента
• Снизит инфузионную нагрузку / частоту инфузий
1. Sheridan, et al. PLoS ONE 2018;13:e0195909.
Обоснование
• Комплекс экулизумаб- С5 хуже диссоциирует в
эндосоме, что приводит к его лизосомной
деградации1
• По этой причине снижается количество
свободного экулизумаба, доступного для
нейтрализации вновь синтезированного C51
14.
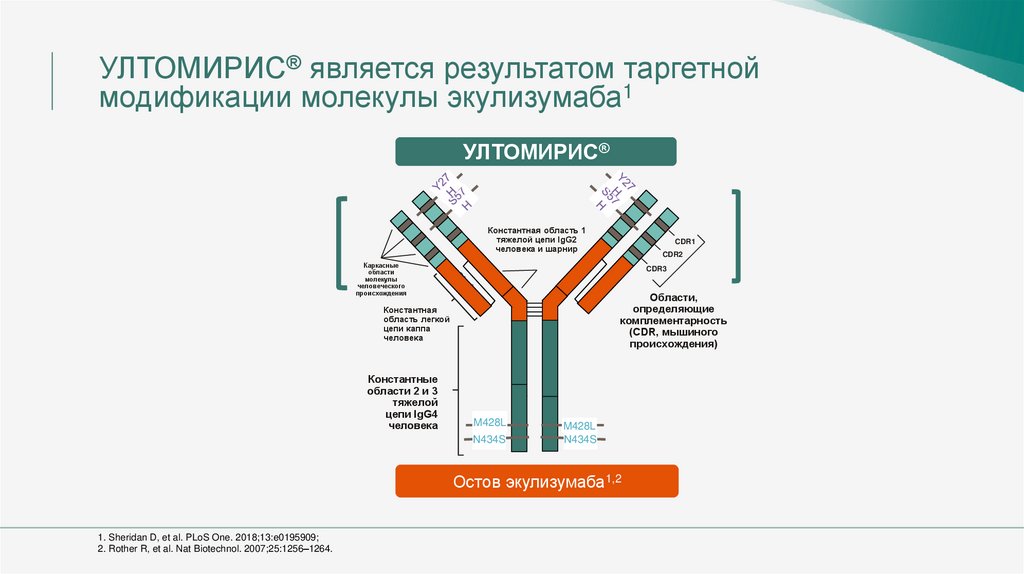
УЛТОМИРИС® является результатом таргетноймодификации молекулы экулизумаба1
УЛТОМИРИС®
Константная область 1
тяжелой цепи IgG2
человека и шарнир
Каркасные
области
молекулы
человеческого
происхождения
CDR3
Области,
определяющие
комплементарность
(CDR, мышиного
происхождения)
Константная
область легкой
цепи каппа
человека
Константные
области 2 и 3
тяжелой
цепи IgG4
человека
CDR1
CDR2
M428L
N434S
M428L
N434S
Остов экулизумаба1,2
1. Sheridan D, et al. PLoS One. 2018;13:e0195909;
2. Rother R, et al. Nat Biotechnol. 2007;25:1256–1264.
15.
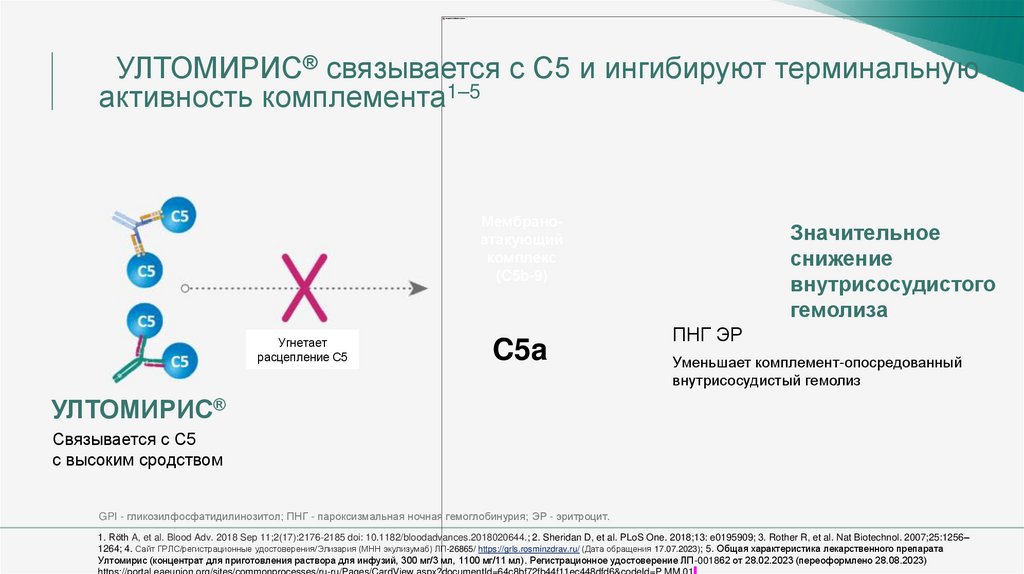
УЛТОМИРИС® связывается с С5 и ингибируют терминальнуюактивность комплемента1–5
Мембраноатакующий
комплекс
(C5b-9)
C5
C5
C5
Угнетает
расцепление С5
C5a
Значительное
снижение
внутрисосудистого
гемолиза
ПНГ ЭР
Уменьшает комплемент-опосредованный
внутрисосудистый гемолиз
УЛТОМИРИС®
Связывается с C5
с высоким сродством
GPI - гликозилфосфатидилинозитол; ПНГ - пароксизмальная ночная гемоглобинурия; ЭР - эритроцит.
1. Röth A, et al. Blood Adv. 2018 Sep 11;2(17):2176-2185 doi: 10.1182/bloodadvances.2018020644.; 2. Sheridan D, et al. PLoS One. 2018;13: e0195909; 3. Rother R, et al. Nat Biotechnol. 2007;25:1256–
1264; 4. Сайт ГРЛС/регистрационные удостоверения/Элизария (МНН экулизумаб) ЛП-26865/ https://grls.rosminzdrav.ru/ (Дата обращения 17.07.2023); 5. Общая характеристика лекарственного препарата
Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от 28.02.2023 (переоформлено 28.08.2023)
https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
16.
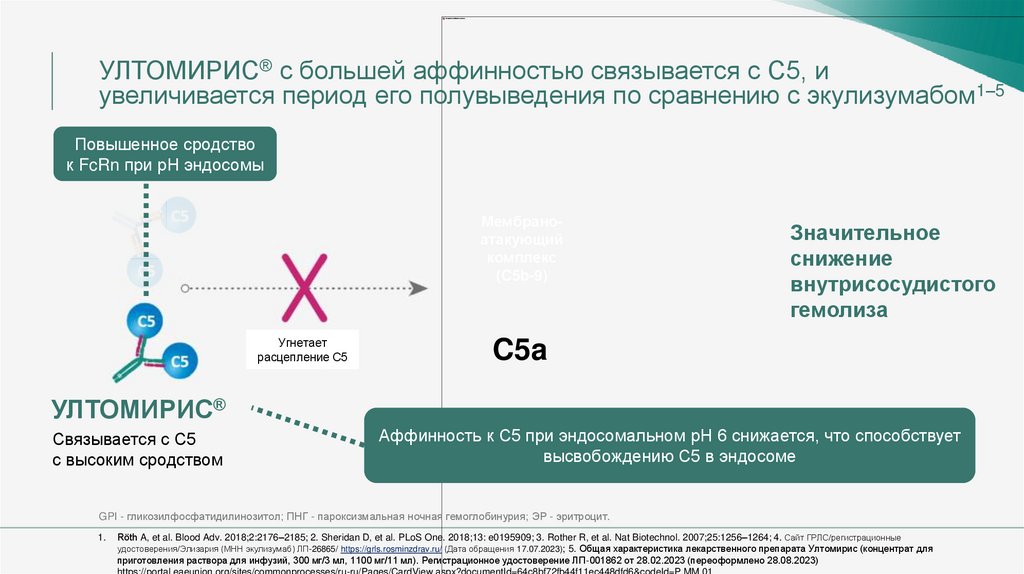
УЛТОМИРИС® с большей аффинностью связывается с С5, иувеличивается период его полувыведения по сравнению с экулизумабом1–5
Повышенное сродство
к FcRn при рН эндосомы
Мембраноатакующий
комплекс
(C5b-9)
Угнетает
расцепление С5
Значительное
снижение
внутрисосудистого
гемолиза
C5a
УЛТОМИРИС®
Связывается с C5
с высоким сродством
Аффинность к С5 при эндосомальном рН 6 снижается, что способствует
высвобождению С5 в эндосоме
GPI - гликозилфосфатидилинозитол; ПНГ - пароксизмальная ночная гемоглобинурия; ЭР - эритроцит.
1.
Röth A, et al. Blood Adv. 2018;2:2176–2185; 2. Sheridan D, et al. PLoS One. 2018;13: e0195909; 3. Rother R, et al. Nat Biotechnol. 2007;25:1256–1264; 4. Сайт ГРЛС/регистрационные
удостоверения/Элизария (МНН экулизумаб) ЛП-26865/ https://grls.rosminzdrav.ru/ (Дата обращения 17.07.2023); 5. Общая характеристика лекарственного препарата Ултомирис (концентрат для
приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от 28.02.2023 (переоформлено 28.08.2023)
https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
17.
УЛТОМИРИС® связывается с С5 в кровотокеи предотвращает его активацию1
™
Молекулы иммуноглобулина G подвергаются постоянному неспецифическому пиноцитозу
эндотелиальными клетками и доставляются в подкисленные эндосомы.
1. Sheridan D, et al. PLoS One. 2018;13:e0195909.
18.
УЛТОМИРИС® высвобождает С5 в лизосому для дальнейшейдеградации, а затем сам подвергается рециркуляции1
УЛТОМИРИС™
УЛТОМИРИС® высвобождает С5 в подкисленной эндосоме, оставляя здесь С5 для лизосомального
расщепления. В данной подкисленной среде также увеличивается сродство УЛТОМИРИС ® к неонатальному Fcрецептору, что способствует более активному возвращению молекулы препарата на клеточную поверхность
посредством FcRn-опосредованной рециркуляции1,2
FcRn - неонатальный Fc-рецептор
1.
Sheridan D, et al. PLoS One. 2018;13:e0195909;
2. Общая характеристика лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП001862 от 28.02.2023 (переоформлено 28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
19.
УЛТОМИРИС® возвращается в кровоток для повторногосвязывания с большим количеством С51
1. Sheridan D, et al. PLoS One 2018;13:e0195909.
20.
УЛТОМИРИС® обеспечивает немедленное, полное иустойчивое ингибирование C5 в течение восьми недель1,2
Исследование смены терапии на УЛТОМИРИС®2b
Исследование УЛТОМИРИС® у ранее не получавших
терапии ингибиторами системы комплемента1a
(μg/mL)
ЭКУЛИЗУМАБ
Soliris®
Средние (95% ДИ) концентрации свободного С5 в группах УЛЬТОМРИС™ и экулизумаба с течением времени.
Горизонтальная линия указывает на уровень свободного С5 0,5 мг/мл. Уровни свободного С5 <0,5 мг/мл
свидетельствуют о полном ингибировании активности С5 (дополнительную информацию см. в примечаниях к слайду).
По материалам: Lee JW, et al. Blood. 2019;133:530–539.
(μg/mL)
УЛТОМИРИС®
УЛТОМИРИС®
ЭКУЛИЗУМАБ
Средние (95% ДИ) концентрации свободного С5 в группах УЛЬТОМРИС™ и экулизумаба с течением времени.
Горизонтальная линия указывает на уровень свободного С5 0,5 мг/мл. Уровни свободного С5 <0,5 мг/мл свидетельствуют о
полном ингибировании активности С5 (дополнительную информацию см. в примечаниях к слайду).
По материалам: Kulasekararaj AG, et al. Blood. 2019;133:540–549.
• УЛТОМИРИС® обеспечивает снижение уровня свободного С5 на >99% к концу первой инфузии и это снижение сохраняется в
течение восьми недель как у пациентов, ранее не получавших экулизумаб, так и у пациентов, ранее получавших такую
терапию1,2
• Уровни свободного С5 <0,5 мкг/мл коррелируют с максимальным уровнем контроля внутрисосудистого гемолиза и полным
ингибированием терминального звена системы комплемента3
a Открытое, рандомизированное, многоцентровое исследование фазы III с активным контролем. Эффективность и безопасность УЛТОМИРИС® оценивали в выборке взрослых (≥18 лет) пациентов с ПНГ, ранее не получавших экулизумаб.
b Открытое, рандомизированное, многоцентровое исследование фазы III с активным контролем. Эффективность и безопасность УЛТОМИРИС® оценивали в выборке взрослых (≥18 лет) пациентов с ПНГ, у которых была достигнута клиническая
стабилизация на фоне терапии экулизумабом в течение ≥6 месяцев.
ИСХ - исходный этап (последнее доступное значение оценки перед введением первой дозы исследуемого препарата).
1.
Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3. 2. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced
adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-2018-09-876805 3. Общая характеристика лекарственного препарата Ултомирис (концентрат
для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от 28.02.2023 (переоформлено 28.08.2023)
https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
21.
ВыводБлагодаря увеличенному периоду полувыведения и расчету дозы по массе тела,
УЛТОМИРИС® позволяет свести к минимуму количество инфузий, обеспечивая при этом
устойчивое ингибирование C5 в течение восьми недель1,2,3
ПНГ - пароксизмальная ночная гемоглобинурия.
1.
Sheridan, et al. PLoS ONE. 2018;13:e0195909; 2. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3.; Общая характеристика лекарственного
препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от 28.02.2023 (переоформлено
28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
22.
Показания1ПОКАЗАНИЯ
Препарат УЛТОМИРИС показан для лечения взрослых и пациентов детского возраста с массой тела не
менее 10 кг с ПНГ:
- пациентов с гемолизом с клиническими симптомами, свидетельствующими о высокой активности
заболевания;
- пациентов, у которых наблюдается клинически стабильное состояние после лечения экулизумабом в
течение не менее 6 предшествующих месяцев
ПНГ - пароксизмальная ночная гемоглобинурия.
Общая характеристика лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от
28.02.2023 (переоформлено 28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
23.
Исследование с участием пациентов, ранеене получавших ингибиторы комплемента
24.
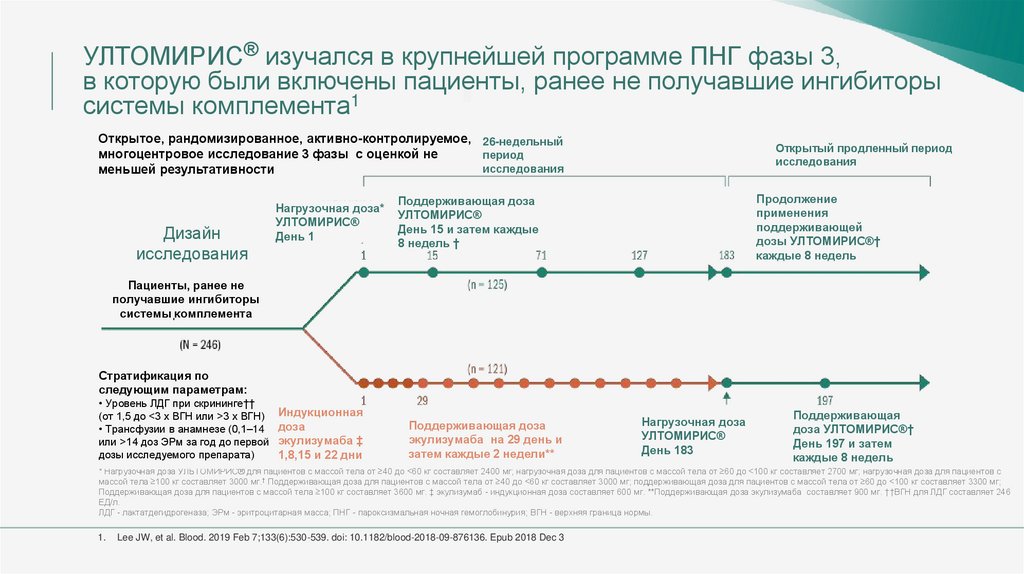
УЛТОМИРИС® изучался в крупнейшей программе ПНГ фазы 3,в которую были включены пациенты, ранее не получавшие ингибиторы
системы комплемента1
Открытое, рандомизированное, активно-контролируемое, 26-недельный
многоцентровое исследование 3 фазы с оценкой не
период
исследования
меньшей результативности
Дизайн
исследования
Нагрузочная доза*
УЛТОМИРИС®
День 1
‡
**
Открытый продленный период
исследования
Продолжение
применения
поддерживающей
дозы УЛТОМИРИС®†
каждые 8 недель
Поддерживающая доза
УЛТОМИРИС®
День 15 и затем каждые
8 недель †
Пациенты, ранее не
получавшие ингибиторы
системы комплемента
Стратификация по
следующим параметрам:
• Уровень ЛДГ при скрининг円
(от 1,5 до <3 x ВГН или >3 x ВГН)
• Трансфузии в анамнезе (0,1–14
или >14 доз ЭРм за год до первой
дозы исследуемого препарата)
Индукционная
доза
экулизумаба ‡
1,8,15 и 22 дни
Поддерживающая доза
экулизумаба на 29 день и
затем каждые 2 недели**
Нагрузочная доза
УЛТОМИРИС®
День 183
Поддерживающая
доза УЛТОМИРИС®†
День 197 и затем
каждые 8 недель
* Нагрузочная доза УЛЬТОМИРИС® для пациентов с массой тела от ≥40 до <60 кг составляет 2400 мг; нагрузочная доза для пациентов с массой тела от ≥60 до <100 кг составляет 2700 мг; нагрузочная доза для пациентов с
массой тела ≥100 кг составляет 3000 мг.† Поддерживающая доза для пациентов с массой тела от ≥40 до <60 кг составляет 3000 мг; поддерживающая доза для пациентов с массой тела от ≥60 до <100 кг составляет 3300 мг;
Поддерживающая доза для пациентов с массой тела ≥100 кг составляет 3600 мг. ‡ экулизумаб - индукционная доза составляет 600 мг. **Поддерживающая доза экулизумаба составляет 900 мг. ††ВГН для ЛДГ составляет 246
ЕД/л.
ЛДГ - лактатдегидрогеназа; ЭРм - эритроцитарная масса; ПНГ - пароксизмальная ночная гемоглобинурия; ВГН - верхняя граница нормы.
1.
Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
25.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: ключевые критерии включения (1)1
Мужчины или женщины в возрасте ≥18 лет
Доказанный диагноз ПНГ, подтвержденный результатами анализа оценкой эритроцитов и лейкоцитов с
помощью высокочувствительной проточной цитометрии, с размером клона гранулоцитов или моноцитов
≥5% и уровнем ЛДГ ≥1,5x ВГН при скрининге
Вакцинация против менингококковых инфекций в течение 3 лет до или во время начала УЛТОМИРИС®
- Пациенты, которые начали терапию препаратом УЛТОМИРИС® менее чем через 2 недели после
получения менингококковой вакцины, должны получать лечение соответствующими профилактическими
антибиотиками в течение не менее чем 2 недель после вакцинации.
Пациенты должны следовать оговоренным в протоколе мерам по предотвращению наступления
беременности во время терапии УЛТОМИРИС® и в течение 8 месяцев после введения последней дозы.
Пациенты должны желать и быть в состоянии дать письменное информированное согласие и соблюдать
все запланированные в исследовании визиты и процедуры.
ЛДГ - лактатдегидрогеназа; ПНГ - пароксизмальная ночная гемоглобинурия; ЭР – эритроциты; Лей - лейкоциты
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
26.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: ключевые критерии включения (2)1
Наличие 1 и более из следующих признаков или симптомов, связанных с ПНГ, в течение 3
месяцев до скрининга:
– Гемоглобинурия
– Анемия (гемоглобин <10 г/дл)
– Трансфузия эритроцитарной массы в анамнезе по причине ПНГ
– Наличие в анамнезе серьезных неблагоприятных сосудистых событий, включая тромбоз.
– Усталость
– Боль в животе
– Дисфагия
– Одышка
– Эректильная дисфункция
ПНГ - пароксизмальная ночная гемоглобинурия; RBCs, red blood cells; ULN, upper limit of normal.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
27.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: копримарные конечные точки 1
Исключение необходимости трансфузии
Определяется как доля пациентов, которым не выполняют трансфузию и которые не нуждаются в
трансфузии в соответствии с протокольными рекомендациями
Нормализация ЛДГ
Доля пациентов с внутрисосудистым гемолизом, оцененная по нормализации уровней ЛДГ
(нормализация определяется как уровень ЛДГ ≤1 раз выше ВГН (246 Ед/л) в период с 29-го по
183-й дни).
Сопервичные конечные точки служили для оценки не меньшей результативности
УЛТОМИРИС® по сравнению с экулизумабом при применении у взрослых лиц, ранее не
получавших ингибиторы системы комплемента*
*Считается достигнутым только у пациентов, которым не выполняли гемотрансфузий и которые не соответствовали указанным в протоколе критериям для выполнения трансфузии, от исходного этапа до 183-го дня.
ЛДГ - лактатдегидрогеназа; ВГН - верхняя граница нормы.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
28.
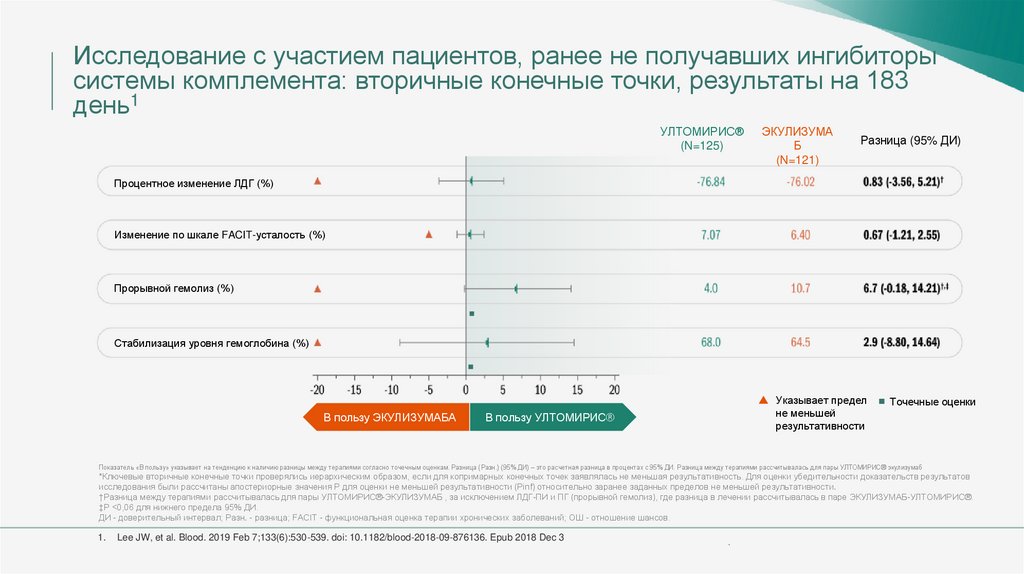
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: вторичные конечные точки1
Процентное изменение уровня ЛДГ от исходного этапа до 183-го дня
Изменение качества жизни (FACIT-усталость) от исходного этапа до 183-го дня
Доля пациентов с прорывным гемолизом. 1 и более новых или ухудшающихся симптом или
признака внутрисосудистого гемолиза на фоне повышения уровня ЛДГ 2x ВГН после
предшествующего снижения уровня ЛДГ до <1,5x ВГН на фоне терапии
Доля пациентов со стабилизированным уровнем гемоглобина. Определяется как
недопущение снижения уровня гемоглобина на ≥2 г/дл по сравнению с исходным этапом при
отсутствии выполнения трансфузии
FACIT - функциональная оценка терапии хронических заболеваний; ЛДГ - лактатдегидрогеназа; КЖ - качество жизни; ВГН - верхняя граница нормы.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3 .
29.
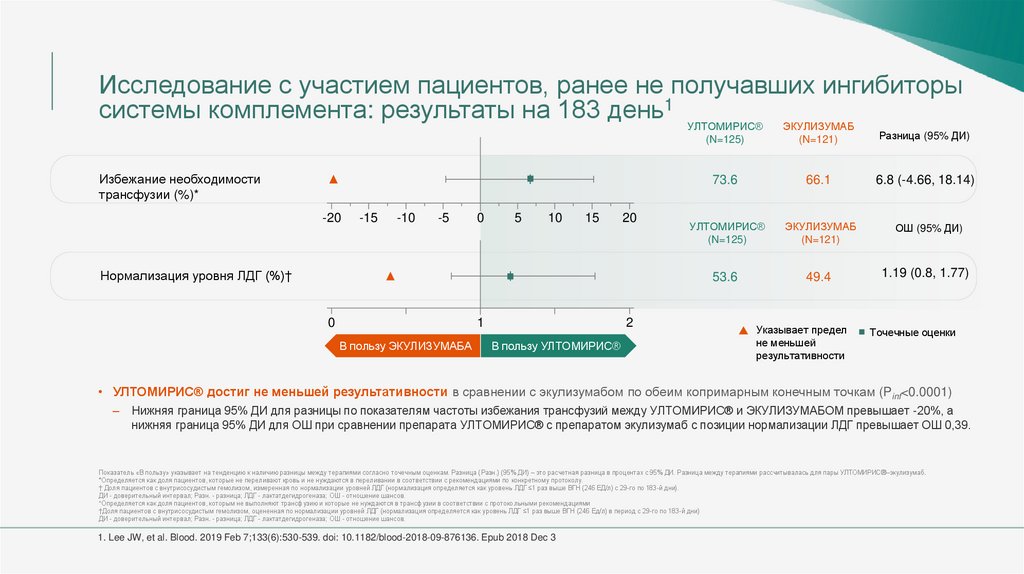
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: результаты на 183 день1 УЛТОМИРИС® ЭКУЛИЗУМАБ
Избежание необходимости
трансфузии (%)*
-20
-15
-10
-5
0
5
10
15
20
Нормализация уровня ЛДГ (%)†
0
1
В пользу ЭКУЛИЗУМАБА
2
В пользу УЛТОМИРИС®
(N=125)
(N=121)
Разница (95% ДИ)
73.6
66.1
6.8 (-4.66, 18.14)
УЛТОМИРИС®
(N=125)
ЭКУЛИЗУМАБ
(N=121)
ОШ (95% ДИ)
53.6
49.4
1.19 (0.8, 1.77)
Указывает предел
не меньшей
результативности
Точечные оценки
• УЛТОМИРИС® достиг не меньшей результативности в сравнении с экулизумабом по обеим копримарным конечным точкам (Pinf<0.0001)
–
Нижняя граница 95% ДИ для разницы по показателям частоты избежания трансфузий между УЛТОМИРИС® и ЭКУЛИЗУМАБОМ превышает -20%, а
нижняя граница 95% ДИ для ОШ при сравнении препарата УЛТОМИРИС® с препаратом экулизумаб с позиции нормализации ЛДГ превышает ОШ 0,39.
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ. Разница между терапиями рассчитывалась для пары УЛТОМИРИС®–экулизумаб.
*Определяется как доля пациентов, которые не переливают кровь и не нуждаются в переливании в соответствии с рекомендациями по конкретному протоколу.
† Доля пациентов с внутрисосудистым гемолизом, измеренная по нормализации уровней ЛДГ (нормализация определяется как уровень ЛДГ ≤1 раз выше ВГН (246 ЕД/л) с 29-го по 183-й дни).
ДИ - доверительный интервал; Разн. - разница; ЛДГ - лактатдегидрогеназа; ОШ - отношение шансов.
*Определяется как доля пациентов, которым не выполняют трансфузию и которые не нуждаются в трансфузии в соответствии с протокольными рекомендациями
†Доля пациентов с внутрисосудистым гемолизом, оцененная по нормализации уровней ЛДГ (нормализация определяется как уровень ЛДГ ≤1 раз выше ВГН (246 Ед/л) в период с 29-го по 183-й дни)
ДИ - доверительный интервал; Разн. - разница; ЛДГ - лактатдегидрогеназа; ОШ - отношение шансов.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
30.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: вторичные конечные точки, результаты на 183
день1
УЛТОМИРИС®
(N=125)
ЭКУЛИЗУМА
Б
(N=121)
Разница (95% ДИ)
Процентное изменение ЛДГ (%)
Изменение по шкале FACIT-усталость (%)
Прорывной гемолиз (%)
Стабилизация уровня гемоглобина (%)
В пользу ЭКУЛИЗУМАБА
Указывает предел
не меньшей
результативности
В пользу УЛТОМИРИС®
Точечные оценки
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ. Разница между терапиями рассчитывалась для пары УЛТОМИРИС® экулизумаб
*Ключевые вторичные конечные точки проверялись иерархическим образом, если для копримарных конечных точек заявлялась не меньшая результативность. Для оценки убедительности доказательств результатов
исследования были рассчитаны апостериорные значения P для оценки не меньшей результативности (Pinf) относительно заранее заданных пределов не меньшей результативности.
†Разница между терапиями рассчитывалась для пары УЛТОМИРИС®-ЭКУЛИЗУМАБ , за исключением ЛДГ-ПИ и ПГ (прорывной гемолиз), где разница в лечении рассчитывалась в паре ЭКУЛИЗУМАБ-УЛТОМИРИС®.
‡P <0,06 для нижнего предела 95% ДИ.
ДИ - доверительный интервал; Разн. - разница; FACIT - функциональная оценка терапии хронических заболеваний; ОШ - отношение шансов.
1.
Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
.
31.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: вторичные конечные точки, результаты на 183
день1,2
УЛТОМИРИС®
(N=125)
ЭКУЛИЗУМАБ
(N=121)
Разница (95% ДИ)
Прорывной гемолиз (%)
В пользу ЭКУЛИЗУМАБА
В пользу УЛТОМИРИС®
Указывает
предел не
меньшей
результативнос
ти
Точечные оценки
• На 50% меньше пациентов, получавших УЛТОМИРИС® (4,0% в сравнении с 10,7%), испытывали
прорывной гемолиз, что подтверждает не меньшую эффективность экулизумаба (Pinf <0,0001)*,† 1,2
- Определяется как 1 и более новый или ухудшающийся признак или симптом внутрисосудистого гемолиза (усталость,
гемоглобинурия, боль в животе, одышка, анемия [гемоглобин менее 10 г/дл], MAVE, включая тромбоз, дисфагию или
эректильную дисфункцию) на фоне ЛДГ ≥ 2 x ВГН после предварительного снижения ЛДГ до <1,5 x ВГН на фоне терапии1
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ. Разница между терапиями
рассчитывалась для пары УЛТОМИРИС®–ЭКУЛИЗУМАБ.
* Разница между терапиями рассчитывалась для пары экулизумаб-УЛТОМИРИС®
† P <0,06 для нижнего предела 95% ДИ.
ДИ - доверительный интервал; ЛДГ - лактатдегидрогеназа; MAVE – большое нежелательное сосудистое событиен; ВГН - верхняя граница нормы.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3
2. Brodsky RA, Peffault De Latour R, Rottinghaus ST, Röth A, Risitano AM, Weitz IC, et al. A prospective analysis of breakthrough hemolysis in 2 phase 3 randomized studies of ravulizumab (ALXN1210) versus eculizumab in adults with
paroxysmal nocturnal hemoglobinuria. Presented at the 60th American Society of Hematology Annual Meeting and Exposition; 1-4 December 2018; San Diego (CA). Blood 2018;132(Suppl 1):2330 https://doi.org/10.1182/blood-2018-99110874 https://ashpublications.org/blood/article/132/Supplement%201/2330/261868/A-Prospective-Analysis-of-Breakthrough-Hemolysis?searchresult=1 (Data access 24.07.2023)
32.
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: вторичные конечные точки, результаты на 183
день: эффективность в сравнении с экулизумабом1
УЛТОМИРИС® не уступал экулизумабу по всем четырем ключевым вторичным конечным
точкам, при этом все точечные оценки стабильно свидетельствовали в пользу УЛТОМИРИС®
У пациентов, получавших УЛТОМИРИС®, среднее изменение ЛДГ от исходного этапа составляло
76,8% по сравнению с 76,0% - у пациентов, получавших экулизумаб (Разн 0,83 [95% ДИ, -5,21, 3,56];
Pinf<0,0001)
По данным шкалы «FACIT-усталость» в обеих группах лечения в динамике по времени наблюдалось
схожее улучшение показателей усталости (Разн 0,67 [95% ДИ, -1,21, 2,55]; Pinf<0,0001)
2x
Двукратное снижение частоты случаев прорывного гемолиза у пациентов,
получающих УЛТОМИРИС® (Разн. 6,7 [95% ДИ, -14,21, 0,18]; Pinf <0,0001)
68%
При применении УЛТОМИРИС® у пациентов наблюдалась стабилизация гемоглобина на 68 %,
а при применении экулизумаба - на 64,5 % (Разн. 2,9 [95% ДИ, -8,80, 14,64]; Pinf <0,0001).
ДИ - доверительный интервал; FACIT - функциональная оценка терапии хронических заболеваний; ЛДГ - лактатдегидрогеназа.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3.
33.
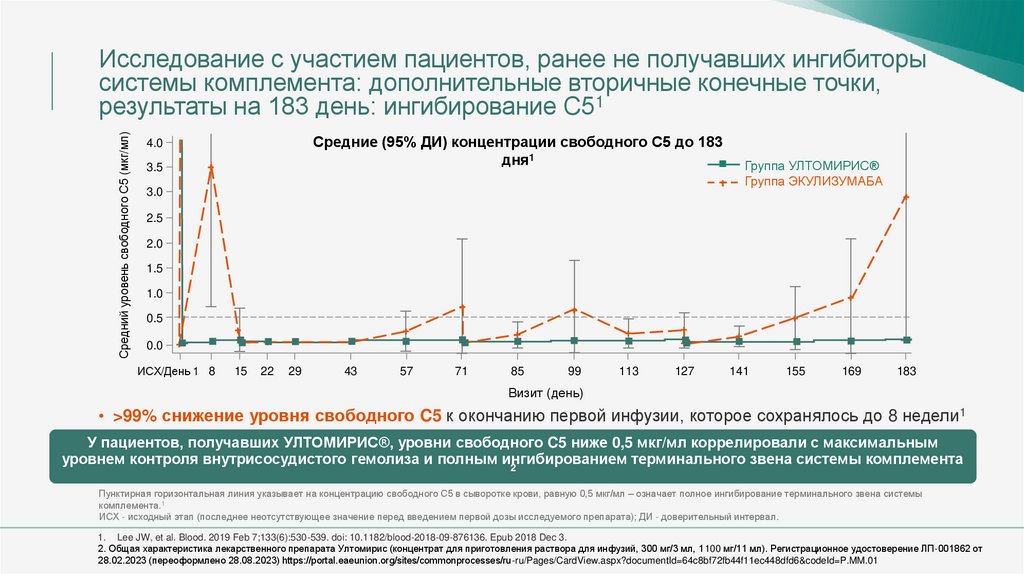
Средний уровень свободного С5 (мкг/мл)Исследование с участием пациентов, ранее не получавших ингибиторы
системы комплемента: дополнительные вторичные конечные точки,
результаты на 183 день: ингибирование C51
Средние (95% ДИ) концентрации свободного C5 до 183
дня1
4.0
3.5
3.0
Группа УЛТОМИРИС®
Группа ЭКУЛИЗУМАБА
2.5
2.0
1.5
1.0
0.5
0.0
ИСХ/День 1 8
15
22
29
43
57
71
85
99
113
127
141
155
169
183
Визит (день)
• >99% снижение уровня свободного C5 к окончанию первой инфузии, которое сохранялось до 8 недели1
У пациентов, получавших УЛТОМИРИС®, уровни свободного C5 ниже 0,5 мкг/мл коррелировали с максимальным
уровнем контроля внутрисосудистого гемолиза и полным ингибированием
терминального звена системы комплемента
2
Пунктирная горизонтальная линия указывает на концентрацию свободного С5 в сыворотке крови, равную 0,5 мкг/мл – означает полное ингибирование терминального звена системы
комплемента.1
ИСХ - исходный этап (последнее неотсутствующее значение перед введением первой дозы исследуемого препарата); ДИ - доверительный интервал.
1. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3.
2. Общая характеристика лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от
28.02.2023 (переоформлено 28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
34.
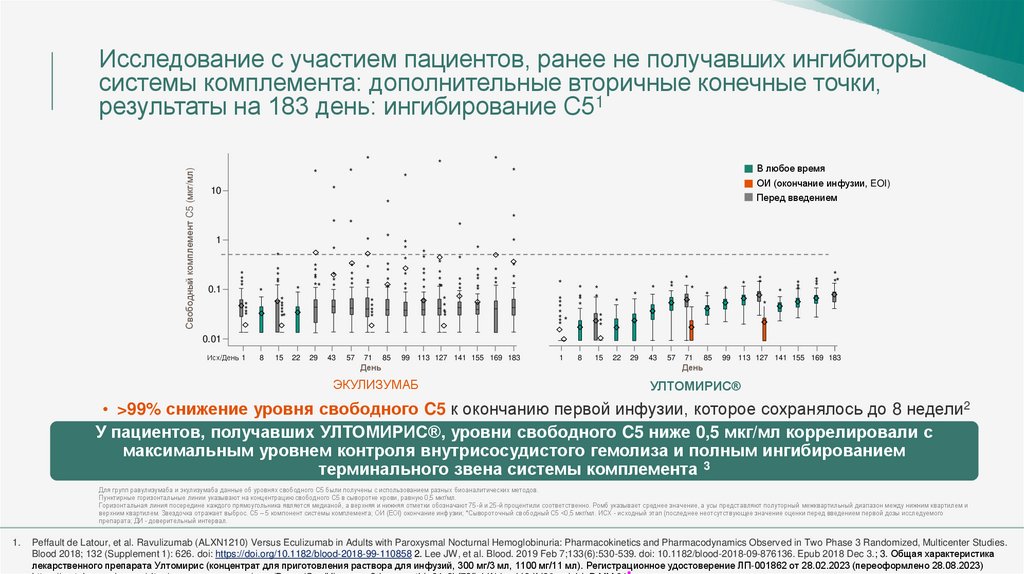
Исследование с участием пациентов, ранее не получавших ингибиторысистемы комплемента: дополнительные вторичные конечные точки,
результаты на 183 день: ингибирование C51
Свободный комплемент C5 (мкг/мл)
*
*
*
*
*
В любое время
*
*
ОИ (окончание инфузии, EOI)
*
10
Перед введением
*
*
*
1
0.1
*
*
*
**
*
*
*
*
*
*
**
*
**
**
**
*
*
*
*
*
**
**
**
***
**
**
*
*
*
*
*
*
*
**
*
*
*
*
*
**
*
*
*
**
*
**
**
*
*
*
*
*
**
*
*
**
*
*
**
*
**
**
*
**
*
*
*
*
**
*
*
** *
*
*
*
*
*
*
*
*
*
**
*
*
*
*
*
**
*
**
*
**
*
*
**
*
*
**
0.01
Исх/День 1
8
15
22
29
43
57
71
85
99
113 127 141 155 169 183
1
8
15
22
29
43
57
71
85
99
113 127 141 155 169 183
День
День
ЭКУЛИЗУМАБ
УЛТОМИРИС®
• >99% снижение уровня свободного C5 к окончанию первой инфузии, которое сохранялось до 8 недели2
У пациентов, получавших УЛТОМИРИС®, уровни свободного C5 ниже 0,5 мкг/мл коррелировали с
максимальным уровнем контроля внутрисосудистого гемолиза и полным ингибированием
терминального звена системы комплемента 3
Для групп равулизумаба и экулизумаба данные об уровнях свободного C5 были получены с использованием разных биоаналитических методов.
Пунктирные горизонтальные линии указывают на концентрацию свободного C5 в сыворотке крови, равную 0,5 мкг/мл.
Горизонтальная линия посередине каждого прямоугольника является медианой, а верхняя и нижняя отметки обозначают 75-й и 25-й процентили соответственно. Ромб указывает среднее значение, а усы представляют полуторный межквартильный диапазон между нижним квартилем и
верхним квартилем. Звездочка отражает выброс. C5 – 5 компонент системы комплемента; ОИ (EOI) окончание инфузии; *Сывороточный свободный C5 <0,5 мкг/мл. ИСХ - исходный этап (последнее неотсутствующее значение оценки перед введением первой дозы исследуемого
препарата; ДИ - доверительный интервал.
1.
Peffault de Latour, et al. Ravulizumab (ALXN1210) Versus Eculizumab in Adults with Paroxysmal Nocturnal Hemoglobinuria: Pharmacokinetics and Pharmacodynamics Observed in Two Phase 3 Randomized, Multicenter Studies.
Blood 2018; 132 (Supplement 1): 626. doi: https://doi.org/10.1182/blood-2018-99-110858 2. Lee JW, et al. Blood. 2019 Feb 7;133(6):530-539. doi: 10.1182/blood-2018-09-876136. Epub 2018 Dec 3.; 3. Общая характеристика
лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862 от 28.02.2023 (переоформлено 28.08.2023)
35.
Исследование с участием пациентов, ранее не получавших ингибиторы системыкомплемента: ключевые выводы: данные по эффективности
• У взрослых пациентов с ПНГ, ранее не получавших ингибиторы комплемента, УЛТОМИРИС®
показал стабильную и длительную эффективность в течение 52 недель лечения1
• У пациентов, перешедших с терапии препаратом экулизумаб на УЛТОМИРИС® через 26 недель
лечения, исходы были сопоставимы с пациентами, получавшими непрерывную терапию
препаратом УЛТОМИРИС®1
• У всех пациентов с уровнем свободного С5 ≥0,5 мкг/мл на фоне терапии препаратом экулизумаб,
после перехода на УЛТОМИРИС® отмечалось снижение уровня свободного С5 (уровень <0,5
мкг/мл)1
• УЛТОМИРИС® снижал частоту возникновения ПГ за счет уменьшения количества свободного С5,
который ассоциирован ПГ1
ПГ - прорывной гемолиз; ЛДГ - лактатдегидрогеназа.
1.
Scherezenmeier H, et al. ONE-YEAR EFFICACY OF RAVULIZUMAB (ALXN1210) IN ADULT PATIENTS WITH PAROXYSMAL NOCTURNAL HEMOGLOBINURIA NAIVE TO COMPLEMENT INHIBITORS. EHA Library. 06/15/2019; 267446; Abstract: S863
https://library.ehaweb.org/eha/2019/24th/267446/hubert.schrezenmeier.one year.efficacy.of.ravulizumab.28alxn121029.in.adult.html?f=listing%3D4%2Abrowseby%3D8%2Asortby%3D2%2Amedia%3D3%2Aspeaker%3D34768.
36.
Исследование попереключению на терапию
УЛТОМИРИС®
37.
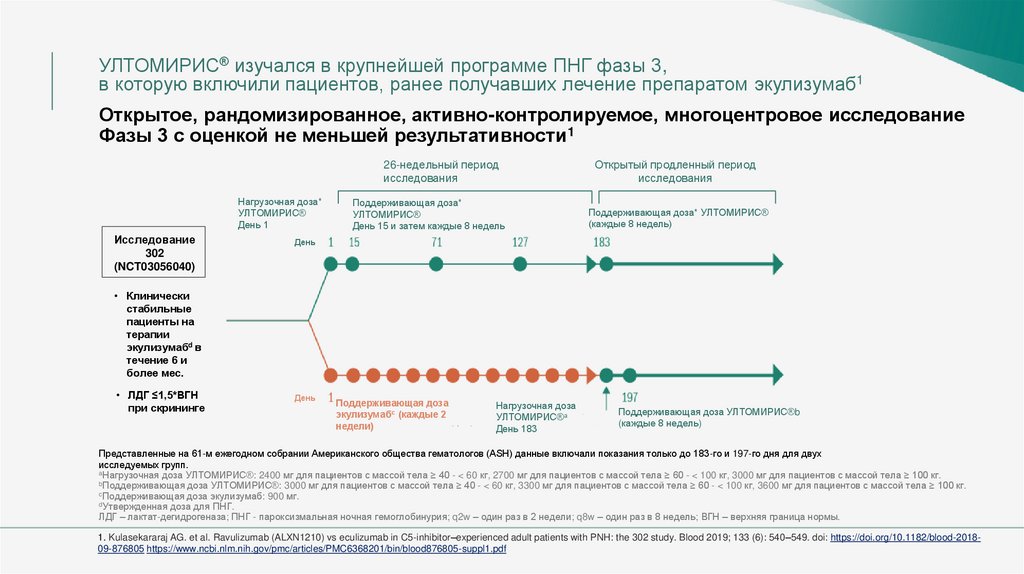
УЛТОМИРИС® изучался в крупнейшей программе ПНГ фазы 3,в которую включили пациентов, ранее получавших лечение препаратом экулизумаб1
Открытое, рандомизированное, активно-контролируемое, многоцентровое исследование
Фазы 3 с оценкой не меньшей результативности1
26-недельный период
исследования
Нагрузочная доза*
УЛТОМИРИС®
День 1
Исследование
302
(NCT03056040)
Поддерживающая доза*
УЛТОМИРИС®
День 15 и затем каждые 8 недель
Открытый продленный период
исследования
Поддерживающая доза* УЛТОМИРИС®
(каждые 8 недель)
День
• Клинически
стабильные
пациенты на
терапии
экулизумабd в
течение 6 и
более мес.
• ЛДГ ≤1,5*ВГН
при скрининге
День
Поддерживающая доза
экулизумабс (каждые 2
недели)
Нагрузочная доза
УЛТОМИРИС®а
День 183
Поддерживающая доза УЛТОМИРИС®b
(каждые 8 недель)
Представленные на 61-м ежегодном собрании Американского общества гематологов (ASH) данные включали показания только до 183-го и 197-го дня для двух
исследуемых групп.
aНагрузочная доза УЛТОМИРИС®: 2400 мг для пациентов с массой тела ≥ 40 - < 60 кг, 2700 мг для пациентов с массой тела ≥ 60 - < 100 кг, 3000 мг для пациентов с массой тела ≥ 100 кг.
bПоддерживающая доза УЛТОМИРИС®: 3000 мг для пациентов с массой тела ≥ 40 - < 60 кг, 3300 мг для пациентов с массой тела ≥ 60 - < 100 кг, 3600 мг для пациентов с массой тела ≥ 100 кг.
cПоддерживающая доза экулизумаб: 900 мг.
dУтвержденная доза для ПНГ.
ЛДГ – лактат-дегидрогеназа; ПНГ - пароксизмальная ночная гемоглобинурия; q2w – один раз в 2 недели; q8w – один раз в 8 недель; ВГН – верхняя граница нормы.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
38.
Исследование по переключению на терапию УЛТОМИРИС®:ключевые критерии включения (1)1
Мужчины или женщины, ≥18 лет на момент подписания согласия
Терапия экулизумабом в соответствии с рекомендациями по дозированию при ПНГ в течение ≥
6 месяцев до 1-го дня.
Уровень ЛДГ ≤1,5 x ВГН при скрининге
- Образец для анализа должен был быть получен в запланированный день введения
препарата экулизумаб до введения дозы препарата (т.е. на минимальном уровне экулизумаб в
организме) и проанализирован в центральной лаборатории.
Документально подтвержденный диагноз ПНГ, доказанный методикой высокочувствительной
проточной цитометрией эритроцитов и лейкоцитов с размером гранулоцитарного или
моноцитарного клона ≥5%
ЛДГ - лактатдегидрогеназа; ПНГ - пароксизмальная ночная гемоглобинурия; Эр - эритроцит; Лейк - лейкоциты; ВГН - верхняя граница нормы.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
39.
Исследование по переключению на терапию УЛТОМИРИС®:ключевые критерии включения (2)1,
Вакцинация против менингококковых инфекций в течение 3 лет до или во время начала терапии
препаратом УЛТОМИРИС®
- Пациенты, начавшие лечение препаратом УЛТОМИРИС® менее чем через 2 недели после
получения менингококковой вакцины, должны получать лечение соответствующими
профилактическими антибиотиками в течение 2 недель после вакцинации.
Пациенты должны следовать указанному в протоколе руководству по предотвращению
беременности во время лечения УЛТОМИРИС® и в течение 8 месяцев после последней дозы2.
Пациенты должны быть в состоянии дать письменное информированное согласие и соблюдать
все визиты и процедуры исследования
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
40.
Исследование по переключению на терапию УЛТОМИРИС®:первичная конечная точка1
Первичная конечная точка
– Процентное изменение ЛДГ от исходного этапа к 183-му дню
Первичная конечная точка позволяла оценить не меньшую эффективность препарата УЛТОМИРИС® по сравнению
с препаратом экулизумаб у взрослых с ПНГ, которые были клинически стабильны после проведения терапии
препаратом экулизумаб в течение не менее 6 месяцев.
ЛДГ - лактатдегидрогеназа; ПНГ - пароксизмальная ночная гемоглобинурия.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
41.
Исследование по переключению на терапию УЛТОМИРИС®:вторичные конечные точки1
Доля пациентов с прорывным гемолизом*
Избежание гемотрансфузий констатировалось только у пациентов, которым не выполнялись
гемотрансфузии, и которые не соответствовали критериям необходимости проведения
гемотрансфузий согласно рекомендациям, указанным в протоколе.
Изменение качества жизни (FACIT-усталость) от исходного этапа к 183 дню
Доля пациентов со стабилизированным уровнем гемоглобина, определялась как
предотвращение снижения уровня гемоглобина на ≥2 г/дл по сравнению с исходным этапом
при условии отсутствия трансфузий
*Определяется как один или более новый или ухудшение уже имеющегося симптома или признака внутрисосудистого гемолиза на фоне повышения уровня ЛДГ на ≥2 x ВГН после
предшествующего снижения уровня ЛДГ до <1,5 x ВГН на фоне терапии.
FACIT - Функциональная оценка терапии хронических заболеваний, ЛДГ-лактатдегидрогеназа; ВГН - верхняя граница нормы.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
42.
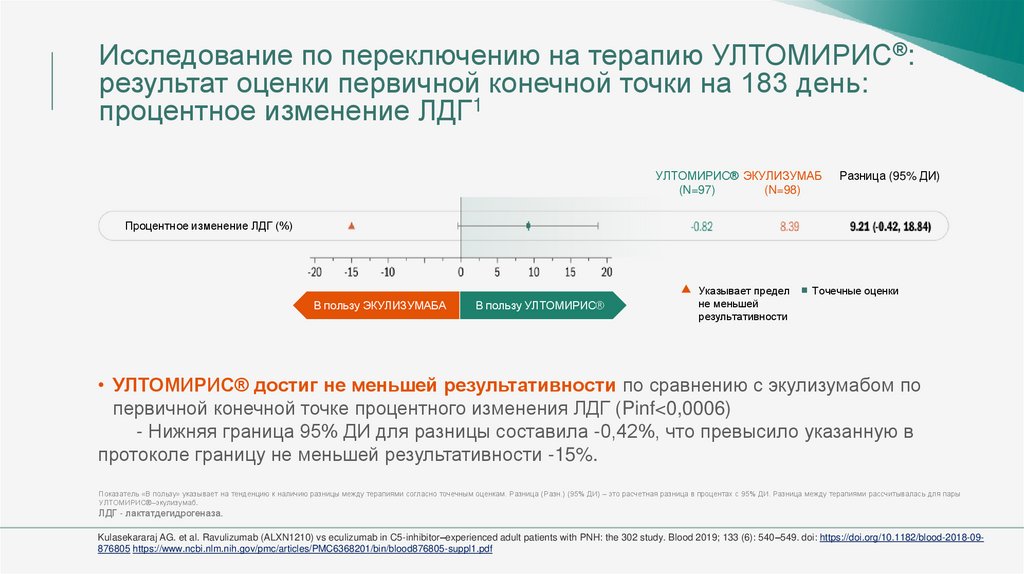
Исследование по переключению на терапию УЛТОМИРИС®:результат оценки первичной конечной точки на 183 день:
процентное изменение ЛДГ1
УЛТОМИРИС® ЭКУЛИЗУМАБ
(N=97)
(N=98)
Разница (95% ДИ)
Процентное изменение ЛДГ (%)
В пользу ЭКУЛИЗУМАБА
В пользу УЛТОМИРИС®
Указывает предел
не меньшей
результативности
Точечные оценки
• УЛТОМИРИС® достиг не меньшей результативности по сравнению с экулизумабом по
первичной конечной точке процентного изменения ЛДГ (Pinf<0,0006)
- Нижняя граница 95% ДИ для разницы составила -0,42%, что превысило указанную в
протоколе границу не меньшей результативности -15%.
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ. Разница между терапиями рассчитывалась для пары
УЛТОМИРИС®–экулизумаб.
ЛДГ - лактатдегидрогеназа.
Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-2018-09876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
43.
Исследование по переключению на терапию УЛТОМИРИС®:результат оценки вторичной конечной точки на 183 день1
УЛТОМИРИС® ЭКУЛИЗУМАБ
(N=97)
(N=98)
Разница (95% ДИ)
Изменение балла Усталость в опроснике
FACIT
Прорывной гемолиз (%)
Стабилизация уровня гемоглобина (%)
Избежание трансфузии (%)
В пользу ЭКУЛИЗУМАБ
В пользу УЛТОМИРИС®
*Ключевые вторичные конечные точки оценивались в иерархическом порядке, если не меньшая результативность была доказана для первичных конечных точек. Для оценки убедительности доказательных
результатов исследования были рассчитаны апостериорные значения P для тестирования не меньшей результативности (Pinf) относительно заранее заданных пределов не меньшей результативности.
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ. Разница между терапиями
рассчитывалась для пары УЛТОМИРИС®–ЭКУЛИЗУМАБ.
ДИ - доверительный интервал; Разн - разница; FACIT - функциональная оценка терапии хронических заболеваний; ОШ - отношение шансов.
Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-2018-09876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
44.
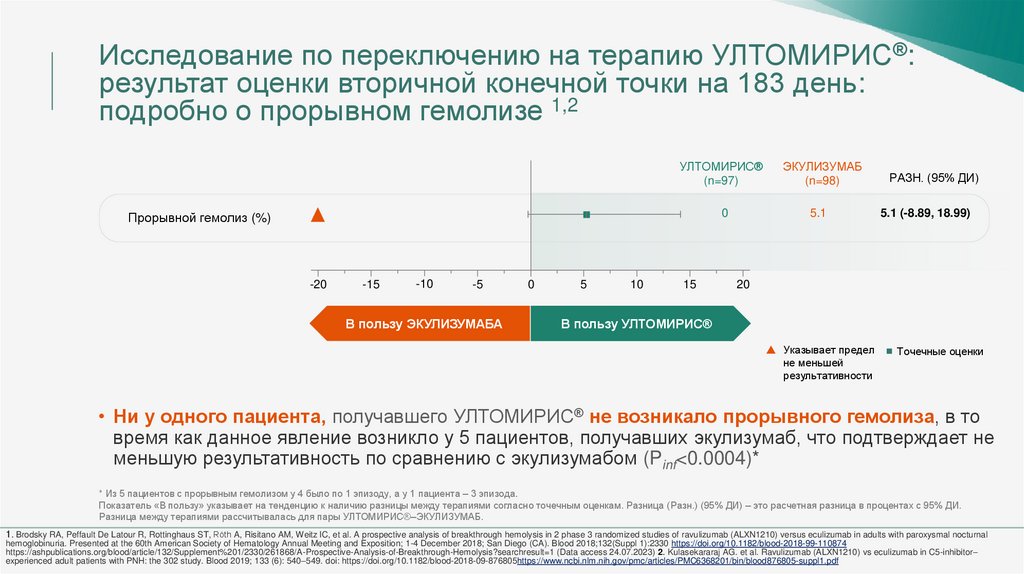
Исследование по переключению на терапию УЛТОМИРИС®:результат оценки вторичной конечной точки на 183 день:
подробно о прорывном гемолизе 1,2
УЛТОМИРИС®
(n=97)
ЭКУЛИЗУМАБ
(n=98)
0
5.1
Прорывной гемолиз (%)
-20
-15
-10
-5
В пользу ЭКУЛИЗУМАБА
0
5
10
15
РАЗН. (95% ДИ)
5.1 (-8.89, 18.99)
20
В пользу УЛТОМИРИС®
Указывает предел
не меньшей
результативности
Точечные оценки
• Ни у одного пациента, получавшего УЛТОМИРИС® не возникало прорывного гемолиза, в то
время как данное явление возникло у 5 пациентов, получавших экулизумаб, что подтверждает не
меньшую результативность по сравнению с экулизумабом (Pinf<0.0004)*
* Из 5 пациентов с прорывным гемолизом у 4 было по 1 эпизоду, а у 1 пациента – 3 эпизода.
Показатель «В пользу» указывает на тенденцию к наличию разницы между терапиями согласно точечным оценкам. Разница (Разн.) (95% ДИ) – это расчетная разница в процентах с 95% ДИ.
Разница между терапиями рассчитывалась для пары УЛТОМИРИС®–ЭКУЛИЗУМАБ.
1. Brodsky RA, Peffault De Latour R, Rottinghaus ST, Röth A, Risitano AM, Weitz IC, et al. A prospective analysis of breakthrough hemolysis in 2 phase 3 randomized studies of ravulizumab (ALXN1210) versus eculizumab in adults with paroxysmal nocturnal
hemoglobinuria. Presented at the 60th American Society of Hematology Annual Meeting and Exposition; 1-4 December 2018; San Diego (CA). Blood 2018;132(Suppl 1):2330 https://doi.org/10.1182/blood-2018-99-110874
https://ashpublications.org/blood/article/132/Supplement%201/2330/261868/A-Prospective-Analysis-of-Breakthrough-Hemolysis?searchresult=1 (Data access 24.07.2023) 2. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–
experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-2018-09-876805https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf
45.
Исследование по переключению на терапию УЛТОМИРИС®:результат оценки вторичной конечной точки на 183 день:
эффективность в сравнении с режимом ЭКУЛИЗУМАБ-УЛТОМИРИС®1,2
УЛТОМИРИС® не уступал по результативности препарату экулизумаб по четырем ключевым вторичным
конечным точкам, при этом все точечные оценки стабильно свидетельствовали в пользу УЛТОМИРИС®
Ни у одного пациента, получавшего УЛТОМИРИС® не возникало прорывного гемолиза, в то
время как данное явление возникло у 5 пациентов, получавших экулизумаб (Разн 5,1 [95% ДИ, -8.89,
18.99]; Pinf<0.0004)
На терапии УЛТОМИРИС у большего числа пациентов удалось избежать трансфузии за
период исследования, по сравнению с пациентами, получавшими экулизумаб (Разн 5,5 [95%
ДИ, -4,27, 15,68]; Pinf<0,0001)
Улучшение баллов оценки утомляемости с течением времени наблюдалось в обеих группах
терапии по данным FACIT-Усталость (Разн 1,47 [95% ДИ, -0,21, 3,15]; Pinf<0,0001).
При применении УЛТОМИРИС® стабилизация гемоглобина наблюдалась у 76,3% пациентов,
а при применении экулизумаб - у 75,5% пациентов (Разн 1,4 [95% ДИ, -10,41, 13,31];
Pinf<0,0005)
Разница (Разн) (95% ДИ) была основана на оценочной разнице в процентах с 95% ДИ. Различие в лечении оценивали для УЛТОМИРИС®–экулизумаб.
ДИ - доверительный интервал; FACIT - функциональная оценка терапии хронических заболеваний.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf (Data access 24.07.2023)
46.
Исследование по переключению на терапию УЛТОМИРИС®:ключевые выводы: данные по эффективности1
• Взрослых пациентов с ПНГ, получавших терапию препаратом экулизумаб, можно
эффективно перевести с экулизумаба на УЛТОМИРИС® (в режиме введения каждые 8
недель) и при этом сохранить эффективность, ранее достигнутую при применении
экулизумаба.
• УЛТОМИРИС® при введении один раз в 8 недель не уступает экулизумабу в режиме один
раз в 2 недели у пациентов, получавших экулизумаб, по всем первичным и вторичным
конечным точкам эффективности, включая изменение уровня ЛДГ, избежание
необходимости гемотрансфузии, стабилизацию уровня гемоглобина и частоту прорывного
гемолиза
• Если стабильных пациентов, получающих препарат экулизумаб каждые 2 недели,
перевести на эффективную терапию с увеличением интервала между инфузиями в 4 раза,
т.е., на терапию препаратом УЛТОМИРИС® в введением один раз в 8 недель, это,
вероятно, приведет к существенному снижению терапевтической нагрузки, к меньшему
количеству случаев прорывного гемолиза, обеспечит улучшение качества жизни и увеличит
вероятность удержания пациента на длительной терапии
ЛДГ - лактатдегидрогеназа; ПНГ - пароксизмальная ночная гемоглобинурия.
1. Kulasekararaj AG. et al. Ravulizumab (ALXN1210) vs eculizumab in C5-inhibitor–experienced adult patients with PNH: the 302 study. Blood 2019; 133 (6): 540–549. doi: https://doi.org/10.1182/blood-201809-876805 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6368201/bin/blood876805-suppl1.pdf (Data access 24.07.2023)
47.
Дозы и способ примененияУЛТОМИРИС
®
48.
Не более семи поддерживающих доз УЛТОМИРИС® в год126 доз ЭКУЛИЗУМАБ в год
(каждые 2 недели)2*
7 поддерживающих доз УЛТОМИРИС®
в год, (каждые 8 недель)1*
1
2
3
4
5
6
7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
8
9
10
11
12
13
14
15
16
17
18
19
20
21
15
16
17
18
19
20
21
22
23
24
25
26
27
28
22
23
24
25
26
27
28
29
30
31
32
33
34
35
29
30
31
32
33
34
35
36
37
38
39
40
41
42
36
37
38
39
40
41
42
43
44
45
46
47
48
49
43
44
45
46
47
48
49
50
51
52
50
51
52
*На рисунке показан календарь, где каждое число – это неделя
1.
Общая характеристика лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862
от 28.02.2023 (переоформлено 28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01
49.
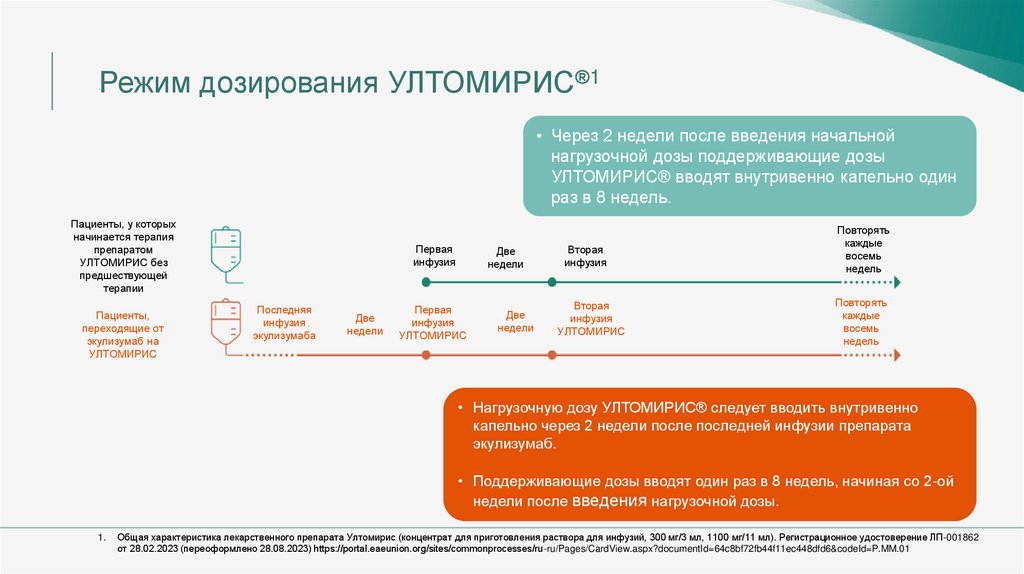
Режим дозирования УЛТОМИРИС®1• Через 2 недели после введения начальной
нагрузочной дозы поддерживающие дозы
УЛТОМИРИС® вводят внутривенно капельно один
раз в 8 недель.
Пациенты, у которых
начинается терапия
препаратом
УЛТОМИРИС без
предшествующей
терапии
Пациенты,
переходящие от
экулизумаб на
УЛТОМИРИС
Первая
инфузия
Последняя
инфузия
экулизумаба
Две
недели
Две
недели
Первая
инфузия
УЛТОМИРИС
Две
недели
Вторая
инфузия
Вторая
инфузия
УЛТОМИРИС
Повторять
каждые
восемь
недель
Повторять
каждые
восемь
недель
• Нагрузочную дозу УЛТОМИРИС® следует вводить внутривенно
капельно через 2 недели после последней инфузии препарата
экулизумаб.
• Поддерживающие дозы вводят один раз в 8 недель, начиная со 2-ой
недели после введения нагрузочной дозы.
1.
Общая характеристика лекарственного препарата Ултомирис (концентрат для приготовления раствора для инфузий, 300 мг/3 мл, 1100 мг/11 мл). Регистрационное удостоверение ЛП-001862
от 28.02.2023 (переоформлено 28.08.2023) https://portal.eaeunion.org/sites/commonprocesses/ru-ru/Pages/CardView.aspx?documentId=64c8bf72fb44f11ec448dfd6&codeId=P.MM.01




































 Медицина
Медицина








