Похожие презентации:
Этиленовые углеводороды (алкены, олефины)
1. Министерство науки и высшего образования РФ ФГБОУ ВО «Самарский государственный технический университет» Химико-технологический
факультетКафедра органической химии
Направление подготовки
18.03.01 «Химическая технология»
04.03.01 «Химия, физика и механика
материалов »
Органическая химия
Лекция № 6
Тема: Этиленовые углеводороды (алкены, олефины)
Преподаватель: д.х.н., профессор Климочкин Ю.Н.
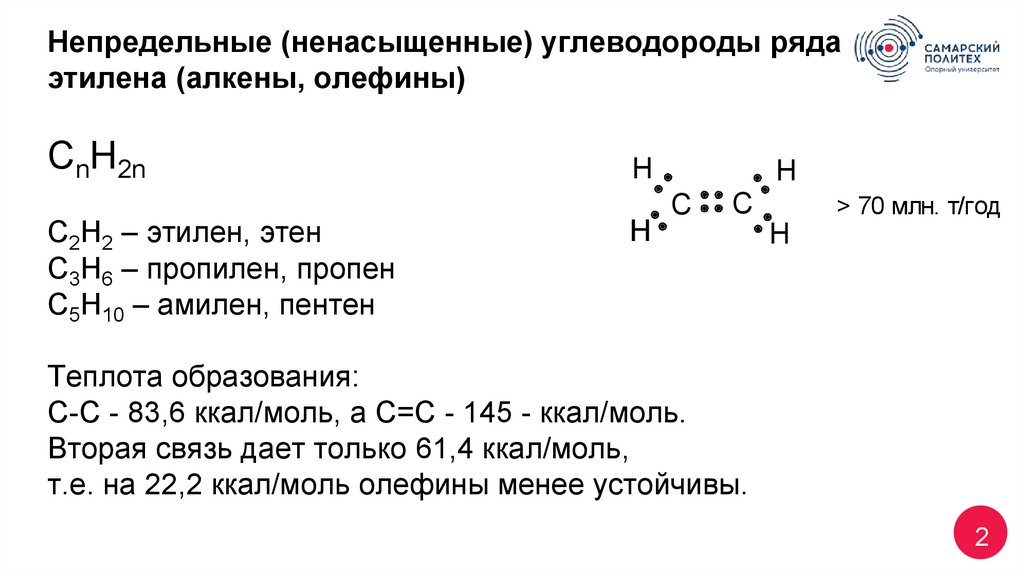
2. Непредельные (ненасыщенные) углеводороды ряда этилена (алкены, олефины) CnH2n С2Н2 – этилен, этен С3Н6 – пропилен, пропен С5Н10
– амилен, пентенH
Н
H
C
C
Н
> 70 млн. т/год
Теплота образования:
С-С - 83,6 ккал/моль, а С=С - 145 - ккал/моль.
Вторая связь дает только 61,4 ккал/моль,
т.е. на 22,2 ккал/моль олефины менее устойчивы.
2
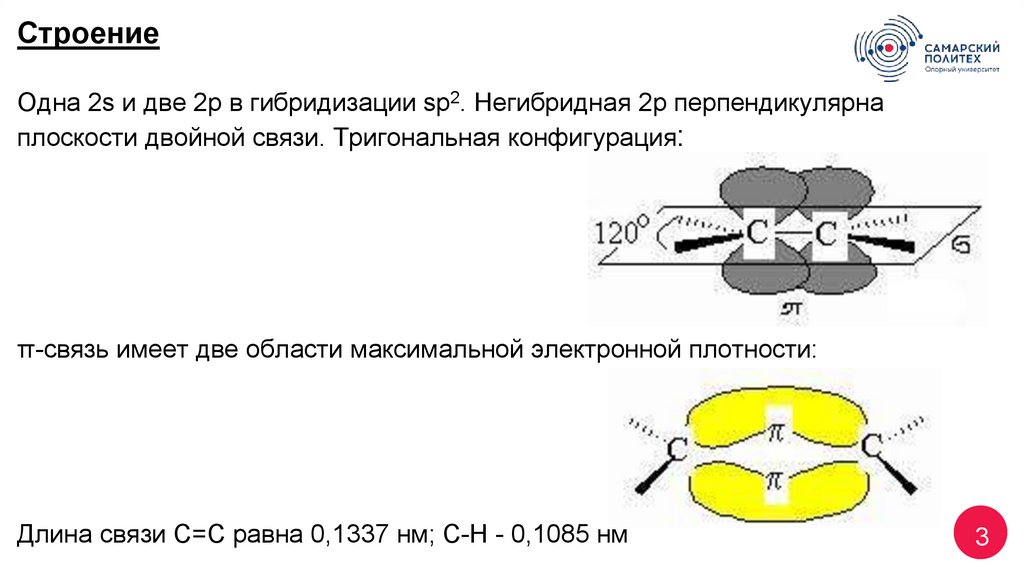
3. Строение Одна 2s и две 2p в гибридизации sp2. Негибридная 2р перпендикулярна плоскости двойной связи. Тригональная
СтроениеОдна 2s и две 2p в гибридизации sp2. Негибридная 2р перпендикулярна
плоскости двойной связи. Тригональная конфигурация:
π-связь имеет две области максимальной электронной плотности:
Длина связи С=С равна 0,1337 нм; С-Н - 0,1085 нм
3
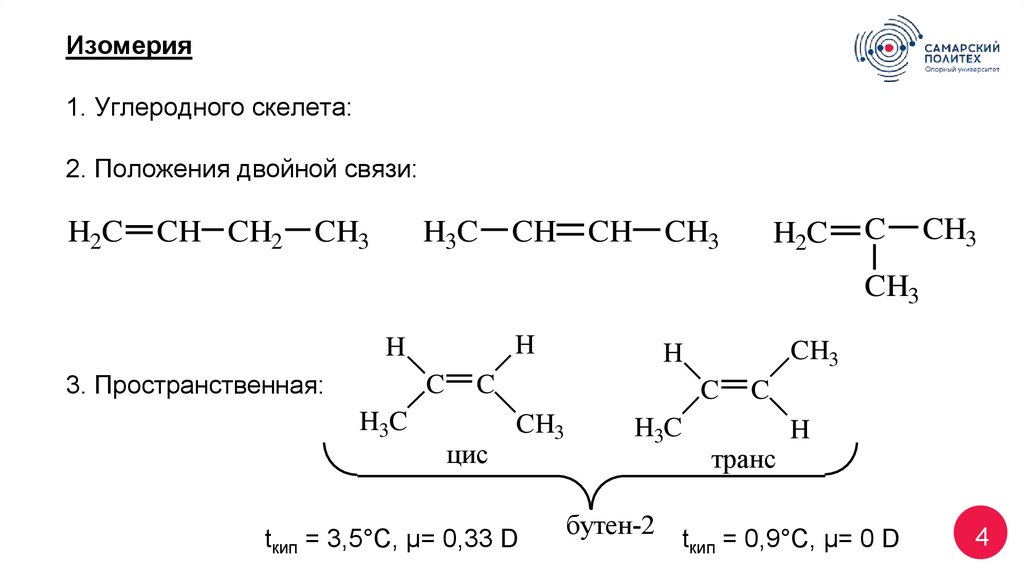
4. Изомерия 1. Углеродного скелета: 2. Положения двойной связи: 3. Пространственная: tкип = 3,5°С, μ= 0,33 D tкип = 0,9°С,
Изомерия1. Углеродного скелета:
2. Положения двойной связи:
H2C
CH CH2
CH3
H3C
CH
CH
CH3
H2C
C
CH3
CH3
H
H
3. Пространственная:
C
H3C
C
цис
CH3
H
C
CH3
tкип = 3,5°С, μ= 0,33 D
H3C
C
транс
H
бутен-2 t = 0,9°С, μ= 0 D
кип
4
5. Номенклатура Систематические:названия алкенов производят от названий соответствующих алканов путём замены суффикс «-ан» на
НоменклатураСистематические:названия алкенов производят от названий соответствующих
алканов путём замены суффикс «-ан» на «-ен»
Рациональная: за основу – простейший член гомологического ряда – этилен, и
перечисляются заместители
H2C
C
CH3
CH3
диметилэтилен
Радикалы:
H3C
CH
CH
CH3
диметилэтилен
H2C
винил
(этенил)
или симм-диметилэтилен
H3C
H2C
CH2
аллил
(пропен-2-ил)
C
CH2
изопропенил
(1-метилэтенил)
5
6.
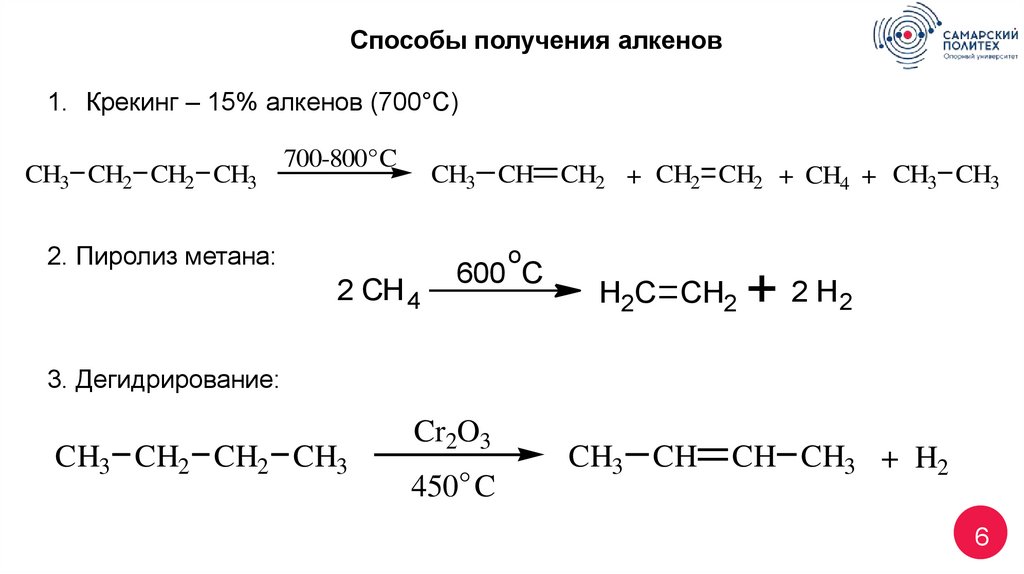
Способы получения алкенов1. Крекинг – 15% алкенов (700°С)
CH3 CH2 CH2 CH3
700-800° C
CH3 CH
2. Пиролиз метана:
CH2 + CH2 CH2 + CH4 + CH3 CH3
o
2 CH 4
600 C
H2C CH2
+ 2 H2
3. Дегидрирование:
CH3 CH2 CH2 CH3
Cr2O3
450° C
CH3 CH
CH CH3 + H2
6
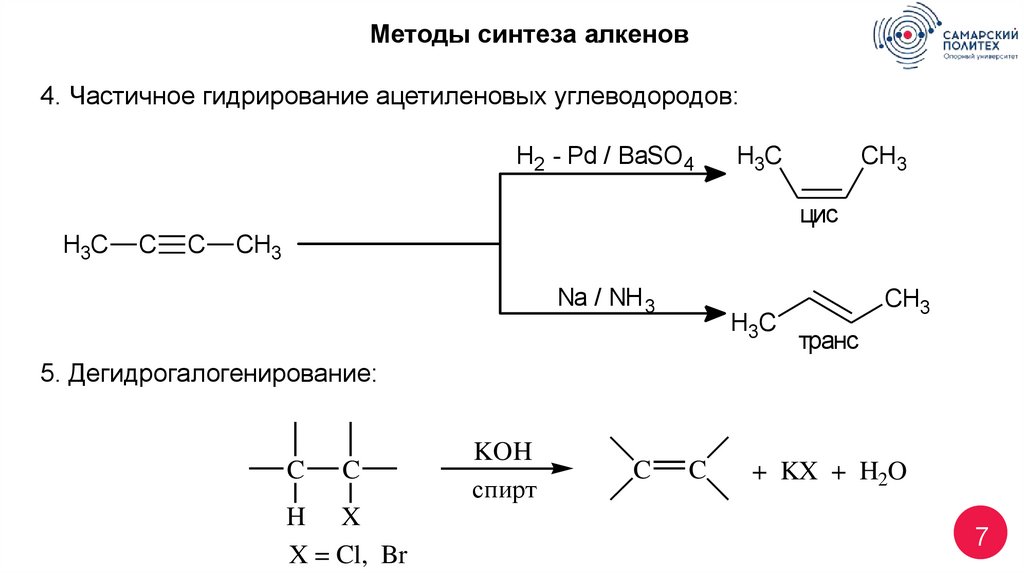
7.
Методы синтеза алкенов4. Частичное гидрирование ацетиленовых углеводородов:
H2 - Pd / BaSO 4
H3C
CH3
цис
H3C
C
C
CH3
Na / NH 3
H3C
CH3
транс
5. Дегидрогалогенирование:
C
C
H X
X = Cl, Br
KOH
спирт
C
C
+ KX + H2O
7
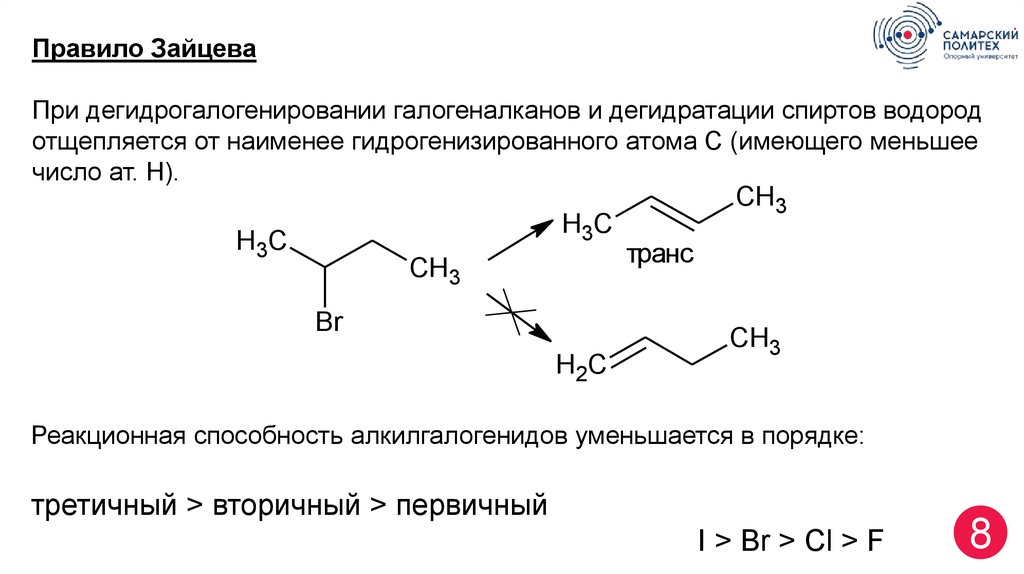
8.
Правило ЗайцеваПри дегидрогалогенировании галогеналканов и дегидратации спиртов водород
отщепляется от наименее гидрогенизированного атома С (имеющего меньшее
число ат. Н).
H3C
H3C
CH3
Br
H2C
CH3
транс
CH3
Реакционная способность алкилгалогенидов уменьшается в порядке:
третичный > вторичный > первичный
I > Br > Cl > F
8
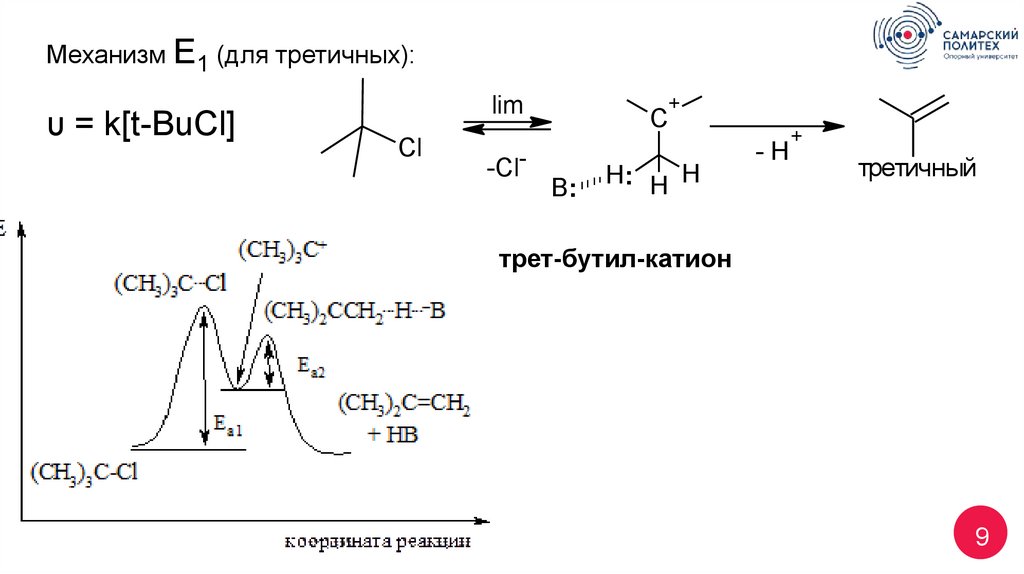
9.
Механизм Е1 (для третичных):υ = k[t-BuCl]
lim
Cl
-Cl-
+
C
B:
Н: H H
-H
+
третичный
трет-бутил-катион
9
10.
Механизм Е2 (для первичных и вторичных):υ= k[OH-][RBr]
10
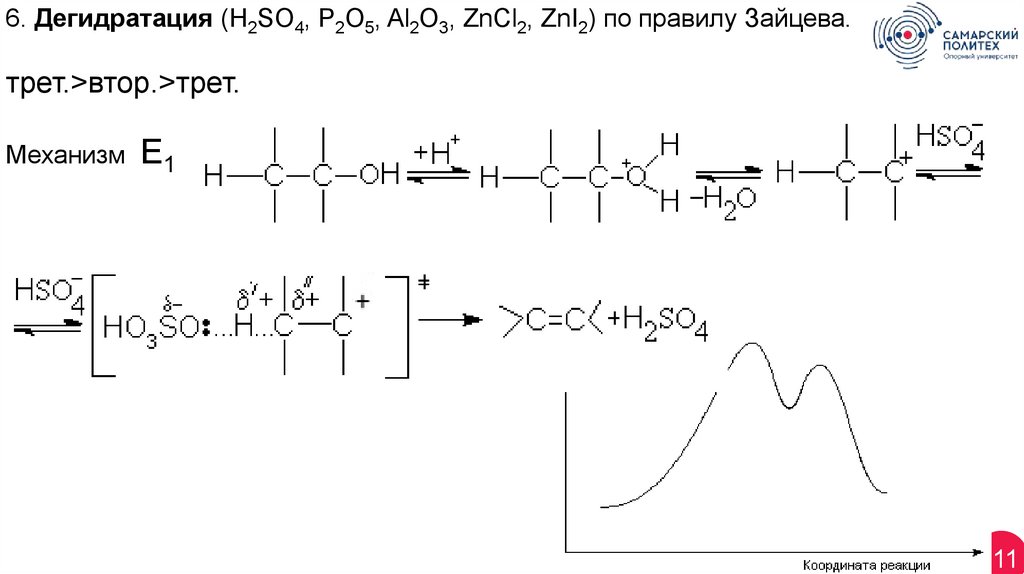
11.
6. Дегидратация (H2SO4, P2O5, Al2O3, ZnCl2, ZnI2) по правилу Зайцева.трет.>втор.>трет.
Механизм
Е1
11
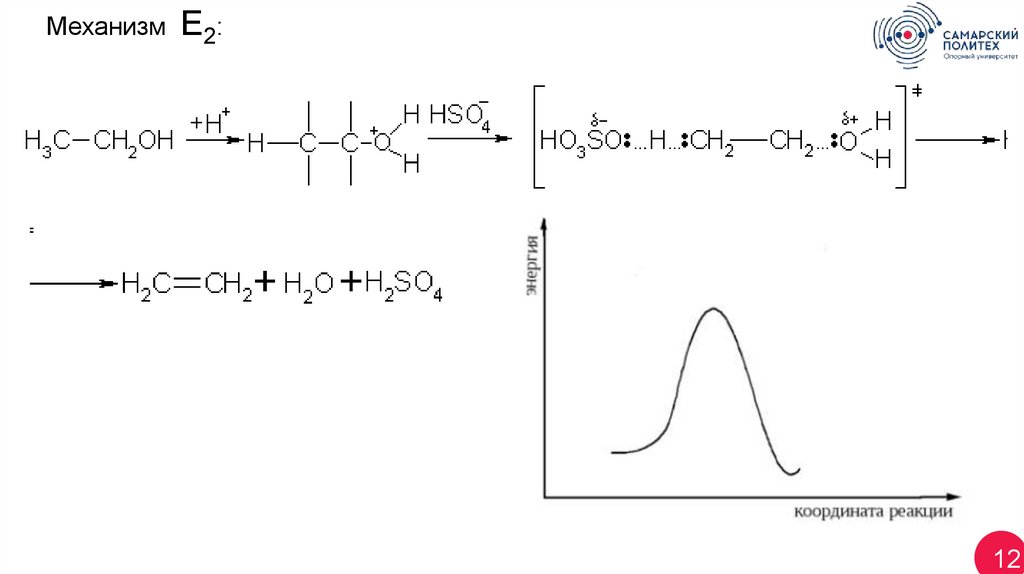
12.
МеханизмЕ2:
12
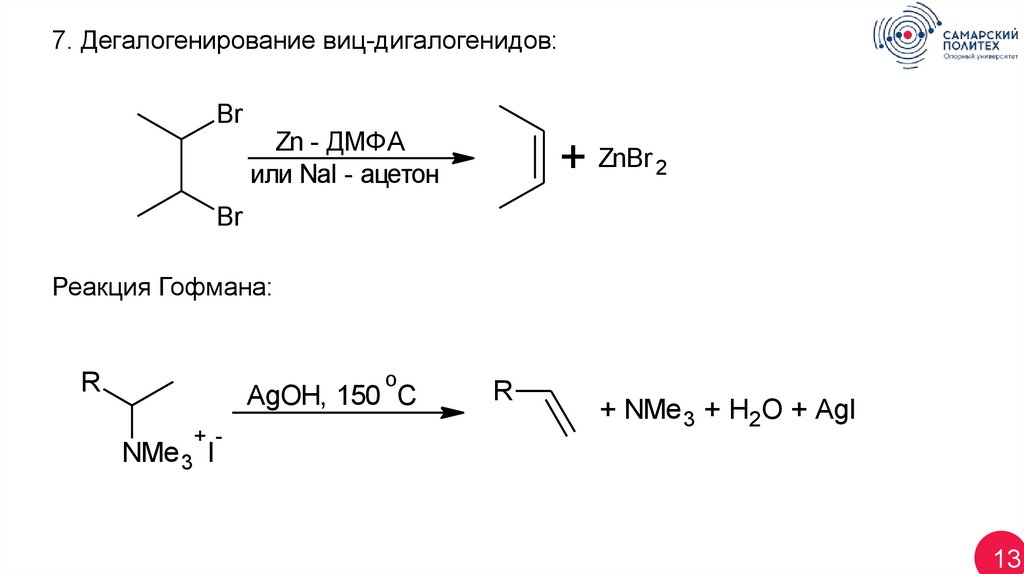
13.
7. Дегалогенирование виц-дигалогенидов:Br
Zn - ДМФА
или NaI - ацетон
+ ZnBr 2
Br
Реакция Гофмана:
o
R
AgOH, 150 C
+ -
R
+ NMe 3 + H2O + AgI
NMe 3 I
13
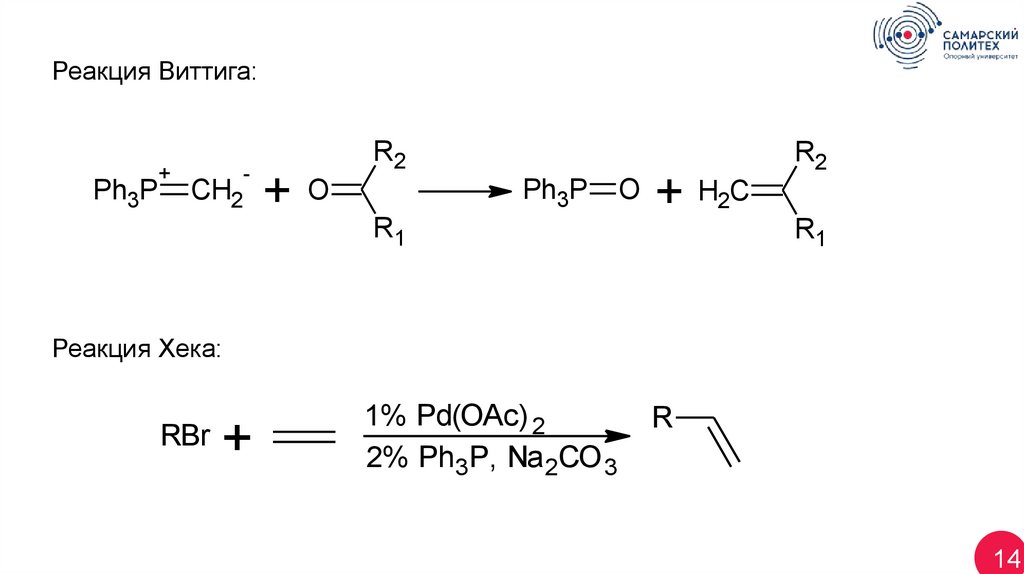
14.
Реакция Виттига:Ph3P
+
CH2
-
+
R2
Ph3P
O
R1
O
+ H2C
R2
R1
Реакция Хека:
RBr
+
1% Pd(OAc) 2
2% Ph3P, Na 2CO 3
R
14
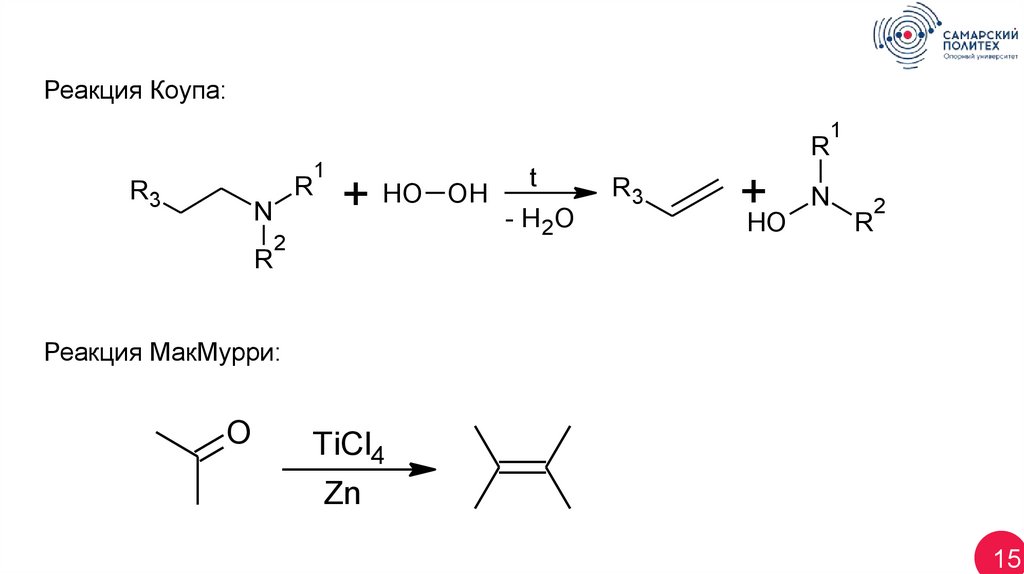
15.
Реакция Коупа:R
R
R3
N
R
1
+
HO OH
2
t
- H 2O
R3
+HO
1
N
R
2
Реакция МакМурри:
O
TiCl4
Zn
15
16.
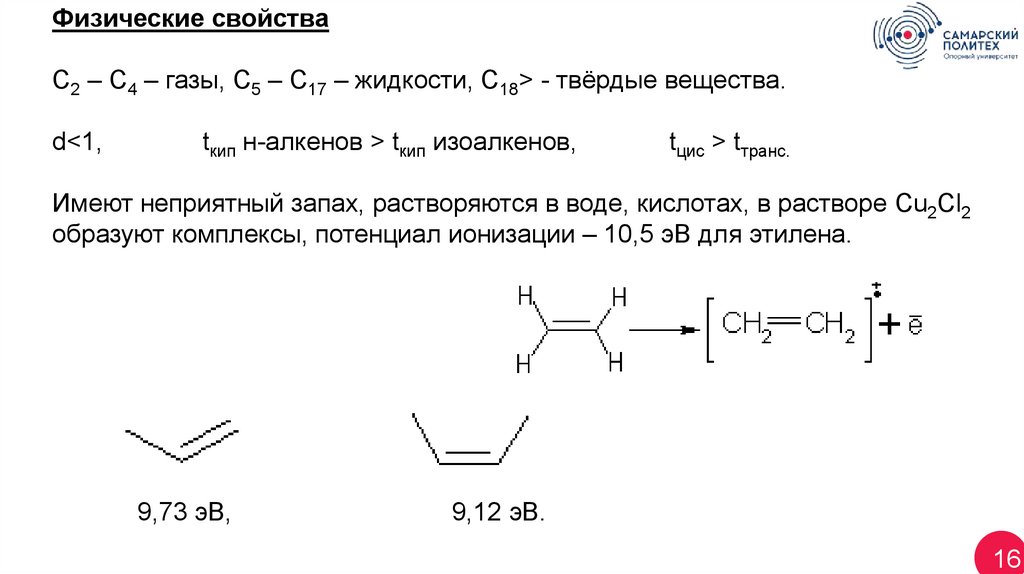
Физические свойстваС2 – С4 – газы, С5 – С17 – жидкости, С18> - твёрдые вещества.
d<1,
tкип н-алкенов > tкип изоалкенов,
tцис > tтранс.
Имеют неприятный запах, растворяются в воде, кислотах, в растворе Cu2Cl2
образуют комплексы, потенциал ионизации – 10,5 эВ для этилена.
9,73 эВ,
9,12 эВ.
16
17.
Химические свойстваРеакции присоединения (собственно присоединение, окисление,
полимеризация) и замещения
1. Присоединение
1.1 Гидрирование по правилу Лебедева: скорость реакции зависит от строения
соединения и в ряду алкенов и циклоалкенов снижается при увеличении
степени замещения этиленовой группы
kat
H2C
CH2 + H 2
H3C CH3
Палладий, платина, скелетный никель позволяют осуществить гидрирование
большинства олефинов при комнатной температуре и давлении водорода 2-3
атм
17
18.
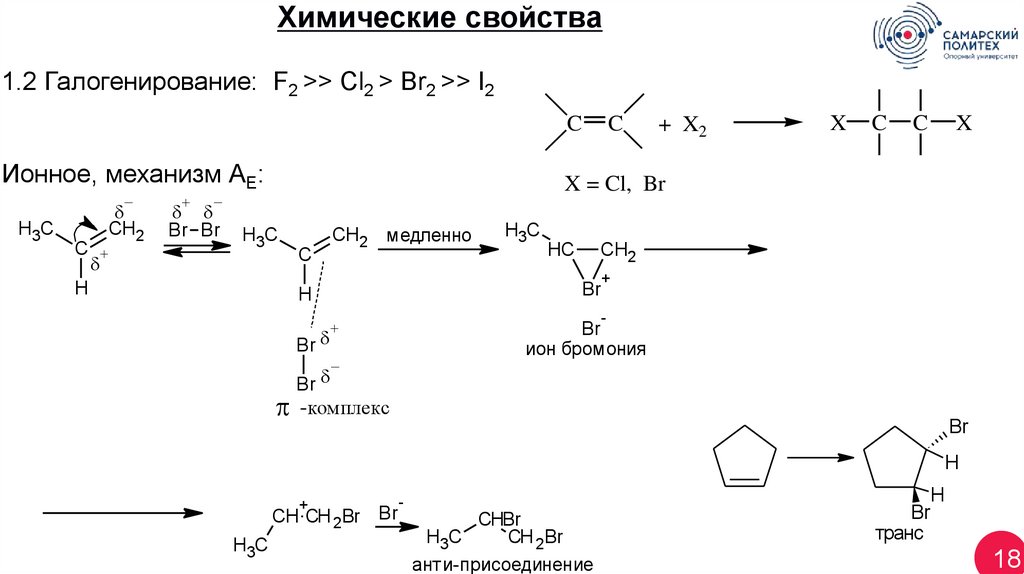
Химические свойства1.2 Галогенирование: F2 >> Cl2 > Br2 >> I2
C
Ионное, механизм АЕ:
H3C
CH2
C
H
+ X2
X
C
C
X
X = Cl, Br
Br Br
C
H3C
CH2 медленно
C
HC
CH2
Br
H
Br
H3C
-
Br
+
Br
ион бромония
-комплекс
Br
H
+
CH CH 2Br Br
H3C
-
CHBr
H3C
CH 2Br
анти-присоединение
H
Br
транс
18
19.
1.2 Галогенирование:Скорость галогенирования меняется в ряду:
H3C
H3C
C
CH2 >
H3C
H
C
CH2
C
>
H
CH2
H
Радикальное, механизм AR:
Инициирование:
O O
Ph
Ph
Ph C
O O
O
O
+ HBr
hv или t
o
Ph C
O
O
Ph C
O
+
OH
Br
19
20.
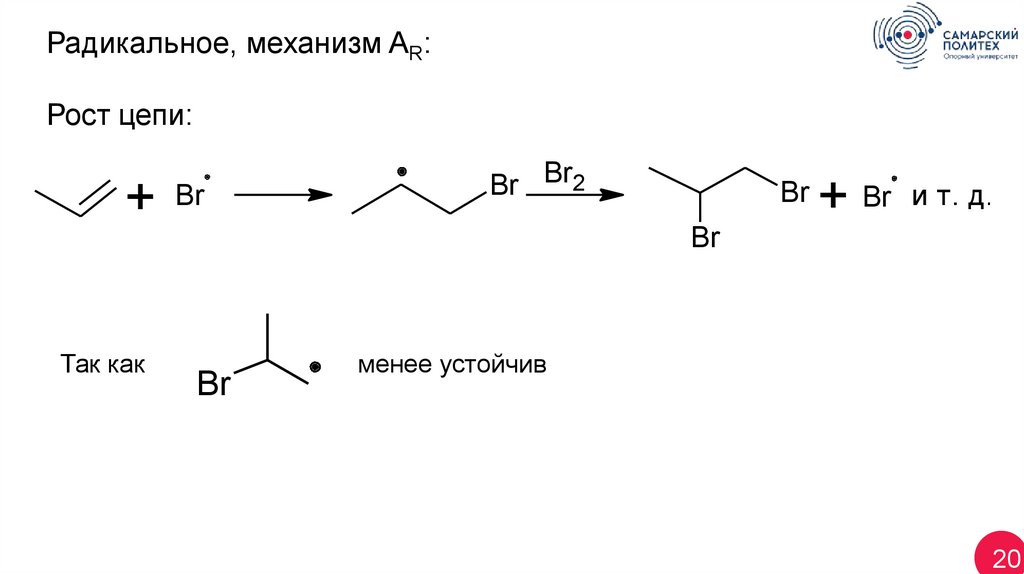
Радикальное, механизм AR:Рост цепи:
+
Br
Br Br2
Br
+ Br
и т. д.
Br
Так как
Br
менее устойчив
20
21.
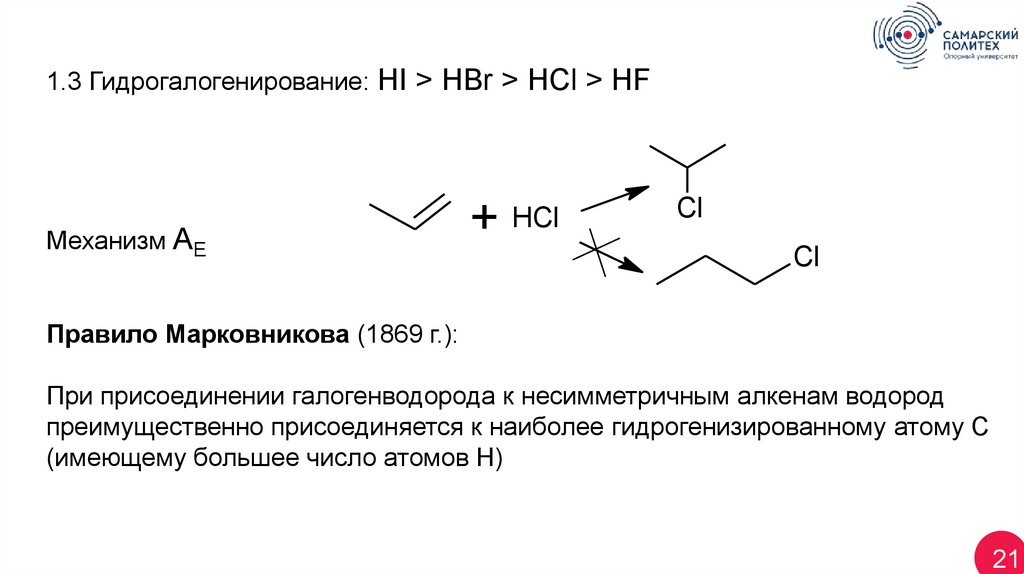
1.3 Гидрогалогенирование: HI > HBr > HCl > HFМеханизм АЕ
+
HCl
Cl
Cl
Правило Марковникова (1869 г.):
При присоединении галогенводорода к несимметричным алкенам водород
преимущественно присоединяется к наиболее гидрогенизированному атому С
(имеющему большее число атомов Н)
21
22.
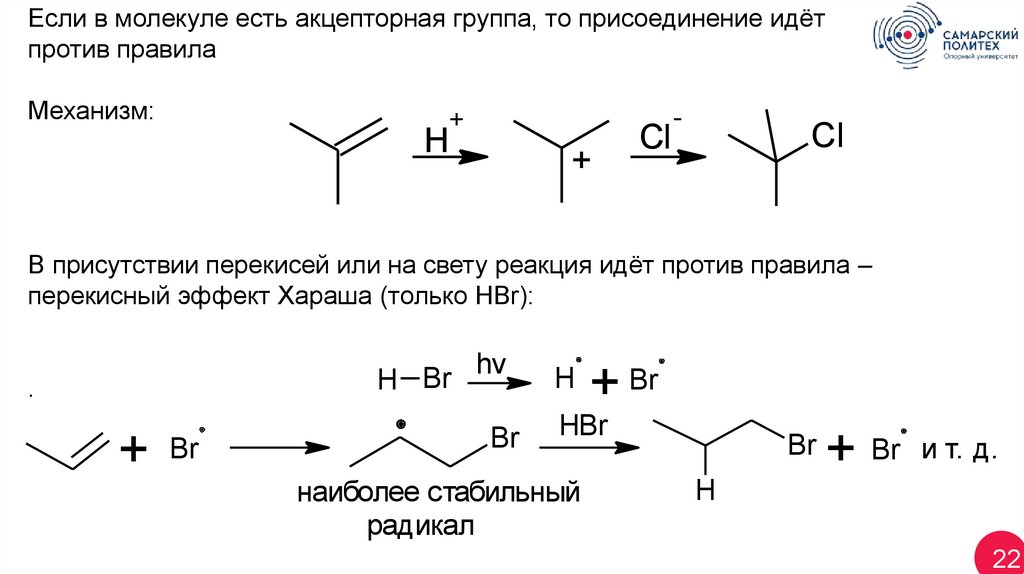
Если в молекуле есть акцепторная группа, то присоединение идётпротив правила
Механизм:
+
H
+
Cl
-
Cl
В присутствии перекисей или на свету реакция идёт против правила –
перекисный эффект Хараша (только HBr):
H Br
.
+
Br
hv
Br
H
+ Br
HBr
наиболее стабильный
радикал
Br
+ Br
и т. д.
H
22
23.
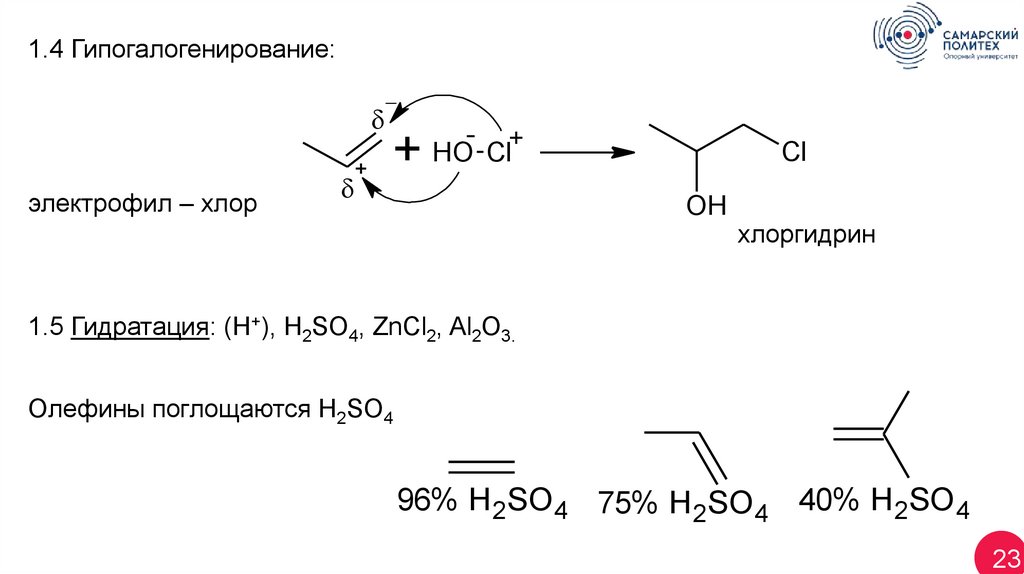
1.4 Гипогалогенирование:электрофил – хлор
+
+
- +
HO Cl
Cl
OH
хлоргидрин
1.5 Гидратация: (Н+), H2SO4, ZnCl2, Al2O3.
Олефины поглощаются H2SO4
96% H 2SO4 75% H 2SO4 40% H 2SO4
23
24.
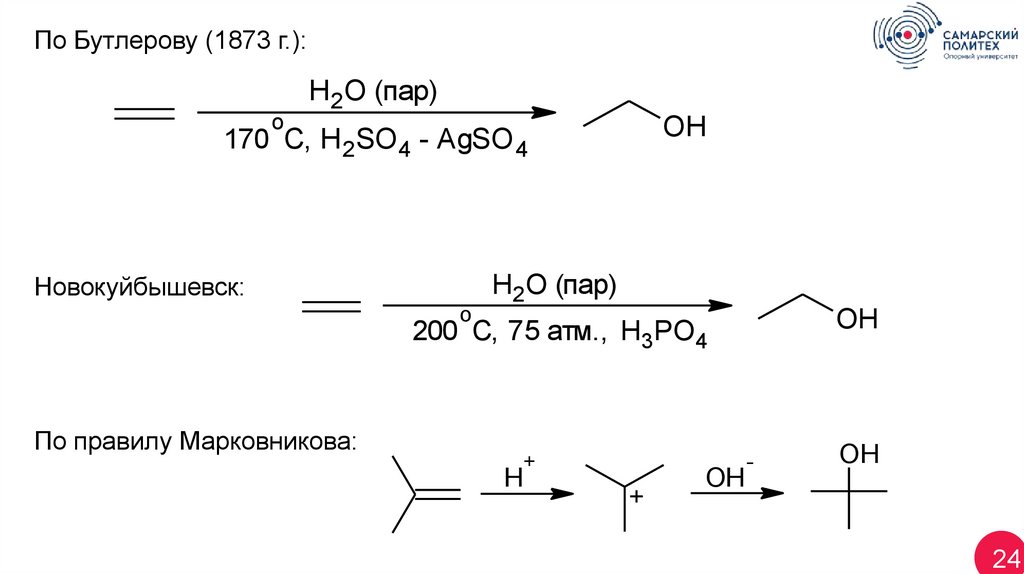
По Бутлерову (1873 г.):H2O (пар)
o
OH
170 C, H 2SO4 - AgSO 4
H2O (пар)
Новокуйбышевск:
o
OH
200 C, 75 атм., H3PO4
По правилу Марковникова:
+
H
+
OH
-
OH
24
25.
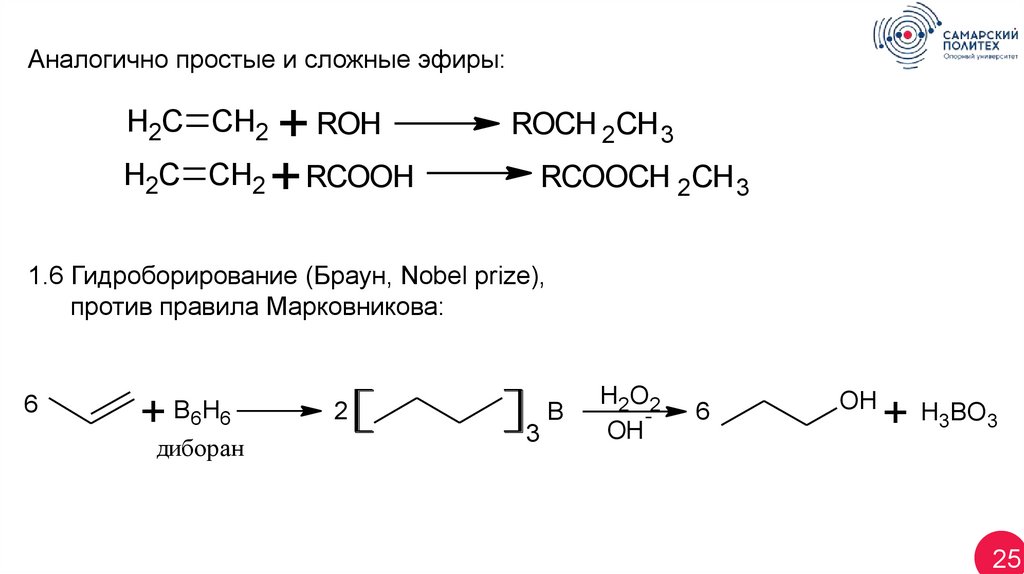
Аналогично простые и сложные эфиры:+ ROH
CH2 + RCOOH
H2C CH2
H2C
ROCH 2CH 3
RCOOCH 2CH 3
1.6 Гидроборирование (Браун, Nobel prize),
против правила Марковникова:
6
+
B 6 H6
диборан
2
3
B
H2 O 2
OH
6
OH
+ H3BO3
25
26.
1.7 Гидроформилирование (оксосинтез):O
[Co]
O
+
o
180 C, 100 атм.
H
H
+ CO + H 2
OH
[2H 2][Co], Ph 3P
o
180 C, 100 атм .
OH
восстановление
+
гидроформилирование
26
27.
1.8 Диспропорционирование (метатезис):2
Re 2O7 / Al2O3
+ H2C
CH2
Обратная реакция - пропилен
CHCl 3 + NaOH
1.9 Присоединение карбенов:
H2O + NaCl + CCl 2
+ CCl 2
Cl
Cl
1.10: Нитрозохлорирование:
2
NOCl
NO
Cl
27
28.
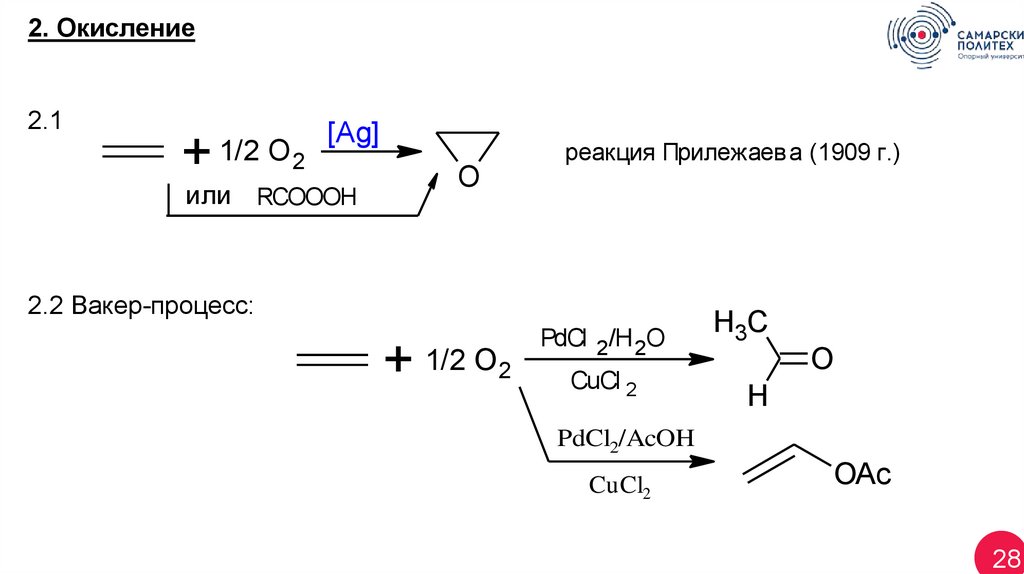
2. Окисление2.1
+ 1/2 O 2
[Ag]
или RCOOOH
O
реакция Прилежаева (1909 г.)
2.2 Вакер-процесс:
+ 1/2 O2
PdCl 2/H 2O
CuCl 2
H3C
O
H
PdCl2/AcOH
CuCl2
OAc
28
29.
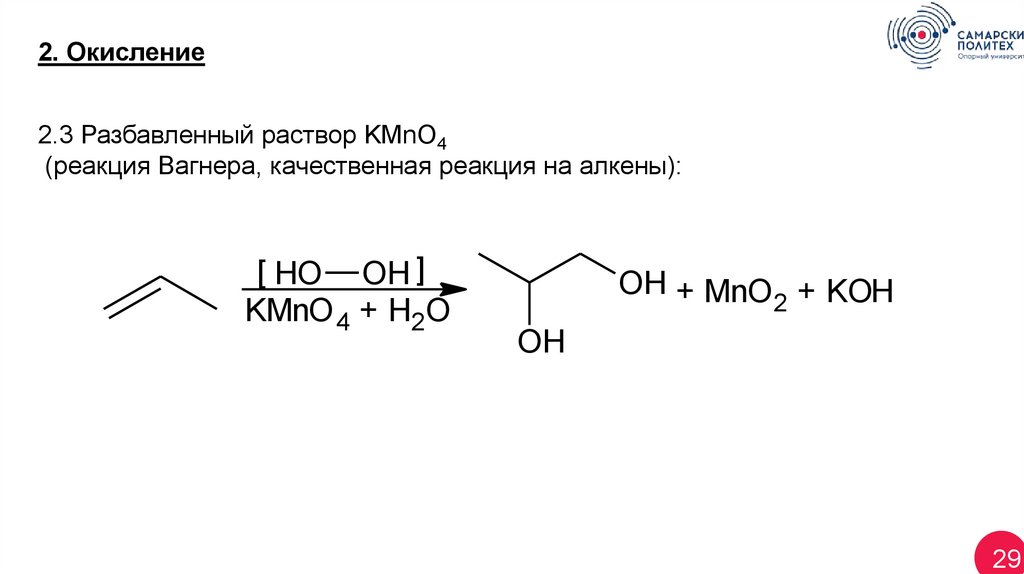
2. Окисление2.3 Разбавленный раствор KМnO4
(реакция Вагнера, качественная реакция на алкены):
[ HO OH ]
KMnO 4 + H2O
OH + MnO + KOH
2
OH
29
30.
Окисление2.4 Сильные окислители (конц. KМnO4-H+, K2Cr2O7 -H+, CrO3, HNO3):
H3C
O + CH 3COOH
H3C
2.5 Озонолиз (установление положения двойной связи):
+ O3
O
O
O
O
O
мольозонид
O
изоозонид
H2O
- H 2O 2
O
+
H
O
H
или Zn, на Ph3P
30
31.
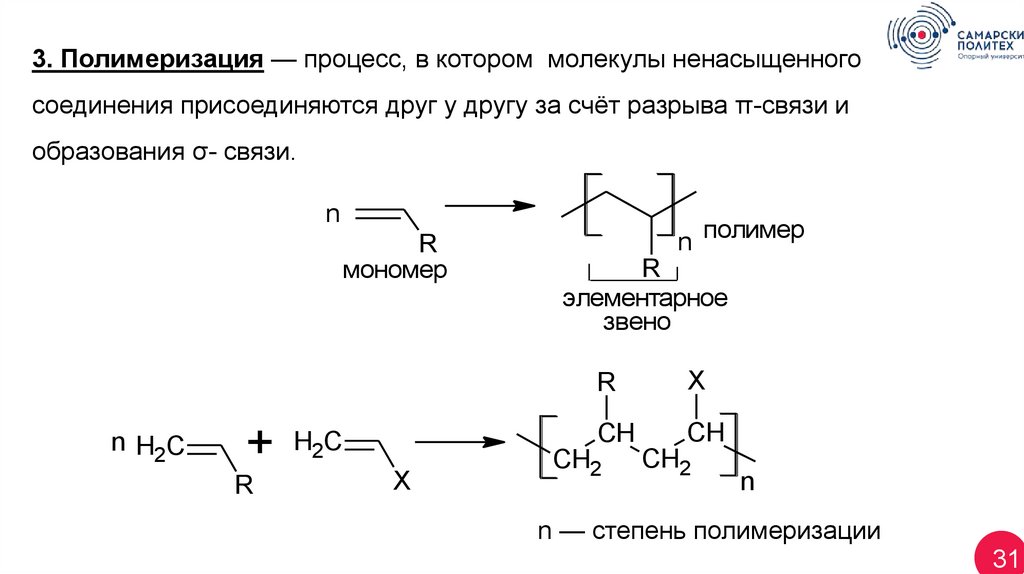
3. Полимеризация — процесс, в котором молекулы ненасыщенногосоединения присоединяются друг у другу за счёт разрыва π-связи и
образования σ- связи.
n
R
мономер
n H2C
+
R
H2C
X
n полимер
R
элементарное
звено
R
X
CH
CH
CH2
CH2
n
n — степень полимеризации
31
32.
Одинаковые звенья — гомополимер, разные — сополимер.(Пример!)
Олигомеры (n = 2 -5) — олигомеризация:
R
R
:
R
R
чаще всего
R=C 7
+
R
и т. д.
R
R
R
поли- -олефины
применение
32
33.
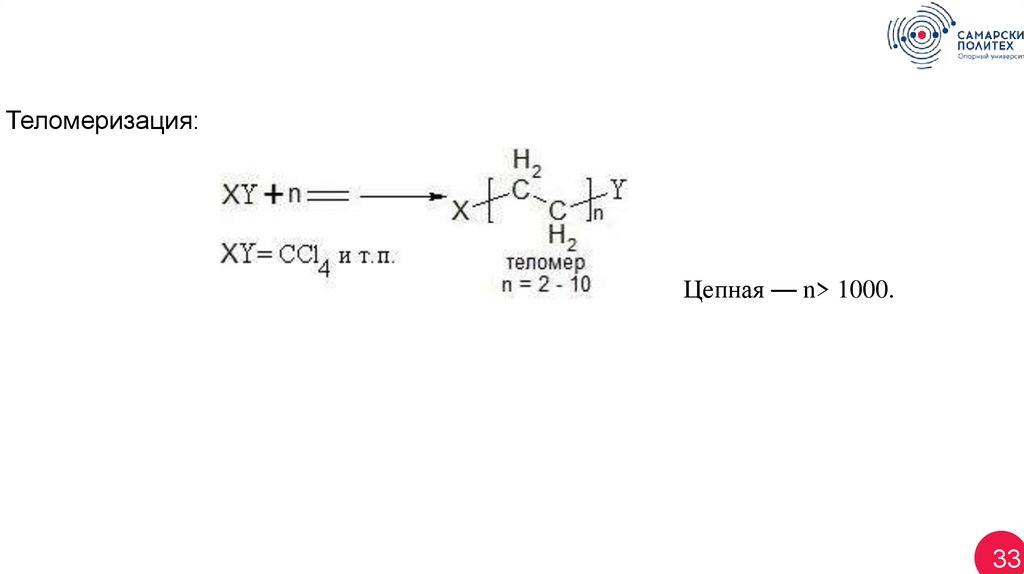
Теломеризация:Цепная — n> 1000.
33
34.
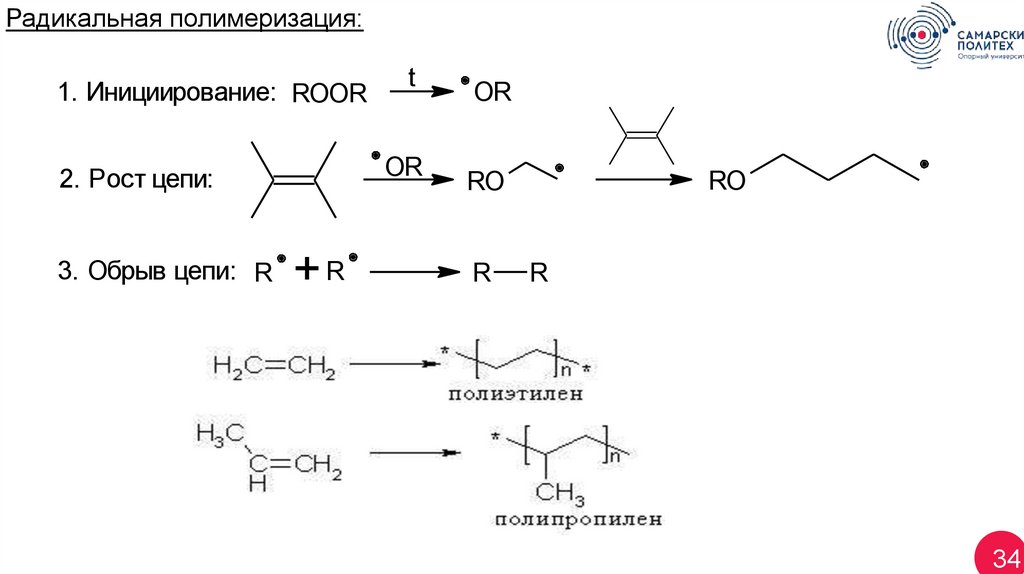
Радикальная полимеризация:1. Инициирование: ROOR
OR
2. Рост цепи:
3. Обрыв цепи: R
t
+R
OR
RO
RO
R
R
34
35.
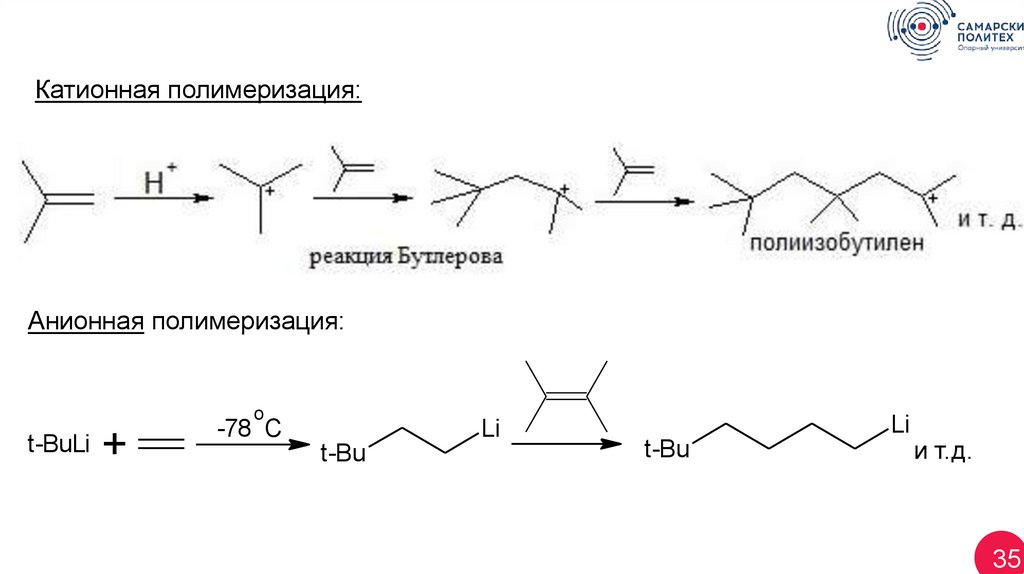
Катионная полимеризация:Анионная полимеризация:
o
t-BuLi
+
-78 C
Li
t-Bu
Li
t-Bu
и т.д.
35
36.
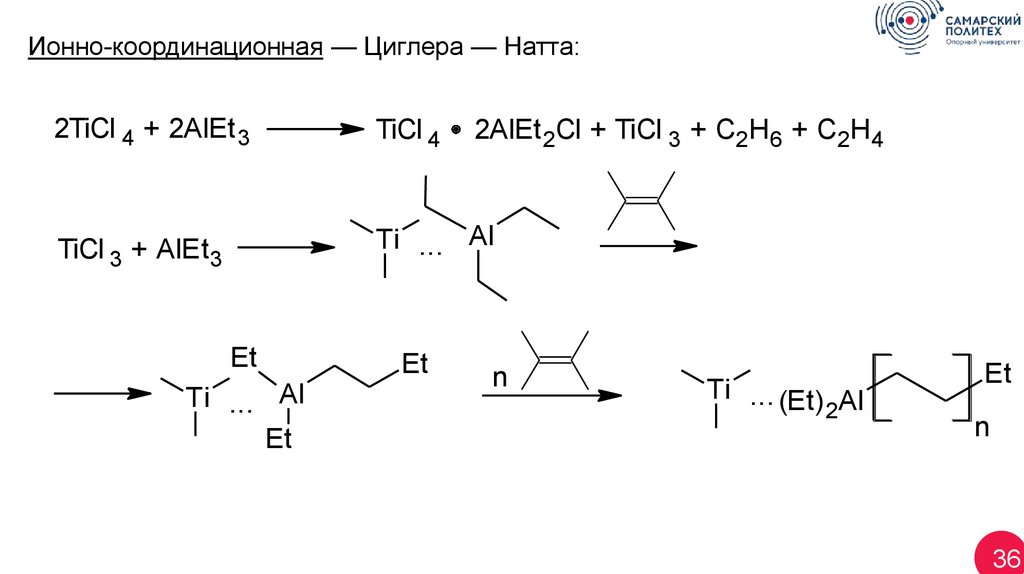
Ионно-координационная — Циглера — Натта:2TiCl 4 + 2AlEt 3
TiCl 4
TiCl 3 + AlEt3
Ti ... Al
Et
Ti ... Al
Et
Et
2AlEt 2Cl + TiCl 3 + C2H6 + C2H4
n
Ti ... (Et) Al
2
Et
n
36
37.
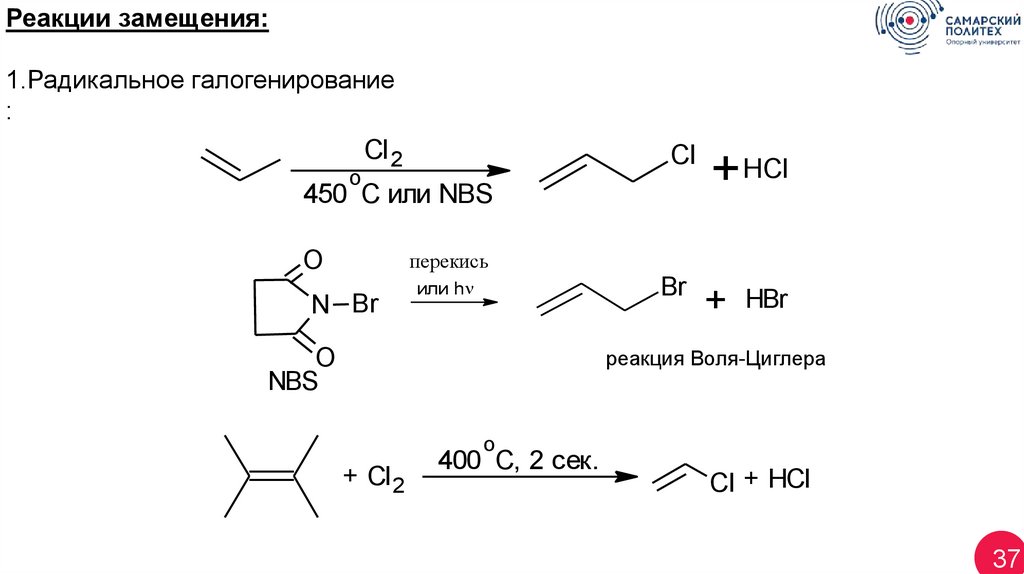
Реакции замещения:1.Радикальное галогенирование
:
o
Cl 2
Cl
450 C или NBS
+ HCl
перекись
O
N Br
Br
или h
+
HBr
реакция Воля-Циглера
O
NBS
o
+ Cl 2
400 C, 2 сек.
Cl + HCl
37
38.
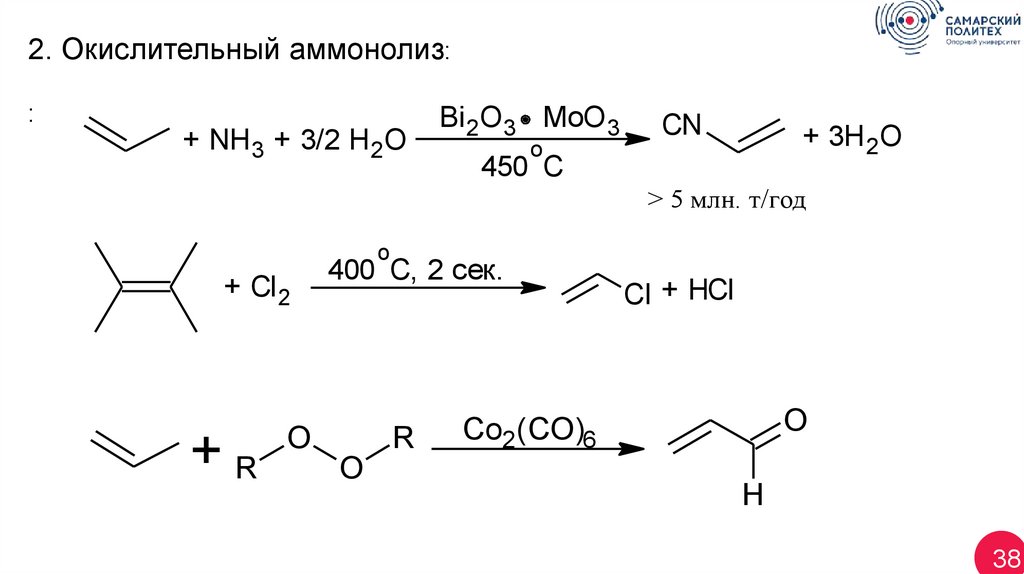
2. Окислительный аммонолиз::
+ NH 3 + 3/2 H2O
Bi 2O3 MoO3
o
CN
+ 3H 2O
450 C
> 5 млн. т/год
o
+ Cl 2
+R
400 C, 2 сек.
O
R
O
Cl + HCl
O
Co2(CO)6
H
38
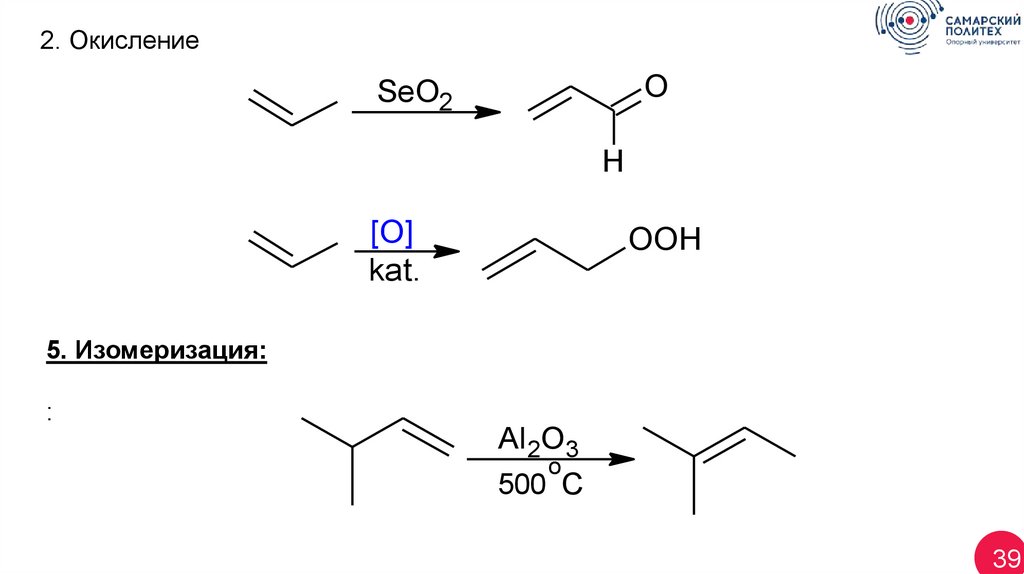
39.
2. ОкислениеO
SeO2
H
[O]
kat.
OOH
5. Изомеризация:
:
Al 2O3
o
500 C
39









 Химия
Химия








