Похожие презентации:
Пути обмена аминокислот. Дезаминирование, трансаминирование и трансдезаминирование аминокислот
1.
ПЯТИГОРСКИЙ МЕДИКО-ФАРМАЦЕВТИЧЕСКИЙ ИНСТИТУТ-филиал федерального государственногобюджетного образовательного учреждения высшего образования «Волгоградский государственный
медицинский университет» Министерства здравоохранения Российской Федерации.
ДИСЦИПЛИНА: «БИОЛОГИЧЕСКАЯ ХИМИЯ»
СПЕЦИАЛЬНОСТЬ: «ФАРМАЦИЯ»
ЛЕКЦИИ № 3 И 4
ПУТИ ОБМЕНА АМИНОКИСЛОТ. ДЕЗАМИНИРОВАНИЕ,
ТРАНСАМИНИРОВАНИЕ И ТРАНСДЕЗАМИНИРОВАНИЕ
АМИНОКИСЛОТ. ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ.
ОРНИТИНОВЫЙ ЦИКЛ. СИНТЕЗ АМИНОКИСЛОТ
ЛЕКТОР: ДОЦЕНТ ЖИЛИНА О.М.
2.
ПЛАН ЛЕКЦИИ:ОБМЕН АМИНОКИСЛОТ.
ПЕРЕВАРИВАНИЕ БЕЛКОВ.
ТРАНСПОРТ АМИНОКИСЛОТ
РАСПАД И СИНТЕЗ АМИНОКИСЛОТ.
ТРАНСАМИНИРОВАНИЕ И ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТ,
ОБМЕН АММИАКА И СИНТЕЗ МОЧЕВИНЫ.
ОРНИТИНОВЫЙ ЦИКЛ
3.
ОБМЕН АМИНОКИСЛОТ (АК)• Структурной единицей белков являются альфа-аминокислоты.Различная последовательность АК
приводит к огромному разнообразию белков.
• В количественном отношении белки занимают первое место среди всех содержащихся в живой
клетке макромолекул.В одной клетке можно обнаружить сотни различных видов белков.
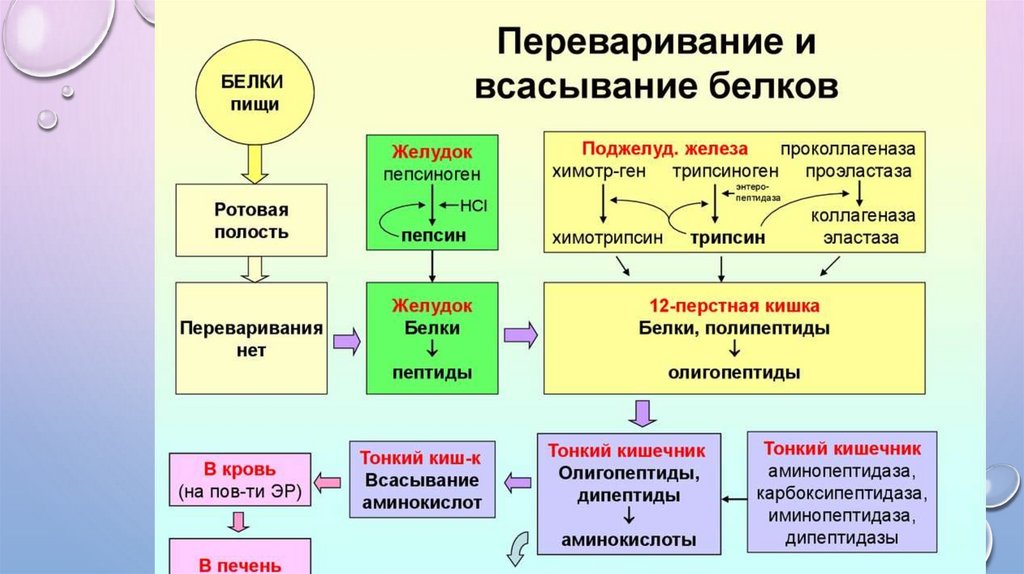
ПЕРЕВАРИВАНИЕ БЕЛКОВ
• Переваривание белков осуществляется пептидазами. Пептидазы являются ферментами класса гидролаз,
расщепляют пептидные связи. Различают эндо- и экзопептидазы.
• Эндопептидазы расщепляют внутренние пептидные связи, к ним относятся пепсин и гастриксин
желудка, трипсин, химотрипсин, коллагеназа и эластаза поджелудочной железы, энтеропептидаза
кишечника.
• Экзопептидазы расщепляют внешние пептидные связи, к ним относятся карбоксипептидаза
поджелудочной железы, аминопептидаза и олигопептидазы кишечника.
Все пептидазы образуются в неактивной форме и активируются путем ограниченного протеолиза в тех
местах, где они действуют.
4.
5.
• Из мышц и кишечника поступает основное количество свободных аминокислот.• 50 % из низ это глутамин и аланин.
• Основное количество глутамина поставляет в кровь мышцы и мозг.
• Почки – основной источник серина и аланина, которые собираются из плазмы печенью.
• Головной мозг, в отличие от других тканей, способен поглощать и окислять в больших
количествах ак с разветвленной боковой цепью (валин, лейцин, изолейцин).
• В мышцах происходит усиленный катаболизм ак, они являются основными донорами
аминогруппы для синтеза аланина из пирувата.
6.
Азотистый баланс• Содержание АК свободных и в составе белков определяет азотистый баланс.
• Азотистый баланс – разница между количеством азота, поступающего с пищей и
количеством выделяемого азота (мочевина, аммонийные соли).
• Азотистое равновесие – количество выделяющего и поступающего азота равно.
• Положительный азотистый баланс наблюдается у детей и выздоравливающих больных
– выделяющего азота меньше.
• Отрицательный - при белковом голодании, тяжелых заболеваниях, старении.
• Норма потребления белка 30-50 г в сутки. Если физ. Нагрузка или тяжелый физ. Труд, то
норма увеличивается до 100-150 г.
7.
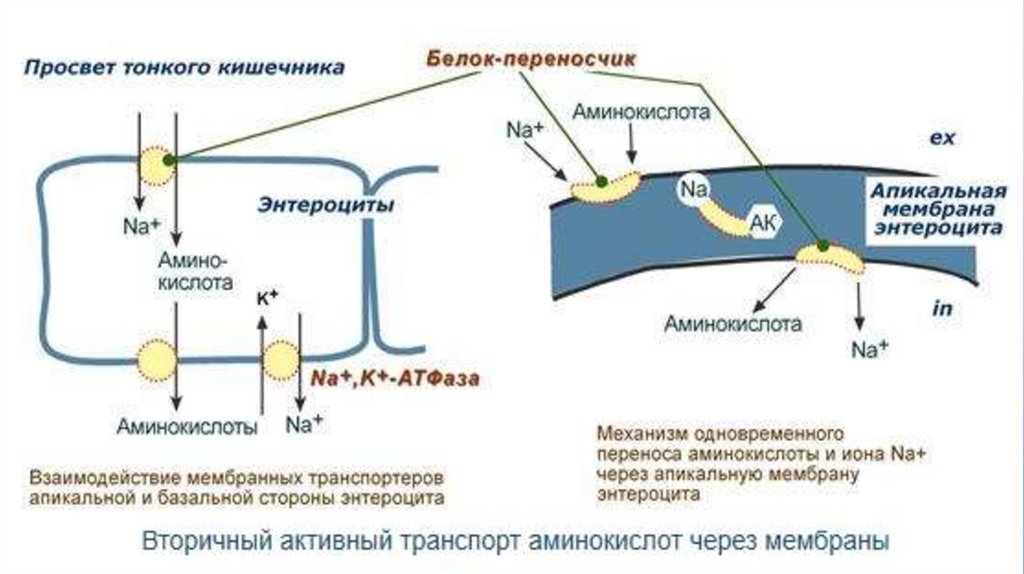
ТРАНСПОРТ АМИНОКИСЛОТДля всасывания АК из полости кишечника в энтероциты, при переходе из
крови клеток в клетки различных тканей используется:
I.
Вторичный активный транспорт
II.
Глутатионовая транспортная система
8.
ВТОРИЧНЫЙ АКТИВНЫЙ ТРАНСПОРТ• Вторичный активный транспорт - это перенос веществ, в частности АК, с использованием
градиента концентрации ионов натрия меду внутренней и наружной сторонами клеточной
мембраны.
• Основан на низкой концентрации ионов натрия внутри клеток.
• Фермент - N+,K+ - АТФ-аза
• Специфические белок-транспортер связывает на апикальной поверхности энтероцитов АК
и ион натрия (!), без последнего связывания не происходит.
• При попадании в цитозоль АК отдает ион натрия и теряет связь с белком-транспортером
9.
10.
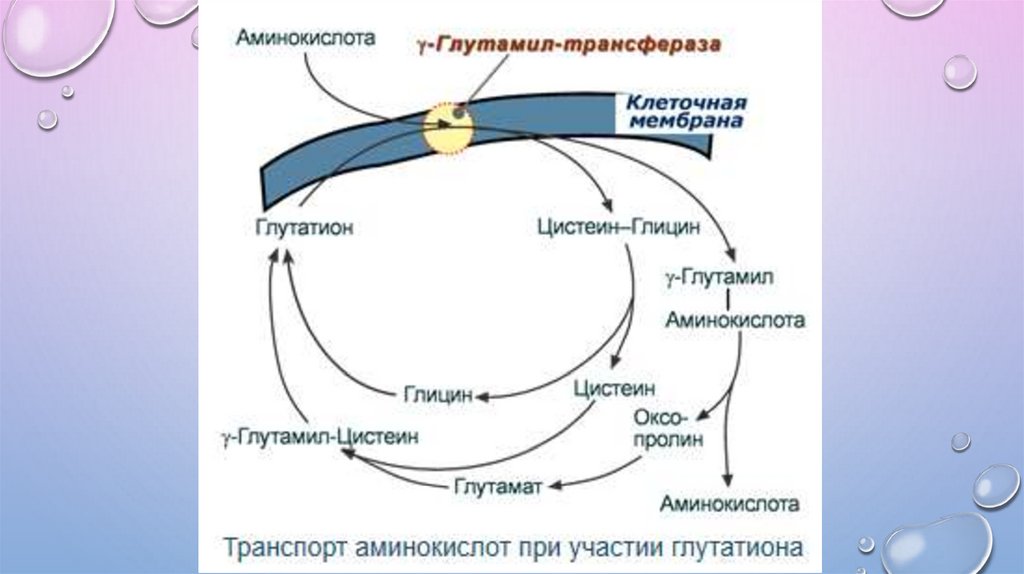
ГЛУТАТИОНОВАЯ ТРАНСПОРТНАЯ СИСТЕМА• Перенос АК (обычно нейтральных) в цитозоль происходит в комплексе с глутатионом (γ(гамма)-глутамилцистеилглицин),
• Фермент – гамма-глутамилтрансферазы,
• Исследование активности гамма-глутамилтрансферазы часто проводится в клиниколабораторной диагностике заболеваний печени и почек.
11.
12.
13.
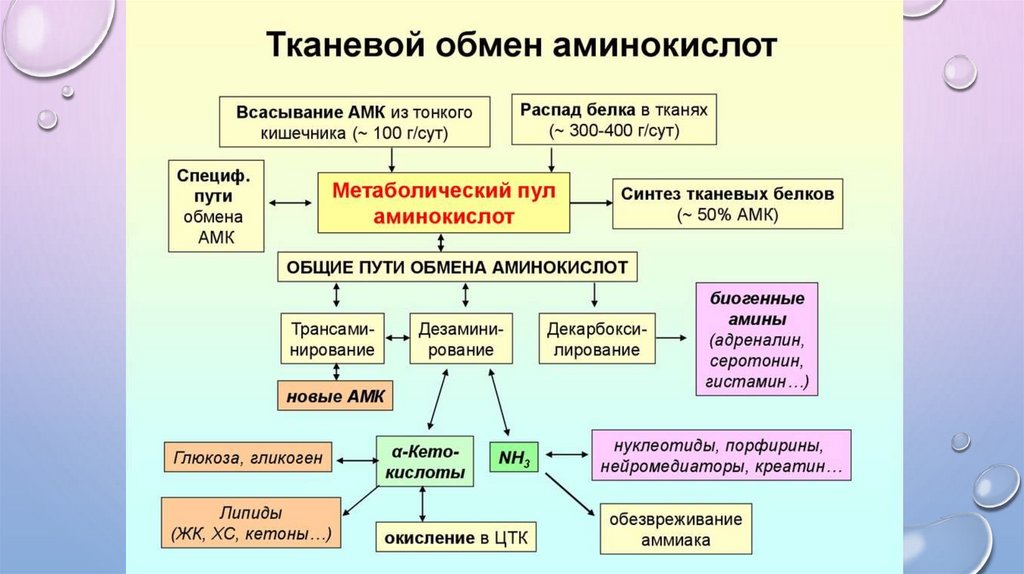
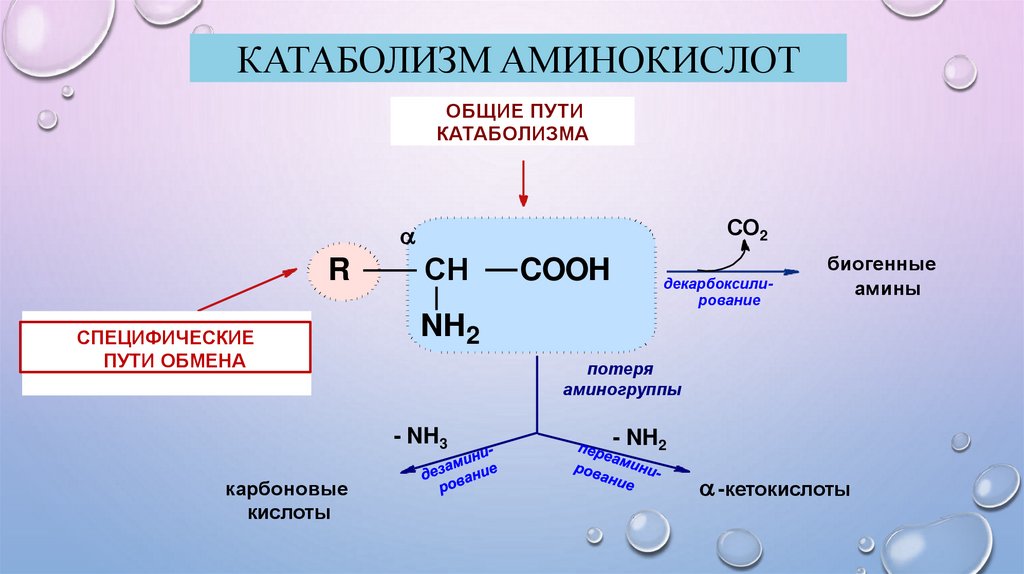
ОБЩИЕ ПУТИ КАТАБОЛИЗМА АМИНОКИСЛОТПРЕВРАЩЕНИЕ АК В КЛЕТКЕ ПРОТЕКАЕТ С УЧАСТИЕМ:
Аминогруппы,
Карбоксильной группы,
Радикала. Реакции, протекающие по радикалу аминокислот, называются
специфическими, или индивидуальными, путями обмена. Направление
превращений аминокислот по радикалу зависит от строения самого
радикала и наличия ферментов, катализирующих эти превращения.
14.
КАТАБОЛИЗМ АМИНОКИСЛОТОБЩИЕ ПУТИ
КАТАБОЛИЗМА
СО2
R
ИНДИВИДУАЛЬНЫЕ
СПЕЦИФИЧЕСКИЕПУТИ
КАТАБОЛИЗМА
ПУТИ ОБМЕНА
СН
декарбоксилирование
биогенные
амины
NH2
потеря
аминогруппы
- NH3
карбоновые
кислоты
COOH
- NH2
-кетокислоты
15.
ДЕЗАМИНИРОВАНИЕ АМИНОКИСЛОТКатаболиз АК начинается с реакции дезаминирования – отщепления альфааминогруппы, которая выделяется в виде аммиака и образования безазотистого остатка
(альфа-кетокислоты)
Дезаминированию подвергаются все АК, кроме пролина и лизина.
Существует несколько типов реакций дезаминирования:
Неокислительное – характерное для сер, тре, гис
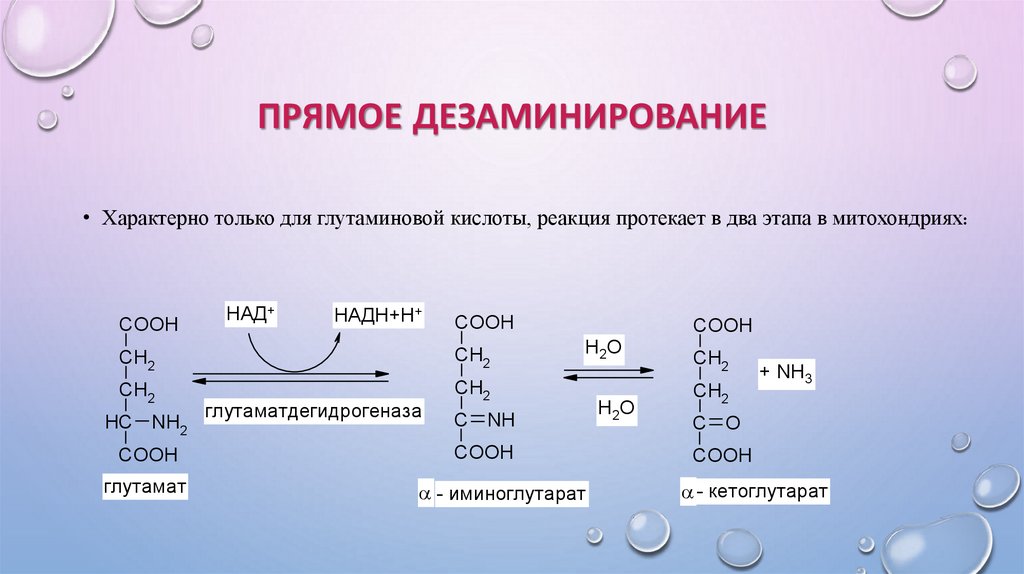
Окислительное прямое – характерно только для глу.
Окислительное непрямое – характерно для всех остальных.
!!! ОКИСЛИТЕЛЬНОЕ ДЕЗАМИНИРОВАНИЕ ЯВЛЯЕТСЯ ОСНОВНЫМ ПУТЕМ
КАТАБОЛИЗМА АК
16.
ПРЯМОЕ ДЕЗАМИНИРОВАНИЕ• Характерно только для глутаминовой кислоты, реакция протекает в два этапа в митохондриях:
COOH
НАД+
НАДН+Н+
COOH
CH2
CH2
CH2
CH2
HC NH2
COOH
глутамат
глутаматдегидрогеназа
Н2О
C NH
COOH
- иминоглутарат
Н2О
COOH
CH2
CH2
+ NH3
C O
COOH
- кетоглутарат
17.
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕЭто дезаминирование, которое происходит в 2 стадий с участием нескольких ферментов. Оно
характерно для большинства АК, так как они не способны к прямому дезаминированию (нет
ферментов).
На первой стадии происходит одна и несколько реакций переаминирования с участием
аминотрансфераз (коферментом является витамин В6), в результате аминогруппа АК переходит
на кетосоединение.
На второй стадии происходит реакция дезаминирования аминосоединения (глу, амф), в
результате чего образуется аммиак.
Последовательность реакций непрямого дезаминирования зависит от набора ферментов в тканях.
18.
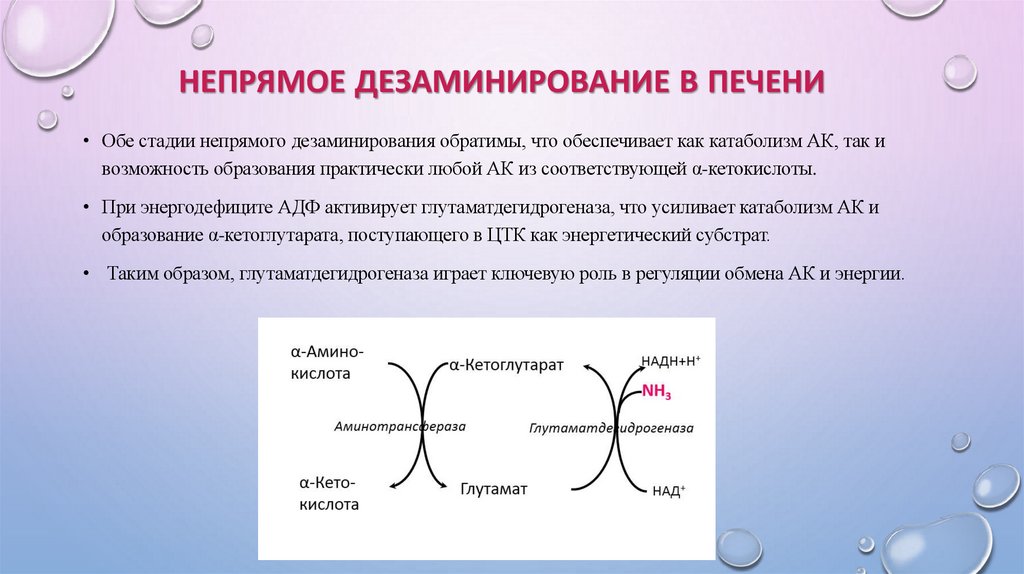
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ В ПЕЧЕНИ• Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм АК, так и
возможность образования практически любой АК из соответствующей α-кетокислоты.
• При энергодефиците АДФ активирует глутаматдегидрогеназа, что усиливает катаболизм АК и
образование α-кетоглутарата, поступающего в ЦТК как энергетический субстрат.
• Таким образом, глутаматдегидрогеназа играет ключевую роль в регуляции обмена АК и энергии.
19.
НЕПРЯМОЕ ДЕЗАМИНИРОВАНИЕ В МЫШЦАХ (И НЕРВНОЙТКАНИ)
В мышечной ткани активность глутаматдегидрогеназы низкая, поэтому при
интенсивной физической нагрузке функционирует ещё один путь
непрямого дезаминирования с участием цикла ИМФ-АМФ.
20.
Гликогенные аминокислоты образуют промежуточные продукты общихпутей катаболизма (пируват, α-кетоглутарат, сукцинил-КоА, фумарат,
оксалоацетат) – идущие в процессе глюконеогенеза на синтез глюкозы
Кетогенные аминокислоты (лизин, лейцин) превращаются в ацетил-KoA
из которого синтезируются кетоновые тела.
Гликокетогенные аминокислоты распадаются на два продукта –
метаболит ОПК и ацетил –КоА (изолейцин) или ацетоацетат
(фенилаланин, тирозин, треонин), которые могут использоваться для
синтеза как глюкозы, так и кетоновых тел
21.
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ТРАНСАМИНАЗ:• Трансаминирование - заключительный этап синтеза заменимых АК из соответствующих
альфа-кетокислот.
• Трансаминирование - первая стадия дезаминирования большинства АК, т.е. начальный
этап их катаболизма.
• Образующиеся при этом кетокислоты окисляются в ЦТК или используются для синтеза
глюкозы и кетоновых тел.
22.
ДИАГНОСТИЧЕСКОЕ ЗНАЧЕНИЕ ТРАНСАМИНАЗ:Коэффициент де Ритиса
Коэффициент де Ритиса
Коэффициент де Ритиса
23.
ДЕКАРБОКСИЛИРОВАНИЕ АМИНОКИСЛОТ• Процесс катализируется декарбоксилазами,
• Необратим
• Коферментом декарбоксилаз является провитамин В6. - Пиридоксальфосфат.
• В большинстве случаев при декарбоксилировании аминокислот образуются амины
(исключением является глутамат, при декарбоксилировании которого образуется
-аминомасляная кислота)
24.
ПРИМЕРЫ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ ИФУНКЦИИ ОБРАЗОВАВШИХСЯ ПРОДУКТОВ:
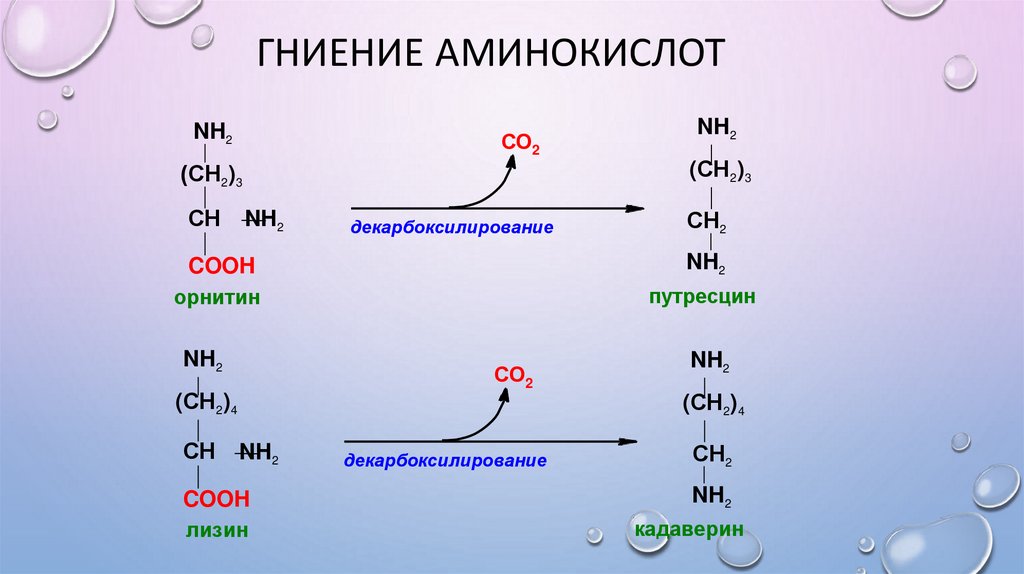
• Орнитина - путресцин,
• Лизина - кадаверин.
Эти амины образуются при бактериальном брожении из белков и давно известны из-за
неприятного запаха. Раньше их считали трупными ядами, хотя это не так. Из них образуются
полиамины. Из путресцина образуются спермин и спермидин, которые стабилизируют
структуру мембран. Спермидин прочно связан с ДНК и может способствовать стабилизации
ее структуры.
25.
ПРИМЕРЫ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ ИФУНКЦИИ ОБРАЗОВАВШИХСЯ ПРОДУКТОВ:
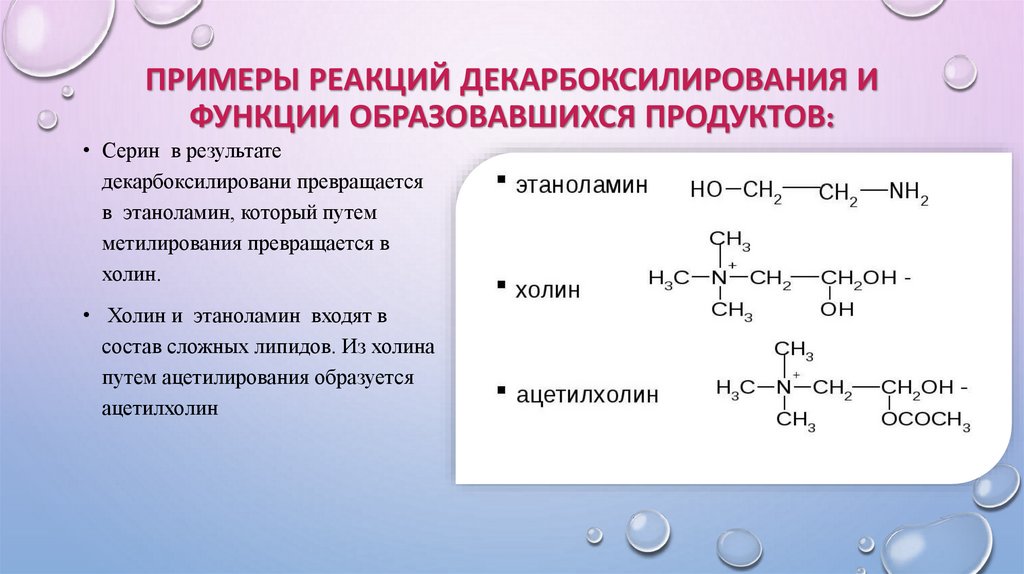
• Серин в результате
декарбоксилировани превращается
в этаноламин, который путем
метилирования превращается в
холин.
• Холин и этаноламин входят в
состав сложных липидов. Из холина
путем ацетилирования образуется
ацетилхолин
26.
ПРИМЕРЫ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ ИФУНКЦИИ ОБРАЗОВАВШИХСЯ ПРОДУКТОВ:
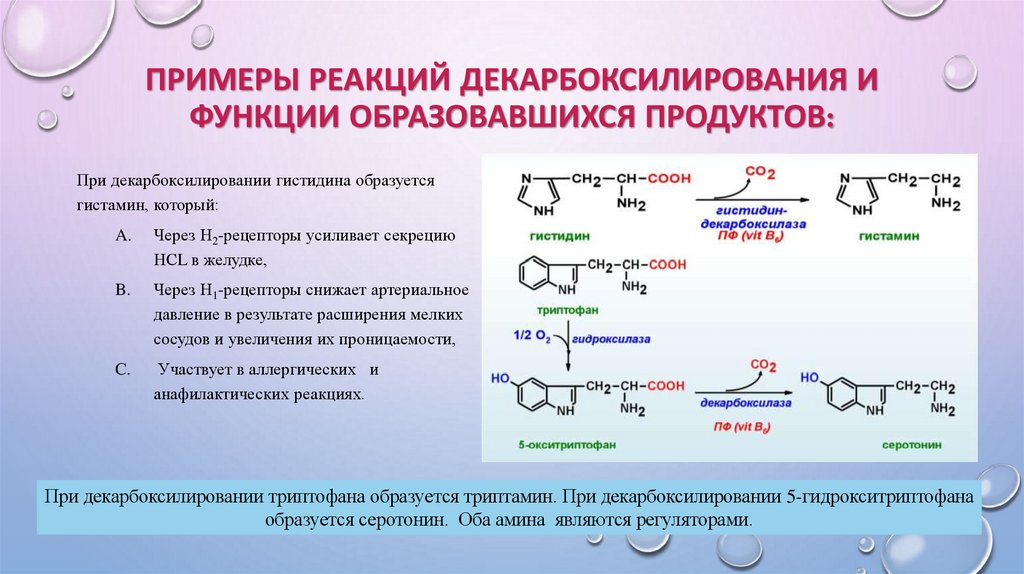
При декарбоксилировании гистидина образуется
гистамин, который:
A.
Через Н2-рецепторы усиливает секрецию
НСL в желудке,
B.
Через Н1-рецепторы снижает артериальное
давление в результате расширения мелких
сосудов и увеличения их проницаемости,
C.
Участвует в аллергических и
анафилактических реакциях.
При декарбоксилировании триптофана образуется триптамин. При декарбоксилировании 5-гидрокситриптофана
образуется серотонин. Оба амина являются регуляторами.
27.
ПРИМЕРЫ РЕАКЦИЙ ДЕКАРБОКСИЛИРОВАНИЯ ИФУНКЦИИ ОБРАЗОВАВШИХСЯ ПРОДУКТОВ:
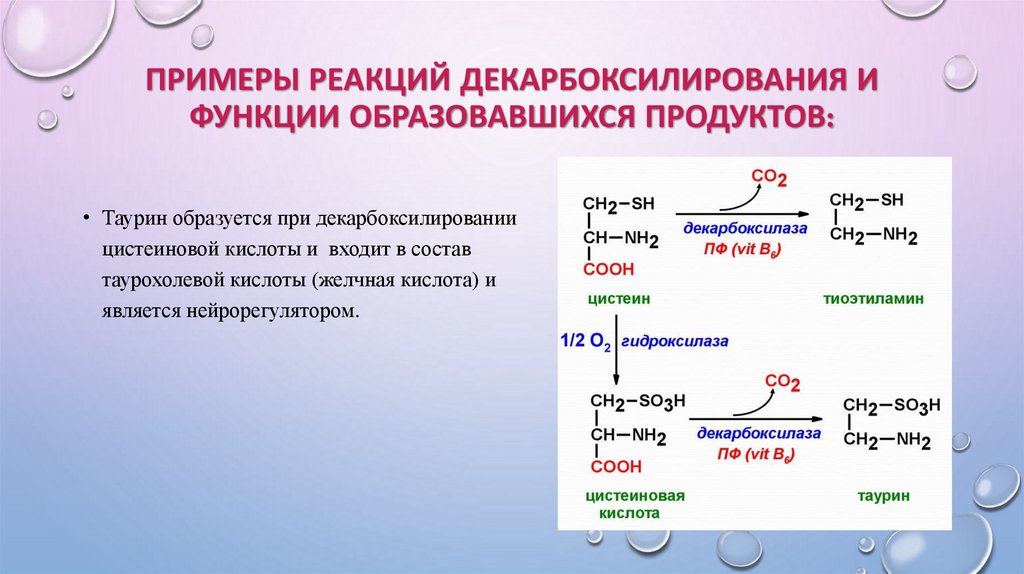
• Таурин образуется при декарбоксилировании
цистеиновой кислоты и входит в состав
таурохолевой кислоты (желчная кислота) и
является нейрорегулятором.
28.
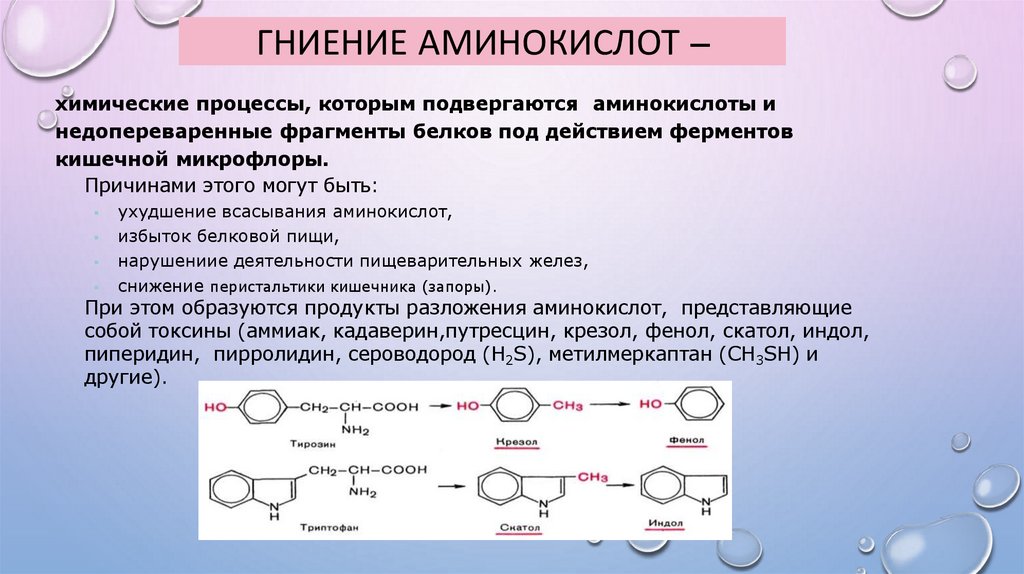
ГНИЕНИЕ АМИНОКИСЛОТ –химические процессы, которым подвергаются аминокислоты и
недопереваренные фрагменты белков под действием ферментов
кишечной микрофлоры.
Причинами этого могут быть:
ухудшение всасывания аминокислот,
избыток белковой пищи,
нарушениие деятельности пищеварительных желез,
снижение перистальтики кишечника (запоры).
При этом образуются продукты разложения аминокислот, представляющие
собой токсины (аммиак, кадаверин,путресцин, крезол, фенол, скатол, индол,
пиперидин, пирролидин, сероводород (H2S), метилмеркаптан (СН3SН) и
другие).
29.
ГНИЕНИЕ АМИНОКИСЛОТNH2
СО2
(СН 2)3
(СН2)3
СН
NH2
NH2
декарбоксилирование
СН2
COOH
NH2
орнитин
путресцин
NH2
СО2
(СН 2)4
СН
NH2
(СН 2)4
NH2
декарбоксилирование
СН2
COOH
NH2
лизин
кадаверин
30.
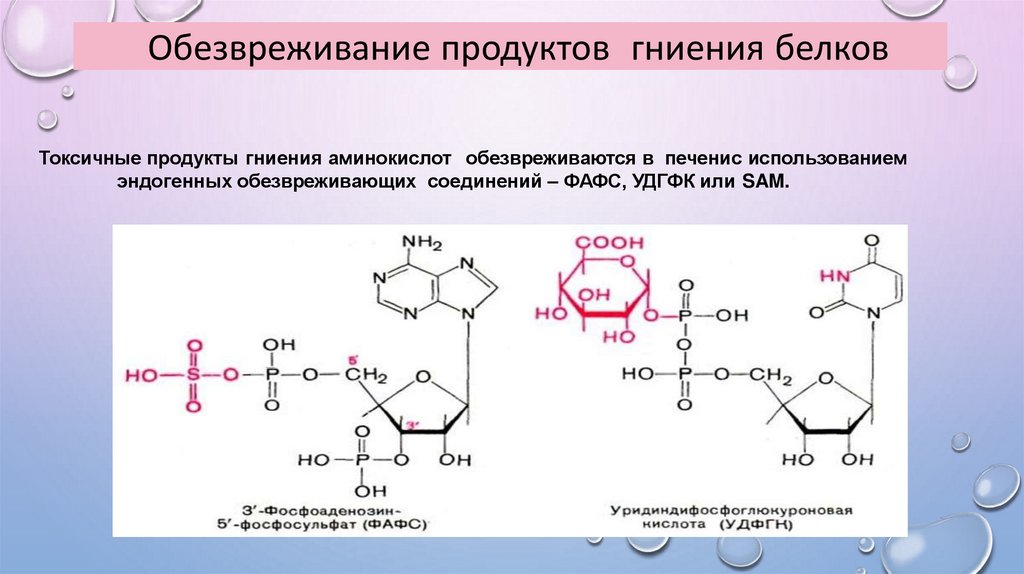
Обезвреживание продуктов гниения белковТоксичные продукты гниения аминокислот обезвреживаются в печенис использованием
эндогенных обезвреживающих соединений – ФАФС, УДГФК или SAM.
31.
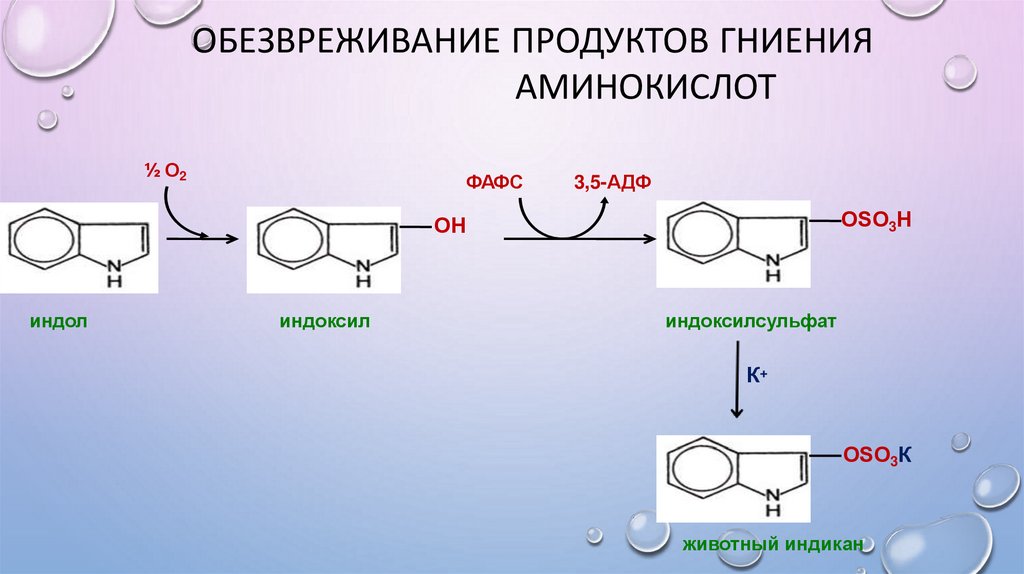
ОБЕЗВРЕЖИВАНИЕ ПРОДУКТОВ ГНИЕНИЯАМИНОКИСЛОТ
½ О2
ФАФС
3,5-АДФ
ОSO3Н
ОН
индол
индоксил
индоксилсульфат
К+
ОSO3К
животный индикан
32.
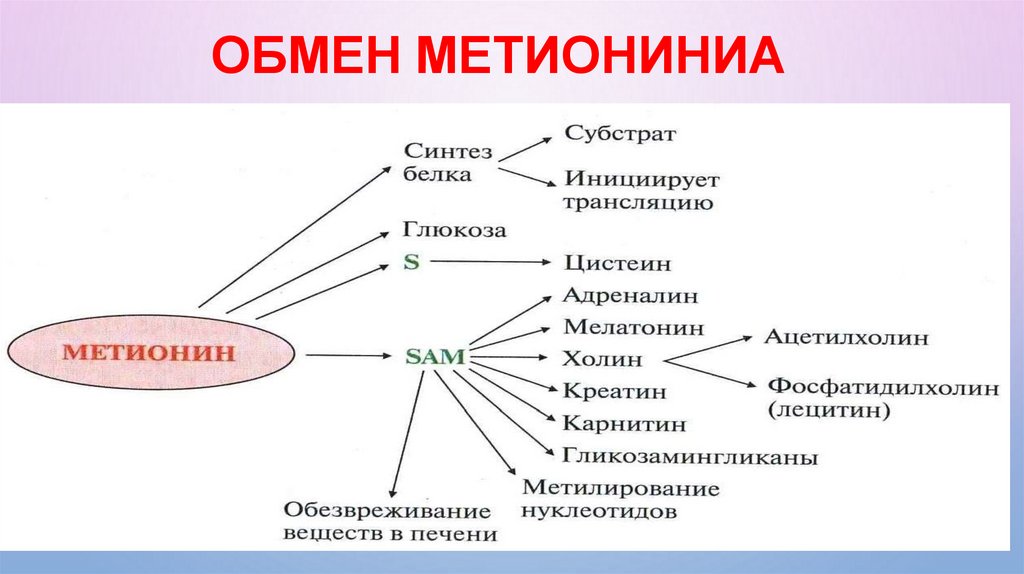
МЕТИОНИНМетионин – незаменимая,
остродефицитная аминокислота,
поступающая в организм
преимущественно в составе продуктов животного
происхождения. Особенно богаты метионином
сыры, мясо, рыба, из растительных продуктов
относительно высоко содержание
метионина в бобовых и гречке.
Метионин – единственная
аминокислота, в которой метильная
группа соединена с атомом серы, что в
значительной мере определяет процессы, в
которых эта аминокислота используется.
33.
ОБМЕН МЕТИОНИНИА34.
S-АДЕНОЗИЛМЕТИОНИН (SAМ)Метильная группа в радикале метионина, соединѐнная с атомом серы, значительно более
подвижна, чем в других аминокислотах (аланине, валине и т.д.), однако этой подвижности
недостаточно для реакций переноса метильной группы на другое вещество. Поэтому сначала
метионин активируется при участии АТФ и образуется активная форма – S-аденозилметионин,
включающийся в реакции трансметилирования.
35.
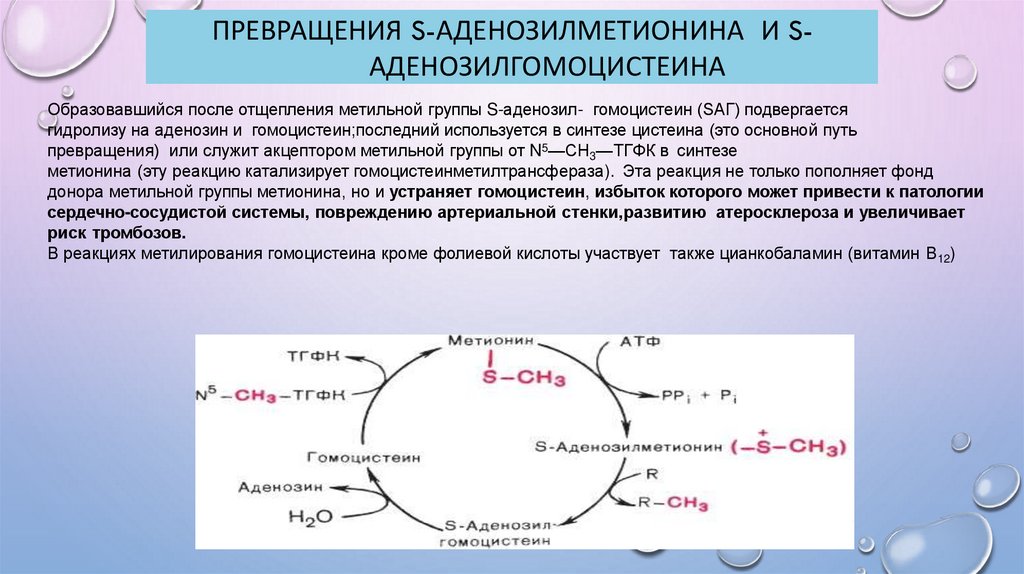
ПРЕВРАЩЕНИЯ S-АДЕНОЗИЛМЕТИОНИНА И SАДЕНОЗИЛГОМОЦИСТЕИНАОбразовавшийся после отщепления метильной группы S-аденозил- гомоцистеин (SАГ) подвергается
гидролизу на аденозин и гомоцистеин;последний используется в синтезе цистеина (это основной путь
превращения) или служит акцептором метильной группы от N5—СН3—ТГФК в синтезе
метионина (эту реакцию катализирует гомоцистеинметилтрансфераза). Эта реакция не только пополняет фонд
донора метильной группы метионина, но и устраняет гомоцистеин, избыток которого может привести к патологии
сердечно-сосудистой системы, повреждению артериальной стенки,развитию атеросклероза и увеличивает
риск тромбозов.
В реакциях метилирования гомоцистеина кроме фолиевой кислоты участвует также цианкобаламин (витамин В12)
36.
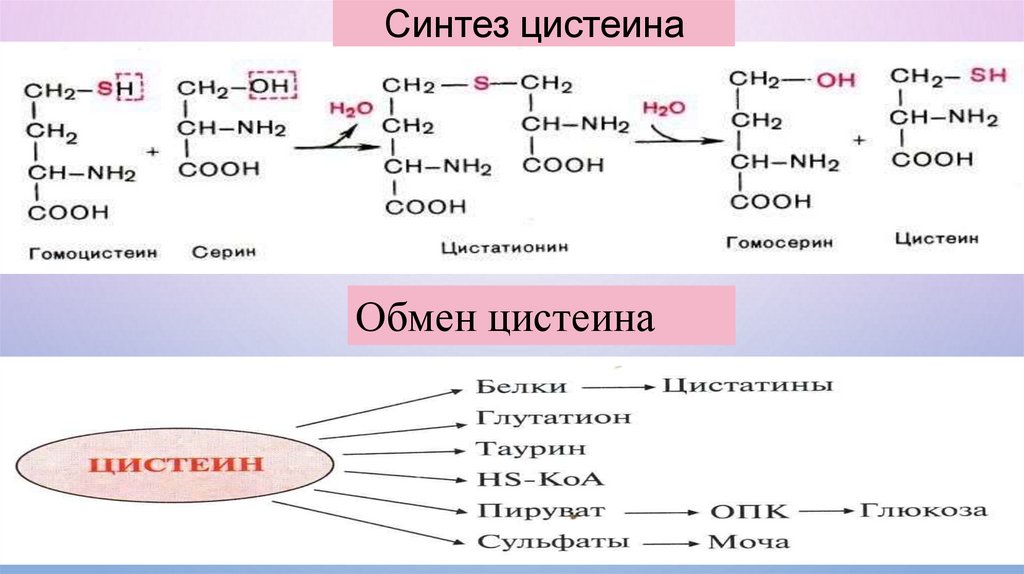
Синтез цистеинаОбмен цистеина
37.
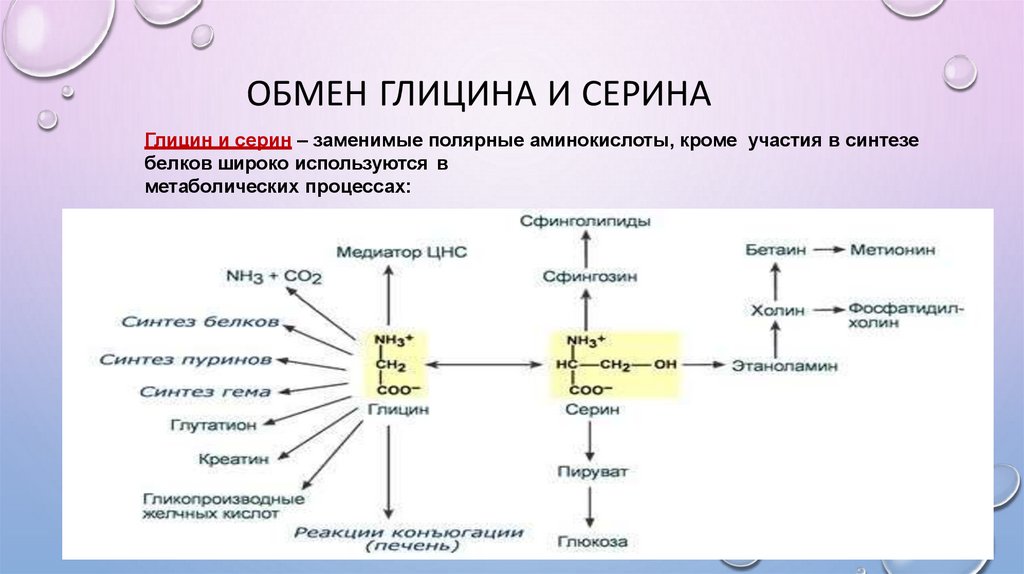
ОБМЕН ГЛИЦИНА И СЕРИНАГлицин и серин – заменимые полярные аминокислоты, кроме участия в синтезе
белков широко используются в
метаболических процессах:
38.
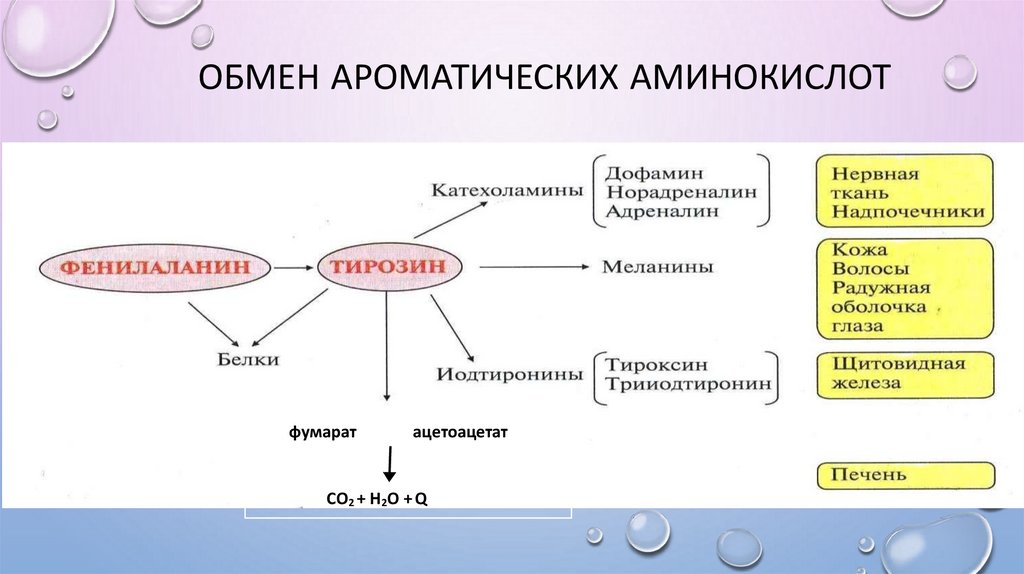
ОБМЕН АРОМАТИЧЕСКИХ АМИНОКИСЛОТфумарат
ацетоацетат
СО2 + Н2О + Q
39.
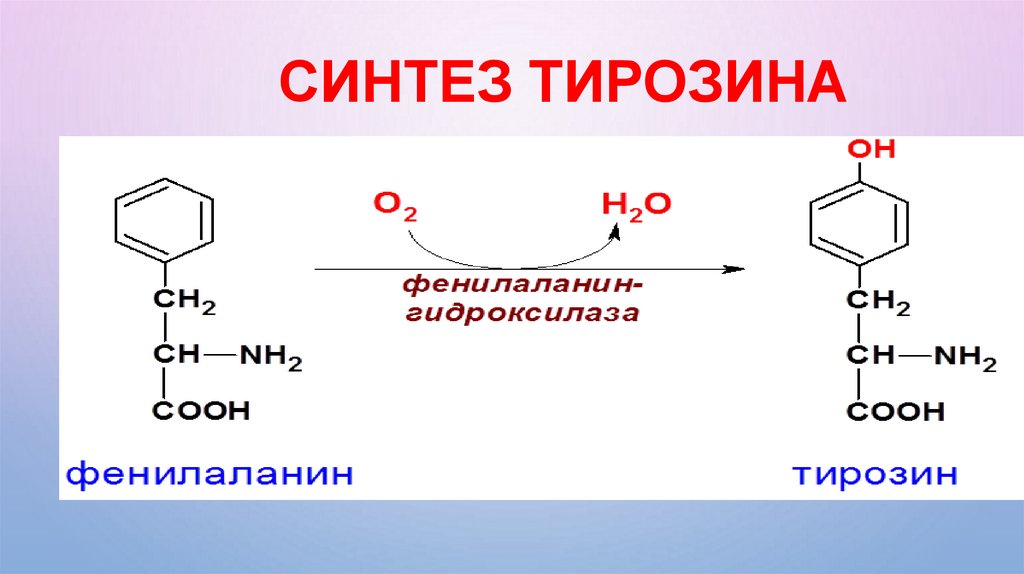
СИНТЕЗ ТИРОЗИНА40.
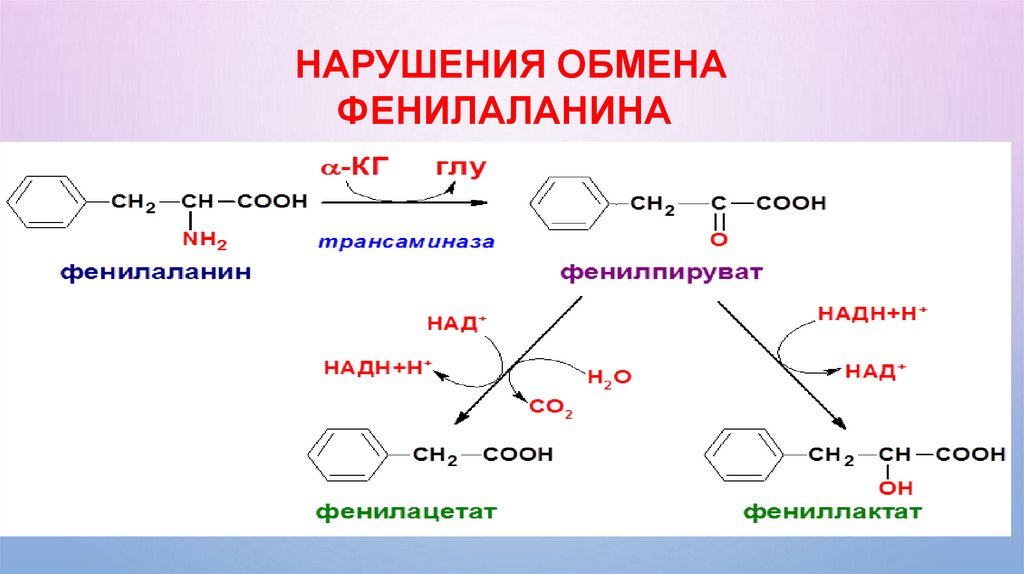
НАРУШЕНИЕ ОБМЕНА ФЕНИЛАЛАНИНАВ случае отсутствия фенилаланингидроксилазы (фенилаланин-4монооксигеназы) в организме накапливается сам фенилаланин и
продукты
альтернативных путей его превращения –
фенилпировиноградная кислота (фенилпируват),
фенилацетат и фениллактат, вызывающие нарушение развития мозга и
умственную отсталость. Это наследственное заболевание –
фенилкетонурия, или фенилпировиноградная олигофрения.
Заболевание наследуется по аутосомно-рецесивному типу. Частота 1
случай на 10000 новорожденных.
Диагностика – проведение скринг-тестов на 3-5 день у
всех новорожденных.
Лечение – диета с пониженным содержанием фенилаланина и
увеличенным – тирозина.
41.
НАРУШЕНИЯ ОБМЕНАФЕНИЛАЛАНИНА
42.
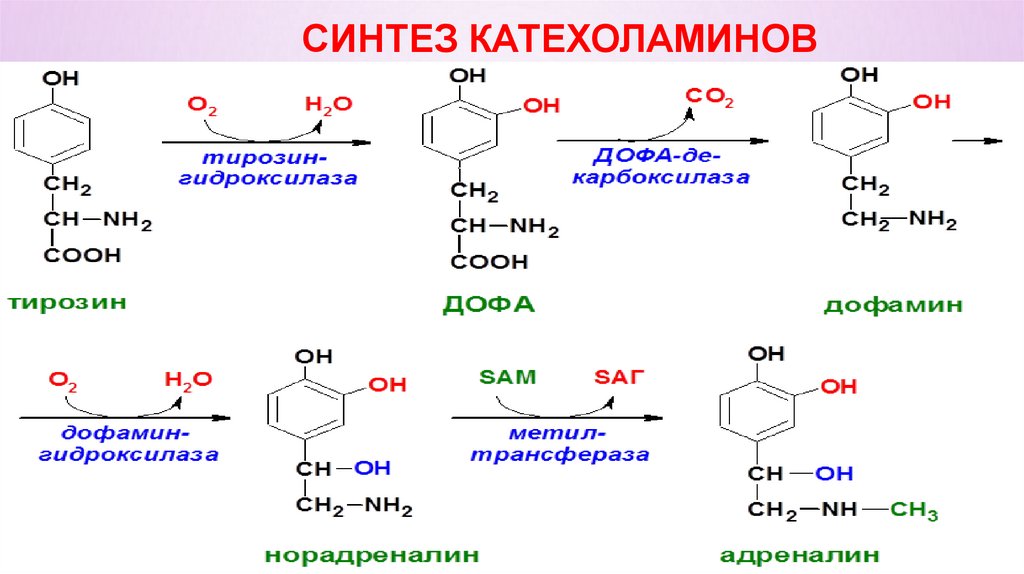
АРОМАТИЧЕСКИЕ АМИНОКИСЛОТЫФенилаланин – незаменимая аминокислота,
используется только в двух направлениях: или на синтез
белка, или на образование тирозина.
Тирозин – условнозаменимая аминокислота (заменимая в случае
достаточного количества фенилаланина и при наличии ферментов,
катализирующих превращение
фенилаланина в тирозин). Используется на синтезы:
белка,
катехоламинов,
йодтиронинов,
меланина.
Может окисляться с образованием конечных продуктов и
энергии.
43.
СИНТЕЗ КАТЕХОЛАМИНОВ44.
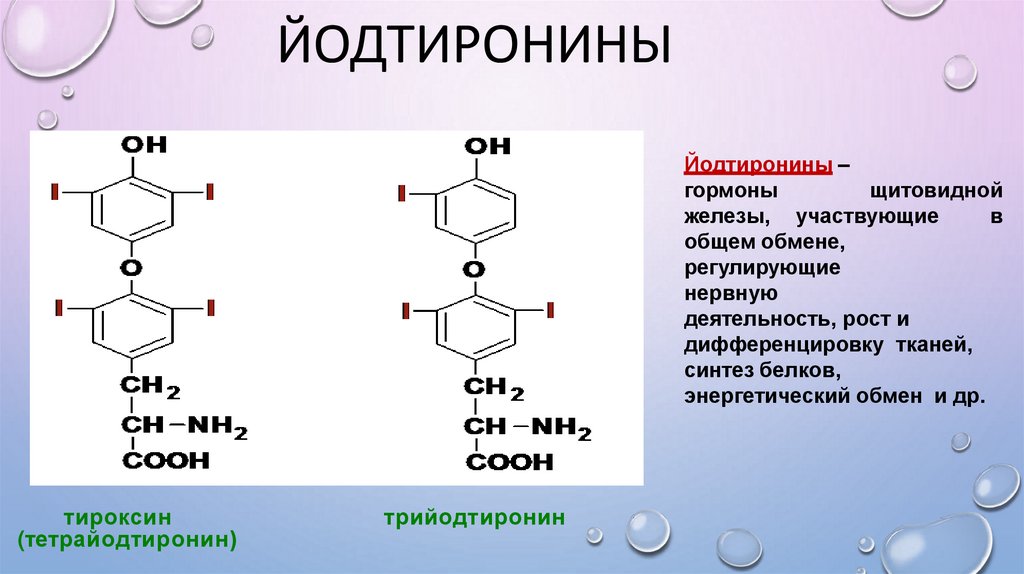
ЙОДТИРОНИНЫOH
I
OH
I
I
O
I
O
I
I
I
СН 2
СН 2
СН NH 2
СН NH 2
COOH
COOH
тироксин
(тетрайодтиронин)
трийодтиронин
Йодтиронины –
гормоны
щитовидной
железы, участвующие
в
общем обмене,
регулирующие
нервную
деятельность, рост и
дифференцировку тканей,
синтез белков,
энергетический обмен и др.
45.
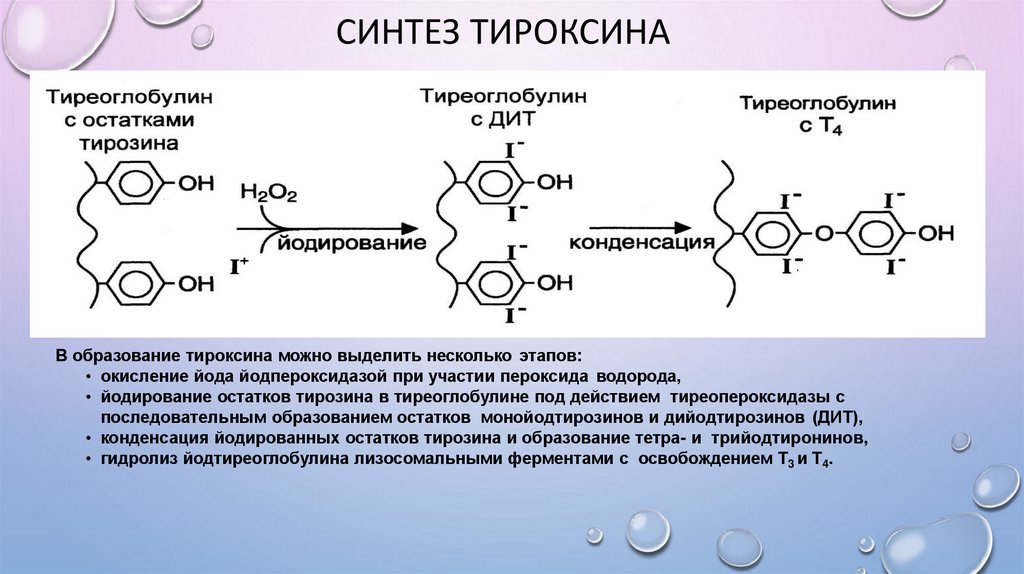
СИНТЕЗ ТИРОКСИНАВ образование тироксина можно выделить несколько этапов:
• окисление йода йодпероксидазой при участии пероксида водорода,
• йодирование остатков тирозина в тиреоглобулине под действием тиреопероксидазы с
последовательным образованием остатков монойодтирозинов и дийодтирозинов (ДИТ),
• конденсация йодированных остатков тирозина и образование тетра- и трийодтиронинов,
• гидролиз йодтиреоглобулина лизосомальными ферментами с освобождением Т3 и Т4.
46.
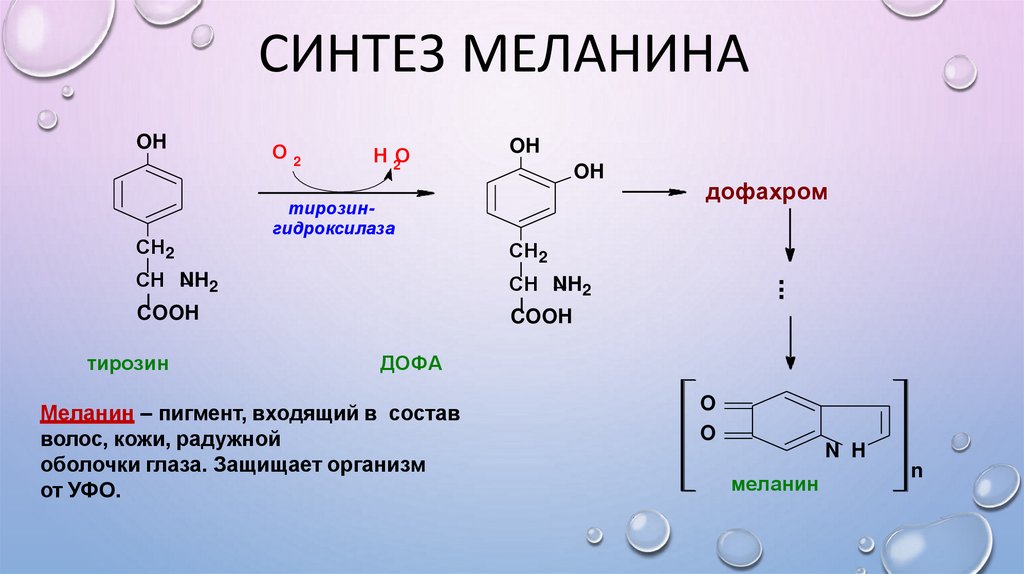
СИНТЕЗ МЕЛАНИНАСН2
О2
Н 2О
OH
OH
тирозингидроксилаза
СН2
СН NH2
СН NH2
COOH
COOH
тирозин
дофахром
...
OH
ДОФА
Меланин – пигмент, входящий в состав
волос, кожи, радужной
оболочки глаза. Защищает организм
от УФО.
O
O
N H
меланин
n
47.
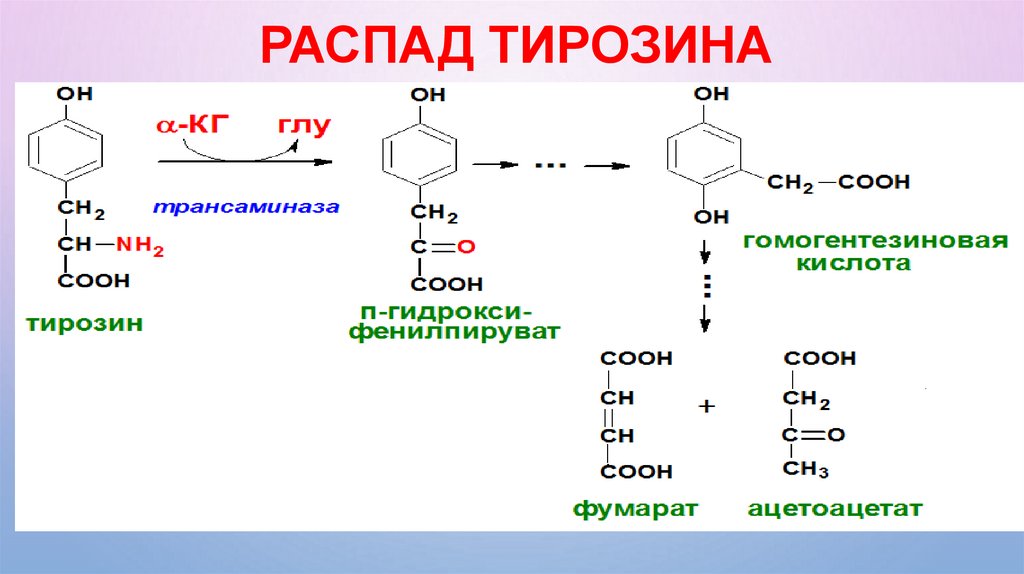
РАСПАД ТИРОЗИНА48.
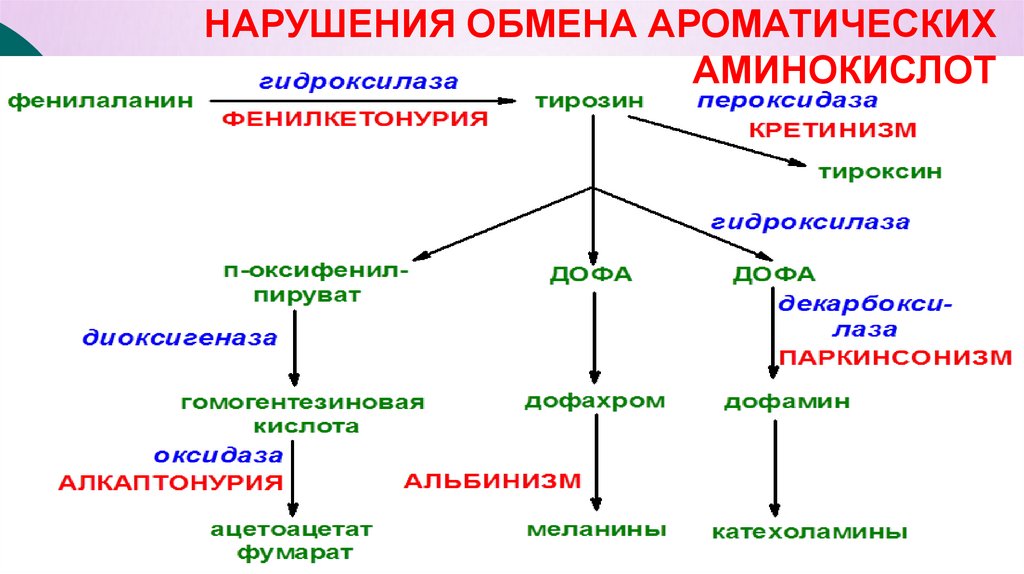
НАРУШЕНИЯ ОБМЕНА АРОМАТИЧЕСКИХАМИНОКИСЛОТ
фенилаланин
гидроксилаза
тирозин
ФЕНИЛКЕТОНУРИЯ
пероксидаза
КРЕТИНИЗМ
тироксин
гидроксилаза
п-оксифенилпируват
ДОФА
ДОФА
декарбоксилаза
диоксигеназа
ПАРКИНСОНИЗМ
гомогентезиновая
дофахром
дофамин кислота
оксидаза
АЛКАПТОНУРИЯ
ацетоацетат
АЛЬБИНИЗМ
меланины
катехоламины фумарат
49.
КРЕТИНИЗМКретинизм (от фр. crétin — идиот,
малоумный) — эндокринное заболевание,
вызываемое недостатком гормонов щитовидной
железы, характеризуется выраженным снижением
функции щитовидной
железы, задержкой физического и
умственного развития. Одна из форм
врождѐнного гипотиреоза. Одной из причин
кретинизма является недостаточная активность
фермента тирозинпероксидазы.
50.
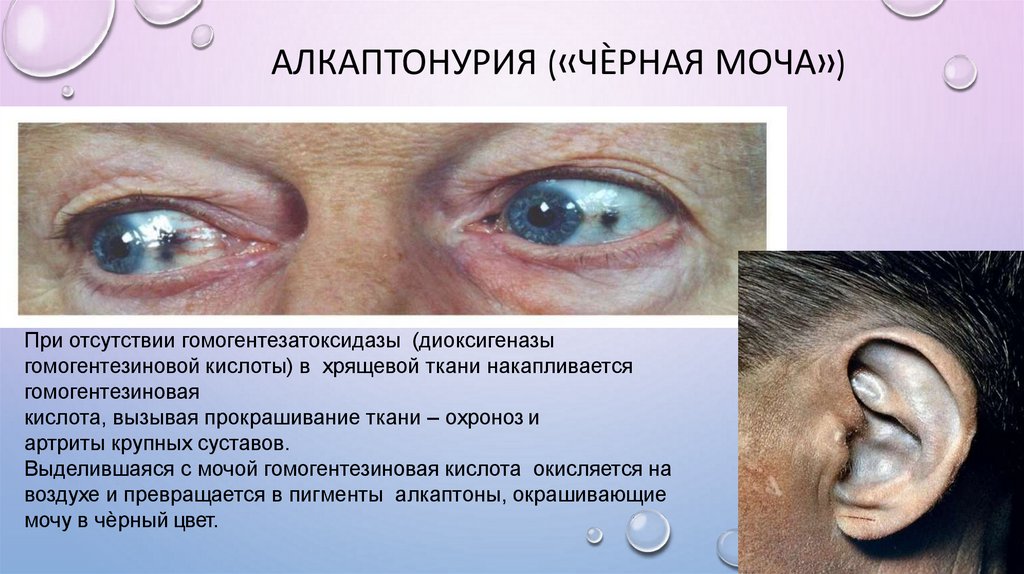
АЛКАПТОНУРИЯ («ЧЀРНАЯ МОЧА»)При отсутствии гомогентезатоксидазы (диоксигеназы
гомогентезиновой кислоты) в хрящевой ткани накапливается
гомогентезиновая
кислота, вызывая прокрашивание ткани – охроноз и
артриты крупных суставов.
Выделившаяся с мочой гомогентезиновая кислота окисляется на
воздухе и превращается в пигменты алкаптоны, окрашивающие
мочу в чѐрный цвет.
51.
АЛЬБИНИЗМ52.
БОЛЕЗНЬ ПАРКИНСОНАСнижение активности
ДОФАдекарбоксилазы приводит к развитию
болезни Паркинсона –
уменьшению синтеза нейромедиатора дофамина.
Заболевание сопровождается следующими основными
симптомами: акинезия (скованность движений),
ригидность (напряжение мышц), тремор
(непроизвольное дрожание).
Почерк при болезни
Паркинсона
Поза «манекена»,
характерная при
болезни Паркинсона
53.
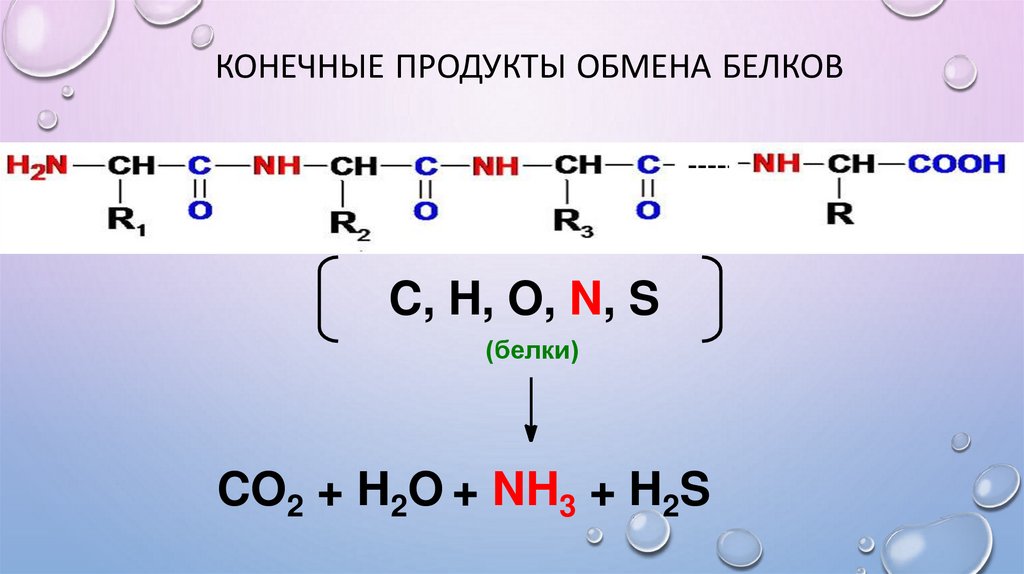
КОНЕЧНЫЕ ПРОДУКТЫ ОБМЕНА БЕЛКОВC, H, O, N, S
(белки)
CO2 + H2O + NH3 + H2S
54.
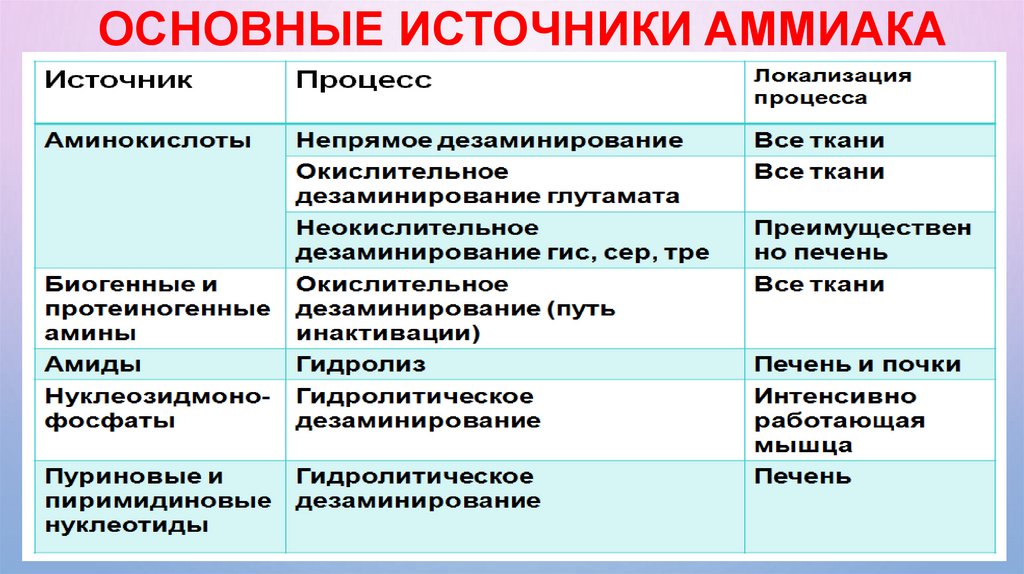
ОСНОВНЫЕ ИСТОЧНИКИ АММИАКА55.
ИСТОЧНИКИ АММИАКА И ПУТИ ЕГООБЕЗВРЕЖИВАНИЯ
• Аммиак образуется в результате реакций дезаминирования аминокислот, биогенных
аминов (гистамина, серотонина, катехоламинов и др.), Пуриновых и пиримидиновых
азотистых оснований, амидов аминокислот в тканях организма.
• Часть аммиака образуется в кишечнике в результате деятельности микрофлоры (гниение
белков) и всасывается в кровь воротной вены.
• Содержание аммиака в крови в норме 25-40 мкмоль/л.
56.
ПРИЧИНЫ ТОКСИЧНОСТИ АММИАКААммиак – токсичное соединение, особенно для центральной нервной системы. Это судорожный яд,
требующий постоянного обезвреживания.
Механизм токсического действия аммиака сводится к следующему:
• на обезвреживание аммиака расходуется α-кетоглутаровая кислота, это приводит к выключению ее
из цикла трикарбоновых кислот, блокаде ЦТК и развитию гипоэнергетического состояния
• повышенная концентрация аммиака в крови (гипераммониемия) приводит к нарушению кислотноосновного состояния, развивается алкалоз
•нарушается синтез медиаторов, нарушается проведение нервных импульсов, страдает нервная
система
•изменяется концентрация в крови катионов натрия и калия, нарушается электролитный баланс.
Поскольку аммиак очень токсичен, его необходимо повсеместно обезвреживать с образованием
транспортных форм (глутамата, глутамина, амидированных карбоксильных групп белков плазмы
крови), которые затем направляются в печень или в почки, где осуществляется окончательное
обезвреживание аммиака с образованием менее токсичных форм его выведения в виде мочевины,
аммонийных солей.
57.
ТОКСИЧНЫЙ АММИАК В КЛЕТКАХОБЕЗВРЕЖИВАЕТСЯ СЛЕДУЮЩИМ ОБРАЗОМ:
• Используется на восстановительное аминирование (имеет небольшое значение);
• Используется на образование амидов (аспарагина и глутамина), которые поступают в
кровь и переносятся в печень и почки, где под действием глутаминазы и аспарагиназы
соответственно расщепляются до глутамата или аспартата и аммиака. В печени
аммиак используется на образование карбамоилфосфата, из почек аммиак выводится в
виде аммонийных солей с мочой.
• В мышцах аммиак используется на образование аланина, который выводится в кровь и
переносится в печень, где после переаминирования превращается в пируват,
используемый в глюконеогенезе для синтеза глюкозы. Образовавшаяся глюкоза
поступает в кровь и переносится в мышцы, где превращается в пируват в ходе
гликолиза. Обмен метаболитами (аланином и глюкозой) между печенью и мышцей
называется глюкозо-аланиновым циклом.
58.
59.
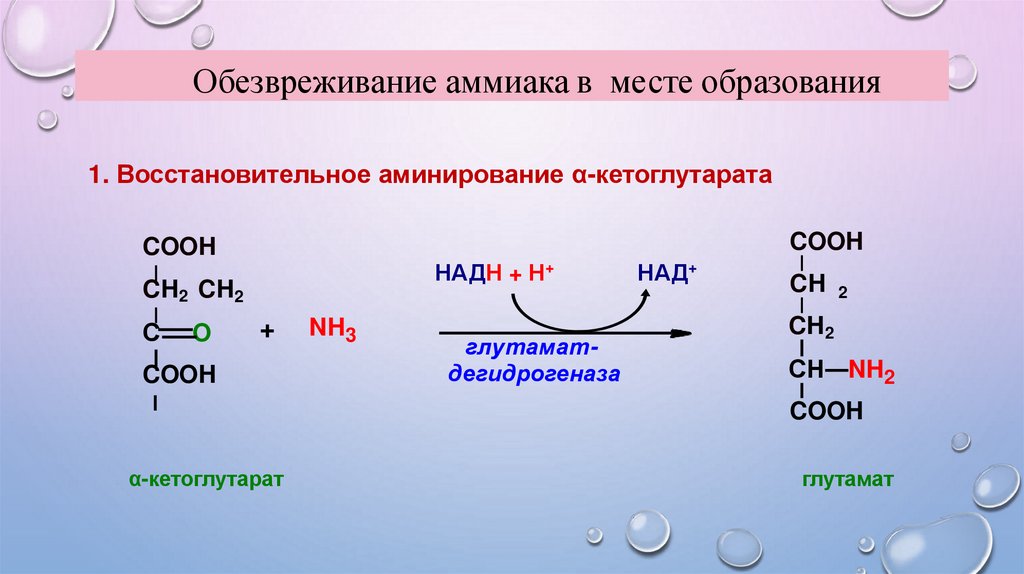
Обезвреживание аммиака в месте образования1. Восстановительное аминирование α-кетоглутарата
COOH
COOH
НАДН + Н+
CH2 CH2
С
O
+
COOH
α-кетоглутарат
NH3
глутаматдегидрогеназа
НАД+
CH 2
CH2
СН NH2
COOH
глутамат
60.
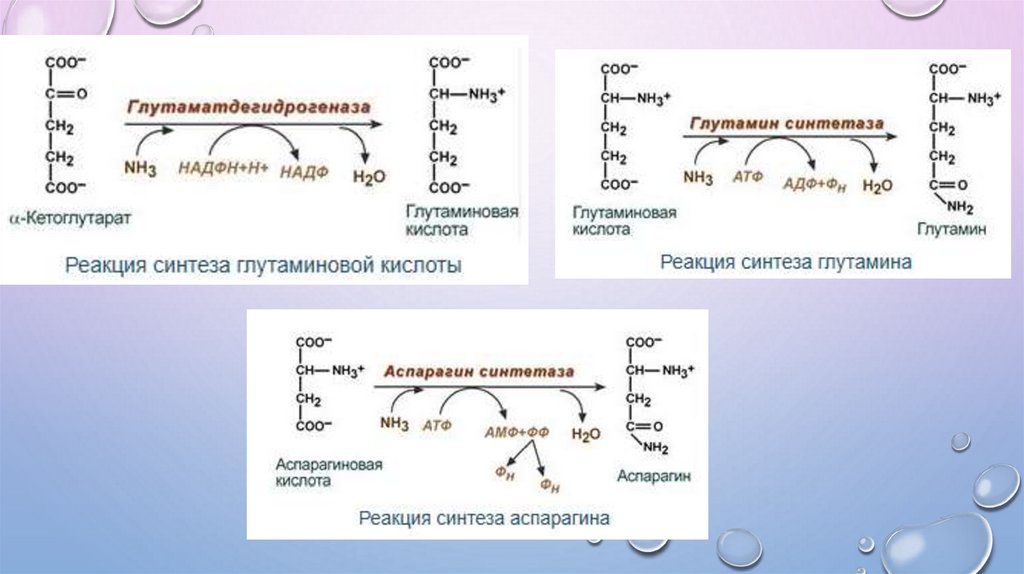
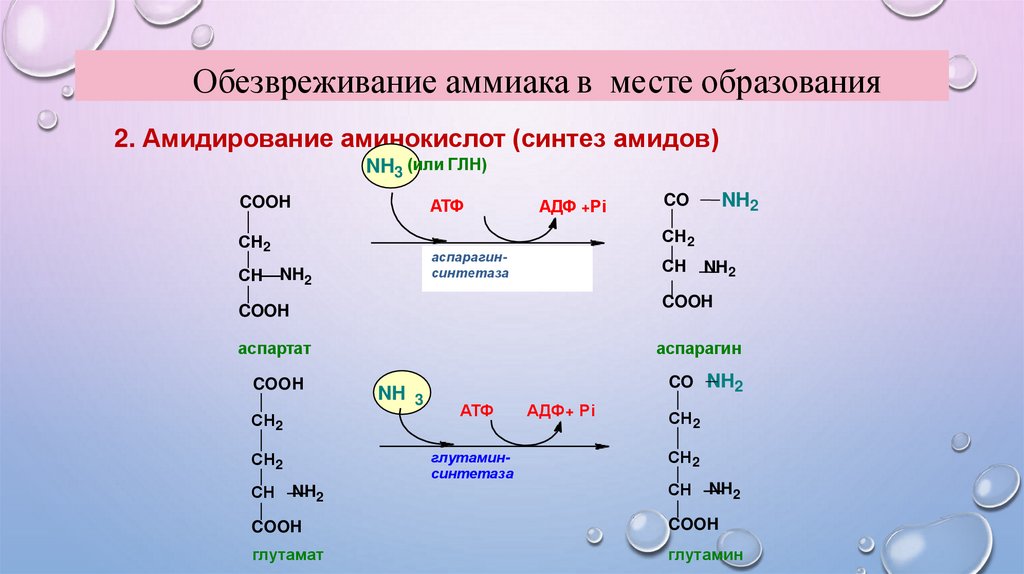
Обезвреживание аммиака в месте образования2. Амидирование аминокислот (синтез амидов)
NH3 (или ГЛН)
COOH
АТФ
СН2
АДФ +Рi
СН2
глутаминаспарагинсинтетаза
синтетаза
СН NH2
СН NH2
COOH
COOH
аспартат
COOH
СН2
аспарагин
NH 3
CO NH2
АТФ
глутаминсинтетаза
СН2
СН
NH2
CO
NH2
АДФ+ Рi
СН2
СН2
СН
NH2
COOH
COOH
глутамат
глутамин
61.
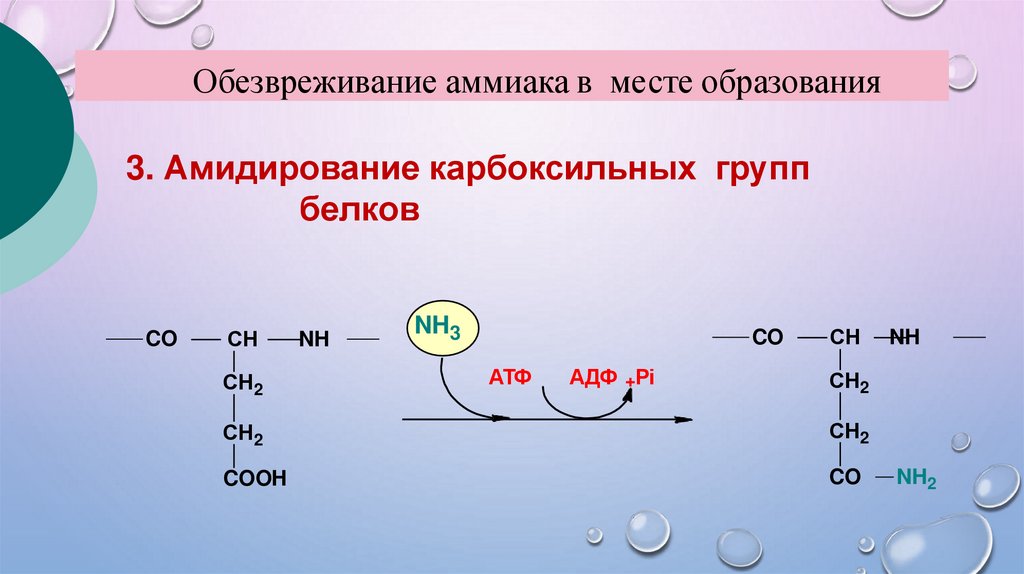
Обезвреживание аммиака в месте образования3. Амидирование карбоксильных групп
белков
CO
СН
СН2
NH
NH3
CO
АТФ
АДФ +Рi
СН
NH
СН2
СН2
СН2
COOH
CO
NH2
62.
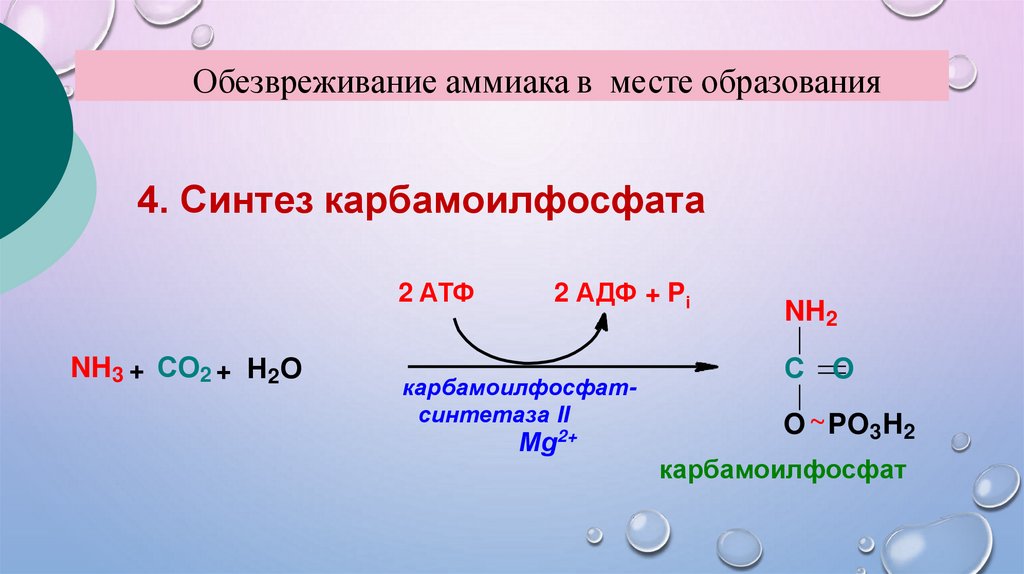
Обезвреживание аммиака в месте образования4. Синтез карбамоилфосфата
2 АТФ
NH3 + СО2 + Н2О
2 АДФ + Pi
карбамоилфосфатсинтетаза II
Мg
2+
NH2
С O
O ~PO3H2
карбамоилфосфат
63.
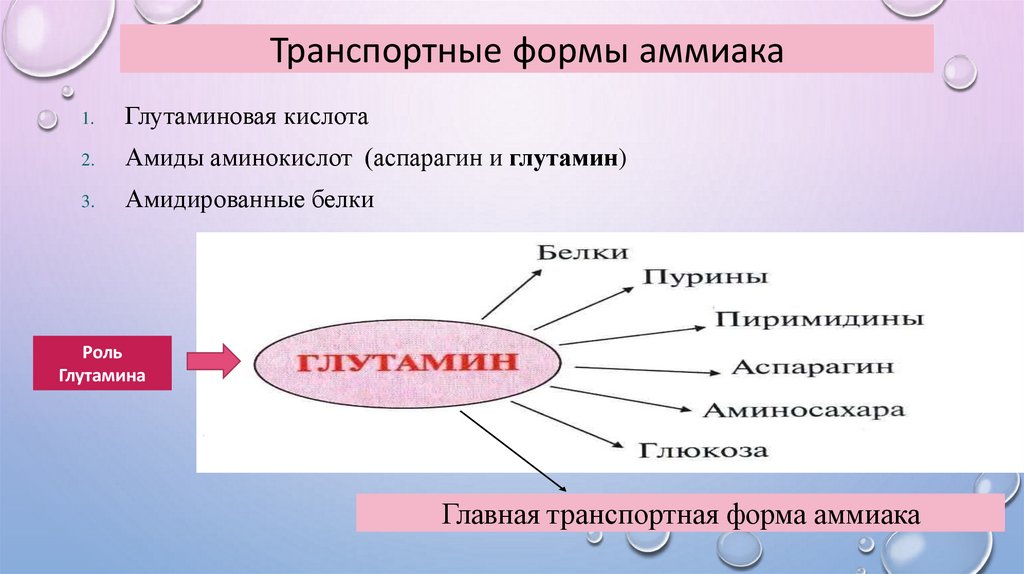
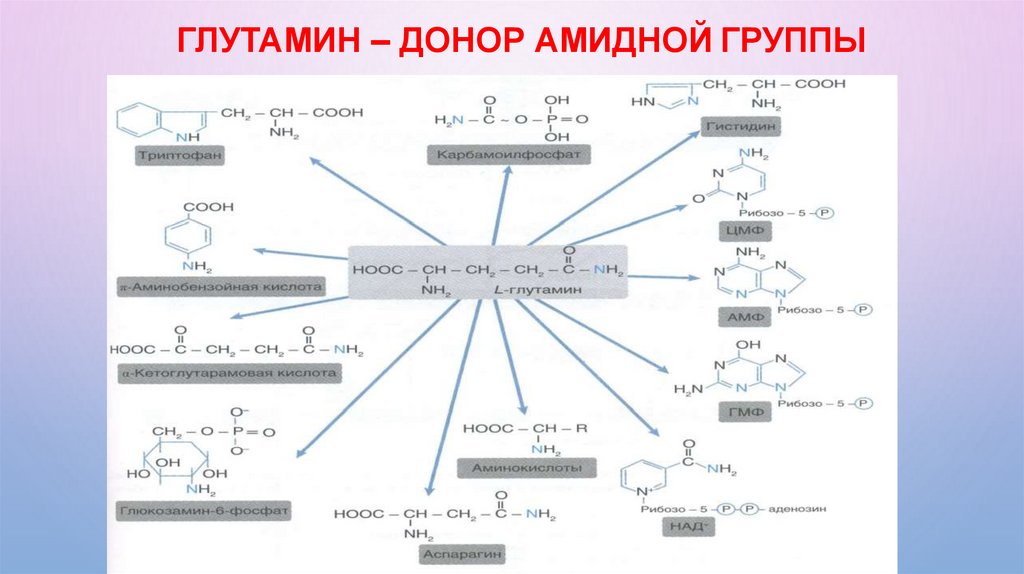
Транспортные формы аммиака1.
Глутаминовая кислота
2.
Амиды аминокислот (аспарагин и глутамин)
3.
Амидированные белки
Роль
Глутамина
Главная транспортная форма аммиака
64.
ГЛУТАМИН – ДОНОР АМИДНОЙ ГРУППЫ65.
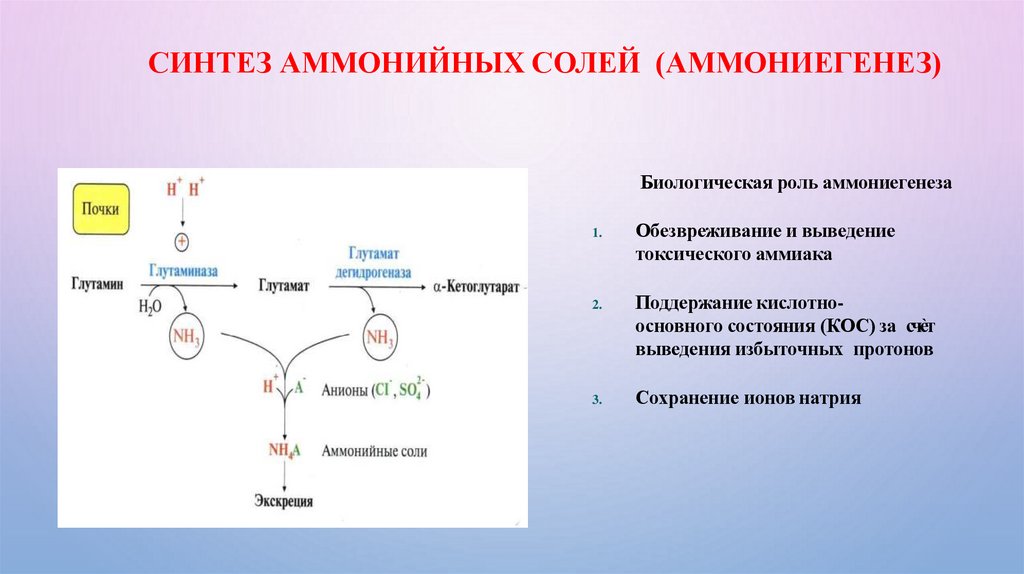
СИНТЕЗ АММОНИЙНЫХ СОЛЕЙ (АММОНИЕГЕНЕЗ)Биологическая роль аммониегенеза
1.
2.
3.
Обезвреживание и выведение
токсического аммиака
Поддержание кислотноосновного состояния (КОС) за счѐт
выведения избыточных протонов
Сохранение ионов натрия
66.
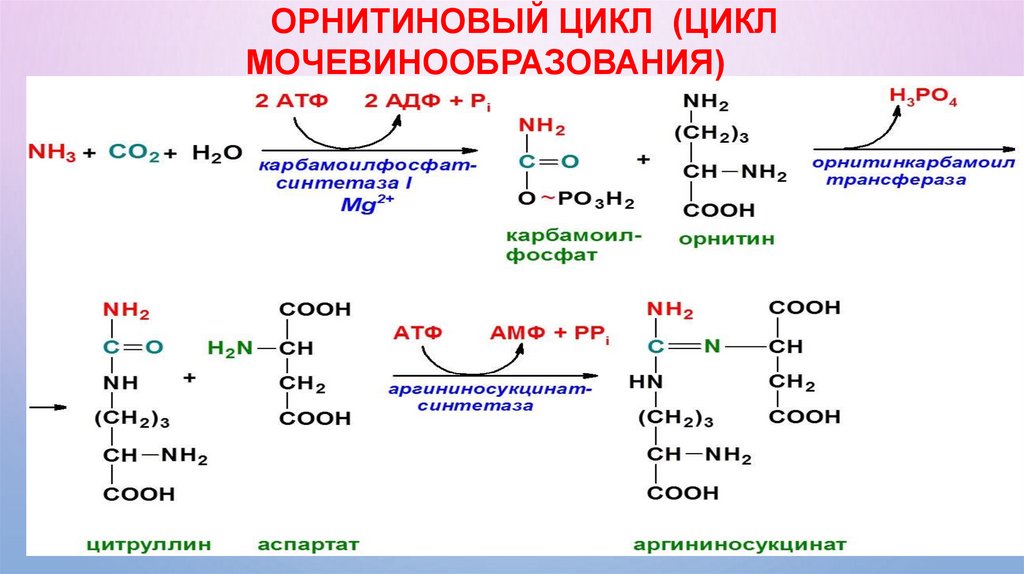
СИНТЕЗ МОЧЕВИНЫ (ОРНИТИНОВЫЙ ЦИКЛ)• Синтез мочевины протекает в гепатоцитах печени,
• Является процессом циклическим.
• Для синтеза одной молекулы мочевины требуется:
- 3 молекулы АТФ,
- 1 молекула аммиака,
- 1 молекула аспартата,
- 1 молекула СО2,
- 1 молекула орнитина.
67.
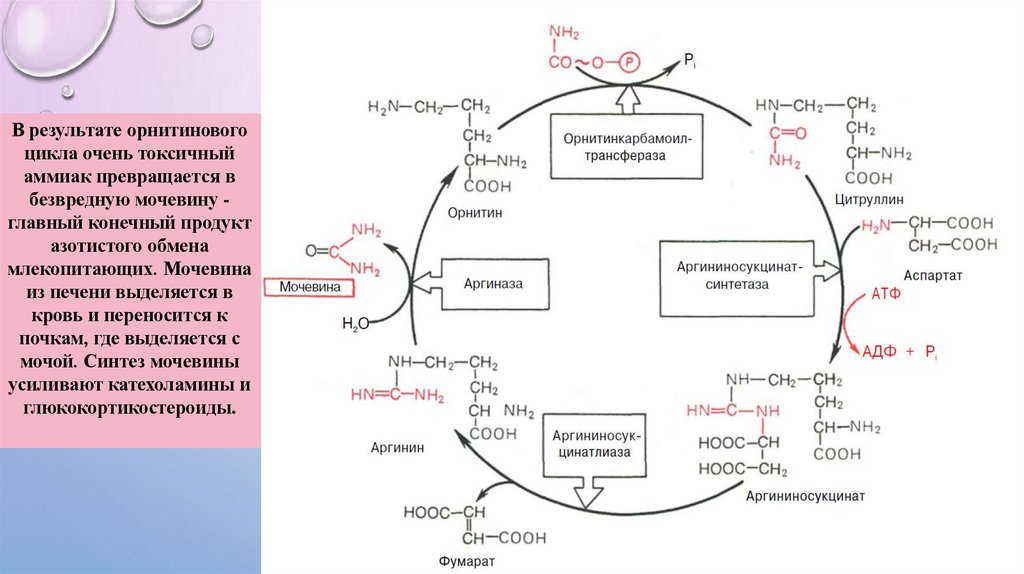
ОРНИТИНОВЫЙ ЦИКЛ (ЦИКЛМОЧЕВИНООБРАЗОВАНИЯ)
68.
69.
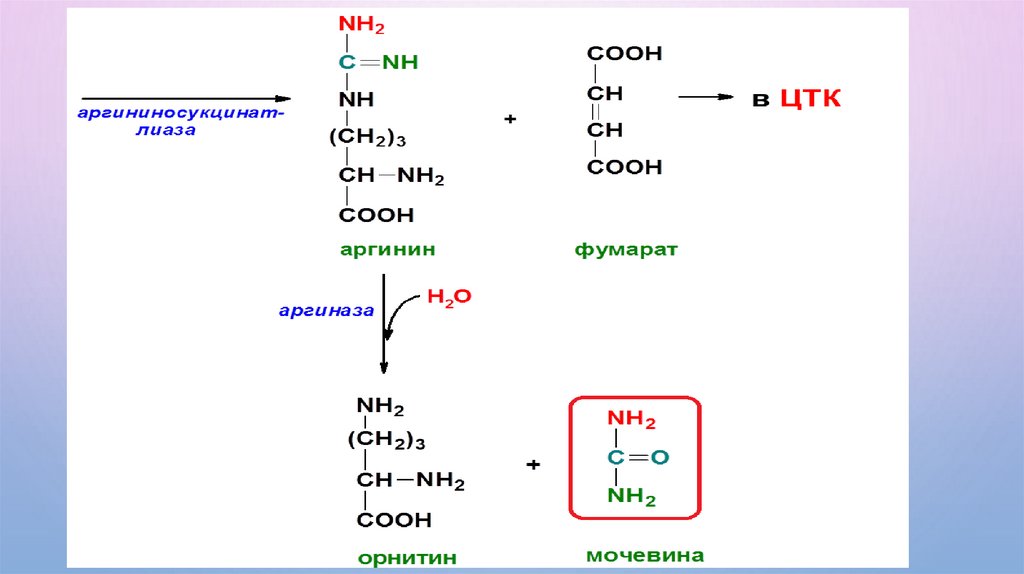
В результате орнитиновогоцикла очень токсичный
аммиак превращается в
безвредную мочевину главный конечный продукт
азотистого обмена
млекопитающих. Мочевина
из печени выделяется в
кровь и переносится к
почкам, где выделяется с
мочой. Синтез мочевины
усиливают катехоламины и
глюкокортикостероиды.
70.
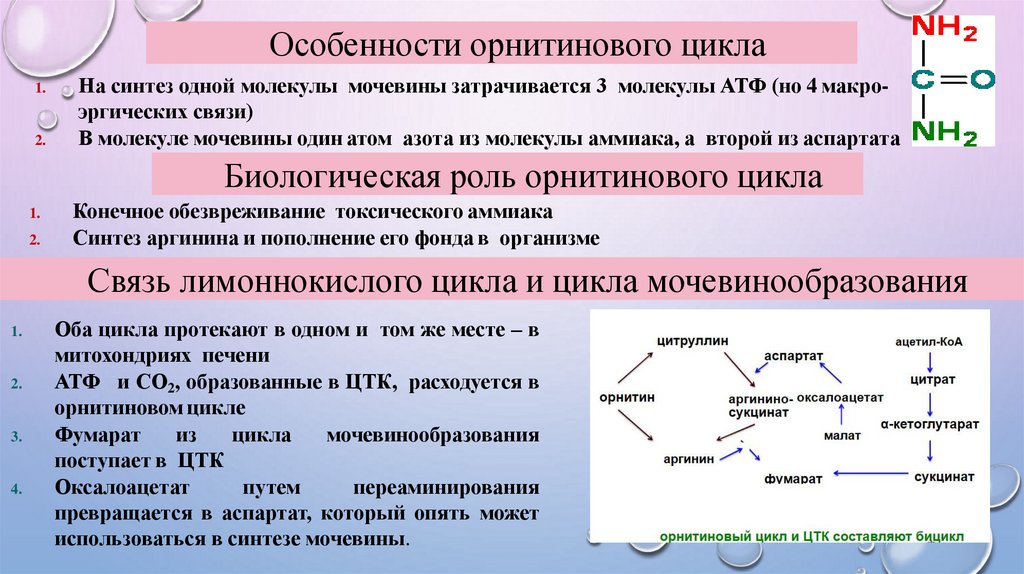
Особенности орнитинового цикла1.
2.
На синтез одной молекулы мочевины затрачивается 3 молекулы АТФ (но 4 макроэргических связи)
В молекуле мочевины один атом азота из молекулы аммиака, а второй из аспартата
Биологическая роль орнитинового цикла
1.
2.
Конечное обезвреживание токсического аммиака
Синтез аргинина и пополнение его фонда в организме
Связь лимоннокислого цикла и цикла мочевинообразования
1.
2.
3.
4.
Оба цикла протекают в одном и том же месте – в
митохондриях печени
АТФ и СО2, образованные в ЦТК, расходуется в
орнитиновом цикле
Фумарат
из
цикла
мочевинообразования
поступает в ЦТК
Оксалоацетат
путем
переаминирования
превращается в аспартат, который опять может
использоваться в синтезе мочевины.
71.
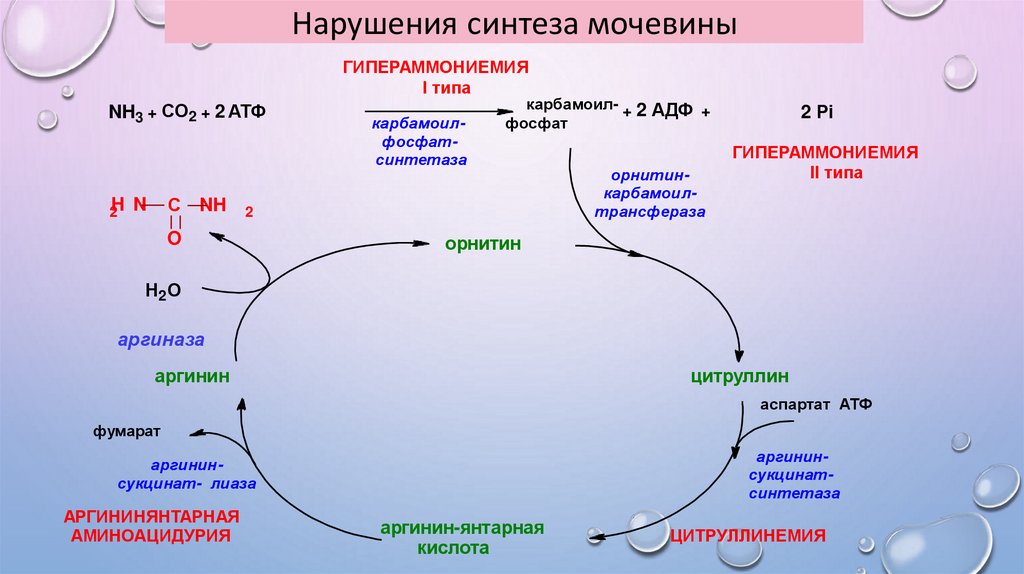
Нарушения синтеза мочевиныГИПЕРАММОНИЕМИЯ
I типа
NH3 + СО2 + 2 АТФ
С NH
2H N
карбамоилфосфатсинтетаза
карбамоил- + 2 АДФ +
фосфат
2
O
орнитинкарбамоилтрансфераза
2 Рi
ГИПЕРАММОНИЕМИЯ
II типа
орнитин
Н2 О
аргиназа
цитруллин
аргинин
аспартат АТФ
фумарат
аргининсукцинатсинтетаза
аргининсукцинат- лиаза
АРГИНИНЯНТАРНАЯ
АМИНОАЦИДУРИЯ
аргинин-янтарная
кислота
ЦИТРУЛЛИНЕМИЯ
72.
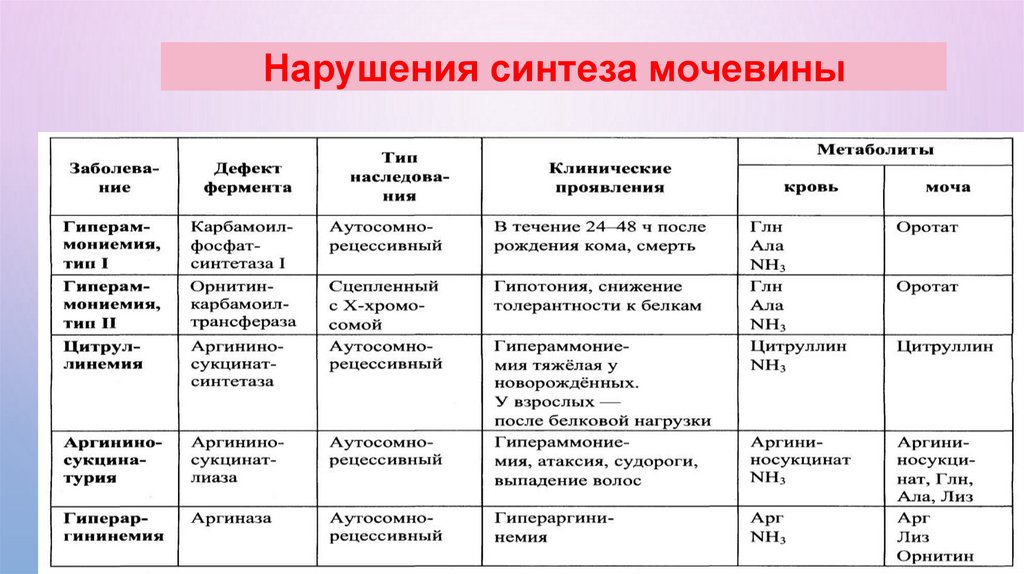
Нарушения синтеза мочевины73.
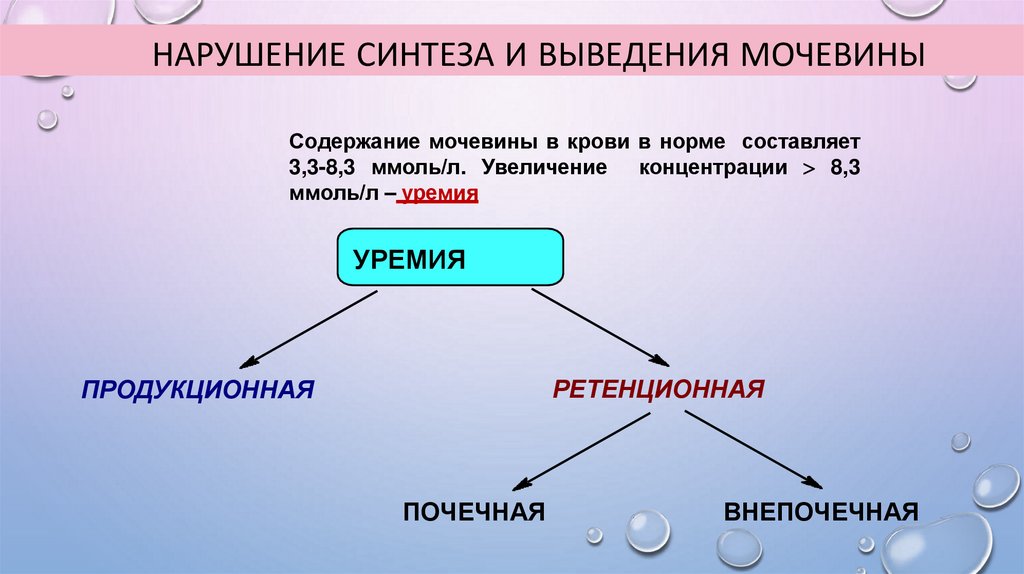
НАРУШЕНИЕ СИНТЕЗА И ВЫВЕДЕНИЯ МОЧЕВИНЫСодержание мочевины в крови в норме составляет
3,3-8,3 ммоль/л. Увеличение концентрации 8,3
ммоль/л – уремия
УРЕМИЯ
РЕТЕНЦИОННАЯ
ПРОДУКЦИОННАЯ
ПОЧЕЧНАЯ
ВНЕПОЧЕЧНАЯ
74.
ТИПЫ УРЕМИЙПродукционная - сверхобразование мочевины из-за повышенного катаболизма белков организма
(при ожогах, туберкулѐзах, некрозах и т.д.) или избытка белков в пище.
Ретенционная - нарушение выведения мочевины при нормальном еевыделении печенью в кровь
(т.е. ретенция – удержание в организме).
Может быть почечной (нарушение фильтрующей способности почек, острая почечная
недостаточность, хронический гломерулонефрит, нефросклероз, врожденные аномалии почек) и
внепочечной (экстраренальной), которую в свою очередь можно разделить на надпочечную и
подпочечную. Надпочечная ретенционная уремия развивается при нарушениях общей (или только
почечной) гемодинамики, когда уменьшается кровоснабжение почки (почек) из-за поражения
сосудов, например, вследствие сужения почечных артерий атеросклеротическими бляшками,
фибромускулярного стеноза и других причин. Такой тип уремии может развиться вследствие
тяжелой формы сердечно-сосудистой недостаточности, сопровождаемой нарушениями
кровообращения.
Подпочечная уремия – следствие нарушение выведения мочи из-за камней, опухолей, сдавлений
мочевого пузыря и мочеточников.
75.
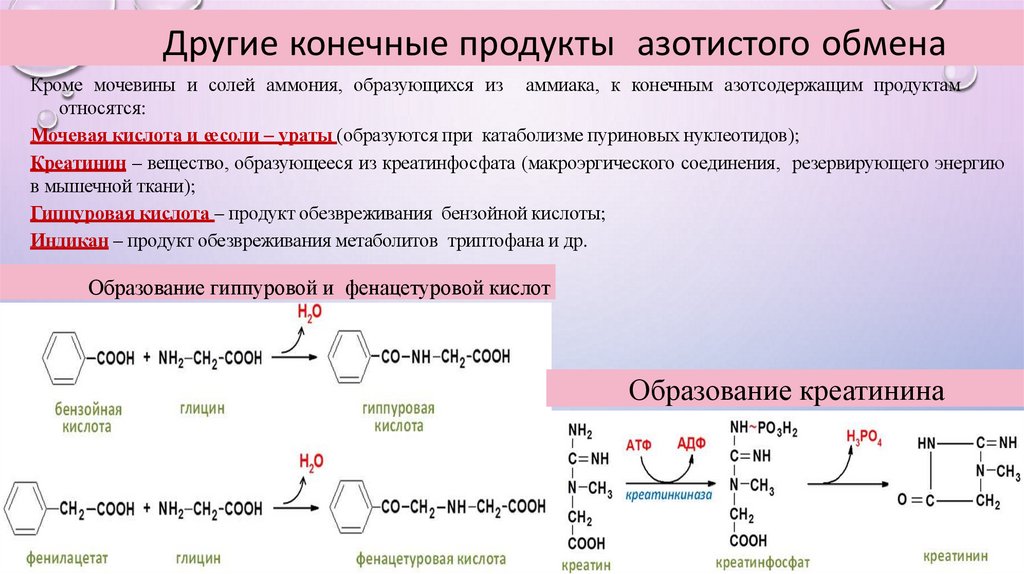
Другие конечные продукты азотистого обменаКроме мочевины и солей аммония, образующихся из аммиака, к конечным азотсодержащим продуктам
относятся:
Мочевая кислота и еесоли – ураты (образуются при катаболизме пуриновых нуклеотидов);
Креатинин – вещество, образующееся из креатинфосфата (макроэргического соединения, резервирующего энергию
в мышечной ткани);
Гиппуровая кислота – продукт обезвреживания бензойной кислоты;
Индикан – продукт обезвреживания метаболитов триптофана и др.
Образование гиппуровой и фенацетуровой кислот
Образование креатинина
76.
СООТНОШЕНИЕ АЗОТСОДЕРЖАЩИХ ВЕЩЕСТВ ВМОЧЕ (%) ПРИ НОРМАЛЬНОМ БЕЛКОВОМ ПИТАНИИ
77.
Вопросы к лекции для письменного ответа1.
Охарактеризуйте основные пути катаболизма аминокислот, дайте определение каждому из трех и приведите
уравнение реакции.
2.
Какой тип дезаминирования является основным путем катаболизма аминокислот?
3.
Укажите трансаминазы, которые имеют диагностическое значение. При каких заболеваниях отслеживают их
активность? Укажите референсные значения и отклонения при той или иной патологии.
4.
Какие вещества образуются в результате реакций декарбоксилирования аминокислот. Что такое «гниение
аминокислот», когда происходит, с чем связано, как проявляется?
5.
Что такое S-аденозилметионин, из чего он образуется? Из чего образуется гомоцистеин, в чем его опасность?
6.
Как клинически проявляются нарушения обмена ароматических кислот?
7.
В чем заключается токсичность аммиака для организма человека? Укажите основную транспортную форму аммиака.
8.
Сколько реакций включает Орнитиновый цикл? Этот процесс идет с выделением или с поглощением энергии? В
каком органе он происходит? В чем выражается взаимосвязь Орнитинового цикла и Лимоннокислого цикла?
9.
Что такое уремия? Какие виды уремий вы знаете?
10. Укажите конечные продукты азотистого обмена































 Биология
Биология








