Похожие презентации:
Правила взятия биоматериала и лабораторные требования
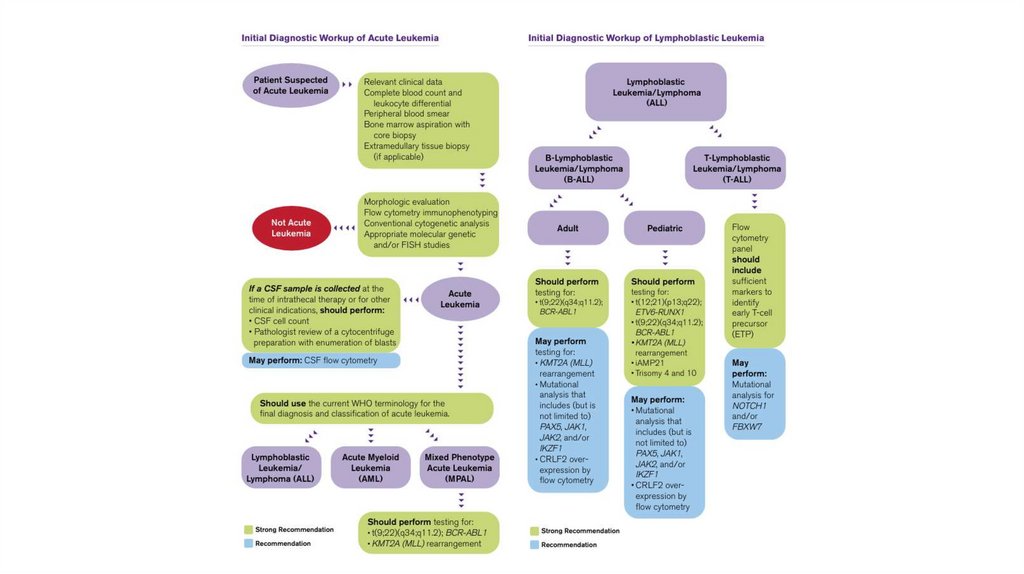
1.
Правила взятия биоматериала илабораторные требования
2.
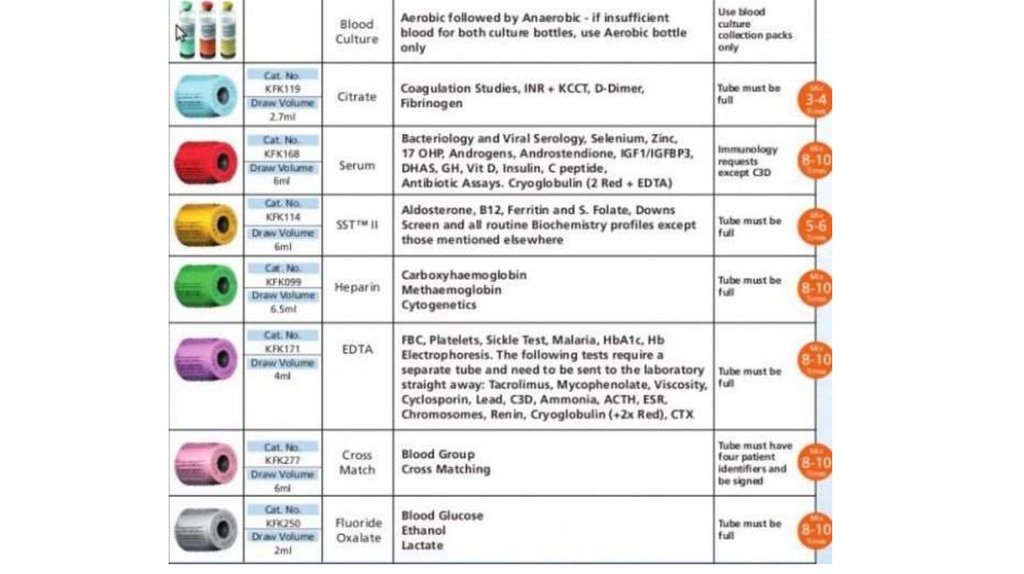
Правила взятия биоматериалаДля проточной цитометрии и молекулярногенетического
анализа
биоматериал
(периферическая кровь, костный мозг)
помещают в пробирки с фиолетовыми
крышками.
Для
проведения
традиционного
цитогенетического
и
молекулярноцитогенетического (FISH) анализа биоматериал
(костный мозг, периферическая кровь) помещают
в пробирки с зелеными крышками.
Аккуратно перемешайте содержимое пробирок, чтобы не
образовались сгустки.
3.
Когда можно брать биоматериалы дляпроточной цитометрии, молекулярной генетики
(ПЦР), удобной цитогенетики и молекулярноцитогенетических (FISH) анализов:
желательно перед любым лечением;
минимум через 2 недели после химиотерапии
(после восстановления КМ: WBC>1.0*109/ Neut
>0.5*109).
4.
Правила соблюдения сдачи анализов при первичном иповторном обследовании (МОБ)
Указывать тип лейкоза. PS. У ОЛЛ также бывают подтипы.
В направлении обязательно необходимо указать
результаты общего анализа крови.
При повторном анализе необходимо указать результаты
предыдущего соответствующего анализа.
5.
6.
7.
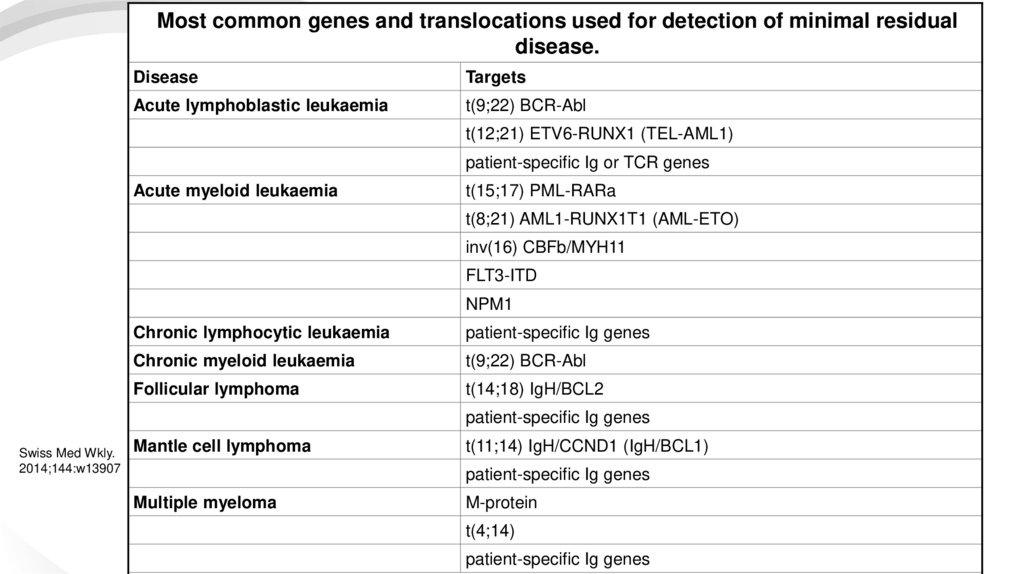
Most common genes and translocations used for detection of minimal residualdisease.
Disease
Targets
Acute lymphoblastic leukaemia
t(9;22) BCR-Abl
t(12;21) ETV6-RUNX1 (TEL-AML1)
patient-specific Ig or TCR genes
Acute myeloid leukaemia
t(15;17) PML-RARa
t(8;21) AML1-RUNX1T1 (AML-ETO)
inv(16) CBFb/MYH11
FLT3-ITD
NPM1
Chronic lymphocytic leukaemia
patient-specific Ig genes
Chronic myeloid leukaemia
t(9;22) BCR-Abl
Follicular lymphoma
t(14;18) IgH/BCL2
patient-specific Ig genes
Swiss Med Wkly.
2014;144:w13907
Mantle cell lymphoma
t(11;14) IgH/CCND1 (IgH/BCL1)
patient-specific Ig genes
Multiple myeloma
M-protein
t(4;14)
patient-specific Ig genes
8.
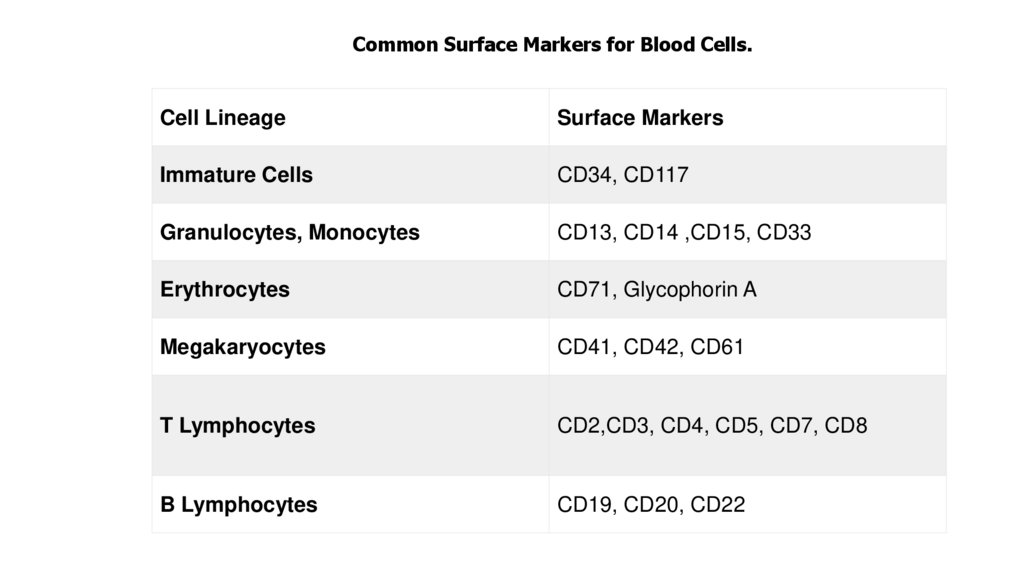
Common Surface Markers for Blood Cells.Cell Lineage
Surface Markers
Immature Cells
CD34, CD117
Granulocytes, Monocytes
CD13, CD14 ,CD15, CD33
Erythrocytes
CD71, Glycophorin A
Megakaryocytes
CD41, CD42, CD61
T Lymphocytes
CD2,CD3, CD4, CD5, CD7, CD8
B Lymphocytes
CD19, CD20, CD22
9.
Спасибо за внимание!10.
11.
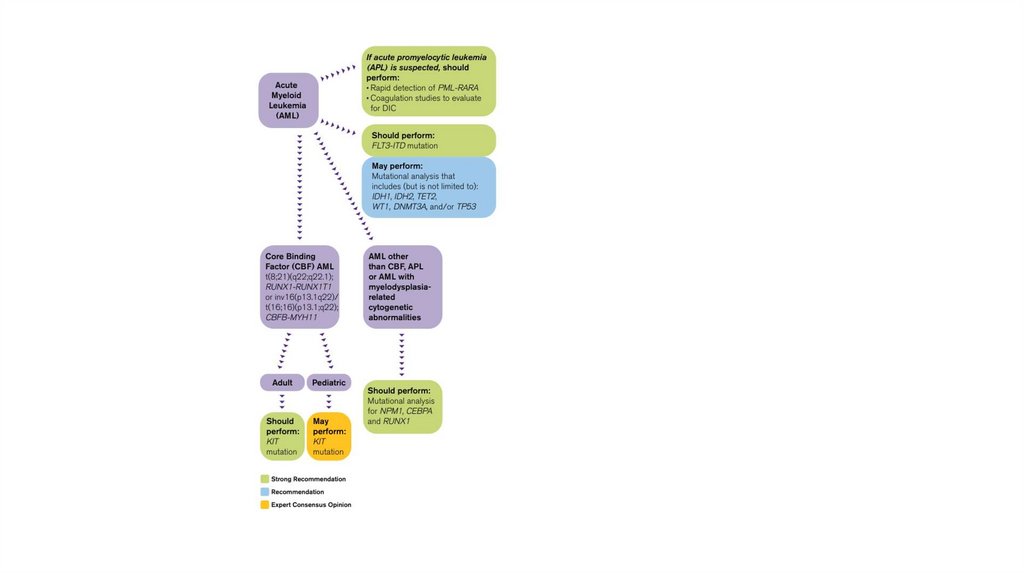
Interestingly, specific immunophenotypic profiles have been associated withprognosis and/or unique cytogenetic and molecular abnormalities (42-45).
Expression profiling found the gene for CD44 to be one of the best, correlating
with the MLL genotype and with the subgroup of T-ALL patients, who later
developed hematological relapse (45). In addition, dual CD27posCD44pos blasts
are typically seen in BCR/ABLpos ALL and a subset of TEL/AML1pos patients
exists with CD44posCD27pos blasts (45). In 74 cases with B-ALL children,
including 21 cases with chromosomal translocations, t(12;21)pos and 53 cases
with chromosomal translocation, t(12;21)neg. The t(12;21)pos ALLs displayed a
higher intensity of CD10 and HLADR expression together with lower levels of
the CD20, CD45, CD135 and CD34 antigens as compared to the t(12;21)neg cases
(42). This immunophenotypic approach used for the identification of
t(12;21)pos cases can be achieved with a sensitivity of 86% and a specificity of
100% (42). Moreover, a study with 82 B-ALL cases showed that BCR/ABLpos BALL cases constantly displayed a homogeneous expression of CD10 and CD34,
but low and relatively heterogeneous CD38 expression, together with an
aberrant reactivity for CD13 (43).
12.
Flow cytometric immunophenotyping has proven to be of great utility forsensitive detection of low levels of residual blast cells and their
distinction from normal regenerating immature cells in the bone marrow
of acute leukemia patients during treatment (46). Flow cytometry is
capable of detecting a single leukemia cell among 10,000 or more normal
cells in peripheral blood during treatment for newly diagnosed T-lineage
ALL in children (47). However, it is critical that flow cytometric analysis
of MRD relies on markers that truly distinguish ALL cells from normal
cells, including lymphoid progenitors; otherwise, the risk of false-positive
MRD results is high. Therefore, a combination of flow sorting of small
immunophenotypically defined cell populations with subsequent
analyses of leukemia associated cytogenetic and molecular markers may
provide a more sophisticated method for detecting low MRD levels.
13.
There are two major conventional techniques to investigate the ploidy ofleukemic blasts. The first traditional way is the karyotyping of cultured bone
marrow cells with light microscopy counting of Giemsa-banded metaphase
chromosomes (49). However, the low number of metaphases studied required,
making this technique insensitive, it also depends on a successful cell culture.
The second way is the DNA content measurement by image analysis or by flow
cytometry (50,51). The DNA content of cells is measured by the ability of
propidium iodide to bind stoichiometrically to DNA under appropriate staining
conditions. The nuclei of these stained cells are evaluated individually for DNA
content by flow cytometry. The results are displayed graphically as a histogram,
in which the fluorescence emitted by each nucleus is directly proportional to its
DNA content. The difference in DNA content can be expressed as the ratio of
leukemia sample/standard DNA fluorescence, defined as the DI.
14.
Флуоресцентная гибридизация in situ (FISH)FISH — это молекулярный метод, который является
цитогенетическим инструментом, используемым для обнаружения
хромосомных аномалий, таких как транслокации, делеции,
инверсии и дупликации.
Метод включает использование флуоресцентно меченого ДНК- или
РНК-зонда, который комплементарен определенной целевой
последовательности. После денатурации двухцепочечной ДНК в
одноцепочечную ДНК меченый зонд инкубируется и гибридизуется
с ДНК. После инкубации образец промывают для удаления любых
несвязанных зондов, а затем добавляют контрастное окрашивание
для облегчения исследования. Образцы исследуют с помощью
флуоресцентного микроскопа для поиска любых хромосомных
аномалий в клетках.










 Медицина
Медицина








