Похожие презентации:
Методы аналитического контроля в производстве материалов современной энергетики. Физические основы методов
1. Методы аналитического контроля в производстве материалов современной энергетики
Часть 11 ФИЗИЧЕСКИЕ ОСНОВЫ МЕТОДОВ
1
2. Типы энергетических уровней и переходов
23. Таблица 1 – Области электромагнитных волн
34. Поглощение энергии
Е = Еэл. + Екол.+ Евр.в
принципом Франка-Кондона: во время
электронного
перехода
и
последующей
ионизации
межъядерные расстояния (и, следовательно, геометрия)
в ионизируемой молекуле не изменяются.
соответствии
с
4
5. Основной закон светопоглощения
Связь между интенсивностями световыхпотоков I0, I с концентрацией поглощающего
вещества и толщиной слоя раствора
устанавливает объединённый
закон Бугера-Ламберта-Бера.
5
6. Спектр поглощения – зависимость интенсивности поглощения от энергии падающего на образец света или от длины волны.
67. Спектр поглощения является качественной характеристикой исследуемого вещества, а количественной – оптическая плотность (А) при определе
Спектр поглощенияявляется
качественной
характеристикой
исследуемого
вещества, а
количественной –
оптическая плотность
(А) при определенной
длине волны, или
молярный
десятичный
коэффициент
поглощения:
ε ≈ 103 ÷ 104 л/моль.см
7
8. Диаграмма состояний (Яблонского)
89.
Колебательная релаксация – очень быстрыйпроцесс.
Внутренняя конверсия до S1– 10-13 – 10-11 с,
или до S0 – за 10-9 – 10-11 с.
Флуоресценция (S1 → S0 + hv) за 10-7 – 10-11
Интеркомбинационная конверсия (S1 → Т n
) – 10-13 – 10-8 с.
Внутренняя конверсия до Т 1 – 10-13 – 10-11 с.
ИКК до (Т1 → S0 ) 10-3 –10+1 с.
Фосфоресценция (Т1→ S0 + hv)
9
10. Ограничения
A C1. Закон Бера справедлив для разбавленных
растворов.
2. Закон справедлив для
монохроматического излучения.
3. Температура
4. Пучок света должен быть параллельным.
5. Свет поглощает только один тип частиц ,
т.е. отсутствует химическое заимодействие.
10
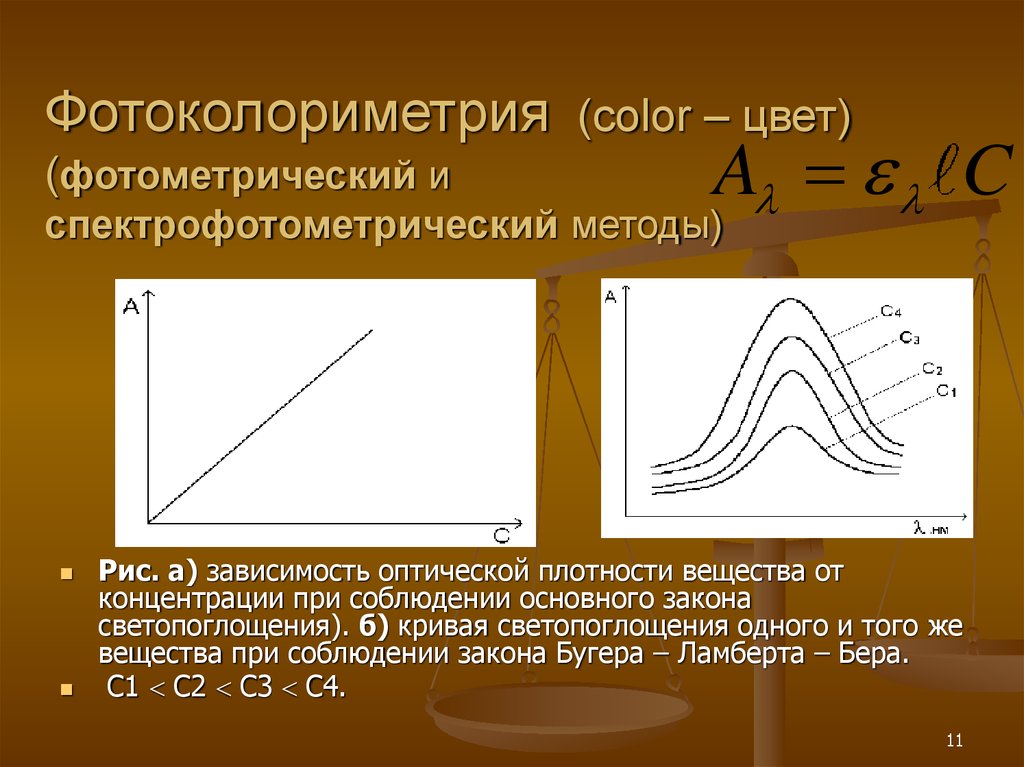
11. Фотоколориметрия (color – цвет) (фотометрический и спектрофотометрический методы)
Фотоколориметрия (color – цвет)(фотометрический и
A C
спектрофотометрический методы)
Рис. а) зависимость оптической плотности вещества от
концентрации при соблюдении основного закона
светопоглощения). б) кривая светопоглощения одного и того же
вещества при соблюдении закона Бугера – Ламберта – Бера.
С1 С2 С3 С4.
11
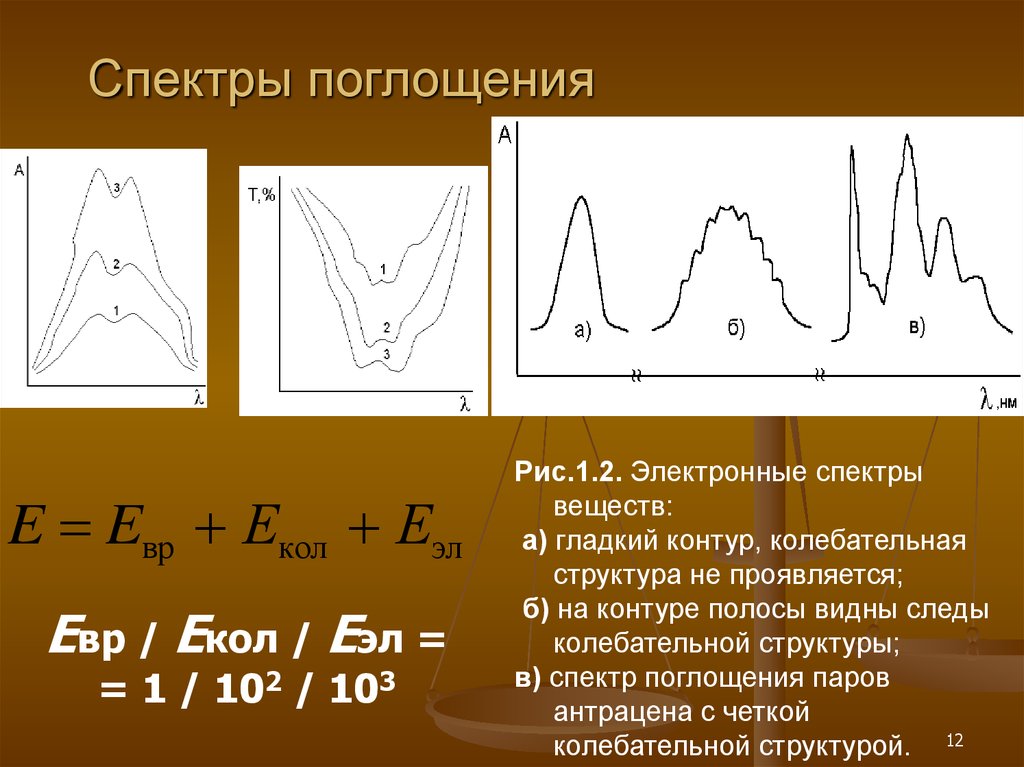
12. Спектры поглощения
E Eвр Екол ЕэлЕвр / Екол / Еэл =
= 1 / 102 / 103
Рис.1.4. Способы
представления спектров
поглощения одних
и тех же растворов.
(С1 : С2 : C3 = 1 : 2 : 3).
Рис.1.2. Электронные спектры
веществ:
а) гладкий контур, колебательная
структура не проявляется;
б) на контуре полосы видны следы
колебательной структуры;
в) спектр поглощения паров
антрацена с четкой
колебательной структурой. 12
13. Основные характеристики спектра
maxΔ ½
max
Рис.1.5.
Полоса поглощения.
полуширина
(ширина на
половине
высоты)
13
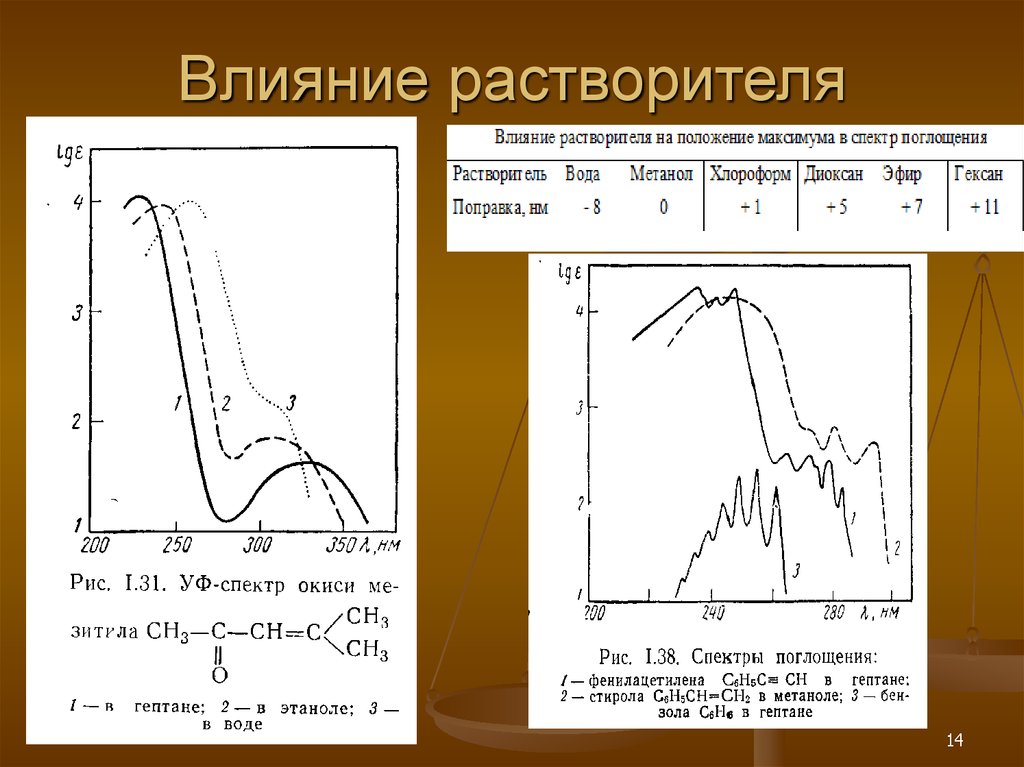
14. Влияние растворителя
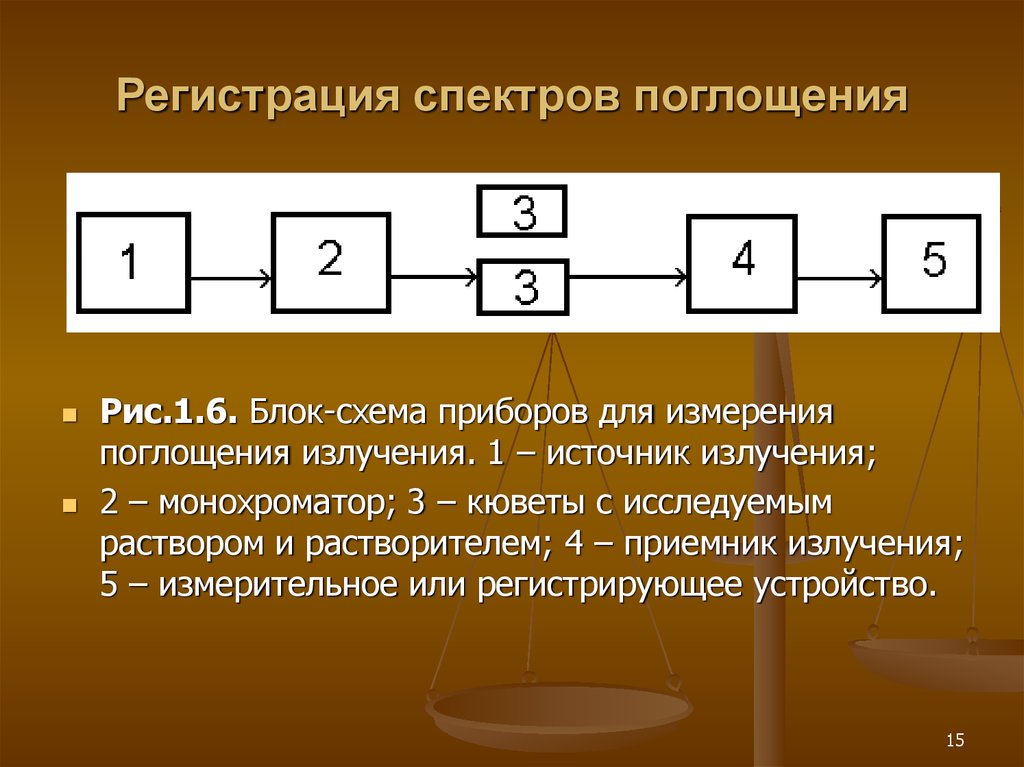
1415. Регистрация спектров поглощения
Рис.1.6. Блок-схема приборов для измеренияпоглощения излучения. 1 – источник излучения;
2 – монохроматор; 3 – кюветы с исследуемым
раствором и растворителем; 4 – приемник излучения;
5 – измерительное или регистрирующее устройство.
15
16. Регистрация спектров поглощения
Оптическая схема спектрофотометра СФ-2616
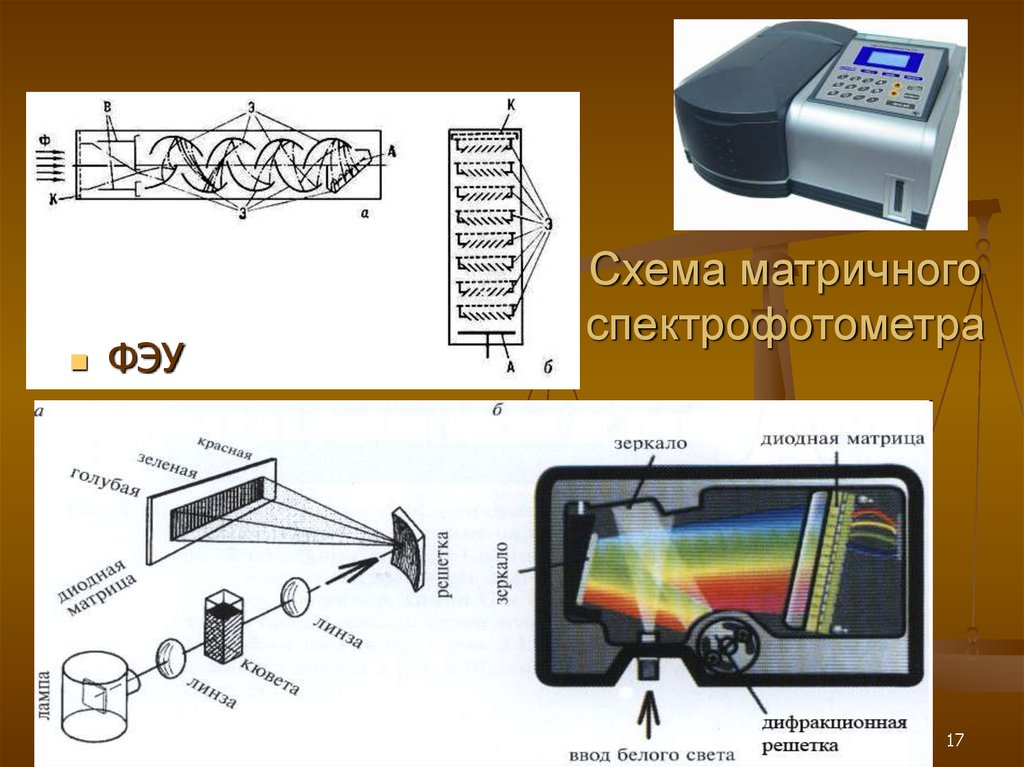
17. Схема матричного спектрофотометра
ФЭУСхема матричного
спектрофотометра
17
18. Детектирование ионов – электронный умножитель
Схема действия электронного умножителя (ЭУ):Электронный умножитель масс-спектрометра Thermo Electron
DFS:
18
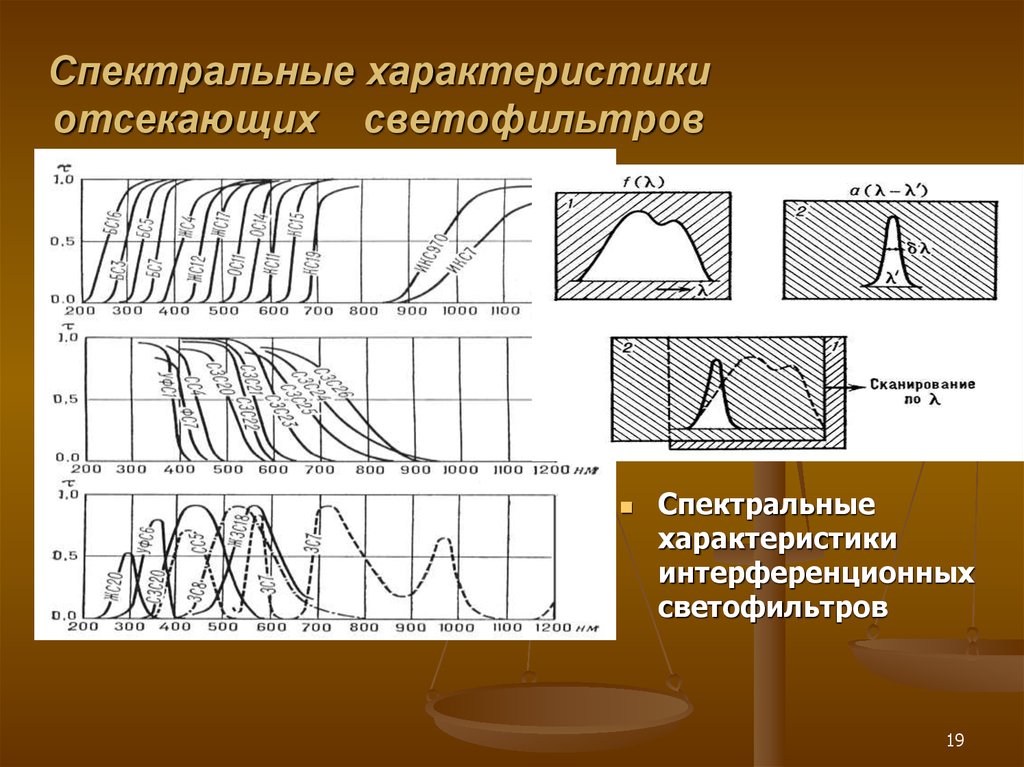
19. Спектральные характеристики отсекающих светофильтров
Спектральныехарактеристики
интерференционных
светофильтров
19
20. фотоколориметры
Принципиальная схемафотоколориметра:
Многофункциональный
спектрофотометр с uvдиапазоном LEKI SS2107UV
20
21. Основные этапы анализа в фотометрии
– перевод анализируемого образца в раствор иотделение, в случае необходимости, мешающих
компонентов;
– выбор фотометрической формы вещества и
проведение химических реакций для получения
окрашенного соединения (если определяемое
вещество не обладает интенсивным собственным
поглощением)
– установление области концентраций, в которой
выполняется основной закон светопоглощения:
– измерение оптической плотности исследуемого
раствора;
– расчет содержания вещества в анализируемой
пробе и его метрологическая оценка.
21
22. Метрологические характеристики метода
Чувствительность характеризуется угломнаклона градуировочного графика. Тангенс
угла наклона равен молярному коэффициенту
поглощения. Если принять минимальное
значение оптической плотности, измеренное
с необходимой точностью, Аmin = 0,01,
можно рассчитать минимально определяемую
концентрацию:
0,01
Сmin
При величинах 105 чувствительность
определения может составлять 10–7–10–6 М.
22
23. Метрологические характеристики метода
-Воспроизводимость. С/C имеет минимальное
значение при Т = 0,37 или оптической плотности
А = 0,435.
А в интервале 0,1–1,0
Правильность.
отклонения от закона Бера
немонохроматичность
наличии примесей
Точность Обычная относительная погрешность
фотометрических методов составляет 1–2%.
23
24. Анализ однокомпонентных систем фотометрическим методом
Метод сравнения оптических плотностейстандартного и исследуемого соединений
Ах
Ax Сх
Ax Cx Aст Сст
Сх Сст
Аст
Aст Сст
Метод молярного коэффициента А
ст
поглощения
Сст
Сх
Ах
Метод градуировочного
графика
24
25. Анализ однокомпонентных систем фотометрическим методом
Метод добавокАх Сх
Ах ст (Сх Сст )
Ах
Сх Сст
Ах ст Ах
если строить график Ах+ст как функции Сст, то получится
прямая, экстраполяция которой до пересечения с осью
абсцисс дает отрезок, равный –Сх. Действительно, при
Ах+ст = 0 из уравнения (1.16) следует, что –Сст = Сх.
25
26. Метод дифференциальной фотометрии
Метод высокого поглощения(Со Сх).
Метод низкого поглощения
(Со Сх).
Метод двухстороннего
дифференцирования
(метод предельной точности)
26
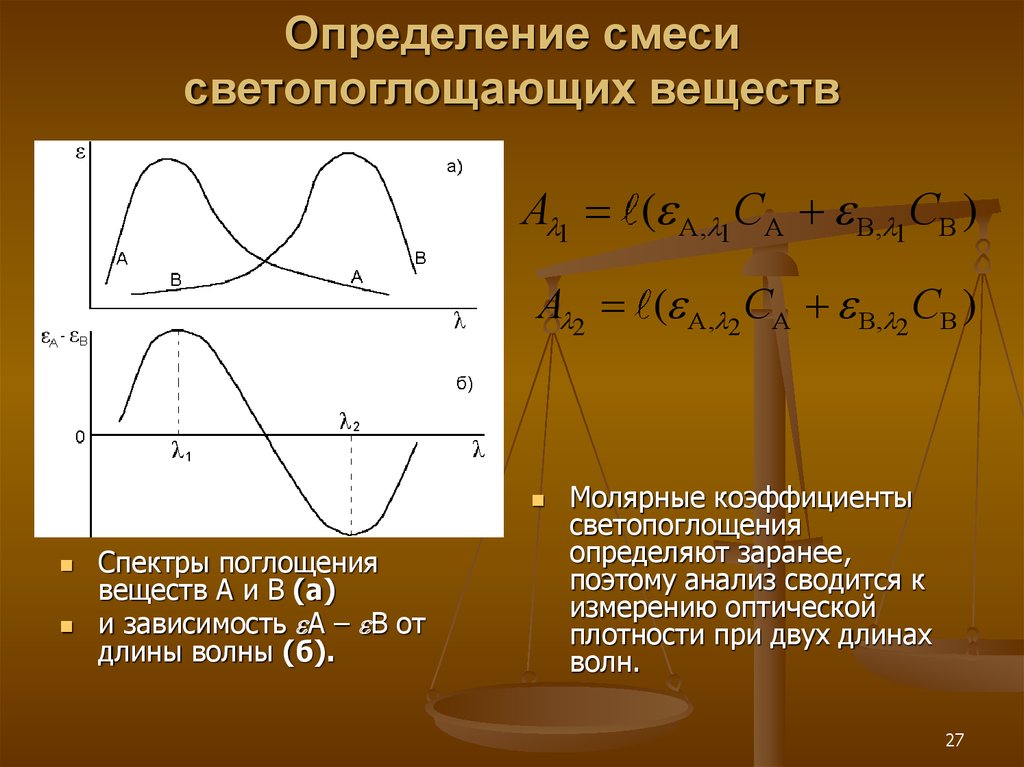
27. Определение смеси светопоглощающих веществ
А 1 ( А, 1СА В, 1СВ )А 2 ( А, 2 СА В, 2 СВ )
Спектры поглощения
веществ А и В (а)
и зависимость А – В от
длины волны (б).
Молярные коэффициенты
светопоглощения
определяют заранее,
поэтому анализ сводится к
измерению оптической
плотности при двух длинах
волн.
27
28. Принципы разложения спектров
2829. Другие области применения молекулярной абсорбционной спектроскопии
Фотометрическое титрование.Исследование равновесий в
растворах.
29
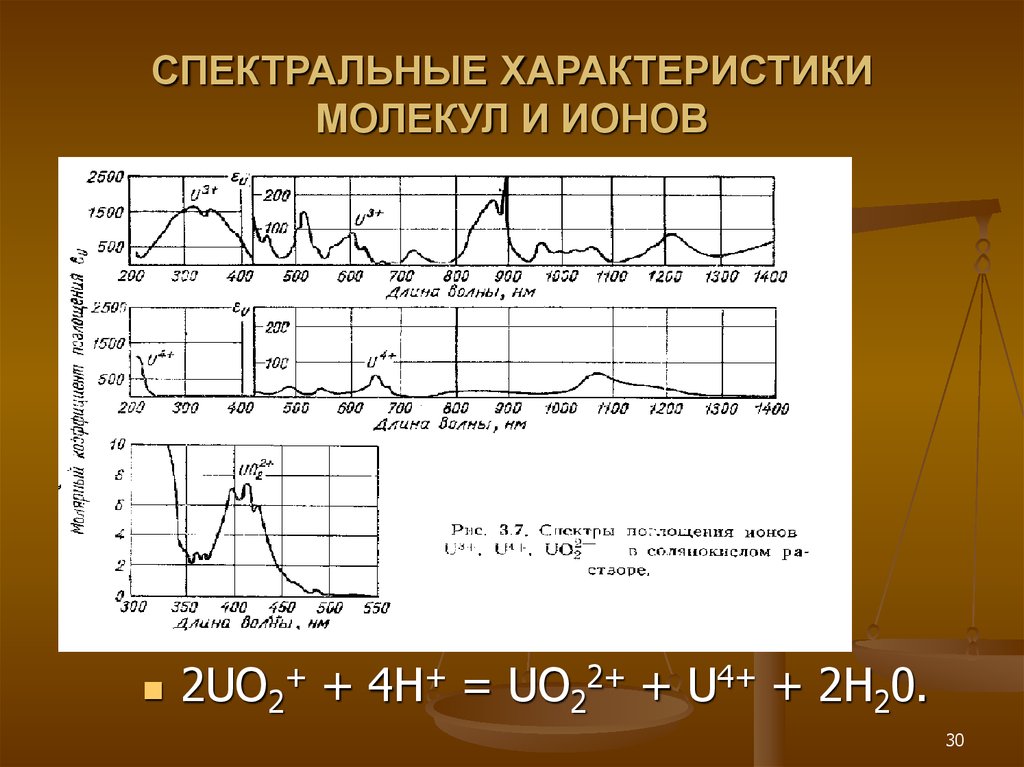
30. СПЕКТРАЛЬНЫЕ ХАРАКТЕРИСТИКИ МОЛЕКУЛ И ИОНОВ
2UО2+ + 4Н+ = UO22+ + U4+ + 2Н20.30
31. Неорганические ионы
UO2(OCOCH3)2*2H2Oуранилацетат
31
32. Органические соединения
Ароматическиесоединения
Диены
32
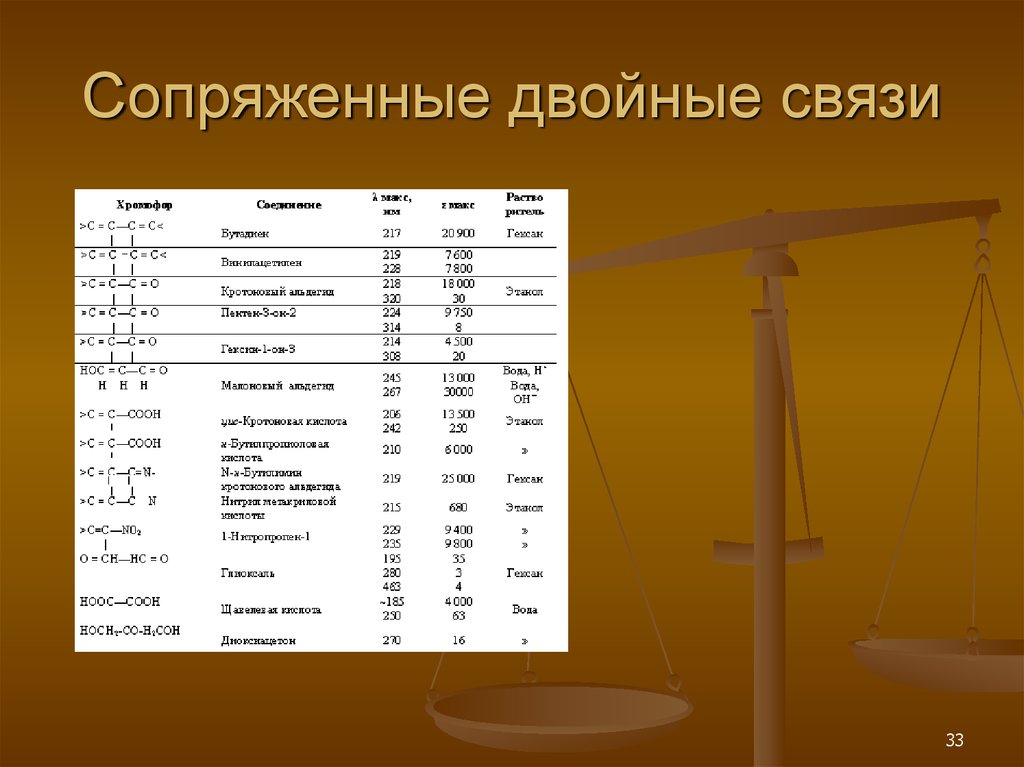
33. Сопряженные двойные связи
3334. Спектры поглощения органических соединений
ε≥ 103
( дм3 / моль·см).
ароматические
соединения, а также
непредельные
производные альдегидов,
кетонов, кислот и
аналогичных веществ, в
молекулах которых
имеется сопряжение как
минимум двух кратных
связей.
34
35. Влияние структуры молекулы на λмакс
λмакс = 215 + Δλнмλмакс = 197 + Δλнм
Фурилполиеновые
альдегиды
35
36. Инфракрасная спектроскопия
3637. Источники ИК- излучения
ГлобарГазоразрядный лазер,
генерирующий излучение на
колебательно-вращательных
переходах молекулы СО .
Непрерывный газовый лазер
на молекулах СО2 .
Инфракрасные спектрометры
с преобразованием Фурье
37
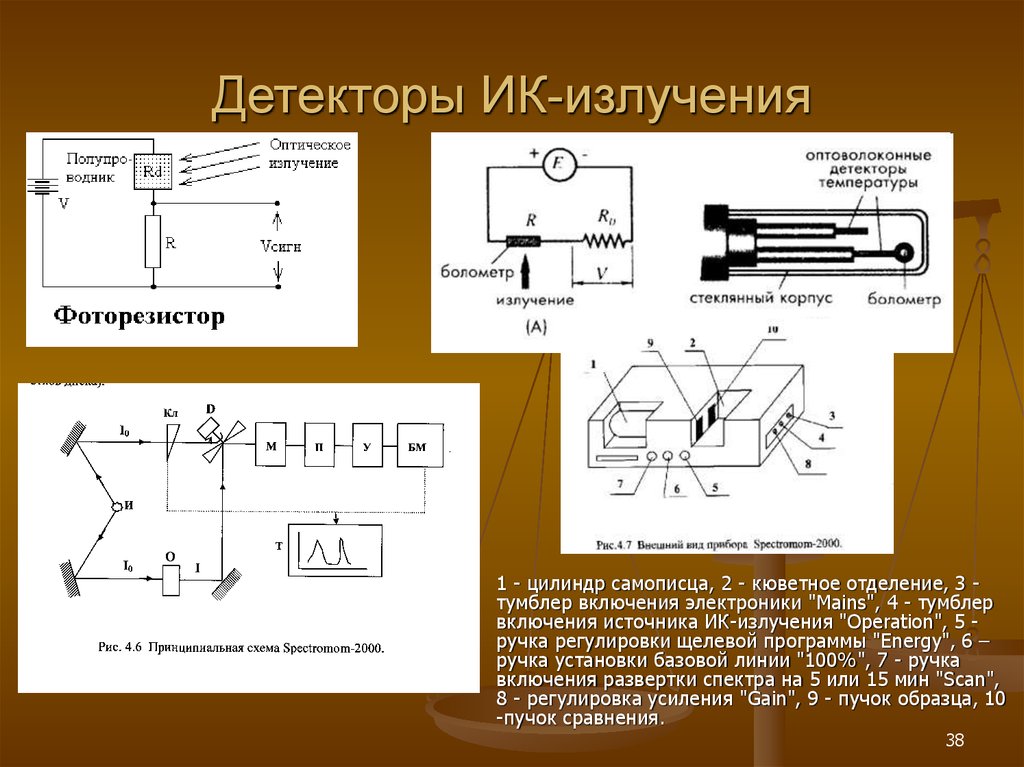
38. Детекторы ИК-излучения
1 - цилиндр самописца, 2 - кюветное отделение, 3 тумблер включения электроники "Mains", 4 - тумблервключения источника ИК-излучения "Operation", 5 ручка регулировки щелевой программы "Energy", 6 –
ручка установки базовой линии "100%", 7 - ручка
включения развертки спектра на 5 или 15 мин "Scan",
8 - регулировка усиления "Gain", 9 - пучок образца, 10
-пучок сравнения.
38
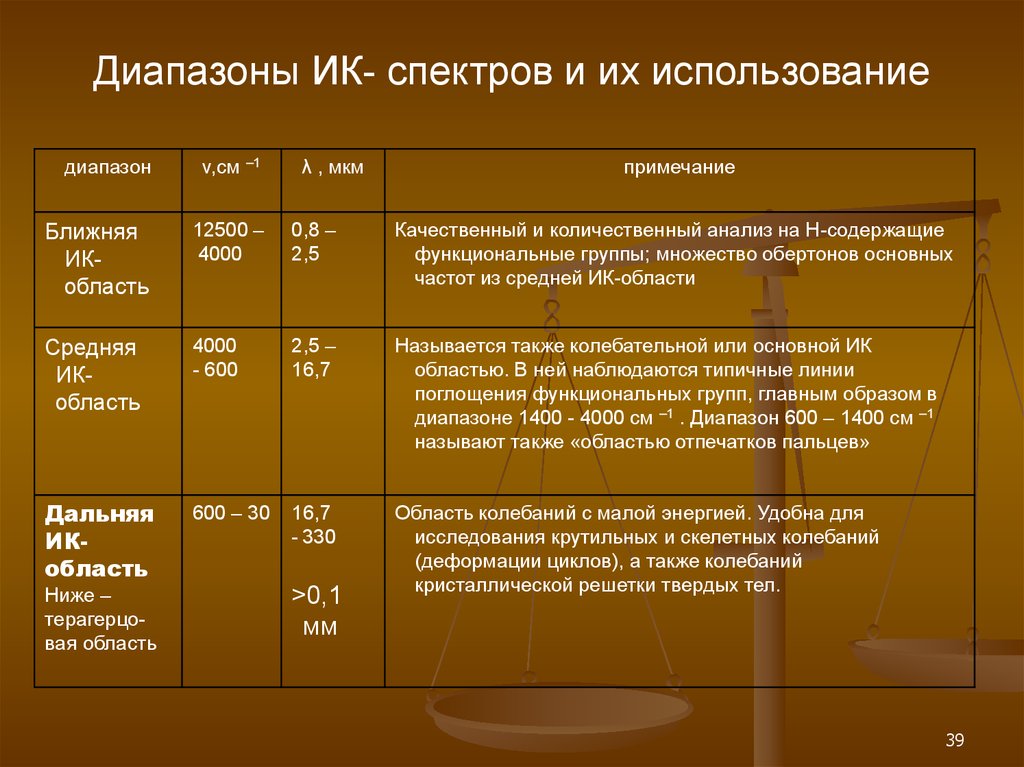
39. Диапазоны ИК- спектров и их использование
диапазонv,см –1
Ближняя
ИКобласть
12500 –
4000
0,8 –
2,5
Качественный и количественный анализ на Н-содержащие
функциональные группы; множество обертонов основных
частот из средней ИК-области
Средняя
ИКобласть
4000
- 600
2,5 –
16,7
Называется также колебательной или основной ИК
областью. В ней наблюдаются типичные линии
поглощения функциональных групп, главным образом в
диапазоне 1400 - 4000 см –1 . Диапазон 600 – 1400 см –1
называют также «областью отпечатков пальцев»
Дальняя
ИКобласть
600 – 30
16,7
- 330
Область колебаний с малой энергией. Удобна для
исследования крутильных и скелетных колебаний
(деформации циклов), а также колебаний
кристаллической решетки твердых тел.
Ниже –
терагерцовая область
λ , мкм
>0,1
мм
примечание
39
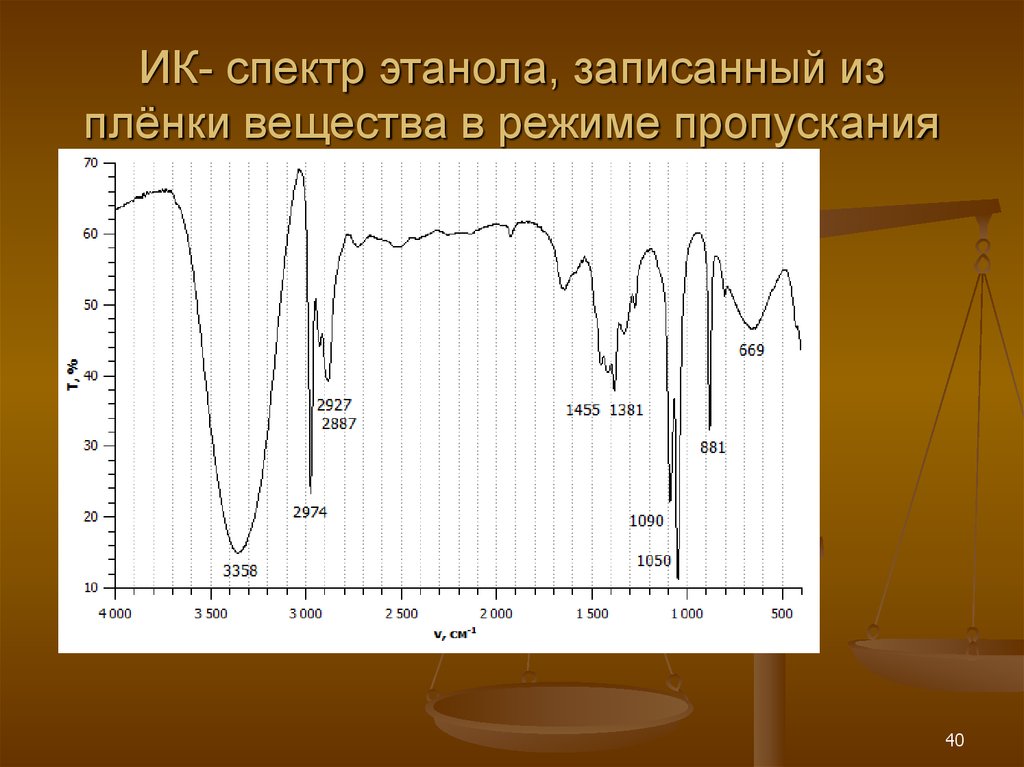
40. ИК- спектр этанола, записанный из плёнки вещества в режиме пропускания
4041.
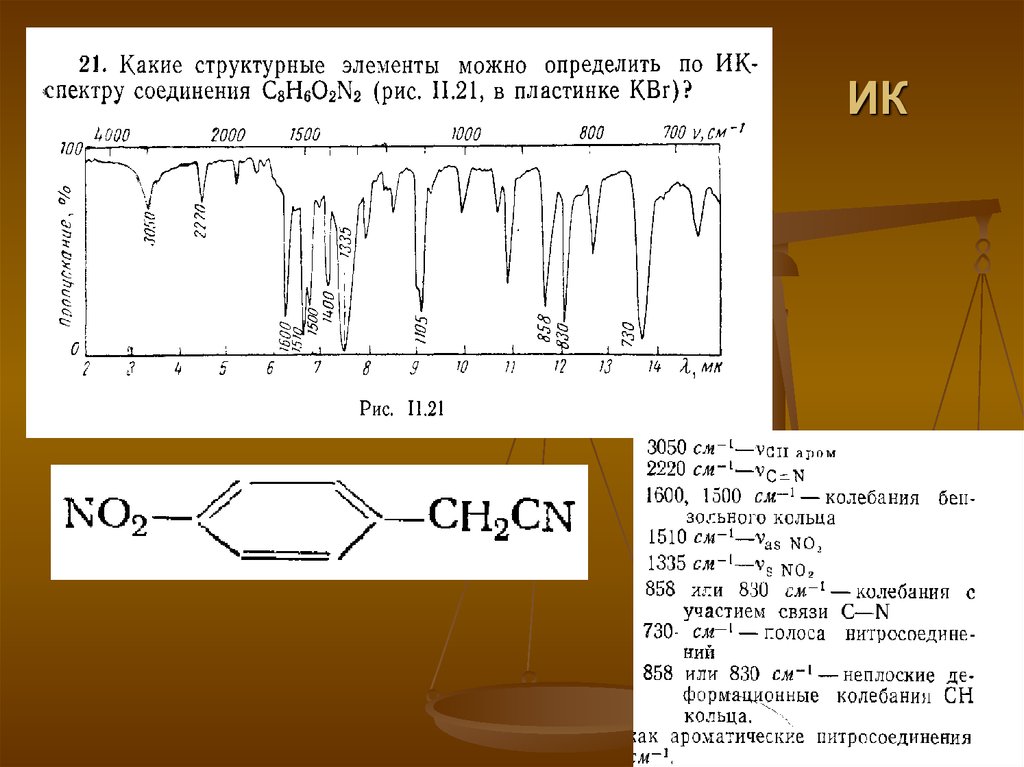
4142. ИК
4243. Терагерцовое излучение
Максимальный допустимый диапазон ТГцчастот 1011—1013 Гц, диапазон длин волн
3—0,03 мм соответственно. Такие волны ещё
называются субмиллиметровыми, если длина
волны попадает в диапазон 1—0,1 мм.
43
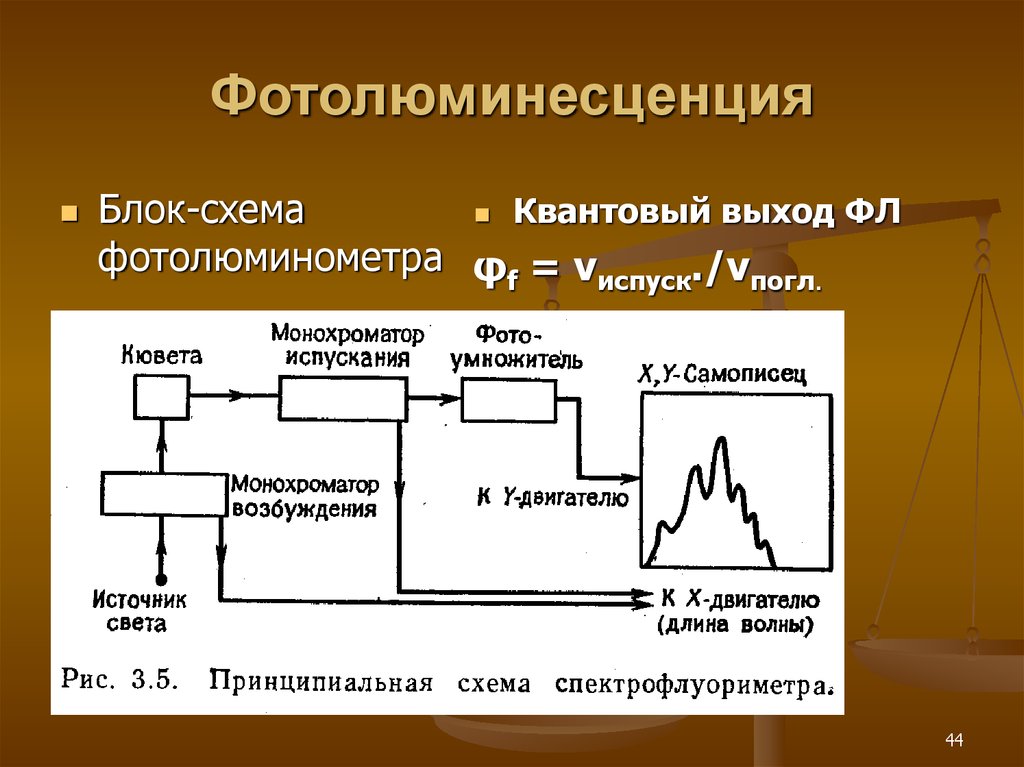
44. Фотолюминесценция
Блок-схемаКвантовый выход ФЛ
фотолюминометра φf = vиспуск./vпогл.
44
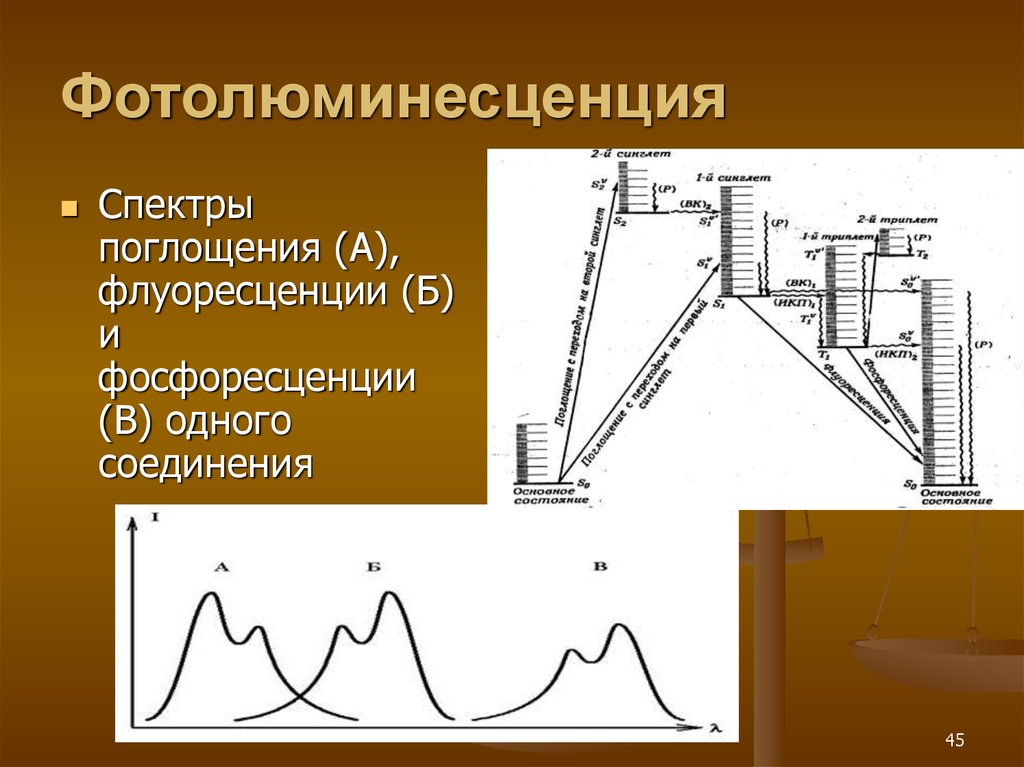
45. Фотолюминесценция
Спектрыпоглощения (А),
флуоресценции (Б)
и
фосфоресценции
(В) одного
соединения
45
46. Кинетика и тушение ФЛ
Константа тушенияШтерна-Фольмера,
определяемая из
уравнения:
F/Fо = 1/( 1 + KШФ[Q])
KШФ τ [Q]1/2 = 1
Квантовый выход ФЛ
про РЛИ
φf = vиспуск./vпогл.
46
47. Светосоставы постоянного действия (РЛИ)
РЛИСпектральный диапазон: 120 нм – 2000 нм
Интенсивность светового потока –
до 1012 квант/см2 .с
47
48. Литература
Аналитическая химия. Проблемы и подходы. Кн.2. –М.: Мир,2004.-728 с.
Харитонов Ю.Я. Аналитическая химия. Аналитика. Кн. 2.
Количественный анализ. Физико-химические (инструментальные)
методы анализа –М.: Высш. шк., 2005. - 559 с.
Васильев В.П. Аналитическая химия. Кн. 2. Физико-химические
методы анализа. – М.: Дрофа, 2004. - 383 с.
Пикаев А.К. Современная радиационная химия. Основные
положения. Экспериментальная техника и методы. - М.: Наука,
1985. - 375 с.
Инструментальные методы анализа функциональных групп
органических соединений /Под ред. С. Сиггиа – М.: Мир, 1974. 465с.
Мельников М.Я. Электронно - возбужденные радикалы. В сб.
Физическая химия. Современные проблемы. - М., Химия, 1987. - С.
48 - 88.
Дайер Д.Р. Приложения адсорбционной спектроскопии
органических соединений. - М., Химия, 1970. - 163 с.
48

































 Физика
Физика Химия
Химия Электроника
Электроника








