Похожие презентации:
Реакционная способность углеводородов
1.
Федеральное государственное бюджетное образовательноеучреждение высшего образования «Кубанский государственный
медицинский университет» Министерства здравоохранения
Российской Федерации
КАФЕДРА ФУНДАМЕНТАЛЬНОЙ И КЛИНИЧЕСКОЙ БИОХИМИИ
Лекция по органической химии
Тема:
«РЕАКЦИОННАЯ СПОСОБНОСТЬ
УГЛЕВОДОРОДОВ»
Есауленко Елена Евгеньевна
д.б.н., проф.
2.
АЛКАНЫАлканы
(предельные, или насыщенные, углеводороды) –
это углеводороды с незамкнутыми (открытыми)
углеродными цепями, в молекулах которых между
атомами образуются только одинарные связи
Общая формула СnН2n+2
Атомы углерода в молекулах алканов находятся в
состоянии sp3-гибридизации.
3.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВГлавными источниками алканов являются
природный газ и нефть
Большое значение имеет синтез углеводородов из
оксида углерода(II) и водорода
(метод Фишера- Тропша)
При температуре 250°С в присутствии никелевого
катализатора получают метан:
СО + 3Н2 СН4 + Н2О
Если в качестве катализатора использовать железо
и кобальт, то можно получать смесь углеводородов
(синтин), содержащих от 12 до 18 атомов углерода:
nСO + (2n + 1)Н2 СnН2n+2 + nН2O
4.
СИНТЕТИЧЕСКИЕ СПОСОБЫПервую группу составляют способы, основанные
на реакциях, в которых исходные вещества и конечные
продукты содержат одинаковое число атомов углерода;
к ним относят следующие реакции:
а) гидрирование непредельных углеводородов:
Н2С=СН2 + Н2 СН3-СН3
б) восстановление галогенопроизводных
водородом или йодоводородом:
CH3I + Н2 СН4 + HI,
CH3I + HI СН4 + I2
5.
СИНТЕТИЧЕСКИЕ СПОСОБЫКо второй группе относятся способы, основанные
на реакциях, при которых продукт содержит больше
атомов углерода, чем исходное вещество
(реакция Вюрца):
C2H5I + 2Na + IC2H5 С4Н10 + 2NaI
Иодэтан
Иодэтан
Бутан
Реакция Вюрца представляет интерес при получении
симметричных алканов. Если же исходными веществами
являются разные галогенопроизводные, то, как правило,
образуется смесь трех алканов:
3CH3I + 3CH3CH2I + 6Na
СН3-СН3 + СН3-СН2-СН3 + СН3-СН2-СН2-СН3 + 6NaI
6.
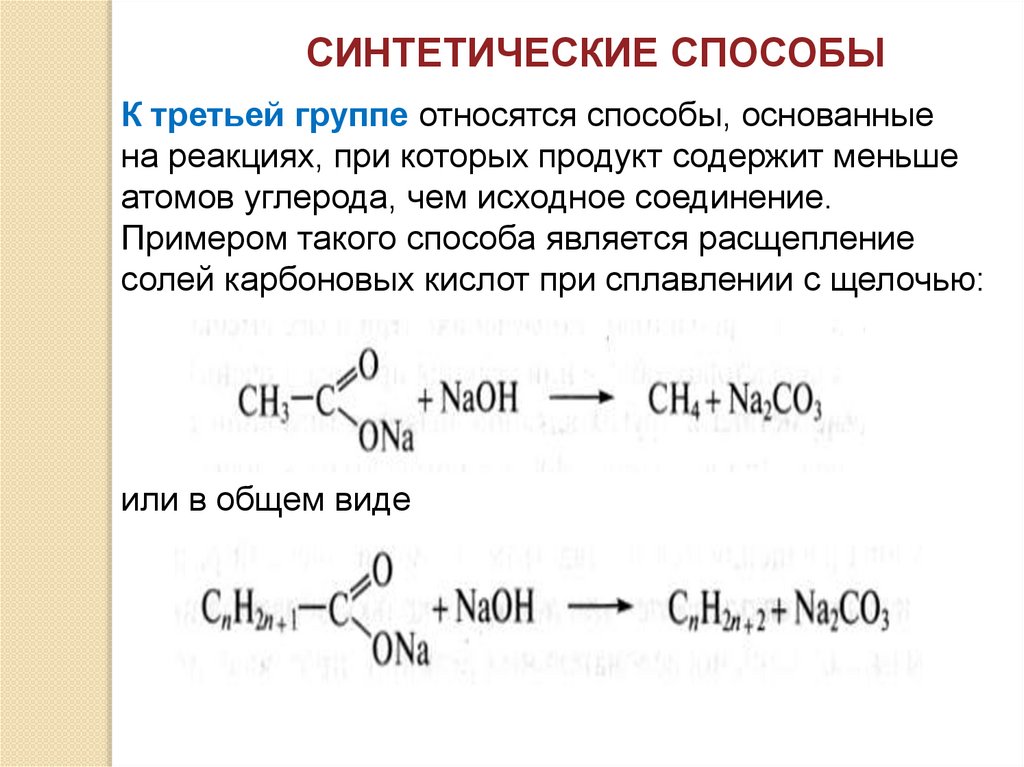
СИНТЕТИЧЕСКИЕ СПОСОБЫК третьей группе относятся способы, основанные
на реакциях, при которых продукт содержит меньше
атомов углерода, чем исходное соединение.
Примером такого способа является расщепление
солей карбоновых кислот при сплавлении с щелочью:
или в общем виде
7.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВПредельные углеводороды, содержащие от 1 до 4
атомов углерода, - газы.
Алканы с числом атомов углерода n = 5-17 - жидкости,
n > 17 - твердыe вещества.
С увеличением длины цепи на один атом углерода
температура кипения углеводорода повышается
на 20-30°С, за исключением метана, этана и пропана.
Нормальные алканы (т.е. алканы с неразветвленной
цепью) имеют более высокие температуры кипения,
чем их разветвленные изомеры.
Алканы неполярны , поэтому практически
нерастворимы в воде, однако хорошо растворяются
в неполярных и малополярных органических
растворителях.
В чистом виде алканы бесцветны, имеют слабый запах.
8.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВДля алканов более предпочтительны гомолитические
реакции с образованием промежуточных частиц –
радикалов
Реакции галогенирования
Хлорирование метана можно представить в виде
последовательных реакций замещения:
СН4 + Сl2 СН3Сl + НСl
Метан
Хлорметан
СН3Сl + Сl2 СН2Cl2 + НСl
Дихлорметан
СН2Cl2 + Сl2 СНСl3 + НСl
Трихлометан (хлороформ)
СНСl3 + Сl2 ССl4 + НСl
Тетрахлорметан
9.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВХлорирование метана и других алканов является
типичной цепной радикальной реакцией.
При высокой ( 400°С) температуре и(или)
интенсивном ультрафиолетовом облучении
происходит гомолитическое расщепление связей.
Молекула хлора расщепляется на два атома
(гомолитический разрыв связи).
Эта стадия называется зарождением цепи,
поскольку образующиеся радикалы далее вызывают
цепь последовательных реакций, протекающих
по SR-механизму:
• зарождение (инициирование) цепи
10.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ• развитие цепи
• обрыв цепи (два метильных радикала
взаимодействуют между собой, рекомбинируясь в этан,
а два атома хлора - в молекулу Cl2):
СН3 *+ Cl* = CH3Cl
11.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВЕсли алкан имеет разветвленное строение и содержит
первичные, вторичные и третичные атомы углерода, то
при галогенировании замещение происходит
преимущественно по третичному атому углерода.
При бромировании образующийся радикал брома
менее реакционноспособен и избирательность
замещения очень высока:
12.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВРеакции нитрования
Нитрование алканов под действием 10-20%-й азотной
кислоты при нагревании впервые осуществлено
М. И. Коноваловым (1888), поэтому данный процесс
называют реакцией Коновалова.
Такой способ нитрования является жидкофазным, так
как проводится при температуре 150°С и под давлением.
Например, в этих условиях можно получить
2-нитрогексан с выходом 63%:
13.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВРеакции сульфохлорирования
Взаимодействие алканов с оксидом серы(IV) в
присутствии хлора называют сульфохлорированием.
Этот процесс относится к цепным реакциям.
В общем виде его можно представить
следующим образом:
СН3-(СН2)n-СН3 + SO2 + Сl2
СН3-(СН2)n-СН2-SO2Cl + НСl
14.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВРеакции дегидрирования
При высоких ( 650°С) температурах алканы могут
подвергаться дегидрированию.
В зависимости от типа катализатора
(металлы или оксиды металлов) из алкана образуется
либо алкен, либо алкадиен.
Данная реакция используется при дегидрировании
бутан-бутеновой фракции переработки нефти:
15.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВРеакции изомеризации
Под влиянием кислот Льюиса и при высоких
температурах н-алканы, начиная с бутана,
могут переходить (изомеризоваться) в изоалканы,
и наоборот.
Чем больше атомов углерода, тем легче протекает
изомеризация.
Обычно образуется равновесная смесь, например:
16.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВОкисление алканов в жидкой или газообразной фазе
кислородом или воздухом при температуре 150-200°С
сопровождается разрывом углерод-углеродных связей
и образованием преимущественно карбоновых кислот
в качестве конечных продуктов.
Таким путем, например, из бутана можно получить
уксусную кислоту:
17.
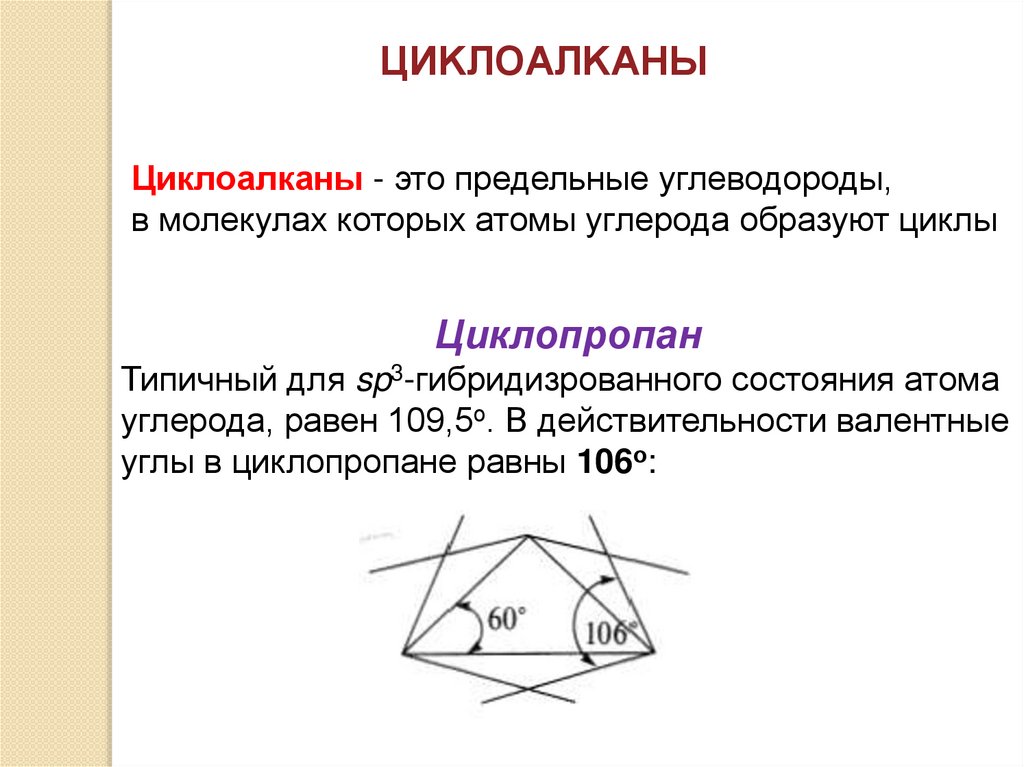
ЦИKЛОAЛKАНЫЦиклоалканы - это предельные углеводороды,
в молекулах которых атомы углерода образуют циклы
Циклопропан
Типичный для sp3-гибридизрованного состояния атома
углерода, равен 109,5о. В действительности валентные
углы в циклопропане равны 106о:
18.
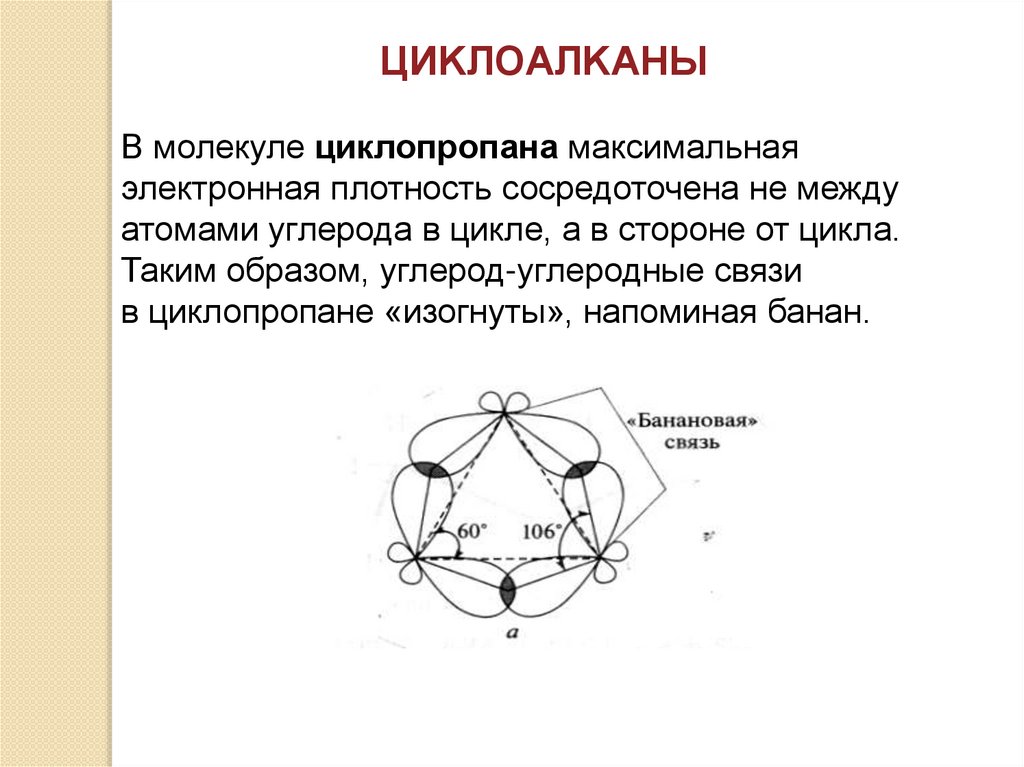
ЦИKЛОAЛKАНЫВ молекуле циклопропана максимальная
электронная плотность сосредоточена не между
атомами углерода в цикле, а в стороне от цикла.
Таким образом, углерод-углеродные связи
в циклопропане «изогнуты», напоминая банан.
19.
СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВОсновные способы получения циклоалканов
1. Дегалогенирование 1,3-дигалогеналканов под
действием цинка, магния или амальгамы лития
позволяет получить производные циклопропана.
Данный препаративный метод представляет собой
аналог внутримолекулярной реакции Вюрца:
20.
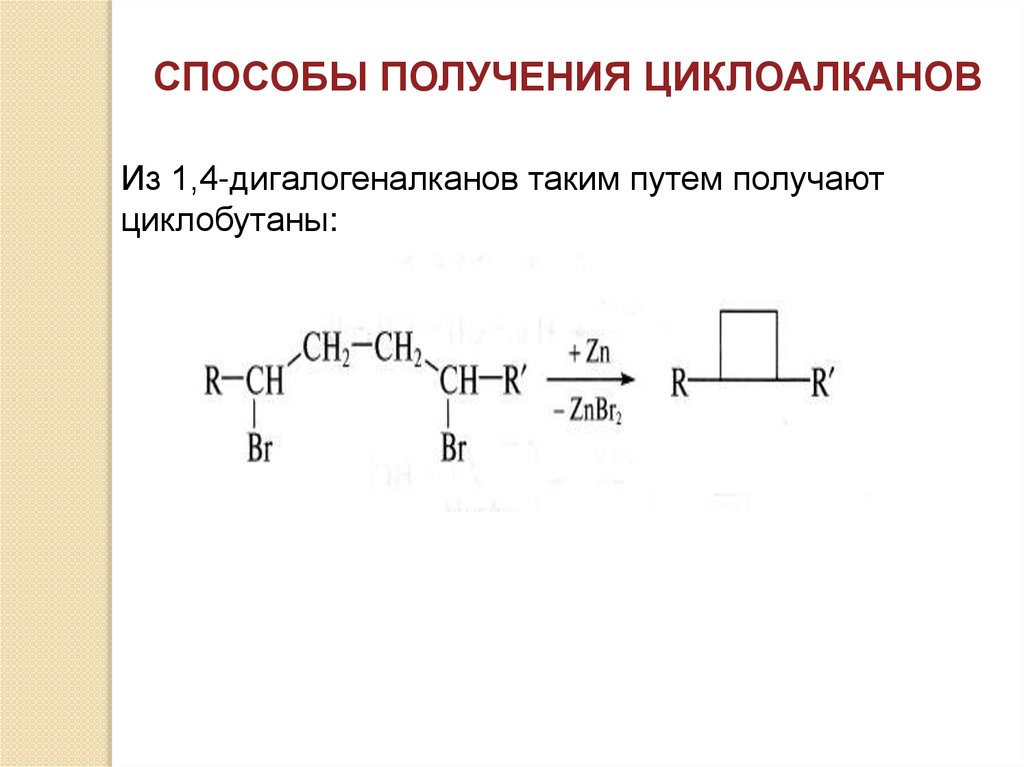
СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВИз 1,4-дигалогеналканов таким путем получают
циклобутаны:
21.
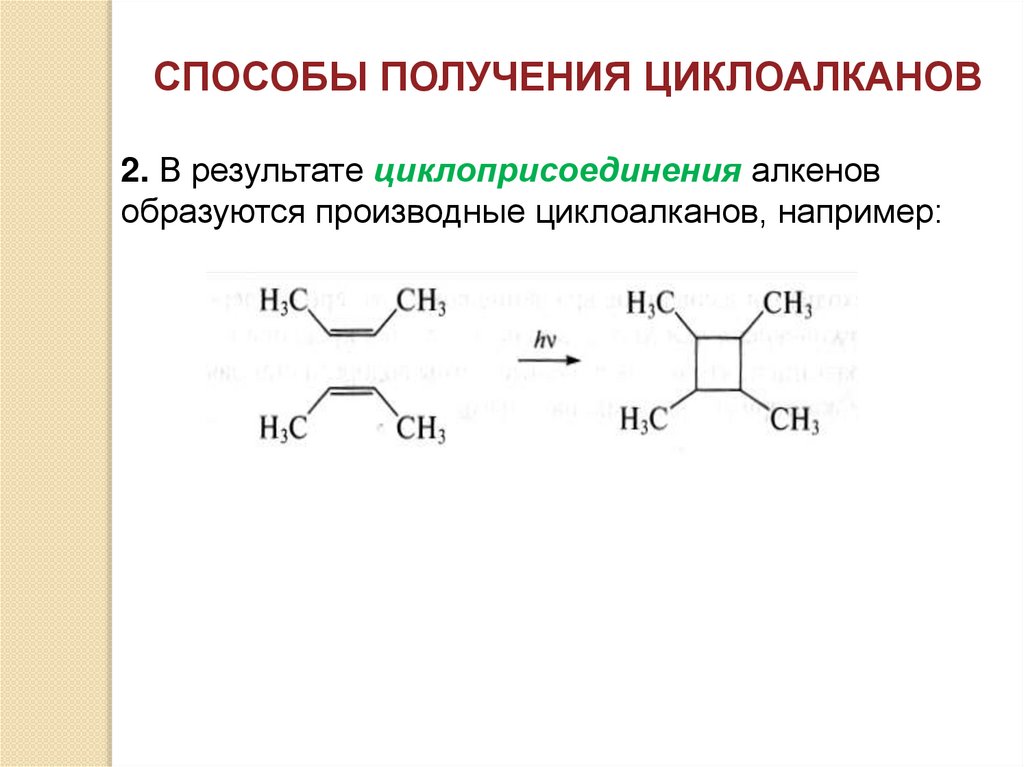
СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ2. В результате циклоприсоединения алкенов
образуются производные циклоалканов, например:
22.
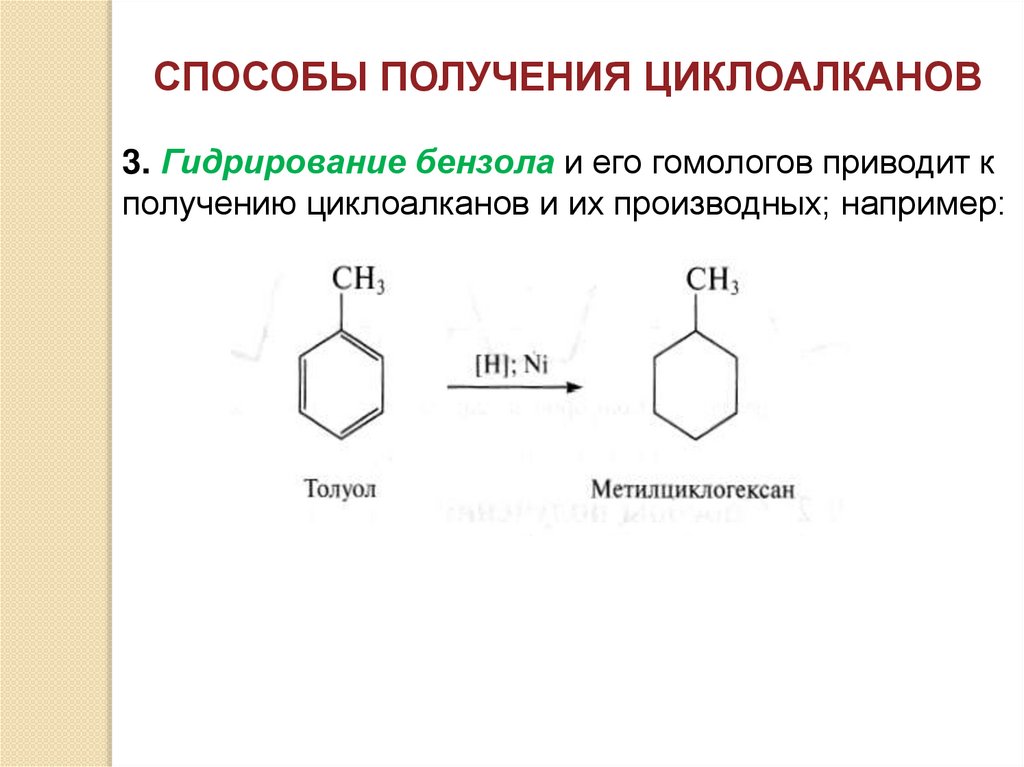
СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ3. Гидрирование бензола и его гомологов приводит к
получению циклоалканов и их производных; например:
23.
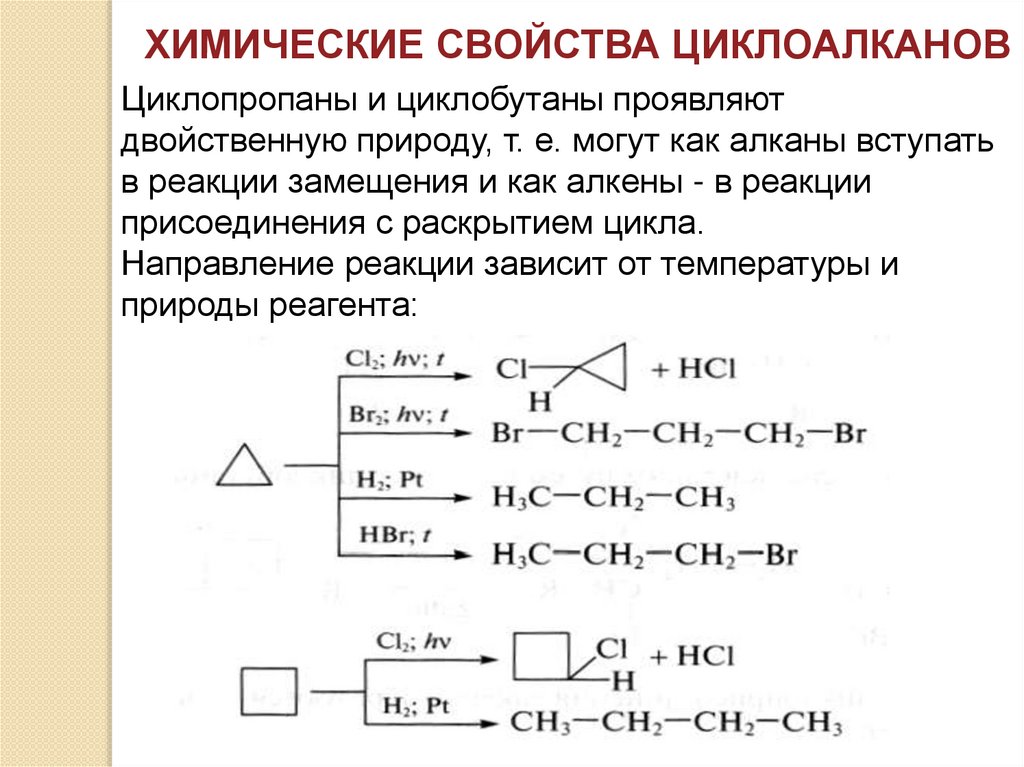
ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВЦиклопропаны и циклобутаны проявляют
двойственную природу, т. е. могут как алканы вступать
в реакции замещения и как алкены - в реакции
присоединения с раскрытием цикла.
Направление реакции зависит от температуры и
природы реагента:
24.
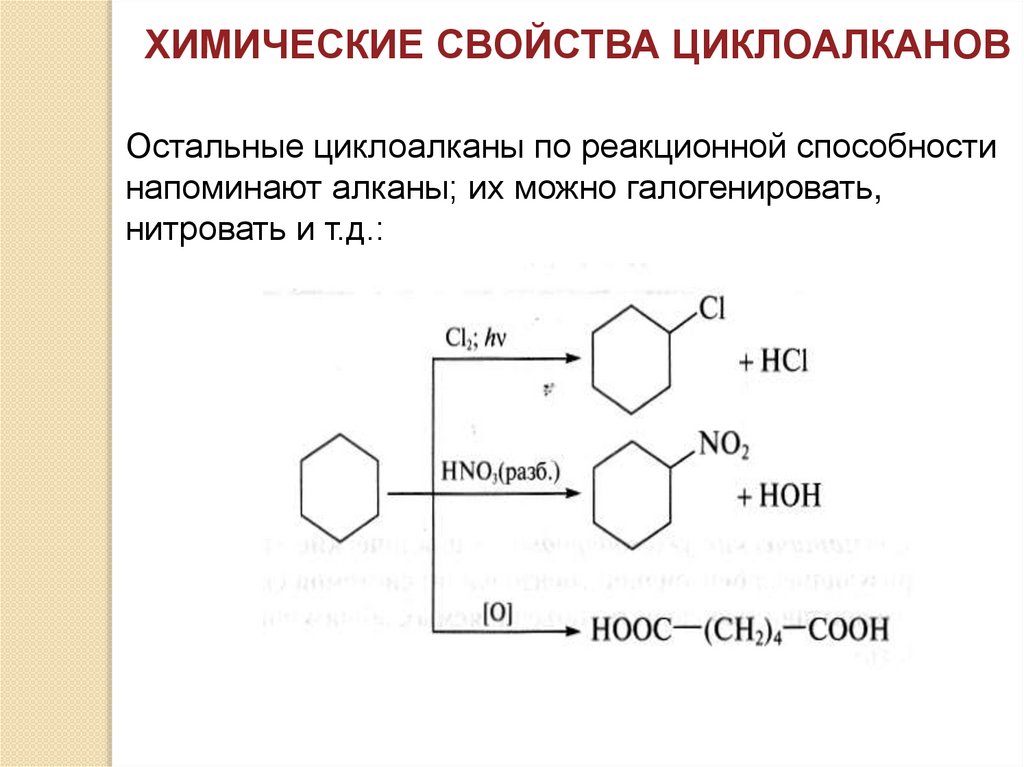
ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВОстальные циклоалканы по реакционной способности
напоминают алканы; их можно галогенировать,
нитровать и т.д.:
25.
АЛКЕНЫАлкены (этиленовые, или олефиновые,
углеводороды) –
это углеводороды с незамкнутыми (открытыми)
углеродными цепями, в молекулах которых
содержится
одна двойная углерод-углеродная связь.
Общая формула алкенов – СnH2n
Простейший представитель алкенов - этилен имеет
плоское строение с валентными углами, близкими к
120°,
что соответствует sp2-гибридизации обоих атомов
углерода
26.
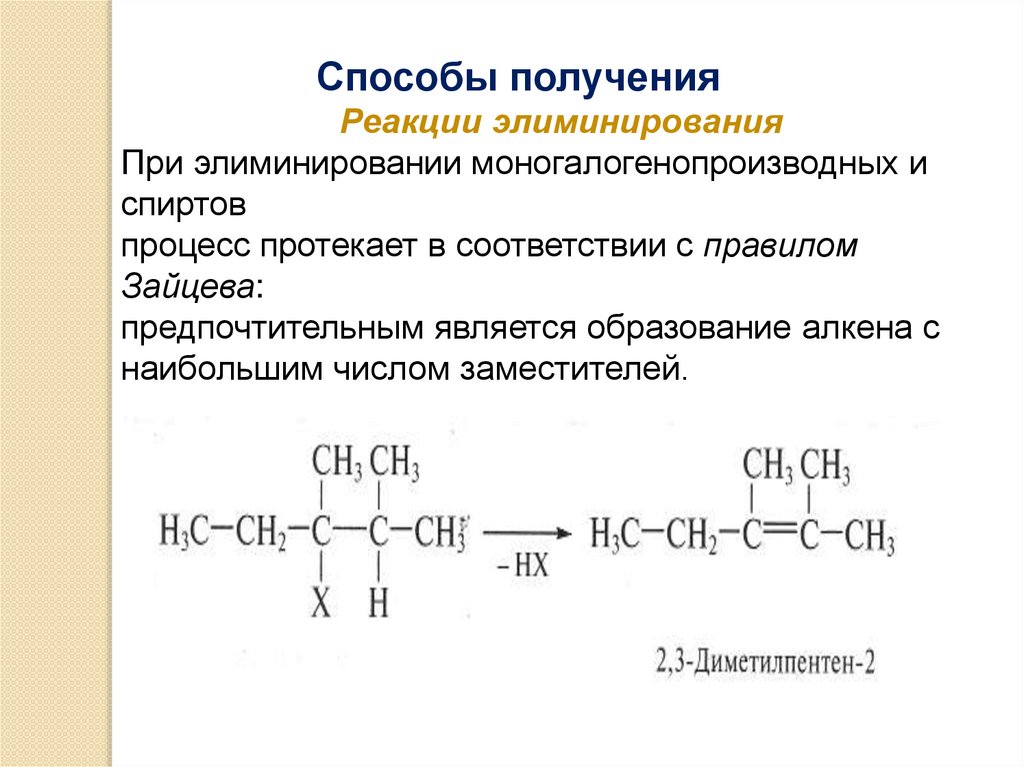
Способы полученияРеакции элиминирования
При элиминировании моногалогенопроизводных и
спиртов
процесс протекает в соответствии с правилом
Зайцева:
предпочтительным является образование алкена с
наибольшим числом заместителей.
27.
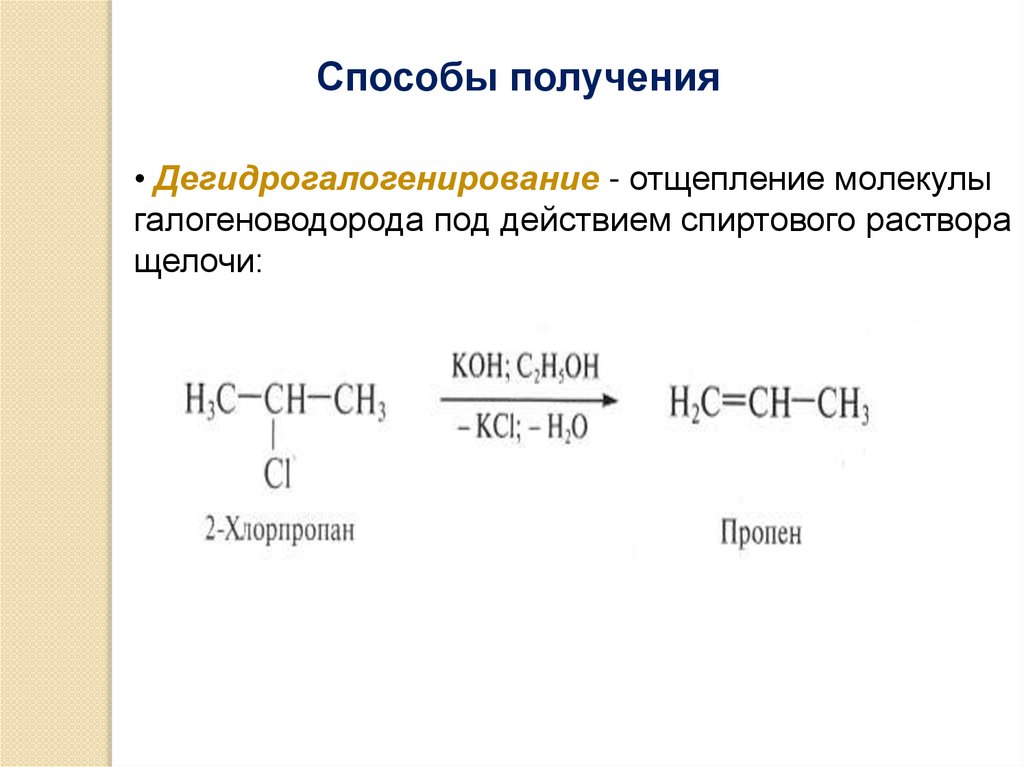
Способы получения• Дегидрогалогенирование - отщепление молекулы
галогеноводорода под действием спиртового раствора
щелочи:
28.
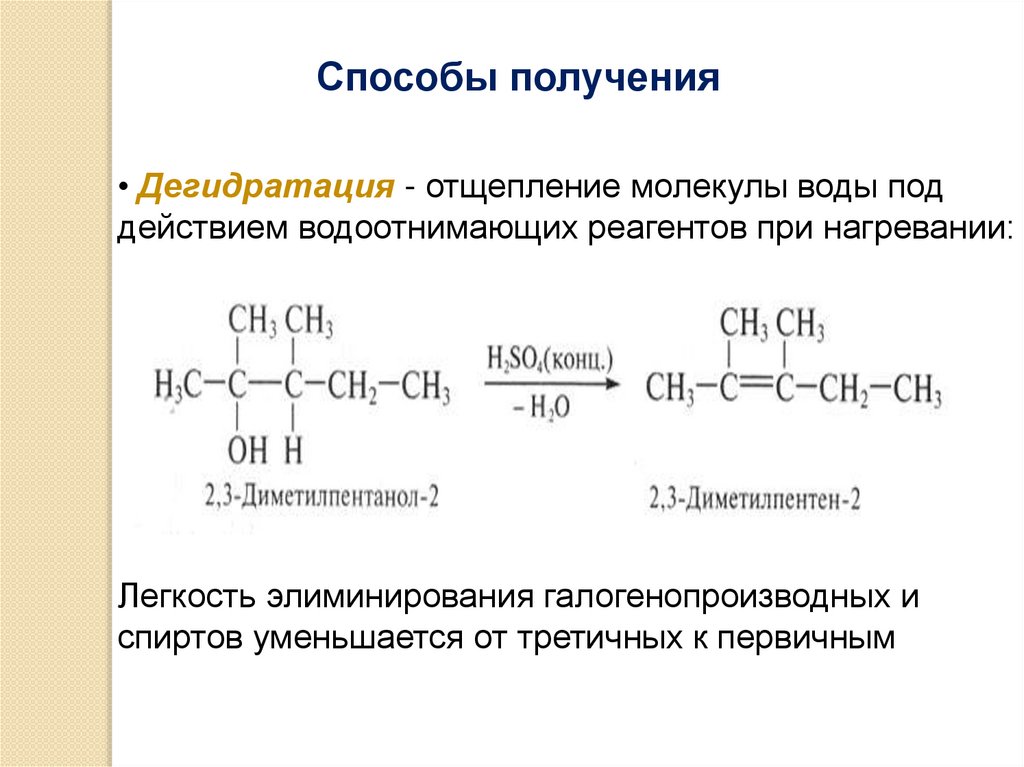
Способы получения• Дегидратация - отщепление молекулы воды под
действием водоотнимающих реагентов при нагревании:
Легкость элиминирования галогенопроизводных и
спиртов уменьшается от третичных к первичным
29.
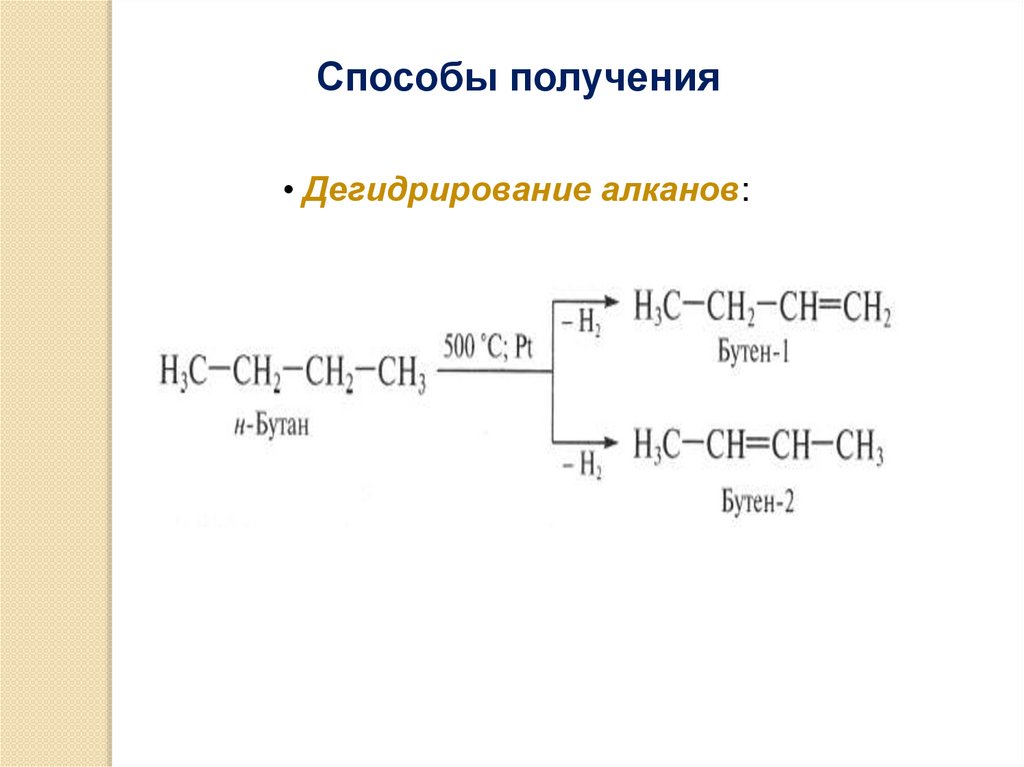
Способы получения• Дегидрирование алканов:
30.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКЕНОВНизшие гомологи алкенов - газы при обычных
условиях,
начиная с углеводорода С5Н10 - низкокипящие
жидкости
Алкены , как и алканы , практически нерастворимы в
воде,
растворимы в неполярных органических
растворителях.
31.
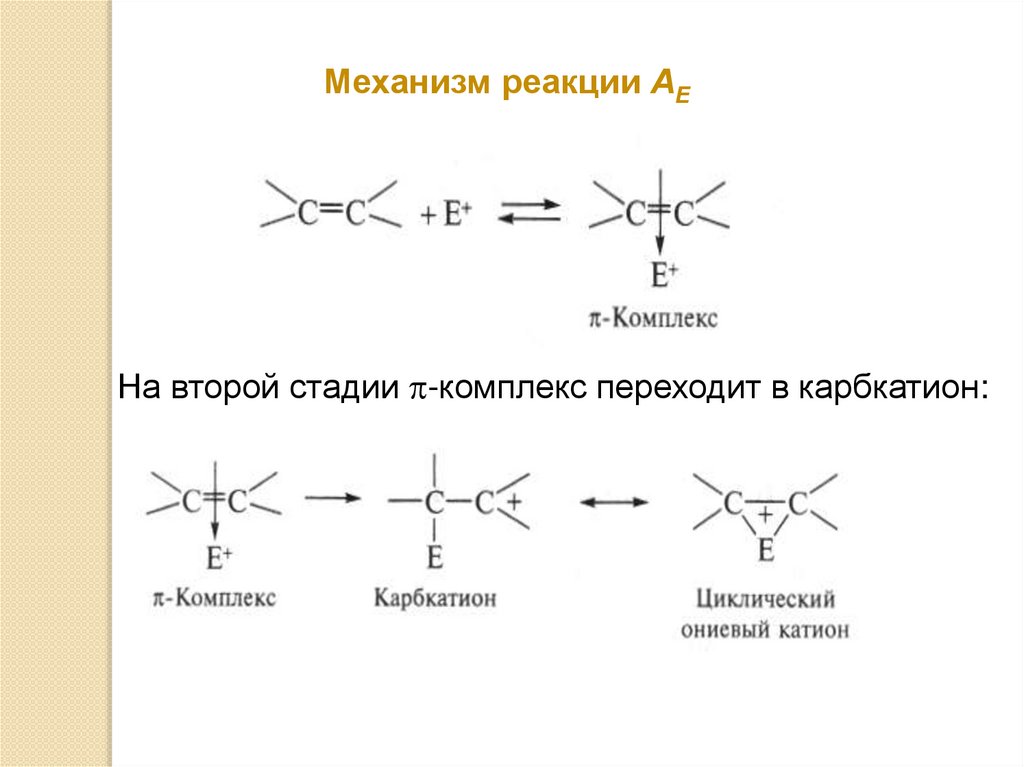
Механизм реакции АЕНа второй стадии -комплекс переходит в карбкатион:
32.
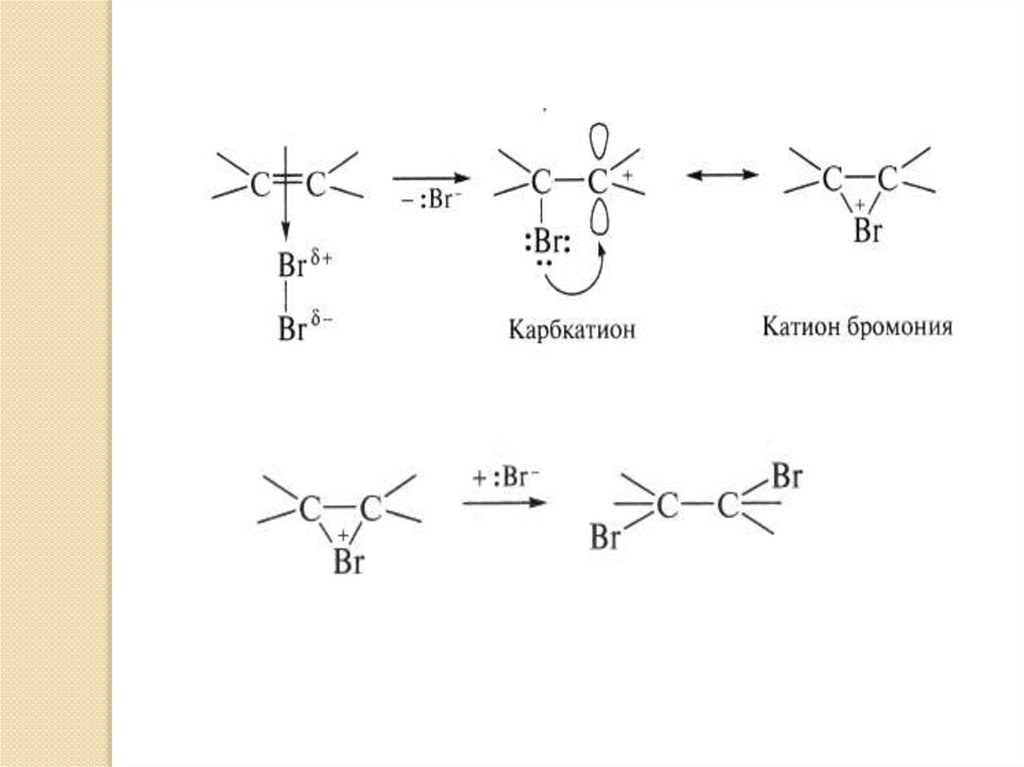
Механизм реакции АЕНа последней третьей стадии нуклеофильная частица
Nu- присоединяется к карбкатиону с образованием
конечного продукта реакции:
По данному механизму протекают реакции
галогенирования, гидрогалогенирования, гидратации,
присоединения серной кислоты
33.
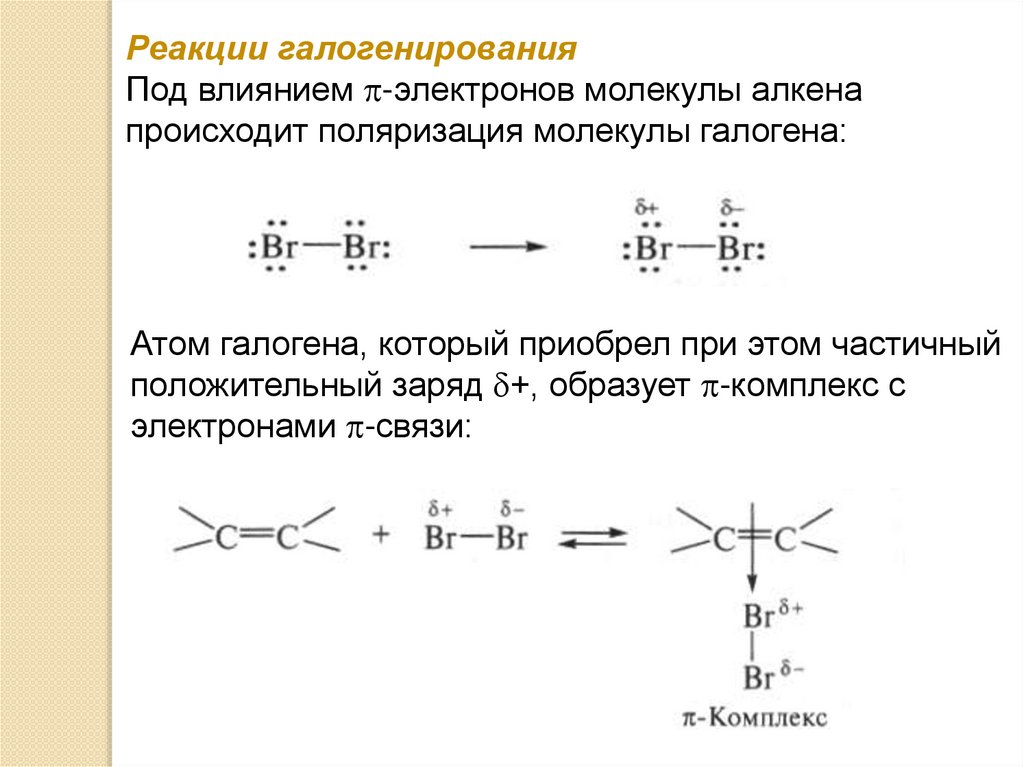
Реакции галогенированияПод влиянием -электронов молекулы алкена
происходит поляризация молекулы галогена:
Атом галогена, который приобрел при этом частичный
положительный заряд +, образует -комплекс с
электронами -связи:
34.
35.
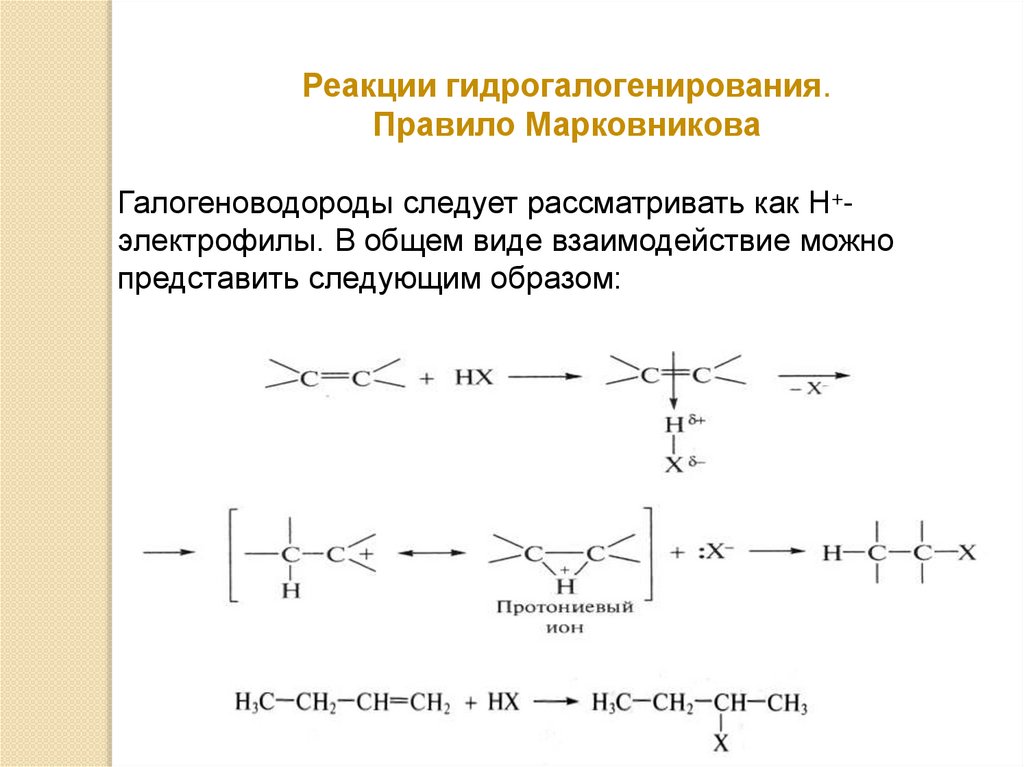
Реакции гидрогалогенирования.Правило Марковникова
Галогеноводороды следует рассматривать как Н+электрофилы. В общем виде взаимодействие можно
представить следующим образом:
36.
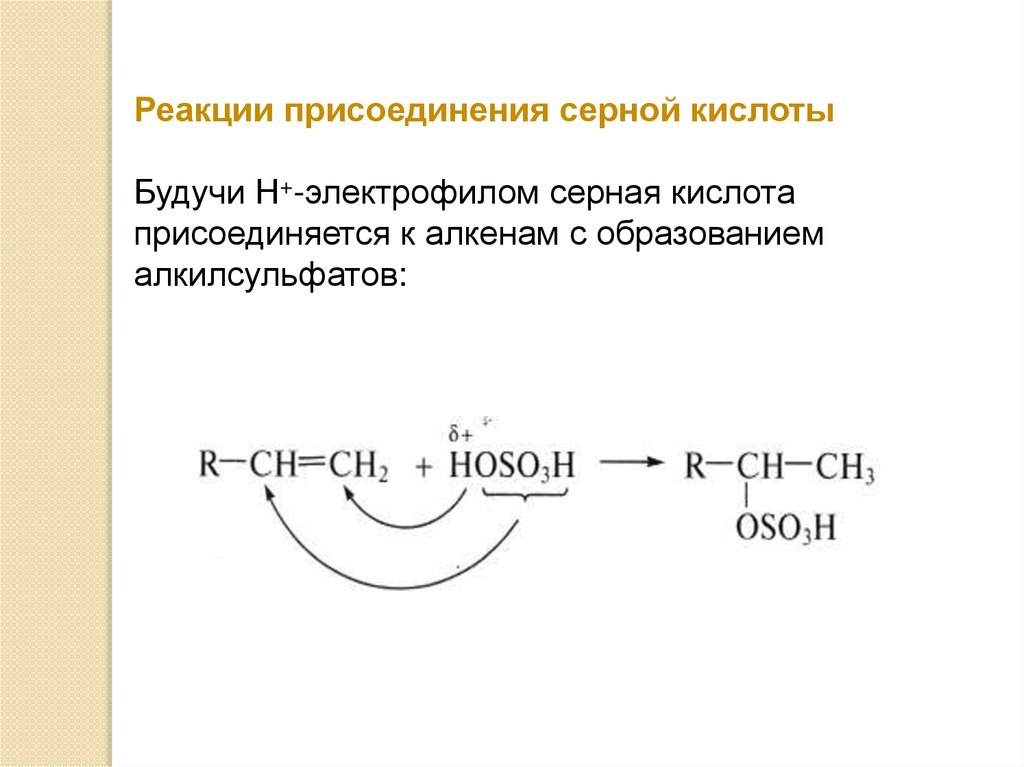
Реакции присоединения серной кислотыБудучи Н+-электрофилом серная кислота
присоединяется к алкенам с образованием
алкилсульфатов:
37.
Реакции гидратации (присоединения воды)Данные реакции относятся к кислотно-катализируемым
процессам, поскольку без катализатора алкены с водой
не реагируют.
При взаимодействии алкена с водным раствором
кислоты,
например серной, образуется спирт.
Направление гидратации алкенов также определяется
правилом Марковникова:
38.
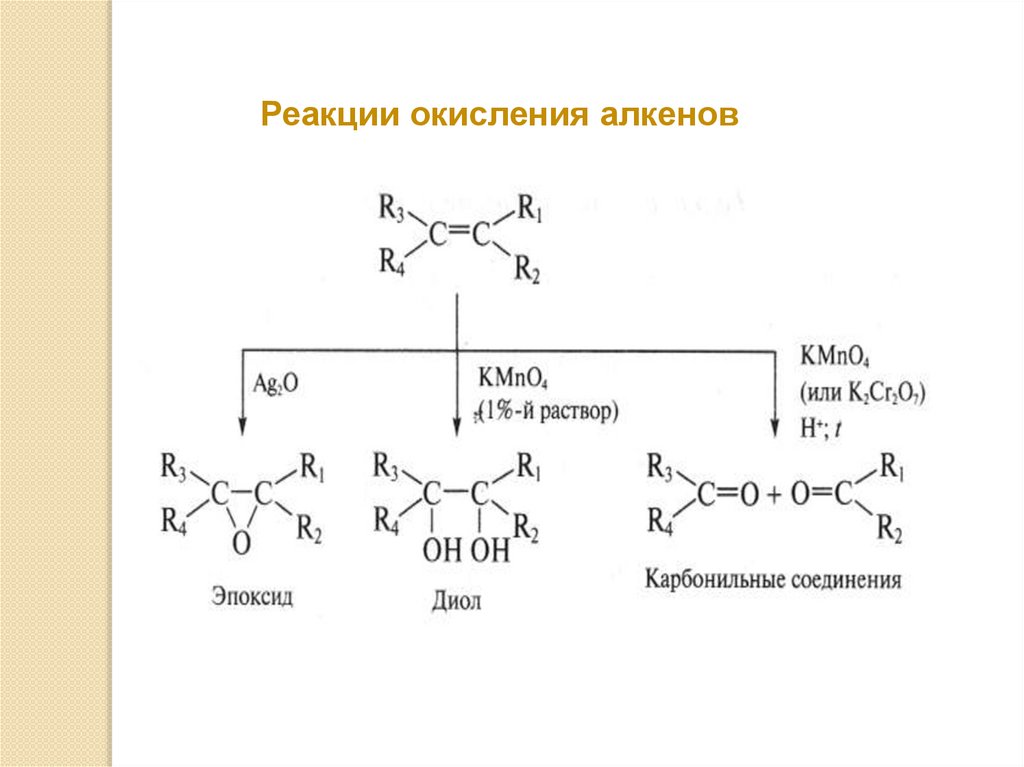
Реакции окисления алкенов39.
Реакции окисления перманганатом калияРазбавленный ( 1%) раствор перманганата калия в
слабощелочной или близкой к нейтральной среде
окисляет алкены до вицинальных диолов:
40.
Реакции окисления перманганатом калияКонцентрированный раствор перманганата калия
(или дихромата калия) в кислотной среде вызывает
окислительную деструкцию по положению двойной
связи.
В этом случае образуются карбонильные
соединения:
41.
Алкадиены.Способы получения алкадиенов
• из бутан-бутеновой фракции переработки нефти
путем каталитического дегидрирования:
42.
Способы получения алкадиенов• из винилацетилена:
• по способу С. В. Лебедева
43.
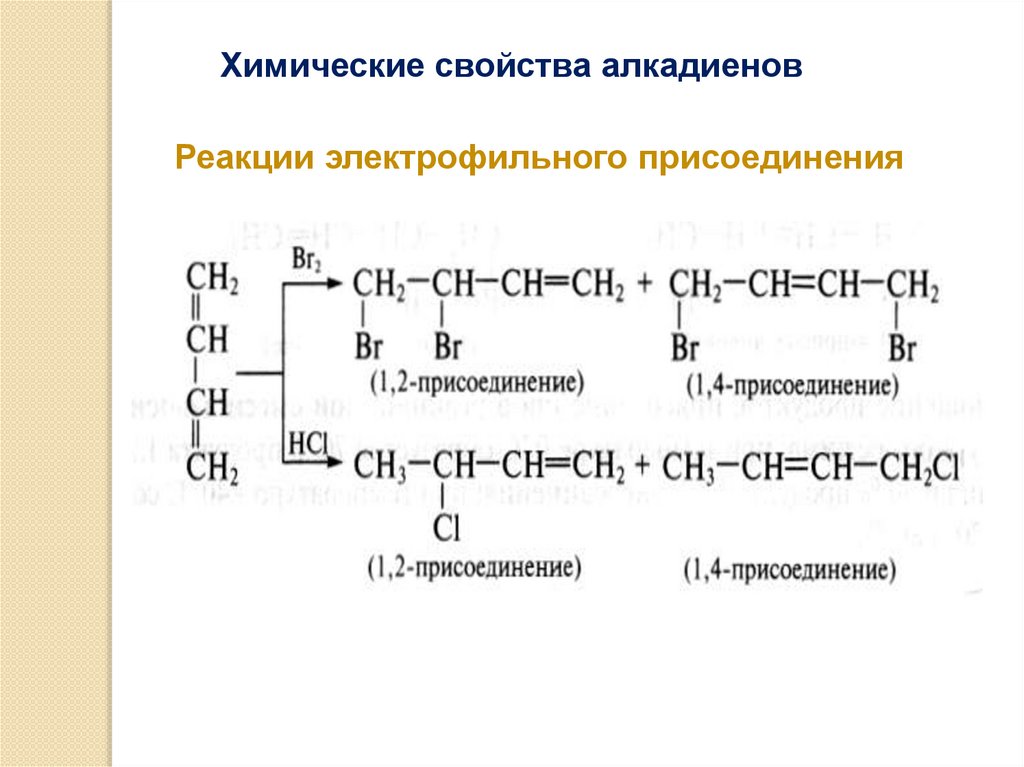
Химические свойства алкадиеновРеакции электрофильного присоединения
44.
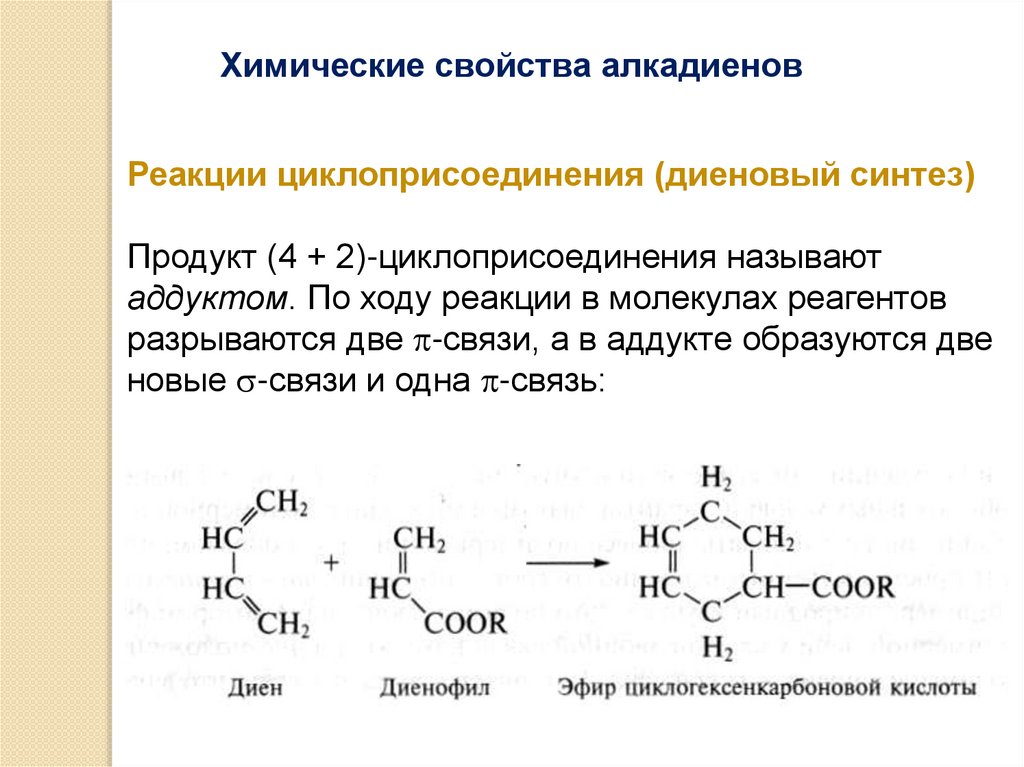
Химические свойства алкадиеновРеакции циклоприсоединения (диеновый синтез)
Продукт (4 + 2)-циклоприсоединения называют
аддуктом. По ходу реакции в молекулах реагентов
разрываются две -связи, а в аддукте образуются две
новые -связи и одна -связь:
45.
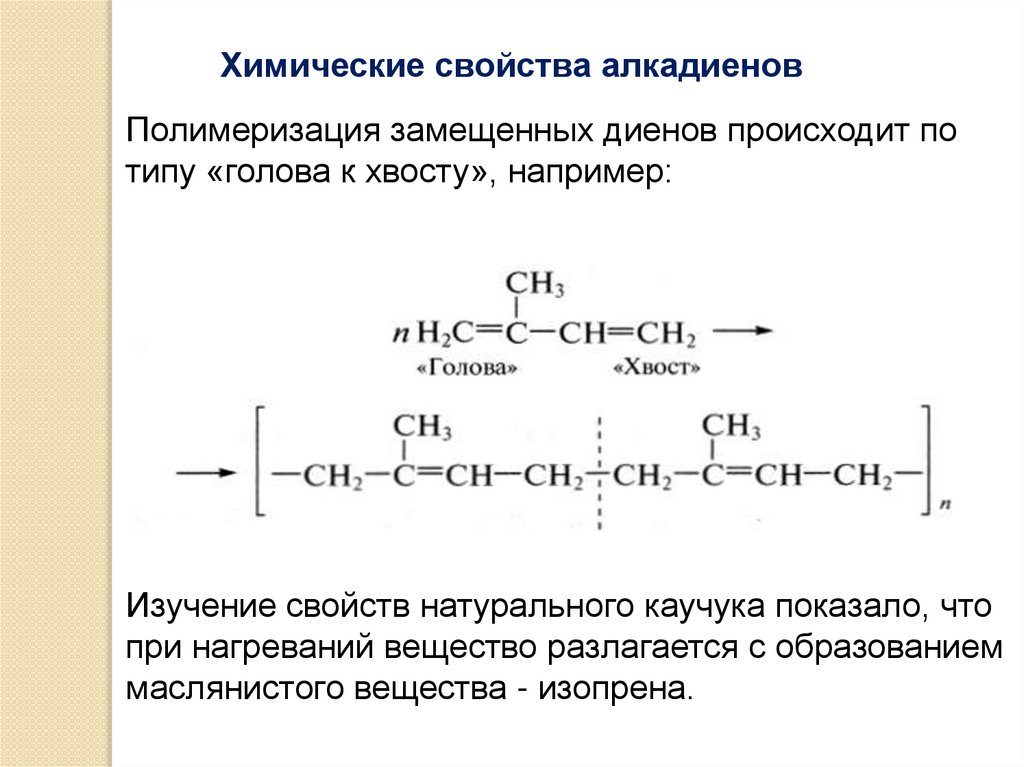
Химические свойства алкадиеновПолимеризация замещенных диенов происходит по
типу «голова к хвосту», например:
Изучение свойств натурального каучука показало, что
при нагреваний вещество разлагается с образованием
маслянистого вещества - изопрена.
46.
АЛКИНЫАлкины (ацетиленовые углеводороды ) - это
углеводороды с незамкнутыми (открытыми)
углеродными цепями, в молекулах которых
содержится одна тройная углерод-углеродная связь.
47.
Способы получения алкиновРассмотрим способы получения алкинов на
примере ацетилена
1. Гидролиз карбида кальция:
2. Пиролиз метана:
3. Пиролиз этана (или этилена):
48.
Способы получения алкинов4. Реакция элиминирования действием спиртовых
растворов щелочей на дигалогенопроизводные
углеводородов, в которых оба атома галогена находятся
при одном атоме углерода (геминальное положение)
или у двух соседних атомов углерода (вицинальное
положение):
49.
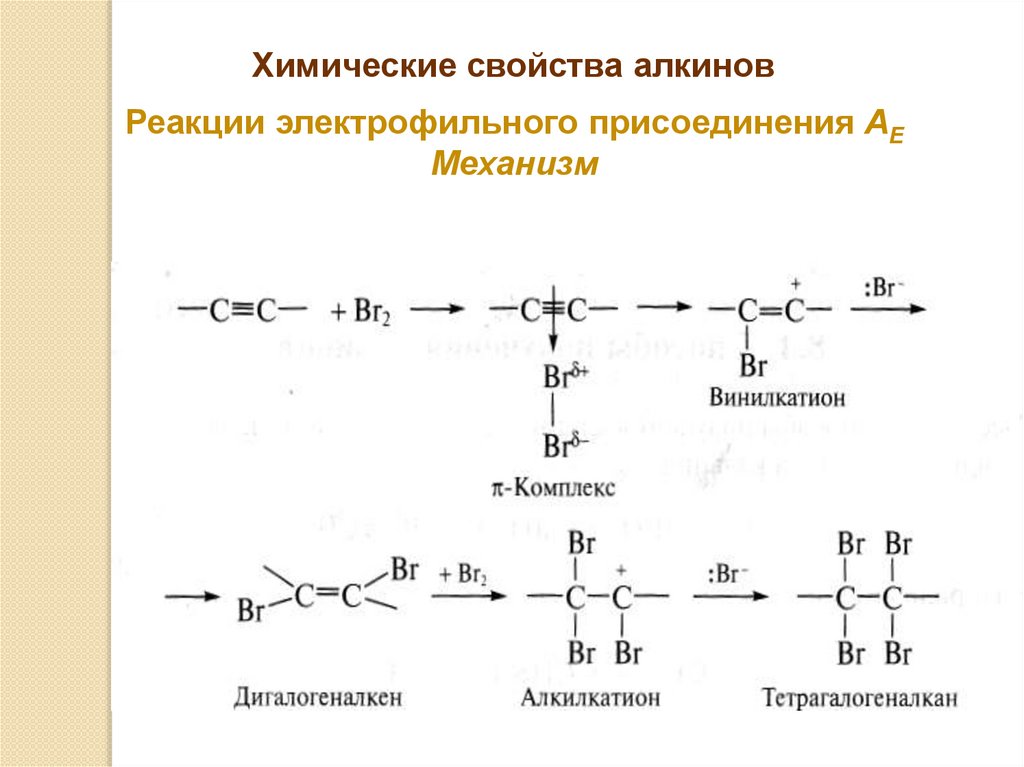
Химические свойства алкиновРеакции электрофильного присоединения АЕ
Механизм
50.
Химические свойства алкиновПрисоединение галогеноводородов и других молекул
типа НХ к алкинам происходит в соответствии с
правилом Марковникова:
51.
Химические свойства алкиновРеакции присоединения спиртов
В присутствии солей ртути(II) или меди(II), а также
гидроксидов щелочных металлов ацетилен и его
гомологи присоединяют спирты с образованием
алкилвиниловых эфиров:
52.
Химические свойства алкиновПрисоединение уксусной кислоты к ацетилену
приводит к образованию винилацетата - исходного
мономера для получения поливинилацетата:
Реакции присоединения синильной кислоты
Из ацетилена путем присоединения молекулы HCN
можно получить акрилонитрил, который широко
используют в синтезе каучуков и других полимеров:
53.
Кислотные свойства алкиновРеакции с образованием ацетиленидов
Свойство органических молекул высвобождать
ионы водорода Н+ за счет гетеролитического
расщепления связи С-Н называют СНкислотностью
54.
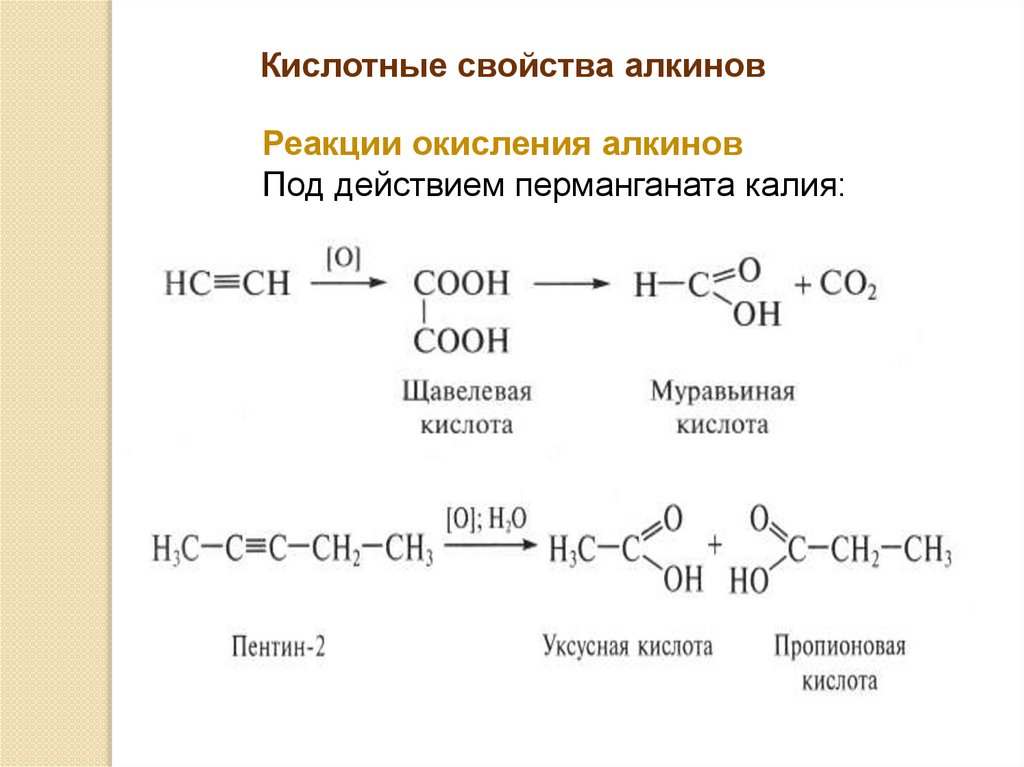
Кислотные свойства алкиновРеакции окисления алкинов
Под действием перманганата калия:
55.
Кислотные свойства алкиновРеакции димеризации и циклоолигомеризации
Винилацетилен широко используют при синтезе
каучуков
56.
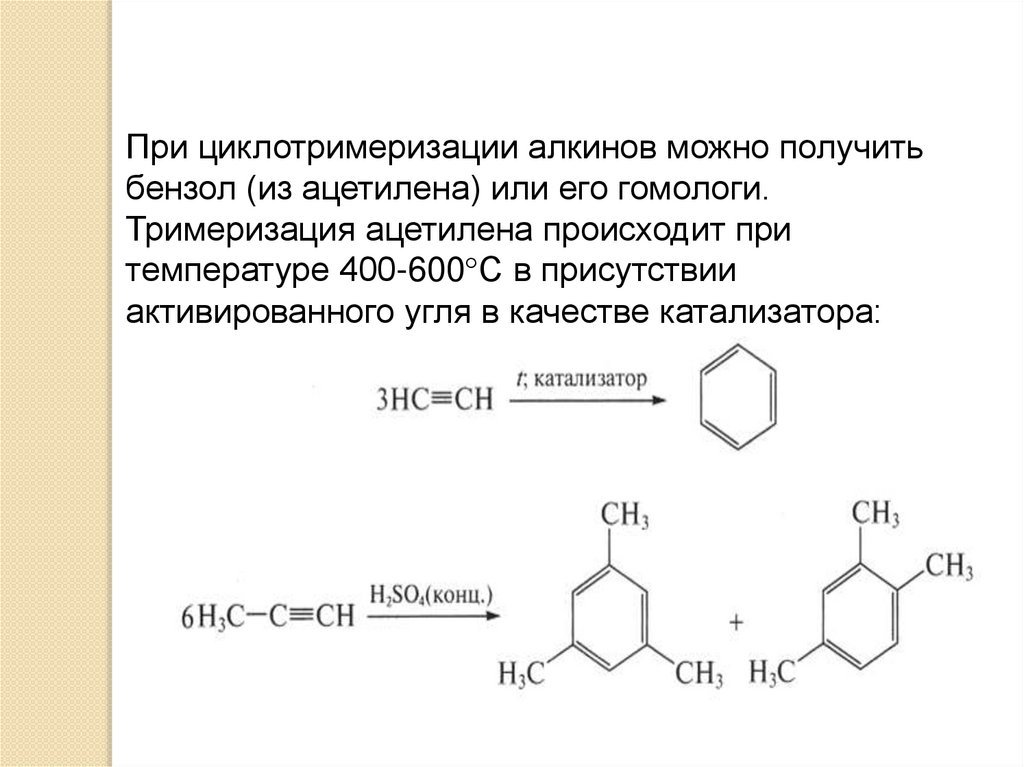
При циклотримеризации алкинов можно получитьбензол (из ацетилена) или его гомологи.
Тримеризация ацетилена происходит при
температуре 400-600°С в присутствии
активированного угля в качестве катализатора:
57.
АРЕНЫАрены (ароматические углеводороды) циклические углеводороды, характеризующиеся
бензоидной (бензольной) системой связей и
обладающие совокупностью свойств,
объединяемых общим понятием
«ароматичность»
Общая формула аренов – СnН2n-6 (n 6).
58.
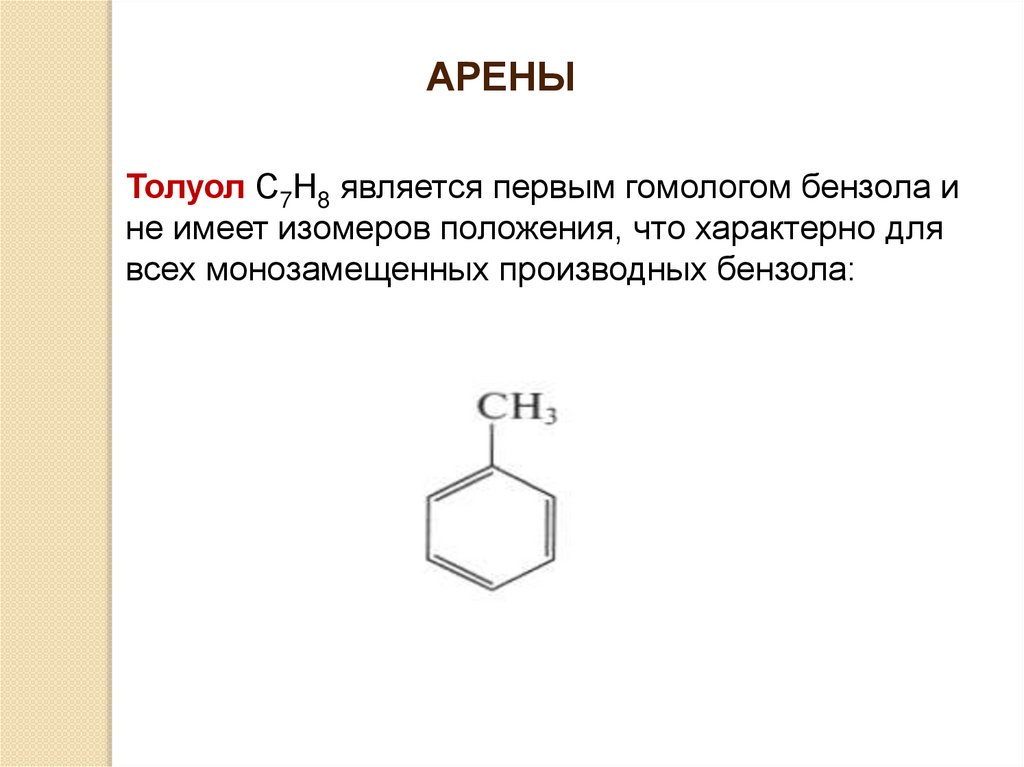
АРЕНЫТолуол С7Н8 является первым гомологом бензола и
не имеет изомеров положения, что характерно для
всех монозамещенных производных бензола:
59.
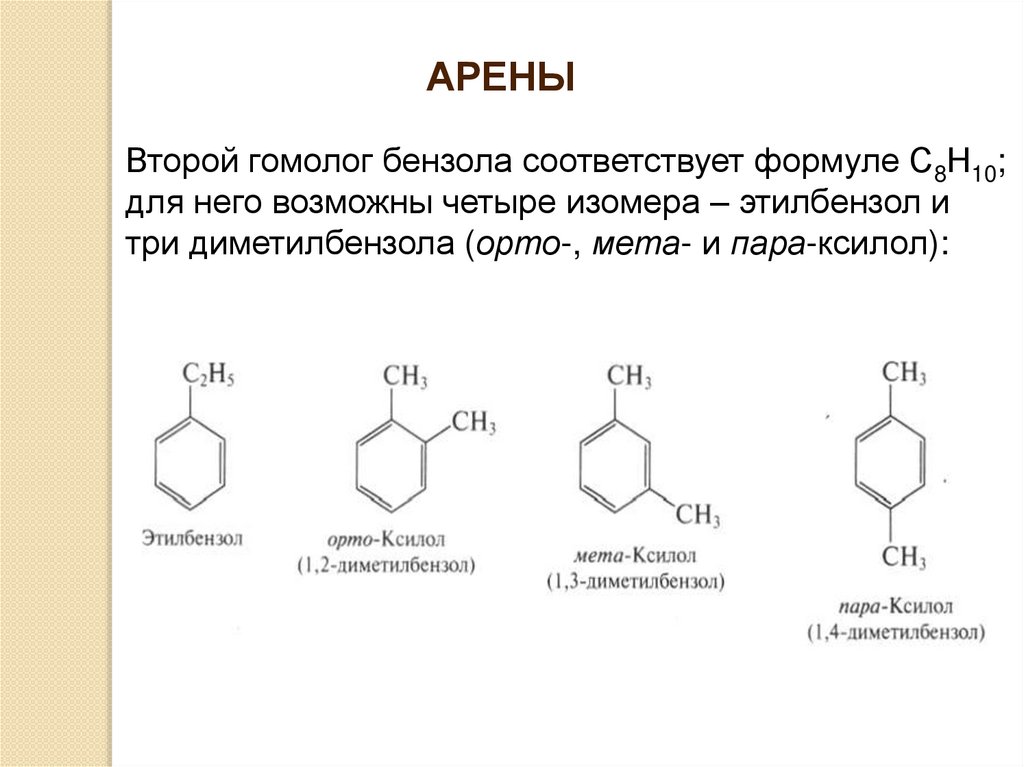
АРЕНЫВторой гомолог бензола соответствует формуле С8Н10;
для него возможны четыре изомера – этилбензол и
три диметилбензола (орто-, мета- и пара-ксилол):
60.
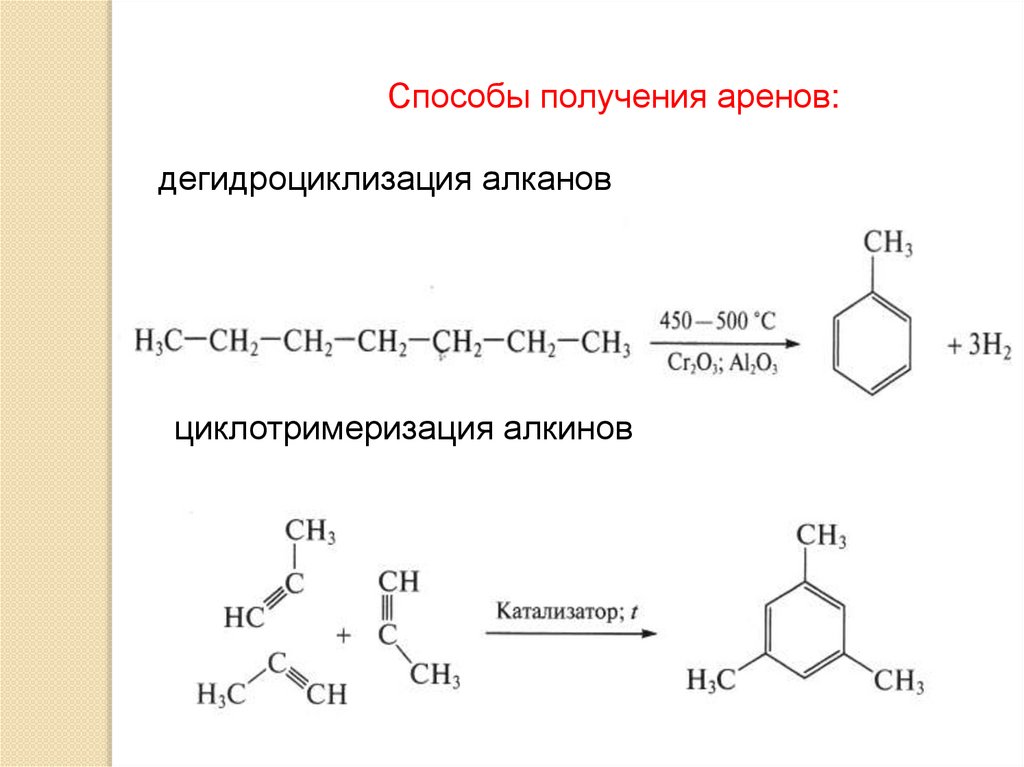
Способы получения аренов:дегидроциклизация алканов
циклотримеризация алкинов
61.
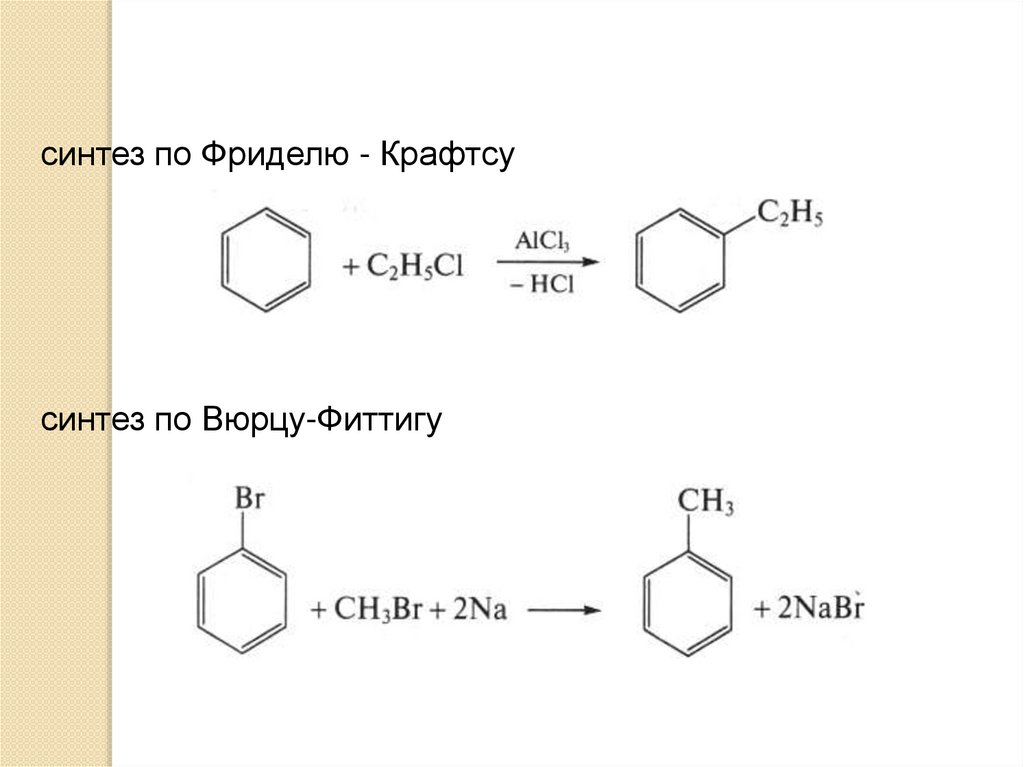
синтез по Фриделю - Крафтсусинтез по Вюрцу-Фиттигу
62.
Физические свойства ареновНизшие члены гомологического ряда аренов в
обычных условиях - бесцветные жидкости с
характерным запахом
Они не смешиваются с водой, но легко смешиваются
с неполярными органическими растворителями
Температуры кипения изомерньх соединений
отличаются не существенно:
орто-изомеры обычно кипят при более высокой
температуре, чем пара-изомеры.
63.
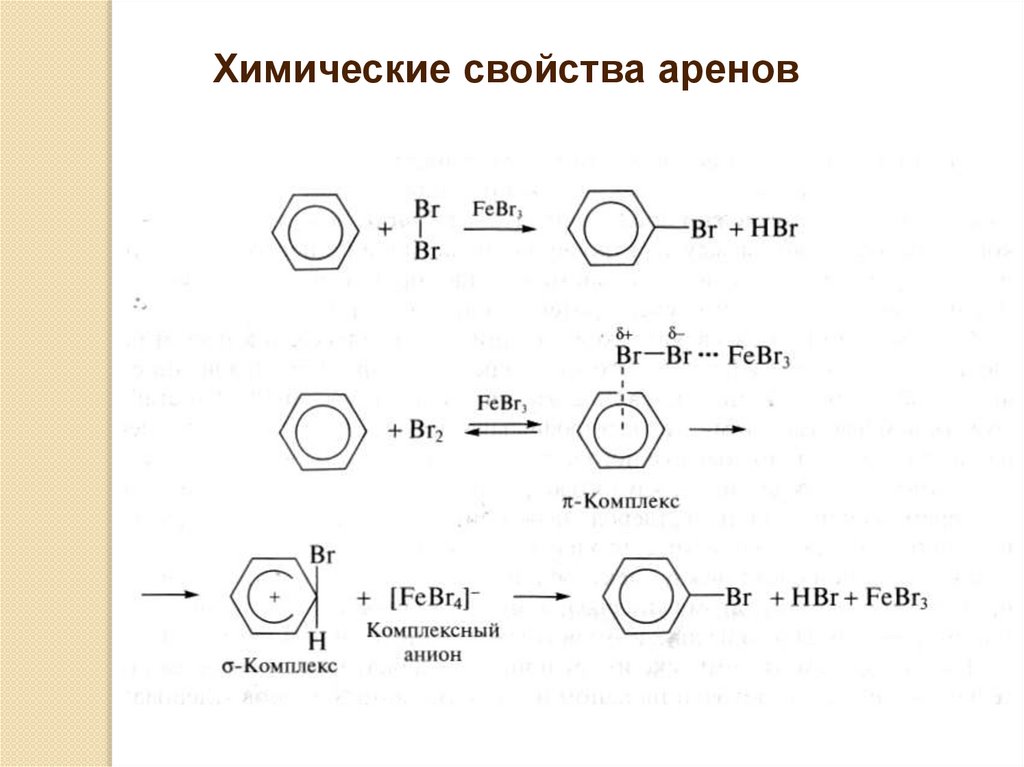
Химические свойства ареновРеакции электрофильного замещения SE
Реакции галогенирования
Галогенирование осуществляется в присутствии
катализаторов, роль которых сводится к
поляризации молекулы галогена с последующим
образованием электрофильной частицы,
например Br+:
64.
Химические свойства аренов65.
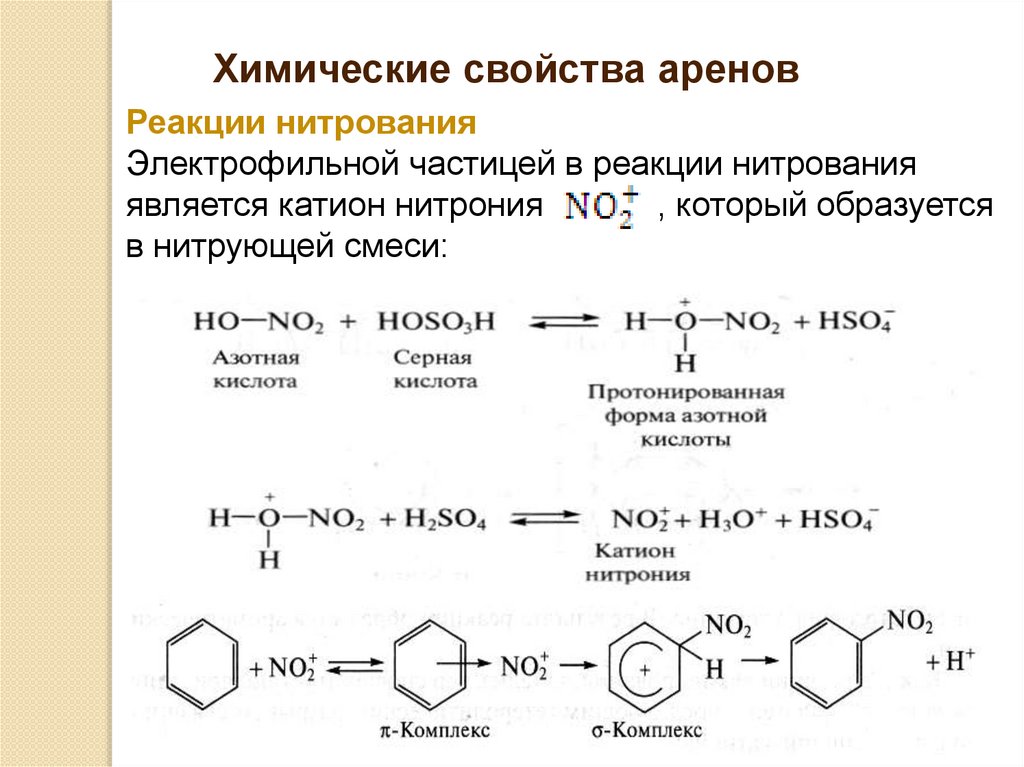
Химические свойства ареновРеакции нитрования
Электрофильной частицей в реакции нитрования
является катион нитрония
, который образуется
в нитрующей смеси:
66.
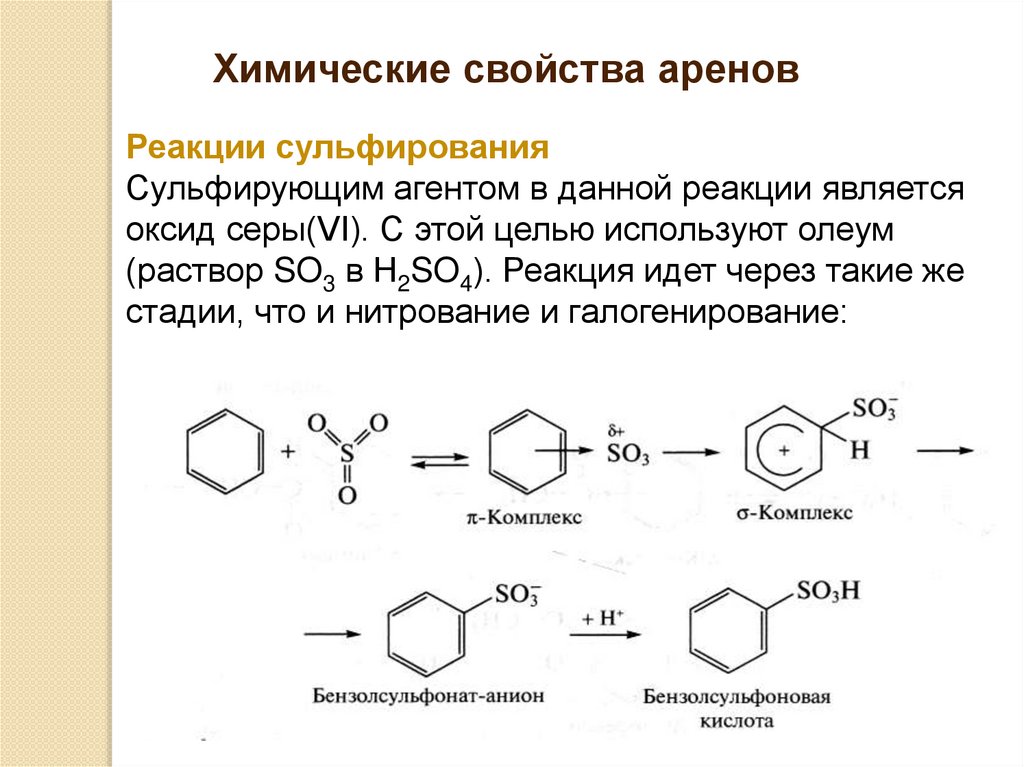
Химические свойства ареновРеакции сульфирования
Сульфирующим агентом в данной реакции является
оксид серы(VI). С этой целью используют олеум
(раствор SO3 в H2SO4). Реакция идет через такие же
стадии, что и нитрование и галогенирование:
67.
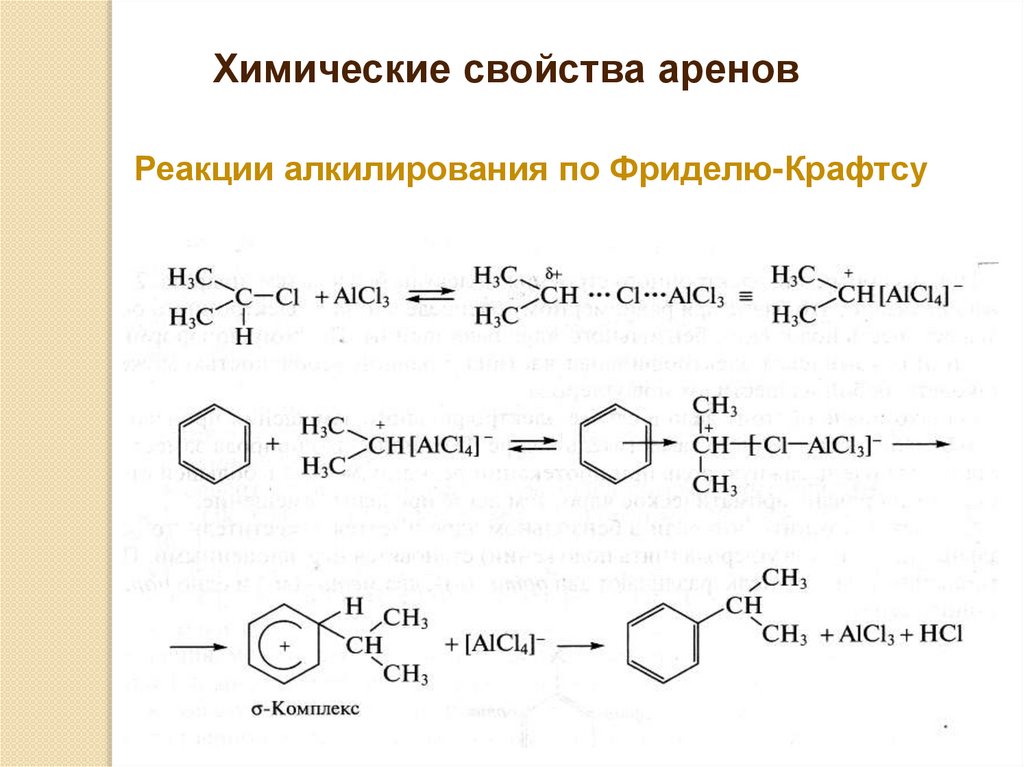
Химические свойства ареновРеакции алкилирования по Фриделю-Крафтсу
68.
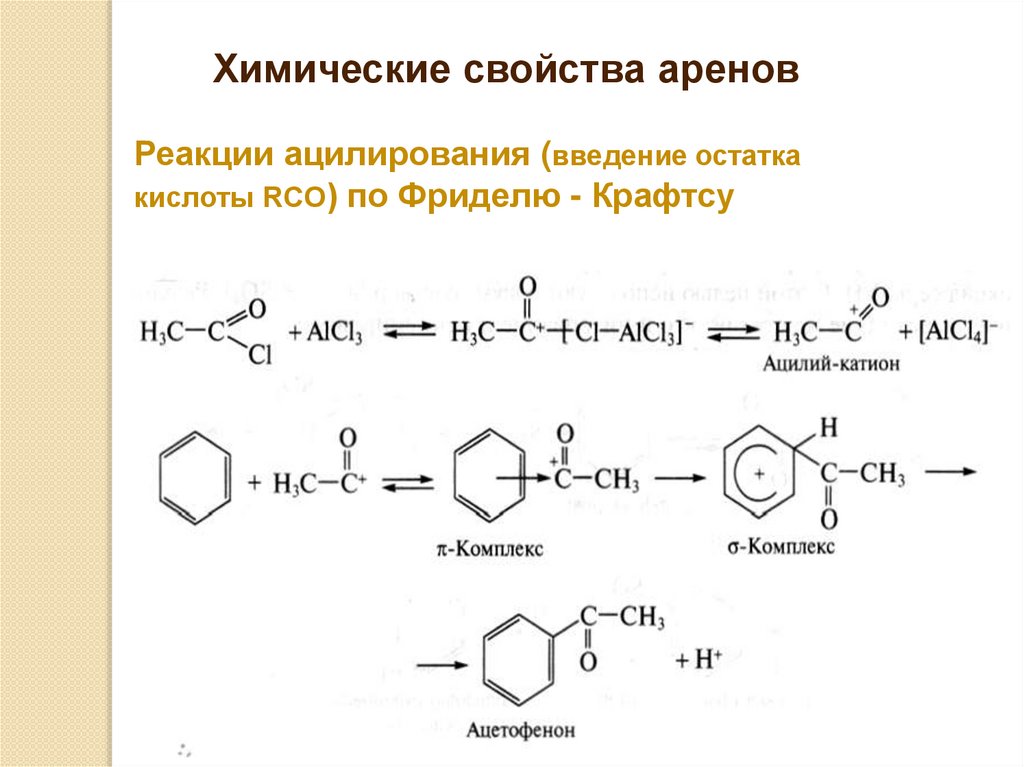
Химические свойства ареновРеакции ацилирования (введение остатка
кислоты RCO) по Фриделю - Крафтсу
69.
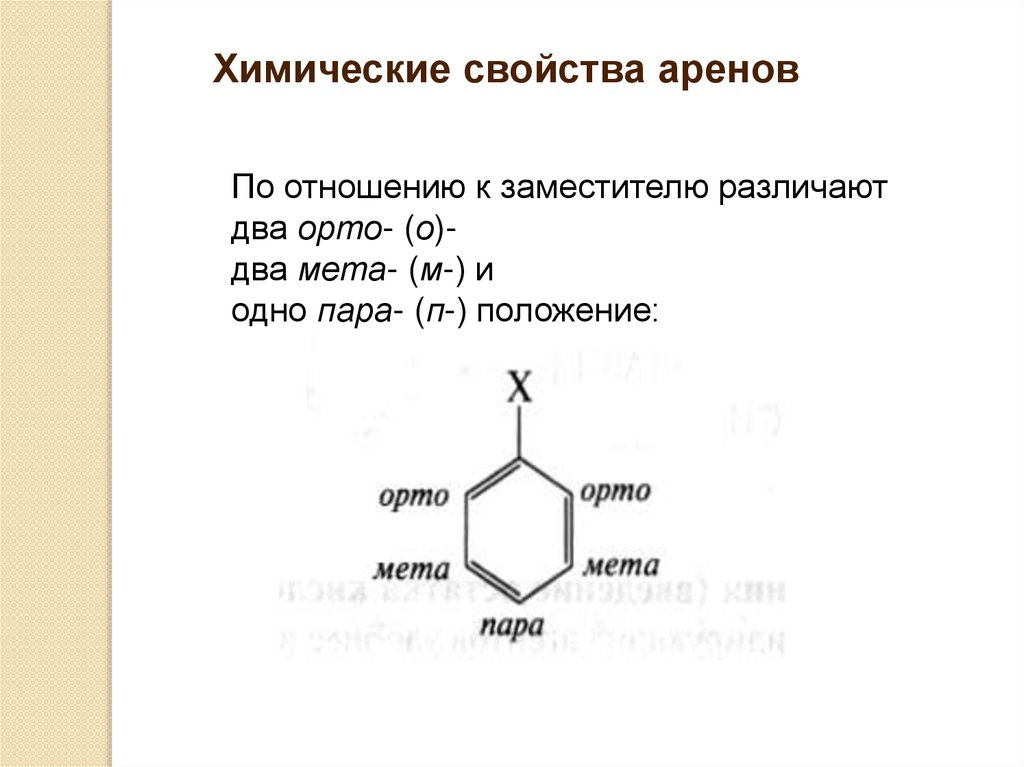
Химические свойства ареновПо отношению к заместителю различают
два орто- (о)два мета- (м-) и
одно пара- (п-) положение:
70.
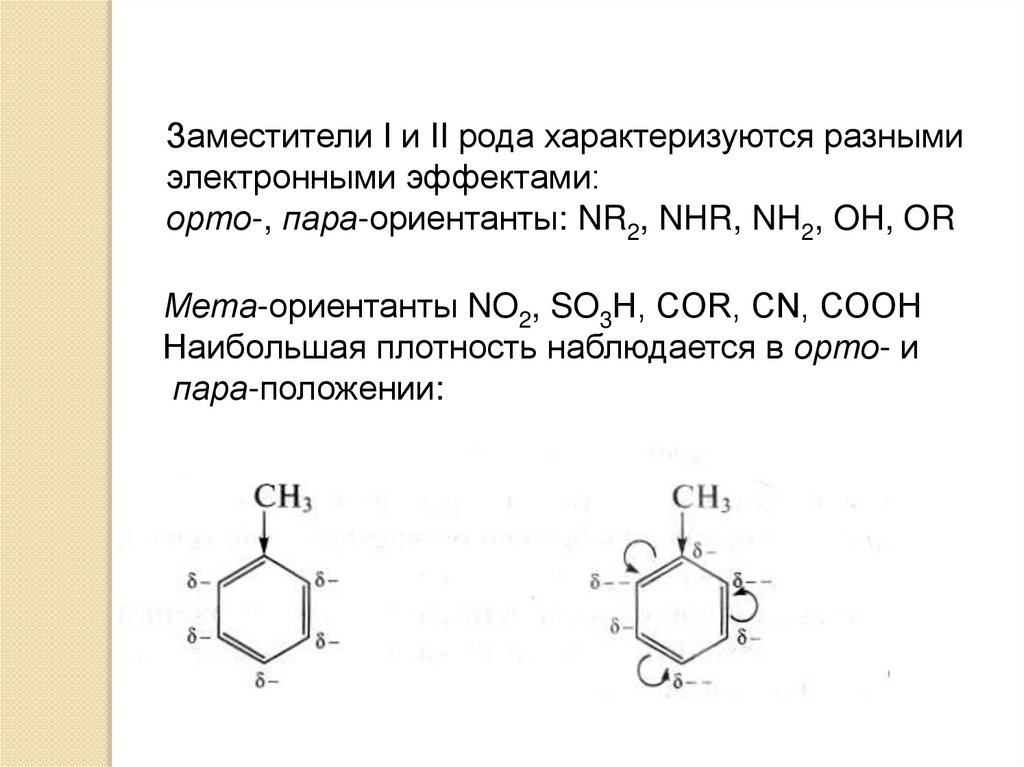
Заместители I и II рода характеризуются разнымиэлектронными эффектами:
орто-, пара-ориентанты: NR2, NHR, NH2, OH, OR
Мета-ориентанты NO2, SO3Н, COR, CN, СООН
Наибольшая плотность наблюдается в орто- и
пара-положении:
71.
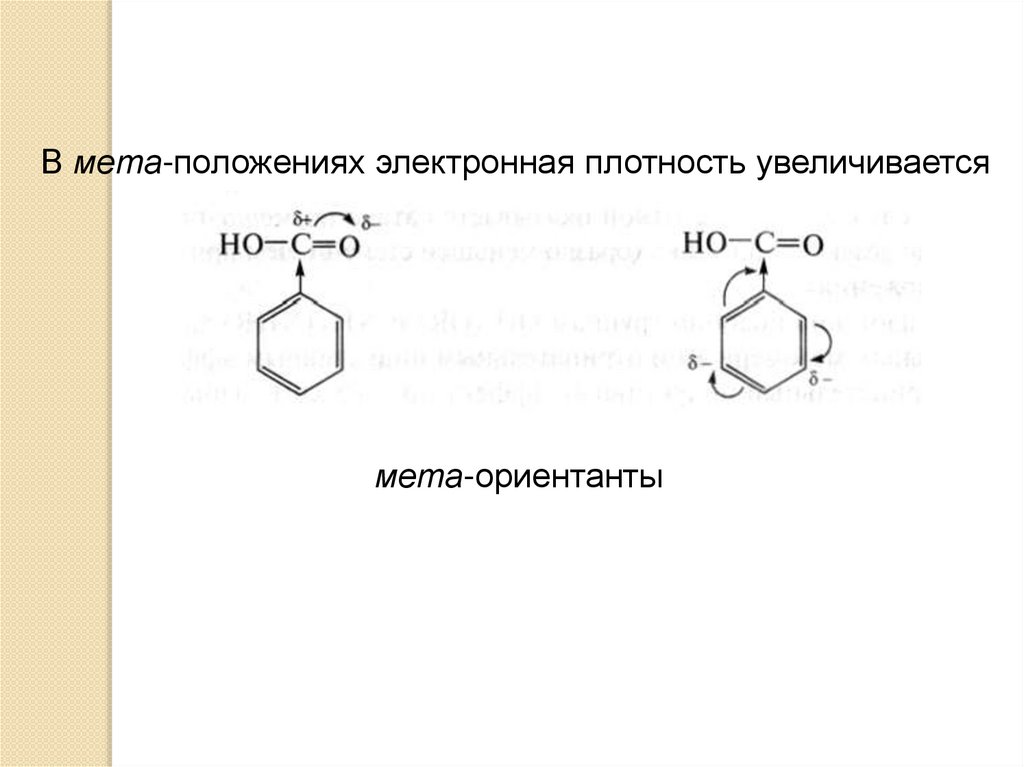
В мета-положениях электронная плотность увеличиваетсямета-ориентанты
72.
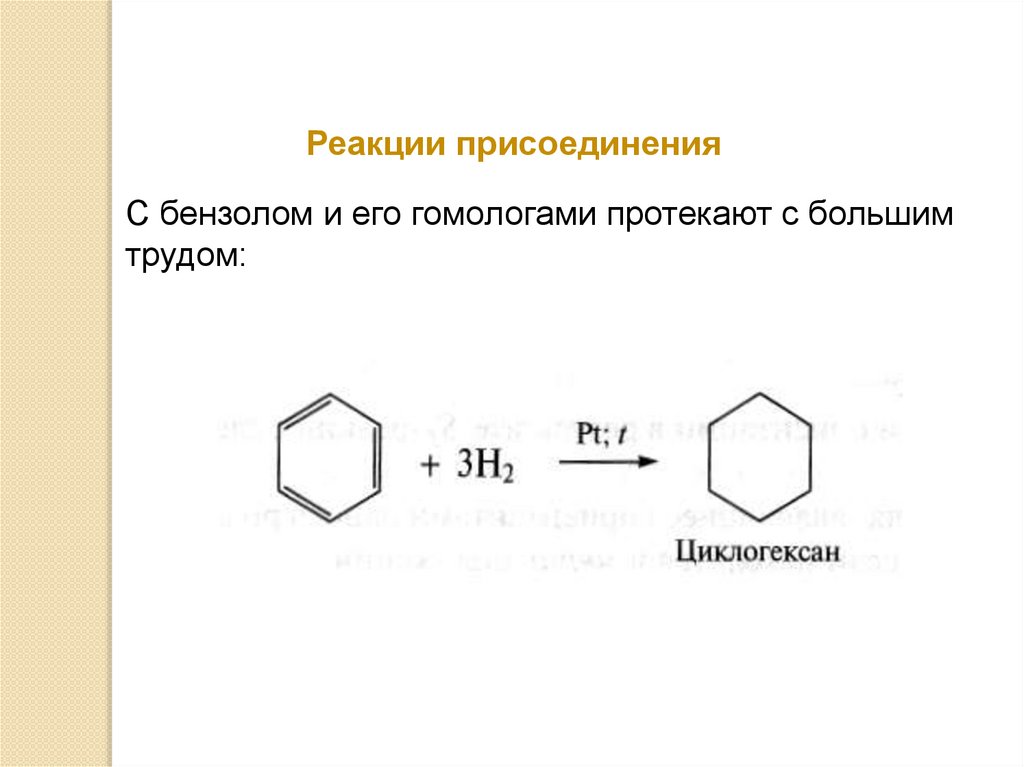
Реакции присоединенияС бензолом и его гомологами протекают с большим
трудом:
73.
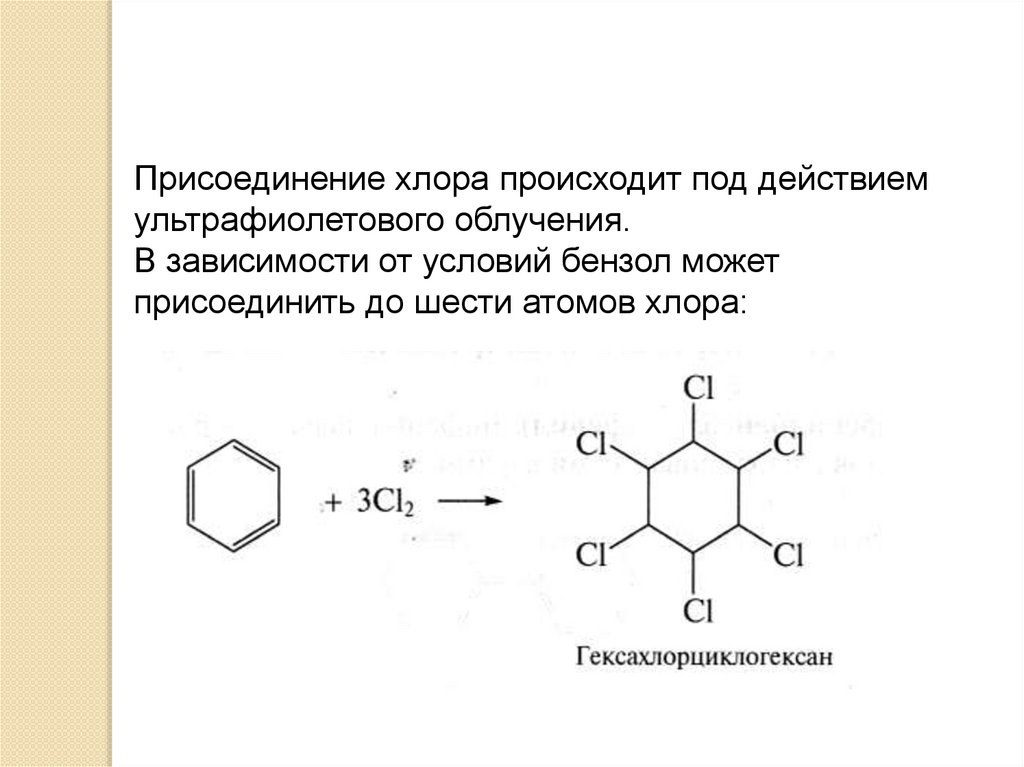
Присоединение хлора происходит под действиемультрафиолетового облучения.
В зависимости от условий бензол может
присоединить до шести атомов хлора:
74.
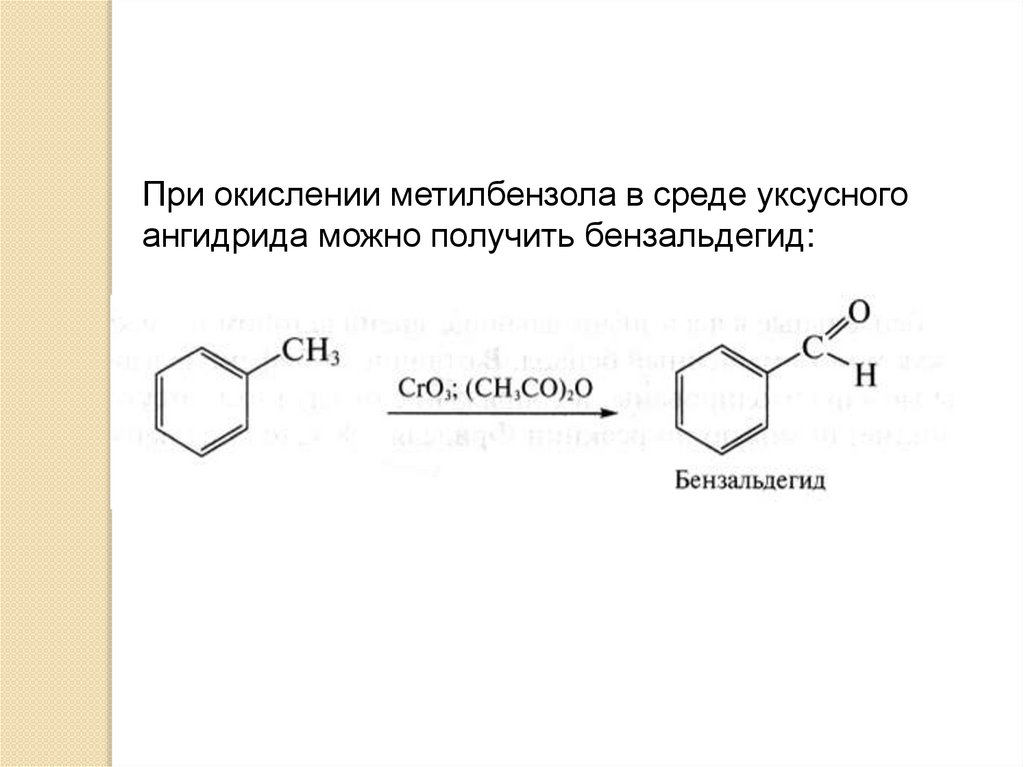
При окислении метилбензола в среде уксусногоангидрида можно получить бензальдегид:
75.
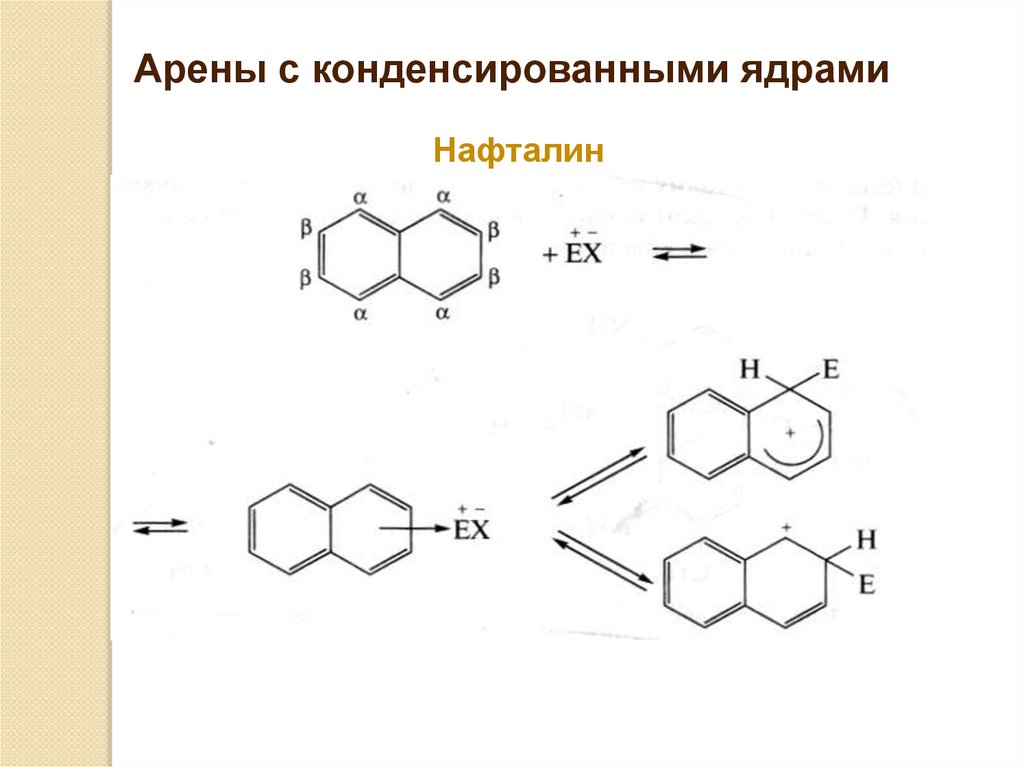
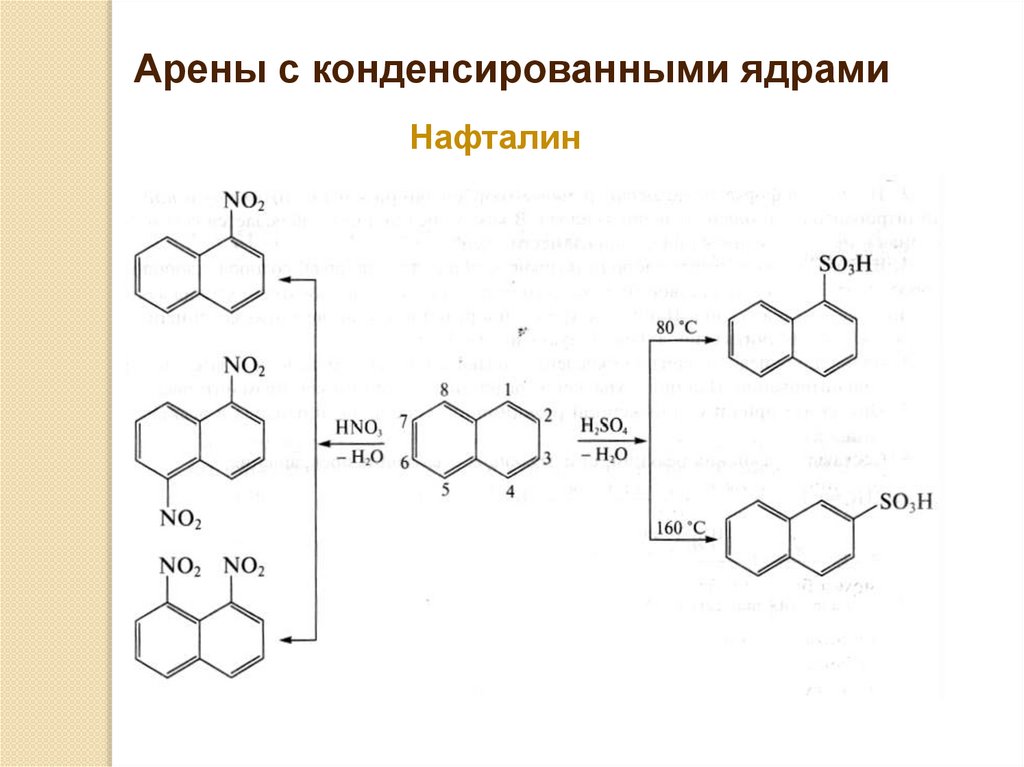
Арены с конденсированными ядрамиНафталин
76.
Арены с конденсированными ядрамиНафталин
77.
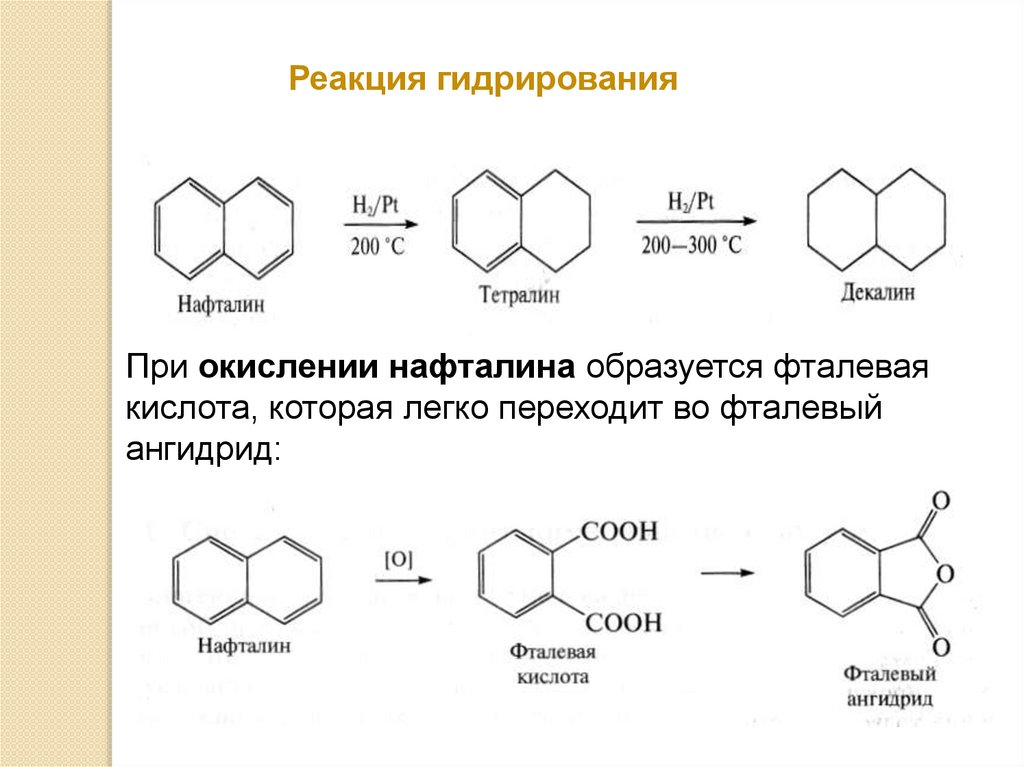
Реакция гидрированияПри окислении нафталина образуется фталевая
кислота, которая легко переходит во фталевый
ангидрид:




































 Химия
Химия








