Похожие презентации:
Классификация органических реакций и реагентов. Реакционная способность предельных органических соединений
1.
Мы учим и лечимс 1888 года
Классификация органических реакций и реагентов.
Реакционная способность предельных органических соединений
Чешкова Т.В.
Доцент кафедры химии
к.х.н.
2.
Химические реакцииОсобенности протекания органических реакций: - в органических реакциях
чаще всего принимают участие молекулы; - органические реакции протекают гораздо
медленнее
и
для
их
ускорения
часто
используют
катализаторы
или
создают
соответствующие условия (повышают температуру или давление);
- выход конечного продукта обычно невысок (50-80%), так как в процессе его получения
идет не одна реакция, а несколько, которые называют побочными. Поэтому органическую
реакцию записывают не в виде химического уравнения (с приведением стехиометрических
соотношений реагирующих веществ), а ее схему, которая показывает только исходные
вещества и основной продукт реакции, а так же условия проведения реакции. В этом
случае
вместо
знака
равенства
используют
стрелку
,
указывающую
направление
превращения веществ.
Все органические реакции классифицируют или по характеру
химических превращений или по механизмам их протекания.
2
3.
Химические реакции. Классификация реакцийСубстрат - молекула, которая предоставляет атом углерода для новой связи
Реагент — вещество, действующее на объект — субстрат — и вызывающее в нем изменение
химической связи.
Типы разрыва ковалентной связи
В химических реакциях эти частицы
выполняют функции «нуклеофилов»
(«фил»
—
от
гр.
любить)
и
«электрофилов», образуя химическую
связь с партнером по реакции по
донорно-акцепторному механизму.
Нуклеофил
—
электроноизбыточный
химический
реагент,
способный
взаимодействовать
с
электронодефицитными соединениями.
Нуклеофил Nu и электрофил E
Радикалы R
При гетеролитическом разрыве ковалентной связи образуются ионы, при гомолитическом
образуются радикалы – частицы с неспаренными электронами.
3
4.
1. Классификация органических реакций по типу частиц,участвующих в реакции.
1. 1. Радикальные реакции протекают с участием радикалов (например, радикальное замещение SR,
радикальное присоединение AR)
1.2. Электрофильные реакции протекают с участием электрофилов. (например, электрофильное
замещение SE, электрофильное присоединение AE). Электрофилы - ("любящие электроны") – это
частицы (катионы или молекулы), имеющие свободную орбиталь, на которую они могут принимать
электроны (практически “электрофил” это синоним кислоты Льюиса). Примеры электрофилов: H+, Br+,
Cl+, NO2+ (катион нитрония), карбокатионы, Br2, Cl2, SO3 и т.д.
1.3. Нуклеофильные реакции протекают с участием нуклеофилов (например, нуклеофильное
замещение SE, нуклеофильное присоединение AE)
Нуклеофил (лат. nucleus – ядро (а оно положительно заряжено!), греч. любить) – частица, имеющая
отрицательный заряд или подвижную электронную пару. Фактически нуклеофилы являются
основаниями Льюиса.
Примеры нуклеофилов: H-, F-, Cl-, Br-, I-, OH-, CH3O-, H2O, спирты, NH3, амины и т.д.
1.4. “Без механизма”. Реакции, протекающие без образования и участия радикалов или ионов.
Например, реакция Дильса-Альдера:
4
5.
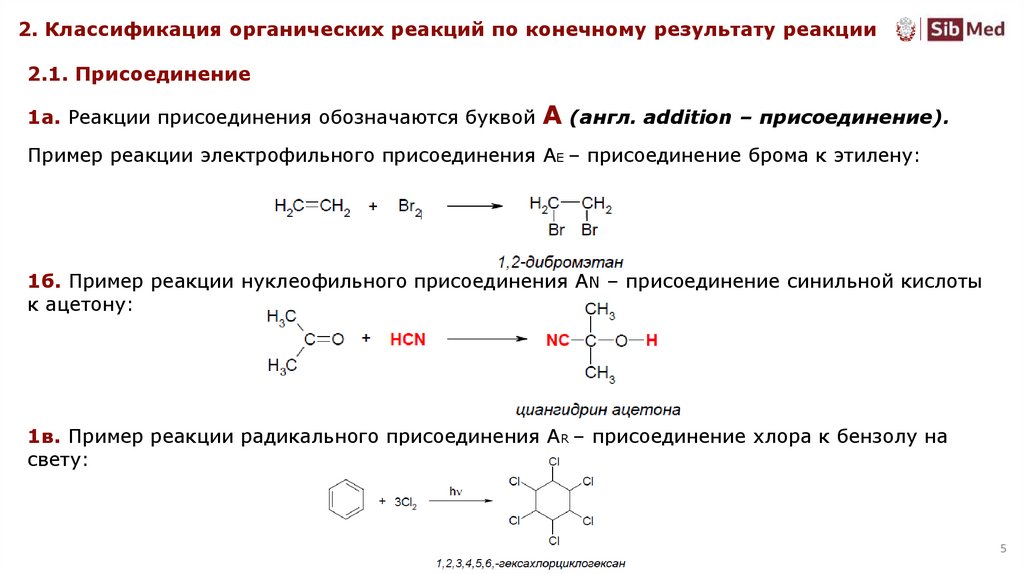
2. Классификация органических реакций по конечному результату реакции2.1. Присоединение
1а. Реакции присоединения обозначаются буквой A (англ. addition – присоединение).
Пример реакции электрофильного присоединения AE – присоединение брома к этилену:
1б. Пример реакции нуклеофильного присоединения AN – присоединение синильной кислоты
к ацетону:
1в. Пример реакции радикального присоединения AR – присоединение хлора к бензолу на
свету:
5
6.
2. Классификация органических реакций по конечному результатуреакции
2.2. Замещение
Реакции замещения обозначаются буквой S (англ. substitution – замещение).
2а. Пример реакции радикального замещения SR – взаимодействие метана с хлором на
свету:
2б. Пример реакции электрофильного замещения SE – взаимодействие бензола с бромом в
присутствии катализатора:
2в. Пример реакции нуклеофильного замещения SE – взаимодействие бромэтана с гидроксидом
натрия в спирте:
6
7.
2. Классификация органических реакций по конечномурезультату реакции
2.3. Элиминирование (отщепление)
Реакции элиминирования обозначаются буквой E (англ. elimination – отщепление).
Реакции элиминирования обычно делятся на три типа: E1, E2, E1cb. Элиминирование обычно
приводит к образованию кратной связи2. Например, элиминирование галогеноводородов от
галогенопроизводных или воды от спиртов приводит к алкенам
7
8.
2. Классификация органических реакций по конечномурезультату реакции
2.4. Изомеризация – превращение вещества в его изомер.
Изомеризация н-пентана в изопентан (2-метилбутан) происходит при 100oС в присутствии
катализатора хлорида алюминия:
2. 5. Окислительно-восстановительные реакции (ОВ-реакции).
Это реакции сопровождающиеся изменением степени окисления атомов, входящих в состав
реагирующих
веществ,
в
результате
перемещения
электронов
от
восстановителя
к
окислителю.
Окисление – процесс перехода электронов от субстрата к окислителю.
Восстановление – процесс перехода электронов от восстановителя к субстрату.
Этот тип реакций может в себя включать вышерассмотренные типы реакций.
8
9.
2. Классификация органических реакций по конечномурезультату реакции
5. Классификация ОВ реакций
2.5.1. Перенос электрона. При этом образуются катион-радикалы или анионрадикалы
2.5.2. Отщепление водорода – дегидрирование
9
10.
2. Классификация органических реакций по конечномурезультату реакции
• Реакция окисления этанола НАД+-зависимым ферментом алкогольдегидрогеназой идѐт в
печени:
• Окисление тиолов в дисульфиды является важной реакцией, идущей в организме:
например, два остатка SH-содержащих аминокислоты цистеина образуют цистин,
содержащий S-S связь, что очень важно для поддержания третичной структуры белка.
10
11.
2. Классификация органических реакций по конечномурезультату реакции
• Очень важной реакциями, идущими в живых организмах является обратимое окисление
убихинона (коэнзим Q) в электронтранспортной цепи мембран митохондрий и с
пластохинона в электрон-транспортный цепи хлоропластов. При этом образуются хиноны
(показано на примере гидрохинона, лежащего в основе строения убихинона и
пластохинона):
2.5.3. Замещение водорода на более электроотрицательные группы.
К этому типу ОВ реакций можно также отнести реакции радикального галогенирования алканов и
многие другие.
11
12.
2. Классификация органических реакций по конечномурезультату реакции
2.5.4. Присоединение электроотрицательных атомов
Реакция Вагнера – качественная реакция на двойную связь: при добавлении алкена в
щелочной раствор KMnO4 на холоду, выпадает бурый осадок оксида марганца IV:
Окисление алкенов надкислотами до эпоксидов (Реакция Прилежаева):
Образованием эпоксидов объясняется активация проканцерогенов – полициклических ароматических
углеводородов.
12
13.
2. Классификация органических реакций по конечномурезультату реакции
2.5.5. Реакции, идущие с разрывом связи С-С.
Кетоны окисляются с разрывом связи С-С в жѐстких условиях, например в реакции БайераВиллигера:
2. 5.6. Полная деструкция.
Реакции горения и окисления в очень жѐстких условиях с образованием углекислого газа.
13
14.
АЛКАНЫАлканы (парафины) являются насыщенными углеводородами,
способностью и огромным экономическим значением (нефть, газ).
с
низкой
реакционной
предельные углеводороды
насыщенные углеводороды
метановые углеводороды
парафины (parum – мало, affines - имеющий)
Алканы имеют общую формулу СnH2n+2.
Каждый последующий член гомологического ряда алканов отличается от предыдущего на
постоянную группу атомов, которая называется гомологическая разность: (-CH2-).
Отдельные члены этого ряда называются гомологами.
14
15.
АЛКАНЫшироко распространены в природе;
используются в качестве топлива и
сырья для
химической промышленности;
это главные компоненты нефти, природного газа, озокерита , сланцев;
являются
родоначальной
структурой для многих классов органических
соединений
.
15
16.
ФИЗИЧЕСКИЕ СВОЙСТВА АЛКАНОВЧетыре первых гомолога ряда метана – газообразные вещества без запаха.
Начиная с пентана (С5Н12) до пентадекана (С15Н32) – жидкости с
характерным бензиновым запахом.
Высшие алканы с (С16Н34) – твердые, воскообразные вещества без запаха.
По мере
роста
молекулярной
массы
алканов
возрастают
температуры кипения, плавления, плотность.
Все алканы легче воды (относительная плотность всех алканов меньше единицы).
Практически нерастворимы в воде, но хорошо растворимы в
углеводородах и их
галогенопроизводных, в простых и сложных эфирах.
16
17.
Строение алкановАтом углерода находится в sp3 гибридном
состоянии
валентный угол 109º28‘
длина С-С связи 0,154 нм
длина С-Н связи 0,109 нм
строение молекулы зигзагообразное
В молекуле следующего гомолога – этана С2Н6 –
два
тетраэдрических
sp3-атома
углерода
связаны друг с другом:
17
18.
Строение алкановВ жидком и газообразном состоянии молекула этана может принимать бесконечное
количество конформаций за счѐт свободного вращения вокруг связи С-С, из которых одна
конформация соответствует энергетическому минимуму (заторможенная конформация,
являющаяся конформером) и одна энергетическому максимуму (заслонѐнная конформация):
Проекции Ньюмена для двух конформаций этана:
Энергетический профиль вращения вокруг связи С-С
18
19.
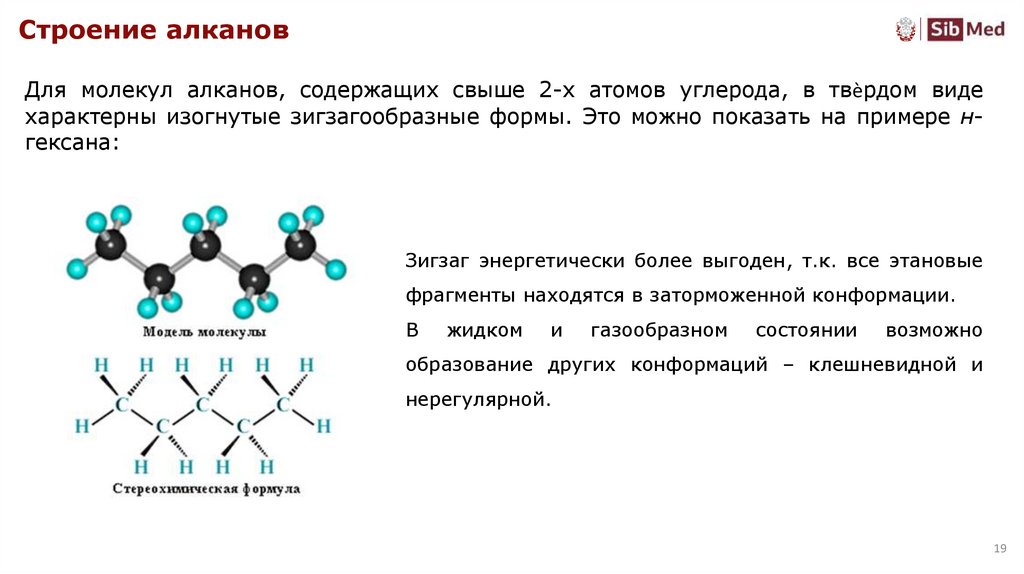
Строение алкановДля молекул алканов, содержащих свыше 2-х атомов углерода, в твѐрдом виде
характерны изогнутые зигзагообразные формы. Это можно показать на примере нгексана:
Зигзаг энергетически более выгоден, т.к. все этановые
фрагменты находятся в заторможенной конформации.
В
жидком
и
газообразном
состоянии
возможно
образование других конформаций – клешневидной и
нерегулярной.
19
20.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВПри получении алканов в промышленности используют природные
нефть, уголь, горный воск, древесина, торф),
крегинг, пиролиз и риформинг.
Существуют
и синтетические методы
лабораторных целях,
главным
углеводородов.
Некоторые методы представляют
(например, синтезы Вюрца и Кольбе).
в
источники (газ,
перерабатываемые такими методами как:
получения,
образом
настоящее
используемые исключительно
для
синтеза
«экзотических»
время
лишь исторический интерес
1. Гидрирование алкенов и алкинов над катализаторами (платина, палладий или никель).
20
21.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ2. Взаимодействие галогеноалканов с металлическим натрием (реакция Вюрца,
1855 г). Получают симметричные алканы с удвоенным числом атомов углерода в молекуле:
Несимметричные
алканы
данным
способом
без
продуктов получить нельзя. Всегда получится смесь трех алканов:
побочных
NB!!! Наиболее легко реакция Вюрца протекает с первичными иод- и бромалканами,
труднее с хлоралканами.
21
22.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ3. Сплавление солей карбоновых кислот со щелочами (р-ция Ж.Б. Дюма), в результате
образуется алкан, имеющий на один атом углерода меньше, чем в исходной соли.
4. Электролиз водных растворов солей карбоновых кислот
Кольбе, 1849 г). Этим способом получают алканы с четным
(синтез
числом
атомов углерода в цепи.
22
23.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВ5. Взаимодействие металлоорганических соединений с водой.
металлоорганические соединения лития,
углерод и образуются алканы.
При действии воды на
натрия, магния, цинка разрывается связь металл –
Действием воды на карбид алюминия получают метан:
6. Восстановление производных алканов
иодоводородной кислотой при нагревании:
(галогеноалканов
спиртов)
23
24.
СПОСОБЫ ПОЛУЧЕНИЯ АЛКАНОВКаталитическое гидрирование оксида углерода (II) (синтез Фишера–Тропша). При
пропускании смеси оксида
углерода (II) и водорода над железным
или
кобальтовым
катализатором при температуре 180–300 0 С
получается смесь алканов
неразветвленной цепью, содержащих 6 – 10 атомов углерода
с
Метод используют в промышленности для получения синтетического
бензина и некоторых алканов.
24
25.
ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВАлканы (парафины, от лат. parum affinis – лишенные сродства) –
относительно инертные вещества.
В обычных условиях на алканы не действуют:
концентрированные кислоты;
расплавленные и концентрированные щелочи;
они не окисляются сильными окислителями (KMnO4, хромовой
смесью и др.);
не взаимодействуют со щелочными металлами.
Такая инертность алканов используется на практике:
концентрированная серная кислота и щелочи применяются для
очистки нефтепродуктов;
щелочные металлы хранятся в слое керосина для предотвращения
их контакта с кислородом и влагой воздуха.
Русский
химик
М.И.
Коновалов
(1858-1906) назвал
алканы
их
за
химическую
инертность
«химическими
мертвецами».
26.
Строение алканов и химические свойстваАлканы насыщенные соединения => характерны реакции замещения S (substutio замещение) с разрывом связи С-Н
ЕС-Н = 414 кДж/моль ЕС-С = 348 кДж/моль
Связь С-Н пространственно более доступна
Гетеролитический разрыв связей С–С и С–Н, как правило, не происходит, поэтому в
ионные реакции алканы практически не вступают.
26
27.
Химические свойства алкановРеакции замещения
CH4 + F2 = CH3F + HF
ΔН = -570 кДж/моль
CH4 + Cl2 = CH3Cl + HCl
ΔН = -109 кДж/моль
CH4 + Br2 = CH3Br + HBr
ΔН = -40 кДж/моль
CH4 + I2 = CH3I + HI
ΔН = +129 кДж/моль
Активность уменьшается
Галогенирование – протекает под действием кванта света или при нагревании выше 400ºС
Алканы со фтором реагируют со взрывом, поэтому фторирование ведут в присутствии
инертного газа (1% фтора). Реакция с хлором идет бурно, но не селективно. С бромом
медленно и селективно, с иодом реакция не идет, она термодинамически запрещена, идет
обратная реакция восстановления иодалканов иодоводородом.
* фтор реагирует слишком активно, поэтому для фторирования алканов используется не
сам фтор, а фторид кобальта (III).
27
28.
Химические свойства алкановХлорирование метана
При достаточном количестве хлора реакция продолжается дальше
образованию смеси продуктов замещения 2-х, 3-х и 4-х атомов водорода:
и
приводит
к
Механизм радикального замещения (символ SR) на примере монохлорирования
метана
Реакция галогенирования алканов протекает по радикальному цепному механизму, т.е.
как цепь повторяющихся реакций с участием свободно- радикальных частиц. В
разработке теории цепных реакций большую роль сыграли труды академика, лауреата
Нобелевской премии Н.Н. Семенова.
Цепные реакции1 – химические реакции, идущие путем последовательного протекания
одних и тех же элементарных стадий. По цепному механизму протекают реакции
крекинга, горения, полимеризации и ряд других реакций.
28
29.
Механизм реакции SRСтадия 1: инициирование. При облучении хлора УФ светом или при нагревании до 400o
образуются атомы хлора:
* Надо иметь ввиду, что у атома хлора на внешнем уровне находится 7 электронов (а не 1) но для удобства пишем только 1
Стадия 2: Образование и рост цепи. Атом хлора атакует молекулу метана, с образованием
хлороводорода и метильного радикала, образующийся метильный радикал атакует молекулу
хлора с образованием хлорметана и атома хлора, далее атом хлора атакует молекулу метана и
т.д.
т.е. каждая элементарная стадия является звеном цепи.
Этим объясняется тот факт, что один фотон вызывает образование большого количества
молекул продукта.
29
30.
Механизм реакции SRэтот процесс можно также представить так:
Механизм отдельной стадии:
Стадия 3. Обрыв цепи. При встрече двух радикалов они взаимодействуют, в результате
чего цепь обрывается:
30
31.
Региоселективность реакций SRПри хлорировании или бромировании алкана при не очень высокой температуре легче всего
идет замещение водорода у третичного атома, и еще труднее всего у первичного. Это
объясняется большей устойчивостью третичных и вторичных углеводородных радикалов по
сравнению с первичными радикалами вследствие большей делокализации неспаренного
электрона:
Поэтому, например, при бромировании пропана основным продуктом реакции является 2-бромпропан:
31
32.
Нитрование по КоноваловуРеакция Коновалова — нитрование алканов разбавленной НNО3 при
повышенном
или
нормальном
давлении.
Реакция
впервые
осуществлена М. И. Коноваловым в 1888 году с 10—25%-ной
кислотой в запаянных ампулах при температуре 140 °C.
Михаил Иванович Коновалов
(1858 – 1906 г.г.)
SR
Реакция
региоселективная,
идет
третичному, затем вторичному атому.
преимущественно
к
Нитрование алканов, циклоалканов и алкиларенов в боковую
цепь представляет собой цепной процесс и протекает по
механизму свободно – радикального помещения. При
нагревании азотная кислота разлагается с выделением
диоксида азота – молекула NO2, которая обладает
неспаренным электроном, является истинным нитрующим
агентом. Под действием диоксида азота из углеводорода
образуется радикал и азотистая кислота, которая реагирует с
азотной кислотой и снова образует диоксид азота.
32
33.
НитрованиеПарофазное нитрование по Хассу
В промышленности широкое применение нашло парофазное нитрование (реакция Хасса),
осуществляется при пропускании паров азотной кислоты и алкана через трубчатый реактор при
температуре 420-450 градусов с последующим резким охлаждением. Реакция сопровождается
крекингом.
Из нитропарафинов наибольшее значение имеют низшие мононитропарафины (нитрометан, нитроэтан,
нитропропан, нитробутан), которые применяются как полупродукты нефтехимического синтеза и
растворители, расматриваются как возможный компонент ракетного топлива.
Полинитросоединения используются как взрывчатые вещества и в производстве ракетных топлив.
33
34.
Сульфирование2-метилбутан-2-сульфокислота
Процесс не является региоселективным, обычно образуются смеси продуктов.
реакция протекает при нагревании или на свету, идет с трудом, сопровождается окислением.
Натриевые соли алкилсульфокислот - являются СМС, при числе атомов углерода 12-14,
такие мыла моют и в жесткой воде, часто входят в состав стиральных порошков.
34
35.
• СульфохлорированиеРеакции
сульфохлорирования
и
сульфоокисления идут на свету, или
при высоких температурах или в
присутсивии перекисей, они не
региоселективны
• Сульфоокисление
O
R-CH2-S-O-O-H
O
При
сульфоокислении
могут
образовываться
пероксисульфоновые
кислоты
–
являются сильными окислителямми
35
36.
Термические превращения алканов• Пиролиз
• Изомеризация
• Крекинг
36
37.
Циклоалканы37
38.
Циклоалканынафтены, циклопарафины
циклические углеводороды, циклы которых построены из атомов углерода, связанных
между собой простыми одинарными σ-связями
1885 г – теория напряжения Байера, по этой теории все
циклы считались плоскими
Циклоалканы
Малые
(напряженные)
Нормальные
В 1885 году Адольф Байер предложил теорию строения циклоалканов, которая
сейчас известна как теория напряжения Байера
Иоганн Фридрих Вильгельм
Адольф фон Ба́йер
(1835 – 1917 г.г.)
Нобелевская премия
по химии 1905 г.
38
39.
Циклопропан• Плоский цикл
39
40.
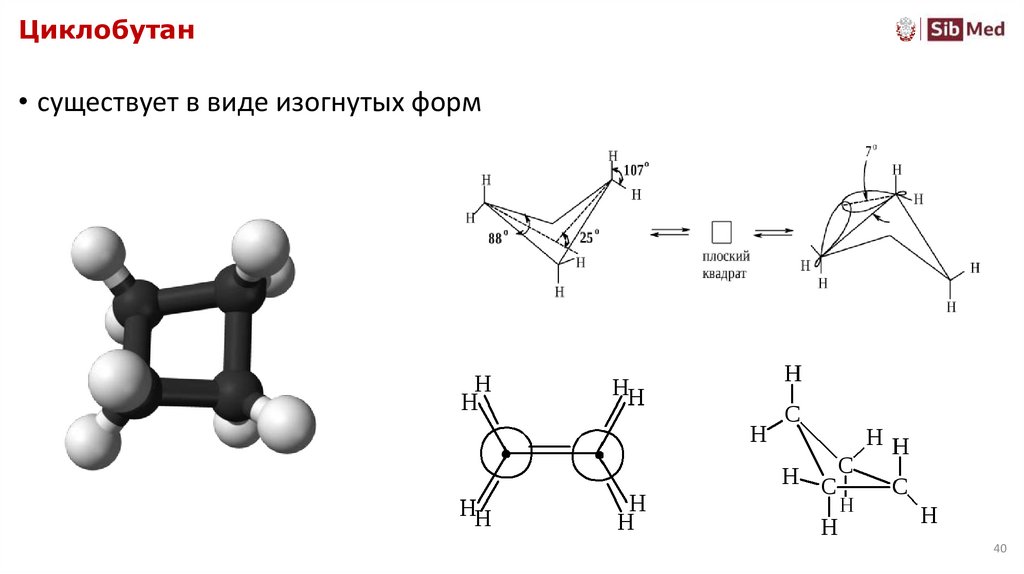
Циклобутан• существует в виде изогнутых форм
40
41.
ЦиклогексанВ циклогексане шестичленный цикл не может быть плоским из-за наличия сильного
углового и торсионного напряжений. За счет частичного поворота вокруг
-связей
возникают менее напряженные неплоские конформации: кресла и ванны. Эти
конформации свободны от углового напряжения, так как углы в них равны 109,5º .
41
42.
ЦиклогексанБолее
термодинамически
выгодной
является
конформация кресла, так как в
ней отсутствуют торсионное и
вандерваальсово напряжения.
Для циклогексана возможны
две
энергетически
вырожденные
конформации
кресла. При переходе их друг в
друга
аксиальные
связи
превращаются
в
экваториальные и наоборот.
Такой
процесс
называется
инверсией цикла. Инверсия
осуществляется
быстро
и
циклогексан
обычно
представляет собой смесь двух
кресловидных конформаций с
одинаковой энергией
При комнатной температуре 99,9% молекул циклогексана находятся в конформации
кресла.
42
43.
Химические свойства малых циклов• Радикальное замещение
CH3 + Cl2
t < 50
только
CH3
Cl
+ HCl
• Присоединения (по правилу Марковникова)
t > 50
CH3-CH-CH2-CH2
Cl
Cl
Br2 при любых условиях
CH3 + Cl2
CH3 + HBr
раствор
CH3-CH-CH2-CH2
Br
H
43
44.
Химические свойства нормальных циклов• Радикальное замещение с сохранением цикла
+ Br2
+ HNO3
hv
Br
+ HBr
NO2
140
раствор
+ H2O
• Дегидрирование
Ni, 300
+ 3H2
44









































 Химия
Химия