Похожие презентации:
Иммуногистохимическое тестирование для таргетной терапии в онкологии
1. ИММУНОГИСТОХИМИЧЕСКОЕ ТЕСТИРОВАНИЕ ДЛЯ ТАРГЕТНОЙ ТЕРАПИИ В ОНКОЛОГИИ
2.
В онкологической практике известно множествопрогностических критериев клинического течения
РМЖ.
К ним относятся традиционные клинические и
морфологические критерии:
• гистологическая форма РМЖ,
• возраст пациентов,
• индекс пролиферативной активности,
• клиническая стадия болезни,
• размеры опухоли в наибольшем ее измерении,
• статус лимфатических узлов (поражение
метастазами),
• множественность поражения метастазами
(больше одного лимфатического узла),
• количество пораженных метастазами
лимфатических узлов
3.
• Современная онкология требует нетолько верификации диагноза и
определения прогностических
маркеров, но и определение
чувствительности к различным
видам лечения (предикторных
факторов), особенно при
использовании современных
таргетных химиопрепаратов.
4.
• Эти препараты имеют точнуюбиологическую мишень и требуют
определения ее наличия в ткани
опухоли. Для выбора оптимальной
лечебной тактики и адекватного
лекарственного лечения необходимо
установить не только стадию рака,
гистологический вариант, степень
злокачественности, но и фенотип
опухоли.
5.
• В опухолях обнаружен ряд факторов,которые связаны с прогнозом
заболевания и ответом на лечение. К
таким факторам относятся
рецепторы к эстрогенам, рецепторы
к прогестерону, Ki 67, HER2-neu,
VEGF (сосудистый фактор роста),
• Bcl -2, р53 и др.
6.
Заболеваемость раком молочнойжелезы (РМЖ) у женщин занимает
первое место среди всех опухолей,
ежегодно в мире выявляется 1300
000 новых случаев, более 458 300
женщин умирают, несмотря на то,
что эта патология относится к так
называемым визуальным
локализациям
7.
В стандарты обследования больных синвазивным РМЖ включено
исследование гормональнорецепторного фенотипа,
определение HER-2 статуса, уровня
пролиферации с определением Ki67.
8.
• Чем выше уровень экспрессиирецепторов эстрогенов, тем меньше
размер опухоли, реже встречаются
множественные лимфогенные метастазы.
• Эстроген-позитивные и прогестеронпозитивные опухоли дают
положительный ответ на терапию
гормонами. Чем выше балл,
определяющий горомонозависимость
опухоли, тем лучшего ответа можно
ожидать от гормонотерапии.
9.
• Ограничение индуцированнойэстрогенами стимуляции
пролиферации с помощью
антиэстрогенов типа тамоксифена с
успехом применяется в таргетной
терапии опухолей и является
средством, предупреждающим или
задерживающим развитие
гормонозависимых опухолей у
человека
10.
• Опухоли с РЭ отрицательнымфенотипом отличаются более
злокачественным течением,
проявляющимся большими
размерами опухоли, множественным
лимфогенным метастазированием и
плохим прогнозом клинического
течения
11.
• Уровень экспрессии РП могут служитьпризнаком неблагоприятного прогноза
клинического течения РМЖ за счет
более короткого безрецидивного
периода и низкой общей выживаемости
пациенток по сравнению с пациентками
с положительными гормональнорецепторными опухолевыми
фенотипами.
12.
• Вторым биологическим показателем РМЖявляется HER-2 статус или герцепт- статус,
который позволяет оценить прогноз
заболевания и возможность использования
таргетного препарата герцептина
(трастузумаба). Препарат представляет
собой моноклональное антитело,
связывающееся с рецептором HER2/neu на
поверхности опухолевых клеток и
блокирующее его. Препарат блокирует
пролиферацию, стимулирует апоптоз и
обладает антиангиогенной активностью.
13.
• Создан первый российский биоаналоглекарственного препарата трастузумаб
(герциптин) – гертикад.
• Гертикад – гуманизированное
моноклональное антитело,
избирательно взаимодействующее с
внеклеточным доменом HER 2.
Препарат блокирует пролиферацию
опухолевых клеток с гиперэкспрессией
HER 2
14.
• При исследовании экспрессии белка HER2по стандартизованной
иммуногистохимической методике
• HER2 статус оценивается как
положительный ( ИГХ3+) при однородно
выраженном мембранном окрашивании
более 30% клеток инвазивного рака или при
амплификации гена Erbb2 (ISH).
• HER2 статус оценивается как
неопределенный, при ИГХ 2+ при
умеренном мембранном окрашивании более
10% опухолевых клеток или сильном
мембранном окрашивание менее 30%
опухолевых клеток
15.
• При ИГХ 2+ требуется выявлениеамплификации гена HER2 методами
гибридизации in situ на тех же
парафиновых срезах. Ретестирование
может быть проведено и при ИГХ1+,0.
• По литературным данным случаи с
амплификацией гена составляют до
5,9%.
16.
Отрицательным HER2 статусомсчитается экспрессия этого белка на
уровне 0, 1+, 2+ при отрицательной
амплификации гена Erbb2 (HER 2).
Рекомендовано исследование экспрессии
HER2/neu только в клетках первичной
опухоли.
17.
• Согласно результатам эпидемиологическойпрограммы скрининга HER2 статуса при РМЖ
в РФ, более 17% диагностических
заключений не соответствуют
действительному рецепторному статусу
опухоли.
• Как ложноположительные, так и
ложноотрицательные результаты
диагностики приводят к неоптимальному
выбору терапии, снижению показателей
выживаемости пациенток и нерациональному
расходованию бюджетных средств.
18.
• Методы гибридизации in situ позволяютвыявлять специфические нуклеотидные
последовательности (мишени)
непосредственно в клетках на
гистологических препаратах с сохранением
морфологии ткани.
• Используют несколько модификаций –
• FISH-флюоресцентная in situ гибридизация,
• CISH- хромогенная in situ гибридизация,
• ISH- усиленная серебром in situ
гибридизация,
• BDISH- автоматизированная хромогенная
усиленная серебром in situ гибридизация
19.
• FISH - микроскопия в темном поле, вкотором используются меченые ДНКзонды. HER2 зонд связывается с
локусом гена HER2 на хромосоме 17,
СЕР-17 зонд связывается с
центромерным участком хромосомы 17.
20.
• Анализ результатов проводят вфлюоресцентном микроскопе.
• Гибридизационный сигнал – окрашенный
осадок, локализованный в цитоплазме, ядре
или перинуклеарной области.
• для определения наличия амплификации
HER 2 используют набор DACO HER 2 FISH
pharmDX TM INFORM (компания DACO) и TM
HER2 SISH (компания Ventana)с зондами,
меченными флюорохромами.
• Красным – помечен HER 2 , зеленым FITS –
участок хромосомы 17.
21.
• Визуализацию препаратов проводят ссоответствующими фильтрами под
флюоресцентным микроскопом,
подсчитывая соотношение красных и
зеленых сигналов в ядрах 20 клеток.
Соотношение больше 2,2
свидетельствует о наличии
амплификации гена HER 2 , меньше 1,8
– амплификация отсутствует.
22.
• BDISH - метод микроскопии в светломполе, полностью автоматизированный и
быстрый – 1 час. HER 2 определяют
серебрением, CEP 17 c
использованием хромотогенной
красной метки. Образцы считают
BDISH-положительными, если
соотношение HER 2: CEP 17 больше
или равно 2
23.
• При РМЖ равнозначно начинатьтестирование как ИГХ методом, так и
методом гибридизации in situ.
24.
• По мере прогрессированиязаболевания достоверно увеличивается
частота опухолей, в ткани которых
выявляется гиперэкспрессия
эпидермального фактора.
25.
• Гиперэкспрессия HER2/neu в опухолевойклетке коррелирует с рядом неблагоприятных
факторов прогноза: размером опухоли,
высокой степенью злокачественности,
уменьшением рецепторов эстрогена и
прогестерона в опухоли. В клинической
практике в результате гиперэкспрессии
HER2/neu снижается эффективность
химиотерапии и эндокринотерапии
тамоксифеном и самое главное –
уменьшается безрецидивная и общая
выживаемость.
26.
• Ф.И.О. Пациентка Б.1953 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимического исследования
на блоках № 8404-05/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых рецепторов имеется
слабое окрашивание ядер в 3% опухолевых клеток, в
сумме баллов по Allred – 3 балла. При исследовании
прогестероновых рецепторов имеются единичные
клетки в сумме баллов по Allred – 2 балла.
Отсутствует экспрессия эпидермального фактора
роста белка HER2-neo 1+.Индекс пролиферативной
активности Ki-67 около 20-25%.
27.
• Ф.И.О. Пациентка С.1940 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимического исследования
на блоках № 9052-53/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых рецепторов имеется
сильное окрашивание ядер в 90% опухолевых
клеток, в сумме баллов по Allred – 8 баллов. При
исследовании прогестероновых рецепторов имеется
сильное окрашивание ядер в 65% опухолевых клеток
в сумме баллов по Allred – 8 баллов. Присутствует
гипеэкспрессия эпидермального фактора роста
белка HER2-neo 3+.Индекс пролиферативной
активности Ki-67 около 23%.
28.
• Ф.И.О. Пациентка С.1950 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимиеского исследования
на блоках № 9052-53/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых рецепторов имеется
сильное окрашивание ядер в 85% опухолевых
клеток, в сумме баллов по Allred – 8 баллов. При
исследовании прогестероновых рецепторов имеется
умеренное окрашивание ядер в опухолевых клеток в
сумме баллов по Allred – 4 балла. Присутствует
гипеэкспрессия эпидермального фактора роста
белка HER2-neo 2+.Индекс пролиферативной
активности Ki-67 около 15-17%.
29.
• Ф.И.О. Пациентка Ж.1979 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимиеского исследования
на блоках № 8384-85/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых и прогестероновых
рецепторов отсутствует окрашивание. Отсутствует
экспрессия эпидермального фактора роста белка
HER2-neo 0.Индекс пролиферативной активности Ki67 около 25-27%.
30.
• Ф.И.О. Пациентка З.1946 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимиеского исследования
на блоках № 9304-05/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых и прогестероновых
рецепторов отсутствует окрашивание. Присутствует
гиерэкспрессия эпидермального фактора роста
белка HER2-neo 3+.Индекс пролиферативной
активности Ki-67 около 40%.
31.
• Ф.И.О. Пациентка Ш.1934 г. р.• Диагноз: Рак молочной железы
• Проведение иммуногистохимиеского исследования
на блоках № 9052-53/8/14 г.
• Исследуемые маркеры:Estrogen Receptor,
Progesteron Receptor, HER2-neo, Ki-67
При исследовании эстрогеновых рецепторов имеется
сильное окрашивание ядер в 85% опухолевых
клеток, в сумме баллов по Allred – 8 баллов. При
исследовании прогестероновых рецепторов
экспрессия отсутствует. Присутствует
гипеэкспрессия эпидермального фактора роста
белка HER2-neo 3+.Индекс пролиферативной
активности Ki-67 около 27-32%.
32.
• Исследование гормональнорецепторного фенотипа и уровняэкспрессии онкобелка HER-2/neu при
наследственно-обусловленном РМЖ
является высокоинформативным,
многофакторным анализом изменений,
возникших в опухолевых клетках на
молекулярном уровне.
33.
• Интерпретация гормонально-рецепторногофенотипа опухоли и уровня экспрессии
онкобелка HER2/neu с точки зрения
молекулярно- генетической классификации
РМЖ (R. Moll и соавт.,1982) способствует
выявлению молекулярных типов РМЖ,
обладающих сходными гистологическими и
гистохимическими характеристиками.
• Это расширяет возможности ранней
диагностики РМЖ, помогает оценить прогноз
заболевания, выбрать тактику лечения и
реабилитации больных
34.
Молекулярно-генетическаяклассификация РМЖ (R. Moll и
соавт.,1982).
Выделены 4 варианта РМЖ:
• люминальный А
• люминальный В,
• HER2/neu позитивный
• и базальноподобный,
различающиеся по прогнозу и
чувствительности к разным видам
лекарственной терапии
35.
• Выделяют так же 6 групп:• Люминальный А
• Люминальный В HER2/neu+
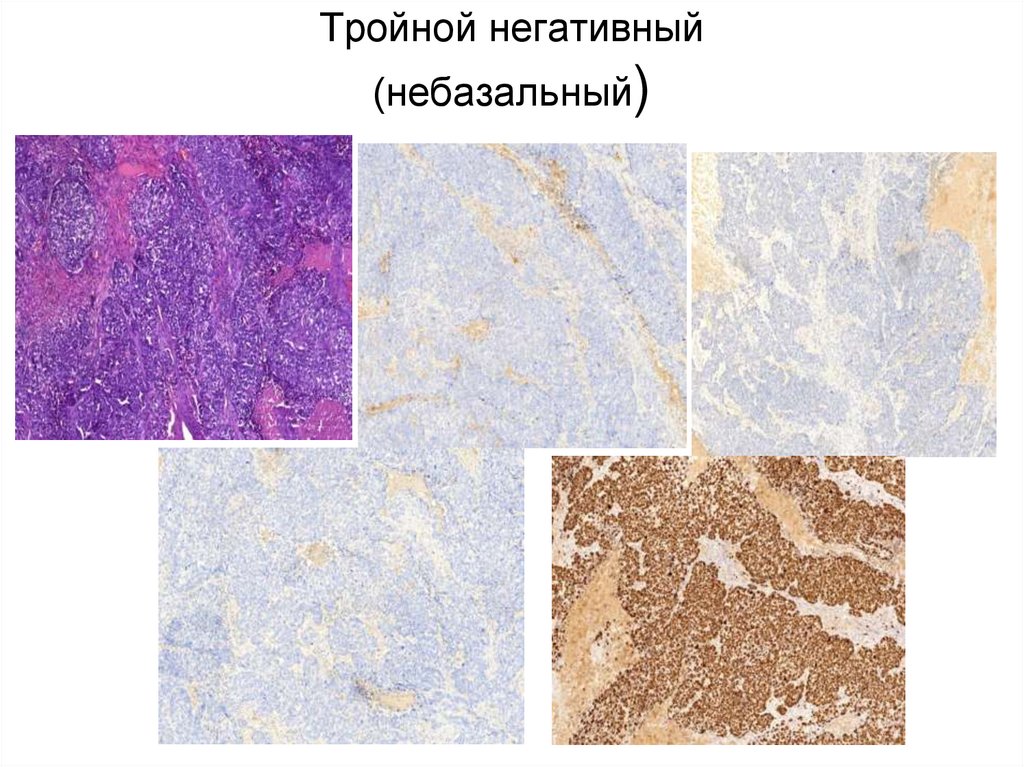
• Люминальный В HER2/neu• Тройной негативный базальный
• Тройной негативный небазальный
36.
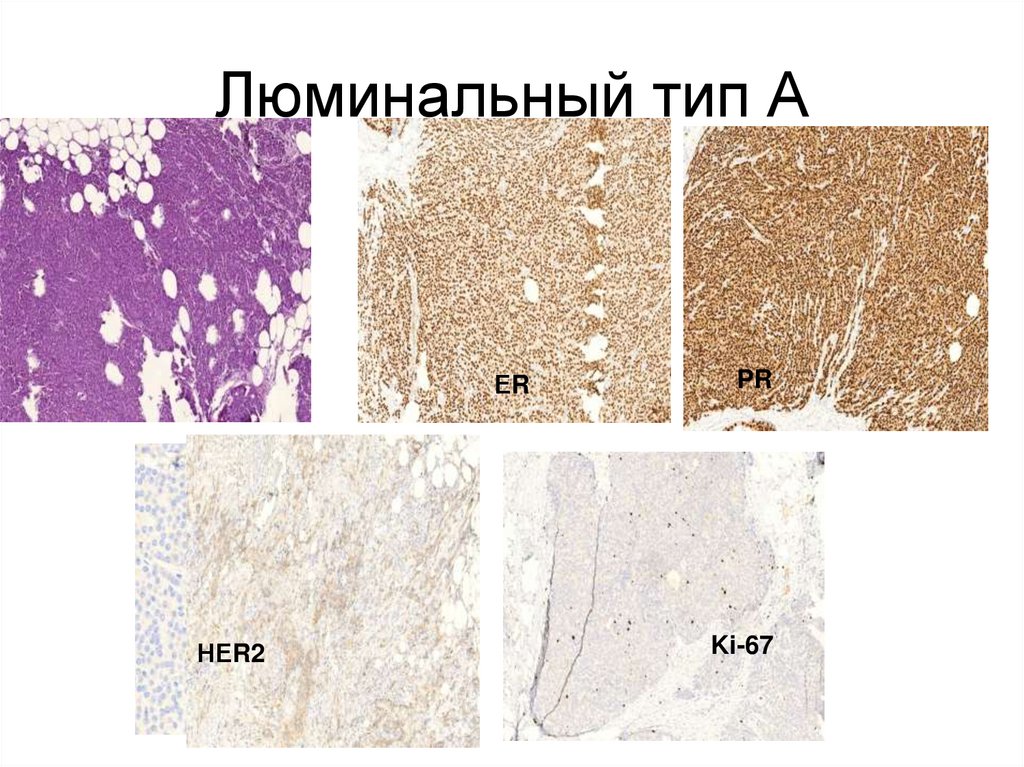
• Люминальный А тип РМЖхарактеризуется сочетанием эстрогенпозитивного фенотипа РЭ+, РП+ и
отрицательного HER-2 статуса.
37. Люминальный тип А
ЕRER
НЕR2
PR
Ki-67
38.
• Это высокодифференцированный рак снизкой пролиферативной активностью.
Имеет хороший прогноз и низкую
вероятность развития рецидивов,
выживаемость свыше 5 лет в 74%
случаев, отмечается высокая
эффективность гормональной терапии
39.
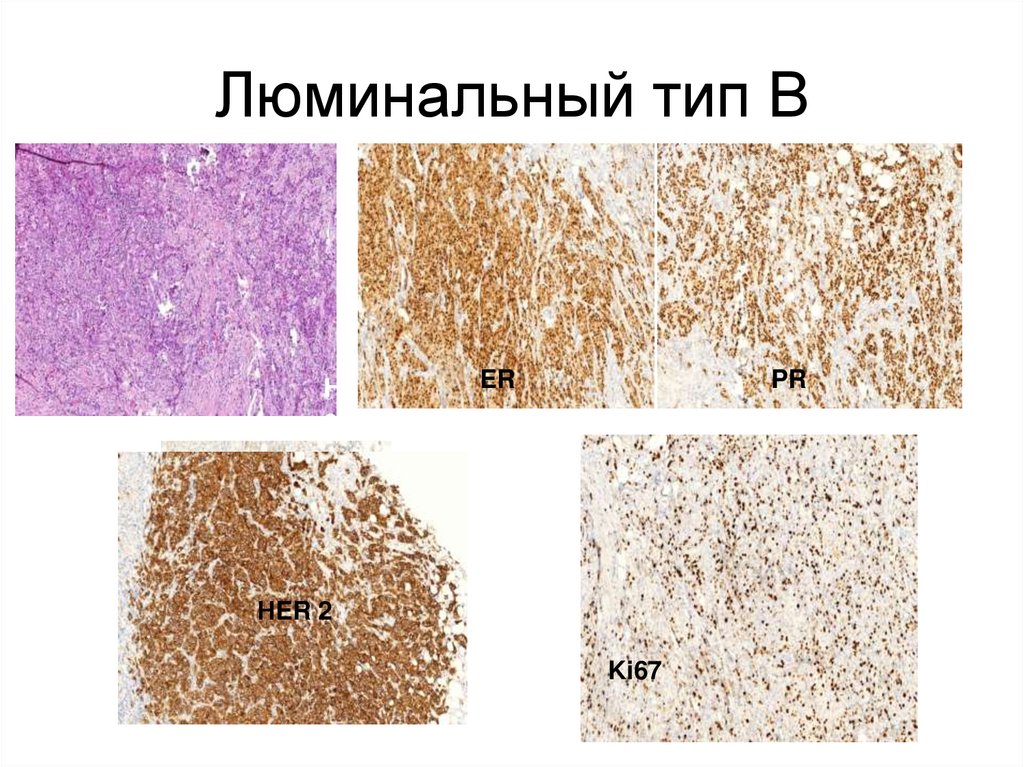
• Люминальный В тип - сочетаниефенотипа РЭ+, РП+ с гиперэкспрессией
белка HER2 /neu (3+).
40. Люминальный тип В
2Люминальный тип В
H
e
r
2
ER
ER
ЕR
PR
HERНER 2
2
Ki67
41.
• Чаще диагностируется в менопаузе,является эстрогензависимым. Такие
опухоли имеют большой размер и рано
дают лимфогенные метастазы, прогноз
при них хуже, часто развиваются
рецидивы
42.
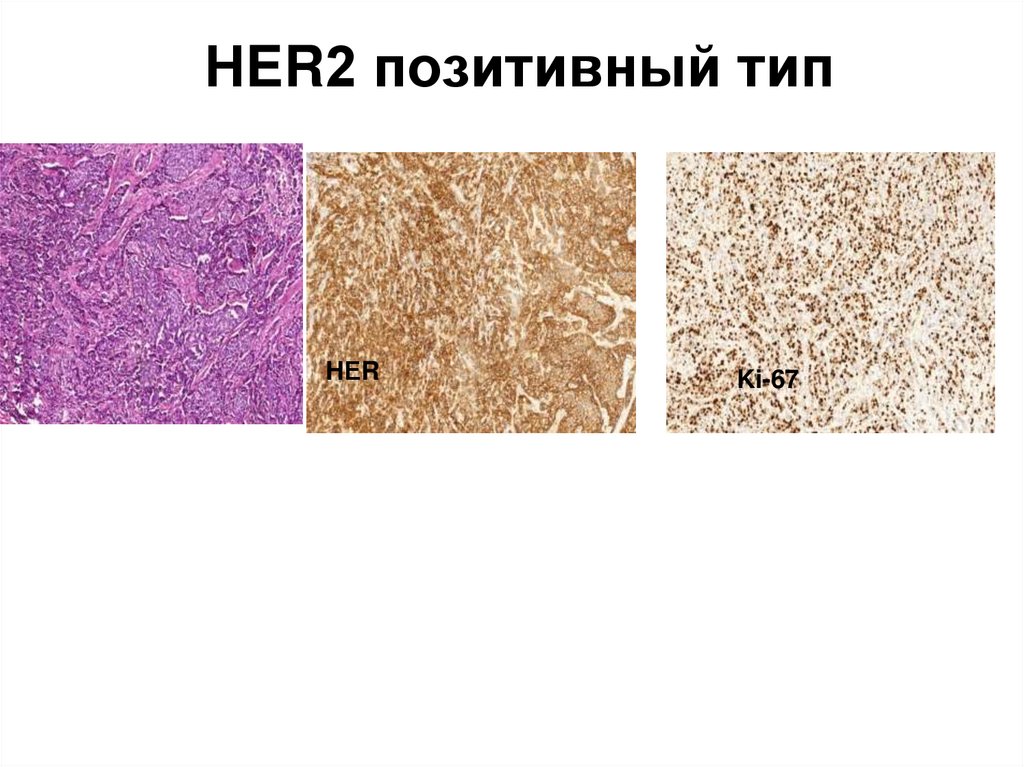
• НER2 позитивный тип РМЖ сочетание фенотипа РЭ-, РП- игиперэкспрессии HER2 (2+, 3+).
HER2-neu позитивный тип является
эстрогеннезависимым, характеризуется
низкой дифференцировкой, большими
размерами, ранним лимфогенным
метастазированием, имеет неблагоприятный
прогноз. При этом варианте у больных
опухоль не чувствительна к гормонотерапии,
хорошо реагирует на герцептин, что является
положительным моментом и способствует
увеличению выживаемости больных
43. НER2 позитивный тип
HЕRKi-67
44.
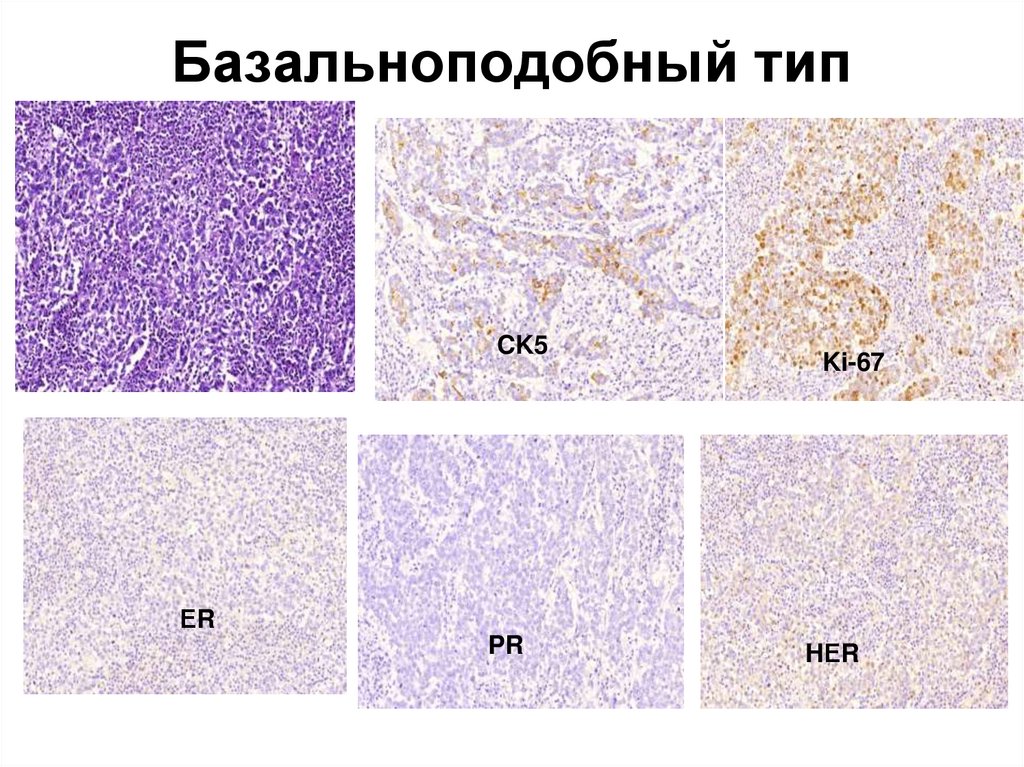
Базальноподобный тип РМЖ сочетание фенотипа РЭ-, РП- и отрицательногоуровня экспрессии белка HER2 /neu (0, 1+).
Это так называемый тройной негативный
фенотип, характеризующийся отсутствием
экспрессии стероидных гормонов и
амплификации гена HER2. Это очень
агрессивные опухоли, склонные к развитию
метастатических форм. Такие опухоли
чувствительны к стандартным
химиотерапевтическим схемам и препаратам
платины.
45. Базальноподобный тип
CK5Ki-67
ЕR
PR
HЕR
46. Тройной негативный (небазальный)
47. Вырезка материала
• Время от момента иссечения ткани до началафиксации не должно превышать 60 минут.
• Фиксация проводится в забуференном нейтральном
формалине не более 24 часов.
• Если удален сектор, обязательна маркировка краев
макропрепарата.
• Из опухолевого узла с непосредственно прилежащей
тканью вырезают не менее 4-5 фрагментов
• Все лимфатические узлы разделяют на группы по
уровням диссекции, измеряют и забирают для
исследования
48. Микроскопическое исследование при раке молочной железы
1) гистологический вариант опухоли,особенности строения;
2) степень дифференцировки (градация
G);
3) наличие структур карциномы in situ;
4) сосудистая инвазия и опухолевые
эмболы в сосудах, как в зоне опухоли,
так и вне ее;
5) лечебный патоморфоз (в случае
неоадьювантной терапии);
49. Заключение
• Содержит:1) гистологический вариант опухоли
2) степень дифференцировки (G1, G2,
G3);
3) распространение на кожу и мышцу;
4) статус
лимфатических
узлов
(с
указанием количества метастазов,
микрометастазов, ITC);
5) край резекции и критерии pTNM.
50.
• Опухоли со сверхэкспрессиейонкобелка HER2 обладают большим
лимфогенным метастатическим
потенциалом в сравнении с опухолями
с фенотипами HER2 (0, 1+), что
подтверждается более частым
множественным поражением
лимфатических узлов
51.
• В стандарты лечения РМЖ в нашейстране не включено определение
пролиферативной активности опухоли,
однако этот показатель является очень
важным для установления
молекулярно-генетического подтипа
опухоли.
• маркер клеточной пролиферации
антиген Ki-67 является важным
критерием прогноза клинического
течения РМЖ.
52.
• Для лечения РМЖ используетсягертикад – первый российский
биоаналог лекарственного препарата
трастузумаб (герциптин).
53.
• Наследственная форма рака молочнойжелезы является важной медицинской
и социальной проблемой , встречается
в 5-10 % случаев рака молочной
железы (Барышников А.Ю., 2003;
Давыдов М.И., Аксель Е.М., 2009).
54.
• Генетически обусловленные формы ракаотличны по этиологии, клинической картине,
факторам прогноза и требуют
индивидуального подхода в
морфологической диагностике, тактике
лечения, в разработке и внедрении
профилактических методов и технологий,
позволяющих предотвратить развитие РМЖ,
стабилизировать рост заболеваемости и
существенно сократить смертность
(Герштейн Е.С., Кушлинский Н.Е., 2002;
Завалишина Л.Э. с соавт., 2008, 2010, 2011;
Франк Г.А. с соавт., 2013 и др).
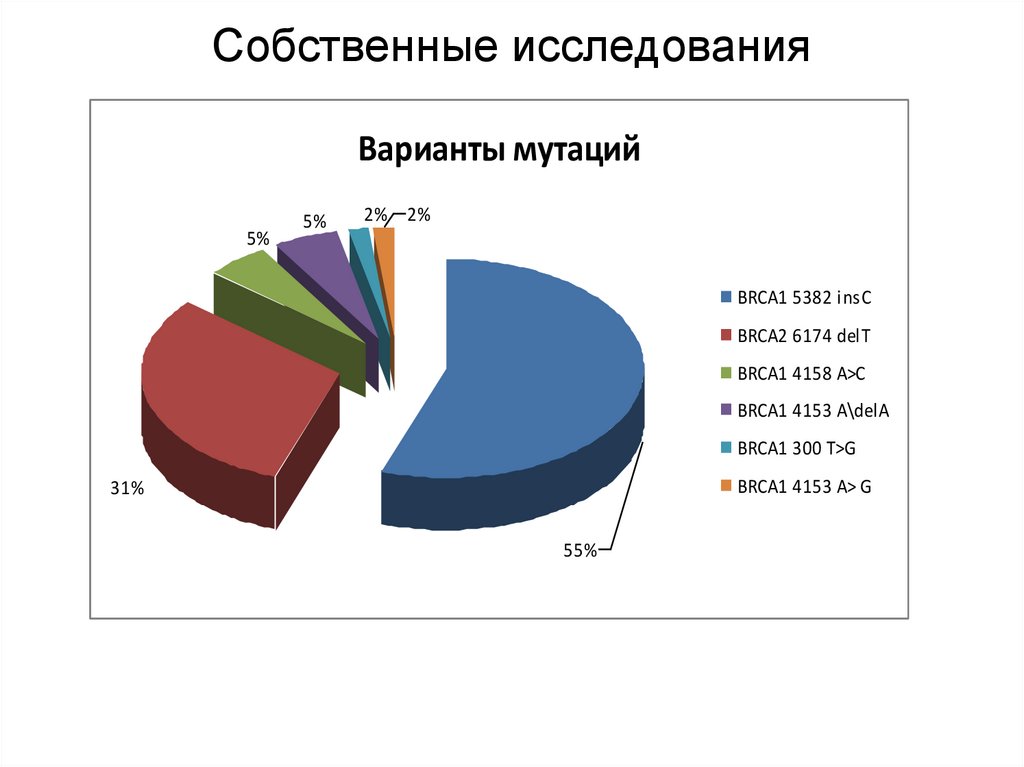
55. Собственные исследования
Варианты мутаций5%
5%
2% 2%
BRCA1 5382 insC
BRCA2 6174 delT
BRCA1 4158 А>С
BRCA1 4153 А\delA
BRCA1 300 Т>G
BRCA1 4153 А> G
31%
55%
56. Гормонально-рецепторные фенотипы опухоли:
• 1. РЭ+,РП+• 2. РЭ+, РП• 3.РЭ-, РП+
• 4. РЭ-, РП-
57.
• наследственно-обусловленный РМЖчаще тройной негативный рак.



















































 Медицина
Медицина