Похожие презентации:
Коллигативные свойства растворов
1. Коллигативные свойства растворов
Физическая и коллоидная химия2.
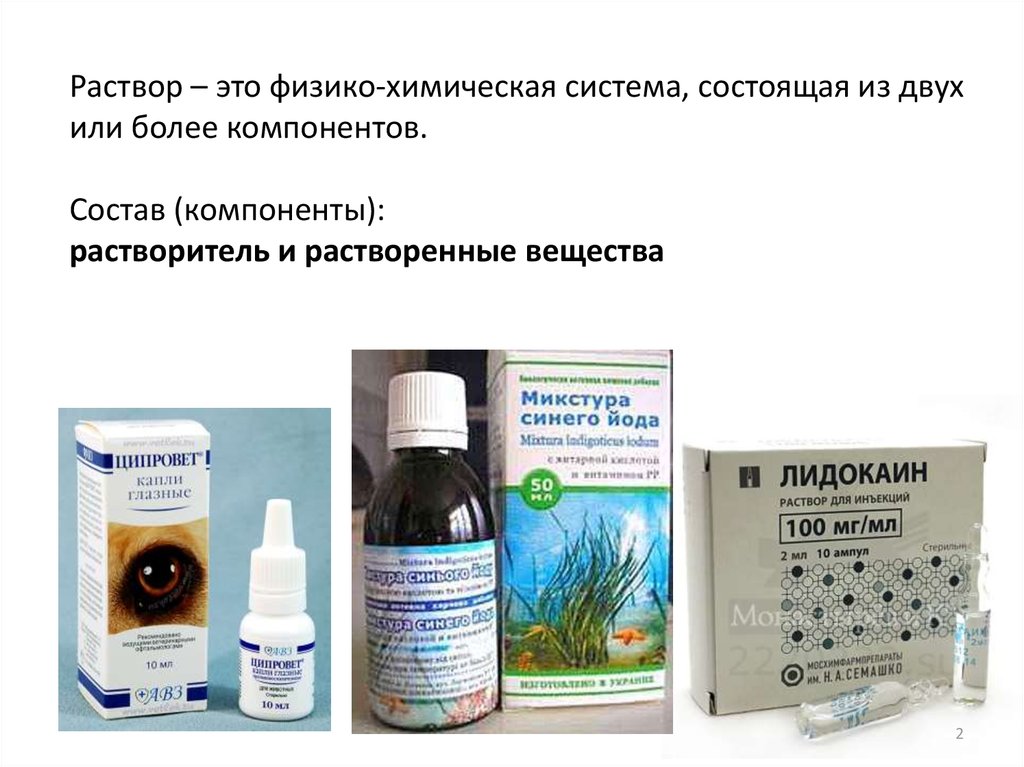
Раствор – это физико-химическая система, состоящая из двухили более компонентов.
Состав (компоненты):
растворитель и растворенные вещества
2
3.
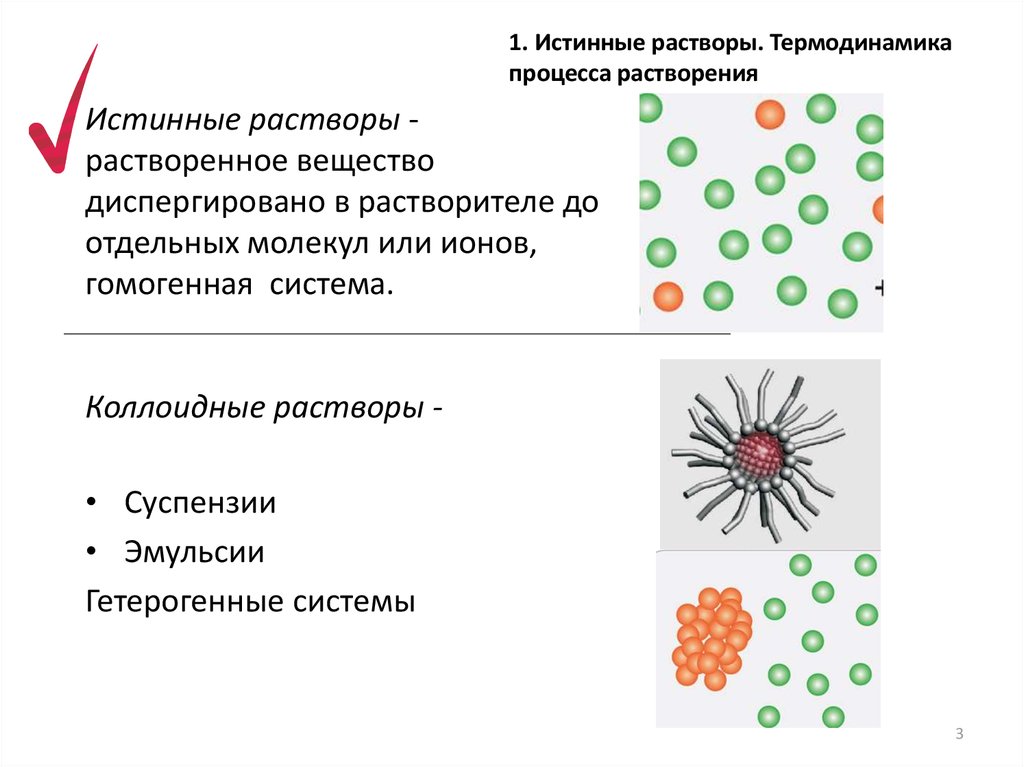
1. Истинные растворы. Термодинамикапроцесса растворения
Истинные растворы растворенное вещество
диспергировано в растворителе до
отдельных молекул или ионов,
гомогенная система.
Коллоидные растворы • Суспензии
• Эмульсии
Гетерогенные системы
3
4.
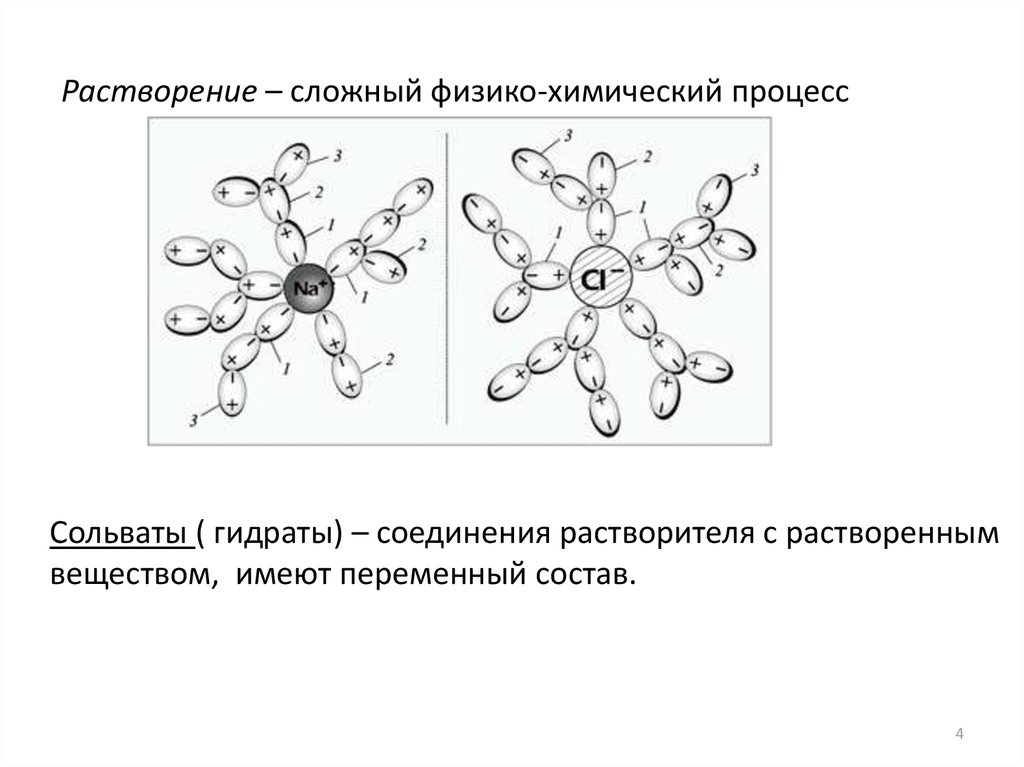
Растворение – сложный физико-химический процессСольваты ( гидраты) – соединения растворителя с растворенным
веществом, имеют переменный состав.
4
5.
В ряде случаев гидратная водаудерживается твердой фазой
кристаллогидраты
CuSO4 3H2O
CuSO4 5H2O
гипс CaSO4 2H2O,
глауберова соль Na2SO4 10H2O,
железный купорос FeSO4 7H2O,
медный купорос CuSO4 5H2O,
квасцы NaAl(SO4)2 ·12H2O, KAl (SO4)2 ·12H2O
5
6.
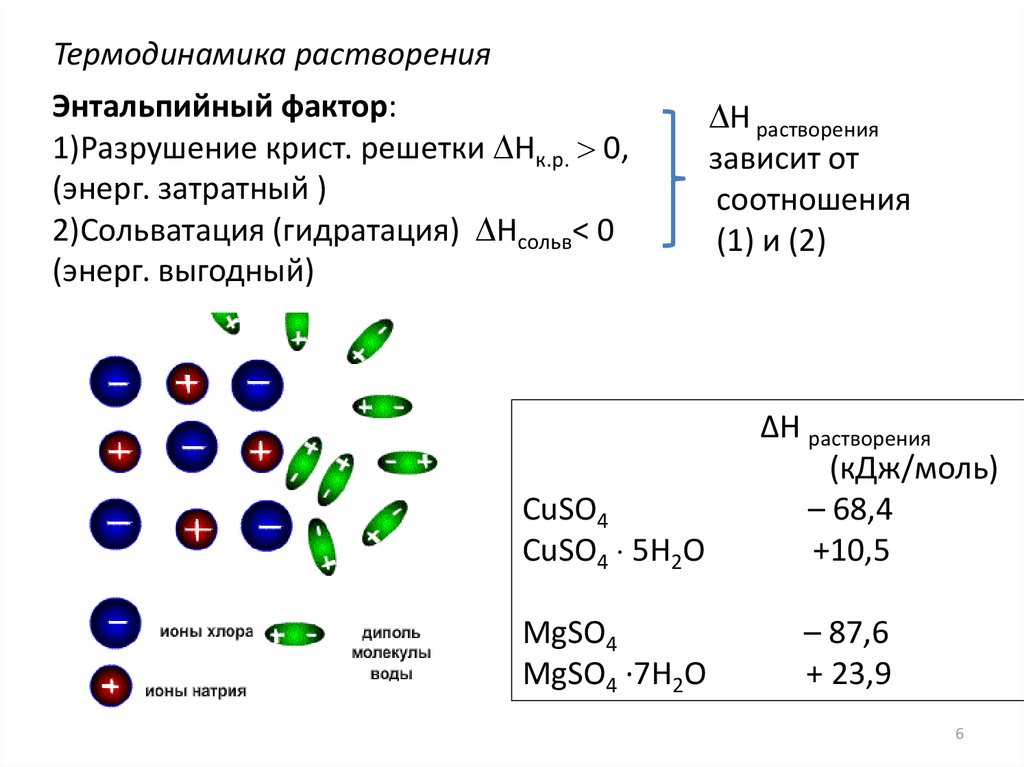
Термодинамика растворенияЭнтальпийный фактор:
1)Разрушение крист. решетки Нк.р. 0,
(энерг. затратный )
2)Сольватация (гидратация) Нсольв< 0
(энерг. выгодный)
CuSO4
CuSO4 5H2O
MgSO4
MgSO4 ·7H2O
Н растворения
зависит от
соотношения
(1) и (2)
∆H растворения
(кДж/моль)
– 68,4
+10,5
– 87,6
+ 23,9
6
7.
Растворение твердого вещества ∆H раств < 0 или > 0 (от соотношения 1 и 2)Растворение жидкости или газа ∆H раств < 0
(нет затрат на разрушение крист. решетки, только
«выгодный» процесс сольватации)
.
7
8.
Энтропийный фактор:При растворении тв. в-ва и жидк. S 0
При растворении газа
∆S < 0
Самопроизвольное растворение:
G < 0,
G = H – T S
При достижении равновесия ΔG = 0
μ (чистого в-ва) = μ (в-ва в растворе).
8
9.
Концентрация - содержание компонентов в раствореМассовое
содержание
Молярность
Моляльность
Мольная доля
mв-ва
mв ва
%
100 %
100 %
m р ра
mв ва m р ля
nв ва
mв ва
С
(моль/л или М).
V р ра M V p ра
nв ва
mв ва
Сm
(моль/кг)
m р ля M m р ля
X в ва
nв ва
nв ва n р ля
X р ля
n р ля
n р ля nв ва
Xр-ля + X в-ва = 1.
9
10.
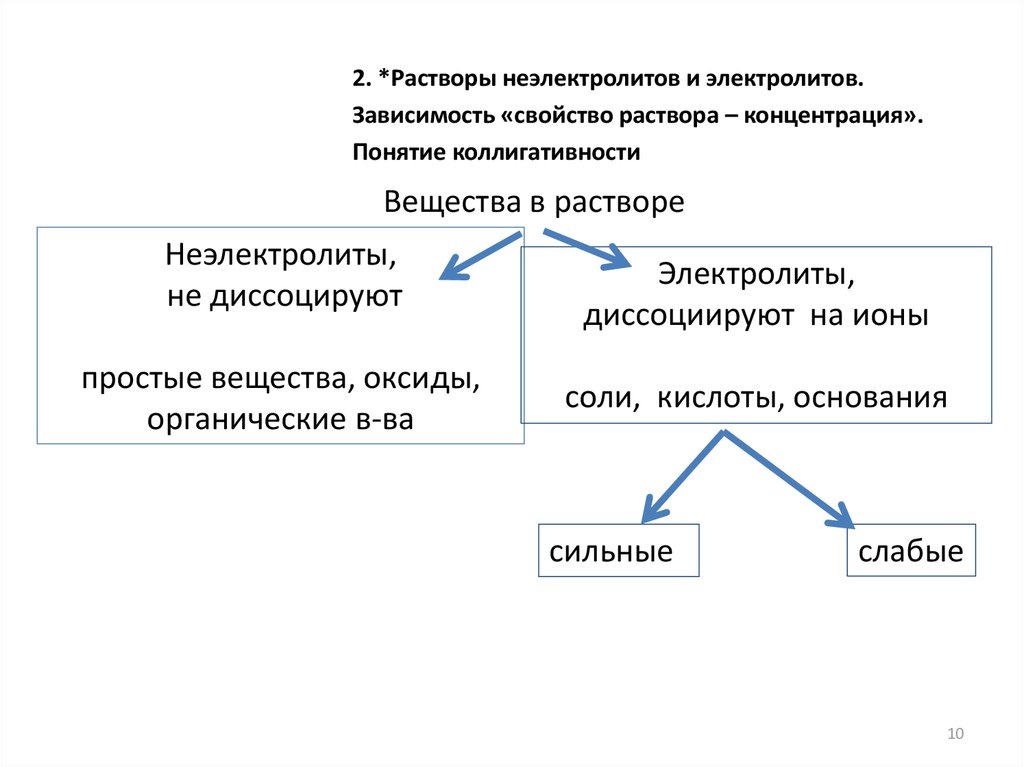
2. *Растворы неэлектролитов и электролитов.Зависимость «свойство раствора – концентрация».
Понятие коллигативности
Вещества в растворе
Неэлектролиты,
не диссоцируют
простые вещества, оксиды,
органические в-ва
Электролиты,
диссоциируют на ионы
соли, кислоты, основания
сильные
слабые
10
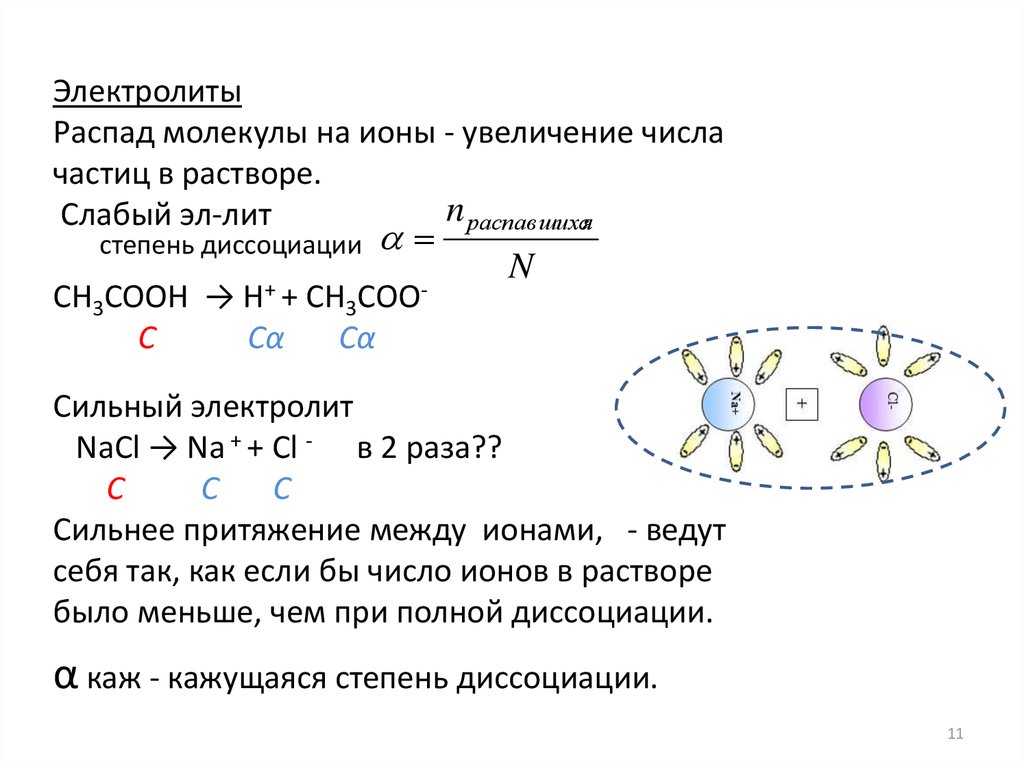
11.
ЭлектролитыРаспад молекулы на ионы - увеличение числа
частиц в растворе.
n распавшихся
Слабый эл-лит
степень диссоциации
СН3СООН → Н+ + СН3СООС
Сα
Сα
N
Сильный электролит
NaCl → Na + + Cl - в 2 раза??
С
С
С
Сильнее притяжение между ионами, - ведут
себя так, как если бы число ионов в растворе
было меньше, чем при полной диссоциации.
α каж - кажущаяся степень диссоциации.
11
12.
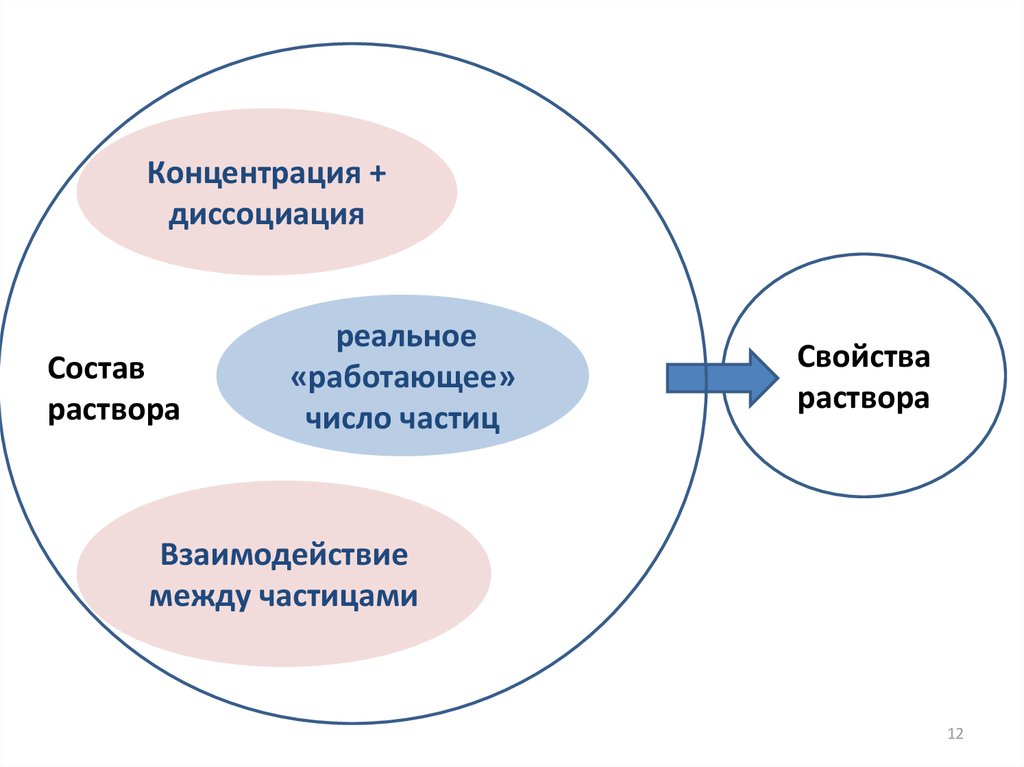
Концентрация +диссоциация
Состав
раствора
реальное
«работающее»
число частиц
Свойства
раствора
Взаимодействие
между частицами
12
13.
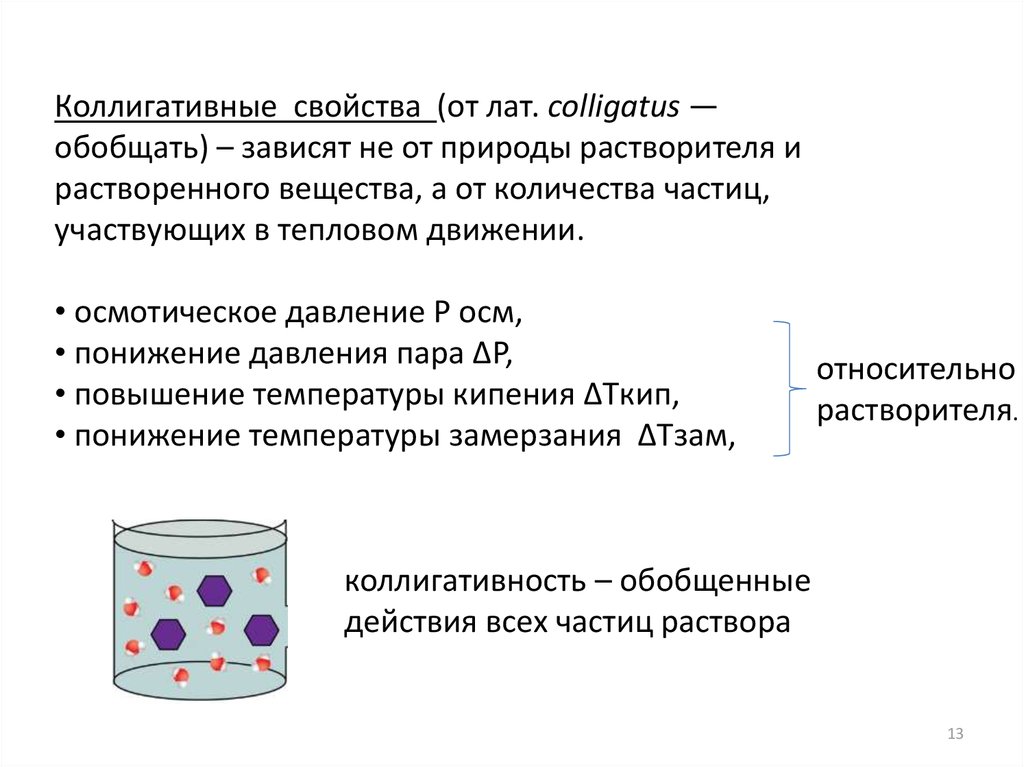
Коллигативные свойства (от лат. colligatus —обобщать) – зависят не от природы растворителя и
растворенного вещества, а от количества частиц,
участвующих в тепловом движении.
• осмотическое давление P осм,
• понижение давления пара ∆P,
• повышение температуры кипения ∆Tкип,
• понижение температуры замерзания ∆Tзам,
относительно
растворителя.
коллигативность – обобщенные
действия всех частиц раствора
13
14.
3.* Осмос и осмотическое давление. ЗаконВант-Гоффа.
Изотонический
коэффициент.
Осмоляльность и осмолярность. Плазмолиз,
гемолиз, тургор. Гипо-, гипер- и изотонические
растворы
14
15.
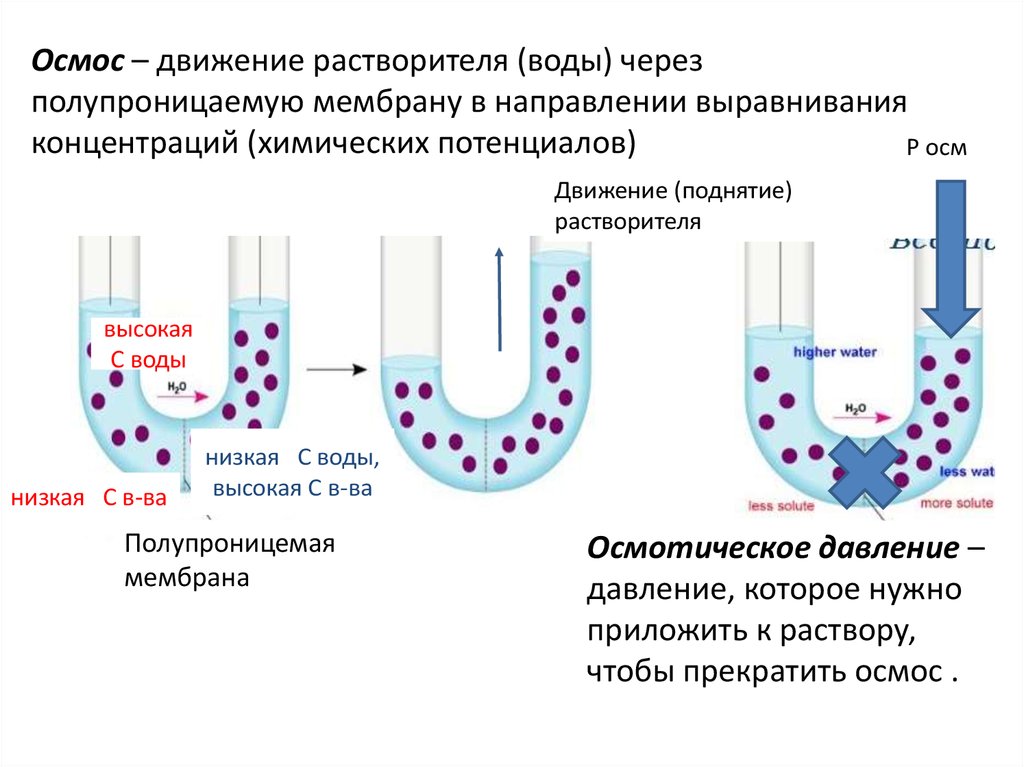
Осмос – движение растворителя (воды) черезполупроницаемую мембрану в направлении выравнивания
концентраций (химических потенциалов)
P осм
Движение (поднятие)
растворителя
высокая
С воды
низкая С в-ва
низкая С воды,
высокая С в-ва
Полупроницемая
мембрана
Осмотическое давление –
давление, которое нужно
приложить к раствору,
чтобы прекратить осмос .
15
16.
Доп. материал:Если P > P осм – обратный осмос
Нужно приложить внешнее
давление, превосходящее Pосм,
растворитель будет перемещаться
из более конц. раствора в менее
конц. раствор или в чистый
растворитель.
Очистка воды методом обратного
осмоса - для получения «Воды
очищенной» и «Воды для
инъекций».
16
17.
Вант-Гофф: движение частиц в растворе - по законам газов,Pосм может быть выражена через уравнение состояние газа
Pосм = RTС
(идеальные растворы)
CИ:
Pосм [ Па = Н/м2], C [ моль/м3], R = 8.31 Дж/моль. K
Если
Pосм [атм], C [ моль/л], R = 0,082 (л . атм)/моль. K
Pосм = i RTС
(реальные растворы)
i - изотонический коэффициент
(во сколько раз в растворе больше частиц по сравнению с
идеальным раствором неэлектролита)
17
18.
Если молекула распадается на n ионов (NaCl – 2, ZnCl2 – 3),количество исходных молекул N,
степень диссоциации — α или α каж
количество диссоциировавших молекул N·α
при этом образуются N·α·n ионов,
общее количество частиц в растворе N — N·α + N·α·n
N N N n N (1 n)
i
1 (n 1)
N
N
i 1
n 1
18
19.
*Метод определения степени диссоциации α.пример
0,05 М раствор NaCl при 25°С , Pосм = 235256,1 Па.
Используем формулу Вант-Гоффа для электролита,
переведем концентрацию в размерность СИ
0,05 моль/л = 50 моль /м3
Pосм
235256 ,1
i
1,9
CRT 50 8,31 298
i >1 – эл. диссоциация (если i =1 нет диссоциации)
i 1 1,9 1
0,9
n 1 2 1
Это кажущаяся степень диссоциации
19
20.
0,05 М раствор NaCli = 1,9 (вместо 2,0 )
0,05 М раствор MgSO4
i =1,3 (вместо 2,0).
Доп. материал:
Учет межионных взаимодействий и числа частиц
теор. вычисления
измерения Pосм
Теория Дебая и Хюккеля:
ионная сила и активность
I
1
2
Сi z i
2
i
Нобелевская премия 1936 г.
за исследования
дипольных явлений
Теория Вант Гоффа:
изотонический коэффициент
Pосм
i
CRT
Нобелевская премия 1901 г.
за законы химической динамики
и осмотического давления
20
в растворах
21.
Осмотическое давление биологических жидкостей создаетсяионами (Na+ К+, Сl-, НСО3- и др.), молекулами неэлектролитов
(мочевина, глюкоза и др.) и протеинами.
Их суммарная концентрация - осмолярность
в молях (осмолях) на литр (осмоль/л).
плазма крови – 280-300, СМЖ – 270-290, моча – 600-1200
милиосмоль/л.
Эта величина должна быть использована в уравнении Вант-Гоффа
для жидкостей сложного состава.
Осмоляльность – концентрация тех же частиц, растворенных в
килограмме воды, (осмоль/кг).
21
22.
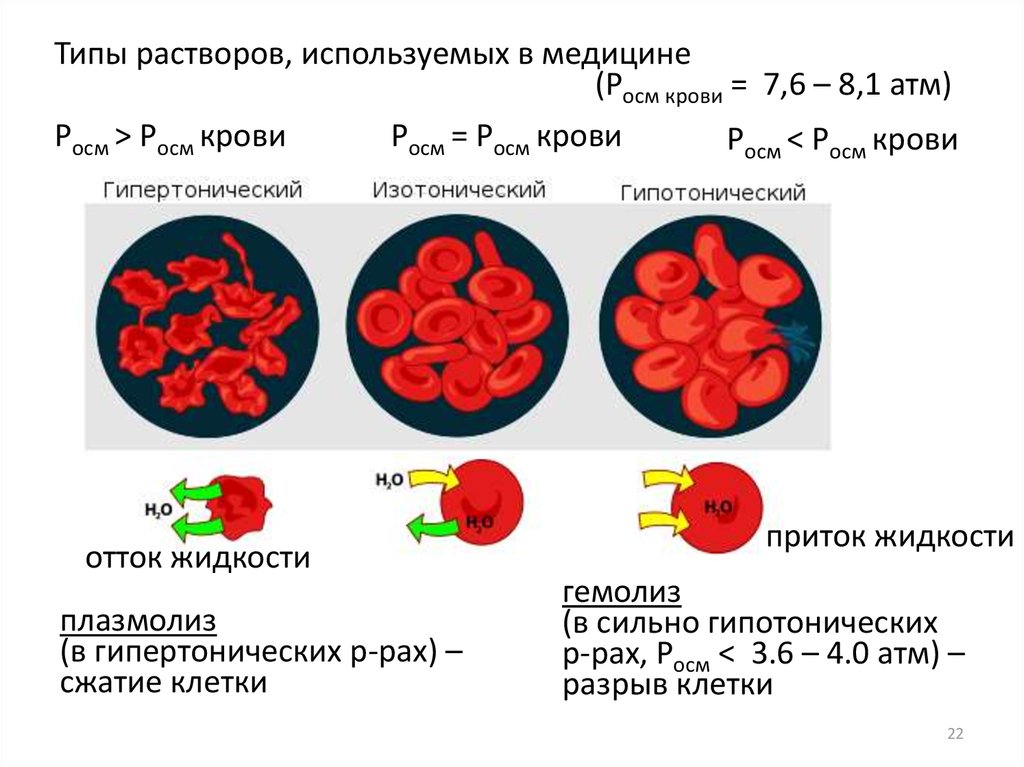
Типы растворов, используемых в медицине(Росм крови = 7,6 – 8,1 атм)
Pосм > Pосм крови
Pосм = Pосм крови
отток жидкости
плазмолиз
(в гипертонических р-рах) –
сжатие клетки
Pосм < Pосм крови
приток жидкости
гемолиз
(в сильно гипотонических
р-рах, Росм < 3.6 – 4.0 атм) –
разрыв клетки
22
23.
В плазме наиболее значимый компонент - NaCl.Онкотическое давление – осмотическое давление,
обусловленное белками крови
Ронк = 0,03 – 0,04 атм
Ронк крови > Ронк тканей
Ронк обеспечивает удержание воды в крови. Снижение
содержания белка в плазме крови ведет к потере воды
плазмой и отеку тканей, а увеличение — к задержке воды
в крови.
23
24.
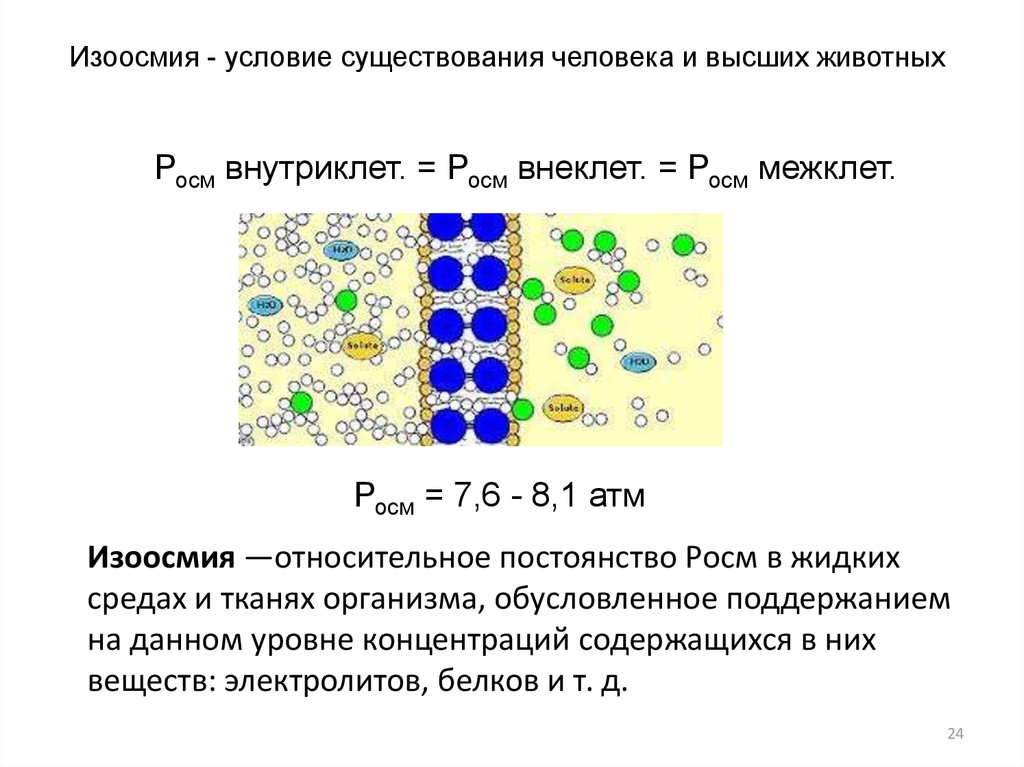
Изоосмия - условие существования человека и высших животныхРосм внутриклет. = Росм внеклет. = Росм межклет.
Росм = 7,6 - 8,1 атм
Изоосмия —относительное постоянство Pосм в жидких
средах и тканях организма, обусловленное поддержанием
на данном уровне концентраций содержащихся в них
веществ: электролитов, белков и т. д.
24
25.
Изотонические растворы, используемые в медицинеРосм = СRT = С . 0,082 . 310 = 7,62 атм
С = 0,3 осмоль/л
0,9 % водный раствор хлорида натрия,
5 % водный раствор глюкозы.
Раствор Рингера
NaCl, KCl и CaCl2
25
26.
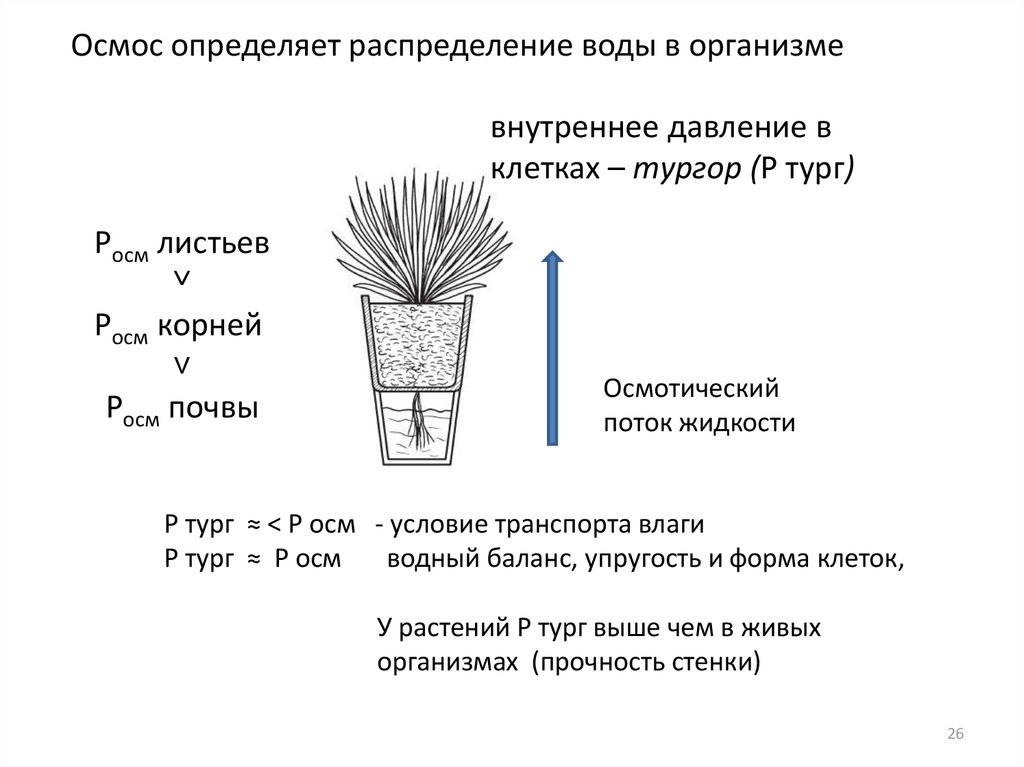
Осмос определяет распределение воды в организмевнутреннее давление в
клетках – тургор (P тург)
Росм листьев
˅
Росм корней
˅
Росм почвы
Осмотический
поток жидкости
P тург ≈ < P осм - условие транспорта влаги
P тург ≈ P осм
водный баланс, упругость и форма клеток,
У растений P тург выше чем в живых
организмах (прочность стенки)
26
27.
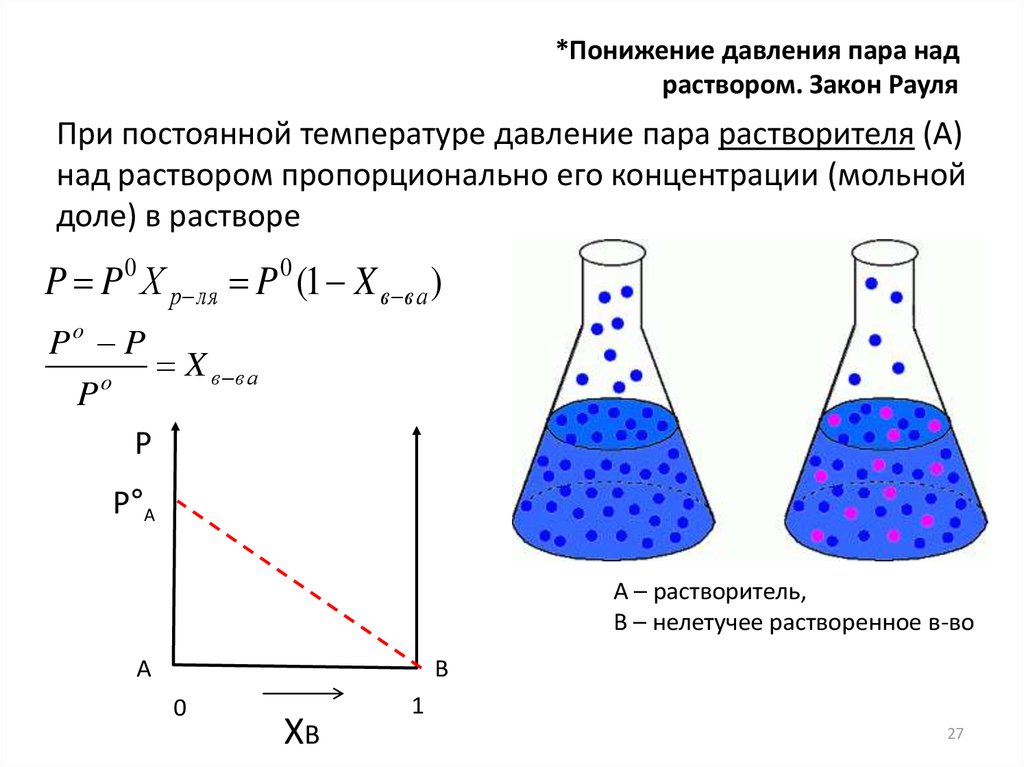
*Понижение давления пара надраствором. Закон Рауля
При постоянной температуре давление пара растворителя (А)
над раствором пропорционально его концентрации (мольной
доле) в растворе
P P 0 Х р ля P 0 (1 X в ва )
Po P
X в ва
o
P
P
P°A
А – растворитель,
В – нелетучее растворенное в-во
A
B
0
XB
1
27
28.
Для разбавленных водныхрастворов на 1000 г воды :
X в ва
nв ва
nв ва
nв ва
0,018 nв ва
nв ва n р ля n р ля 1000 18
Po P
0,018 С m 0,018 C
о
P
Неэлектролиты
Po P
i 0,018 С m i 0,018 C
о
P
Электролиты
28
29.
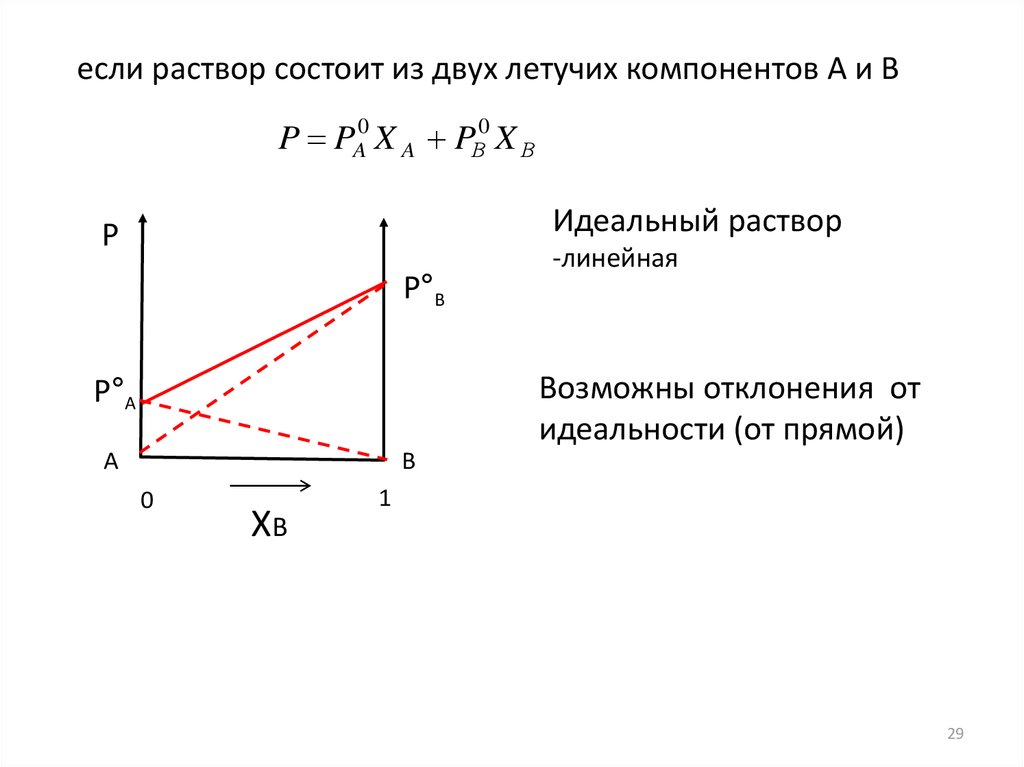
если раствор состоит из двух летучих компонентов А и ВP PA0 X A PВ0 X В
Идеальный раствор
P
P°B
-линейная
Возможны отклонения от
идеальности (от прямой)
P°A
A
B
0
XB
1
29
30.
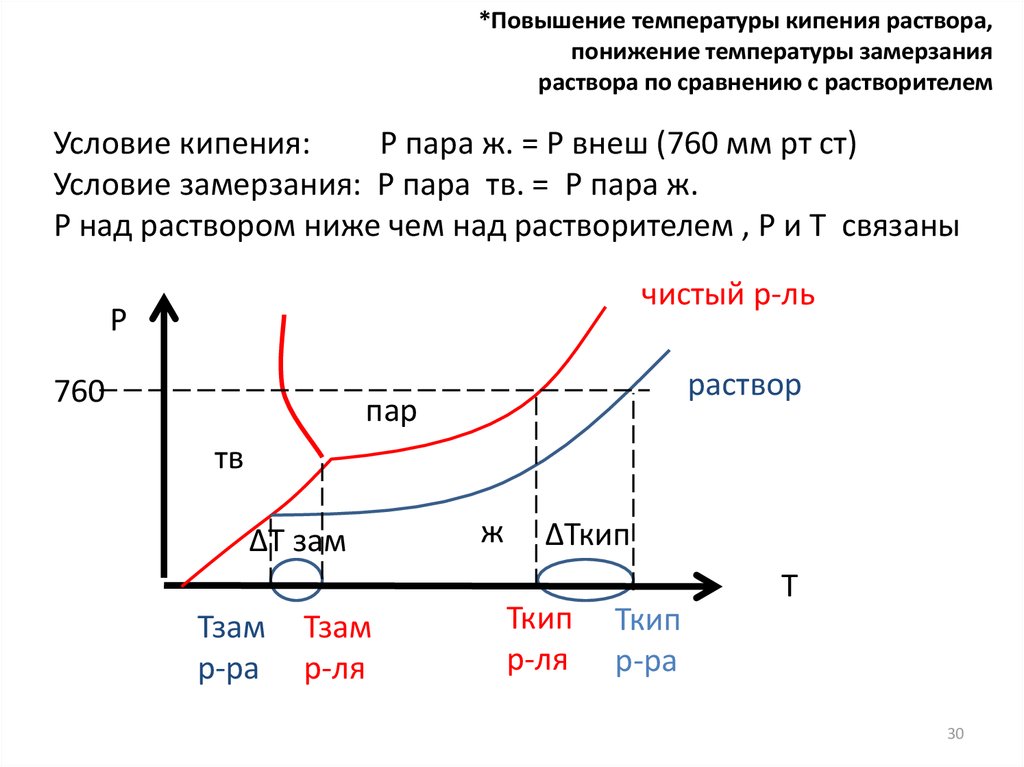
*Повышение температуры кипения раствора,понижение температуры замерзания
раствора по сравнению с растворителем
Условие кипения:
P пара ж. = P внеш (760 мм рт ст)
Условие замерзания: Р пара тв. = P пара ж.
Р над раствором ниже чем над растворителем , Р и Т связаны
чистый р-ль
P
760
раствор
пар
тв
∆Т зам
Тзам
р-ра
Тзам
р-ля
ж
∆Ткип
Ткип
р-ля
Ткип
р-ра
Т
30
31.
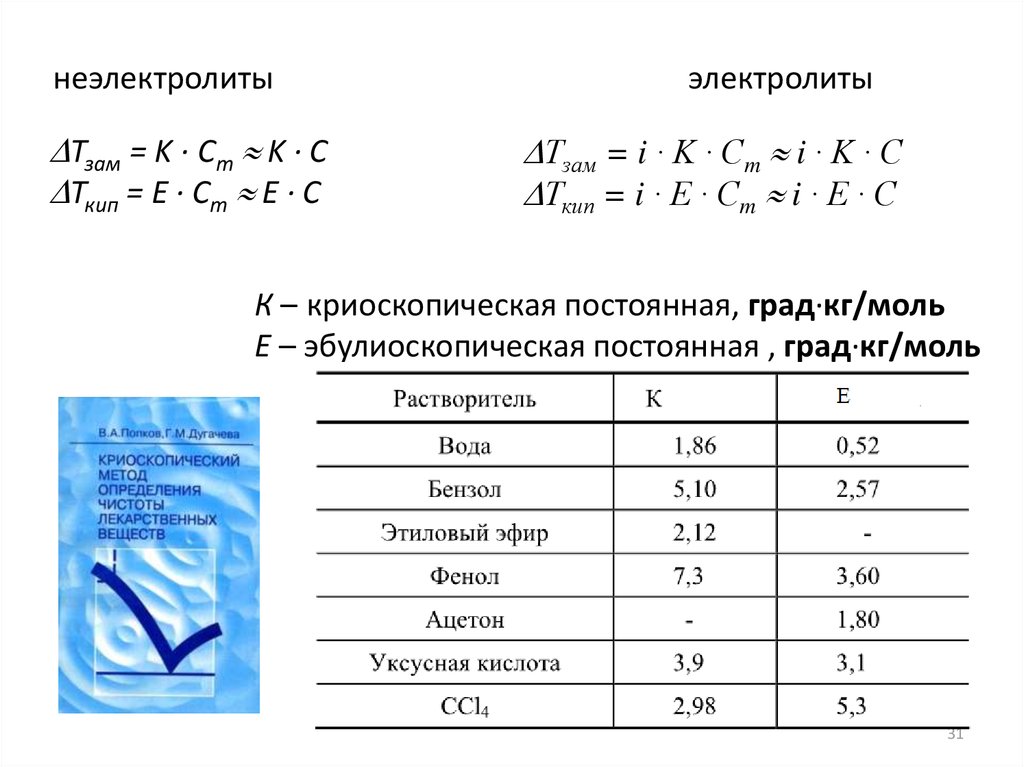
неэлектролитыТзам = K · Сm K · С
Ткип = E · Сm E · С
электролиты
Тзам = i ∙ K ∙ Сm i ∙ K ∙ С
Ткип = i ∙ E ∙ Сm i ∙ E ∙ С
К – криоскопическая постоянная, град·кг/моль
Е – эбулиоскопическая постоянная , град·кг/моль
31















 Химия
Химия








