Похожие презентации:
Металлы
1.
МЕТАЛЛЫ2. ДЕВИЗ
«Источникомразвития
является личный
повседневный и
кропотливый
труд»
3.
4.
СВОЙСТВА МЕТАЛЛОВФизические
Химические
1. Агрегатное
1. Взаимодействие с
состояние.
неметаллами (O2, Сl2,
2. Цвет, запах.
Н2, S и другие).
3. Металлический блеск 2. Взаимодействие с
4. Твёрдость.
водой (H2O).
5. Пластичность.
3. Взаимодействие с
6. Тепло и
кислотами (HCl).
электропроводность 4. Взаимодействие со
7. Магнитные свойства
щелочами (NaOH).
5. Взаимодействие с
солями.
5.
ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВАгрегатное
состояние
Все металлы ТВЁРДЫЕ,
а ртуть – жидкая
Цвет
Большинство серебристые или серые.
Медь – красная, золото – жёлтое
Металлический
блеск
Большинство обладает ярким
металлическим блеском. Самый яркий
блеск у серебра и золота.
Твёрдость
Многие твёрдые. Самый твёрдый – хром.
Пластичность
Большинство обладают высокой
пластичностью. Самый пластичный –
золото.
Все металлы обладают способностью
Тепло- и электропроводить ток и тепло. Наибольшая - у
проводность
серебра.
Магнитные
свойства
Только три металла обладают этим
свойством – железо, никель и кобальт.
6.
HgCu
Au
Ag
Cr
Ni
Co
7.
ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВВзаимодействие
с неметаллами
(O2, Сl2, Н2, S и
другие)
Met + O2 → MetO
Met + Cl2 → MetCl
Met + H2 → MetH
Met + S → MetS
Большинство
Почти все
Только активные
Большинство
Взаимодействие
с водой (H2O)
Met + H2О → MetОH + H2↑Только активные
Met + H2О → MetО + H2↑ Металлы средней
активности
Met + HCl → MetCl + H2↑
Взаимодействие
Металлы средней активности, стоящие в
с кислотами (HCl)
ряду активности до Н
Взаимодействие
со щелочами
Взаимодействие
с солями.
Met + NaOH + H2О → Na[Met(ОH)4] + H2↑
где Met - Al, Zn, Cr
Met + Met*KO → MetKO + Met*↓
где Met - более активный металл
8.
NaK
Mg
Ca
Al
Fe
9.
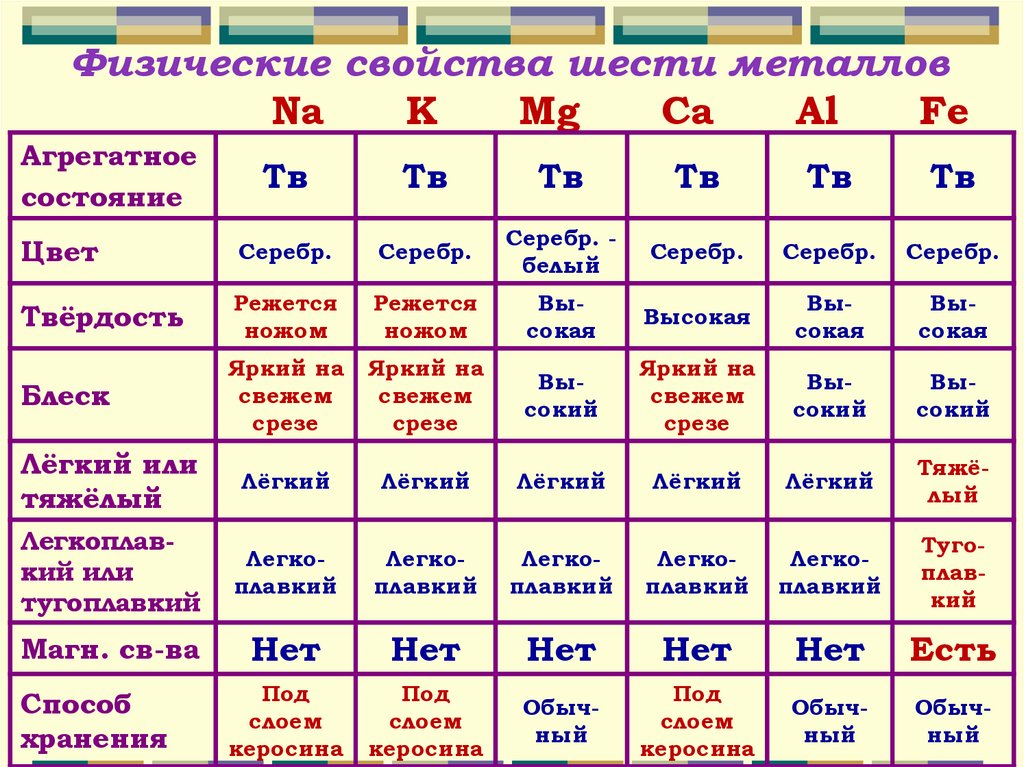
Физические свойства шести металловNa
K
Mg
Ca
Al
Fe
Агрегатное
состояние
Тв
Тв
Тв
Тв
Тв
Тв
Цвет
Серебр.
Серебр.
Серебр. белый
Серебр.
Серебр.
Серебр.
Твёрдость
Режется
ножом
Режется
ножом
Высокая
Высокая
Высокая
Высокая
Блеск
Яркий на
свежем
срезе
Яркий на
свежем
срезе
Высокий
Яркий на
свежем
срезе
Высокий
Высокий
Лёгкий или
тяжёлый
Лёгкий
Лёгкий
Лёгкий
Лёгкий
Лёгкий
Тяжёлый
Легкоплавкий или
тугоплавкий
Легкоплавкий
Легкоплавкий
Легкоплавкий
Легкоплавкий
Легкоплавкий
Тугоплавкий
Магн. св-ва
Нет
Нет
Нет
Нет
Нет
Есть
Способ
хранения
Под
слоем
керосина
Под
слоем
керосина
Обычный
Под
слоем
керосина
Обычный
Обычный
10.
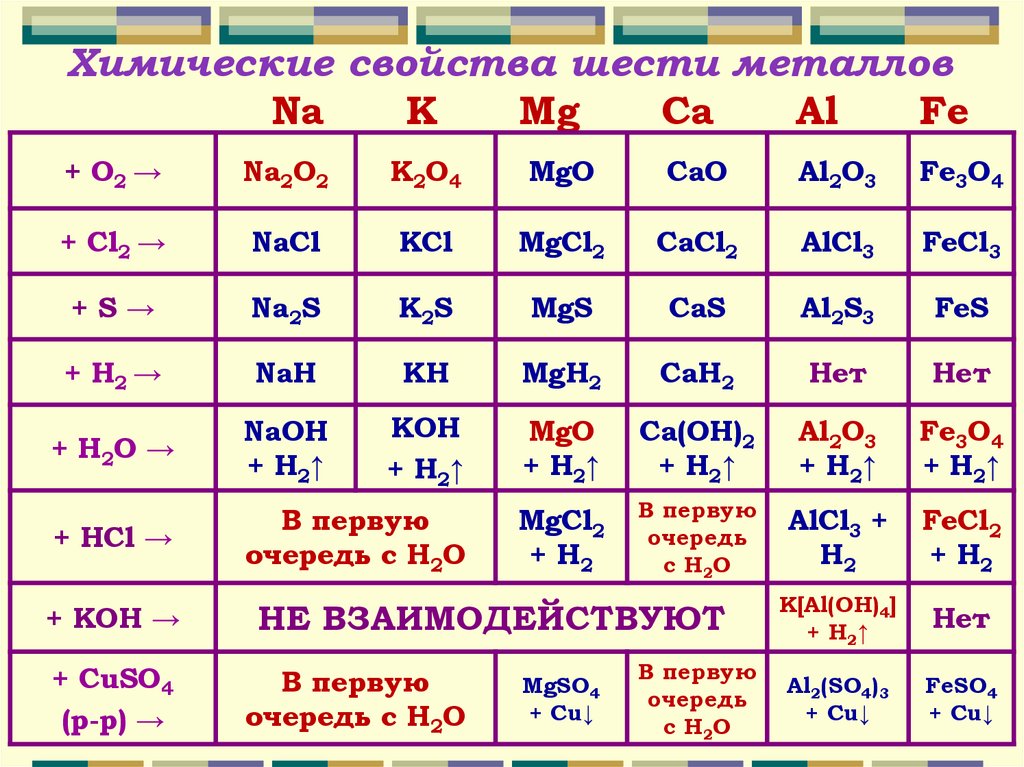
Химические свойства шести металловNa
K
Mg
Ca
Al
Fe
+ O2 →
Na2O2
K2O4
MgO
CaO
Al2O3
Fe3O4
+ Сl2 →
NaCl
KCl
MgCl2
CaCl2
AlCl3
FeCl3
+S→
Na2S
K2S
MgS
CaS
Al2S3
FeS
+ Н2 →
NaH
KH
MgH2
CaH2
Нет
Нет
+ H2O →
NaOH
+ H2↑
KOH
+ H2↑
MgO
+ H2↑
Ca(OH)2
+ H2↑
Al2O3
+ H2↑
Fe3O4
+ H2↑
+ HCl →
В первую
очередь с H2O
MgCl2
+ H2
В первую
очередь
с H2O
AlCl3 +
H2
FeCl2
+ H2
+ KOH →
НЕ ВЗАИМОДЕЙСТВУЮТ
K[Al(OH)4]
+ H2↑
Нет
+ CuSO4
(р-р) →
В первую
очередь с H2O
Al2(SO4)3
+ Cu↓
FeSO4
+ Cu↓
MgSO4
+ Cu↓
В первую
очередь
с H2O
11. 9 класс
МЕТАЛЛЫобщие
физические и
химические
свойства







 Химия
Химия








