Похожие презентации:
Металлы.( 9 класс )
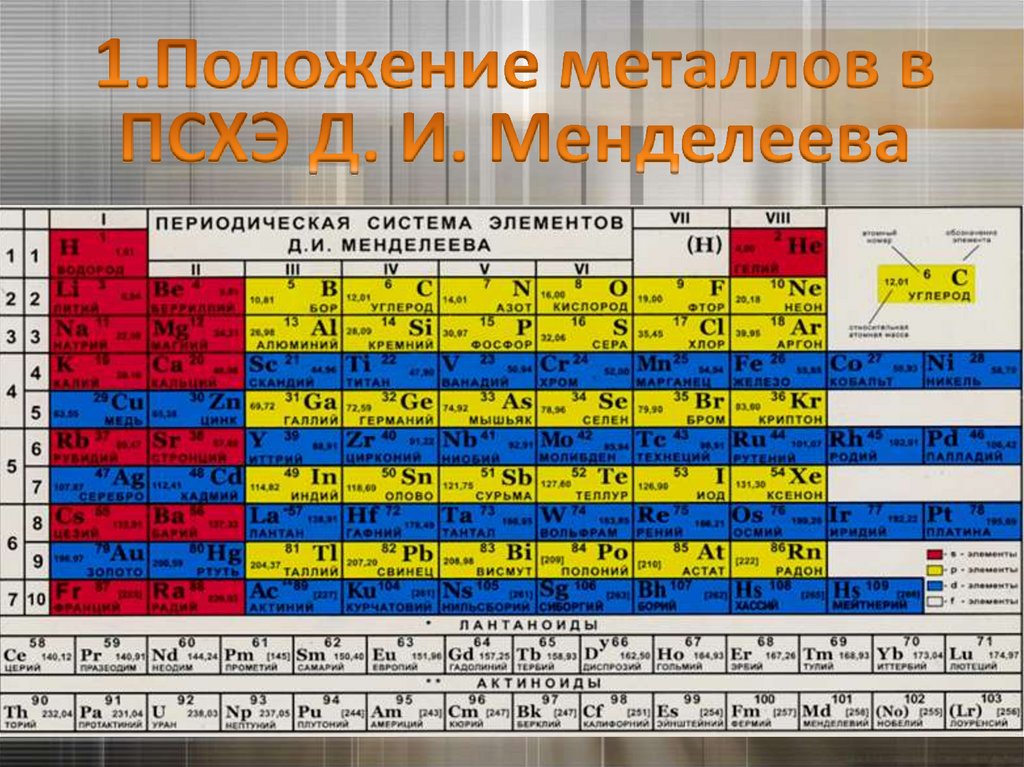
1.
МЕТАЛЛЫОсобенности строения.
Классификация.
Физические и химические свойства.
2.
3.
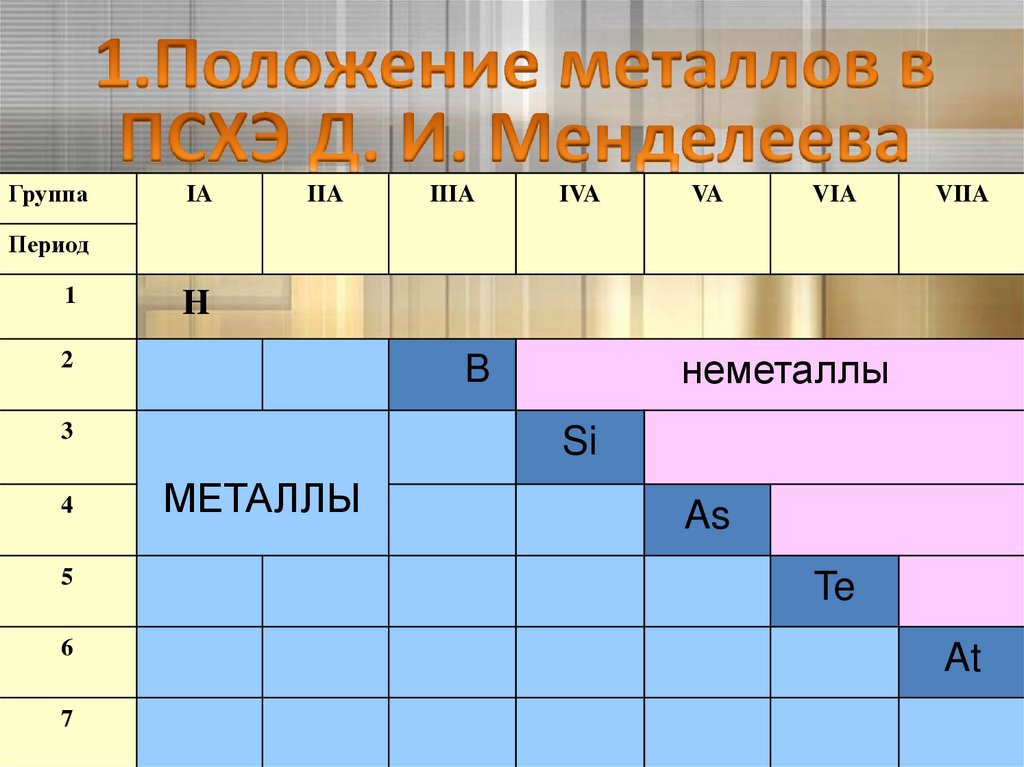
ГруппаIA
IIA
IIIA
IVA
VA
VIA
VIIA
Период
1
H
2
3
4
5
6
7
неметаллы
B
Si
МЕТАЛЛЫ
As
Te
At
4.
В группах:• металлические свойства усиливаются
причина:
1.увеличивается заряд ядра,
2.число электронов на внешнем не изменяется
3.радиус атома увеличивается
В периодах:
• металлические свойства уменьшаются
причина:
1. увеличивается заряд ядра
2. число электронов на внешнем увеличивается
3. радиус атома уменьшается
5.
Из положения в таблице Д.И. Менделееваследует:
1. Атомы металлов на последнем
энергетическом уровне имеют 1 – 3 ē.
Исключения:
Ge, Sn, Pb – 4ē; Sb, Bi – 5ē; Po – 6ē.
6.
2. У атомов металлов большиеразмеры атомных радиусов.
Поэтому металлы легко отдают
внешние электроны.
M ne
0
M
Металлы в реакциях
восстановители!
n
7.
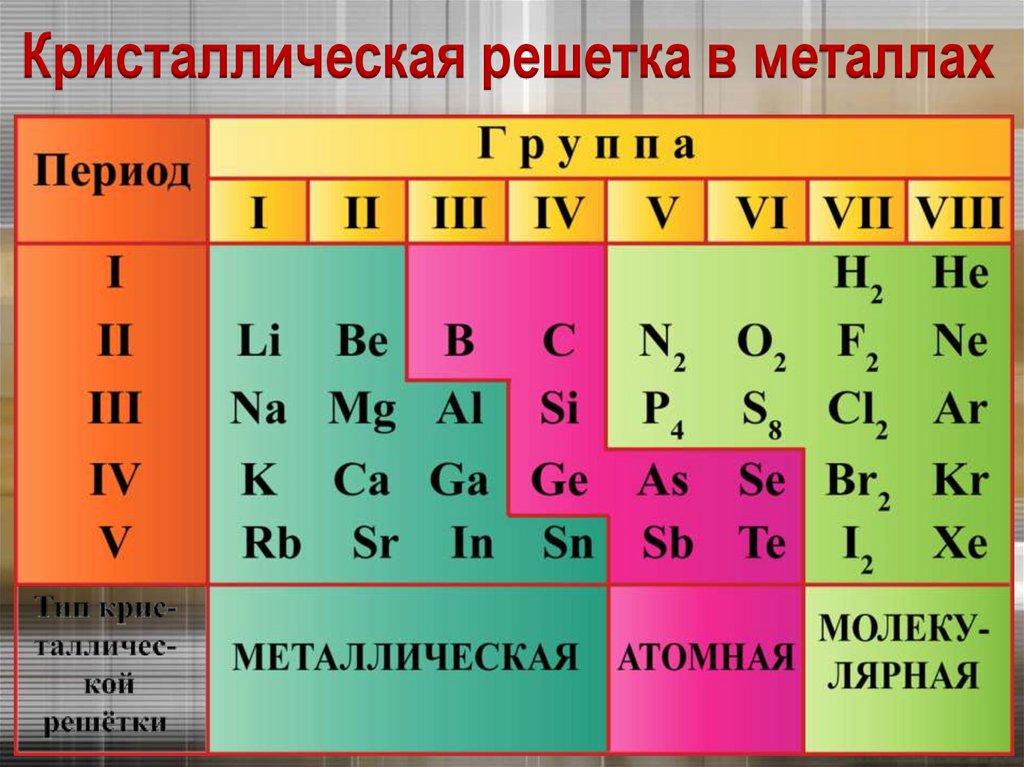
Химическая связь в металлахМеталлическая связь –
это связь в металлах и
сплавах между атомионами металлов,
расположенными в узлах
кристаллической
решётки, осуществляемая
обобществлёнными
внешними электронами.
8.
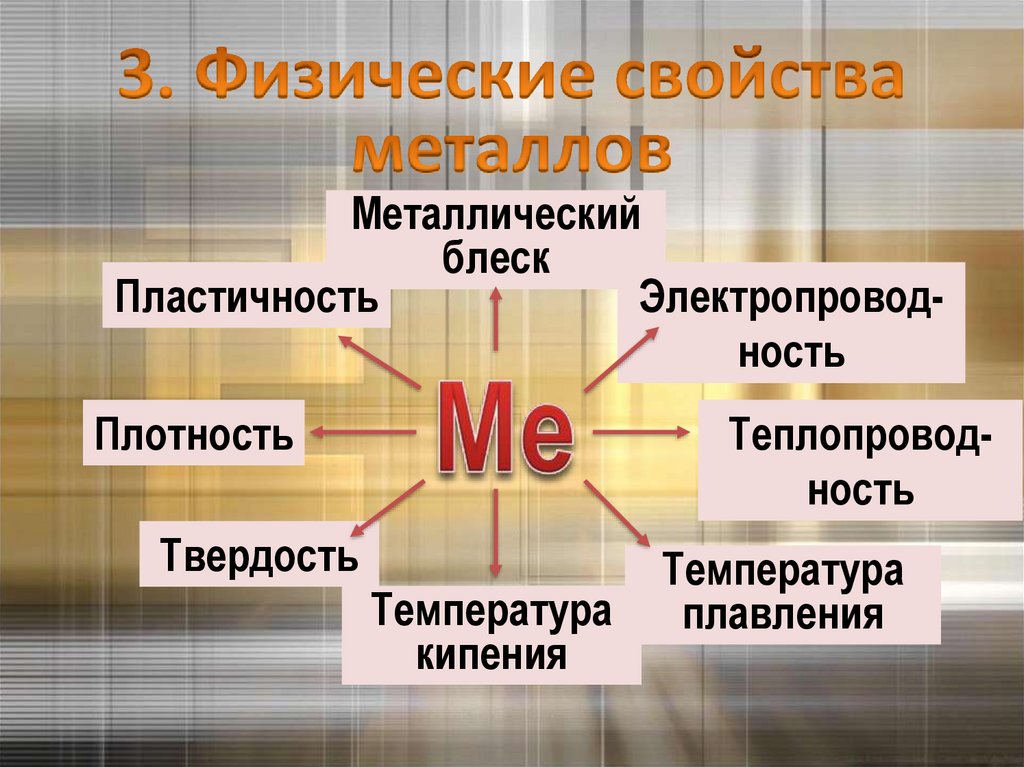
Кристаллическая решетка в металлах9.
Металлическийблеск
Пластичность
Электропроводность
Плотность
Теплопроводность
Твердость
Температура
кипения
Температура
плавления
10.
1. Металлический блескСамые блестящие металлы – Hg, Ag, Pd.
В порошке все металлы, кроме Al и Mg,
теряют блеск и имеют чёрный или
тёмно-серый цвет.
11.
12.
2. Электропроводностьи теплопроводность
В ряду:
Ag→Cu → Al → Fe уменьшается.
Наименьшая электропроводность в ряду:
Mn → Pb → Hg.
13.
14.
2. Электропроводностьи теплопроводность
При нагревании электропроводность
уменьшается, т.к. с повышением температуры
усиливаются колебания атомов и ионов в узлах
кристаллической решетки, что затрудняет
направленное движение "электронного газа".
15.
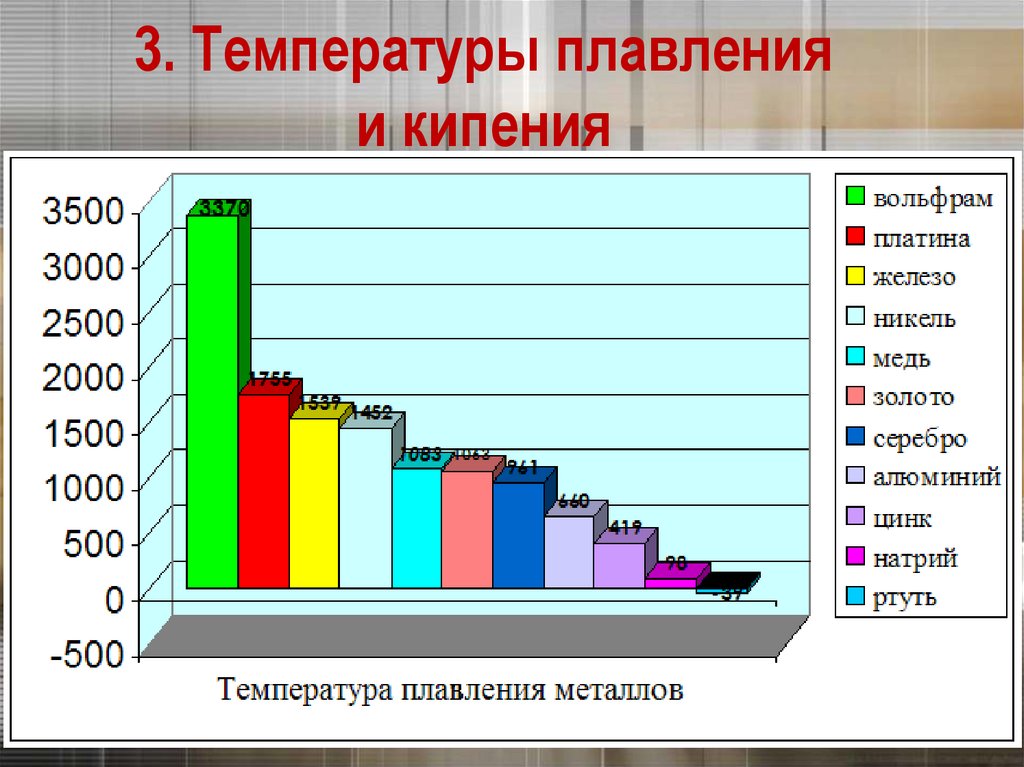
3. Температуры плавленияи кипения
Вольфрам
Калий
Ртуть
16.
3. Температуры плавленияи кипения
17.
3. Температуры плавленияи кипения
Самый легкоплавкий металл – ртуть (т.пл. = -39°C),
самый тугоплавкий металл –
вольфрам (t°пл. = 3370°C).
Металлы с t°пл. выше 1000°C считаются
тугоплавкими, ниже – низкоплавкими.
18.
Нить накаливания19.
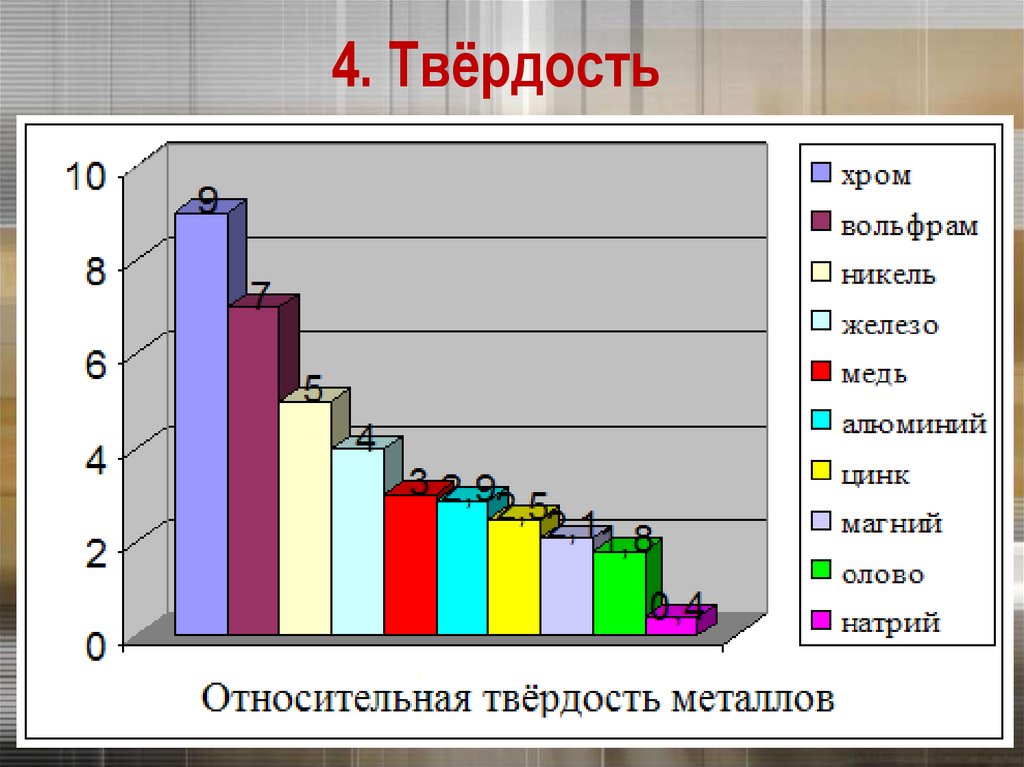
4. ТвёрдостьЩелочные металлы режутся ножом
20.
4. Твёрдость21.
Хром – самыйтвёрдый металл
22.
4. ТвёрдостьСамый твердый – хром (режет стекло).
Самые мягкие – щелочные металлы – калий,
натрий, рубидий и цезий – режутся ножом.
23.
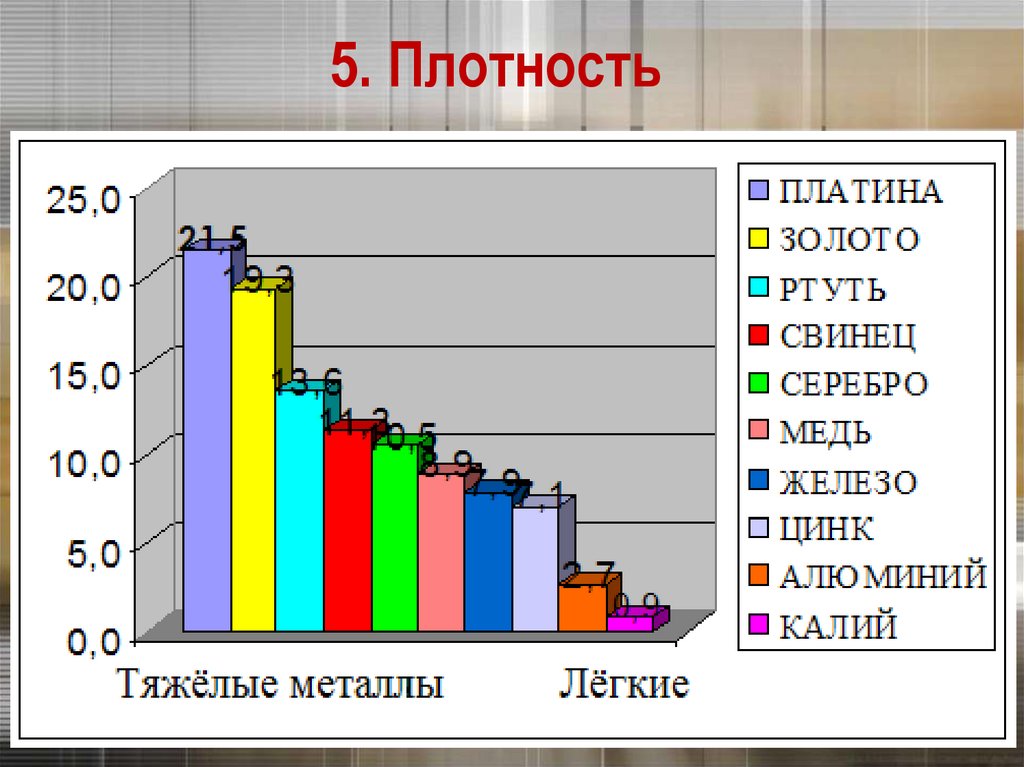
5. ПлотностьПлотность тем меньше, чем меньше атомная
масса металла и чем больше радиус его атома
Платина и золото – одни из тяжёлых металлов
24.
5. Плотность25.
5. ПлотностьСамый легкий – литий (ρ =0,53 г/см3), всплывает
в керосине.
Самый тяжелый – осмий (ρ =22,6 г/см3).
26.
Литий – самыйлёгкий металл
27.
Осмий – самыйОсмий –металл
самый
дорогой
тяжёлый
(изотопметалл
187)
28.
6. ПластичностьПластичность - способность изменять форму
при ударе, вытягиваться в проволоку,
прокатываться в тонкие листы. В ряду :
Au→Ag → Cu → Sn → Pb → Zn → Fe
уменьшается.
29.
Сусальное золото30.
Ряд активности металловпоследовательность, в которой металлы расположены в
порядке увеличения их стандартных электрохимических
потенциалов
Увеличение
восстановительных свойств
31.
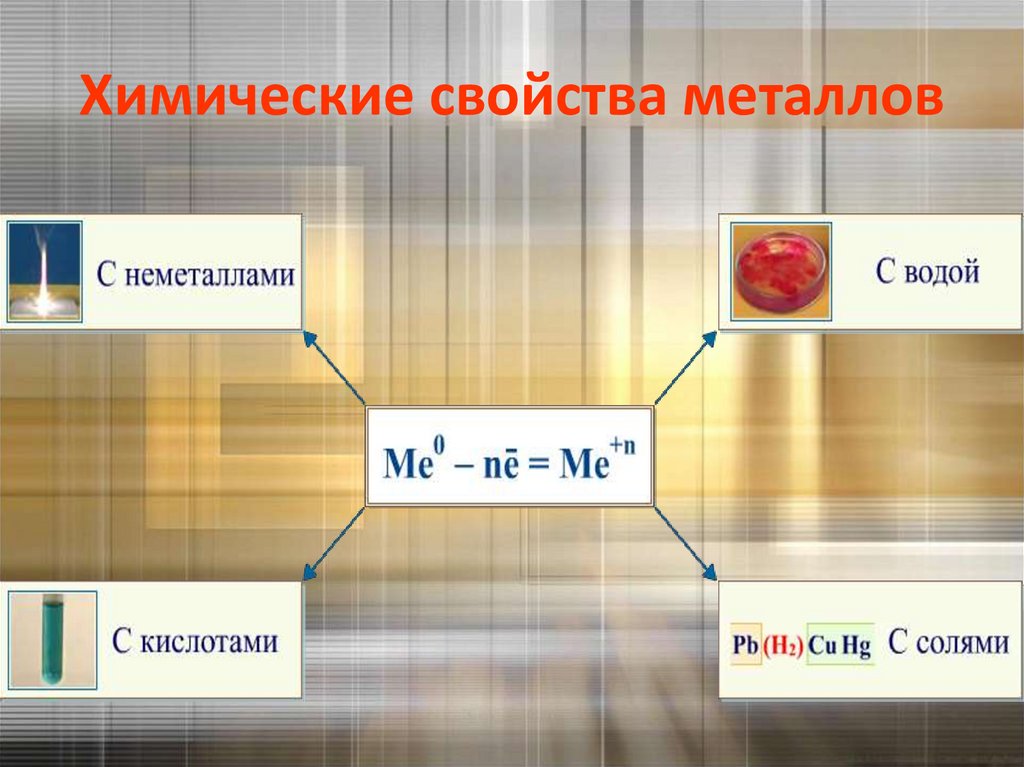
Химические свойства металлов32.
Взаимодействие с неметаллами:• с кислородом
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb Cu Hg
Ag
При обычных
условиях
4Li + O2 → 2Li2O
2Na + O2 → Na2O2
Медленно или при
нагревании
4Al + O2 → 2Al2O3
3Fe + 2O2 = Fe3O4
Pt Au
M + O2
≠
33.
Взаимодействие со сложными веществами:с водой
Li K Ca Na
Mg Al Zn Cr Fe Ni Pb
Cu Hg Ag Pt Au
(H2)
При обычных
условиях
2Me + 2H2O =
2MeOH + H2
При нагревании
M + H2O ≠
3Fe + 4H2O → Fe3O4 +
4H2
34.
Взаимодействие растворами кислотLi K Ca Na Mg Al |Zn Cr Fe Ni Pb (H2) Cu Hg Ag Pt
Au
Zn + 2HCl → ZnCl2 + H2
Не вытесняют
H2↑ из
растворов
кислот
35.
Взаимодействие с растворами солей«Каждый металл вытесняет из растворов солей
другие металлы, находящиеся правее него в ряду
напряжений, и сам может быть вытеснен
металлами, расположенными левее»
Fe + CuSO4 → Cu↓ +FeSO4
36.
Какие реакции практически осуществимы?Реагирующие
вещества
О2
Н2О
HCl
(раствор)
Pb(NO3)2
раствор
K
Ca
Fe
Cu
Au
37.
1.Zn+2HCl→2.Сu+HCl→
3.Fe+CuSO4→
4.Cu+FeCl2→
5.Cu+O2→
38.
Выводы :Все металлы имеют --------------- кристаллическую
решетку.
В металлах осуществляется --------------------- связь.
Основные физические свойства металлов –
металлический блеск, электро- и теплопроводность,
пластичность обусловлены ----------------------металлов.
Металлы проявляют только ------------------------свойства,
потому что в реакциях они всегда ---------- свои
электроны.
Металлы используют в основном в виде --------------.






























 Химия
Химия








