Похожие презентации:
Металлы
1.
МеталлыМеталлы – это элементы, атомы которых
легко отдают электроны внешнего
(а
некоторые
и
предвнешнего)
электронного
слоя,
превращаясь
в
положительные ионы.
2.
Группы элементовПери –
оды
1
2
3
I
II
Н
Li
Литий
Натрий
4
Ag
56 57
Барий
*
Hg ТI
80
Rа
81
Таллий
88 89
Франций
Радий
R2О
RO
**
32 As
Zr
Цирконий
Sn
VIII
2
Олово
R2O3
Nb
Ниобий
51 Тe
Тантал
82 Вi
Свинец
Вольфрам
Висмут
105
Db
Резерфордий Дубний
Технеций
Кобальт
75
Sg
Сиборгий
Ni
Никель
36
44
Ru
Рутений
45
Rh
Родий
46
Pd
Палладий
Xe
54
Ксенон
Re
Рений
76
Оs
Осмий
77
Ir
Иридий
Bh
Борий
RO2
R2O5
RO3
R2O7
RH4
RH3
RH2
RH
78
Рt
Платина
Rn
85
Радон
Астат
107
28
Кr
53
84 At
Полоний
106
Железо
Со
27
Йод
W
83 Ро
Fe
Криптон
52 I
Теллур
74
26
35
Тс
43
18
Аргон
Бром
Молибден
Та
73
Ar
17
34 Br
Мо
42
10
Неон
Марганец
Селен
Сурьма
Гафний
Pb
41
Фтор
Cr 25 Мn
24
Хром
Мышьяк
Nе
9
Хлор
33 Se
50 Sb
Ас 104 Rf
Актиний
V
F
17 Cl
Сера
Ванадий
La 72 Hf
Лантан
Ртуть
87
49
Индий
55 Ва
Аu
Fr
Сd In
48
Кадмий
Цезий
79
Иттрий
40
8
15 S
Ti 23
Германий
О
Кислород
Фосфор
Титан
Y
7
Азот
Кремний
31 Ge
38 39
N
14 P
Sc 22
Галлий
Стронций
6
13 Si
Zn Ga
37 Sr
С
Углерод
Скандий
Цинк
Рубидий
47
30
Бор
20 21
Кальций
Сu
29
5
Алюминий
19 Сa
Калий
В
12 Al
Магний
Золото
ЛВС
Ве
11 Мg
Na
Cs
Высшие
оксиды
VII
Не
Бериллий
Серебро
7
VI
Гелий
3
Rb
6
V
Водород
Медь
5
IV
1
К
4
III
108
Hs
Хассий
109
Мt
Мейтнерий
RO4
86
3.
Положение металлов в ПСХЭLi
В
Условная граница между элементаминеметаллами и элементами металлами
проходит ниже диагонали B – Si – As – Te –
At.
Металлы составляют
побочные подгруппы.
Fr
At
все
4.
Мы знаем, что…- В атомах металлов на внешнем электронном слое
небольшое число электронов = номеру группы
- Атомы
металлов
отдают
валентные
электроны,
превращаясь в катионы
- Атомы
металлов
соединяются
друг
с
другом
металлической связью
- Атомы
металлов,
соединенные
друг
с
другом
металлической связью, образуют простые вещества с
металлической кристаллической решеткой
М0 ─ nе ↔ Мn+
атом
катион
5.
Физические свойства металловМеталлы проводят электрический ток и тепло
электропроводность
теплопроводность
6.
Физические свойства металловФизические свойства
металлов
Чем
обусловлены
свойства?
У каких металлов
наиболее
выражены
Электропроводность
Наличие
«свободных
электронов»
Ag, Cu, Al
Теплопроводность
Наличие
«свободных
электронов»
Ag, Cu, Al
7.
Физические свойства металловМеталлы
обладают
металлическим
блеском
8.
Физические свойства металловФизические свойства
металлов
Чем
обусловлены
свойства?
У каких металлов
наиболее
выражены
Металлический
блеск
Наличие
«свободных
электронов»
Ag, Hg, Pd
9.
Физические свойства металловМеталлы
ковки и
пластичны
10.
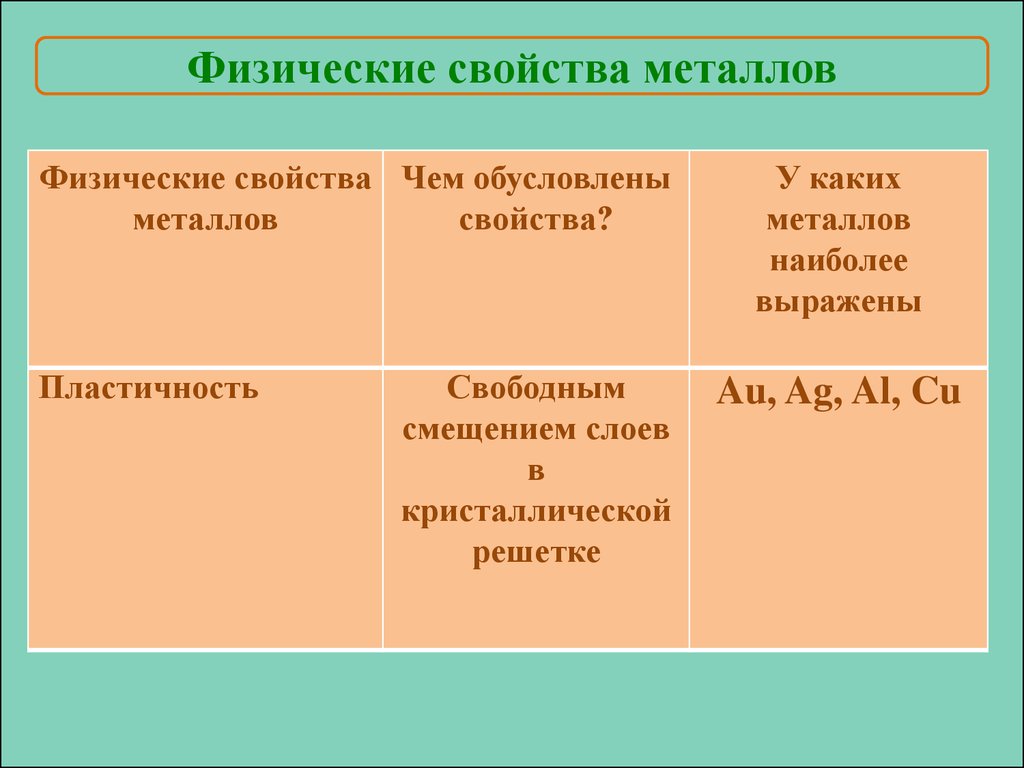
Физические свойства металловФизические свойства Чем обусловлены
металлов
свойства?
Пластичность
Свободным
смещением слоев
в
кристаллической
решетке
У каких
металлов
наиболее
выражены
Au, Ag, Al, Cu
11.
Физические свойства металловФизические свойства
металлов
Плотность
Чем
обусловлены
свойства?
У каких металлов
наиболее
выражены
Атомной массой
и радиусом
атома
Легкие:
Li, Na, Al
Тяжелые:
Fe, Pb, Os
12.
Физические свойства металловОтносительная твердость некоторых металлов
13.
Физические свойства металловТемпература плавления некоторых металлов
Легкоплавкие
Тугоплавкие
14.
Физические свойства металловФизические свойства
металлов
Чем
обусловлены
свойства?
У каких металлов
наиболее
выражены
Твердость
От прочности
металлической
связи (количества
электронов,
участвующих в
образовании связи)
W, Cr
Температура
плавления
От прочности
металлической
связи (количества
электронов,
участвующих в
образовании связи)
Легкоплавкие:
Cs, Na, Sn
Тугоплавкие:
Cu, Fe, W
15.
Химические свойства металловнеМе
О2
Н 2О
Ме
+
Оксиды металлов
Кислоты
Соли
2Na + Cl2 → 2NaCl
Cl20 +Na0→ ?
4Al + 3O2 → 2Al2O3
О2 +Al → ?
2Na+2Н2О→2NaOH+H2
H2O +Na→ ?
Al + Fe2O3 → Al2O3 + Fe
Al + Fe2O3 → ?
Zn + HCL → ZnCl2 + H2
Zn+HCl → ?
Fe + CuCl2→ FeCl2 + Cu
Fe+CuCl2→
?
16.
Особенности химических реакций металлов:При взаимодействии с кислородом
металлы могут образовать
различные по составу продукты: оксиды (основные и амфотерные), а
также пероксиды:
Например, 2Na + O2 = Na2O2 (пероксид натрия)
Взаимодействие металлов с водой, если металл – щелочной,
щелочно-земельный или алюминий:
M + H2O → M(OH)n + H2↑
Взаимодействие металлов с водой, если металл находится в
электрохимическом ряду напряжений от марганца до свинца (вкл.):
t
M + H2O → MxOy + H2↑
Взаимодействие металлов с водой, если металл находится в
электрохимическом ряду напряжений после водорода:
M + H 2O →
17.
Взаимодействие металлов с кислотамиM + HmAc → MxAcy + H2↑
1) Металл должен находиться в электрохимическом ряду
напряжений левее водорода.
2) Для реакций не рекомендуется использовать щелочные
металлы, т.к. они сначала взаимодействуют с водой.
3) В результате реакции должна образоваться растворимая
соль, т.к. в противном случае она покроет металл осадком и
доступ кислоты к металлу прекратится.
4) По-особому взаимодействуют с металлами азотная и
концентрированная серная кислоты.
18.
Взаимодействие металлов с растворами солейM + M/xAcy → MxAcy + М/
1) Металл должен находиться в электрохимическом ряду
напряжений левее металла, образующего соль.
2) Для реакций не рекомендуется использовать щелочные
металлы, т.к. они сначала взаимодействуют с водой.
3) В результате реакции должна образоваться растворимая
соль, т.к. в противном случае она покроет металл осадком и
доступ раствора соли к металлу прекратится.
19.
Общие способы получения металлов- Пирометаллургия
– получение металлов и сплавов под
действием высоких температур.
- Гидрометаллургия – получение металлов из водных
растворов.
- Электрометаллургия – получение
действием электрического тока.
металлов
под
20.
Общие способы получения металловПирометаллургия
- Восстановление углем (угарным газом):
2PbO + C = CO2 + 2Pb
- Восстановление алюминием (кальцием):
2Al + Fe2O3 = Al2O3 + 2Fe
- Восстановление водородом:
СuO + H2 = Cu + H2O
21.
Общие способы получения металловГидрометаллургия
1 стадия: растворение в кислоте
минералов, содержащих металлы:
нерастворимых
CuS + 2HCl = CuCl2 + H2S
2 стадия: вытеснение металлов из растворов их солей более
активными металлами:
CuCl2 + Fe = FeCl2 + Cu
22.
Общие способы получения металловЭлектрометаллургия
Электролиз расплавов:
KCl → K+ + Cl─
катод (─) K+ +1e → K0
анод (+) 2Cl─ ─ 2e → Cl20
эл.ток
2KCl
→
2K + Cl2↑
Этим способом в промышленности получают металлы,
стоящие в ряду напряжений металлов до Al.
23.
Коррозия металловСамопроизвольное
разрушение
металлических
материалов, происходящее под воздействием окружающей
среды, называется коррозией.
Химическая
4Fe + 6H2O + 3O2 = 4Fe(OH)3
Коррозия железа и
образование ржавчины
Электрохимическая
Коррозия железа в контакте с
медью и в растворе соляной
кислоты:
Катод 2Н+ + 2е = Н2
Анод Fe2+ - 2e = Fe0
24.
Способы защиты металлов от коррозииЗащита более активным металлом;
Отделение металла от агрессивной среды;
Использование замедлителей коррозии;
Электрозащита;
Пассивация металлов;
Изготовление сплавов, стойких к коррозии.























 Химия
Химия








