Похожие презентации:
Молекулярная физика и термодинамика
1.
Сегодня: четверг, 19 июня, 2025Молекулярная физика и
термодинамика
Степанова Екатерина Николаевна
доцент кафедры ОФ ФТИ ТПУ
2.
Лекция 2.ЭНТРОПИЯ. ВТОРОЕ И
ТРЕТЬЕ НАЧАЛА ТЕРМОДИНАМИКИ
2.1. Приведённая теплота. Энтропия
2.2 Изменение энтропии
2.3 Поведение энтропии в процессах изменения
агрегатного состояния
2.4 Изменение энтропии в обратимых и
необратимых процессах
2.5 Второе начало термодинамики
2.6 Свободная и связанная энергии
2.7 Статистический смысл энтропии
2.8 Третье начало термодинамики
2
3.
2.1. Приведённая теплота. ЭнтропияИз цикла Карно следует, что отношение количества
теплоты к температуре, при которой они были получены или
отданы в изотермическом процессе, равны между собой:
Q1 Q2
T1
T2
Отношение теплоты Q в изотермическом процессе к
температуре, при которой происходила передача теплоты,
называется приведённой теплотой Q':
Q
Q
T
3
4.
Для подсчёта приведённой теплоты в произвольном процессенеобходимо разбить этот процесс на бесконечно малые
участки, где T можно считать постоянной. Приведённая
теплота на таком участке будет равна Q/T.
Суммируя приведённую теплоту на всех участках процесса,
получим
2
Q
Q1 2
T
2
Тогда в обратимом цикле Карно имеем
В
C
D
A
Q
Q
Q
Q
QКарно
T
T C T2 D T
А 1
B
Этот результат справедлив для любого обратимого процесса.
4
5.
Для процесса по замкнутому циклуQобр
T
0
Из равенства нулю интеграла, взятого по замкнутому
контуру, следует, что Q/T есть полный дифференциал
некоторой функции, которая определяется только состоянием
системы и не зависит от пути, каким система пришла в это
состояние.
5
6.
Функция состояния, дифференциал которой является Q/T,называется энтропией (от греч. entropia – поворот,
превращение) и обозначается S
Q
dS
T обр
Энтропия S – отношение изменения теплоты к температуре,
при которой происходил процесс.
Понятие энтропии было введено Клаузиусом в 1854 г.
Для обратимых процессов изменение энтропии равно нулю,
т.к.
Qобр
T
0
– равенство Клаузиуса
6
7.
Клаузиус Рудольф(1822–1888)
– немецкий физик-теоретик, один из
создателей термодинамики и кинетической
теории газов. Его работы посвящены
молекулярной физике, термодинамике,
теории
паровых
машин,
теоретической
механике,
математической физике. Развивая идеи Карно, точно
сформулировал принцип эквивалентности теплоты и работы.
В 1850 г. Получил общие соотношения между теплотой и
механической работой (первое начало термодинамики) и
разработал идеальный термодинамический цикл паровой
машины (цикл Ранкина–Клаузиуса).
7
8.
2.2. Изменение энтропии в изопроцессахЭнтропия системы является функцией ее состояния,
определенной с точностью до произвольной постоянной.
Если система совершает равновесный переход из состояния
1 в состояние 2, то изменение энтропии
2
2
Q
dU A
S1 2 S 2 S1
T
T
1
1
Таким образом, можно определить энтропию лишь с
точностью до аддитивной постоянной, то есть начало
энтропии произвольно.
Физический смысл имеет лишь разность энтропий.
8
9.
Учтя, чтоim
m
dU
RdT CV dT
2
m
dV
A pdV RT
V
Исходя из этого, изменение энтропии в процессах
идеального газа равно
m
T2 m
V2
S CV ln R ln
T1
V1
Таким образом, изменение энтропии S1→2 идеального
газа при переходе его из состояния 1 в состояние 2 не
зависит от вида перехода 1→2.
9
10.
10Каждый из изопроцессов идеального газа
характеризуется своим изменением энтропии,
а именно:
1. Изохорический процесс
m
T2
S CV ln
T1
т.к. V1=V2
2. Изобарический процесс
T2
m
dT2 m
T2
S C P
C P ln , т.к. Р1=Р2
T
T1
T1
1
11.
113. Изотермический процесс
m
V2
S R ln ,
V1
т.к. Т1=Т2
4. Адиабатический процесс
S = 0,
т.к.
Q = 0
В этом случае адиабатический процесс
называют изоэнтропийным процессом, т.к.
S = const
12.
2.3. Изменение энтропии в процессах измененияагрегатного состояния
Три агрегатных состояния:
Твердое,
Жидкое,
Газообразное
и два перехода к ним.
12
13.
131. Фазовый переход «твердое тело – жидкость»
1: переход вещества из твердого состояния (фазы) в жидкое называется
плавлением, а обратный – кристаллизацией.
2: при плавлении система поглощает тепло, а при отвердевании – отдает тепло.
3: в процессе плавления температура системы остается постоянной до тех пор,
пока вся система не расплавится. Эта температура называется температурой
плавления.
4:
закон
плавления
и
кристаллизации:
количество
тепла
Q,
необходимое для плавления (кристаллизации) вещества массой dm,
пропорционально этой массе:
Q = dm
λ - удельная теплота плавления (кристаллизации)
14.
Изменение энтропии в процессе фазового переходаможно найти, если считать процесс равновесным.
m
S
Tпл
Следовательно, при плавлении энтропия возрастает, а
при кристаллизации уменьшается.
14
15.
Физический смыслФазовая область молекулы в твердом теле гораздо меньше,
чем в жидкости, так как в твердом теле каждой молекуле
доступна
только
малая
область
пространства
между
соседними узлами кристаллической решетки, а в жидкости
молекулы занимают всю область пространства. Поэтому при
равной температуре энтропия твердого тела меньше энтропии
жидкости. Это означает, что твердое тело представляет собой
более упорядоченную, и менее хаотичную систему, чем
жидкость.
15
16.
2. Фазовый переход «жидкость – газ»1: переход вещества из жидкости в газовую фазу
называется испарением, а обратный переход –
конденсацией.
2: при испарении система поглощает тепло, при
конденсации – теряет.
3: процессы испарения и конденсации являются
фазовым переходом лишь тогда, когда процесс
захватывает всю массу вещества и происходит при
определенной температуре Tк – температуре кипения,
которая остается постоянной до тех пор, пока вся
система не перейдет из одной фазы в другую.
16
17.
174: Закон испарения и конденсации: количество тепла Q, необходимое
для испарения вещества массой dm, и пропорциональное этой массе:
Q = rdm,
где
r – удельная теплота испарения (конденсации)
Применение энтропии в этом процессе можно найти, считая процесс
равновесным, что вполне допустимо при условии, что разность
температур между системой и источником тепла намного меньше
температуры кипения:
S2
При
2
2
Q
r m
S S 2 S1 dS
rdm
T
Tк
испарении энтропия
возрастает,
S1
1
1а при конденсации
уменьшается.
–
18.
Физический смыслПри равных температурах фазовая область молекул газа
значительно больше фазовой области молекул жидкости,
и энтропия газа больше энтропии жидкости. Газ, по
сравнению с жидкостью, гораздо менее упорядоченная,
более хаотичная система.
18
19.
2.4. Изменения энтропиипри обратимых и необратимых процессах
Энтропия – отношение полученной или отданной системой
теплоты в обратимом процессе к температуре, при которой
происходит эта передача.
S
Qобр
T
Энтропия – величина аддитивная,
аддитивная то есть она равна сумме
энтропий всех тел, входящих в систему.
S Sk
k
19
20.
Обратимый цикл КарноВ тепловой машине, работающей по принципу Карно,
имеются три тела:
холодильник,
нагреватель,
рабочее тело (газ).
Изменение энтропии газа в тепловой машине Sгаза = 0, так как
газ возвращается в исходное состояние.
20
21.
Изменение энтропии нагревателя:Q1
S нагр
T1
Изменение энтропии холодильника:
Q2
S хол
T2
Тогда
Q1 Q2
S нагр S хол
T1
T2
21
22.
Q1 Q2Sцикла Карно S нагр S хол
0
T1
T2
Sцикла Карно 0
S – константа
Равенство Клаузиуса
Qобр
Т
0
22
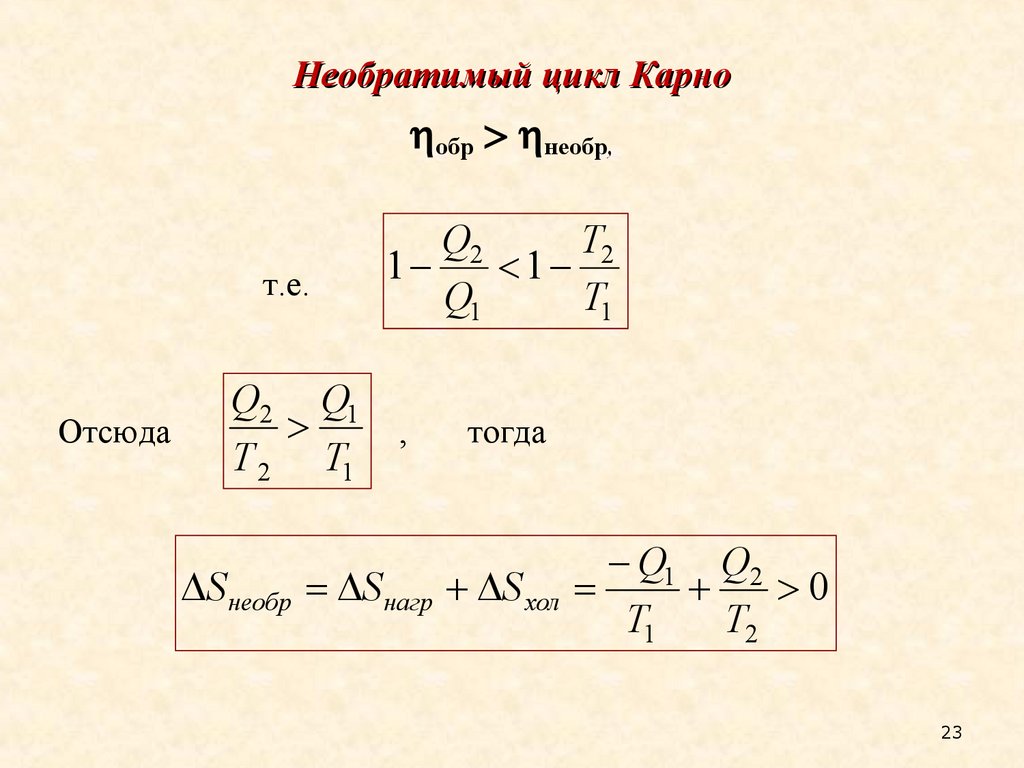
23.
Необратимый цикл Карнообр необр,
т.е.
Отсюда
Q2
T2
1
1
Q1
T1
Q2 Q1
,
Т 2 T1
тогда
Q1 Q2
S необр S нагр S хол
0
T1
T2
23
24.
Таким образом,Sнеобр 0
или
Q
T 0
Это выражение называют неравенством Клаузиуса: при
любом необратимом процессе в замкнутой системе энтропия
возрастает
(dS > 0).
24
25.
2.5. Второе начало термодинамикиТермодинамика – это наука о тепловых процессах, о
превращении тепловой энергии.
Для описания термодинамических процессов первого
начала термодинамики недостаточно, т.к. оно выражает
общий закон сохранения и превращения энергии, но не
позволяет определить направление протекания процессов.
25
26.
Исторически второе начало термодинамики возникло изанализа работы тепловых двигателей.
Рассмотрим схему теплового двигателя. От термостата с
более высокой температурой Т1, называемого нагревателем, за
цикл отнимается количество теплоты Q1, а термостату с более
низкой температурой Т2, называемому холодильником, за цикл
передается количество теплоты Q2 и совершается работа
A Q1 Q2
26
27.
Вечный двигатель второго родаЧтобы
термический
коэффициент
полезного
действия
теплового двигателя был µ = 1, должно быть выполнено
условие Q2 = 0, то есть тепловой двигатель должен иметь один
источник теплоты, а это невозможно. Такой двигатель
называется вечным двигателем второго рода.
27
28.
В 1824 году Карно доказал, что для работытеплового двигателя необходимо не менее
двух источников теплоты с различными
температурами.
Невозможность создания вечного двигателя
второго рода подтверждается вторым
началом термодинамики.
Некоторые формулировки второго начала термодинамики:
Кельвин: невозможен процесс, единственным результатом
которого является превращение всей теплоты, полученной от
нагревателя в эквивалентную ей работу.
Томпсон–Планк: невозможен вечный двигатель второго рода.
Клаузиус: невозможен процесс, единственным результатом
которого является передача энергии в форме теплоты от
холодного тела к горячему.
28
29.
Математическойформулировкой
второго
начала
термодинамики является выражение
dS 0
Энтропия замкнутой системы при любых происходивших в
ней процессах не может убывать (или увеличивается, или
остается неизменной).
Первое и второе начала термодинамики в объединенной
форме имеют вид:
TdS dU + A
29
30.
2.6. Свободная и связанная энергииКак следует из объединенной формулы первого и второго
начала термодинамики
A = (dU TdS)
Это равенство можно переписать в виде
A = d(U TS) SdT
U – TS = F,
Пусть
где F – свободная энергия.
Тогда
A = (dF + SdT)
30
31.
Если тело совершает обратимый изотермический процесс, тоdT = 0, следовательно
2
A dF dF ( F2 F1 ) F2 F1
1
то есть
Аизотерм. = F1 F2
Следовательно, свободная энергия – работа, которую могло
бы совершить тело в обратимом изотермическом процессе,
или свободная энергия есть максимальная возможная работа,
которую может совершить система, обладая каким-то
запасом внутренней энергии.
31
32.
Внутренняя энергия системы U равна сумме свободной (F)и связанной энергии (TS):
U = F + TS
Связанная энергия – та часть внутренней энергии, которая
не может быть превращена в работу, – это обесцененная часть
внутренней энергии.
32
33.
При одной и той же температуре связанная энергия тембольше, чем больше энтропия.
Таким
образом,
энтропия
системы
есть
мера
обесцененности её энергии, то есть мера той энергии, которая
не может быть превращена в работу.
В термодинамике есть понятие энергетической потери в
изолированной системе:
П = Тмин S
Tмин – температура окружающей среды.
33
34.
При любом необратимом процессе энергия увеличиваетсядо того, пока не прекратятся какие-либо процессы, т.е. пока
не станет F = 0. И это произойдет при достижении замкнутой
системой равновесного состояния, т.е. когда все параметры
состояния системы (Р, Т) во всех точках системы станут
одинаковыми. Вывести систему из этого равновесного
состояния, можно только затратив энергию извне.
34
35.
2.7. Статистический смысл энтропииПосмотрим на энтропию с другой стороны.
Макросостояние
–
это
состояние
вещества,
характеризуемое его термодинамическими параметрами
Микросостояние – состояние системы, характеризуемое
состоянием каждой входящей в систему молекулы.
Так как молекулы движутся хаотически, то много
микросостояний, соответствующих одному макросостоянию.
Обозначим W – число микросостояний, соответствующее
данному макросостоянию (как правило, W >> 1).
35
36.
Термодинамическая вероятность или статистическийвес
макросостояния
осуществляющих
перестановок
W
–
число
микросостояний,
данное
макросостояние
одноименных
элементов,
или
при
число
которых
сохраняется данное макросостояние.
Термодинамическая вероятность W максимальна, когда
система находится в равновесном состоянии.
36
37.
В состоянии равновесия термодинамическая вероятность(W) и энтропия (S) максимальнs. Из этого можно сделать
вывод, что между ними существует связь.
Больцман предложил зависимость:
S = k lnW
где k – коэффициент Больцмана.
С этой точки зрения энтропия выступает как мера
беспорядочности, хаотичности состояния.
37
38.
Связьмежду
S
и
W
позволяет
несколько
иначе
сформулировать второе начало термодинамики: наиболее
вероятным изменением энтропии является её возрастание.
Энтропия – вероятностная статистическая величина.
Утверждение
о
возрастании
энтропии
потеряло
свою
категоричность. Её увеличение вероятно, но не исключаются
флуктуации.
38
39.
На основе этих рассуждений Клаузиус в 1867 году ивыдвинул гипотезу о тепловой смерти Вселенной.
Больцман один из первых опроверг эту гипотезу и показал,
что закон возрастания энтропии – статистический закон, то
есть возможны отклонения.
Российские
физики
Зельдович
и
Новиков
также
опровергли эту теорию и показали, что Клаузиус не учел, что
Вселенная не стационарна и в будущем не перейдет к одному
состоянию, так как она эволюционирует, не остается
статичной.
Энтропия
замкнутой
системы
максимальна
достижении системой равновесного состояния.
при
39
40.
2.8. Третье начало термодинамикиПервое и второе начала термодинамики не позволяет
определить значение энтропии при абсолютном нуле Т = 0 К.
На основании обобщения экспериментальных исследований
свойств различных веществ при сверхнизких температурах
был установлен закон, устранивший указанный недостаток.
Сформулировал его в 1906 году Нернст, и называл третьим
началом термодинамики, или теоремой Нернста.
40
41.
Нернст Вальтер Фридрих Герман(1864–1941 гг.)
– немецкий физик и физикохимик, один
из основоположников физической химии,
лауреат Нобелевской премии по
химии в 1920 году «в признание его работ
по термодинамике».
Работы в области термодинамики, физики низких
температур, физической химии. Высказал утверждение, что
энтропия химически однородного твердого или жидкого тела
при абсолютном нуле равна нулю.
41
42.
Согласно Нернсту, изменение энтропии ∆S стремится кнулю при любых обратимых изотермических процессах,
совершаемых между двумя равновесными состояниями при
температурах, приближающихся к абсолютному нулю (∆S
0, при Т 0).
Нернст сформулировал теорему для изолированных систем,
а затем Планк распространил её на случай любых систем,
находящихся в термодинамическом равновесии.
42
43.
Как первое и второе начала термодинамики, теоремаНернста может рассматриваться как результат обобщения
опытных фактов, поэтому ее часто называют третьим началом
термодинамики.
Иногда его формулируют следующим образом: энтропия
любой
равновесной
системы
при
абсолютном
нуле
температуры может быть равна нулю.
43
44.
TQ
Отсюда следует, что при T 0 интеграл
T
Т0
сходится на нижнем пределе, то есть имеет конечное
значение S(0)=const или S(0)=0, причем равенство нулю
рассматривается как наиболее вероятное.
Нулевое же значение энтропии (меры беспорядка)
соответствует отсутствию теплового движения при
абсолютном нуле.
44
45.
При T = 0 внутренняя энергия и тепловая функция системыпрекращают зависеть от температуры.
Кроме того, используя метод термодинамических функций,
можно показать, что при T = 0 от температуры не зависит
коэффициент
коэффициент
объемного
давления
и
расширения,
другие
термический
параметры
системы.
Согласно классическим представлениям при абсолютном нуле
возможно непрерывное множество микросостояний системы.
45
46.
Объяснениетеоремы
Нернста
можно
дать
только
на
основании квантово-механических представлений.
Третье начало термодинамики можно сформулировать
следующим способом: при абсолютном нуле температуры
любые
изменения
термодинамической
системы
происходят без изменения энтропии.
ΔST=0 = 0,
то есть
ST=0 = const
или
ST=0 = 0
46
47.
Принцип Нернста был развит Планком, предположившим,что при абсолютном нуле температуры энергия системы
минимальна.
Тогда можно считать, что при абсолютном нуле система
имеет одно квантовое состояние:
ST=0 = 0
S = k lnW,
a
W = 1,
то
ST=0 = k ln1 = 0
Значит, термодинамическая вероятность W при Т = 0 К
должна быть равна единице, что недостижимо.
47
48.
Следствие третьего начала термодинамикиНевозможно охладить тело до абсолютного нуля T = 0 K
(принцип недостижимости абсолютного нуля
температуры).
Иначе был бы возможен вечный двигатель II рода.
48















































 Физика
Физика








