Похожие презентации:
Термодинамика. Первое начало термодинамики
1.
ТермодинамикаТермодинамика: раздел физики, изучающий соотношения и превращения
теплоты и других форм энергии.
В термодинамике имеют дело с макроскопическими телами, состоящими
из огромного числа атомов и молекул. Эти тела называются
термодинамическими системами.
Состояние такой макросистемы характеризуют термодинамическими
параметрами.
Обычно это давление p, объём V и температура T (неприменимы к
отдельным атомам или молекулам).
Обратимые и необратимые процессы
Квазистатический (равновесный) процесс
Квазистатические (равновесные) процессы обратимы
(может быть изображён на диаграмме).
2.
Первое начало термодинамикиВ дифференциальной форме
Q dU A
Q dU pdV
C p CV R
Формула Майера
Постоянная адиабаты:
Cp
CV
3.
Изопроцессы. Работа в изопроцессах (квазистатических,равновесных)
2
V2
1
V1
A pdV
pdV
Работа - не функция
состояния
Изохорический процесс: V=const.
A 0
Изобарический процесс: p=const.
A p(V2 V1 )
Изотермический процесс: Т = const
Адиабатический процесс: δQ = 0
V2
A RT ln
V1
A ?
4.
Работа в изопроцессахАдиабатический процесс: δQ = 0.
Адиабатическим называется процесс, протекающий при
отсутствии теплообмена с окружающими телами.
Согласно первому началу (
0 dU A
или
Q dU A ),
A dU
При адиабатическом расширении работа совершается газом за
счет уменьшения его внутренней энергии, газ охлаждается.
При адиабатическом сжатии над газом совершается работа,
которая целиком идёт на приращение внутренней энергии газа,
газ нагревается.
5.
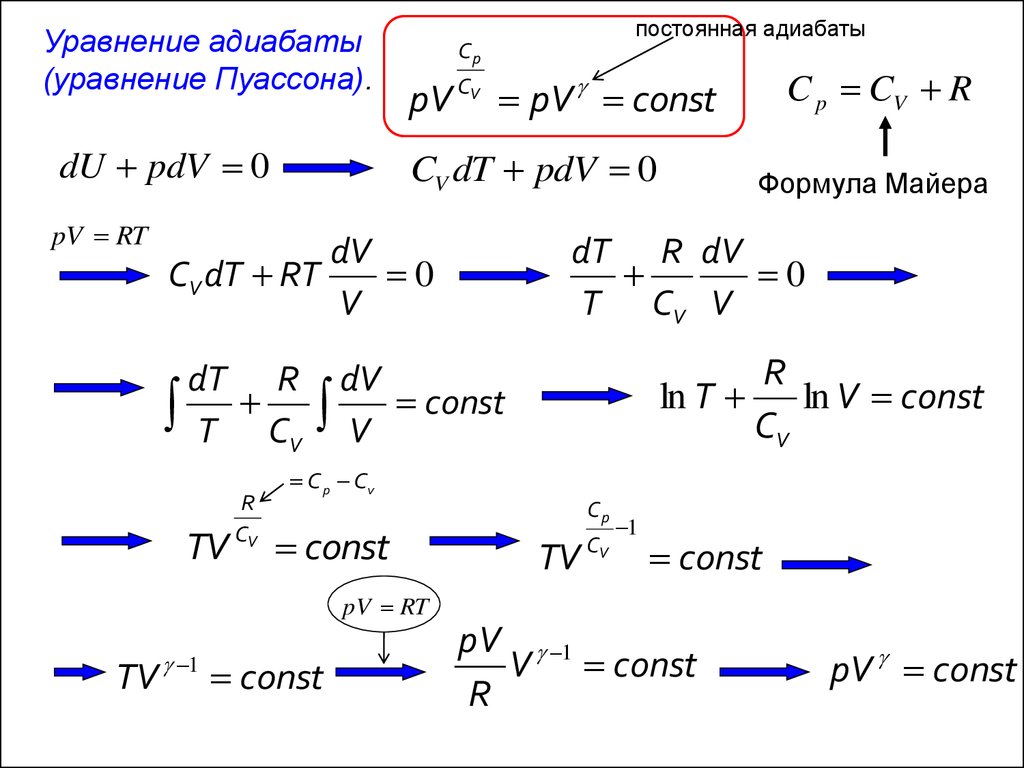
Уравнение адиабаты(уравнение Пуассона).
dU pdV 0
pV RT
Cp
CV dT pdV 0
dT R
T CV
TV
C p CV R
pV CV pV const
Формула Майера
dT R dV
0
T CV V
dV
CV dT RT
0
V
R
CV
постоянная адиабаты
R
ln T
ln V const
CV
dV
V const
C p Cv
const
Cp
TV CV
1
const
pV RT
TV
1
const
pV 1
V const
R
pV const
6.
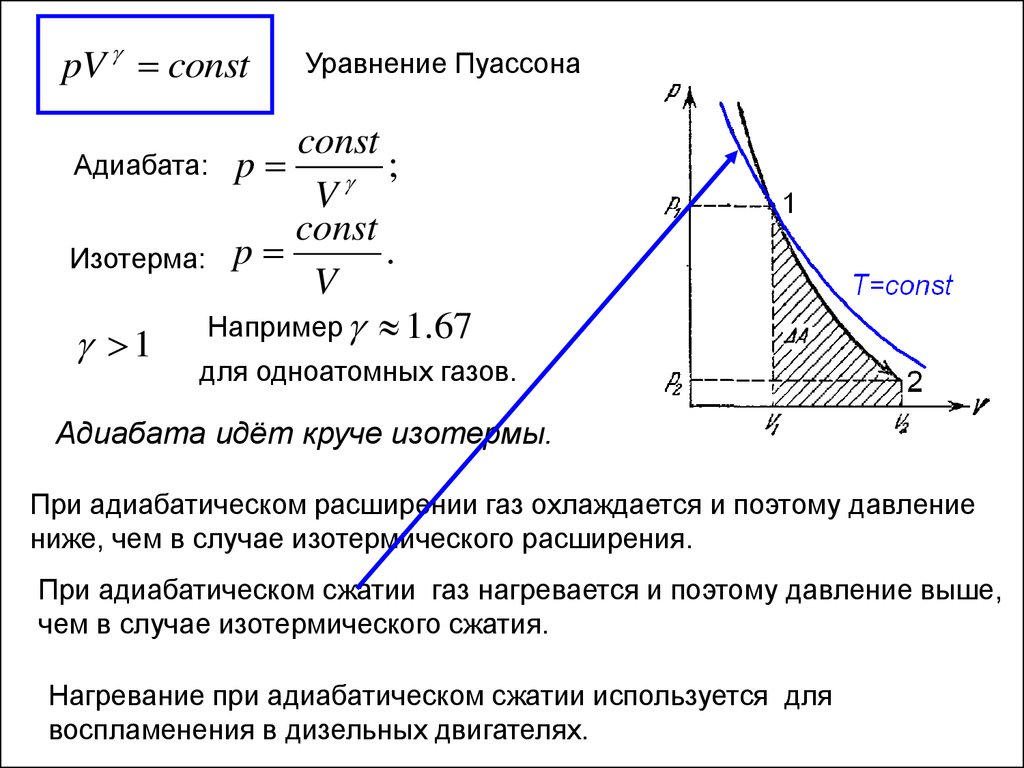
pV constУравнение Пуассона
const
Адиабата: p
;
V
const
.
Изотерма: p
V
Например 1.67
1
для одноатомных газов.
Адиабата идёт круче изотермы.
При адиабатическом расширении газ охлаждается и поэтому давление
ниже, чем в случае изотермического расширения.
При адиабатическом сжатии газ нагревается и поэтому давление выше,
чем в случае изотермического сжатия.
Нагревание при адиабатическом сжатии используется для
воспламенения в дизельных двигателях.
7.
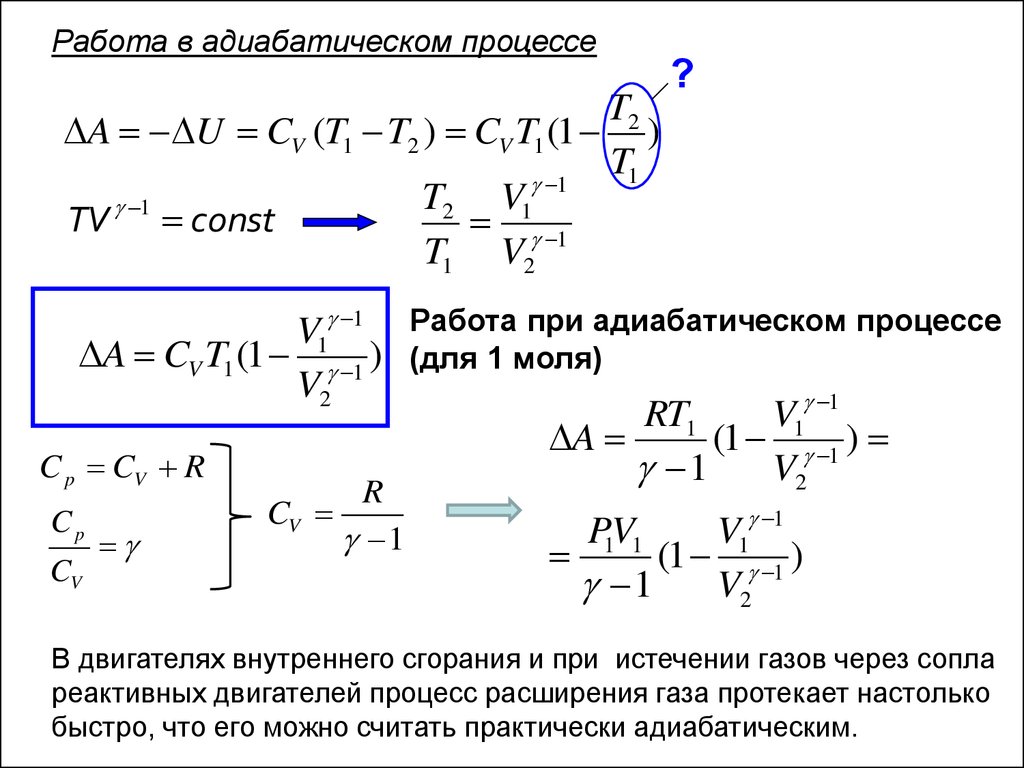
Работа в адиабатическом процессеT2
A U CV (T1 T2 ) CV T1 (1 )
T1
1
T2 V1
1
TV const
1
T1 V2
?
V1 1 Работа при адиабатическом процессе
A CV T1 (1 1 ) (для 1 моля)
V2
RT1
V1 1
A
(1 1 )
C p CV R
1
V2
Cp
CV
R
CV
1
P1V1
V1 1
(1 1 )
1
V2
В двигателях внутреннего сгорания и при истечении газов через сопла
реактивных двигателей процесс расширения газа протекает настолько
быстро, что его можно считать практически адиабатическим.
8.
Изопроцессы. Работа в изопроцессах (квазистатических,равновесных)
Изохорический процесс: V=const.
A 0
Изобарический процесс: p=const.
A p(V2 V1 )
Изотермический процесс: Т = const.
Адиабатический процесс: δQ = 0.
V2
A RT ln
V1
p1V1
V1 1
A
(1 1 )
1
V2
9.
Второе начало термодинамикиЭнергия теплового движения молекул качественно отличается от всех
других видов энергии – механической, электрической, химической и т. д.
Энергия любого вида, кроме энергии теплового движения молекул, может
полностью превратиться в любой другой вид энергии, в том числе и в
энергию теплового движения.
Энергия теплового движения может превратиться в любой другой вид
энергии лишь частично.
Поэтому любой физический процесс, в котором происходит
превращение какого-либо вида энергии в энергию теплового движения
молекул, является необратимым: он не может быть осуществлен
полностью в обратном направлении.
В связи с этими особенностями энергии теплового движения молекул не
все процессы, разрешённые первым началом термодинамики, возможны.
Второе начало термодинамики формулирует эти ограничения.
10.
Второе начало термодинамикиСуществует несколько формулировок второго начала.
1. Клаузиус (1850): невозможен самопроизвольный переход тепла
от менее к более нагретому телу, или невозможны процессы
единственным конечным результатом которых был бы переход
тепла от менее к более нагретому телу.
Примеры: изотермическое расширение, цикл Карно
Обе формулировки эквивалентны – из одной вытекает другая.
КПД тепловой машины (теплового цикла) ΔU=0 в круговом
A Q1 Q2
Q1
Q1
процессе
Другая форма формулировки Кельвина
Невозможно создать тепловой двигатель с КПД η=1, или
невозможен вечный двигатель 2-го рода.
11.
Второе начало термодинамикиA Q1 Q2
Q1
Q1
Вечный двигатель второго рода — воображаемая машина,
которая, превращала бы в работу всё тепло, извлекаемое из
окружающих тел.
тепловой двигатель с КПД =1
работу
всё тепло превращается в
Q2=0
нет нужды в более холодных телах
совершать работу, отбирая тепло из окружающих нас тел,
например, от океана.
можно
В силу практической безграничности такого источника тепловой
энергии это был бы вечный двигатель (второго рода).
Пример: адиабатическое
расширение
работа+охлаждение
нагревание от
среды
12.
Второе начало термодинамикиЭнтропия
Понятие энтропии было введено Клаузиусом (1865) и
является характеристикой необратимости процессов.
Понятие энтропии играет важную роль не только в
физике, но и в теории информации.
Энтропия вводится через её изменение. В
дифференциальной форме
dS
Q
T
,
Рудольф Клаузиус
1822-1888
где δQ/T относится к квазистатическим процессам.
Можно доказать, что энтропия (или «приведённое тепло») является
функцией состояния (несмотря на то что количество теплоты функцией
состояния не является).
2
Q
Изменение энтропии при переходе системы из
S 2 S1
состояния 1 в состояние 2 в равновесном процессе
T
S2 – S1 не зависит от вида процесса. S2 – S1 определяется лишь
начальным и конечным состояниями.
1
13.
Второе начало термодинамикиdS
Q
T
Энтропия
2
Q
S 2 S1
1
T
При таком введении энтропии можно вычислять только разность
энтропий для разных состояний системы, но не саму величину
,
энтропии.
Энтропия определяется с точностью до постоянной.
14.
Второе начало термодинамикиЭнтропия
Важнейшее свойство энтропии:
Энтропия замкнутой (теплоизолированной, внешние силы не
совершают работу) макросистемы не уменьшается – она либо
возрастает, либо остаётся постоянной.
Ещё одна формулировка 2-го
S 0
В замкнутых системах:
начала
В случае обратимых процессов энтропия
S 0
замкнутой макросистемы не меняется
В случае необратимых процессов энтропия
S 0
замкнутой макросистемы возрастает
Таким образом, величина возрастания энтропии в замкнутой
системе может служить мерой необратимости процессов,
протекающих в системе.
Анализ изменения энтропии даёт указание, в каком направлении
могут происходить самопроизвольные необратимые процессы в
замкнутой системе: в сторону возрастания энтропии.
15.
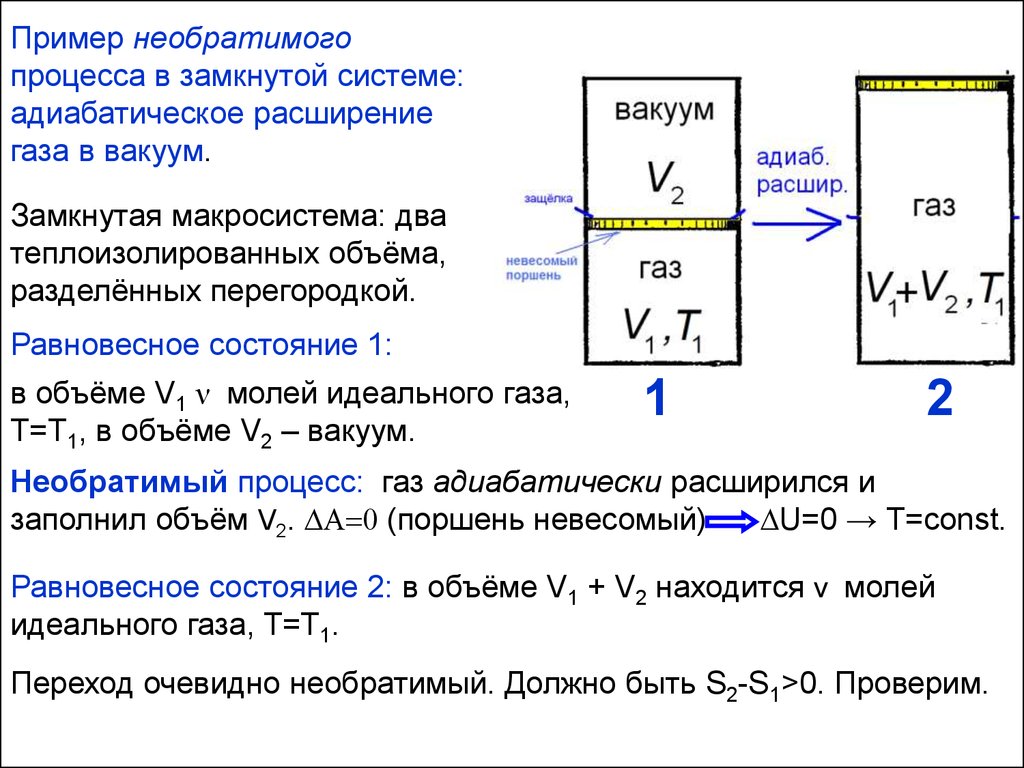
Пример необратимогопроцесса в замкнутой системе:
адиабатическое расширение
газа в вакуум.
Замкнутая макросистема: два
теплоизолированных объёма,
разделённых перегородкой.
Равновесное состояние 1:
в объёме V1 ν молей идеального газа,
T=T1, в объёме V2 – вакуум.
1
2
Необратимый процесс: газ адиабатически расширился и
заполнил объём V2. A 0 (поршень невесомый)
U=0 → Т=const.
Равновесное состояние 2: в объёме V1 + V2 находится ν молей
идеального газа, T=T1.
Переход очевидно необратимый. Должно быть S2-S1>0. Проверим.
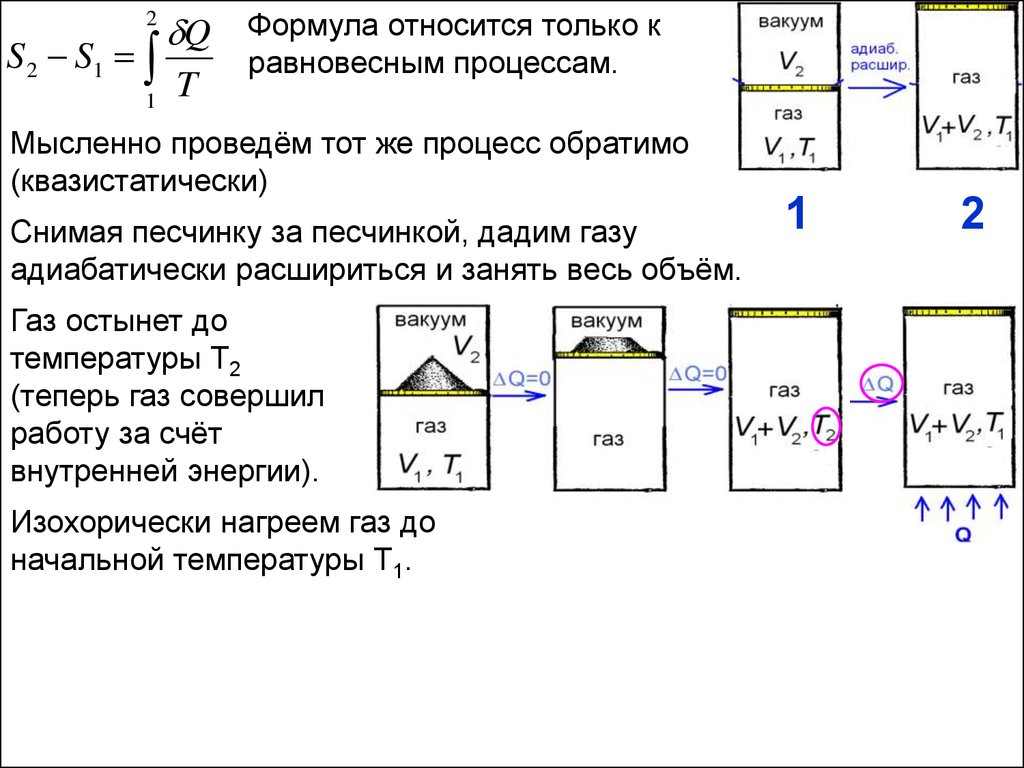
16.
2S 2 S1
1
Q Формула относится только к
T
равновесным процессам.
Мысленно проведём тот же процесс обратимо
(квазистатически)
Снимая песчинку за песчинкой, дадим газу
адиабатически расшириться и занять весь объём.
Газ остынет до
температуры Т2
(теперь газ совершил
работу за счёт
внутренней энергии).
Изохорически нагреем газ до
начальной температуры Т1.
1
2
17.
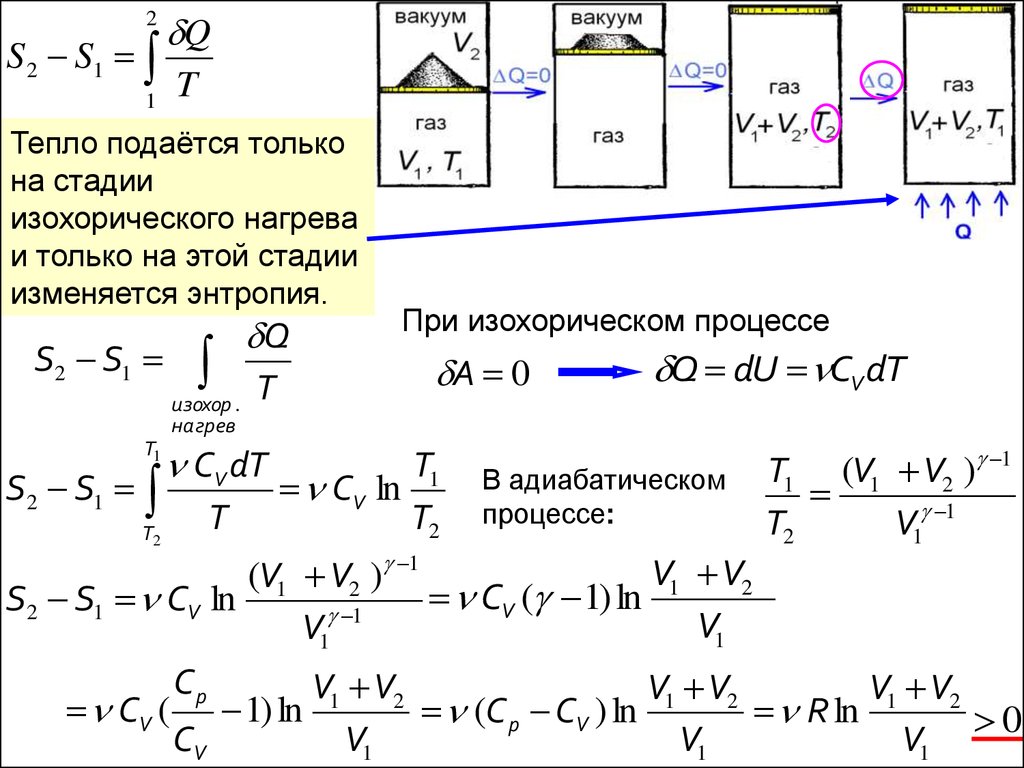
2S 2 S1
1
Q
T
Тепло подаётся только
на стадии
изохорического нагрева
и только на этой стадии
изменяется энтропия.
S2 S1
изохор .
нагрев
T1
S2 S1
T2
Q
T
CV dT
T
При изохорическом процессе
A 0
T1
CV ln
T2
Q dU CV dT
В адиабатическом
процессе:
T1 (V1 V2 ) 1
T2
V1 1
V1 V2
(V1 V2 ) 1
CV ( 1) ln
S2 S1 CV ln
1
V1
V1
Cp
V1 V2
V1 V2
V1 V2
CV ( 1) ln
(C p CV ) ln
R ln
0
V1
V1
CV
V1
18.
Расширение газа в замкнутой системе приводит к росту энтропии.Согласно второму началу (в замкнутых
системах S 0 ), расширение газа в
замкнутой системе – необратимый
процесс.
1
2
Самопроизвольно он может протекать лишь в одну сторону.
Обратный процесс (самопроизвольное сжатие) запрещён вторым
началом (поскольку энтропия при этом снижается).
Таким образом, анализ изменения энтропии указывает, какие
неравновесные процессы в замкнутой системе возможны
(протекают самопроизвольно), а какие нет.
19.
Статистический смысл энтропииВ замкнутых системах:
S 0
Самопроизвольные процессы протекают в направлении роста энтропии.
С другой стороны, макросистема представляет собой ансамбль огромного
числа частиц, поведение которых подчиняется статистическим законам.
Самопроизвольно макросистема переходит в то состояние, которое
наиболее вероятно.
Например, если мысленно разделить объём V,
заполненный газом, пополам, то крайне маловероятно, что
все молекулы соберутся в одной из его частей, а другая
окажется пустой.
И наоборот, если такая ситуация искусственно
создана, когда мы убираем перегородку, газ
немедленно заполняет весь объём, т.е. система
самопроизвольно переходит в более вероятное
состояние (и в то же время увеличивается энтропия).
20.
Статистический смысл энтропииТермодинамическая вероятность (статистический вес).
Макросостояние характеризуется термодинамическими
параметрами p, V, T.
Но, макросистема состоит из громадного числа молекул (или
атомов).
Молекулы газа могут иметь разные импульсы и координаты.
Состояние с определёнными значениями всех координат и
импульсов всех молекул системы называется микросостоянием.
Любому макросостоянию соответствует громадное число
микросостояний.
Чем большим числом способов (микросостояний) может быть
осуществлено данное макросостояние, тем оно более вероятно.
Термодинамическая вероятность данного макросостояния W
равна числу способов (числу микросостояний), которыми может
быть осуществлено данное макросостояние.
21.
Статистический смысл энтропииТермодинамическая вероятность (статистический вес).
Термодинамическая вероятность W – огромное число (это не
математическая вероятность, которая не превосходит 1).
Термодинамическую вероятность называют также статистическим
весом.
Связь термодинамической вероятности состояний идеального
газа с его объёмом.
Число способов, которым можно разместить одну молекулу в
объёме V пропорционально V.
Число способов, которым можно разместить в объёме V N молекул
пропорционально
Термодинамическая вероятность состояния идеального газа:
W~ VN.
22.
Статистический смысл энтропииПри расширении газа в вакуум
V1 V2
S2 S1 R ln
V1
V1 V2
(V1 V2 ) N
S2 S1 kN ln
k ln
N
V
V1
R kNA kN
1
W ~VN
W2
Изменение энтропии при
S2 S1 k ln
расширении газа выражается
W1
через термодинамические
вероятности состояний.
Больцман установил, что это соотношение носит общий характер.
Формула Больцмана
S к ln W
W2
S2 S1 k ln
W1
23.
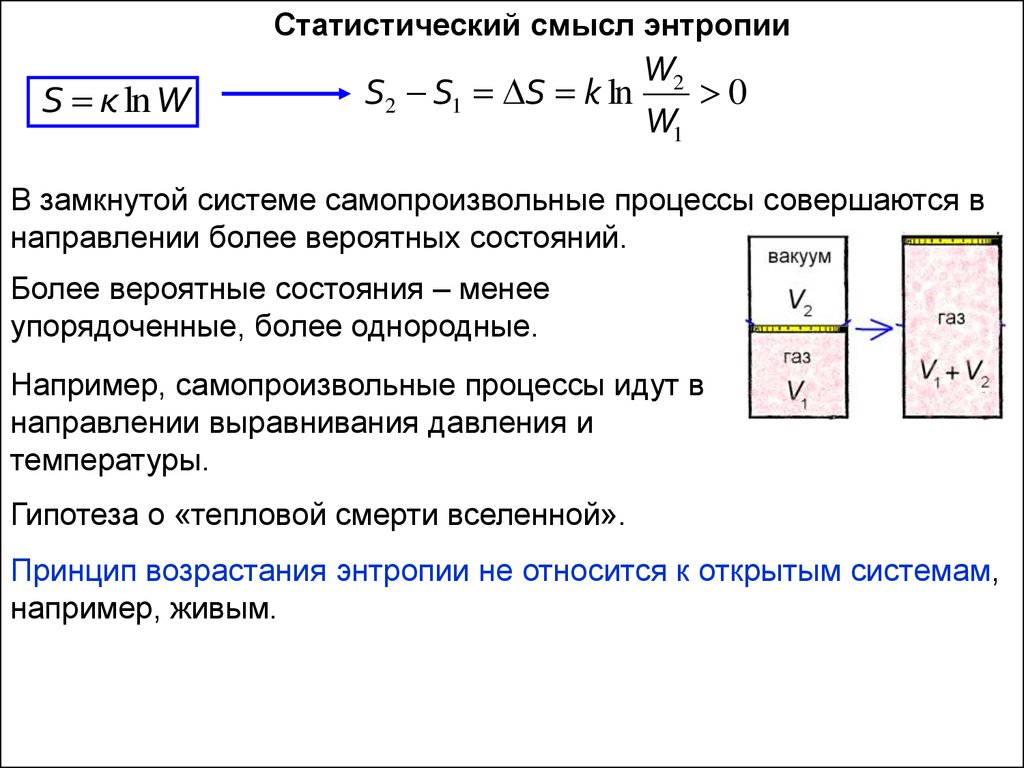
Статистический смысл энтропииS к ln W
W2
S2 S1 S k ln
0
W1
В замкнутой системе самопроизвольные процессы совершаются в
направлении более вероятных состояний.
Более вероятные состояния – менее
упорядоченные, более однородные.
Например, самопроизвольные процессы идут в
направлении выравнивания давления и
температуры.
Гипотеза о «тепловой смерти вселенной».
Принцип возрастания энтропии не относится к открытым системам,
например, живым.
24.
Третье начало термодинамикиПри Т = 0 К
система обладает наименьшей возможной энергией,
её внутренняя энергия распределена между составляющими ее
частицами единственным способом, а именно
все электроны в атомах находятся при этом в наинизших
энергетических состояниях,
а атомы располагаются в пространстве определенным образом (в
узлах кристаллической решетки твердого тела).
Благодаря полной упорядоченности этого единственного состояния
его термодинамическая вероятность W = 1.
Нернст 1906, Планк 1911
При абсолютном нуле энтропия тела обращается в нуль.
Возможность определять абсолютное значения энтропии.
25.
Основное уравнение термодинамики для обратимых(квазистатических) процессов (объединяет 1 и 2 начала).
dS
Q
T
Q TdS
Q dU pdV
ТdS dU pdV
Для обратимых процессов
Энтропия идеального газа
Найдём S2 – S1 для двух состояний ν молей идеального газа: V1, T1
и V 2 , T2
dU СV dT ; PV RT
dU p
dT
dV
dS
dV CV
R
T
T
T
V
26.
Энтропия идеального газаdU p
dT
dV
dS
dV CV
R
T
T
T
V
V2
dT
dV ( C ln T2 R ln V2 )
S 2 S1 dS CV
V
R
T1
V1
T
V
1
T1
V1
2
T2
Энтропия возрастает при увеличении V и T (больше беспорядка).
При Т2=Т1
V2
S 2 S1 R ln
V1
Адиабатическое
расширение в вакуум
27.
Тепловая машина, цикл КарноСогласно второму началу
нельзя отнять от нагретого тела количество тепла Q1 и полностью
превратить его в работу (энтропия нагретого тела при этом
уменьшится).
Необходимо, чтобы одновременном увеличилась энтропия другого
тела - путём передачи ему части тепла Q2.
Возрастание энтропии второго тела должно быть не меньше
убывания энтропии первого тела. Т.е. должно быть
Q1 Q2
T1
T2
Поскольку
Q2 Q1 , должно быть Т2<T1.
Нужно более
холодное тело.
28.
Для получения работы необходимо «рабочее тело», котороедолжно
обратимо отнять тепло Q1 от нагревателя,
обратимо отдать часть тепла Q2 холодильнику,
разность Q1 — Q2 передать поршню в виде механической работы
А.
вернуться в исходное состояние, т. е. совершить замкнутый цикл и
далее повторять его.
29.
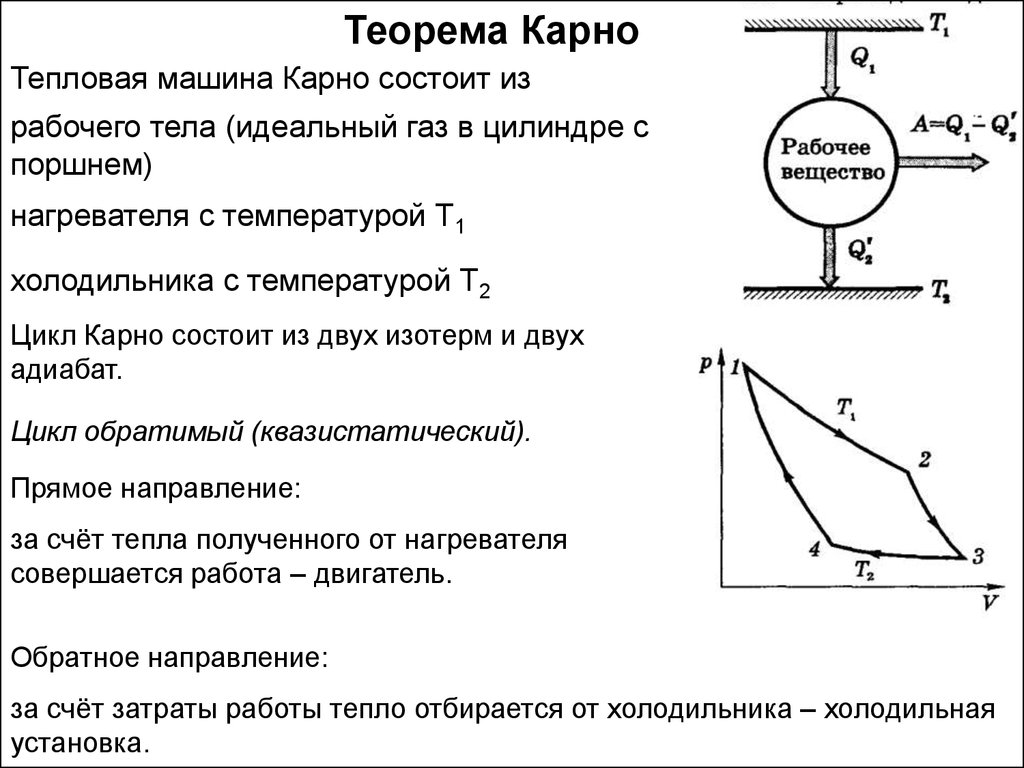
Теорема КарноТепловая машина Карно состоит из
рабочего тела (идеальный газ в цилиндре с
поршнем)
нагревателя с температурой Т1
холодильника с температурой Т2
Цикл Карно состоит из двух изотерм и двух
адиабат.
Цикл обратимый (квазистатический).
Прямое направление:
за счёт тепла полученного от нагревателя
совершается работа – двигатель.
Обратное направление:
за счёт затраты работы тепло отбирается от холодильника – холодильная
установка.
30.
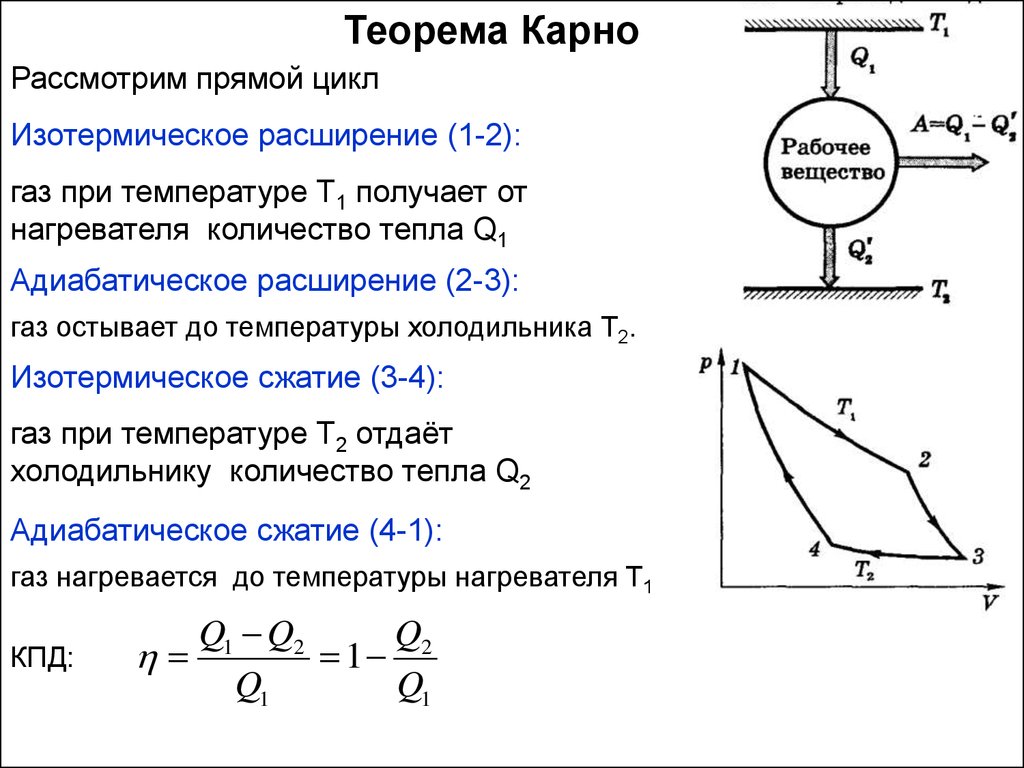
Теорема КарноРассмотрим прямой цикл
Изотермическое расширение (1-2):
газ при температуре Т1 получает от
нагревателя количество тепла Q1
Адиабатическое расширение (2-3):
газ остывает до температуры холодильника Т2.
Изотермическое сжатие (3-4):
газ при температуре Т2 отдаёт
холодильнику количество тепла Q2
Адиабатическое сжатие (4-1):
газ нагревается до температуры нагревателя Т1
КПД:
Q1 Q2
Q2
1
Q1
Q1
31.
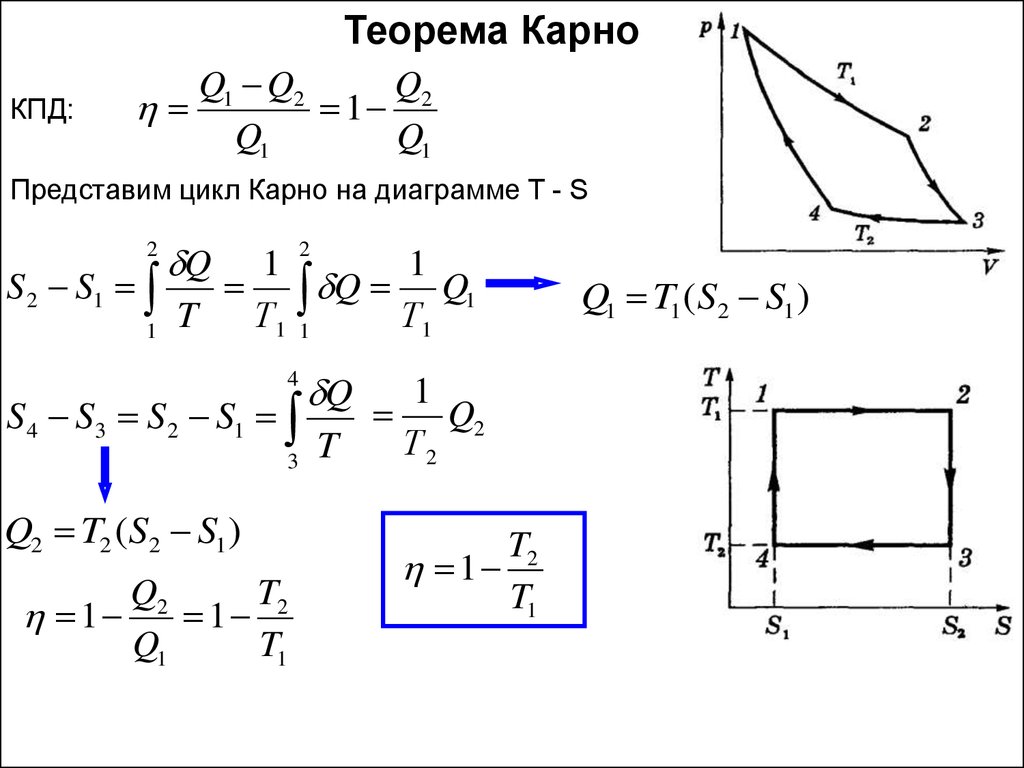
Теорема КарноКПД:
Q1 Q2
Q2
1
Q1
Q1
Представим цикл Карно на диаграмме T - S
2
S 2 S1
1
Q
2
1
1
Q Q1
T
Т1 1
Т1
4
S4 S3 S2 S1
3
Q2 T2 (S2 S1 )
Q2
T2
1
1
Q1
T1
Q
1
Q2
Т2
T
T2
1
T1
Q1 T1 (S2 S1 )
32.
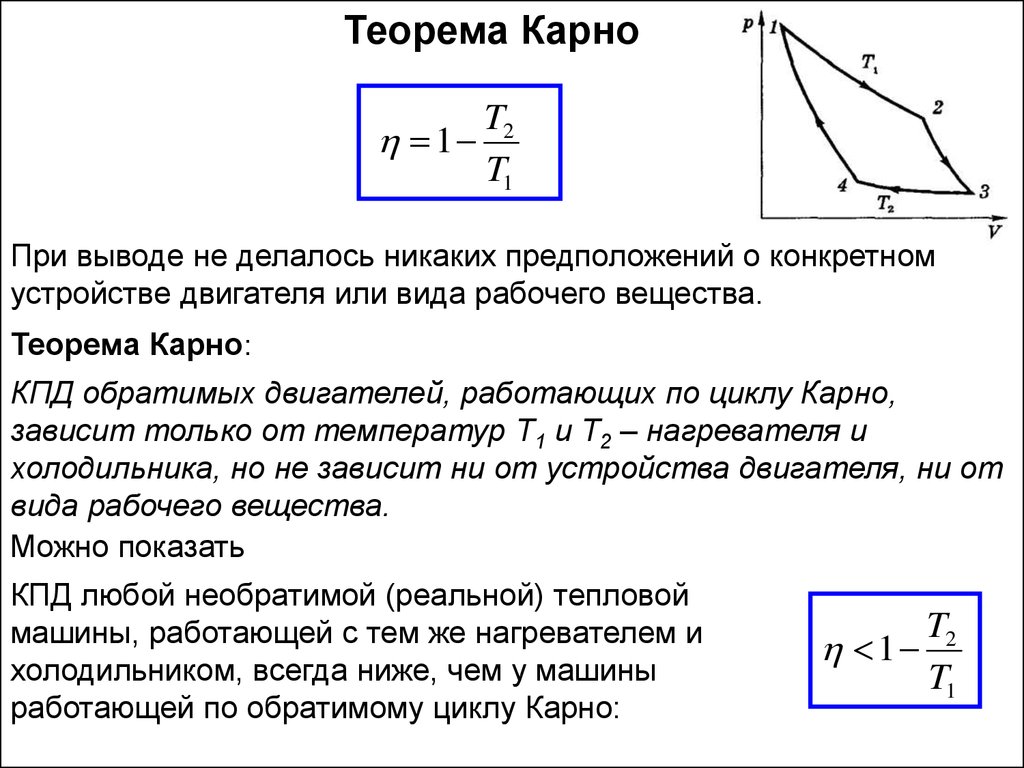
Теорема КарноT2
1
T1
При выводе не делалось никаких предположений о конкретном
устройстве двигателя или вида рабочего вещества.
Теорема Карно:
КПД обратимых двигателей, работающих по циклу Карно,
зависит только от температур Т1 и Т2 – нагревателя и
холодильника, но не зависит ни от устройства двигателя, ни от
вида рабочего вещества.
Можно показать
КПД любой необратимой (реальной) тепловой
машины, работающей с тем же нагревателем и
холодильником, всегда ниже, чем у машины
работающей по обратимому циклу Карно:
T2
1
T1





















 Физика
Физика








