Похожие презентации:
Общая физика. Лекция 4. Молекулярная физика
1. Общая физика Лекция 4 Молекулярная физика
Трушин ОлегСтаниславович
д.ф.-м.н,
Директор ЯФ ФТИАН им. К.А. Валиева РАН,
Доц. каф. нанотехнологии в электронике ЯрГУ
Лебедев Михаил Евгеньевич
к.ф.-м.н.
Доц. каф. нанотехнологии в электронике ЯрГУ
2. План лекции
Статистическая физика и термодинамикаМасса и размеры молекул
Состояние системы. Процесс
Внутренняя энергия системы
Работа при изменении объема
Первое начало термодинамики
Температура
Уравнение состояния идеального газа
3. Статистическая физика и термодинамика
Молекулярно-кинетическая теория:• Все тела состоят из молекул
• Молекулы находятся в постоянном
хаотическом движении
Доказательство – Броуновское
движение
4. Статистическая физика и термодинамика
5. Статистическая физика и термодинамика
Цель молекулярно-кинетической теории объяснитьмакроскопические свойства (давление, температура
…) как результат совокупного действия молекул
используя аппарат статистики => СТАТФИЗИКА
Другой способ описания макросвойств –
феноменологический подход (без опоры на свойства
молекул)=>ТЕРМОДИНАМИКА
В основе термодинамики – НАЧАЛА
ТЕРМОДИНАМИКИ (эмпирически установленные
базовые законы
6. Масса и размеры молекул
Атомной массой (Ar) химического элемента называется отношениемассы атома этого элемента к (1/12) массы атома углерода C12
Молекулярной массой (Mr) вещества называется отношение массы
молекулы этого вещества к (1/12) массы атома углерода C12
Атомная единица массы (med) = 1/12 массы атома углерода C12
Молем называется количество вещества, в котором столько же частиц
как 12 г изотопа углерода C12
Число частиц в 1 моле – Число Авогадро NA=6.023· 1023 моль-1
Оценка размеров молекулы воды:
= 1 г/см3 , MH2O = 18 г/моль, Vмоль = 18 см3
L = 3*10-8 см =
Vмолекулы= Vмоль/NA=18/(6*1023)=3*10-23см3 = 0,3 нм
7. Состояние системы
p, V, TC, U, I …
Система-совокупность рассматриваемых тел
Система может находиться в различных состояниях, отличающихся
p, V, T (параметры состояния)
Неравновесное состояние – параметры не определены (пример:
разная температура в разных частях)
Если систему в неравновесном состоянии изолировать и
предоставить самой себе, то через некоторое время она перейдет в
равновесное состояние
Процесс перехода системы из неравновесного в равновесное
состояние называется релаксацией
Равновесным называется состояние при котором все параметры
имеют определенное значение и, которое, не меняется при отсутствии
внешних воздействий
Равновесное состояние может быть представлено точкой на диаграмме
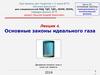
8. Процесс
p1, V1, T1Процесс
p2, V2, T2
Процесс – переход системы из одного состояния в другое
Любой реальный процесс нарушает равновесие
Бесконечно медленный процесс, состоящий из последовательности
равновесных состояний называется равновесным или
квазистатическим
Равновесный процесс - обратим
Обратимый процесс может быть представлен линией на диаграмме
Процесс, при котором система после ряда изменений возвращается в
исходное состояние называется циклом
9. Внутренняя энергия системы
Внутренняя энергия тела U = полная энергия – кинетическая энергиядвижения как целого – потенциальная энергия во внешнем поле
Внутренняя энергия включает в себя = кинетическую энергию
хаотического теплового движения молекул+ потенциальная энергия
взаимодействия молекул+ внутримолекулярная энергия
Внутренняя энергия – аддитивная величина
Внутренняя энергия – функция состояния системы (не зависит от
предыстории)
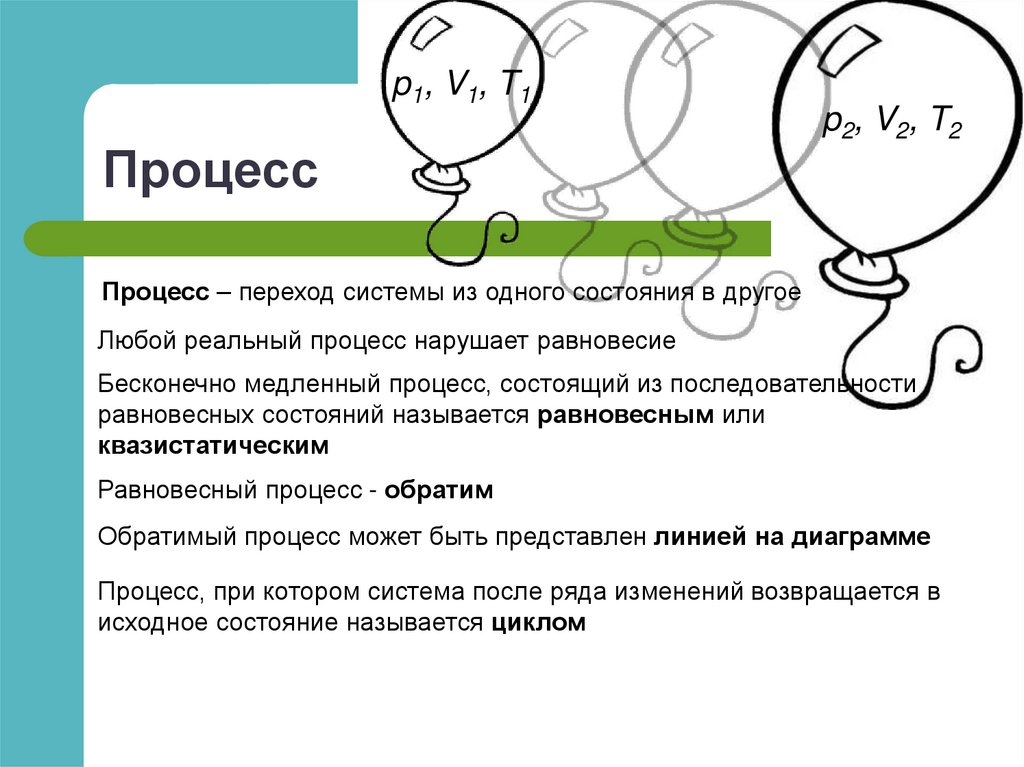
10. Количество теплоты и работа
Количество теплоты Q – энергия, которую тело получает или теряет притеплопередаче
Работа в термодинамике A – работа системы против внешних сил при
деформации системы
11. Первое начало термодинамики
Передача тепла от одного тела другому - теплопередачаQ U 2 U1 A
Количество тепла, сообщенное системе идет на приращение
внутренней энергии системы и на совершение системой
работы над внешними телами
Q U A
Q dU A
Для элементарного процесса
Для бесконечного малого процесса
Приращения работы и тепла зависят от формы пути !!!
12. Работа совершаемая телом при изменении объема
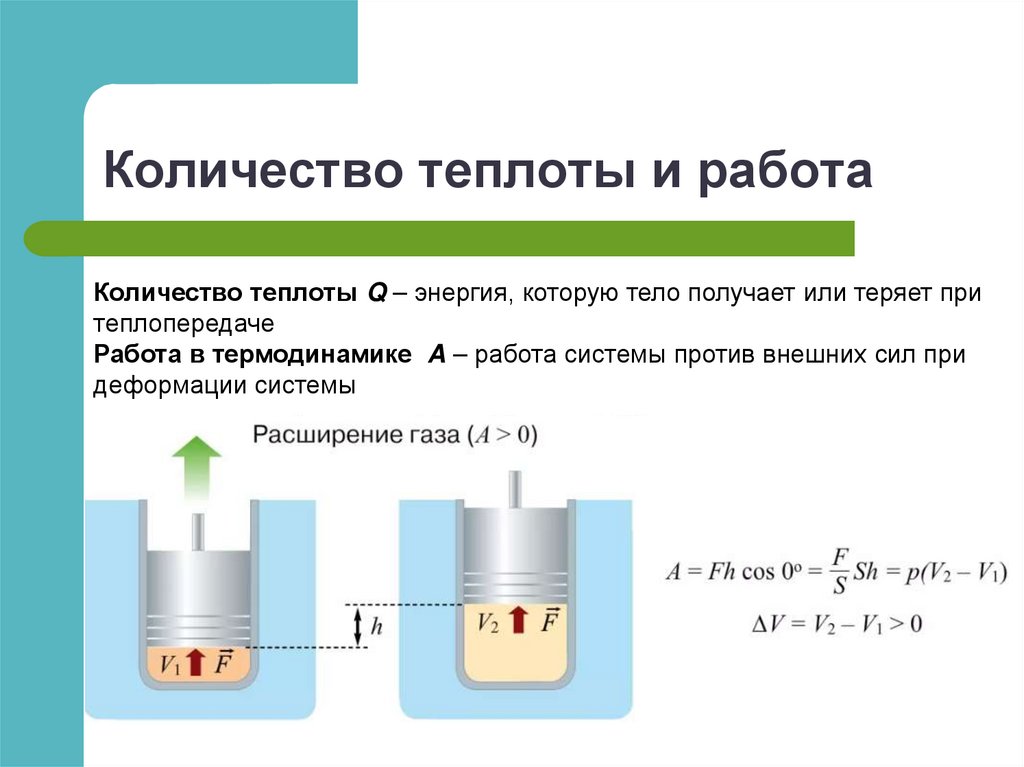
ТемператураТепло передается от более
нагретого к менее нагретому
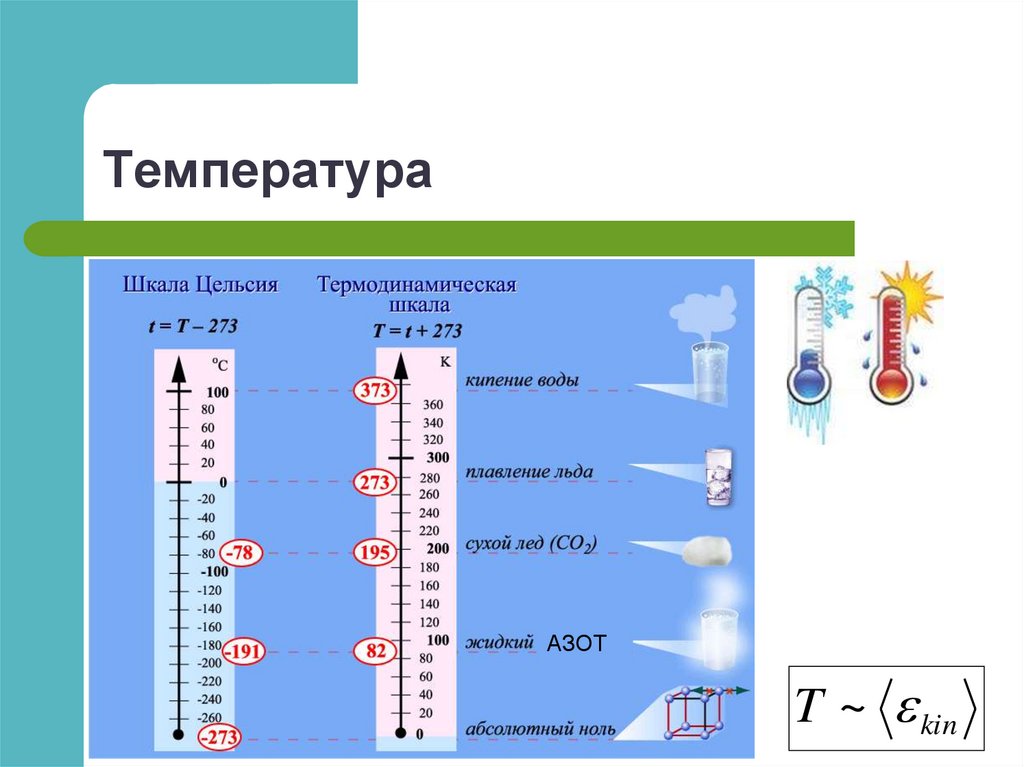
Шкала Цельсия
V V0
t
100 o
V100 V0
АЗОТ
Термодинамическая шкала не зависит от свойств
термометрического тела
T ~ kin
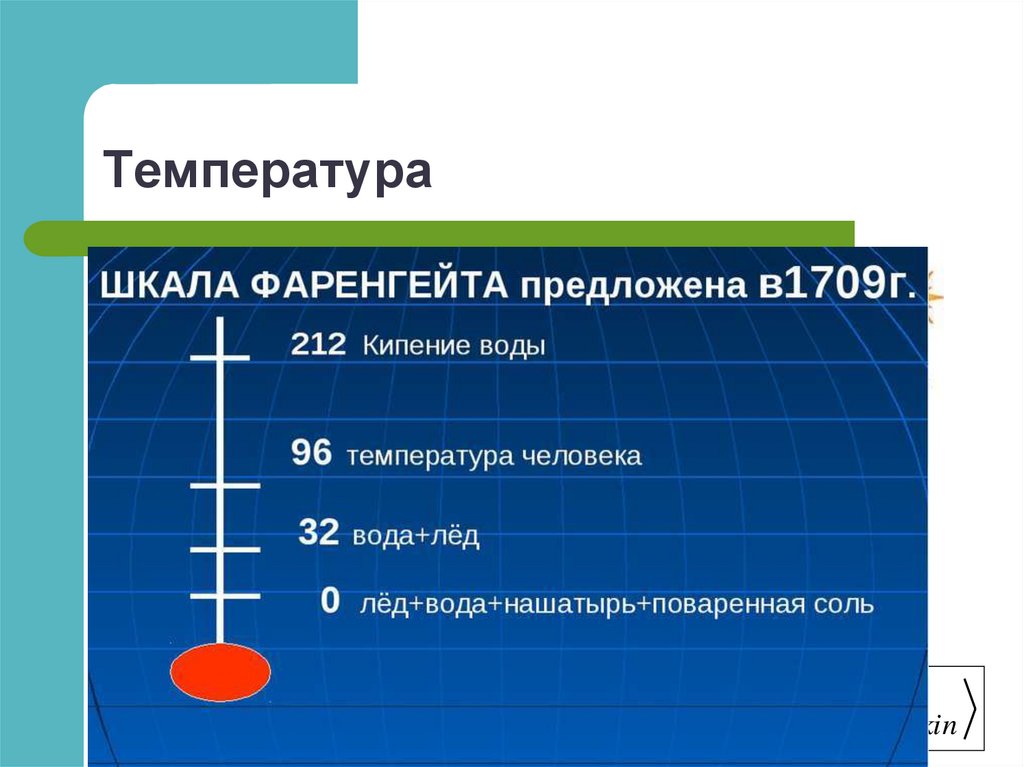
13. Температура
Тепло передается от болеенагретого к менее нагретому
Шкала Цельсия
V V0
t
100 o
V100 V0
Термодинамическая шкала не зависит от свойств
термометрического тела
T ~ kin
14. Температура
Тепло передается от болеенагретого к менее нагретому
Шкала Цельсия
V V0
t
100 o
V100 V0
АЗОТ
Термодинамическая шкала не зависит от свойств
термометрического тела
T ~ kin
15. Температура
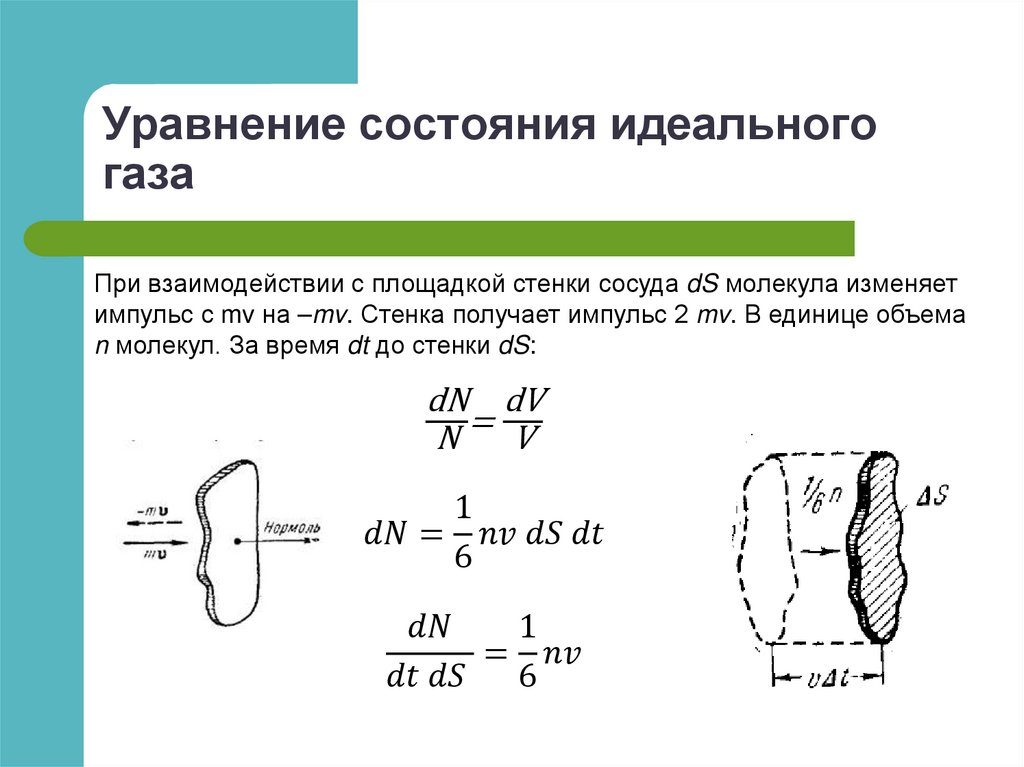
Уравнение состояния идеальногогаза
Для заданной массы газа
F p,V , T 0
Идеальный газ – это газ, взаимодействием молекул которого
можно пренебречь.
pV
const
T
Для 1 моля
16. Уравнение состояния идеального газа
Основные уравненияидеального газа
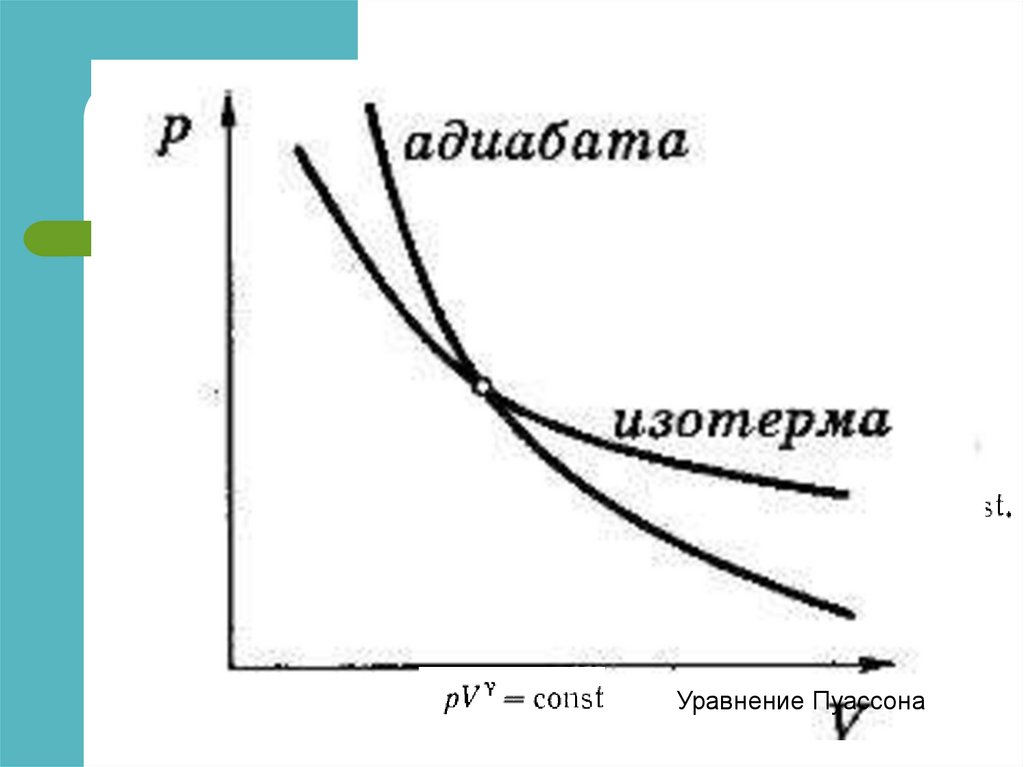
1) Изотерма T=const
Закон Бойля-Мариотта
pV const
2) Изобара p=const
Закон Гей-Люссака
V
const
T
3) Изохора V=const
p
const
T
17. Основные уравнения идеального газа
Уравнение состояния идеальногогаза
Для заданной массы газа
F p,V , T 0
Идеальный газ – это газ, взаимодействием молекул которого
можно пренебречь.
pV
const
T
Для 1 моля
pVM
R
T
m
M
Дж
R 8.31
моль K
m
pV
RT
M
N
n
V
R
- 23 Дж
k
1.38 10
NA
K




















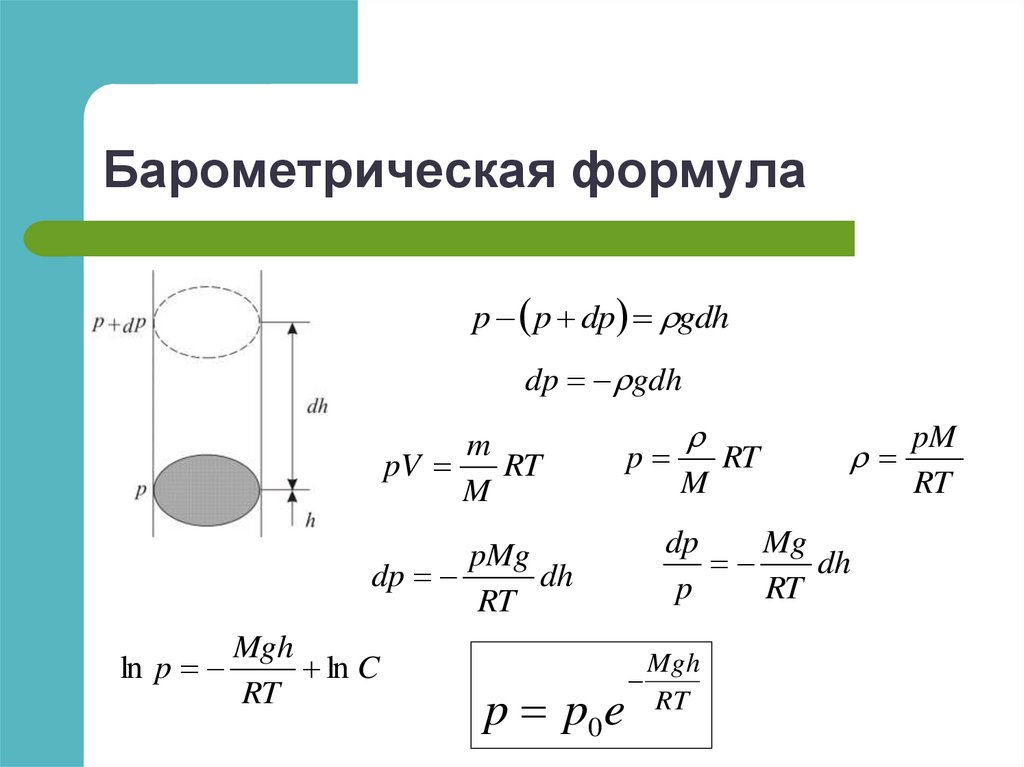

 Физика
Физика