Похожие презентации:
Молекулярная физика
1. Молекулярная физика
2. Молекулярная физика
• Основы мкт• Температура и энергия теплового движения
молекул
• Уравнение состояния идеального газа
• Взаимные превращения жидкостей и газов
• Твердые тела
• Основы термодинамики
3. Основы мкт
• Молекулярно-кинетическая теория• Масса и размеры молекул
• Количество вещества
• Строение газов, жидкостей и твердых тел
• Идеальный газ
• Среднее значение квадрата скорости молекул
• Основное уравнение мкт
4. Температура и энергия теплового движения молекул
• Температура и тепловое равновесие• Определение температуры
• Температура – мера средней
кинетической энергии молекул
• Скорости молекул
5. Уравнение состояния идеального газа
• Уравнение Менделеева-Клапейрона• Газовые законы
- Изотермический процесс
- Изобарный процесс
- Изохорный процесс
6. Взаимные превращения жидкостей и газов
• Насыщенный пар• Испарение и кипение
• Влажность воздуха
• Измерение влажности
7. Твердые тела
• Закон Гука• Кристаллические тела
• Аморфные тела
8. Основы термодинамики
• Внутренняя энергия• Работа в термодинамике
• Количество теплоты
• Первый закон термодинамики и его
применение к различным процессам
• Тепловые двигатели
9. Молекулярно-кинетическая теория
• МКТ объясняет свойства макроскопических тели тепловых процессов, на основе представлений о
том, что все тела состоят из отдельных,
беспорядочно движущихся частиц.
• Макроскопические тела – тела, состоящие из
большого количества частиц.
• Микроскопические тела – тела, состоящие из
малого количества частиц.
10. Основные положения мкт
• Вещество состоит из частиц• Частицы непрерывно и хаотически
движутся
• Частицы взаимодействуют друг с другом
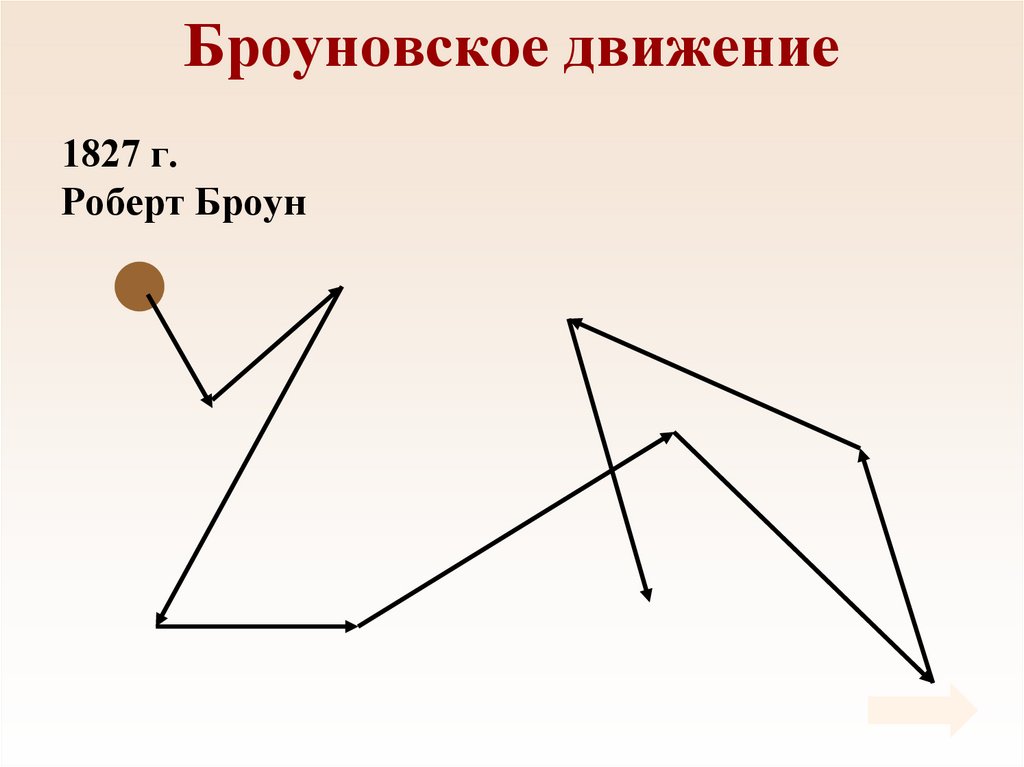
11. Броуновское движение
1827 г.Роберт Броун
12. Броуновское движение
• Причина броуновскогодвижения состоит в том,
что удары молекул
жидкости о частицу не
компенсируют друг друга.
• 1905 г. Альберт
Эйнштейн.
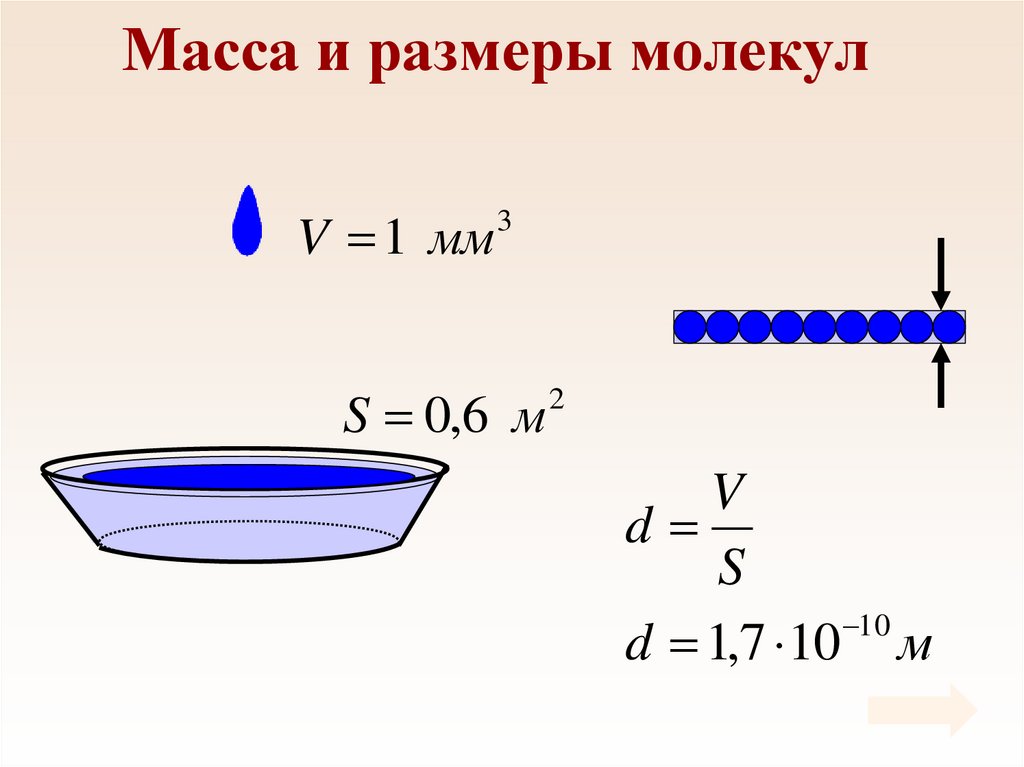
13. Масса и размеры молекул
V 1 мм3
S 0,6 м
2
V
d
S
10
d 1,7 10 м
14. Масса и размеры молекул
22В 1 г воды содержится 3,7 * 10 молекул.
m0 воды
1г
3,7 10
22
2,7 10
23
г
Массы молекул в макроскопических масштабах
чрезвычайно малы.
15.
Масса и размеры молекулкофе
этанол
16. Масса и размеры молекул
1961 годОтносительной молекулярной (или атомной)
массой вещества (Мr) называют отношение массы
молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0C.
Mr
m0
1
m0C
12
17. Количество вещества
Количество вещества наиболее естественно было быизмерять числом молекул или атомов в теле. Но число
частиц в любом макроскопическом теле так велико, что в
расчетах используют не абсолютное число частиц, а
относительное.
моль
Один моль – это количество вещества, в котором
содержится столько же молекул или атомов, сколько
содержится в углероде массой 12 г.
18. Количество вещества
В 1 моле любого вещества содержится одно и то жечисло атомов или молекул.
1
- постоянная
N A 6,022 10
моль Авогадро
23
Количество вещества равно отношению числа
молекул в данном теле к постоянной Авогадро.
N
NA
19. Количество вещества
Молярной массой вещества называют массувещества, взятого в количестве
1 моль.
m0 N A
кг
моль
m0 - масса одной молекулы или атома
m0
NA
20. Количество вещества
m m0 Nm – масса вещества
m
N
N N A N A
m
- формула для расчета
числа частиц в теле
21. Таблица
Свойства газов, жидкостей итвердых тел
22. Строение газов, жидкостей и твердых тел
свойстватвердые
тела
жидкости
газы
расположение
движение и
частиц
взаимод. частиц
23. Свойства
• Твердые тела сохраняют объем и форму.24. Свойства
• Жидкости сохраняют объем и принимают формусосуда.
• Обладают текучестью.
25. Свойства
• Газы не имеют формы, занимают весьпредоставленный объем.
26. Расположение частиц
• Частицы расположены в строгом порядкевплотную друг к другу.
• Кристаллическая решетка.
27. Расположение частиц
• Частицы расположены вплотную друг к другу,образуют только ближний порядок.
28. Расположение частиц
• Частицы расположены на значительныхрасстояниях (расстояния между частицами
во много раз больше размеров самих
частиц).
29. Движение и взаимодействие частиц
• Частицы совершают колебательные движенияоколо положения равновесия
• Силы притяжения и отталкивания
значительны
30. Движение и взаимодействие частиц
• Частицы совершают колебательные движенияоколо положения равновесия, изредка совершая
скачки на новое место
• Силы притяжения и отталкивания значительны
31. Движение и взаимодействие частиц
• Частицы свободно перемещаются по всемуобъему, двигаясь поступательно
• Силы притяжения почти отсутствуют, силы
отталкивания проявляются при соударениях
32. Идеальный газ
Идеальный газ – это газ, в котором• Частицы – материальные точки
• Частицы взаимодействуют только при
соударениях
• Удары абсолютно упругие
33. Среднее значение квадрата скорости молекул
• Скорость – величина векторная, поэтому средняяскорость движения частиц в газе равна нулю.
ср
1 2 3 ...
N
0
34. Среднее значение квадрата скорости молекул
22 3 ...
2
1
2
2
N
x y z
2
2
2
x y z
2
2
1 2
x
3
2
2
2
0
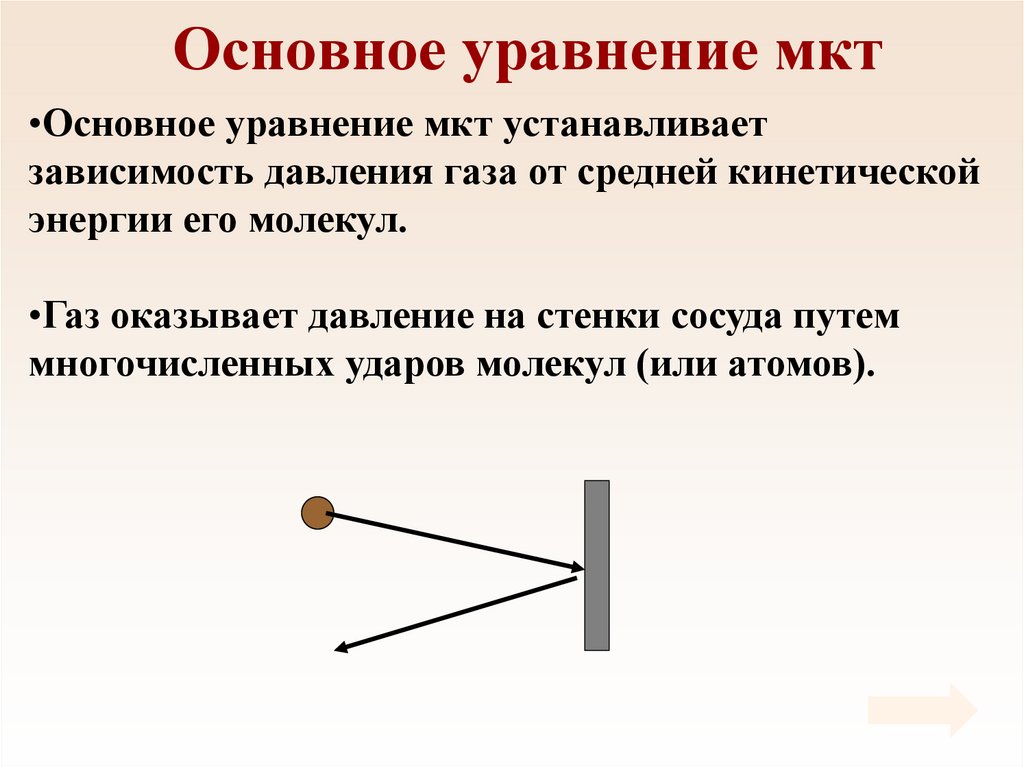
35. Основное уравнение мкт
•Основное уравнение мкт устанавливаетзависимость давления газа от средней кинетической
энергии его молекул.
•Газ оказывает давление на стенки сосуда путем
многочисленных ударов молекул (или атомов).
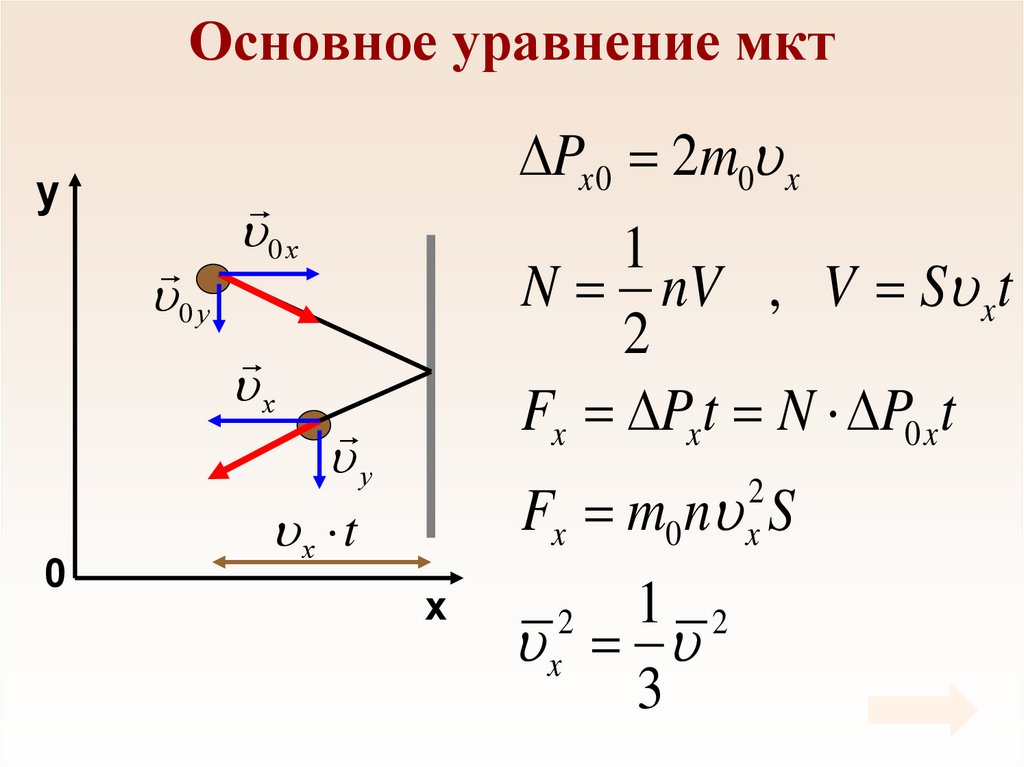
36. Основное уравнение мкт
yPx 0 2m0 x
0 у
0 х
1
N nV , V S xt
2
Fx Pxt N P0 x t
х
0
у
Fx m0 n S
2
x
х t
x
1 2
3
2
x
37. Основное уравнение мкт
12
F nm0 S
3
F
p
S
2
m0
Ek 0
2
1
2
p m0 n
3
2
p nE k 0
3
N m
m0 n m0
V V
1
2
p
3
38. Температура и тепловое равновесие
• Макроскопические параметры(макропараметры) – величины,
характеризующие состояние
макроскопических тел без учета
молекулярного строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
39. Температура и тепловое равновесие
• Любое макроскопическое тело или группамакроскопических тел при неизменных внешних
условиях самопроизвольно переходит в
состояние теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
40. Температура и тепловое равновесие
• Термометр – прибор для измерениятемпературы тела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
41. Температура и тепловое равновесие
• Основная деталь термометра –термометрическое тело, то есть тело,
макропараметры которого изменяются при
изменении температуры. (Например, в ртутных
термометрах термометрическим телом является
ртуть – при изменении температуры изменяется
ее объем.)
42. Температура и тепловое равновесие
• Изобретателем термометра являетсяГалилео Галилей (ок. 1600 г.)
• Термометрическим телом в его термометре
являлся газ – при повышении температуры
его объем увеличивался, вытесняя
жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
43. Температурные шкалы
00
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
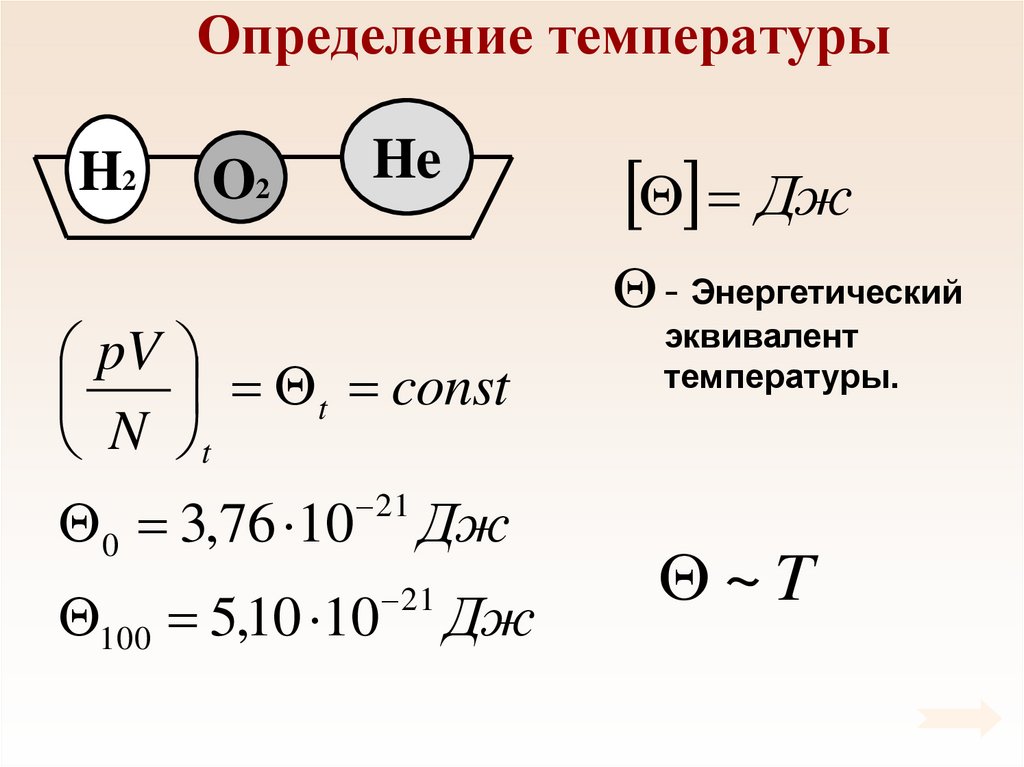
44. Определение температуры
H2O2
He
2
2N
p nEk
Ek
3
3V
2
pV
Ek
const
3
N
2
Ek
3
При тепловом равновесии
средняя кинетическая
энергия поступательного
движения молекул всех
газов одинакова.
45. Определение температуры
H2O2
Дж
He
pV
t const
N t
0 3,76 10
21
100 5,10 10
Дж
21
Дж
- Энергетический
эквивалент
температуры.
~T
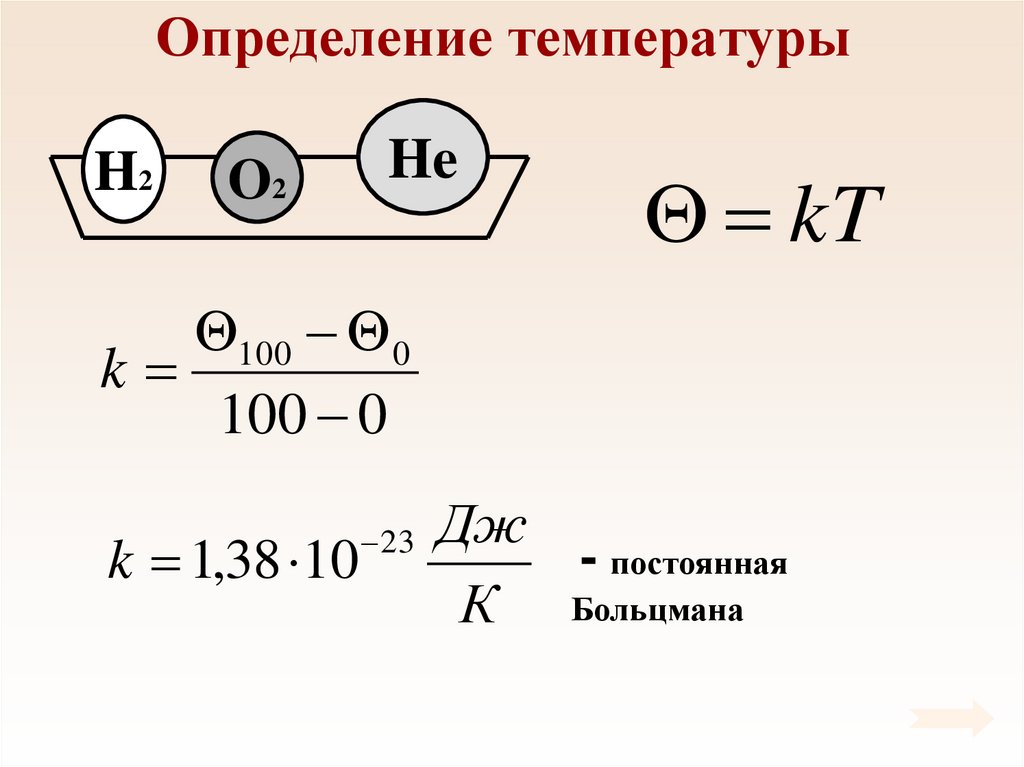
46. Определение температуры
H2O2
He
kT
100 0
k
100 0
k 1,38 10
23
Дж
- постоянная
К Больцмана
47. Температура – мера средней кинетической энергии молекул
kT3
2
Ek kT
2
Ek
3
T K кельвин
T t 273
t T 273
t T
48. Зависимость давления газа от температуры и концентрации молекул газа
3Ek kT
2
p nkT
2
p nEk
3
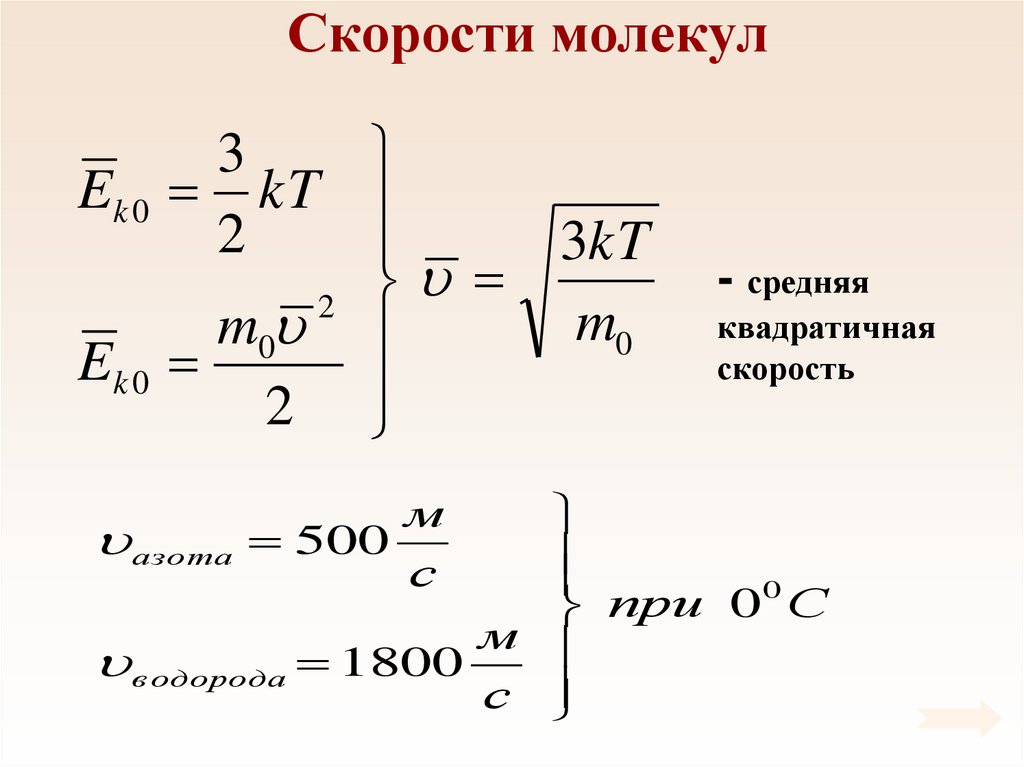
49. Скорости молекул
3Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
0
при
0
С
м
в одорода 1800
с
м
азота 500
с
50. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Np nkT
kT
V
m
N N A N A
М
m
pV
RT
М
Дж
N A k R 8,31
моль К
- универсальная
газовая постоянная
51. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Если в ходе процесса масса газаостается неизменной, то
pV m
R const
T
М
p1V1 p2V2 p3V3
...
T1
T2
T3
52. Изопроцессы
- Изотермический процесс- Изобарный процесс
- Изохорный процесс
53. Изотермический процесс
• Процесс, происходящий с газомнеизменной массы при постоянной
температуре называется изотермическим.
• Изотермический процесс описывается
законом Бойля – Мариотта (конец 17 века):
pV
const
T
p1V1 p2V2
54. Изобарный процесс
• Процесс, происходящий с газомнеизменной массы при постоянном
давлении называется изобарным.
• Изобарный процесс описывается законом
Гей-Люссака (1802 г.):
pV
const
T
V1 V2
T1 T2
55. Изохорный процесс
• Процесс, происходящий с газомнеизменной массы при постоянном объеме
называется изохорным.
• Изохорный процесс описывается законом
Шарля (1787 г.):
pV
const
T
p1 p2
T1 T2
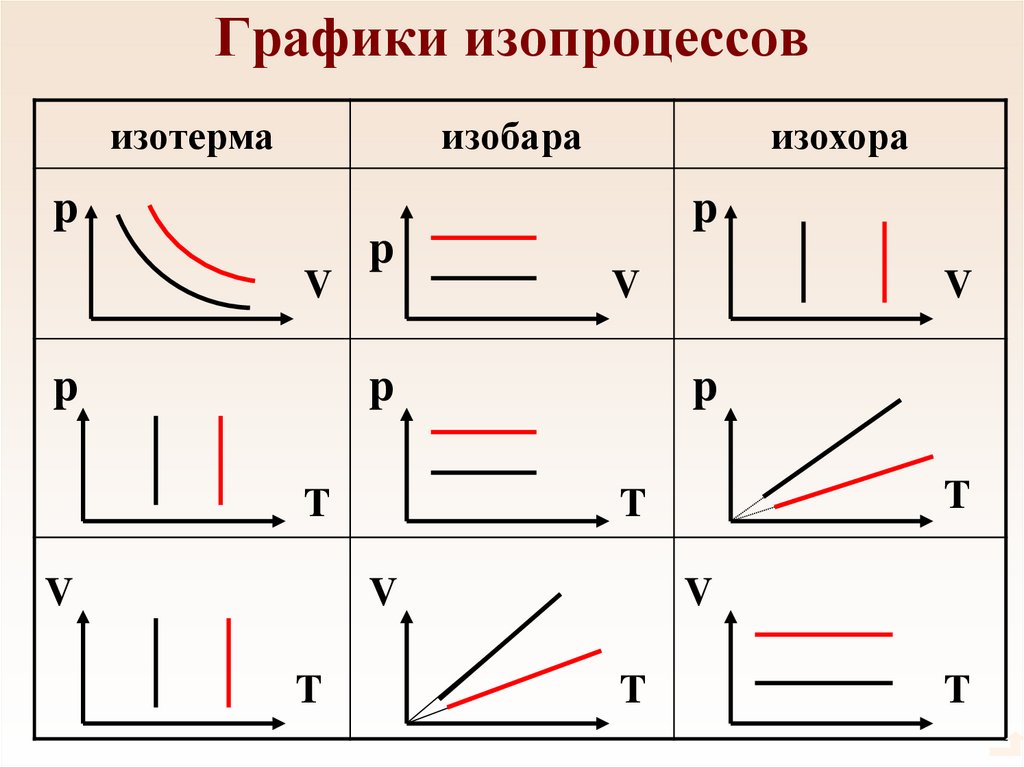
56. Графики изопроцессов
изотермаизобара
p
V
p
p
изохора
p
V
p
T
V
p
T
T
V
T
V
V
T
T
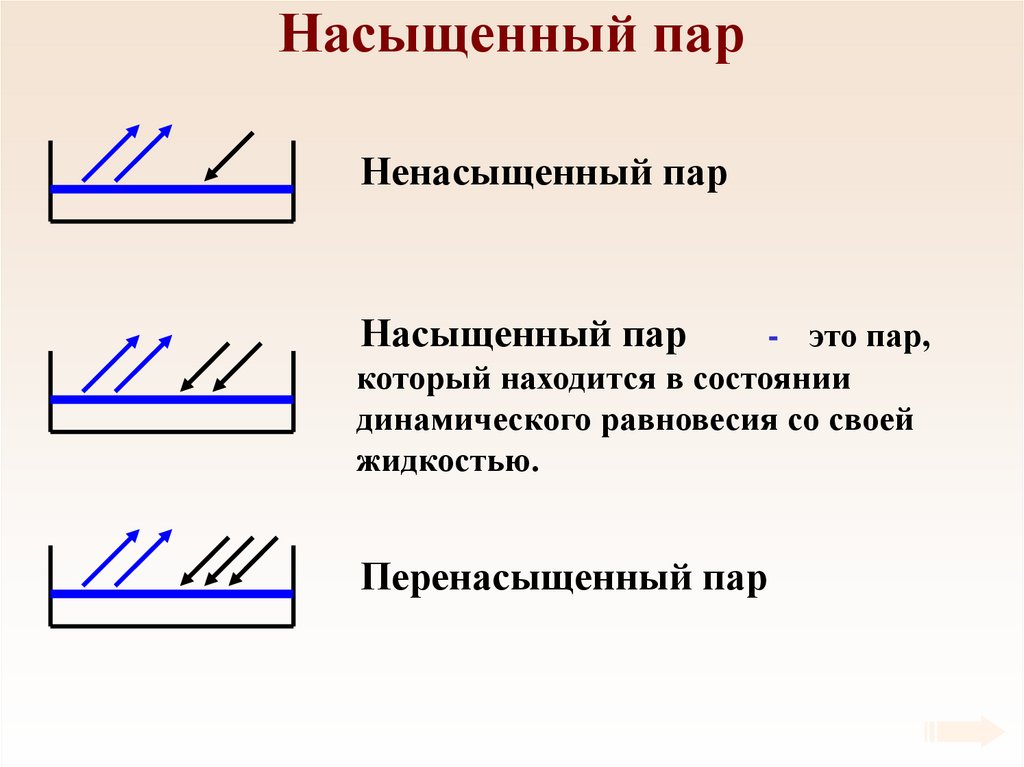
57. Насыщенный пар
Ненасыщенный парНасыщенный пар
- это пар,
который находится в состоянии
динамического равновесия со своей
жидкостью.
Перенасыщенный пар
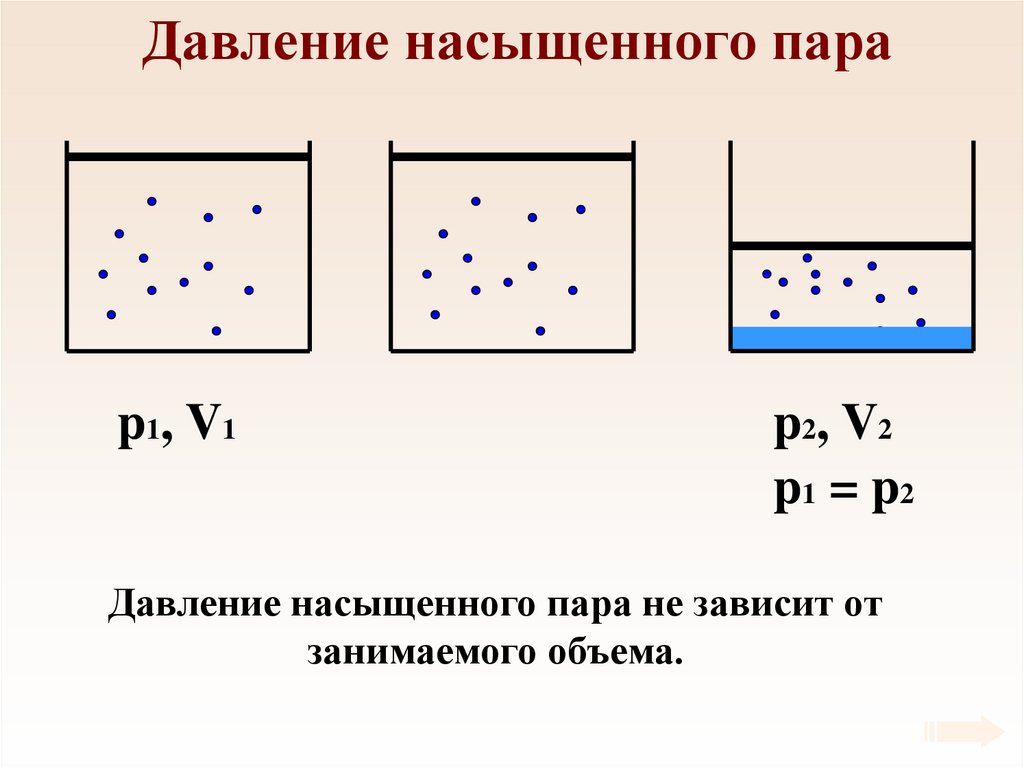
58. Давление насыщенного пара
p1 , V 1p2 , V 2
p1 = p2
Давление насыщенного пара не зависит от
занимаемого объема.
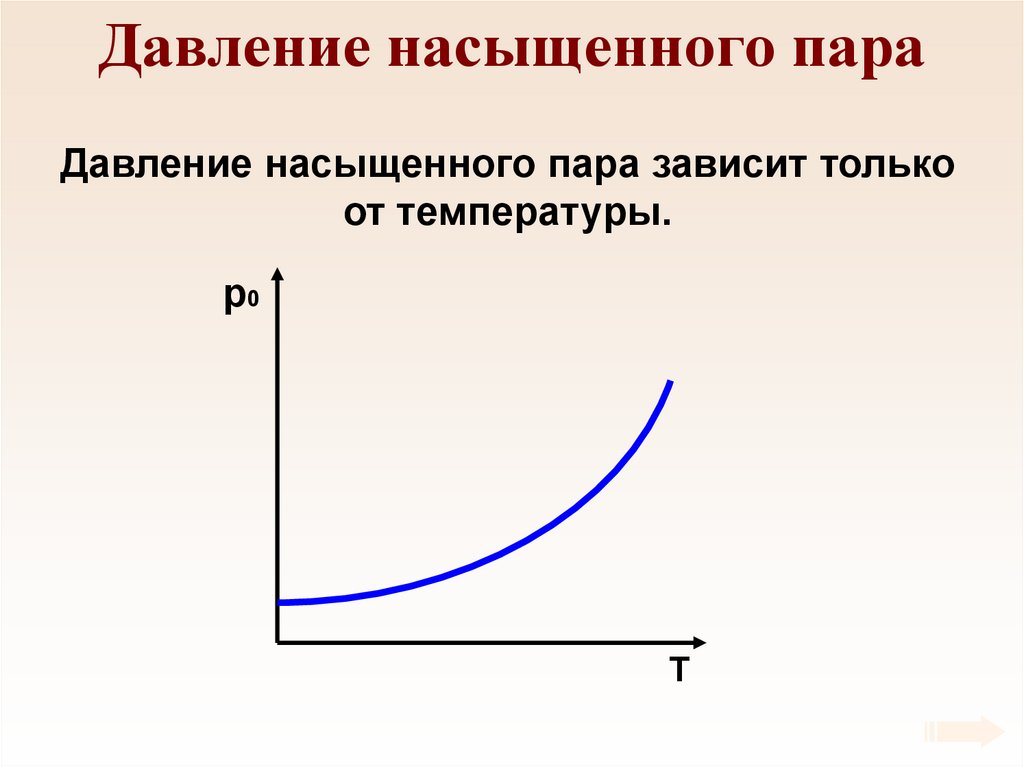
59. Давление насыщенного пара
Давление насыщенного пара зависит толькоот температуры.
p0
T
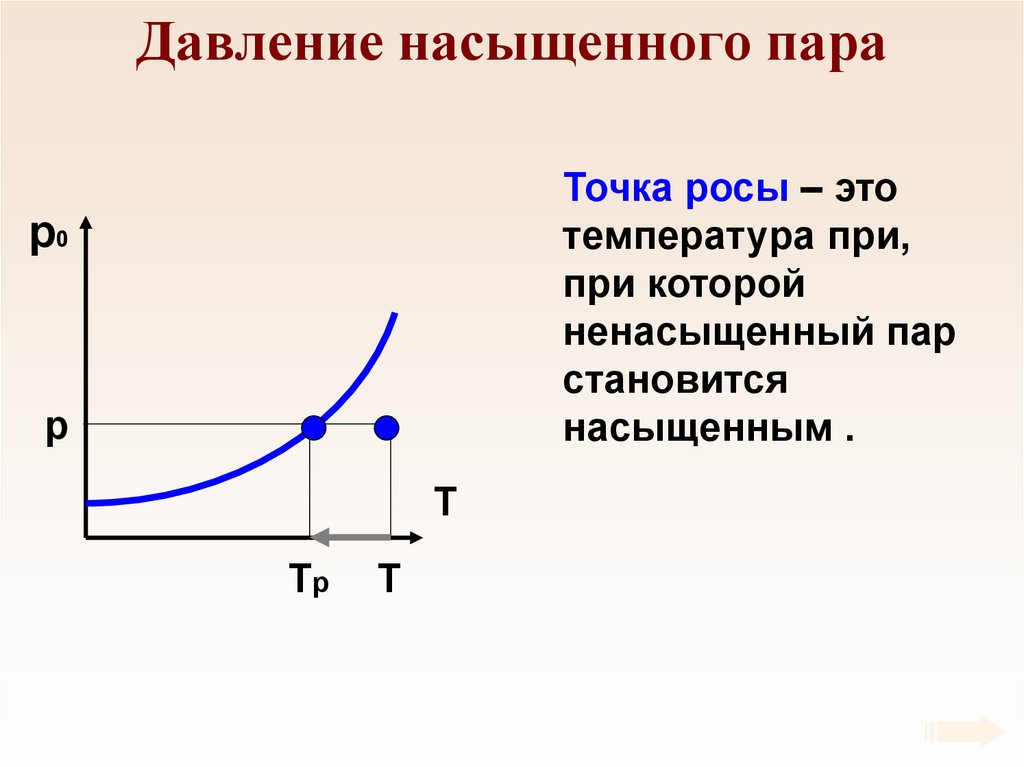
60. Давление насыщенного пара
Точка росы – этотемпература при,
при которой
ненасыщенный пар
становится
насыщенным .
p0
p
T
Tр
T
61. Испарение и кипение
Процесспарообразования с
поверхности
жидкости.
Процесс
парообразования
по всему объему
жидкости.
Происходит при
любой
температуре.
Происходит при
температуре
кипения.
Скорость испарения зависит от:
•Вида жидкости
•Температуры
•Площади поверхности
•Наличие ветра
Чем ниже давление,
тем ниже температура
кипения.
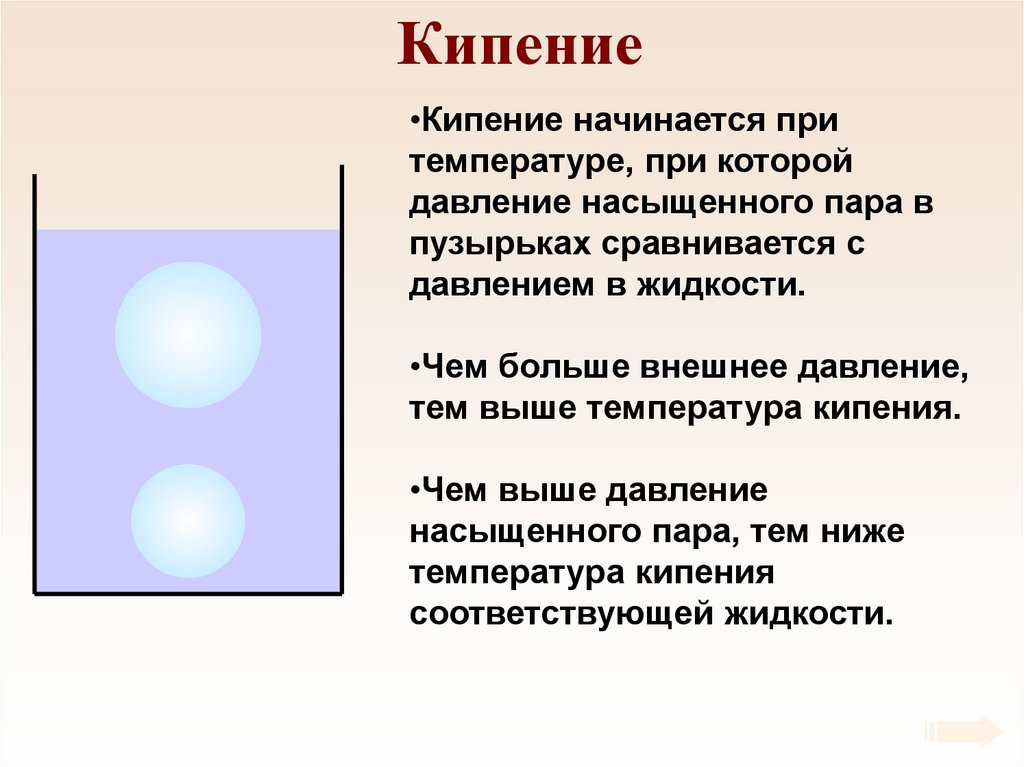
62. Кипение
•Кипение начинается притемпературе, при которой
давление насыщенного пара в
пузырьках сравнивается с
давлением в жидкости.
•Чем больше внешнее давление,
тем выше температура кипения.
•Чем выше давление
насыщенного пара, тем ниже
температура кипения
соответствующей жидкости.
63. Влажность
абсолютнаяПлотность
водяных паров в
воздухе.
m
V
кг
3
м
относительная
Отношение парциального давления
водяного пара, содержащегося в
воздухе, к давлению насыщенного
пара при данной температуре.
p
100%
p0
%
64. Измерение влажности
Приборы для измерения влажности:• Психрометр
• Гигрометр
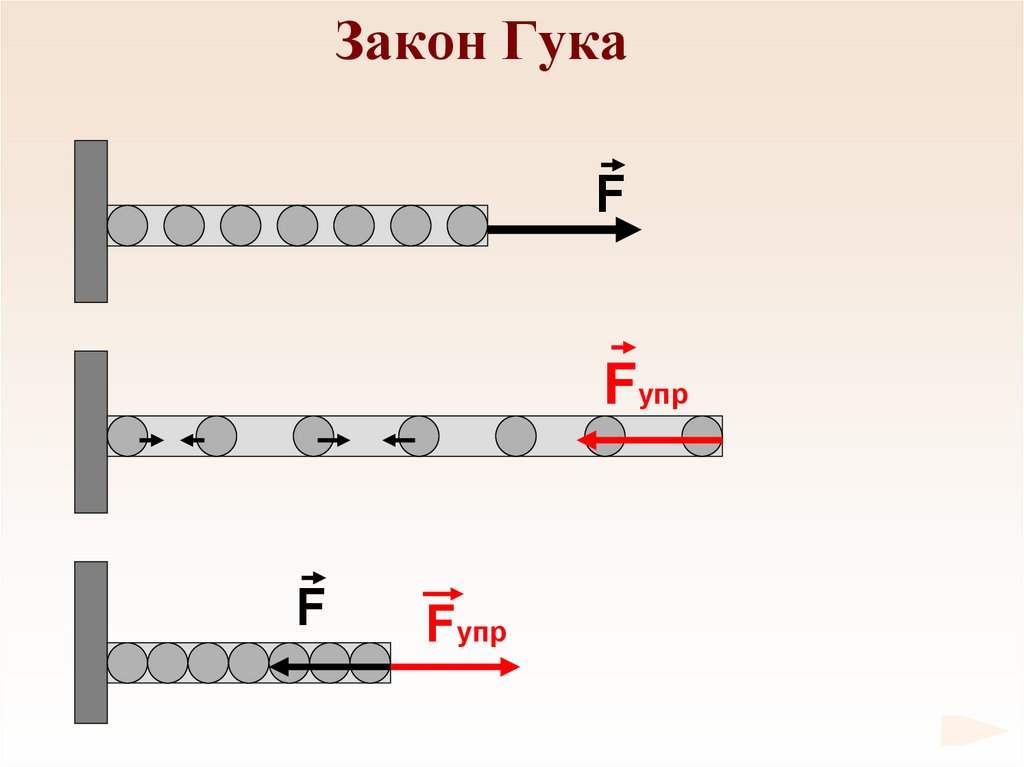
65. Закон Гука
FFупр
F
Fупр
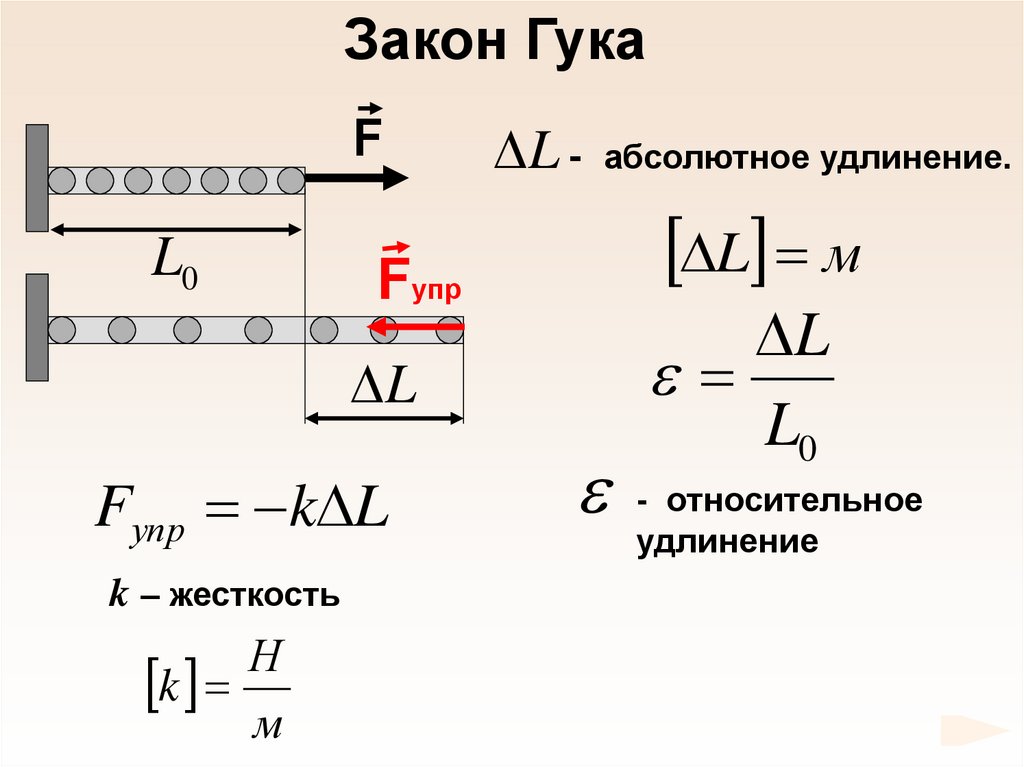
66.
Закон ГукаF
L0
Fупр
L
Fупр k L
k – жесткость
Н
k
м
L - абсолютное удлинение.
L м
L
L0
- относительное
удлинение
67.
Закон ГукаF
- механическое напряжение
S
Н
2 Па
м
пч - предел прочности – максимальное механическое
напряжение, которое выдерживает данное
вещество
Е
1660 г.
Е – модуль Юнга
Е Па
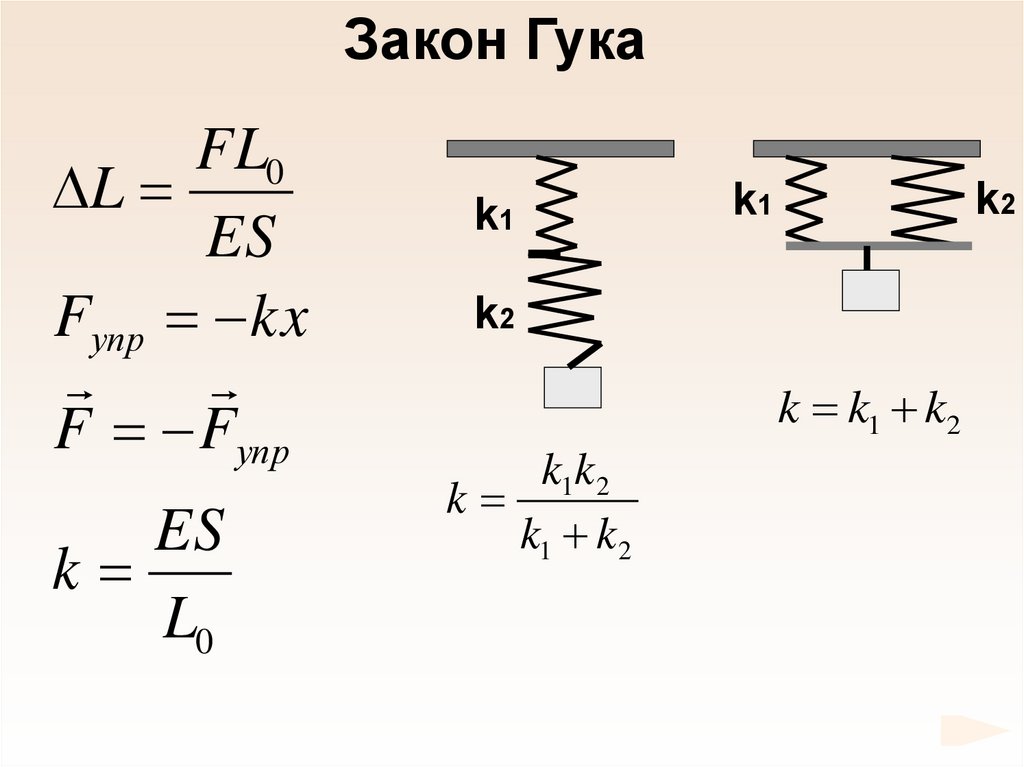
68.
Закон ГукаFL0
L
ES
Fупр kx
F Fупр
ES
k
L0
k1
k2
k1
k2
k k1 k2
k1k 2
k
k1 k 2
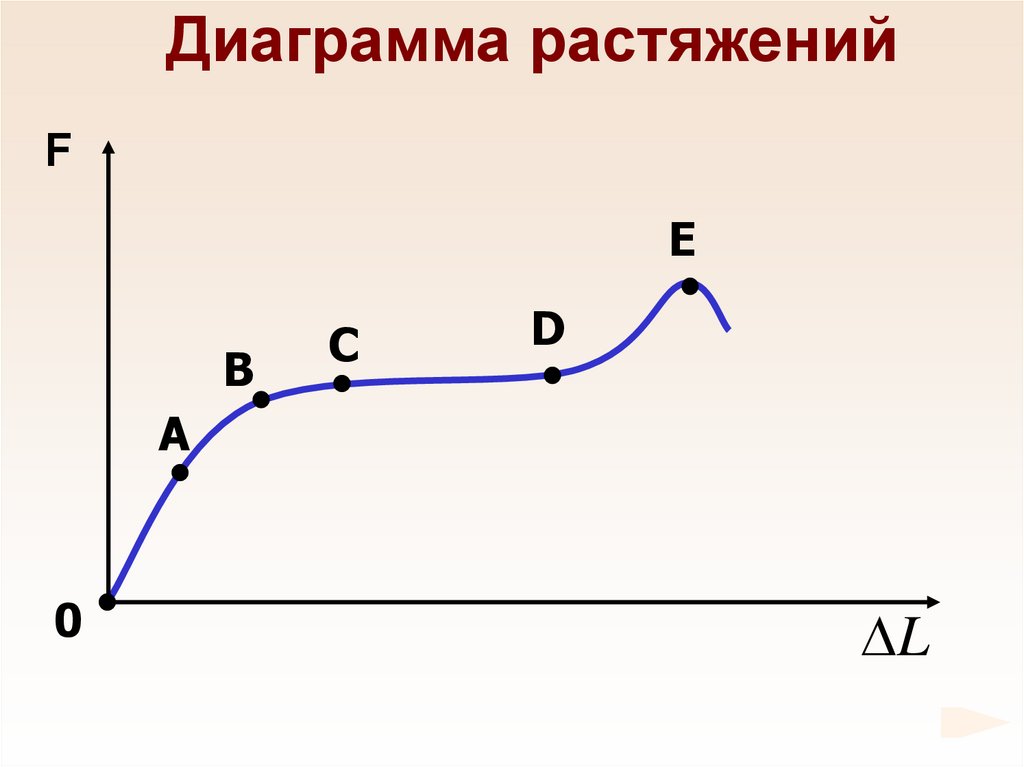
69.
Диаграмма растяженийF
Е
В
С
D
А
0
L
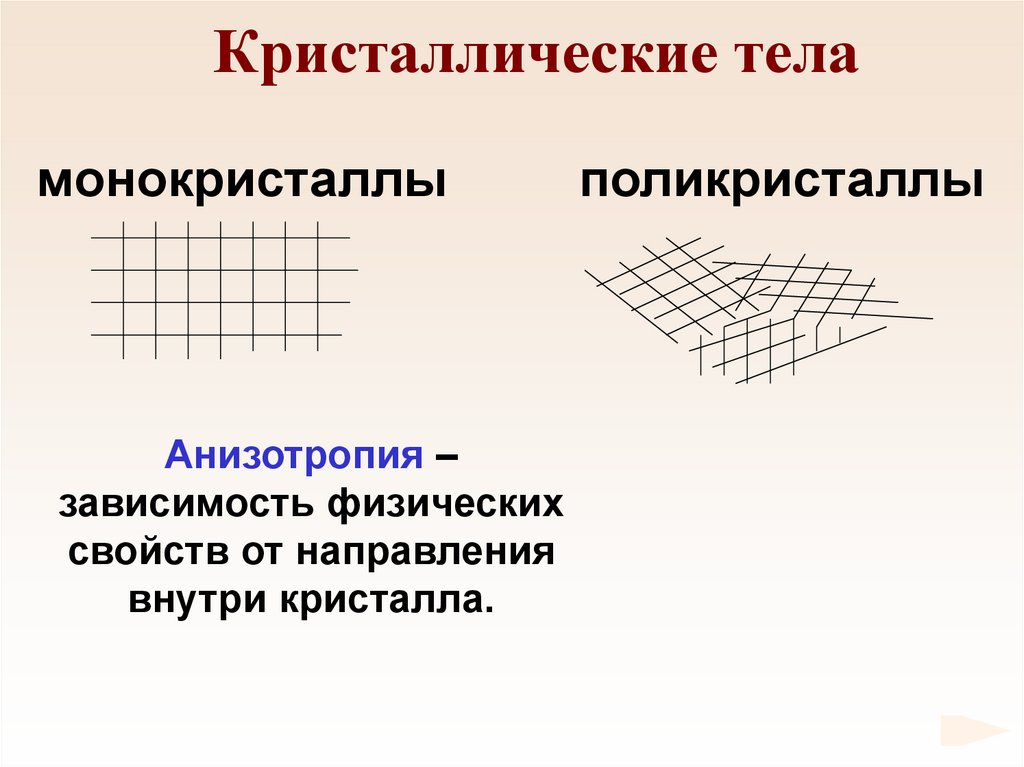
70. Кристаллические тела
монокристаллыАнизотропия –
зависимость физических
свойств от направления
внутри кристалла.
поликристаллы
71. Аморфные тела
• Нет строгого порядка в расположенииатомов.
• Все аморфные тела изотропны, т.е их
физические свойства одинаковы по всем
направлениям.
• Аморфные тела не имеют определенной
температуры плавления.
• При внешних воздействиях аморфные тела
обнаруживают одновременно упругие
свойства, подобно твердым телам, и
текучесть, подобно жидкости.
72. Внутренняя энергия
Внутренняя энергия макроскопическоготела равна сумме кинетических энергий
беспорядочного движения всех молекул
(или атомов) тела и потенциальных
энергий взаимодействий всех молекул
друг с другом (но не с молекулами
других тел).
U Дж
U N E k N En
73. Внутренняя энергия
В идеальном газе частицы не взаимодействуютмежду собой, следовательно их потенциальные
энергии равны нулю.
U N Ek
N NA
m
3
Ek kT
2
NA k R
3m
U
RT
2
3
U RT
2
3
U pV
2
74. Внутренняя энергия
3mU
RT
2
3
•Коэффициент
применим только для одноатомного
2
газа.
i
•В общем случае используется коэффициент
, где i
2
– число степеней свободы движения частицы.
Одноатомный газ (неон, аргон, гелий) – i = 3.
Двухатомный газ (водород, азот) – i = 5.
Трехатомный газ (углекислый газ, озон) – i = 6.
75. Внутренняя энергия
Способы изменения внутреннейэнергии:
• Передача теплоты
• Совершение работы
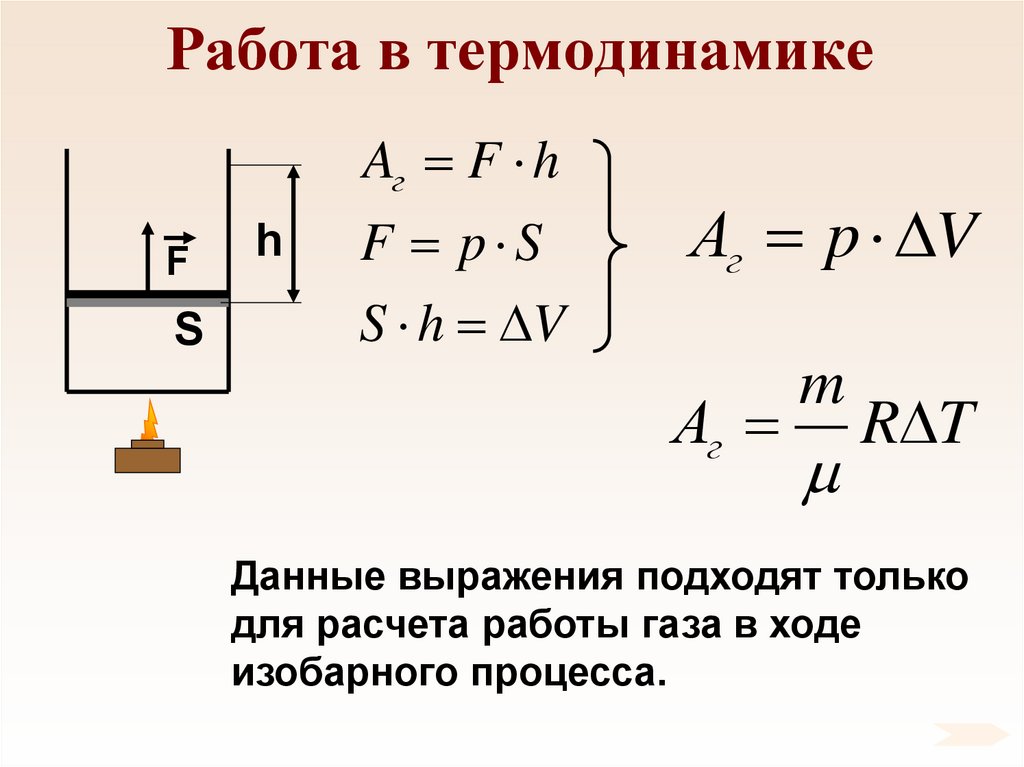
76. Работа в термодинамике
Aг F hF
S
h
F p S
S h V
Аг p V
Аг
m
R T
Данные выражения подходят только
для расчета работы газа в ходе
изобарного процесса.
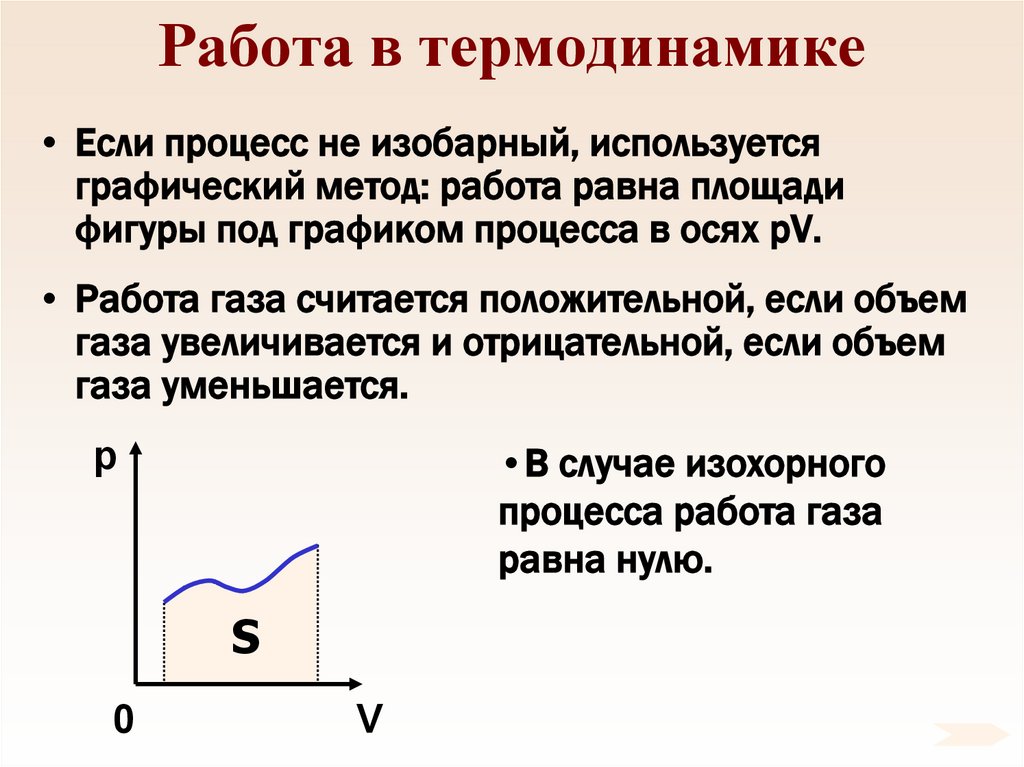
77. Работа в термодинамике
• Если процесс не изобарный, используетсяграфический метод: работа равна площади
фигуры под графиком процесса в осях pV.
• Работа газа считается положительной, если объем
газа увеличивается и отрицательной, если объем
газа уменьшается.
•В случае изохорного
процесса работа газа
равна нулю.
p
S
0
V
78. Количество теплоты
Количество теплоты – это энергия полученная илиотданная телом в процессе теплопередачи.
Виды теплопередачи:
• Теплопроводность
• Конвекция
• излучение
Q Дж
79. Количество теплоты
потребляетсянагревание
выделяется
охлаждение
Q сm t 2 t1
Q сm t 2 t1
t 2 t1 t 0
t 2 t1 t 0
с – удельная теплоемкость вещества – величина
равная энергии, необходимой для нагревания тела
массой 1 кг на 1 К.
Дж
с
кг К
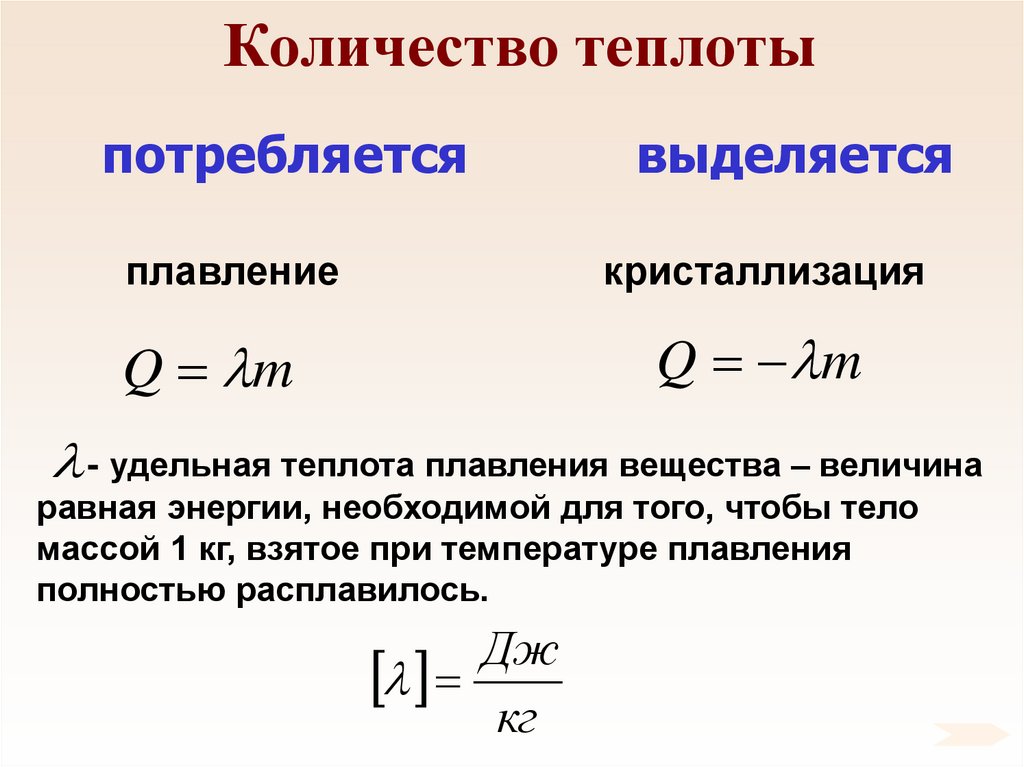
80. Количество теплоты
потребляетсявыделяется
плавление
кристаллизация
Q m
Q m
- удельная теплота плавления вещества – величина
равная энергии, необходимой для того, чтобы тело
массой 1 кг, взятое при температуре плавления
полностью расплавилось.
Дж
кг
81. Количество теплоты
потребляетсявыделяется
парообразование
конденсация
Q Lm
Q Lm
L - удельная теплота парообразования вещества –
величина равная энергии, необходимой для того,
чтобы жидкость массой 1 кг, взятая при температуре
кипения полностью перешла в газообразное
состояние.
Дж
L
кг
82. Количество теплоты
потребляетсявыделяется
Сгорание топлива
Q qm
q – удельная теплота сгорания топлива – величина
равная энергии, которая выделяется при сгорании
данного вида топлива массой 1 кг.
Дж
q
кг
83. Первый закон термодинамики
U Q AИзменение внутренней энергии системы при
переходе ее из одного состояния в другое равно
сумме работы внешних сил и количества теплоты,
переданного системе.
A Aг
Q U Aг
Количество теплоты, переданное системе, идет на
изменение ее внутренней энергии и на совершение
системой работы над внешними телами.
84. Применение первого закона термодинамики к различным процессам
• Изотермический процесс• Изобарный процесс
• Изохорный процесс
• Адиабатный процесс
85. Изотермический процесс
Q U AгU 0 , т.к. T 0
Q Aг
В ходе изотермического процесса все
полученное системой количество теплоты
идет на совершение работы.
86. Изобарный процесс
Q U Aг3m
U
R T
2
m
Aг R T
3
U Aг
2
5
Q Aг
2
5m
Q
R T
2
Данный способ расчета внутренней энергии и
количества теплоты подходит только для
одноатомного газа.
87. Изобарный процесс
Если газ не одноатомный, тоQ cm t 2 t1 , Aг
m
R T
U Q Aг
Можно воспользоваться следующими выражениями:
i m
U
R T
2
i 2 m
Q
R T
2
i – число степеней свободы движения частиц.
88. Изохорный процесс
Q U AгAг 0 , т.к. V 0
Q U
В ходе изохорного процесса все полученное
системой количество теплоты идет на
изменение внутренней энергии системы.
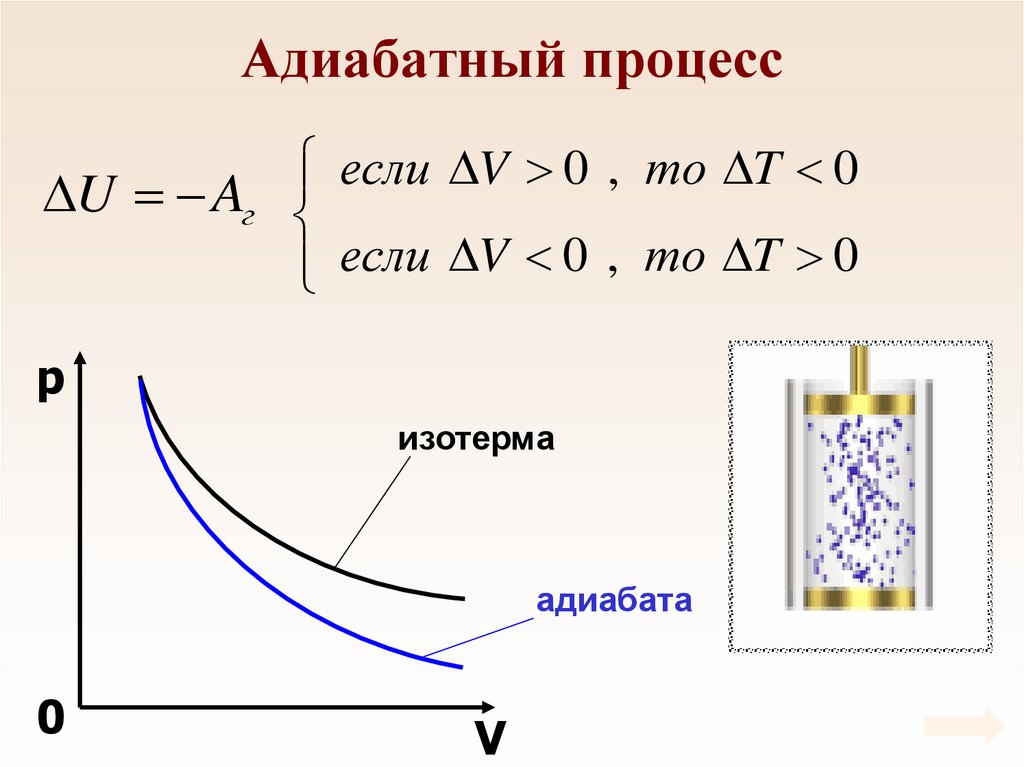
89. Адиабатный процесс
Процесс, который происходит безтеплообмена с внешней средой называется
адиабатным.
Q 0
0 U Aг
U Aг
В ходе адиабатного процесса газ совершает
работу за счет изменения внутренней энергии.
90. Адиабатный процесс
если V 0 , то T 0U Aг
если
V
0
,
то
T
0
p
изотерма
адиабата
0
V
91. Тепловые двигатели
• Тепловые двигатели – механизмы,преобразующие внутреннюю энергию
топлива в механическую энергию.
• Основные детали: нагреватель,
холодильник и рабочее тело.
• В качестве рабочего тела в т.д. выступает
газ.
92. Тепловые двигатели
КПД : %нагреватель
Aг Qн Qх
Qн
рабочее
тело
Qх
холодильник
Аг
Аг
100%
Q
Qн Qх
100%
Qн
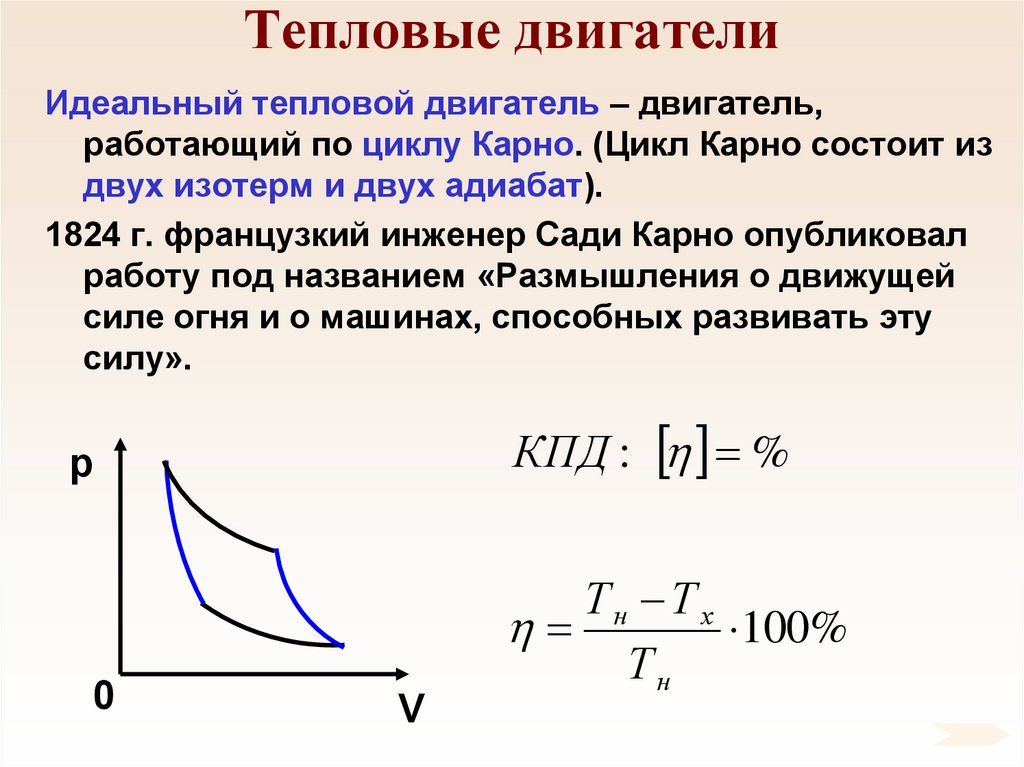
93. Тепловые двигатели
Идеальный тепловой двигатель – двигатель,работающий по циклу Карно. (Цикл Карно состоит из
двух изотерм и двух адиабат).
1824 г. французкий инженер Сади Карно опубликовал
работу под названием «Размышления о движущей
силе огня и о машинах, способных развивать эту
силу».
КПД : %
p
0
V
Тн Т х
100%
Тн



































































 Физика
Физика








