Похожие презентации:
Молекулярная физика. Основы МКТ
1. Молекулярная физика
2. Основы мкт
1. Основные положения МКТ и их опытныедоказательства.
2. Основные понятия МКТ.
3. Основное уравнение МКТ . Молекулярнокинетический смысл температуры.
4.Средняя энергия одной молекулы.
5. Уравнение состояния ид.газа (ур-е
Менделеева- Клапейрона).
6. Изопроцессы в газах. Газовые законы.
3. Молекулярно-кинетическая теория
• МКТ объясняет свойства макроскопических тели тепловых процессов, на основе представлений о
том, что все тела состоят из отдельных,
беспорядочно движущихся частиц.
• Макроскопические тела – тела, состоящие из
большого количества частиц.
• Микроскопические тела – тела, состоящие из
малого количества частиц.
4. 1.Основные положения мкт
• Вещество состоит из частиц• Частицы непрерывно и хаотически
движутся
• Частицы взаимодействуют друг с другом
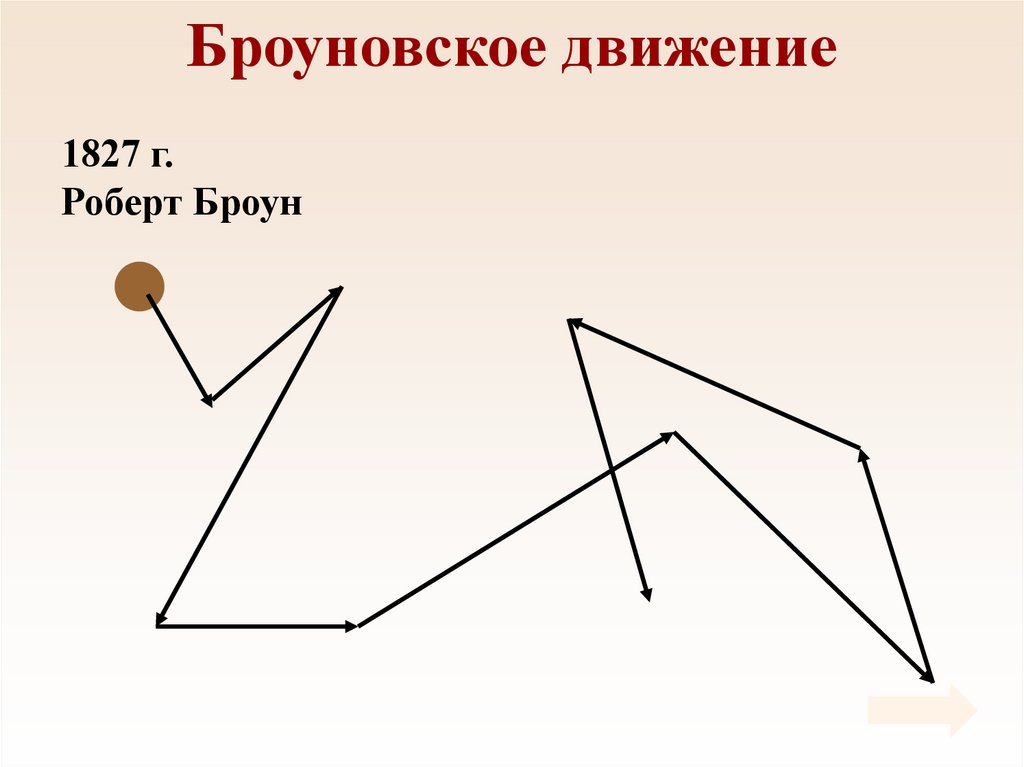
5. Броуновское движение
1827 г.Роберт Броун
6. Броуновское движение
• Причина броуновскогодвижения состоит в том,
что удары молекул
жидкости о частицу не
компенсируют друг друга.
• 1905 г. Альберт
Эйнштейн.
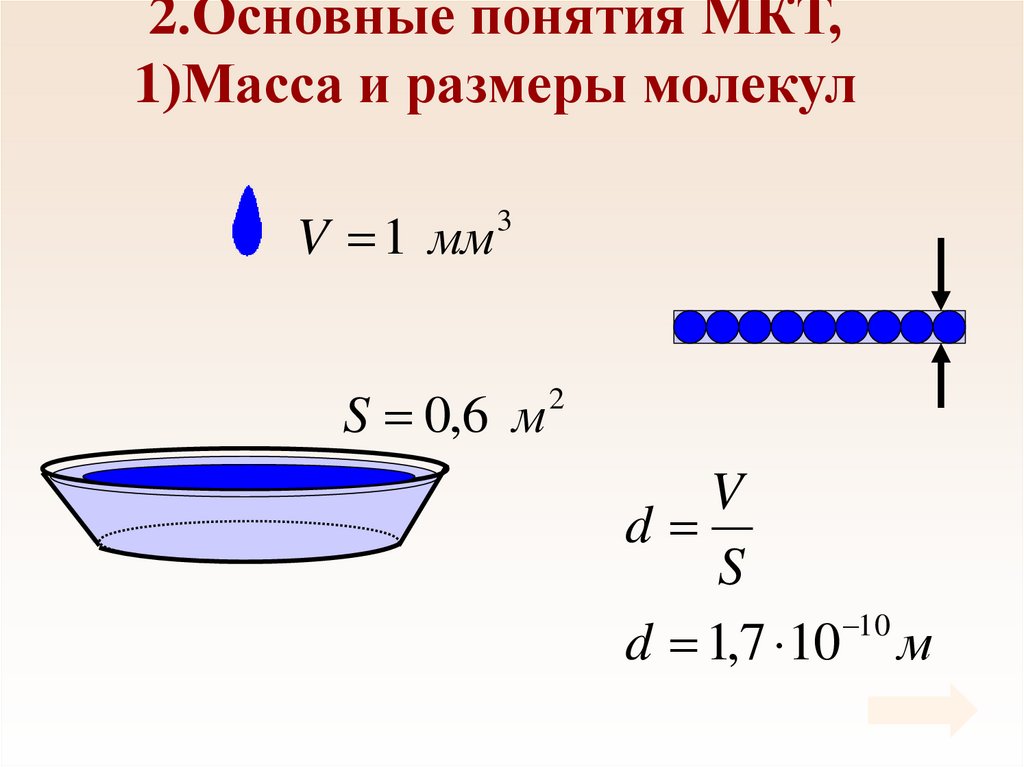
7. 2.Основные понятия МКТ, 1)Масса и размеры молекул
V 1 мм3
S 0,6 м
2
V
d
S
10
d 1,7 10 м
8. Масса и размеры молекул
22В 1 г воды содержится 3,7 * 10 молекул.
m0 воды
1г
3,7 10
22
2,7 10
23
г
Массы молекул в макроскопических масштабах
чрезвычайно малы.
9.
Масса и размеры молекулкофе
этанол
10. Масса и размеры молекул
1961 годОтносительной молекулярной (или атомной)
массой вещества (Мr) называют отношение массы
молекулы (или атома) m0 данного вещества к 1/12
массы атома углерода m0C.
Mr
m0
1
m0C
12
11. 2)Количество вещества
Количество вещества наиболее естественно было быизмерять числом молекул или атомов в теле. Но число
частиц в любом макроскопическом теле так велико, что в
расчетах используют не абсолютное число частиц, а
относительное.
моль
Один моль – это количество вещества, в котором
содержится столько же молекул или атомов, сколько
содержится в углероде массой 12 г.
12. Количество вещества
В 1 моле любого вещества содержится одно и то жечисло атомов или молекул.
1
- постоянная
N A 6,022 10
моль Авогадро
23
Количество вещества равно отношению числа
молекул в данном теле к постоянной Авогадро.
N
NA
13. Количество вещества
Молярной массой вещества называют массувещества, взятого в количестве
1 моль.
m0 N A
кг
моль
m0 - масса одной молекулы или атома
m0
NA
14. Количество вещества
m m0 Nm – масса вещества
m
N
N N A N A
m
- формула для расчета
числа частиц в теле
15. 3)Идеальный газ
Идеальный газ – это газ, в котором• Частицы – материальные точки
• Частицы взаимодействуют только при
соударениях
• Удары абсолютно упругие
16. 4)Среднее значение квадрата скорости молекул
• Скорость – величина векторная, поэтому средняяскорость движения частиц в газе равна нулю.
ср
1 2 3 ...
N
0
17. Среднее значение квадрата скорости молекул
22 3 ...
2
1
2
2
N
x y z
2
2
2
x y z
2
2
1 2
x
3
2
2
2
0
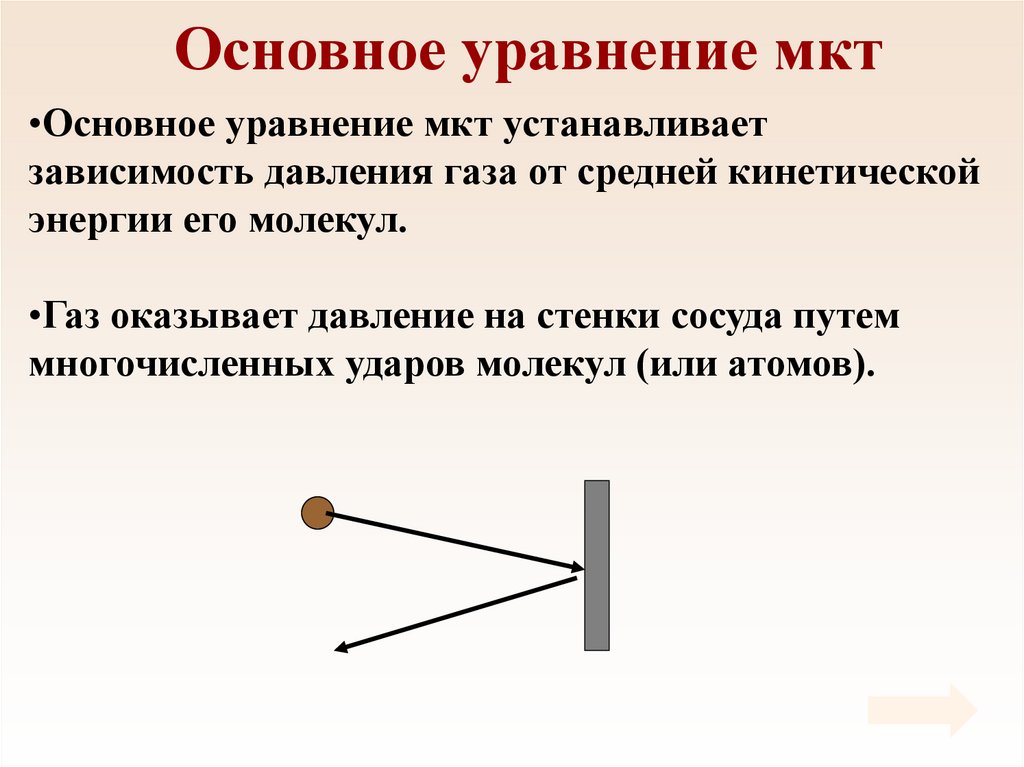
18. Основное уравнение мкт
•Основное уравнение мкт устанавливаетзависимость давления газа от средней кинетической
энергии его молекул.
•Газ оказывает давление на стенки сосуда путем
многочисленных ударов молекул (или атомов).
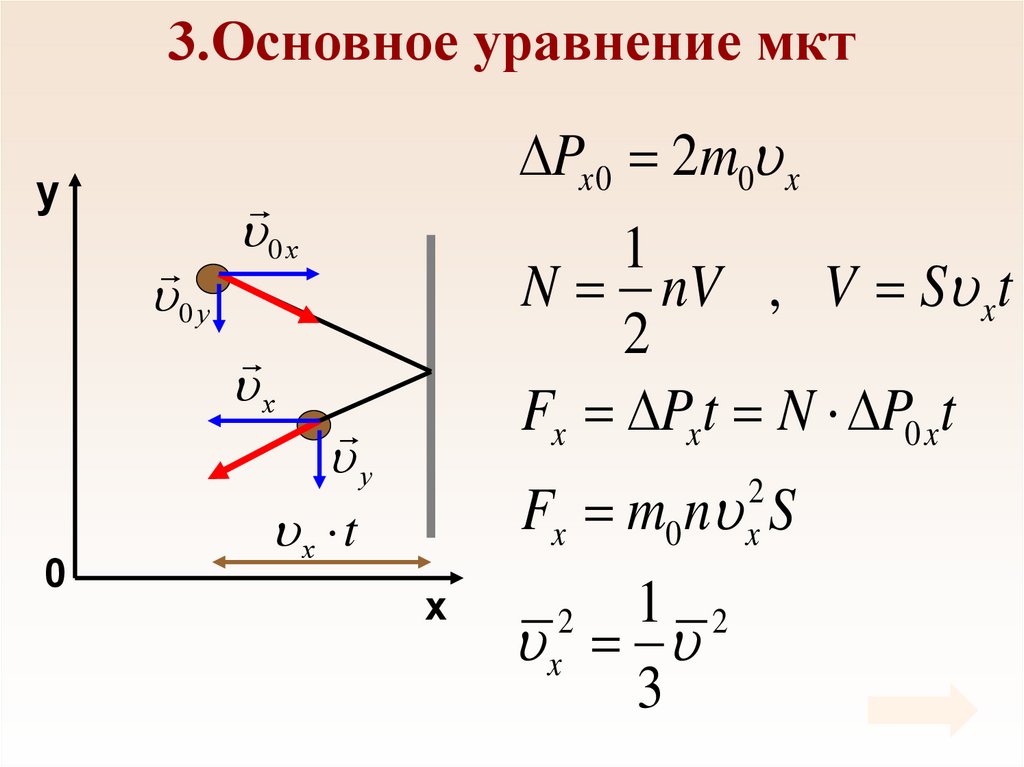
19. 3.Основное уравнение мкт
yPx 0 2m0 x
0 у
0 х
1
N nV , V S xt
2
Fx Px t N P0 xt
х
0
у
Fx m0 n S
2
x
х t
x
1 2
3
2
x
20. Основное уравнение мкт
11
2
F nm0 S p m0 n 2
3
3
2
F
p
p nE k 0
3
S
2
m0
N
m
Ek 0
m n m
0
0
2
V V
1
2
p
3
21. Температура и тепловое равновесие
• Макроскопические параметры(макропараметры) – величины,
характеризующие состояние
макроскопических тел без учета
молекулярного строения. (V, p, t ).
• Тепловым равновесием называют такое
состояние, при котором все макроскопические
параметры всех тел системы остаются
неизменными сколь угодно долго.
22. Температура и тепловое равновесие
• Любое макроскопическое тело или группамакроскопических тел при неизменных внешних
условиях самопроизвольно переходит в состояние
теплового равновесия.
• Все тела системы, находящиеся друг с другом в
тепловом равновесии имеют одну и ту же
температуру.
23. Температура и тепловое равновесие
• Термометр – прибор для измерения температурытела.
• Термометр входит в состояние теплового
равновесия с исследуемым телом и показывает
свою температуру.
24. Температура и тепловое равновесие
• Основная деталь термометра –термометрическое тело, то есть тело,
макропараметры которого изменяются при
изменении температуры. (Например, в ртутных
термометрах термометрическим телом является
ртуть – при изменении температуры изменяется
ее объем.)
25. Температура и тепловое равновесие
• Изобретателем термометра являетсяГалилео Галилей (ок. 1600 г.)
• Термометрическим телом в его термометре
являлся газ – при повышении температуры
его объем увеличивался, вытесняя
жидкость.
• Недостатком термометра Галилея являлось
отсутствие температурной шкалы.
26. Температурные шкалы
00
С
0
F
K
R
100
212
80
373
0
32
0
273
шкала
Цельсия
шкала
Фаренгейта
шкала
Реомюра
шкала
Кельвина
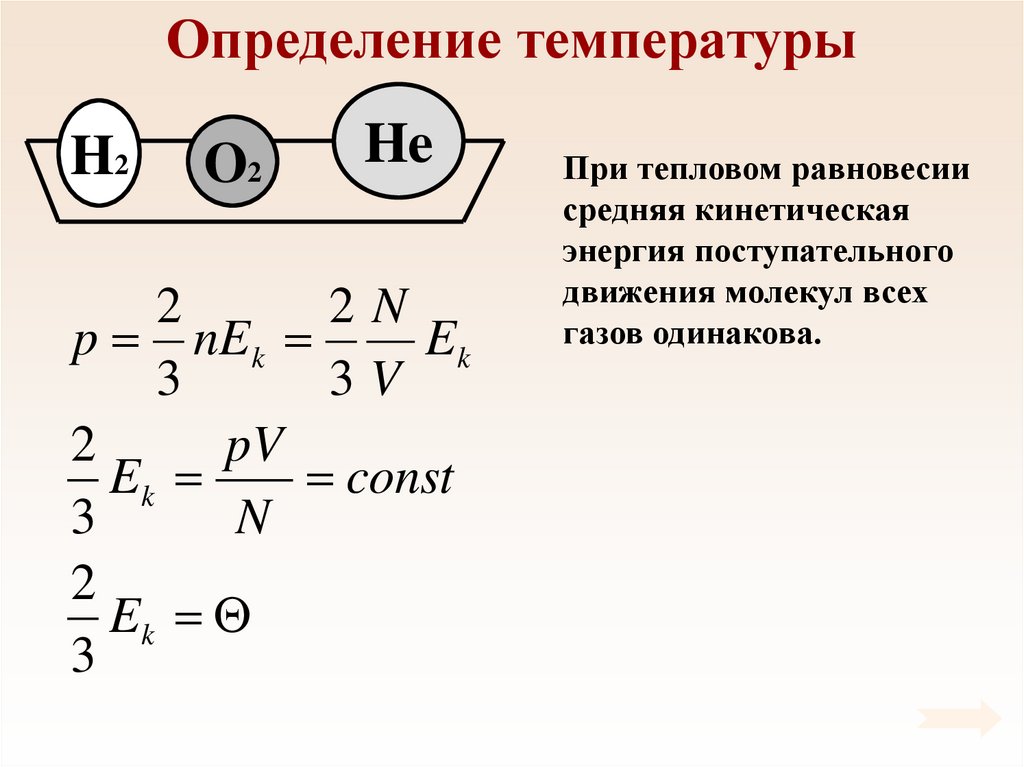
27. Определение температуры
H2O2
He
2
2N
p nEk
Ek
3
3V
2
pV
Ek
const
3
N
2
Ek
3
При тепловом равновесии
средняя кинетическая
энергия поступательного
движения молекул всех
газов одинакова.
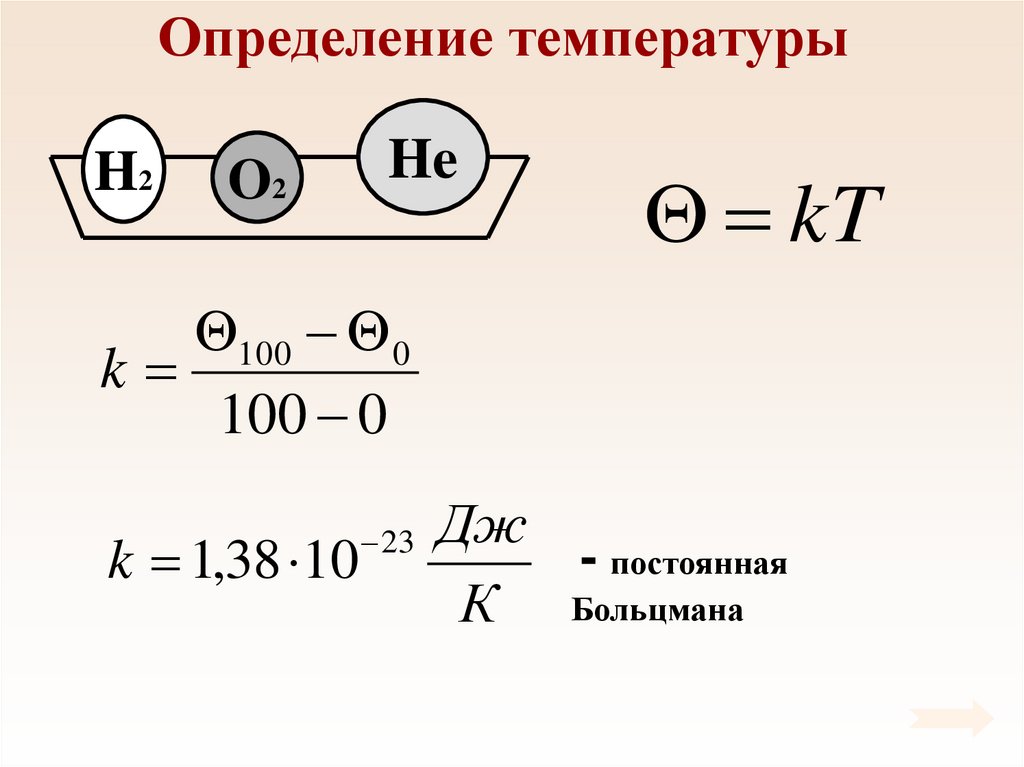
28. Определение температуры
H2O2
He
kT
100 0
k
100 0
k 1,38 10
23
Дж
- постоянная
К Больцмана
29. 4.Температура – мера средней кинетической энергии молекул
kT3
2
Ek kT
2
Ek
3
T K кельвин
T t 273
t T 273
t T
30. Зависимость давления газа от температуры и концентрации молекул газа
3Ek kT
2
p nkT
2
p nE k
3
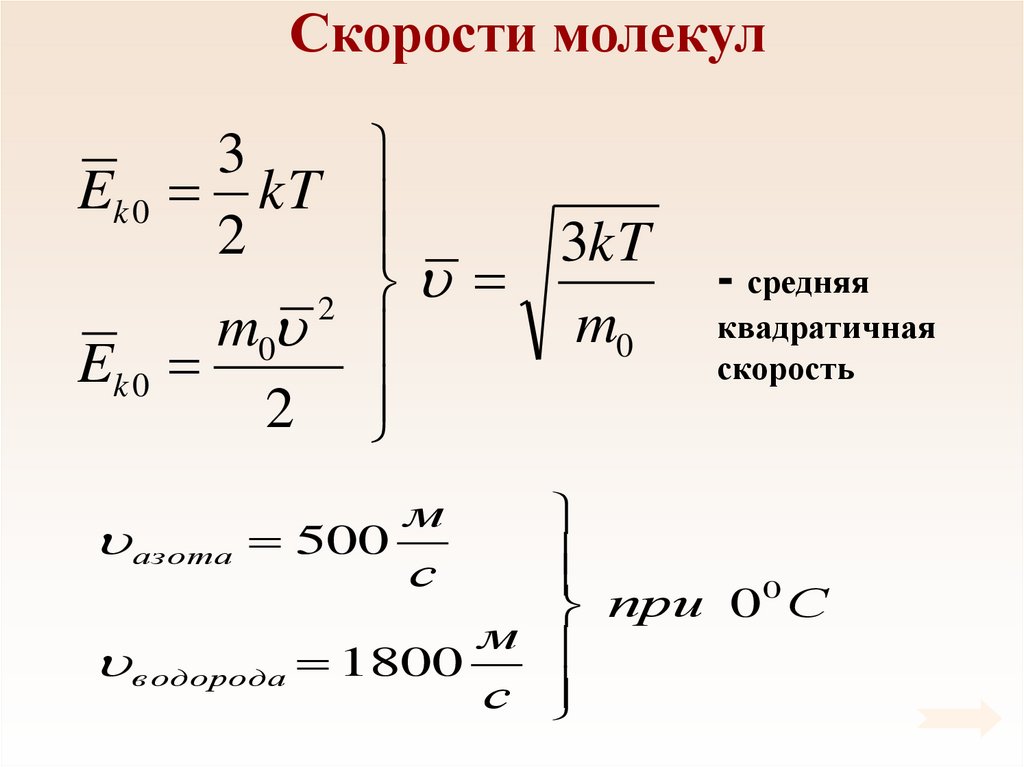
31. Скорости молекул
3Ek 0 kT
2
3kT
2
m0
m0
Ek 0
2
- средняя
квадратичная
скорость
0
при 0 С
м
в одорода 1800
с
м
азота 500
с
32. 5.Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Np nkT kT
V
m
N N A N A
pV
Дж
N A k R 8,31
моль К
- универсальная
m
RT
газовая постоянная
33. Уравнение состояния идеального газа (ур-е Менделеева – Клапейрона)
Если в ходе процесса масса газаостается неизменной, то
pV m
R const
T
p1V1 p2V2 p3V3
...
T1
T2
T3
34. 6.Изопроцессы
- Изотермический процесс- Изобарный процесс
- Изохорный процесс
35. Изотермический процесс
• Процесс, происходящий с газомнеизменной массы при постоянной
температуре называется изотермическим.
• Изотермический процесс описывается
законом Бойля – Мариотта (конец 17 века):
pV
const
T
p1V1 p2V2
36. Изобарный процесс
• Процесс, происходящий с газом неизменноймассы при постоянном давлении
называется изобарным.
• Изобарный процесс описывается законом
Гей-Люссака (1802 г.):
pV
const
T
V1 V2
T1 T2
37. Изохорный процесс
• Процесс, происходящий с газом неизменноймассы при постоянном объеме называется
изохорным.
• Изохорный процесс описывается законом
Шарля (1787 г.):
pV
const
T
p1 p2
T1 T2
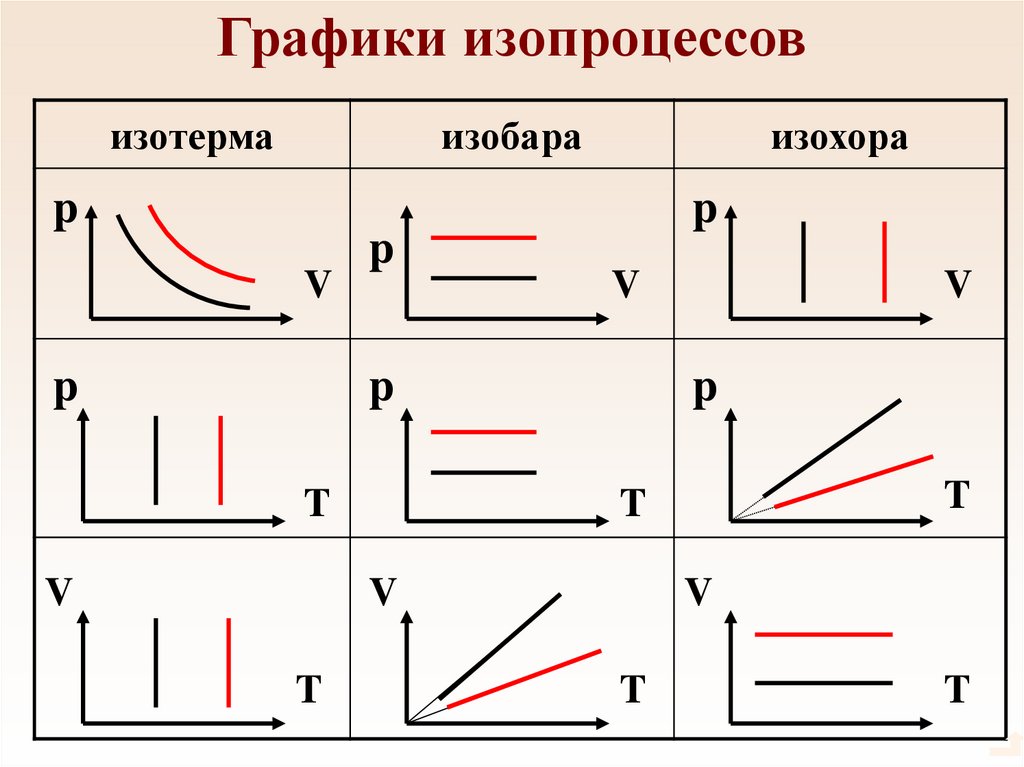
38. Графики изопроцессов
изотермаизобара
p
V
p
p
изохора
p
V
p
T
V
p
T
T
V
T
V
V
T
T
39. Основы термодинамики
1. Основные понятия втермодинамике(внутренняя энергия,
количество теплоты).
2. Работа в термодинамике
3. Первый закон термодинамики и его
применение к различным процессам
4. Тепловые двигатели. КПД тепловых
двигателей.
5. Второй закон термодинамики.
40. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ
Д. Фаренгейт (1685-1736)
В 1710 – 1714 годах предложил шкалу и термометр:
0° - температура смеси воды, льда и поваренной соли,
32° - температура смеси воды и льда, 212° - температура
кипения воды, 96° - температура тела человека.
голливудский физик, мастерстеклодув
А. Цельсий (1701 – 1744),
шведский физик и астроном.
Ж. Понселе (1788 – 1867),
В 1742 году предложил стоградусную шкалу температур:
0° - температура таяния льда, 100° - температура кипение
воды
В 1826 году ввел понятие работы и единицы её измерения.
французский физик и инженер.
С. Карно (1796 – 1832),
французский физик и инженер.
Б. Клапейрон (1799 – 1864),
французский физик и инженер.
Ввел представление об идеальной тепловой машине, а в 1824
году фактически дал формулировку второго начала
термодинамики, связал тепло с движение частиц тела.
В 1834 году вывел уравнение состояния идеального газа,
обобщенное в дальнейшем Д. И. Менделеевым.
41. ИЗ ИСТОРИИ РАЗВИТИЯ ТЕРМОДИНАМИКИ
АВТОРСУТЬ ВВЕДЕННЫХ ПРЕДСТАВЛЕНИЙ
Р. Майер (1818 – 1878),
В 1842 году одним из первых сформулировал закон
сохранения и превращения энергии.
немецкий врач и естествоиспытатель.
Дж. Джоуль (1818 – 1889),
английский физик
В 1843 году первый вычислил механический эквивалент
теплоты и пришел к закону сохранения энергии.
немецкий физик и естествоиспытатель
В 1847 году дополнив идеи Майера и опыты Джоуля,
сформулировал и математически обосновал закон
сохранения и превращения энергии.
Р. Клаузиус (1822 – 1888),
немецкий физик-теоретик.
В 1850 году сформулировал второе начало
термодинамики, а в 1854 г. дал математическую
формулировку первого начала.
У. Томсон (Кельвин) (1824 – 1907),
В 1848 году ввел понятие абсолютной температуры, в
1851 году сформулировал второе начало термодинамики.
Г. Гельмгольц (1821 – 1894),
английский физик.
42. ЧТО ИЗУЧАЕТ ТЕРМОДИНАМИКА?
Возникла как наука тепловых процессов, рассматриваемыхс точки зрения энергетических преобразований.
Не рассматривает явления с точки зрения движения
молекул.
Изучает наиболее общие свойства макроскопических
систем, находящихся в равновесном состоянии, и
процессы их перехода из одного состояния в другое.
Термодинамический метод широко используется в
других разделах физики, химии, биологии.
Как и любая физическая теория или раздел физики,
имеет свои границы применимости.
43. Основные понятия термодинамики. 1)Внутренняя энергия
1.Основные понятия термодинамики.
1)Внутренняя энергия
Внутренняя энергия макроскопического
тела равна сумме кинетических энергий
беспорядочного движения всех молекул
(или атомов) тела и потенциальных
энергий взаимодействий всех молекул
друг с другом (но не с молекулами
других тел).
U Дж
U N E k N En
44. Внутренняя энергия
В идеальном газе частицы не взаимодействуютмежду собой, следовательно их потенциальные
энергии равны нулю.
U N Ek
N NA
m
3
Ek kT
2
NA k R
3m
U
RT
2
3
U RT
2
3
U pV
2
45. Внутренняя энергия
3mU
RT
2
3
•Коэффициент
применим только для одноатомного
2
газа.
i
•В общем случае используется коэффициент
, где i
2
– число степеней свободы движения частицы.
Одноатомный газ (неон, аргон, гелий) – i = 3.
Двухатомный газ (водород, азот) – i = 5.
Трехатомный газ (углекислый газ, озон) – i = 6.
46. В общем виде:
i mi
U
RT pV
2M
2
где i – число степеней свободы молекул газа
(i = 3 для одноатомного газа и i = 5 для
двухатомного газа)
47. Внутренняя энергия
Способы изменения внутреннейэнергии:
• Передача теплоты
• Совершение работы
48. Количество теплоты – часть внутренней энергии, которую тело получает или теряет при теплопередаче
ПроцессНагревание или
охлаждение
Кипение или
конденсация
Плавление или
кристаллизация
Сгорание
топлива
формула
Q cm T
Q rm
С – удельная теплоёмкость
вещества [ Дж/кг 0К], m – масса
[кг], ΔT – изменение
температуры [ 0K].
r – удельная теплота
парообразования [ Дж/кг ]
удельная теплота плавления
Q m λвещества [ Дж/кг ]
– удельная теплота сгорания
Q qm qтоплива
[ Дж/кг ]
49. Количество теплоты
потребляетсянагревание
выделяется
охлаждение
Q сm t 2 t1
Q сm t 2 t1
t 2 t1 t 0
t 2 t1 t 0
с – удельная теплоемкость вещества – величина
равная энергии, необходимой для нагревания тела
массой 1 кг на 1 К.
Дж
с
кг К
50. Количество теплоты
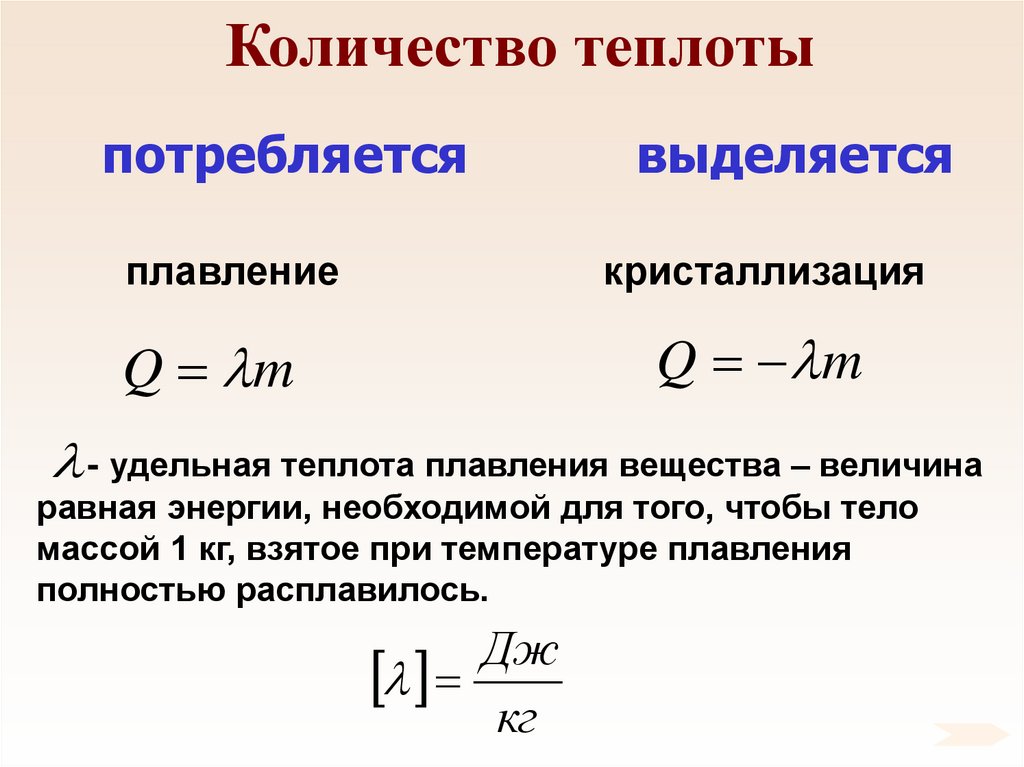
потребляетсявыделяется
плавление
кристаллизация
Q m
Q m
- удельная теплота плавления вещества – величина
равная энергии, необходимой для того, чтобы тело
массой 1 кг, взятое при температуре плавления
полностью расплавилось.
Дж
кг
51. Количество теплоты
потребляетсявыделяется
парообразование
конденсация
Q Lm
Q Lm
L - удельная теплота парообразования вещества –
величина равная энергии, необходимой для того,
чтобы жидкость массой 1 кг, взятая при температуре
кипения полностью перешла в газообразное
состояние.
Дж
L
кг
52. Количество теплоты
потребляетсявыделяется
Сгорание топлива
Q qm
q – удельная теплота сгорания топлива – величина
равная энергии, которая выделяется при сгорании
данного вида топлива массой 1 кг.
Дж
q
кг
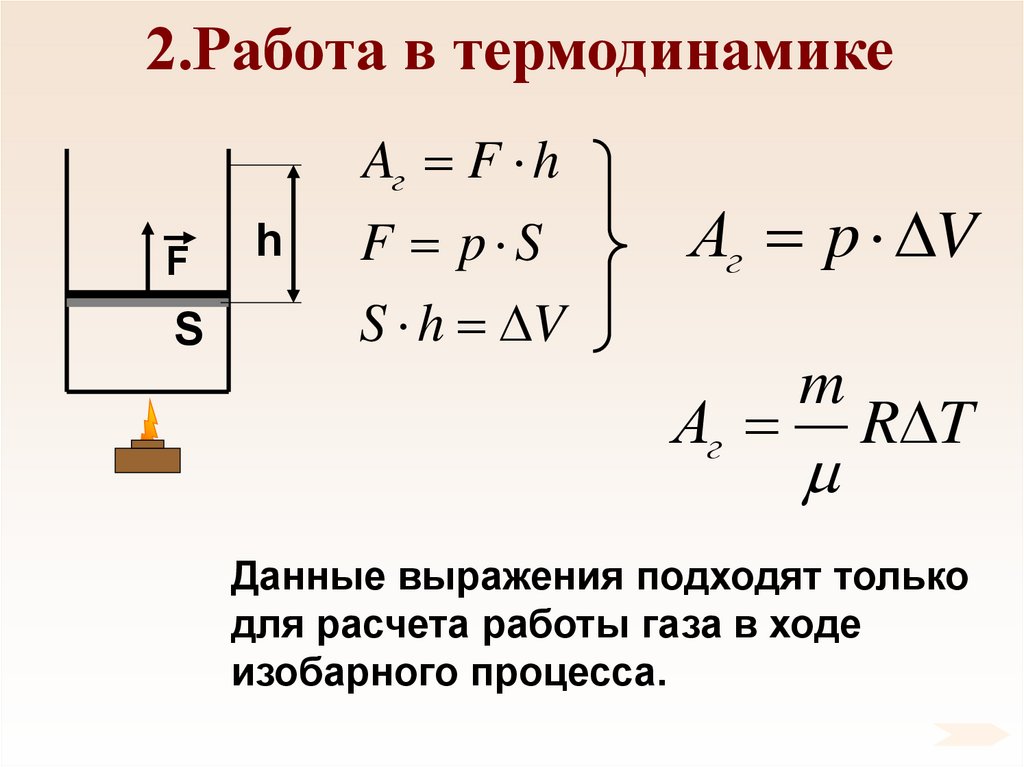
53. 2.Работа в термодинамике
Aг F hF
S
h
F p S
S h V
Аг p V
Аг
m
R T
Данные выражения подходят только
для расчета работы газа в ходе
изобарного процесса.
54. Работа в термодинамике
• Работа газа:A p(V2 V1) p V
• Работа внешних сил:
A A
55. Применение первого закона термодинамики к различным процессам
ПроцессПервый закон
термодинамики
Изохорный
Постоянный
параметр
V = const
Изотермический
Т = const
Q = A'
Изобарный
Р = const
Q = ΔU + A'
Адиабатный
Q = const
ΔU = -A'
ΔU = Q
56. Работа газа при изопроцессах
• При изохорном процессе (V=const):ΔV = 0 работа газом не совершается:
A 0
P
V
Изохорное нагревание
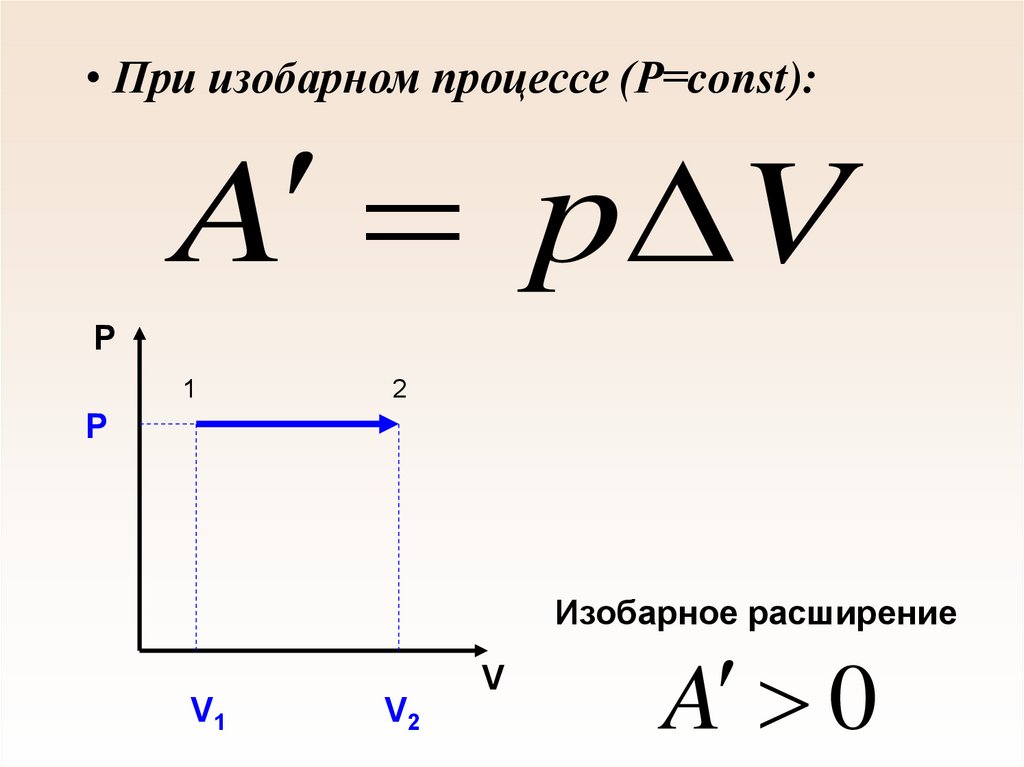
57. При изобарном процессе (Р=const):
• При изобарном процессе (Р=const):A p V
P
1
2
P
Изобарное расширение
V
V1
V2
A 0
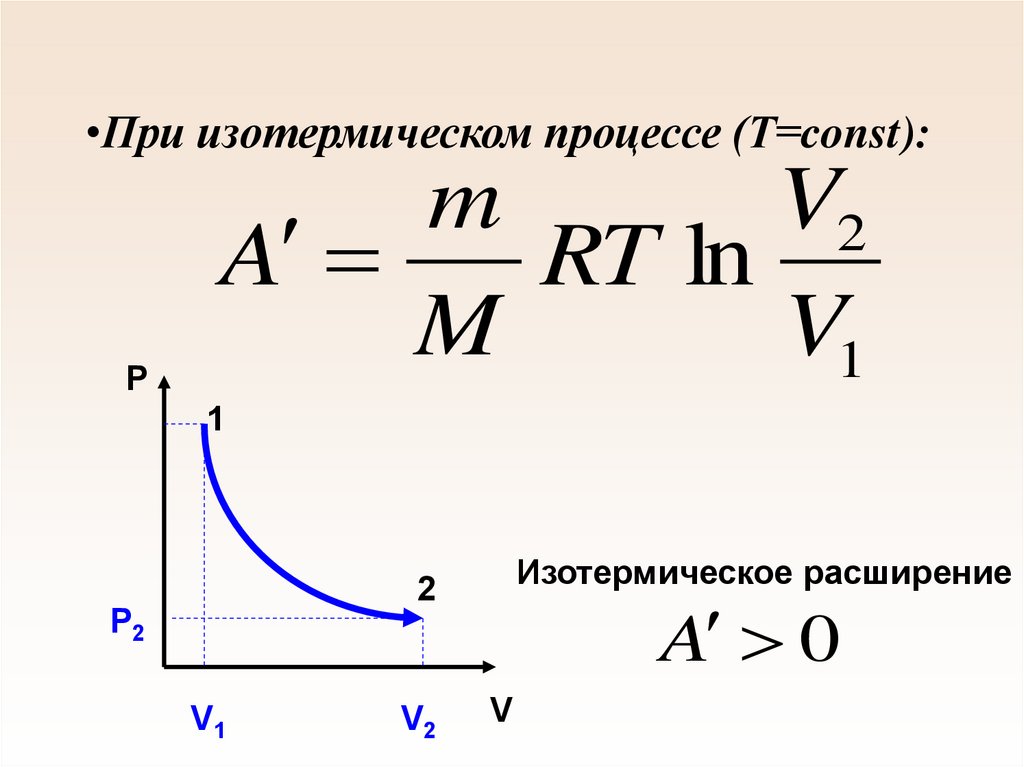
58. При изотермическом процессе (Т=const):
•При изотермическом процессе (Т=const):P
m
V2
A
RT ln
M
V1
1
Изотермическое расширение
2
Р2
V1
V2
A 0
V
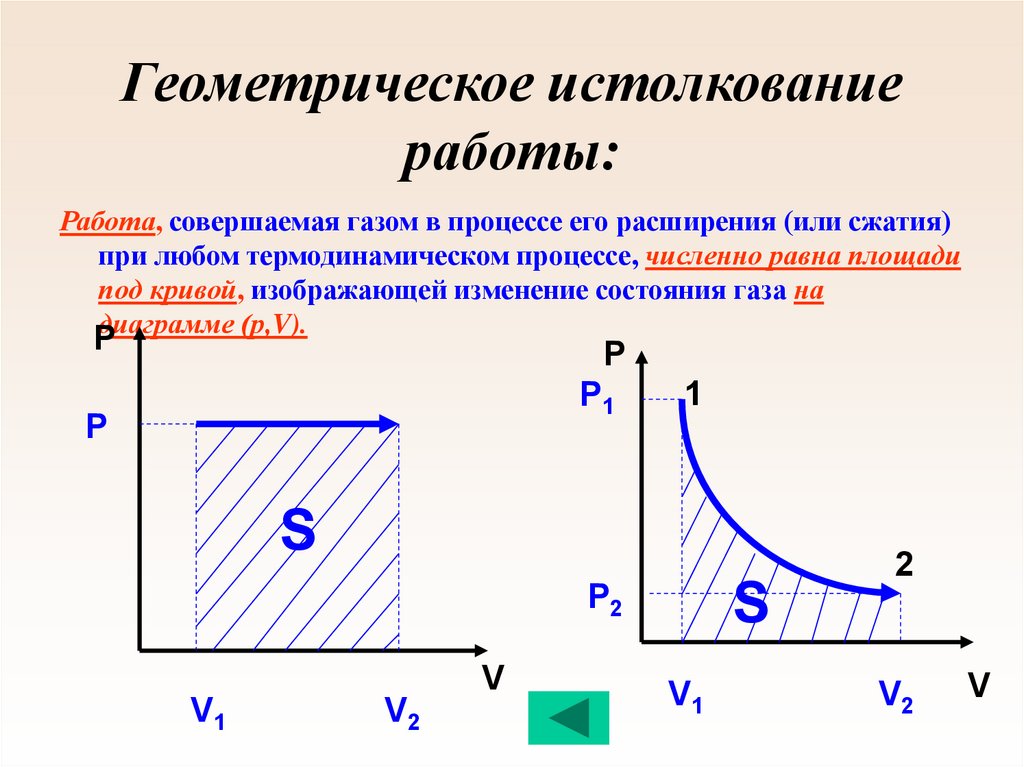
59. Геометрическое истолкование работы:
Работа, совершаемая газом в процессе его расширения (или сжатия)при любом термодинамическом процессе, численно равна площади
под кривой, изображающей изменение состояния газа на
диаграмме (р,V).
P
P
Р1
P
1
S
Р2
V
V1
V2
S
V1
2
V2
V
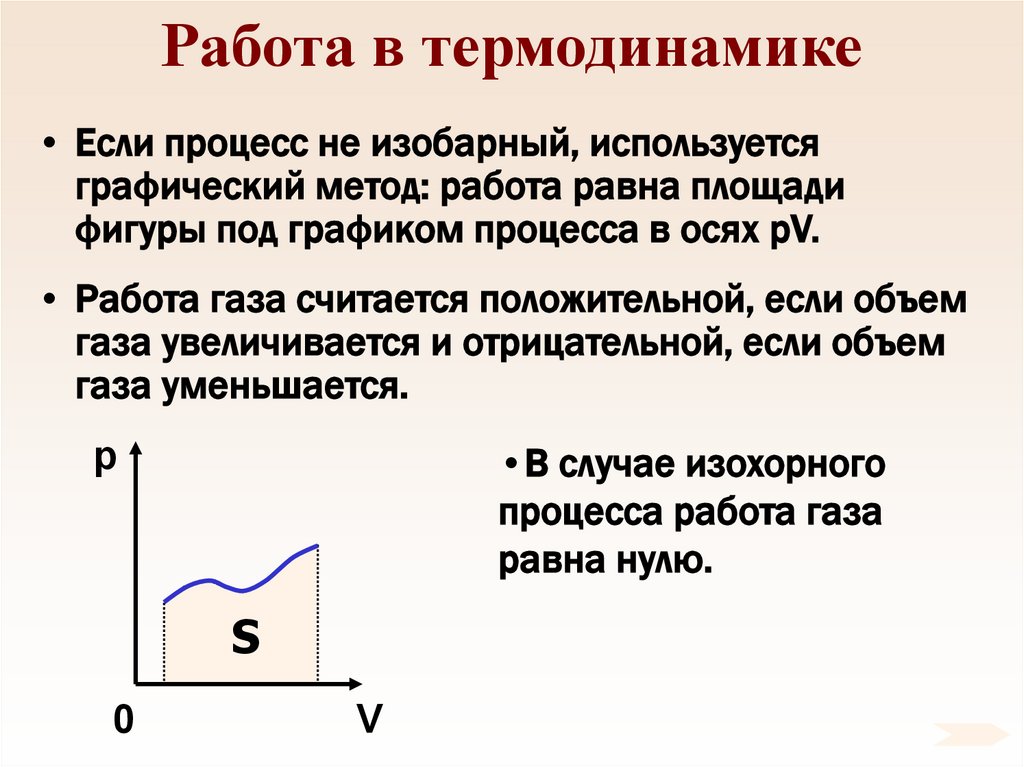
60. Работа в термодинамике
• Если процесс не изобарный, используетсяграфический метод: работа равна площади
фигуры под графиком процесса в осях pV.
• Работа газа считается положительной, если объем
газа увеличивается и отрицательной, если объем
газа уменьшается.
•В случае изохорного
процесса работа газа
равна нулю.
p
S
0
V
61. 3.Первый закон термодинамики
Изменение внутренней энергиисистемы при переходе её из
одного состояния в другое
равно сумме работы внешних
сил и количества теплоты,
переданного системе
Количество теплоты,
переданное системе, идёт
на изменение её внутренней
энергии и на совершение
системой работы над
внешними телами
U A Q
Q U A
62. Применение первого закона термодинамики к различным процессам
• Изотермический процесс• Изобарный процесс
• Изохорный процесс
• Адиабатный процесс
63. Применение первого закона термодинамики к различным процессам
ПроцессПервый закон
термодинамики
Изохорный
Постоянный
параметр
V = const
Изотермический
Т = const
Q = A'
Изобарный
Р = const
Q = ΔU + A'
Адиабатный
Q = const
ΔU = -A'
ΔU = Q
64. Изотермический процесс
Q U AгU 0 , т.к. T 0
Q Aг
В ходе изотермического процесса все
полученное системой количество теплоты
идет на совершение работы.
65. Изобарный процесс
Q U Aг3m
U
R T
2
m
Aг R T
3
U Aг
2
5
Q Aг
2
5m
Q
R T
2
Данный способ расчета внутренней энергии и
количества теплоты подходит только для
одноатомного газа.
66. Изобарный процесс
Если газ не одноатомный, тоQ cm t 2 t1 , Aг
m
R T
U Q Aг
Можно воспользоваться следующими выражениями:
i m
U
R T
2
i 2 m
Q
R T
2
i – число степеней свободы движения частиц.
67. Изохорный процесс
Q U AгAг 0 , т.к. V 0
Q U
В ходе изохорного процесса все полученное
системой количество теплоты идет на
изменение внутренней энергии системы.
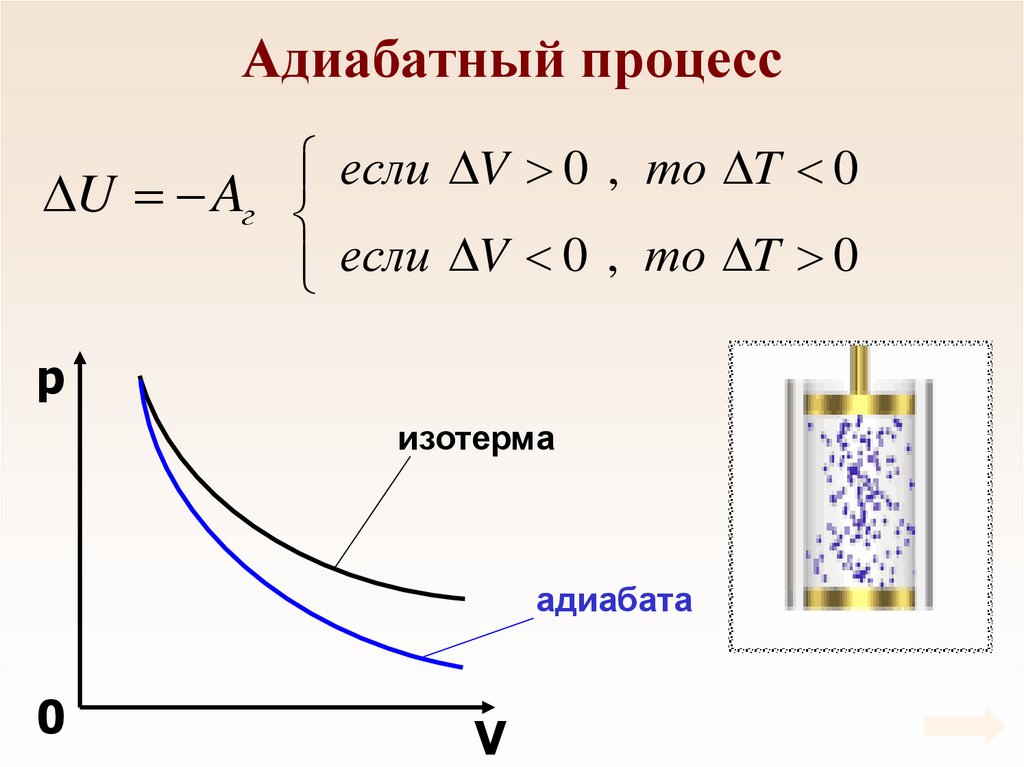
68. Адиабатный процесс
Процесс, который происходит безтеплообмена с внешней средой называется
адиабатным.
Q 0
0 U Aг
U Aг
В ходе адиабатного процесса газ совершает
работу за счет изменения внутренней энергии.
69. Адиабатный процесс
если V 0 , то T 0U Aг
если
V
0
,
то
T
0
p
изотерма
адиабата
0
V
70. 4.Тепловые двигатели
• Тепловые двигатели – механизмы,преобразующие внутреннюю энергию
топлива в механическую энергию.
• Основные детали: нагреватель,
холодильник и рабочее тело.
• В качестве рабочего тела в т.д. выступает
газ.
Виды двигателей:
1. Паровая и газовая турбины
2. Карбюраторный двс
3. Дизель двс
4. Ракетный двигатель
71. Тепловые двигатели
КПД : %нагреватель
Aг Qн Qх
Qн
рабочее
тело
Qх
холодильник
Аг
Аг
100%
Q
Qн Qх
100%
Qн
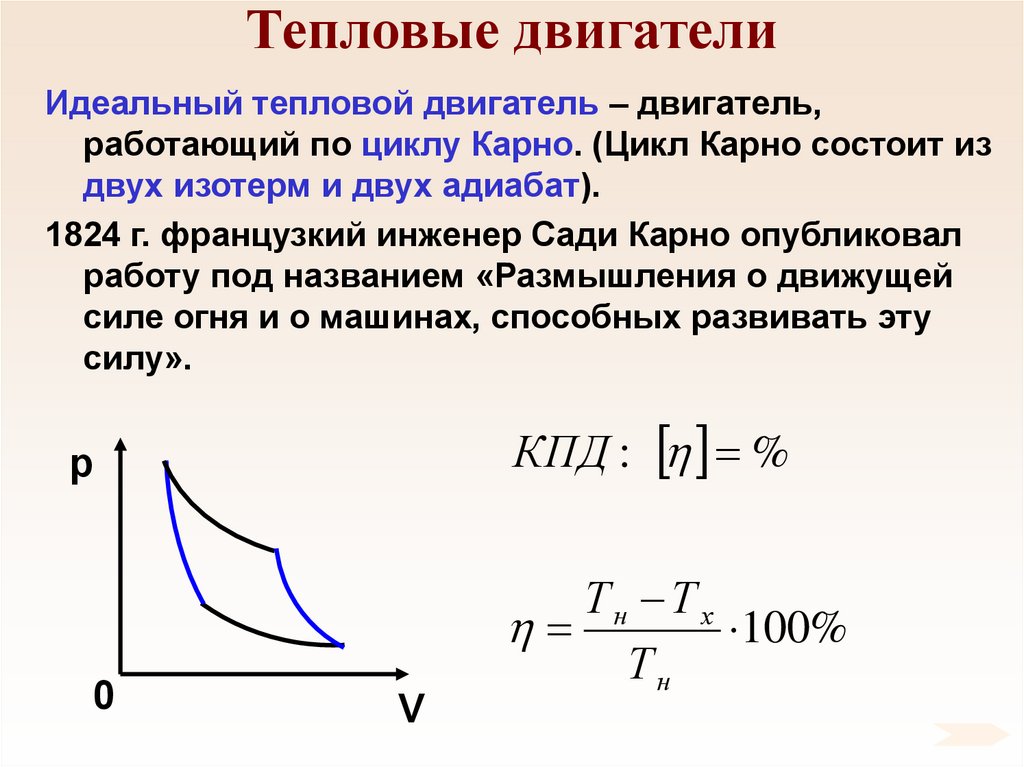
72. Тепловые двигатели
Идеальный тепловой двигатель – двигатель,работающий по циклу Карно. (Цикл Карно состоит из
двух изотерм и двух адиабат).
1824 г. французкий инженер Сади Карно опубликовал
работу под названием «Размышления о движущей
силе огня и о машинах, способных развивать эту
силу».
КПД : %
p
0
V
Тн Т х
100%
Тн
73.
Отрицательные последствияиспользования тепловых
двигателей:
•Потепление климата
•Загрязнение атмосферы
•Уменьшение кислорода в
атмосфере
Решение проблемы:
•Вместо горючего использовать
сжиженный газ.
•Бензин заменить водородом.
•Электромобили.
•Дизели.
•На тепловых электростанциях
использовать скрубберы, в
которых сера связывается с
известью.
•Сжигание угля в кипящем слое.
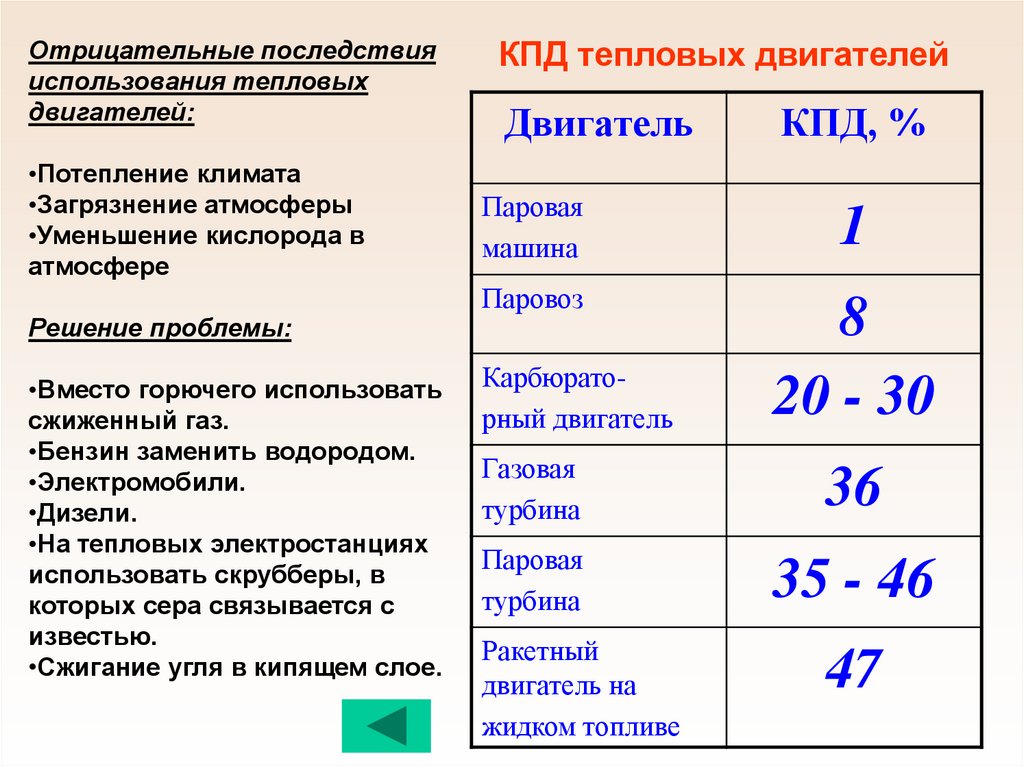
КПД тепловых двигателей
Двигатель
КПД, %
Паровая
машина
1
Паровоз
8
20 - 30
Карбюраторный двигатель
Газовая
турбина
36
Паровая
турбина
35 - 46
Ракетный
двигатель на
жидком топливе
47
74. 5.II ЗАКОН ТЕРМОДИНАМИКИ
Не возможно перевести теплоту от более холодной системык более горячей при отсутствии других одновременных
изменений в обеих системах или окружающих телах.
Не возможен круговой процесс, единственным
результатом которого было бы производство работы за
счет охлаждения теплового резервуара.
Не возможен круговой процесс, единственным
результатом которого является передача теплоты от
менее нагретого тела более нагретому.
Тепловые процессы необратимы.
75. ТЕРМОДИНАМИКА И ПРИРОДА
В окружающей нас природе термодинамическиобратимых процессов нет.
Энтропия в термодинамически не обратимых процессах,
протекающих в изолированной системе, возрастает.
По определению А. Эддингтона, возрастание энтропии,
определяющей необратимые процессы есть «стрела
времени»:чем выше энтропия системы, тем больше
временной промежуток прошла система в своей эволюции.
Возрастание энтропии вселенной должно привести к тому,
что температура всех тел сравняется т. е. наступит
тепловое равновесие и все процессы прекратятся, наступит
«тепловая смерть Вселенной». (Выводы второго закона
термодинамики не всегда имеют место в природе и его
нельзя применить ко всем существующим процессам).
























































 Физика
Физика








