Похожие презентации:
Основные понятия химии. Строение атомов химических элементов и природа химической связи
1. Основные понятия химии. Строение атомов химических элементов и природа химической связи
ГБПОУ ЛО «Центр непрерывного профессионального медицинскогоразвития Ленинградской области»
Лекция 1 (1часть)
Основные понятия химии. Строение
атомов химических элементов и
природа химической связи
Преподаватель: Видерникова Е.А.
2. Виды занятий и подготовка: 69 занятий
Структура ОД.12 ХимияВиды занятий и подготовка: 69 занятий
• Лекции – 66 ч.: 1 семестр = 18 лекций, 2 семестр = 15 лекций.
• Лабораторно-практические занятия (ЛПЗ) – 64 ч.: 1 семестр = 12
ЛПЗ, 2 семестр = 20 ЛПЗ.
• Итоговые занятия (контрольные работы) – 4 занятия.
• Инструкции, вопросы и задания для подготовки к ЛПЗ, итоговым
занятиям, презентации лекций берем у преподавателя (кабинет
№42).
ВИДЕРНИКОВА Елена Александровна
Самостоятельная работа обучающихся: поиск информации и
подготовка отдельных вопросов по теме занятия, составление
таблиц, рисунков, выполнение учебно-исследовательской работы
(УИРС) в виде рефератов и докладов по различным темам курса.
• Подготовка к научно-исследовательской конференции «Моя
будущая профессия» (декабрь 2025 – февраль 2026 гг.)
3. Промежуточный контроль:
Структура ОД.12 ХимияПромежуточный контроль:
За 1 и 2 семестры выставляется текущая семестровая оценка в журнал.
Изучение дисциплины заканчивается ЭКЗАМЕНОМ.
Проходит в 2 этапа: I – компьютерное тестирование;
II - письменная контрольная работа по индивидуальным
вариантам, включающим 5 типов заданий:
1.
2.
3.
4.
5.
Характеристика хим.элемента по его положению в ПСХЭМ.
Характеристика свойств простого вещества или представителя определенного
класса неорганических соединений.
Характеристика свойств представителя определенного класса органических
соединений.
Расчетная задача.
Вопрос профессионально-ориентированного содержания.
• Допуском к сдаче экзамена являются:
- отсутствие пропусков занятий по неуважительным причинам;
- наличие положительных оценок по текущим контрольным работам и тестам в
течении семестров (с учетом отработок);
положительные оценки по всем итоговым занятиям;
Отработки пропущенных занятий (лекций и ЛПЗ),
неудовлетворительных оценок строго обязательны !!!
4. Литература, рекомендуемая для изучения ОД.12 «Химия»
1. АвторЕрохин, Юрий
Михайлович
Заглавие
Химия для профессий и
специальностей
технического и
естественно-научного
профилей
Издание
3-е изд., перераб. и доп.
Выходные
данные
Москва : Академия,
2017
2. ЭБС - Консультант студента:
https://www.studentlibrary.ru/
5.
Основные понятияхимии
6.
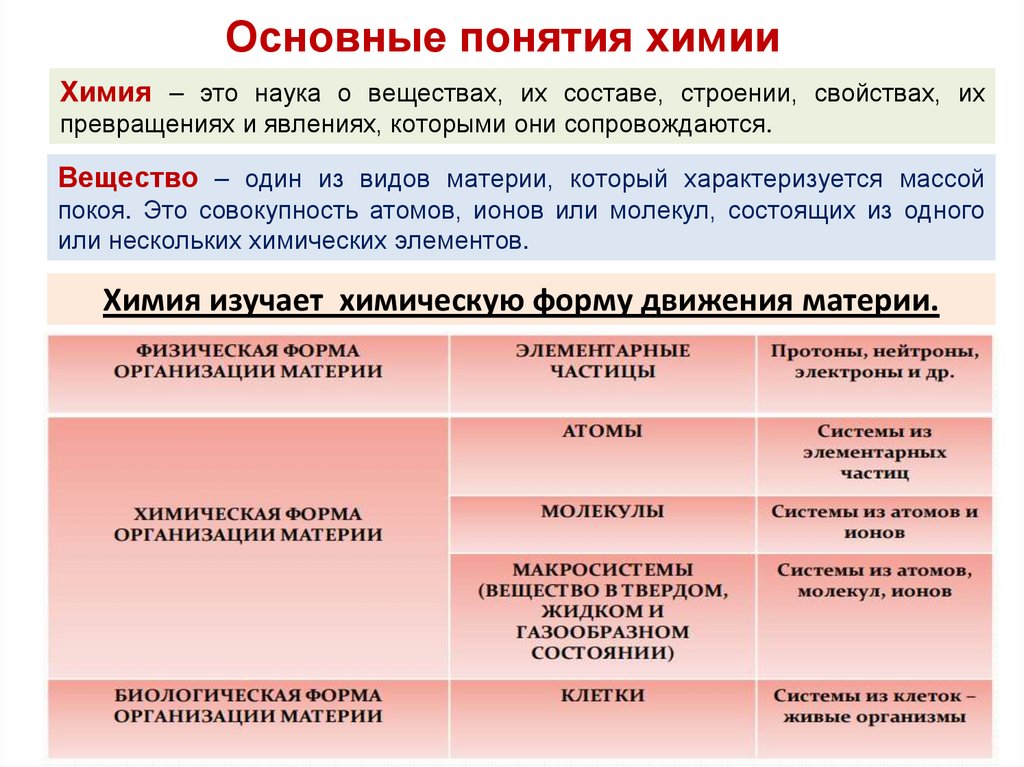
Основные понятия химииХимия – это наука о веществах, их составе, строении, свойствах, их
превращениях и явлениях, которыми они сопровождаются.
Вещество – один из видов материи, который характеризуется массой
покоя. Это совокупность атомов, ионов или молекул, состоящих из одного
или нескольких химических элементов.
Химия изучает химическую форму движения материи.
Объектом изучения химии являются вещества, из которых состоит
окружающий нас мир, а также различные процессы, происходящие на
макроскопическом уровне, такие, как образование осадков, выделение
газов, тепловые эффекты различных процессов и т.д.
Предмет химии - явления, происходящие на микроскопическом уровне с
участием атомов, молекул, ионов и других микроскопических частиц.
7. Роль химии в развитии медицинской науки и практического здравоохранения
Химия имеет две основные задачи:Первая задача — это умение
различать вещества по их
физическим и химическим
свойствам, а также по
физиологическому действию
на живой организм
Вторая задача – получение
различных веществ, которых в
природе нет.
К ним относятся полимеры, некоторые
минеральные удобрения,
лекарственные соединения и пр.
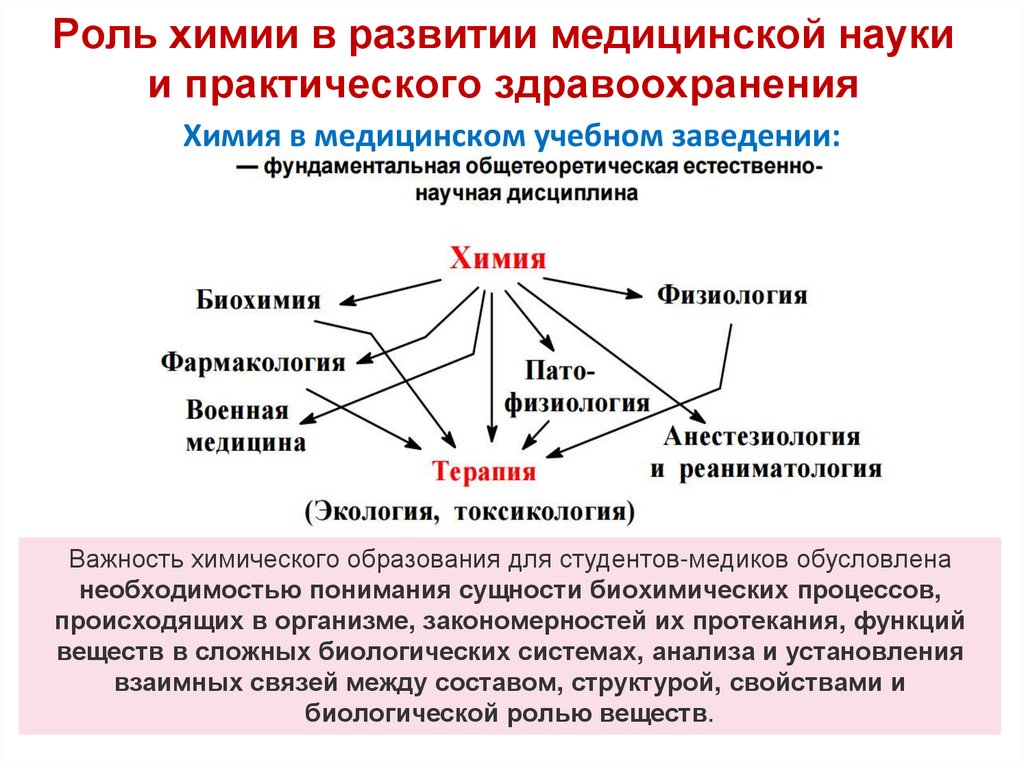
8. Роль химии в развитии медицинской науки и практического здравоохранения
Химия в медицинском учебном заведении:Важность химического образования для студентов-медиков обусловлена
необходимостью понимания сущности биохимических процессов,
происходящих в организме, закономерностей их протекания, функций
веществ в сложных биологических системах, анализа и установления
взаимных связей между составом, структурой, свойствами и
биологической ролью веществ.
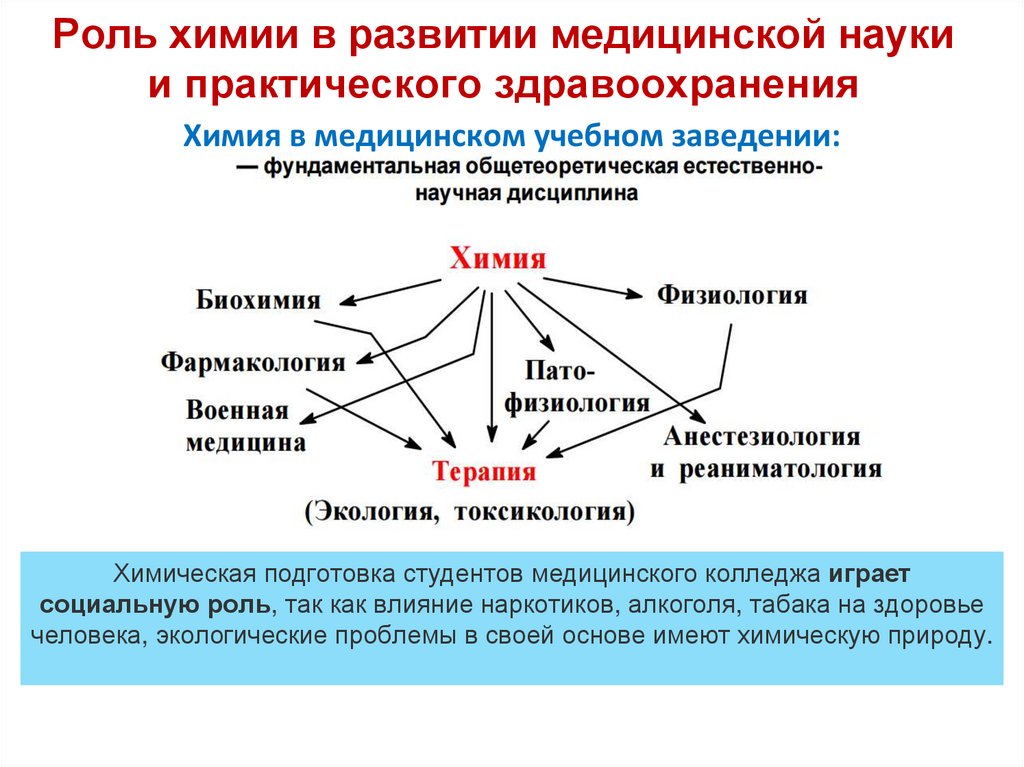
9. Роль химии в развитии медицинской науки и практического здравоохранения
Химия в медицинском учебном заведении:Химическая подготовка студентов медицинского колледжа играет
социальную роль, так как влияние наркотиков, алкоголя, табака на здоровье
человека, экологические проблемы в своей основе имеют химическую природу.
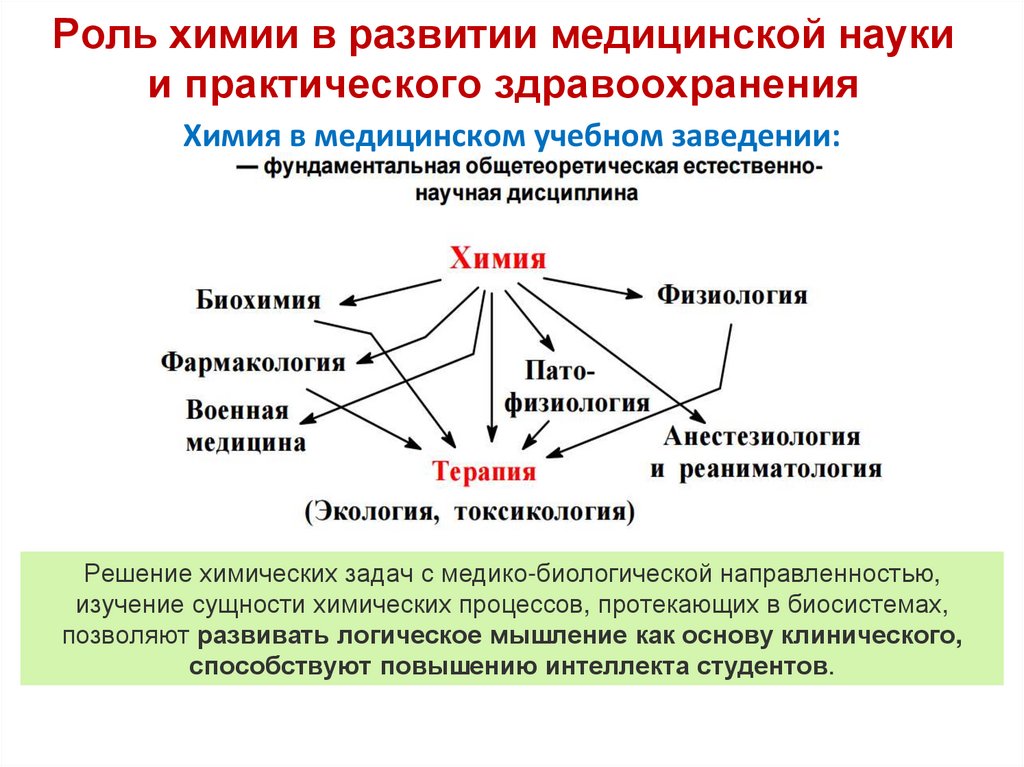
10. Роль химии в развитии медицинской науки и практического здравоохранения
Химия в медицинском учебном заведении:Решение химических задач с медико-биологической направленностью,
изучение сущности химических процессов, протекающих в биосистемах,
позволяют развивать логическое мышление как основу клинического,
способствуют повышению интеллекта студентов.
11.
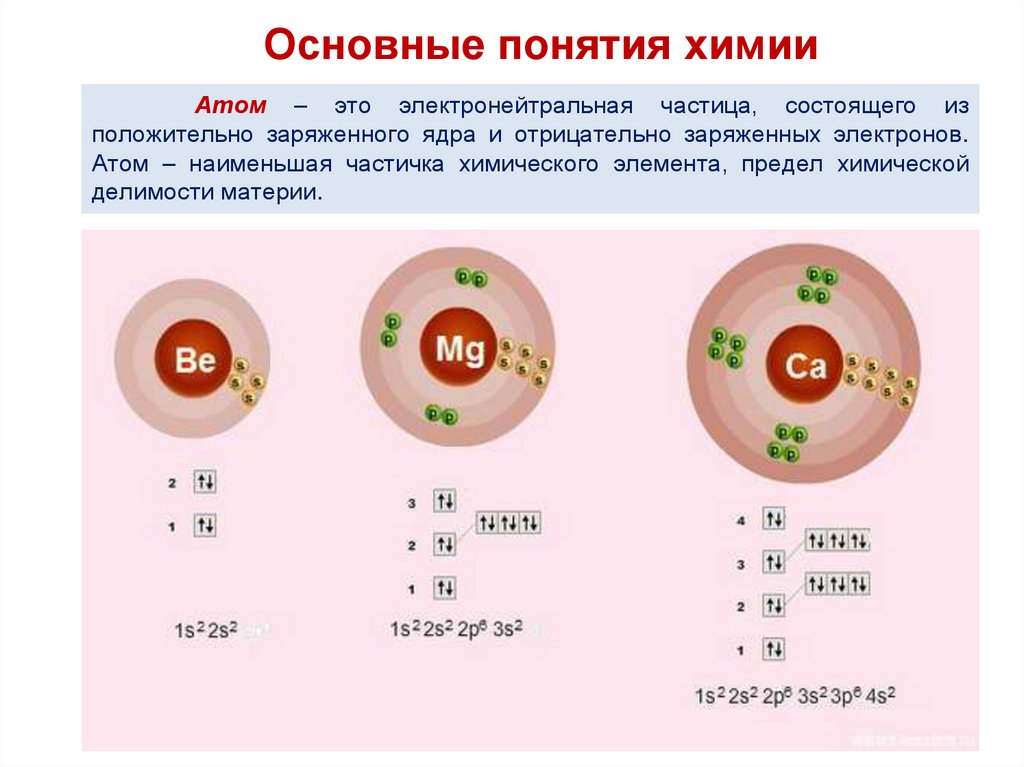
Основные понятия химииАтом – это электронейтральная частица, состоящего из
положительно заряженного ядра и отрицательно заряженных электронов.
Атом – наименьшая частичка химического элемента, предел химической
делимости материи.
12.
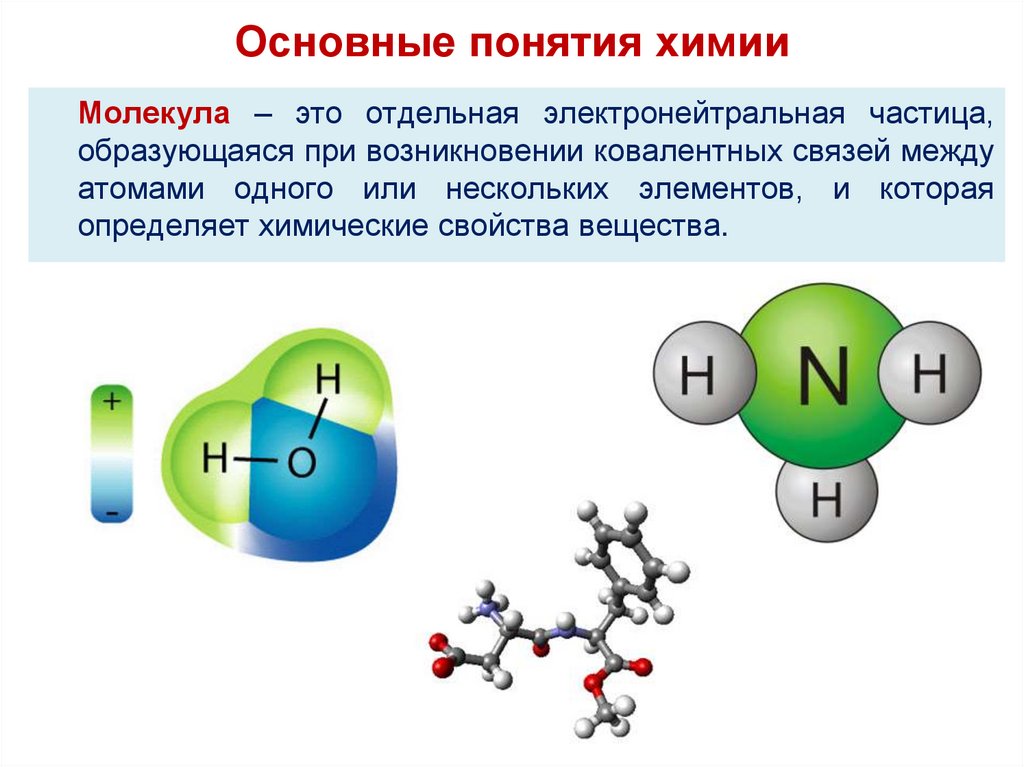
Основные понятия химииМолекула – это отдельная электронейтральная частица,
образующаяся при возникновении ковалентных связей между
атомами одного или нескольких элементов, и которая
определяет химические свойства вещества.
13. Основные положения атомно-молекулярного учения
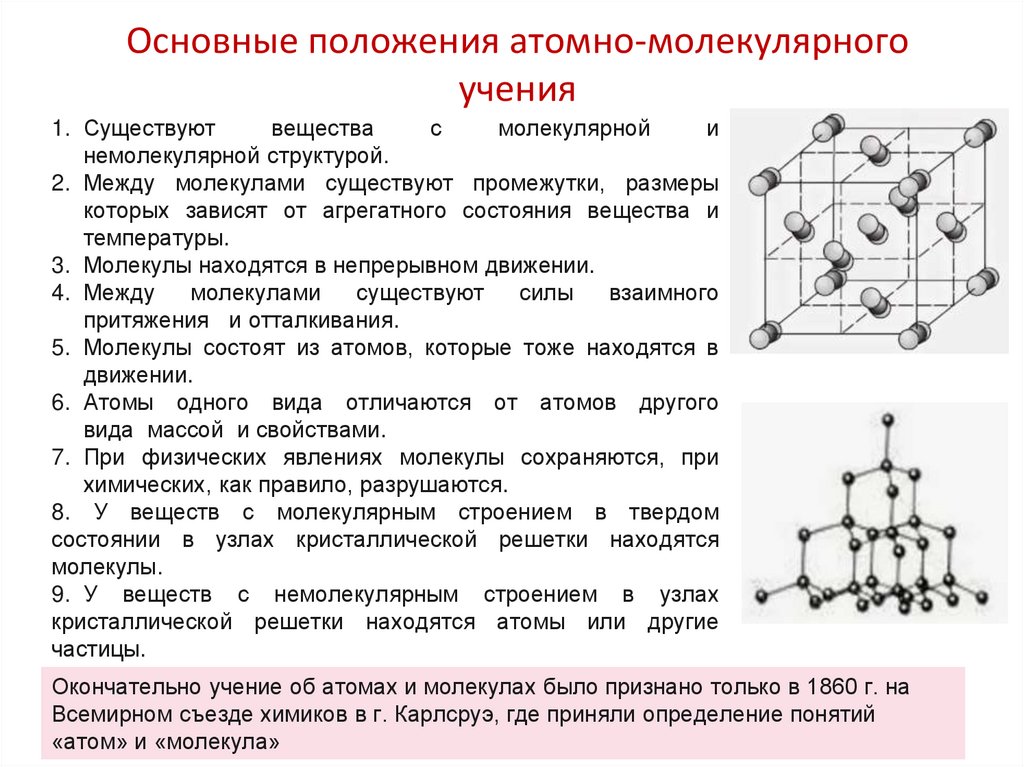
1. Существуютвещества
с
молекулярной
и
немолекулярной структурой.
2. Между молекулами существуют промежутки, размеры
которых зависят от агрегатного состояния вещества и
температуры.
3. Молекулы находятся в непрерывном движении.
4. Между
молекулами
существуют
силы
взаимного
притяжения и отталкивания.
5. Молекулы состоят из атомов, которые тоже находятся в
движении.
6. Атомы одного вида отличаются от атомов другого
вида массой и свойствами.
7. При физических явлениях молекулы сохраняются, при
химических, как правило, разрушаются.
8. У веществ с молекулярным строением в твердом
состоянии в узлах кристаллической решетки находятся
молекулы.
9. У веществ с немолекулярным строением в узлах
кристаллической решетки находятся атомы или другие
частицы.
Окончательно учение об атомах и молекулах было признано только в 1860 г. на
Всемирном съезде химиков в г. Карлсруэ, где приняли определение понятий
«атом» и «молекула»
14.
Химический элемент – это совокупность атомов с одинаковымзарядом ядра.
Например: сера S, углерод C, кальций Са, цинк Zn, железо Fe
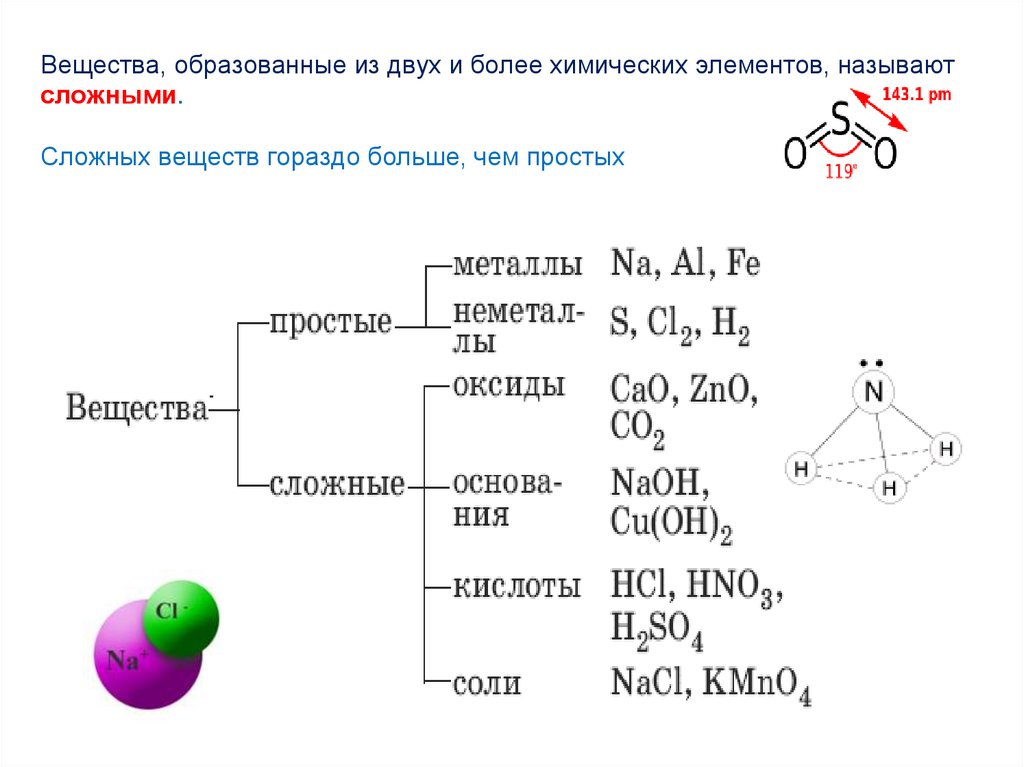
Вещества, образованные одним химическим элементом, называют
простыми.
15.
Вещества, образованные из двух и более химических элементов, называютсложными.
Сложных веществ гораздо больше, чем простых
16.
Различают в качественный и количественныйсостав веществ.
Качественный состав – это совокупность
химических элементов и (или) атомных группировок,
составляющих данное химическое вещество.
Количественный состав – это показатели,
характеризующие количество или число атомов того
или иного химического элемента и (или) атомных
группировок,
образующих
данное
химическое
вещество.
17.
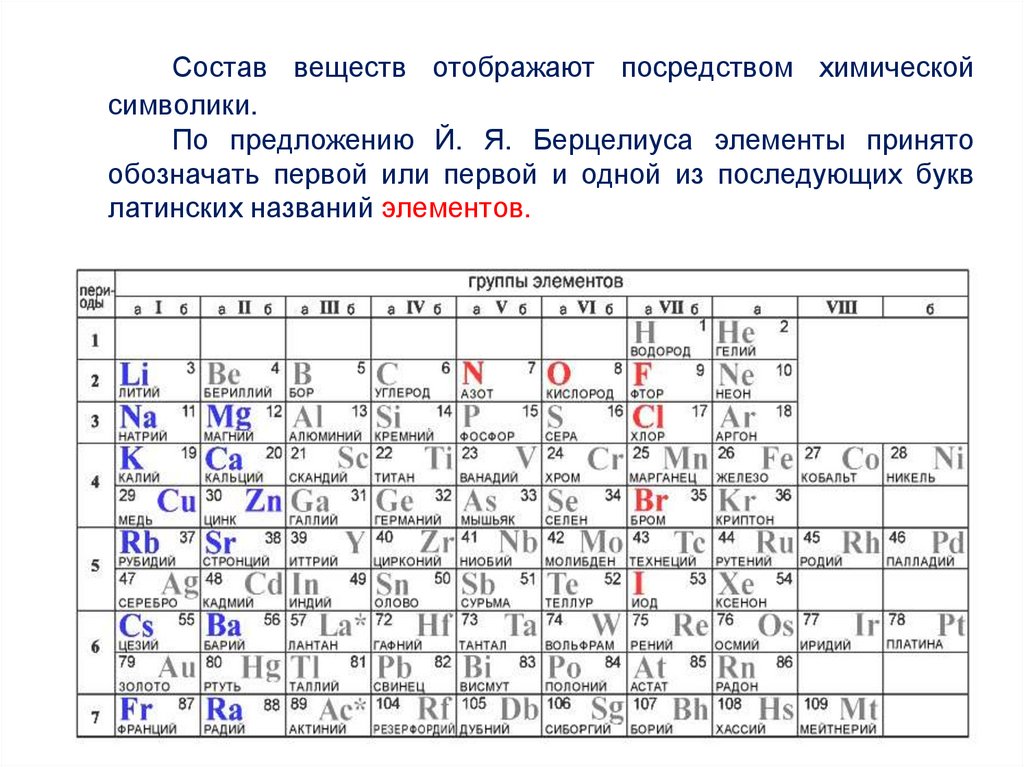
Состав веществ отображают посредством химическойсимволики.
По предложению Й. Я. Берцелиуса элементы принято
обозначать первой или первой и одной из последующих букв
латинских названий элементов.
18.
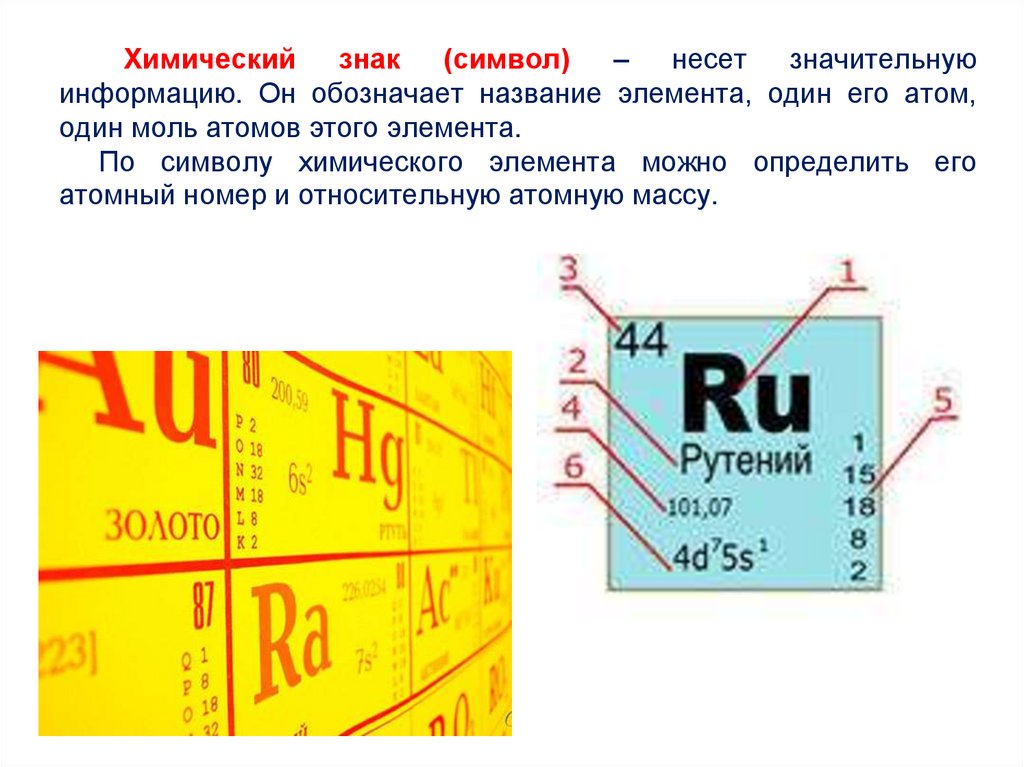
Химический знак(символ)
– несет значительную
информацию. Он обозначает название элемента, один его атом,
один моль атомов этого элемента.
По символу химического элемента можно определить его
атомный номер и относительную атомную массу.
19.
Химическая формула – это способ отображенияхимического состава вещества. Она обозначает
название вещества, одну молекулу его, один моль этого
вещества.
По
химической
формуле
можно
определить
качественный состав вещества, число атомов и
количество вещества каждого элемента в одном моле
вещества,
его
относительную
молекулярную
и
молярную массу.
20.
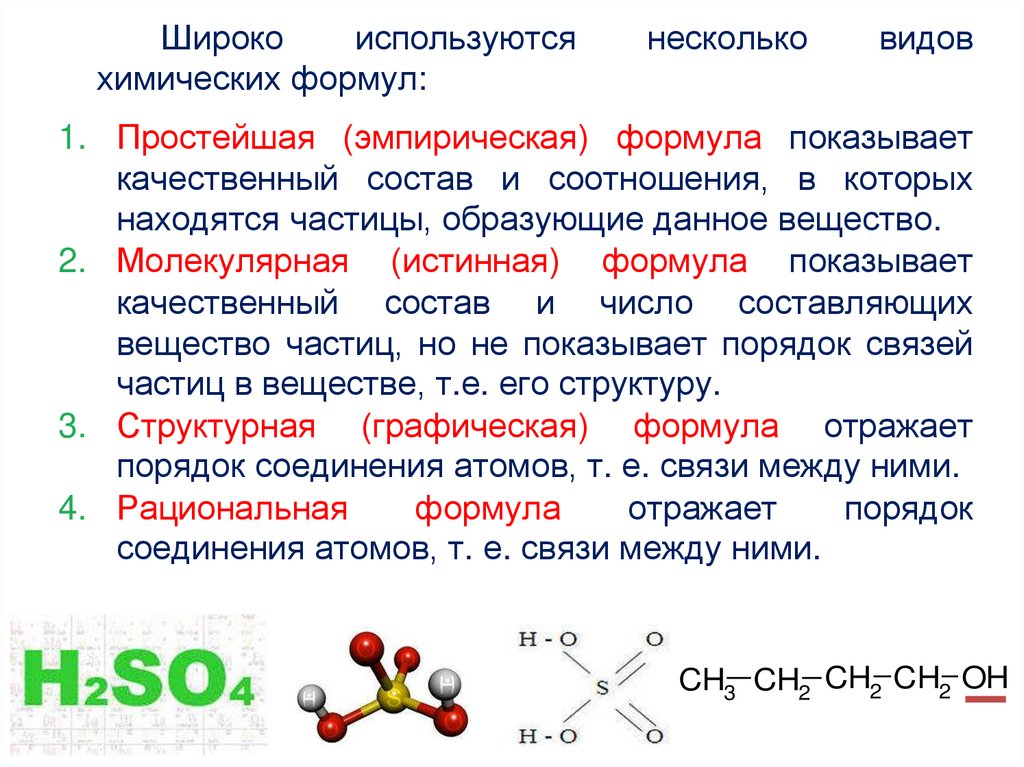
Широкоиспользуются
химических формул:
несколько
видов
1. Простейшая (эмпирическая) формула показывает
качественный состав и соотношения, в которых
находятся частицы, образующие данное вещество.
2. Молекулярная (истинная) формула показывает
качественный состав и число составляющих
вещество частиц, но не показывает порядок связей
частиц в веществе, т.е. его структуру.
3. Структурная (графическая) формула отражает
порядок соединения атомов, т. е. связи между ними.
4. Рациональная
формула
отражает
порядок
соединения атомов, т. е. связи между ними.
CH3 CH2 CH2 CH2 OH
21.
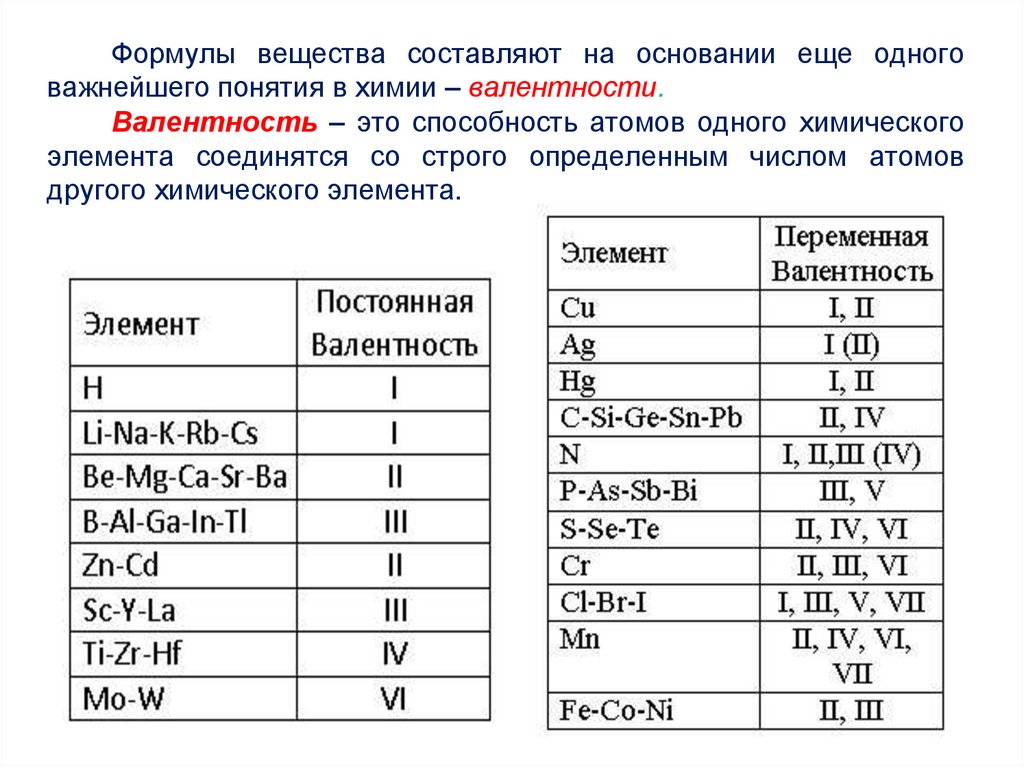
Формулы вещества составляют на основании еще одноговажнейшего понятия в химии – валентности.
Валентность – это способность атомов одного химического
элемента соединятся со строго определенным числом атомов
другого химического элемента.
22.
Строение атома.Состав атомного ядра.
23. Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад.
Исторический экскурсГипотеза о том, что вещества состоят из большого
числа атомов, зародилась свыше двух тысячелетий
назад.
Позиция Демокрита:
«Существует предел деления –
атом».
Позиция Аристотеля:
«Делимость вещества
бесконечна».
24. Исторический экскурс
Конкретные представления о строении атомаразвивались по мере накопления физикой фактов
о свойствах вещества.
1897 г Дж. Дж. Томсон доказал существование электрона,
измерил его заряд и массу.
1897 г - В. Вебер впервые высказал мысль об электронном
строении атома ( электроны входят в состав атома).
1905 г - Ф. Линдеман утверждал, что атом кислорода имеет
форму кольца, а атом серы - форму лепешки.
1903-1904 гг - Дж. Дж. Томсон предложил модель атома в виде
положительно заряженного шара, в котором
«плавают»
электроны.
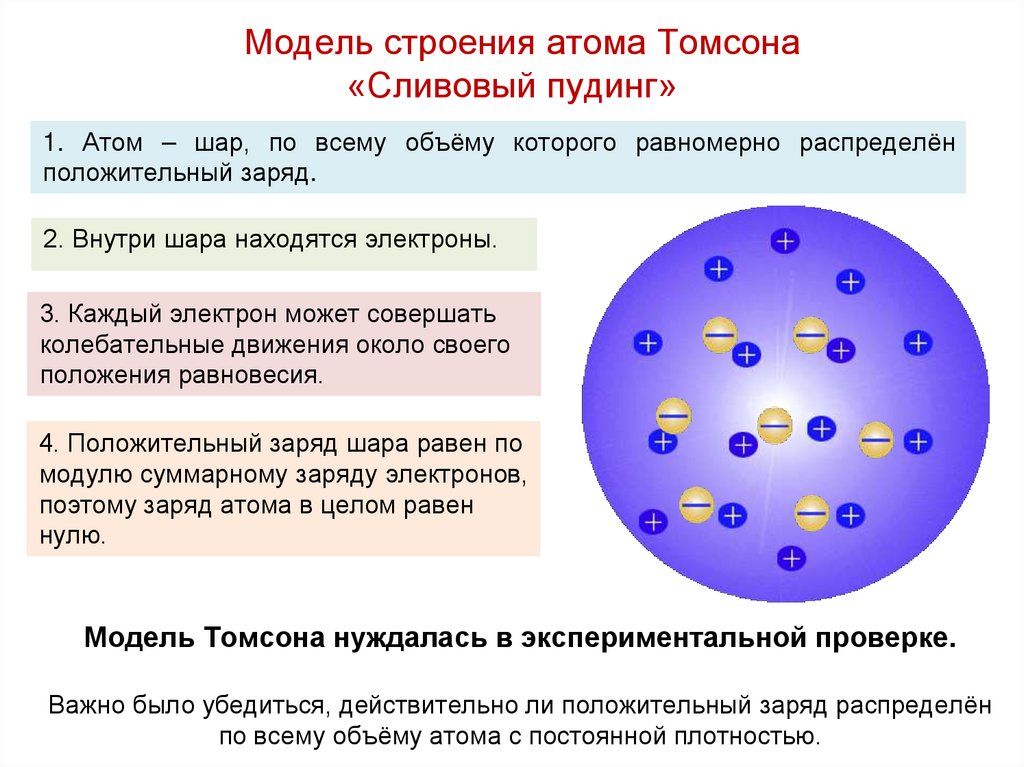
25. Модель строения атома Томсона «Сливовый пудинг»
1. Атом – шар, по всему объёму которого равномерно распределёнположительный заряд.
2. Внутри шара находятся электроны.
3. Каждый электрон может совершать
колебательные движения около своего
положения равновесия.
4. Положительный заряд шара равен по
модулю суммарному заряду электронов,
поэтому заряд атома в целом равен
нулю.
Модель Томсона нуждалась в экспериментальной проверке.
Важно было убедиться, действительно ли положительный заряд распределён
по всему объёму атома с постоянной плотностью.
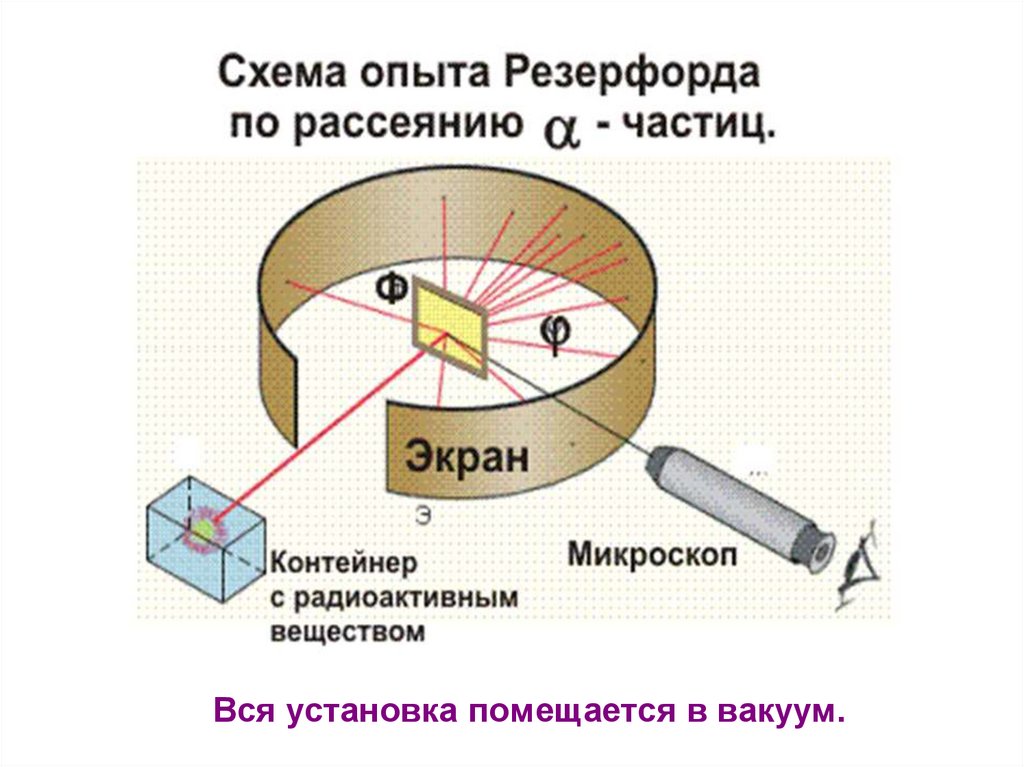
26. Идея опыта Резерфорда:
Модель строения атома Томсона «Сливовыйпудинг»: экспериментальная проверка
В 1909г. Эрнест Резерфорд совместно со своими сотрудниками Г. Гейгером
и Э. Марсденом провёл ряд опытов по исследованию состава и строения
атомов.
Идея опыта Резерфорда:
1. Зондировать атом альфа –частицами.
2. Альфа-частицы возникают при распаде
радия.
3. Масса альфа-частицы в 8000 раз
больше массы электрона.
4. Электрический заряд альфа-частицы в
2 раза больше заряда электрона.
5. Скорость альфа-частицы около 15 000
км/с.
6. Альфа-частица является ядром атома
гелия.
27.
Вся установка помещается в вакуум.28.
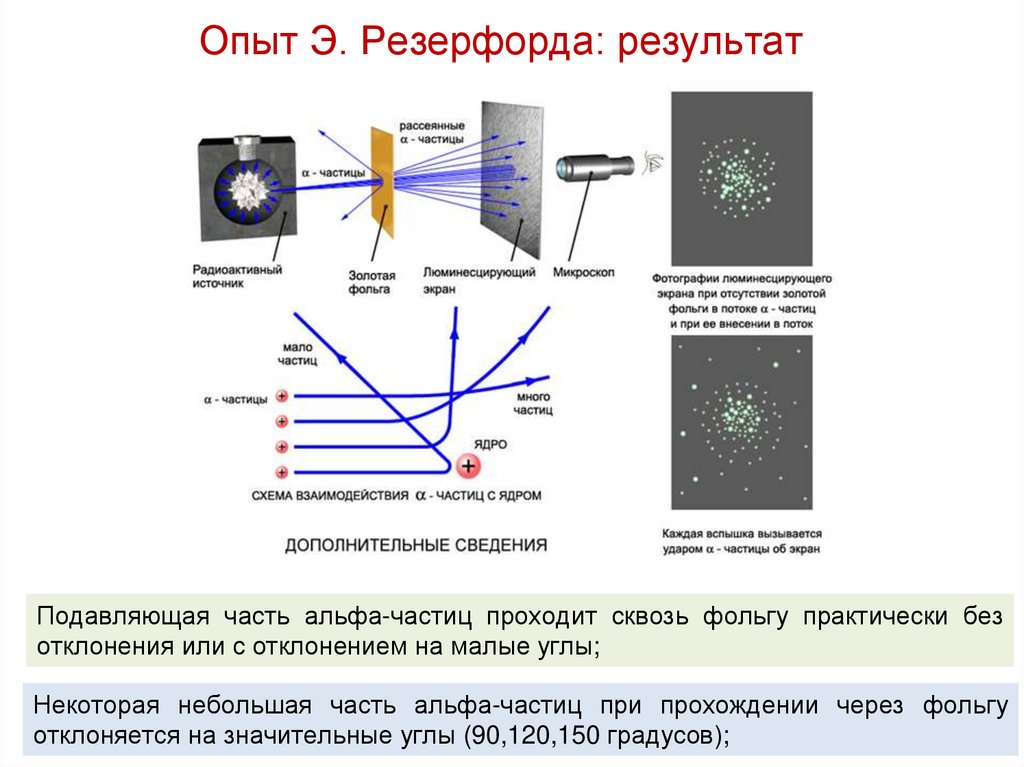
Опыт Э. Резерфорда: результатПодавляющая часть альфа-частиц проходит сквозь фольгу практически без
отклонения или с отклонением на малые углы;
Некоторая небольшая часть альфа-частиц при прохождении через фольгу
отклоняется на значительные углы (90,120,150 градусов);
29.
Опыт Э. Резерфорда: результатПочему некоторые α-частицы отклонялись на
большие углы, до 180º?
Резерфорд понял, что такое отклонение возможно лишь
при встрече с положительно заряженной частицей
большой массы.
Малая вероятность отклонения на большие углы
говорила о том, что эта положительная частица имеет
малые размеры, порядка ~10–14 м.
Электроны, по Резерфорду, движутся вокруг ядра.
Оказалось, что радиус ядра зависит от числа нуклонов в
ядре.
30.
На основе выводов из опытов Э. Резерфордомбыла предложена планетарная модель атома
Конец ХIХ - начало ХХ века
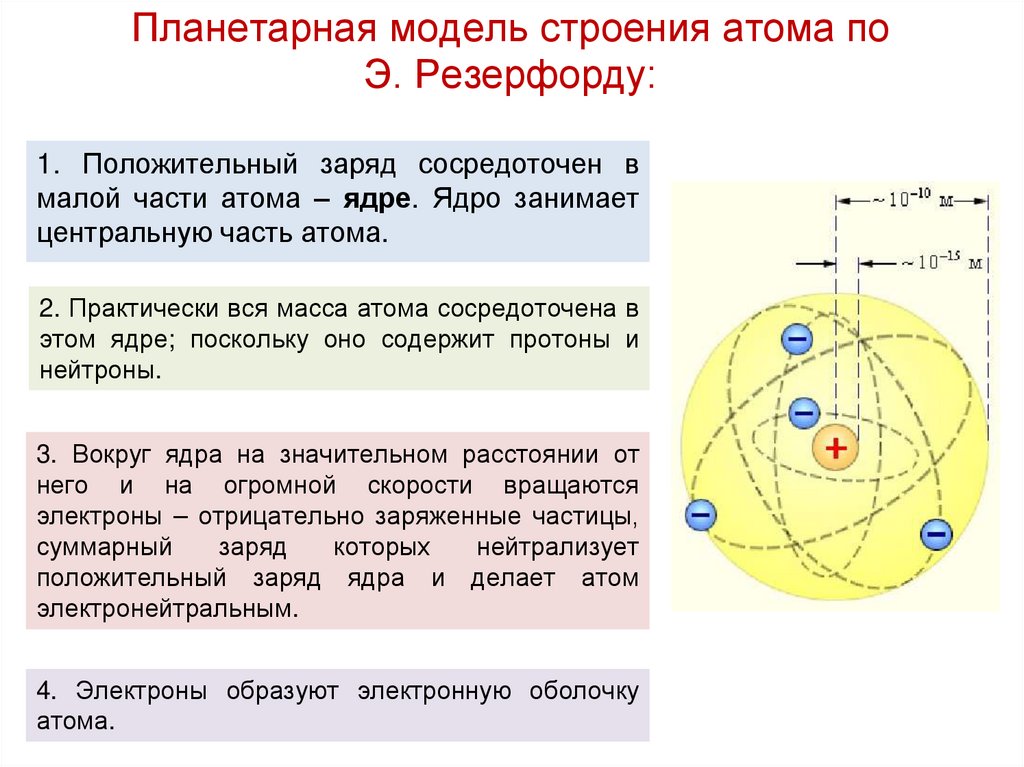
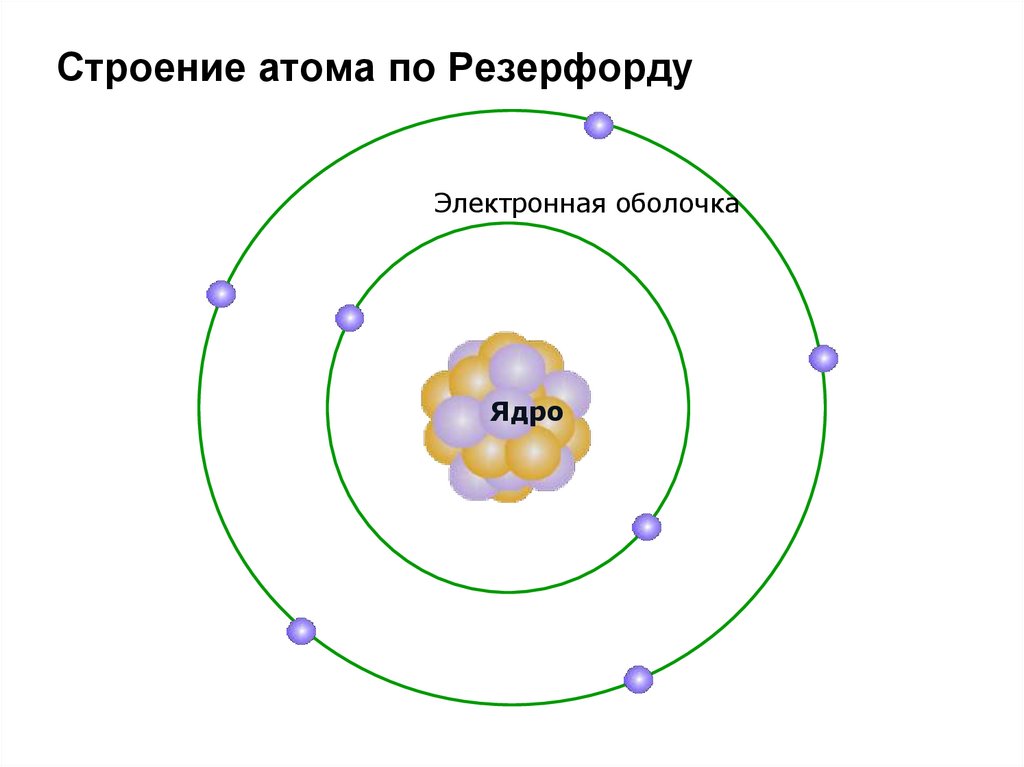
31. Планетарная модель строения атома по Э. Резерфорду:
1. Положительный заряд сосредоточен вмалой части атома – ядре. Ядро занимает
центральную часть атома.
2. Практически вся масса атома сосредоточена в
этом ядре; поскольку оно содержит протоны и
нейтроны.
3. Вокруг ядра на значительном расстоянии от
него и на огромной скорости вращаются
электроны – отрицательно заряженные частицы,
суммарный
заряд
которых
нейтрализует
положительный заряд ядра и делает атом
электронейтральным.
4. Электроны образуют электронную оболочку
атома.
32.
Строение атома по РезерфордуЭлектронная оболочка
Ядро
33.
Недостатки модели атома Э. Резерфорда1. Эта модель не согласуется с наблюдаемой стабильностью
атомов. По законам классической электродинамики вращающийся
вокруг
ядра
электрон
должен
непрерывно
излучать
электромагнитные волны, а поэтому терять свою энергию. В
результате электроны будут приближаться к ядру и в конце концов
упадут на него.
2. Эта модель не объясняет наблюдаемые на опыте оптические
спектры атомов. Оптические спектры атомов не непрерывны, как это
следует из теории Резерфорда, а состоят из узких спектральных
линий, т.е. атомы излучают и поглощают электромагнитные волны
лишь определенных частот, характерных для данного химического
элемента.
К явлениям атомных масштабов законы классической физики
неприменимы.
34.
Попыткой спасенияпланетарной
модели атома стали
постулаты
Нильса Бора
35. Постулаты Н. Бора
1-й постулат. Электроны вращаются вокруг ядране по произвольным, а по строго определенным,
стационарным орбитам.
2-й постулат. При движении по стационарной
орбите электрон не излучает и не поглощает
энергию. Изменение энергии происходит при
переходе электрона с одной стационарной
орбиты на другую.
Но!!! теория Резерфорда–Бора дает
удовлетворительные результаты только для атома
водорода.
36.
Современная квантовая модельстроения атома
1. Электрон имеет двойственную (корпускулярноволновую) природу:
- подобно частице, электрон имеет массу и заряд,
- движущийся электрон обладает свойствами волны.
2. Электрон в атоме не движется по определенной
траектории, а может находиться в любой части
околоядерного пространства.
Область пространства, где вероятнее всего
находится электрон, называется орбиталью.
3. Ядра атомов состоят из протонов и нейтронов,
имеющих общее название – нуклоны.
37. Современные представления о строении атома
1+
Протон (р , p )
1
- Имеет заряд +1
- Масса равна массе атома
водорода
- Количество
протонов
(Z)
в
ядре
равно
порядковому
номеру
элемента в периодической
системе.
38. Электрон (ē)
Современные представления остроении атома
Электрон (ē)
- Имеет заряд -1
- Масса очень мала,
поэтому ее принимают
за 0
- Количество
электронов в атоме
равно количеству
протонов
39. Нейтрон (n0, )
Современные представления остроении атома
1
0
Нейтрон (n , n
0
- Не имеет заряда
- Масса равна массе
атома водорода.
Количество нейтронов (n0)
вычисляется по формуле
n0 = A – Z , где
А – массовое число элемента.
)
40.
Современные представления остроении атома
A = Z + N, где А – массовое число
Z – количество протонов
N – количество нейтронов
16
8
O
p+ = 8
ē=8
n0 = 8
23
11
Na
A
Z
p+ = 11
ē = 11
n0 = 12
Э
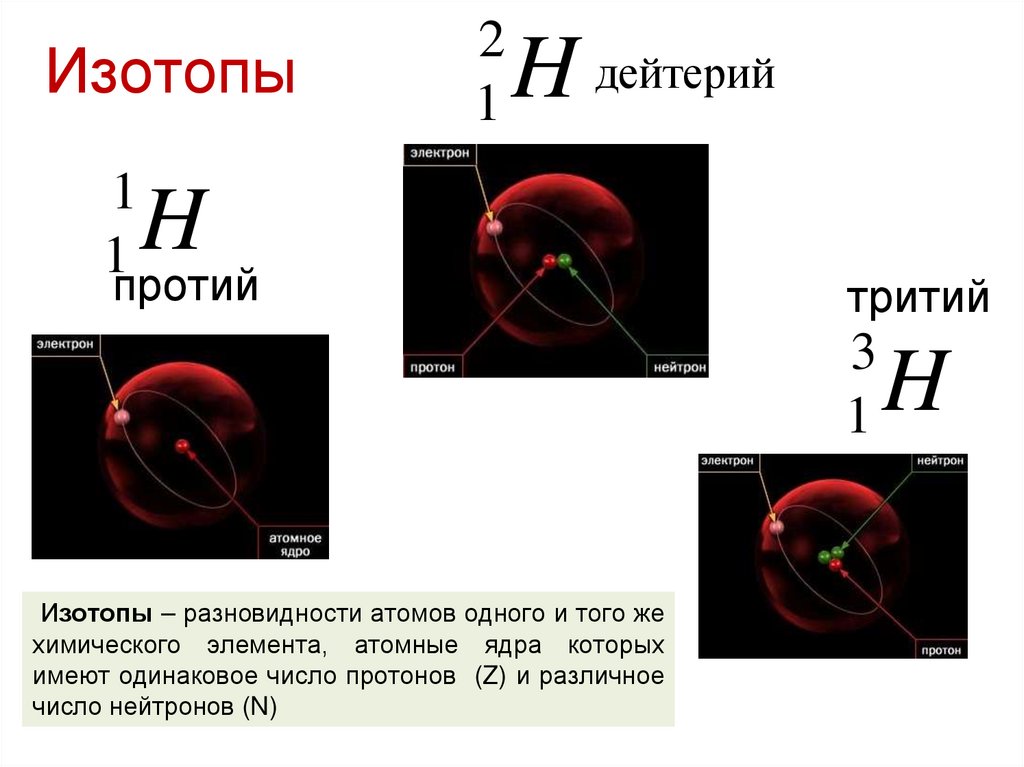
41. Изотопы
11
2
1
H дейтерий
H
протий
тритий
3
1
Изотопы – разновидности атомов одного и того же
химического элемента, атомные ядра которых
имеют одинаковое число протонов (Z) и различное
число нейтронов (N)
H
42.
Строение электронных оболочекатома.
Квантовые числа.
43. Двойственная природа электрона
1. Электрон имеет массу и заряд, как частица.2. Электрон проявляет волновые свойства – способен
к дифракции.
Электрон в атоме можно рассматривать как частицу,
которая при движении проявляет волновые свойства.
Т.е. нельзя описать движение электрона в атоме
определенной траекторией (орбитой).
44. В химических превращениях масса и заряд ядра не меняются, поэтому на них базируется электронная структура атома.
Двойственная природа электронаВ химических превращениях масса и заряд ядра не
меняются,
поэтому
на
них
базируется
электронная
структура атома.
Увеличение заряда ядра z на +1 приводит к увеличению числа еПолучаются новые химические элементы с индивидуальными
свойствами.
Энергия е- различна и зависит от общего числа электронов,
расстояния от центра ядра и других факторов:
Чем ближе расположен е- к ядру, тем прочнее связь и меньше
энергия электрона, его труднее вырвать из электронной оболочки.
На далеко расположенных орбитах энергия е- больше, а связь с ядром
слабее.
45. Электронная оболочка
- это совокупность всех электронов в атоме, окружающихядро.
Каждый электрон имеет свою траекторию движения и
запас энергии.
Электрон в атоме может находиться в любой точке
пространства вокруг ядра, однако вероятность его
пребывания в разных местах атомного пространства
.
различна.
Атомная орбиталь – область вокруг
ядра атома, в которой наиболее вероятно
нахождение электрона.
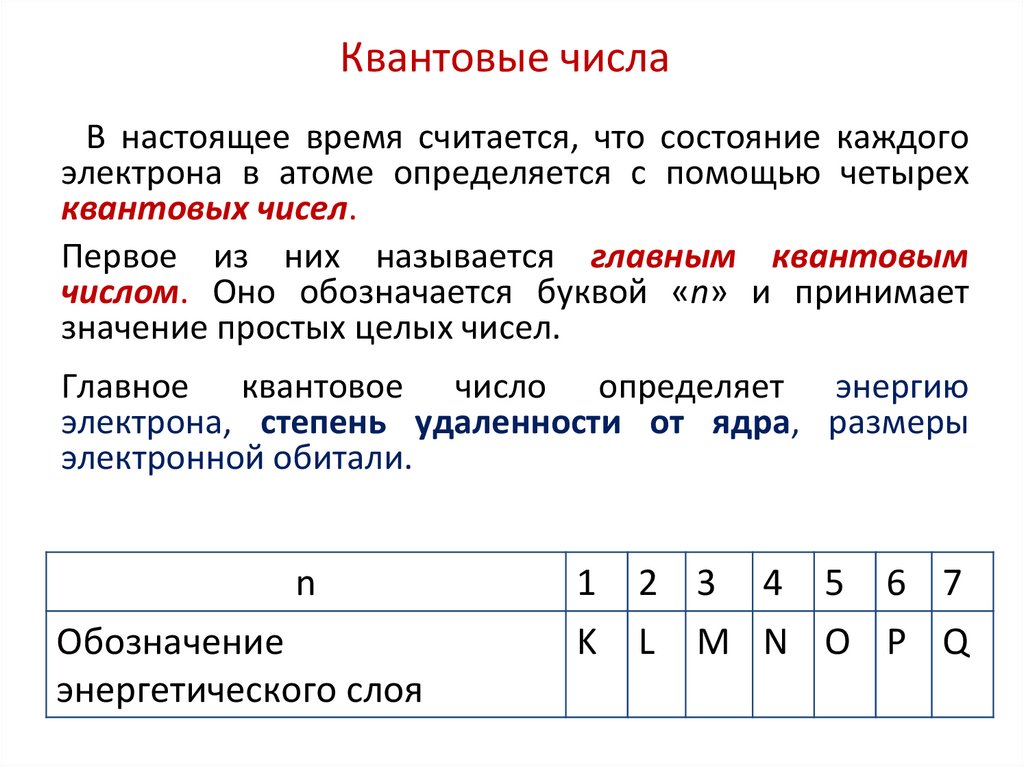
46. Квантовые числа
В настоящее время считается, что состояние каждогоэлектрона в атоме определяется с помощью четырех
квантовых чисел.
Первое из них называется главным квантовым
числом. Оно обозначается буквой «n» и принимает
значение простых целых чисел.
Главное квантовое число определяет энергию
электрона, степень удаленности от ядра, размеры
электронной обитали.
n
Обозначение
энергетического слоя
1
K
2 3 4 5 6 7
L M N O P Q
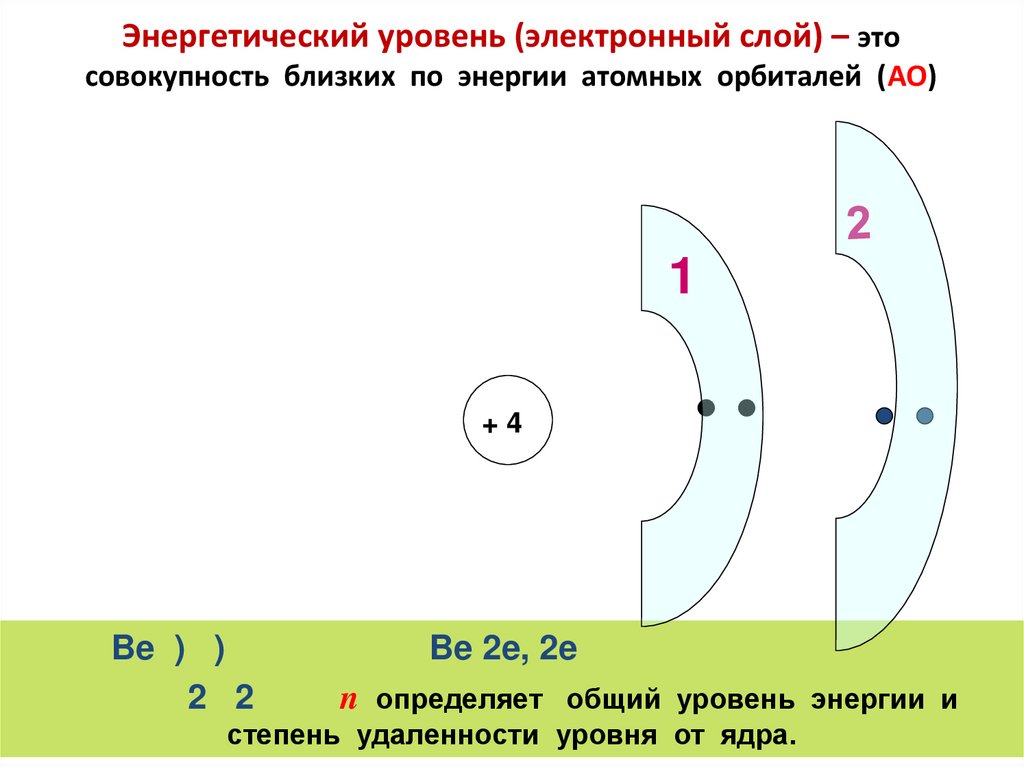
47. Энергетический уровень (электронный слой) – это совокупность близких по энергии атомных орбиталей (АО)
1+4
Be ) )
2 2
Be 2e, 2e
n определяет общий уровень энергии и
степень удаленности уровня от ядра.
48. Число энергетических уровней = номеру периода в ПСХЭМ
Максимальное число электронов на уровне= 2 n2
1 уровень – 2 электрона
2 уровень – 8 электронов
Завершенный
уровень -…
3 уровень – 18 электронов
Энергетические уровни, содержащие максимальное число
электронов, называются завершенными.
Они обладают повышенной устойчивостью и стабильностью.
Энергетические уровни, содержащие
меньшее
электронов, называются незавершенными.
число
49.
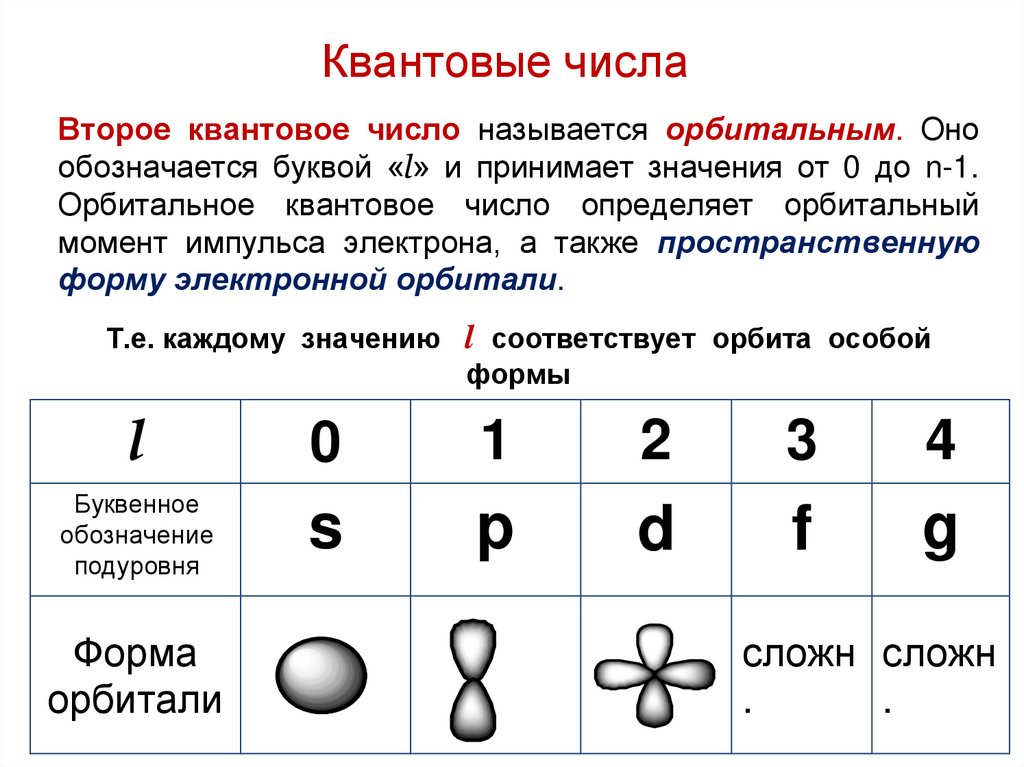
Квантовые числаВторое квантовое число называется орбитальным. Оно
обозначается буквой «l» и принимает значения от 0 до n-1.
Орбитальное квантовое число определяет орбитальный
момент импульса электрона, а также пространственную
форму электронной орбитали.
Т.е. каждому значению l соответствует орбита особой
формы
l
0
1
2
3
4
Буквенное
обозначение
подуровня
s
p
d
f
g
Форма
орбитали
сложн сложн
.
.
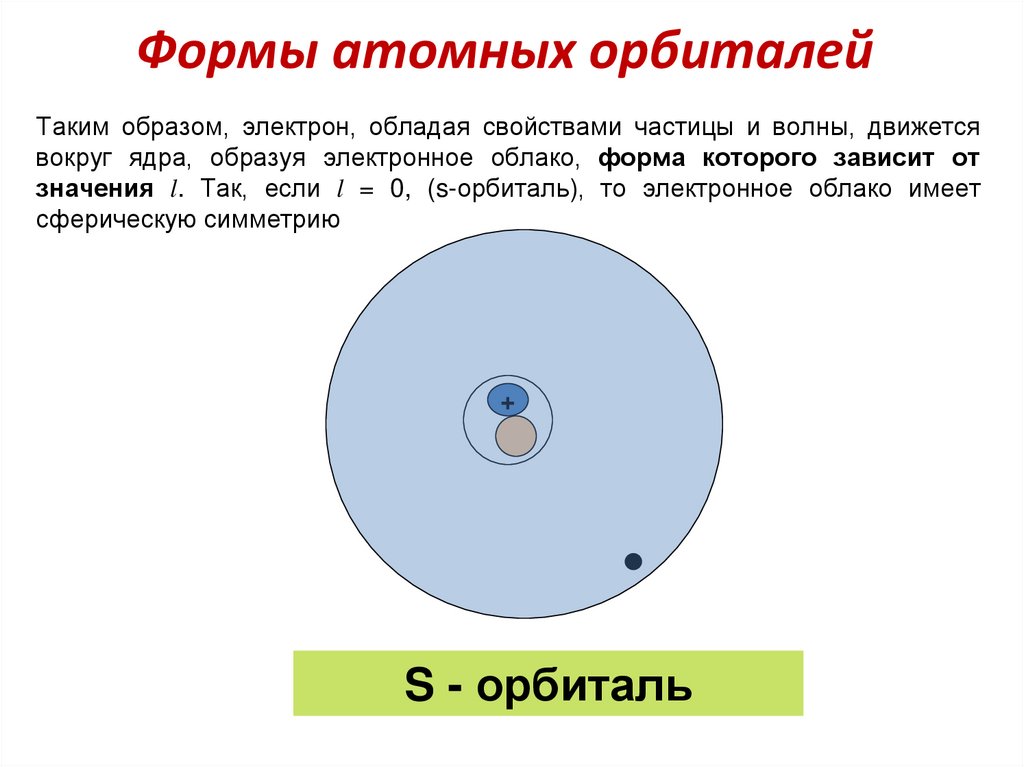
50. Формы атомных орбиталей
Таким образом, электрон, обладая свойствами частицы и волны, движетсявокруг ядра, образуя электронное облако, форма которого зависит от
значения l. Так, если l = 0, (s-орбиталь), то электронное облако имеет
сферическую симметрию
+
S - орбиталь
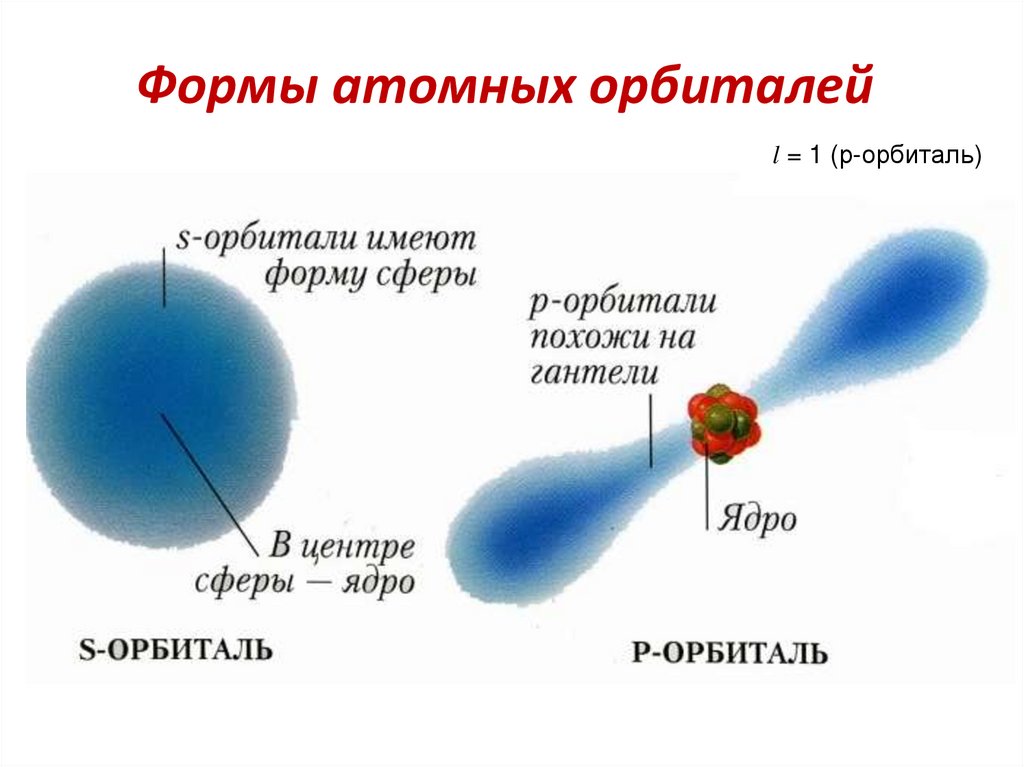
51. Формы атомных орбиталей
l = 1 (р-орбиталь)52.
Формы атомных орбиталей53.
Орбитальное квантовое числоl
54.
Квантовые числаЭнергетический подуровень – это совокупность
электронных
состояний,
характеризующихся
определенным набором квантовых чисел n и l.
Число подуровней, на которые расщепляется
энергетический уровень равно номеру уровня.
Обозначение
подуровня
n
l
1
2
0 (одно значение)
0;1 (два значения)
1s (один подуровень)
2s; 2р (два подуровня)
3
0;1;2 (три значения)
3s; 3р; 3d
(три подуровня)
55.
Количество орбиталей на уровнях равнономеру уровня.
1 уровень – S - орбиталь
2 уровень – S, P - орбитали
56.
Квантовые числаМагнитное квантовое число ml определяет значения
проекции орбитального момента на одной из осей, а также
пространственную ориентацию элементарных орбиталей и их
максимальное число на электронном подуровне.
Оно принимает все целочисленные значения от – l до + l.
Например, при l =0 ml = 0;
при l =1 ml = -1; 0 ; +1;
при l =2 ml = -2; -1; 0 ; +1; +2;
Любому значению l соответствует (2l+1) возможных
расположений электронного облака данного типа в
пространстве.
57. Квантовые числа
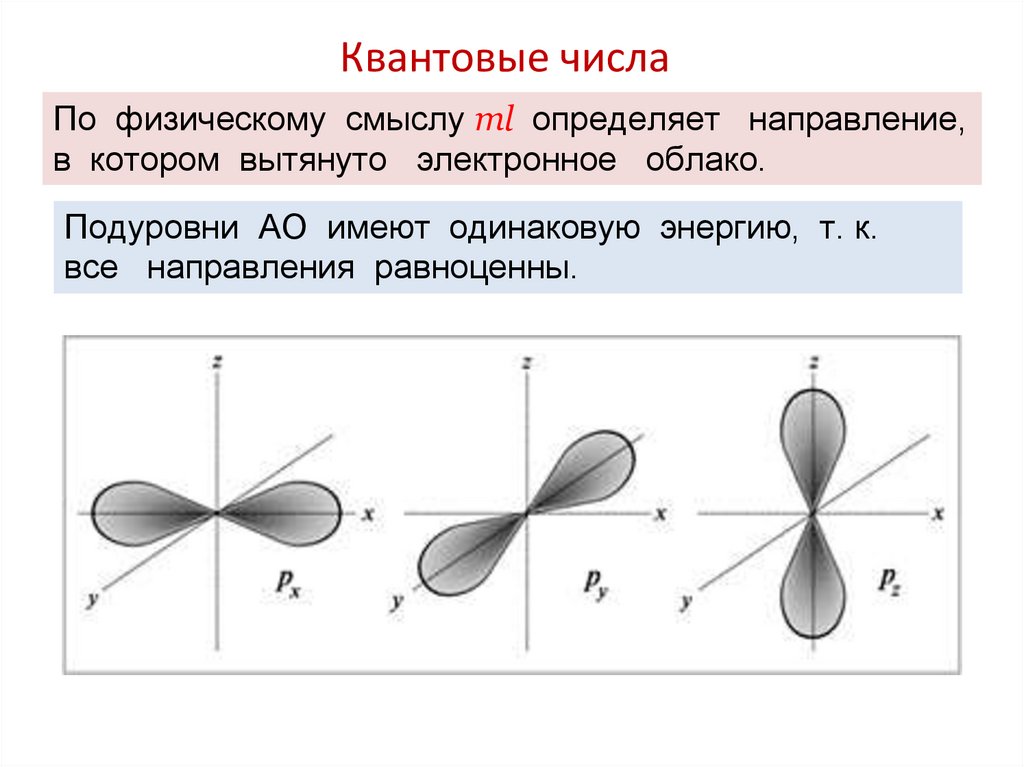
По физическому смыслу ml определяет направление,в котором вытянуто электронное облако.
Подуровни АО имеют одинаковую энергию, т. к.
все направления равноценны.
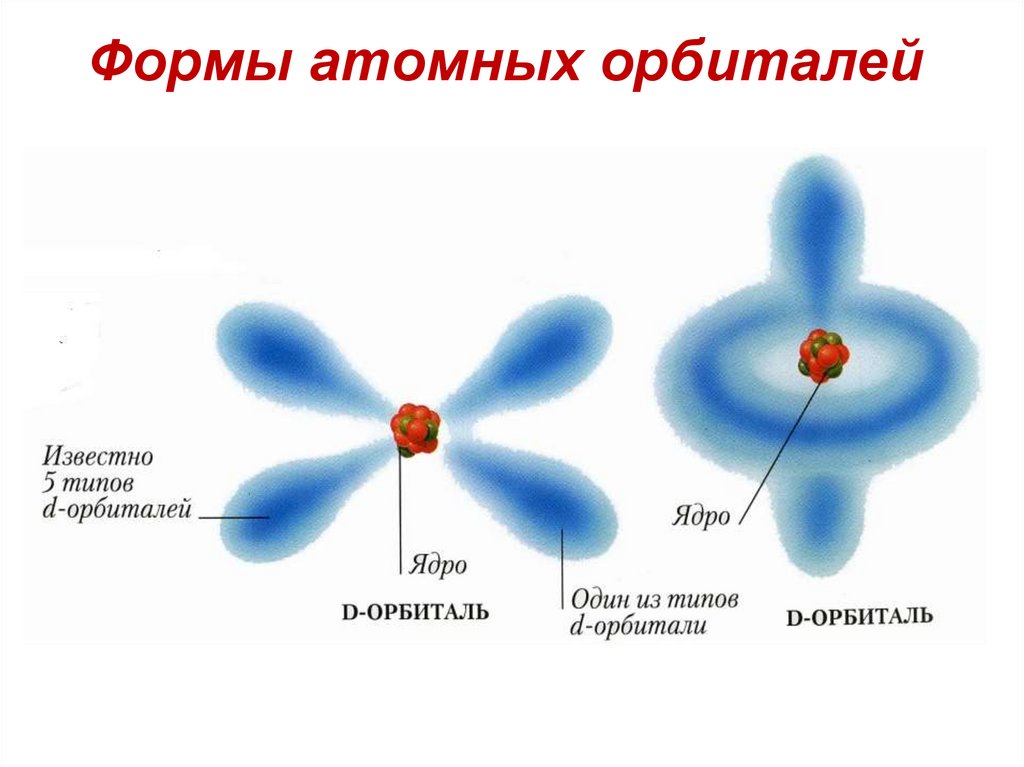
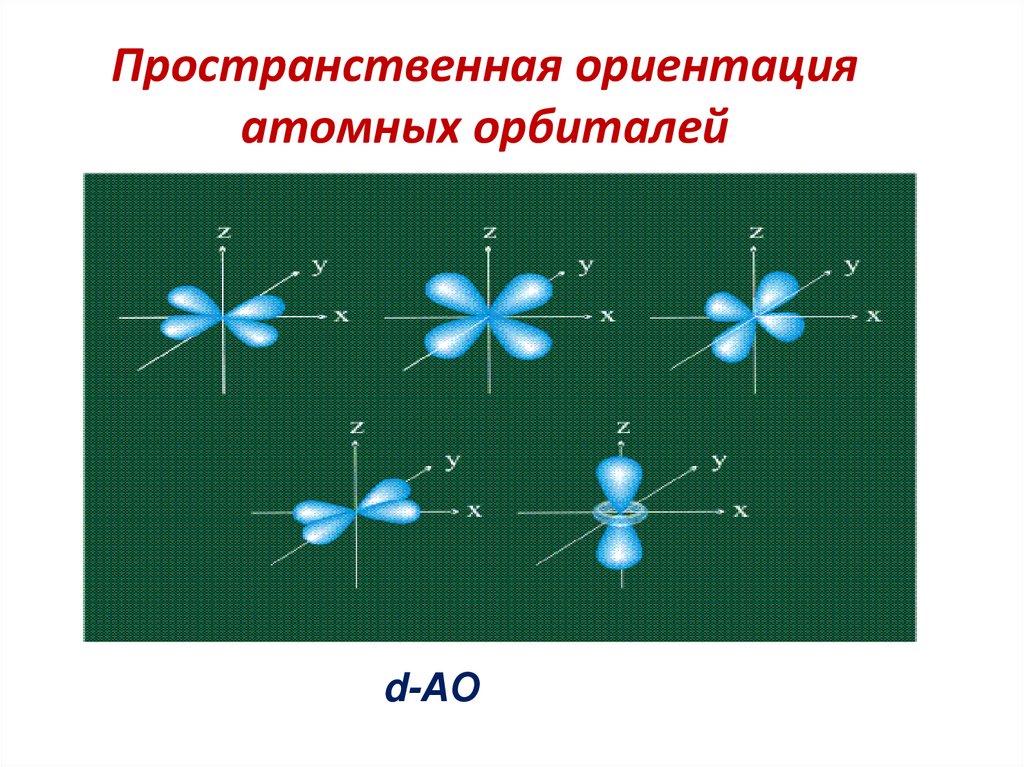
58. Пространственная ориентация атомных орбиталей
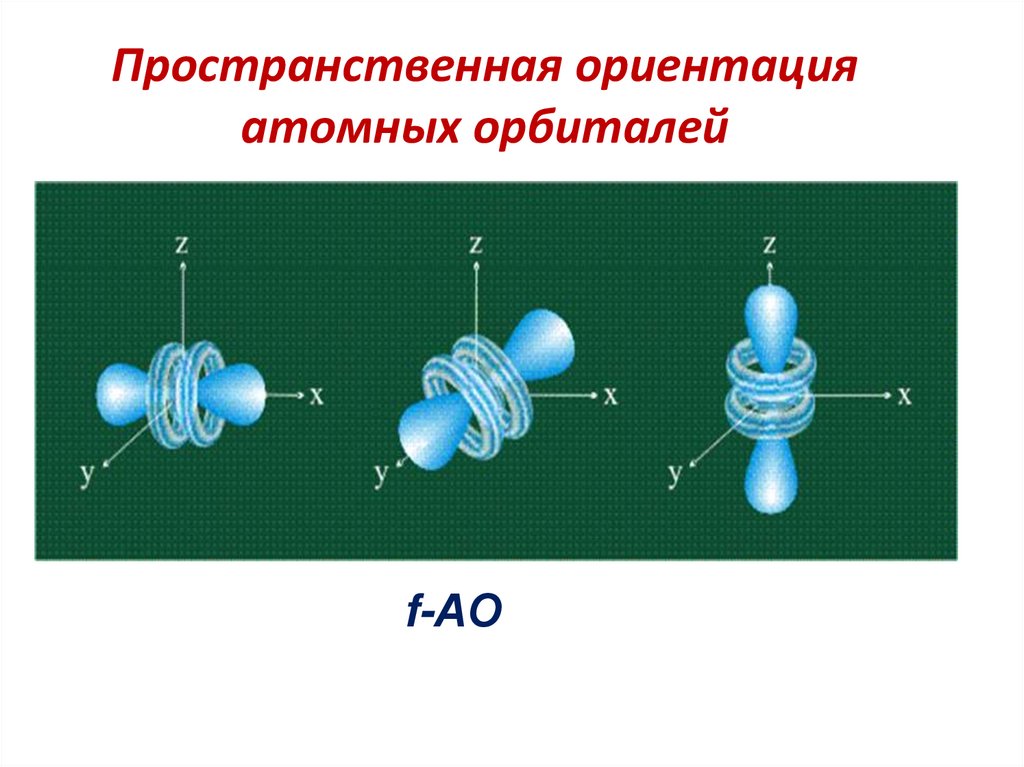
d-АО59. Пространственная ориентация атомных орбиталей
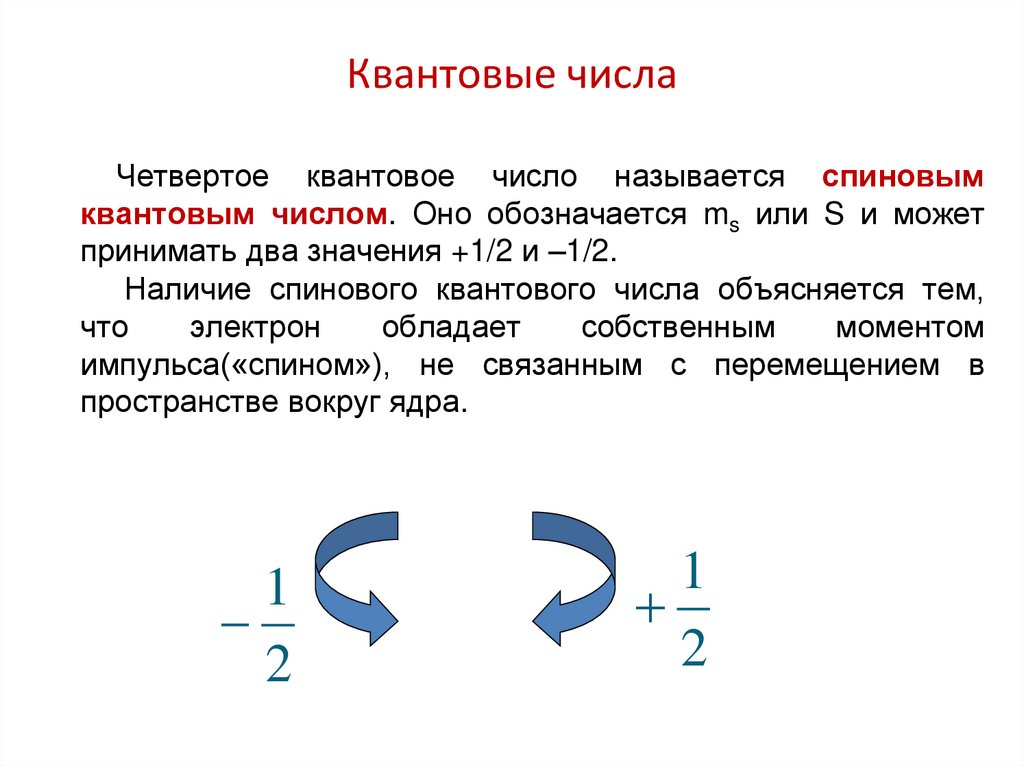
f-АО60. Квантовые числа
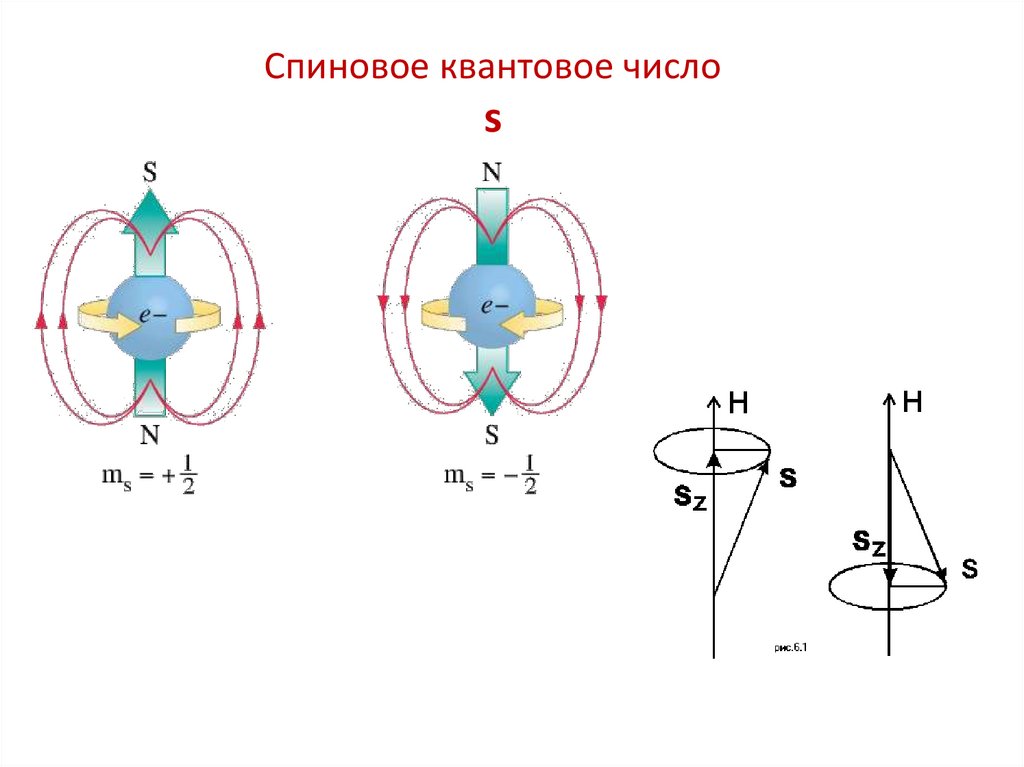
Четвертое квантовое число называется спиновымквантовым числом. Оно обозначается ms или S и может
принимать два значения +1/2 и –1/2.
Наличие спинового квантового числа объясняется тем,
что
электрон
обладает
собственным
моментом
импульса(«спином»), не связанным с перемещением в
пространстве вокруг ядра.
1
2
1
2
61.
Спиновое квантовое числоs
62.
Квантовые числаОбщая характеристика состояния электрона в многоэлектронном
атоме определяется:
принципом Паули: в атоме не может быть двух
электронов, у которых все четыре квантовых числа
были бы одинаковыми.
На одной орбитали могут находиться не более
двух электронов, отличающихся друг от друга
спинами.
1 S2
Электрон на схеме изображается стрелкой: вверх ↑ - положительное
значение спина +1/2, вниз ↓ - отрицательное - ½ ; атомная орбиталь ячейкой.
Принцип Паули определяет максимальное число электронов Nn, на
электронном слое с номером n:
Максимальная емкость энергетического подуровня:
2(2+l) электронов, а уровня – 2n2.
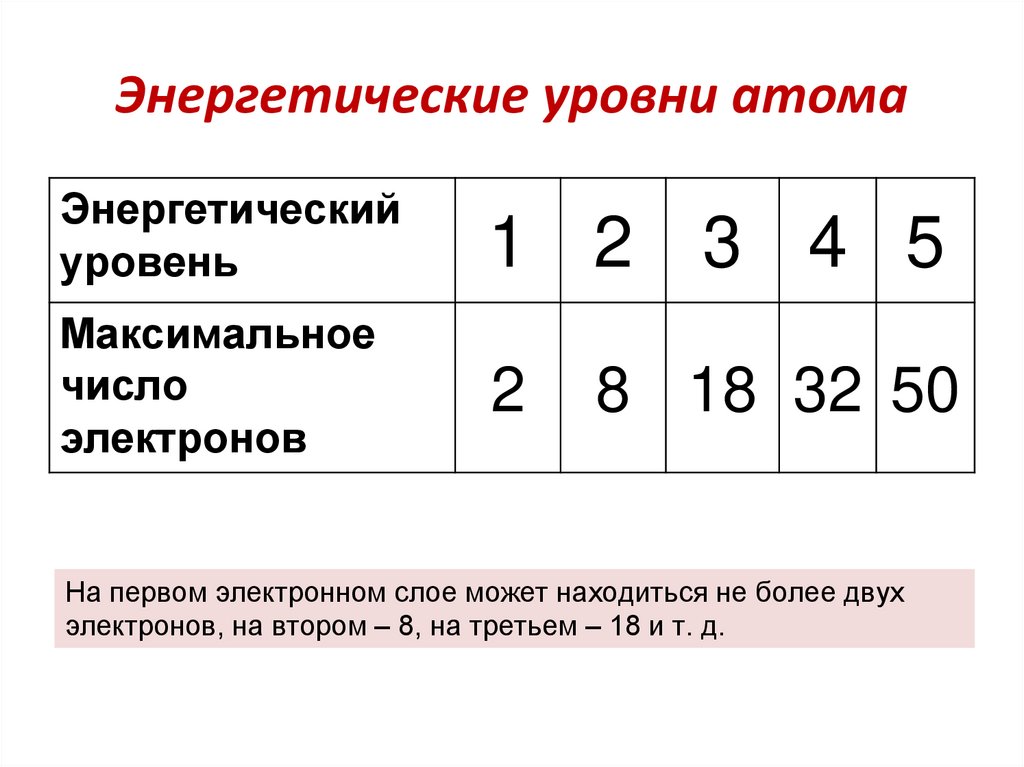
63. Энергетические уровни атома
Энергетическийуровень
1 2 3 4 5
Максимальное
число
электронов
2
8 18 32 50
На первом электронном слое может находиться не более двух
электронов, на втором – 8, на третьем – 18 и т. д.
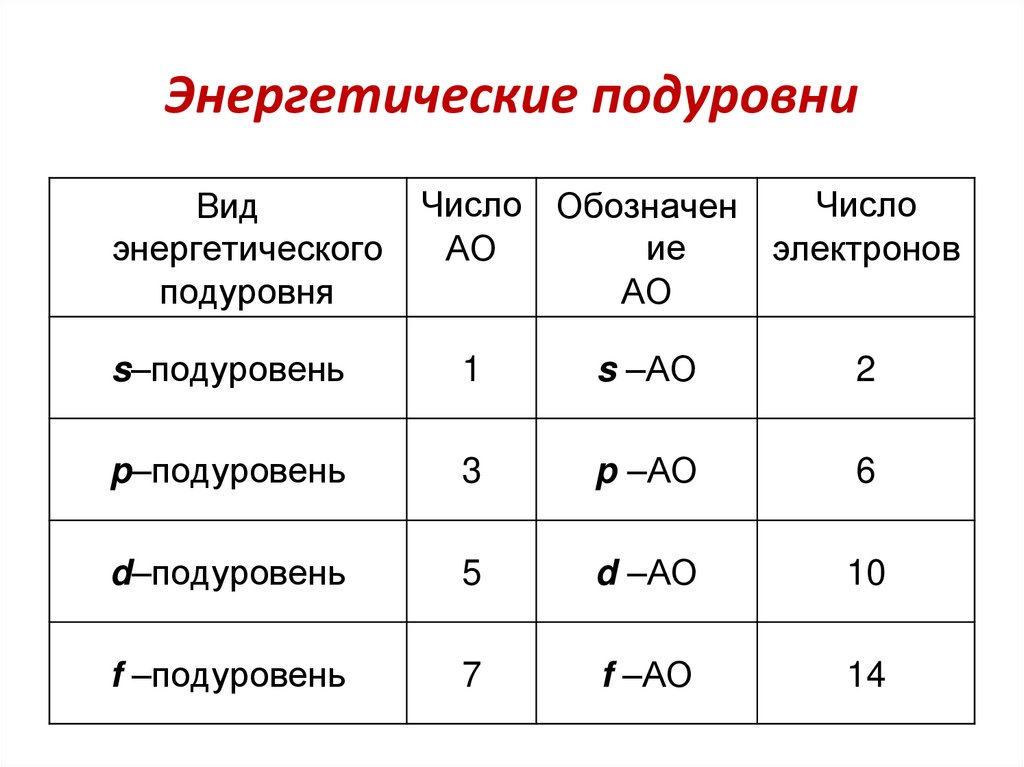
64. Энергетические подуровни
Видэнергетического
подуровня
Число Обозначен
Число
ие
АО
электронов
АО
s–подуровень
1
s –АО
2
p–подуровень
3
p –АО
6
d–подуровень
5
d –АО
10
f –подуровень
7
f –АО
14
65.
В соответствии с принципом Паули, максимальное числоэлектронов на подуровнях:
s2, p6, d10, f14
е- на одной АО имеют одинаковые значения n, l и
ml , могут отличаться только ms.
Н+1
n=1
1
S
1 S1
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
2 спаренных электрона на завершенной оболочке
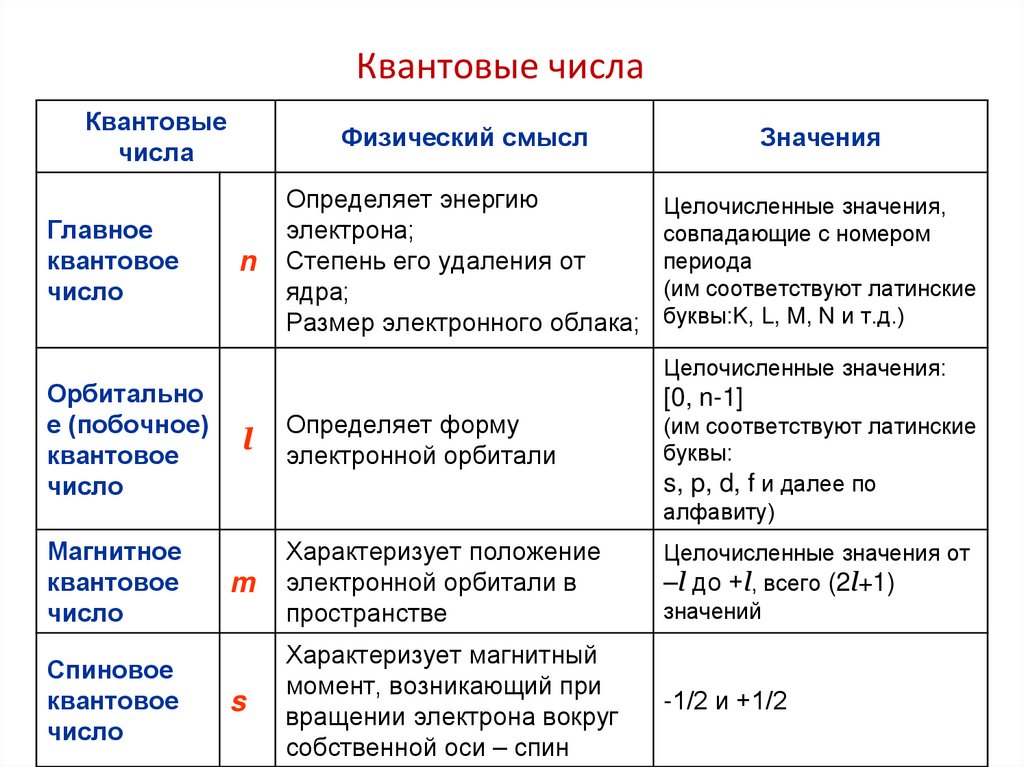
66.
Квантовые числаКвантовые
числа
Главное
квантовое
число
Орбитально
е (побочное)
квантовое
число
Магнитное
квантовое
число
Спиновое
квантовое
число
n
Физический смысл
Значения
Определяет энергию
электрона;
Степень его удаления от
ядра;
Размер электронного облака;
Целочисленные значения,
совпадающие с номером
периода
(им соответствуют латинские
буквы:K, L, M, N и т.д.)
Целочисленные значения:
[0, n-1]
l
Определяет форму
электронной орбитали
m
Характеризует положение
электронной орбитали в
пространстве
Целочисленные значения от
–l до +l, всего (2l+1)
значений
s
Характеризует магнитный
момент, возникающий при
вращении электрона вокруг
собственной оси – спин
-1/2 и +1/2
(им соответствуют латинские
буквы:
s, p, d, f и далее по
алфавиту)
67.
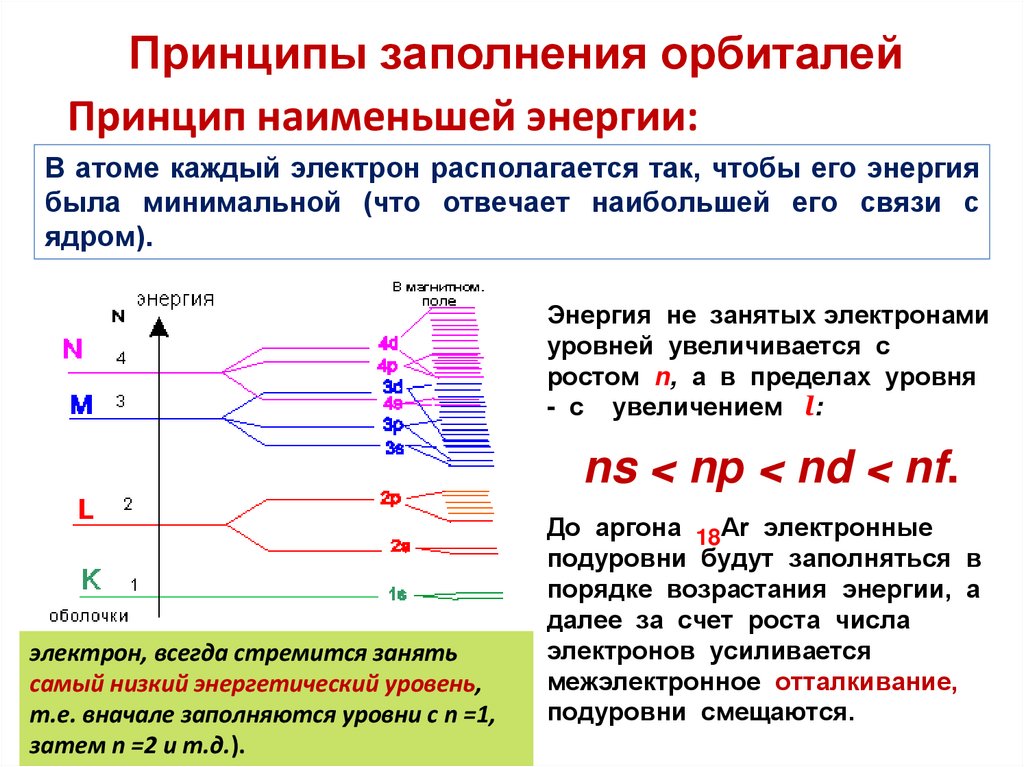
Принципы заполнения орбиталейПринцип наименьшей энергии:
В атоме каждый электрон располагается так, чтобы его энергия
была минимальной (что отвечает наибольшей его связи с
ядром).
Энергия не занятых электронами
уровней увеличивается с
ростом n, а в пределах уровня
- с увеличением l:
ns < nр < nd < nf.
электрон, всегда стремится занять
самый низкий энергетический уровень,
т.е. вначале заполняются уровни с n =1,
затем n =2 и т.д.).
До аргона 18Аr электронные
подуровни будут заполняться в
порядке возрастания энергии, а
далее за счет роста числа
электронов усиливается
межэлектронное отталкивание,
подуровни смещаются.
68.
Принципы заполнения орбиталейВ соответствии с принципом наименьшей энергии
и с помощью квантовых чисел получают т.н.
«идеальный» ряд распределения электронов.
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14
5s2 5p6 5d10 5f14 6s2 6p6 6d10 6f14
7s2 7p6 7d107f14
69.
Принципы заполнения орбиталей1961
Клечковский
Всеволод Маврикиевич
(1900 -1972)
Россия
Правило Клечковского:
Электрон занимает в основном состоянии уровень не с
минимально возможным значением n, а с наименьшим
значением суммы n + l.
70.
12
3
3
4
5
4
5
1+0
2+0
2+1
3+0
3+1
3+2
4+0
4+1
3d10
4s2
4p6
1s2 2s2 2p6 3s2 3p6
6
7
5
6
7
8
6
4+2
4+3
5+0
5+1
5+2
5+3
6+0
4d10 4f14 5s2
5p6 5d10 5f14 6s2
вначале электронами заполняется тот подуровень, для которого
минимальна сумма (n+l), при одинаковых значениях этой суммы
предпочтительней подуровень с меньшим значением n.
71.
Принципы заполнения орбиталейВ соответствии с правилом Клечковского
формируется реальный ряд распределения
электронов:
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
5s2 4d10 5p6 6s2 4f14 5d10 6p6
7s2 5f14 6d10 7p6 6f14 7d10 7f14
ВЫУЧИТЬ НАИЗУСТЬ!!!
72.
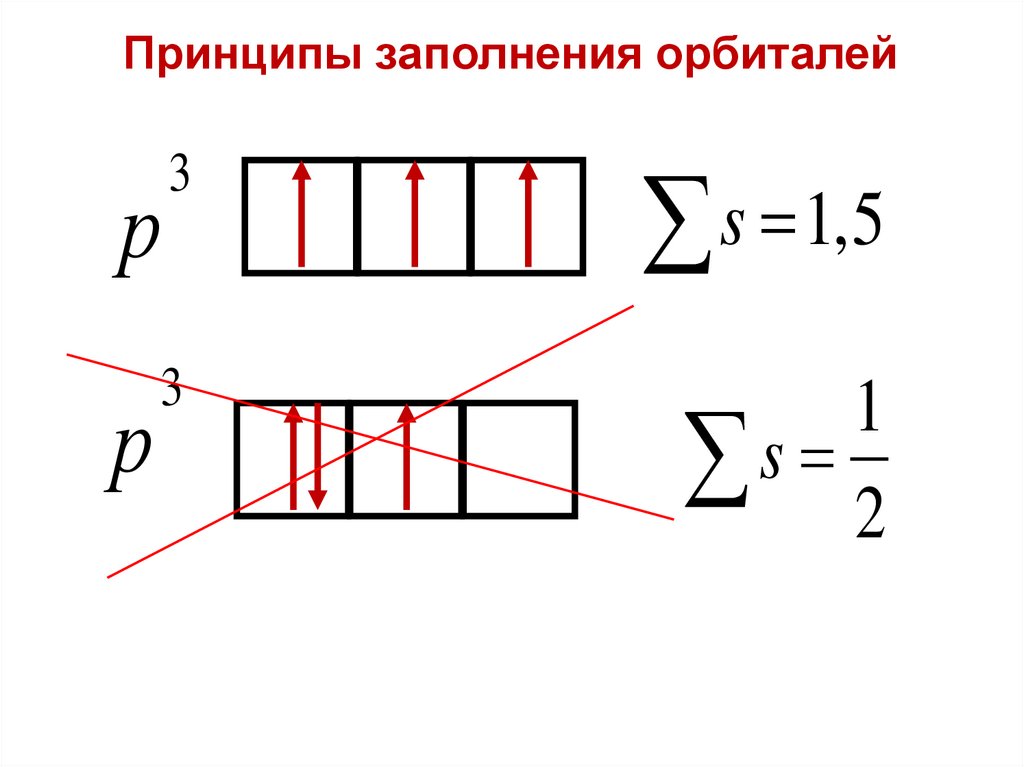
Принципы заполнения орбиталейФридрих Хунд
(1896 – 1997)
Германия
Правило Хунда:
При данном значении l (т. е. в пределах определенного
подуровня) электроны располагаются таким образам,
чтобы суммарный спин был максимальным.
73.
Принципы заполнения орбиталейр
3
s 1,5
р
3
1
s 2
74. Составления электронных и электронно-графических схем строения атома
75. Чтобы правильно изображать электронные конфигурации атомов, нужно ответить на вопросы:
1. Как определить общее число электроновв атоме?
2. Каково максимальное число электронов
на уровнях, подуровнях?
3. Какой порядок заполнения подуровней и
орбиталей?
75
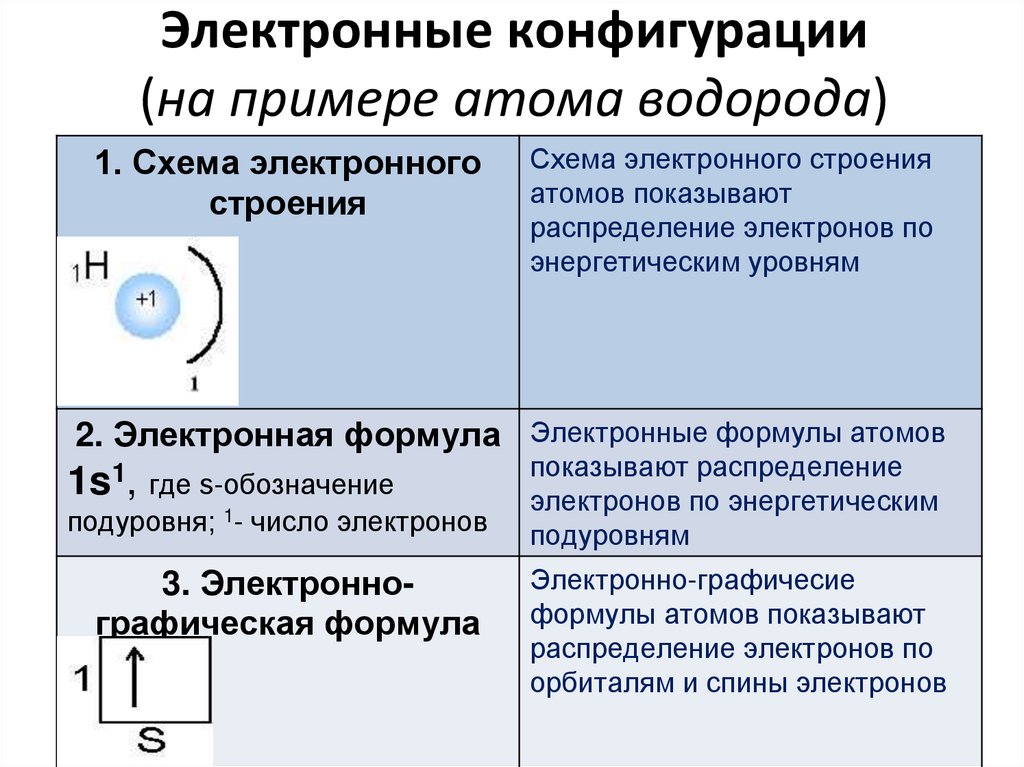
76. Электронные конфигурации (на примере атома водорода)
1. Схема электронногостроения
Схема электронного строения
атомов показывают
распределение электронов по
энергетическим уровням
2. Электронная формула Электронные формулы атомов
1s1, где s-обозначение
подуровня; 1- число электронов
3. Электроннографическая формула
показывают распределение
электронов по энергетическим
подуровням
Электронно-графичесие
формулы атомов показывают
распределение электронов по
орбиталям и спины электронов
77. 1. Запиши знак химического элемента алюминия . Перед ним внизу укажи его порядковый номер.
13Al
78. 2. По образцу составь электронную формулу алюминия
22
6
2
1s , 2s , 2p , 3s , 3p1
• Порядок заполнения энергетических уровней в атоме.
13
Al
У алюминия 13 электронов
Первым в атоме заполняется 1s подуровень
На нем максимально может быть 2 электрона, отметим их и
вычтем из общего числа электронов.
Осталось разместить 11 электронов. Заполняется следующий 2s
подуровень, на нем может быть 2 электрона.
Осталось разместить 9 электронов. Заполняется следующий 2p
подуровень, на нем может быть 6 электронов.
Далее заполняем 3s подуровень
Дошли до 3p подуровня, на нем максимально может быть 6
электронов, но осталось только 1, его и помещаем.
1s2 2s2 2p6 3s2 3p1
13 - 2 = 11
-2=9
-6=3
-2=1
79. 3. Определи: По порядку ли идут энергетические уровни. Если уровни идут по порядку, то так их и оставь. Если уровни идут не по
порядку, то перепиши их, расставив по возрастанию.• Нет. 4s и 3d подуровни идут не по порядку.
2 2s2
6 3s2 3p6 3d4 4s2
Cr
1s
2p
24
• Надо переписать и расставить их по мере возрастания
энергетических показателей.
1s2 2s2 2p6 3s2 3p6 4s2 3d4
80. Правила для составления электронно-графической схемы
Приступаем к составлению электронно-графической схемыs
p
d
f
Каждый подуровень имеет определенное число орбиталей.
На каждой орбитали могут находиться не более двух электронов.
Если на орбитале два электрона, то у них должен быть разный спин (стрелки
смотрят в разные стороны).
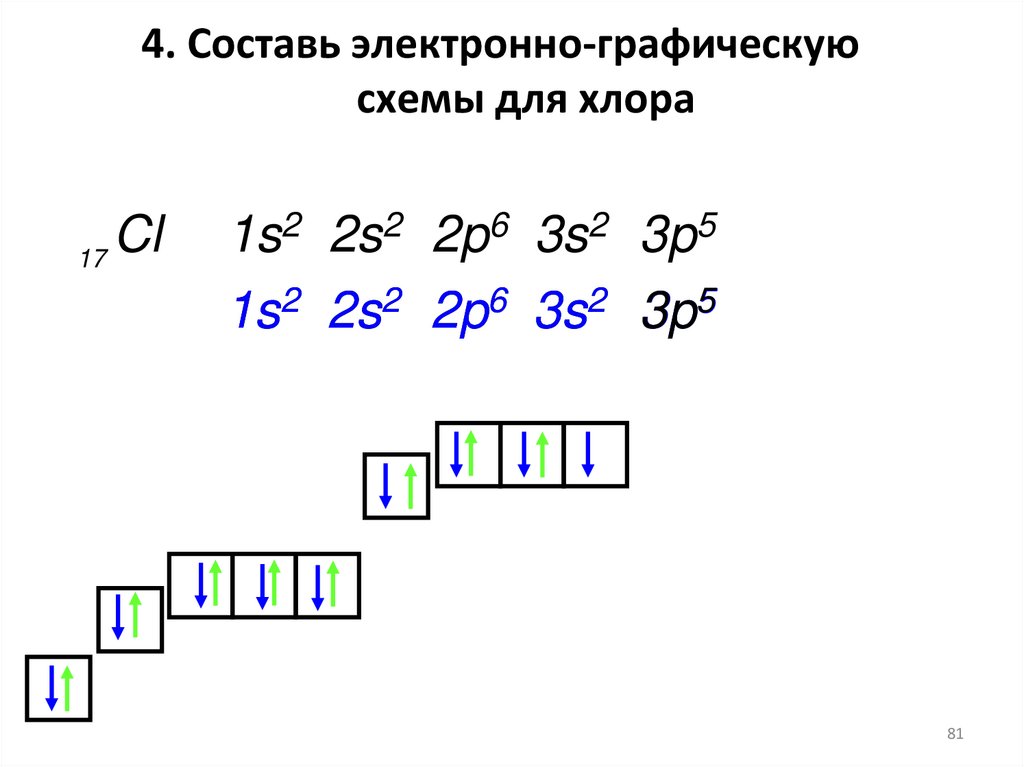
81. 4. Составь электронно-графическую схемы для хлора
Cl17
1s2 2s2 2p6 3s2 3p5
1s2 2s2 2p6 3s2 3p5
81
82. 1 период
Н+1n=1
1
S
1 S1
Одиночный электрон на незавершенной оболочке
Нe + 2
n=1
2
S
1 S2
S - элементы
2 спаренных электрона на завершенной оболочке
83. 2 период
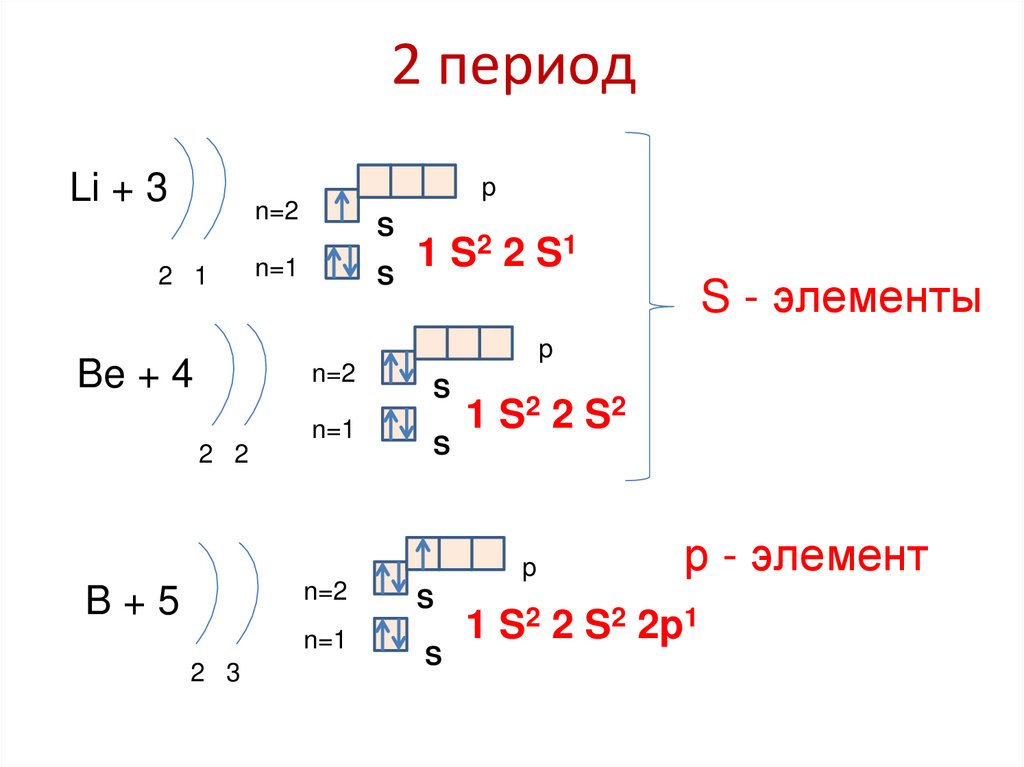
Li + 3p
n=2
2 1
S
2 2 S1
1
S
S
n=1
S - элементы
p
Be + 4
n=2
n=1
2 2
S
S
1 S2 2 S 2
p
n=2
B+5
n=1
2 3
S
S
р - элемент
1 S2 2 S2 2p1
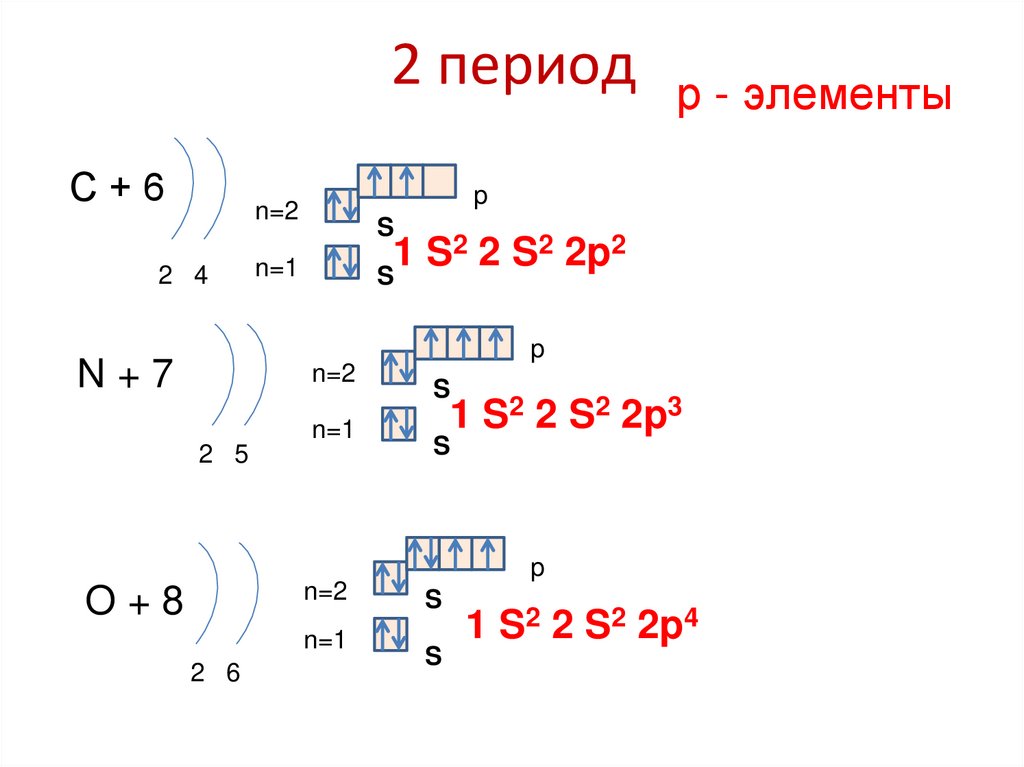
84. 2 период
р - элементыС+6
p
n=2
2 4
S
2 2 S2 2p2
1
S
S
n=1
p
N+7
n=2
n=1
2 5
S
1 S2 2 S2 2p3
S
p
n=2
O+8
n=1
2 6
S
S
1 S2 2 S2 2p4
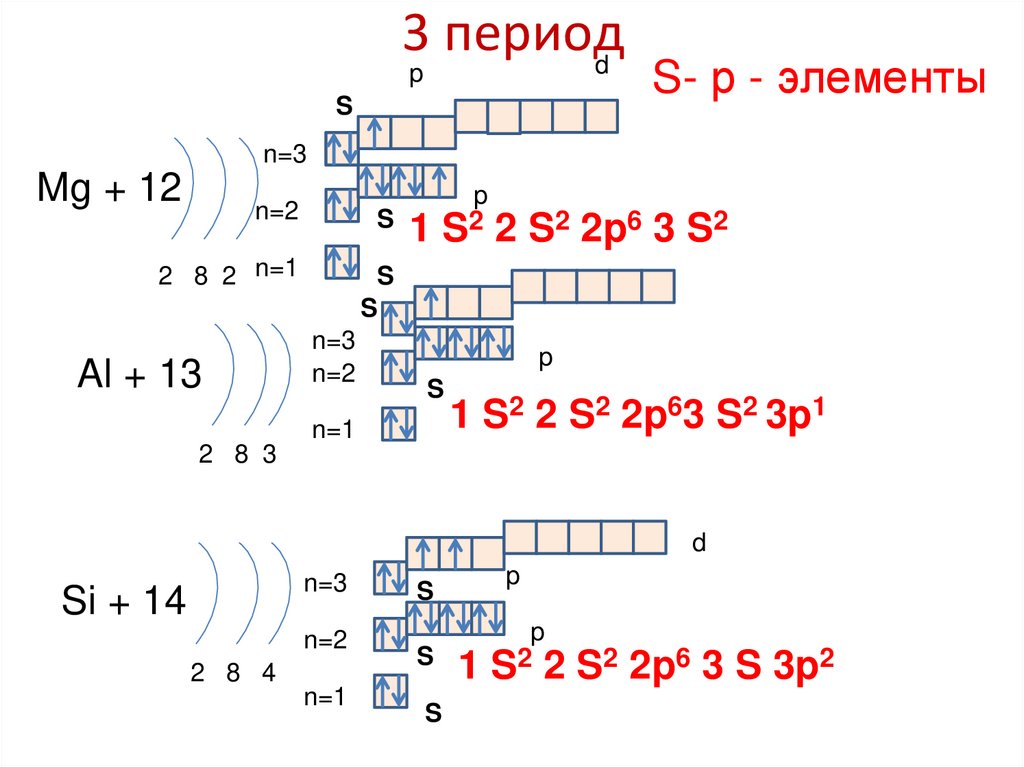
85. 3 период
dp
S
S- р - элементы
n=3
Mg + 12
p
S
1 S2 2 S2 2p6 3 S2
n=2
2 8 2 n=1
Al + 13
S
S
n=3
n=2
p
S
n=1
1 S2 2 S2 2p63 S2 3p1
2 8 3
d
Si + 14
p
n=3
S
n=2
p
S
1 S2 2 S2 2p6 3 S 3p2
2 8 4
n=1
S
86. 3 период
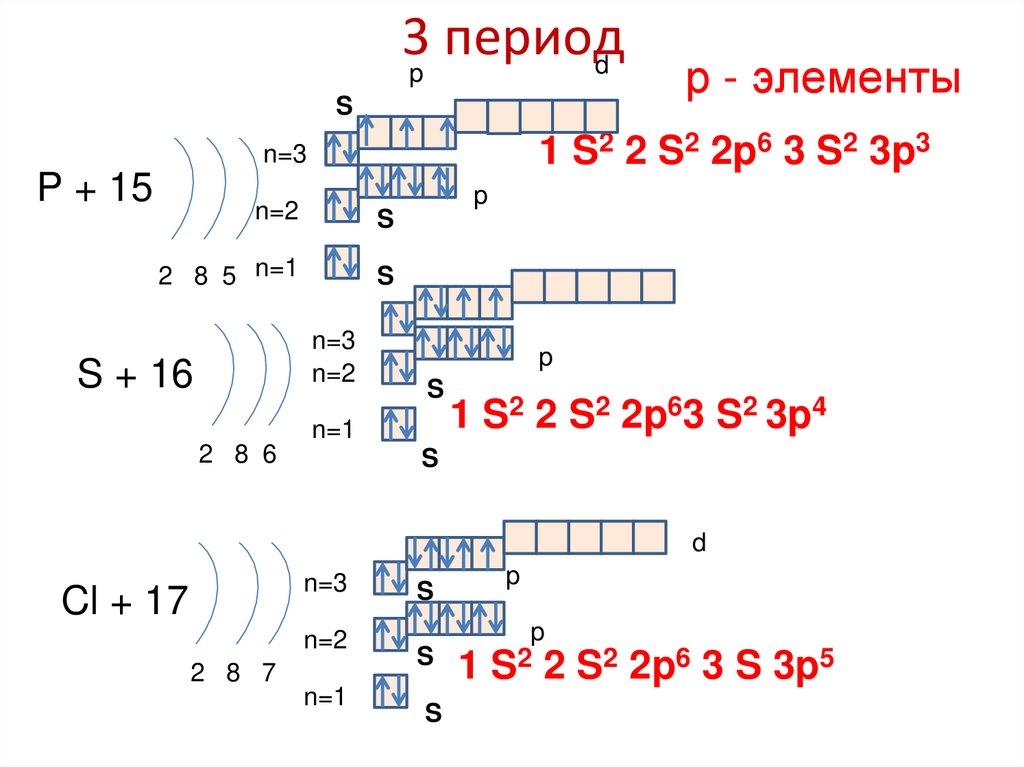
3p периодd
S
1 S2 2 S2 2p6 3 S2 3p3
n=3
P + 15
p
n=2
S
2 8 5 n=1
S
n=3
n=2
S + 16
р - элементы
p
S
n=1
2 8 6
1 S2 2 S2 2p63 S2 3p4
S
d
Cl + 17
p
n=3
S
n=2
p
S
1 S2 2 S2 2p6 3 S 3p5
2 8 7
n=1
S














































 Химия
Химия








