Похожие презентации:
Дисперсные системы их классификация и способы очистки
1. Дисперсные системы их классификация и способы очистки
2.
Дисперсными называют гетерогенные системы, в которых одновещество в виде очень мелких частиц равномерно распределено в
объеме другого. То вещество, которое присутствует в меньшем
количестве и распределено в объеме другого, называют дисперсной
фазой. Она может состоять из нескольких веществ. Вещество,
присутствующее в большем количестве, в объеме которого
распределена дисперсная фаза, называют дисперсионной средой.
Между ней и частицами дисперсной фазы существует
поверхность раздела, поэтому дисперсные системы называют
гетерогенными (неоднородными).
3.
По величине частиц веществ, составляющих дисперсную фазу,дисперсные системы делят на грубодисперсные (взвеси) с размерами
частиц более 100 нм и тонкодисперсные (коллоидные растворы или
коллоидные системы) с размерами частиц от 100 до 1 нм. Если же
вещество раздроблено до молекул или ионов размером менее 1 нм,
образуется гомогенная система − раствор. Она однородна (гомогенна),
поверхности раздела между частицами дисперсной фазы и средой нет.
Если все частицы дисперсной фазы имеют одинаковые размеры, то
такие системы называют монодисперсными (рис. 1, а и б). Частицы
дисперсной фазы неодинакового размера образуют полидисперсные
системы
(рис.1, в)
Рис. 1. Свободнодисперсные системы:
корпускулярно − (а-в), волокнисто − (г) и
пленочно-дисперсные − (д); а, б −
монодисперсные; в − полидисперсная
система.
4.
Дисперсные системы могут быть свободнодисперсными(рис. 1) исвязнодисперсными (рис. 2, а − в) в зависимости от отсутствия или наличия
взаимодействия между частицами дисперсной фазы. К свободнодисперсным
системам относятся аэрозоли, разбавленные суспензии и эмульсии. Они
текучи, в этих системах частицы дисперсной фазы не имеют контактов,
участвуют в беспорядочном тепловом движении, свободно перемещаются под
действием силы тяжести. Связнодисперсные системы − твердообразны; они
возникают при контакте частиц дисперсной фазы, приводящем к
образованию структуры в виде каркаса или сетки. Такая структура
ограничивает текучесть дисперсной системы и придает ей способность
сохранять форму. Порошки, концентрированные эмульсии и суспензии
(пасты), пены, гели – примеры связнодисперсных систем. Сплошную массу
вещества могут пронизывать поры и капилляры, образующие капиллярнодисперсные системы (кожа, картон, ткани, древесина).
Рис. 3. Связнодисперсные (а-в) и
капиллярно-дисперсные (г, д) системы:
гель (а), коагулянт с плотной (б) и
рыхлой – арочной (в) структурой.
5.
Дисперсные системы, в соответствии с их промежуточным положениеммежду миром молекул и крупных тел, могут быть получены двумя
путями: методами диспергирования, т. е. измельчения крупных тел, и
методами конденсации молекулярно- или ионнорастворенных веществ.
Под взаимодействием фаз дисперсных систем подразумевают процессы
сольватации (гидратации в случае водных систем), т. е. образование
сольватных (гидратных) оболочек из молекул дисперсионной среды вокруг
частиц дисперсной фазы. Соответственно, по интенсивности
взаимодействия между веществами дисперсной фазы и дисперсионной
среды (только для систем с жидкой
дисперсионной средой), по предложению Г. Фрейндлиха различают
следующие дисперсные системы:
6.
a) Лиофильныеb) Лиофобные
7.
Лиофильные (гидрофильные, если ДС – вода): мицеллярныерастворы ПАВ, критические эмульсии, водные растворы
некоторых природных ВМС, например, белков (желатина, яичного
белка), полисахаридов (крахмала). Для них характерно сильное
взаимодействие частиц ДФ с молекулами ДС. В предельном случае
наблюдается полное растворение. Лиофильные дисперсные
системы образуются самопроизвольно вследствие процесса
сольватации. Термодинамически агрегативно устойчивы.
8.
Лиофобные (гидрофобные, если ДС – вода): эмульсии, суспензии,золи. Для них характерно слабое взаимодействие частиц ДФ с
молекулами ДС. Самопроизвольно не образуются, для их
образования необходимо затратить работу. Термодинамически
агрегативно неустойчивы (т. е. имеют тенденцию к
самопроизвольной агрегации частиц дисперсной фазы), их
относительная устойчивость (так называемая
метастабильность) обусловлена кинетическими факторами (т.
е. низкой скоростью агрегации).
9.
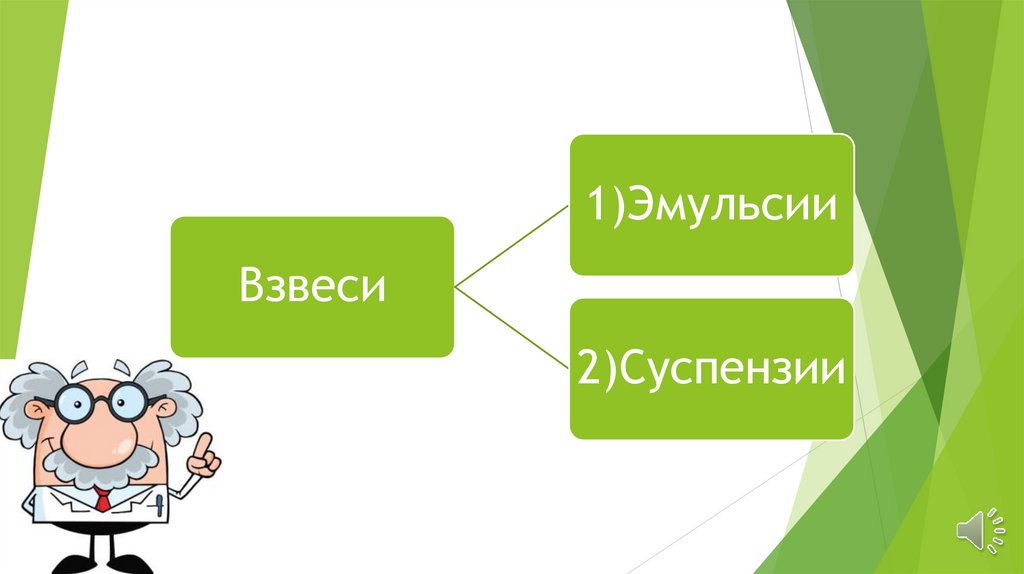
1)ЭмульсииВзвеси
2)Суспензии
10.
Взвеси – это дисперсные системы, в которых размерчастицы фазы более 100 нм. Это непрозрачные
системы, отдельные частицы которых можно
заметить невооруженным глазом. Дисперсная фаза и
дисперсная среда легко разделяются отстаиванием,
фильтрованием. Такие системы разделяются на:
Эмульсии и Суспензии
11.
Эмульсии (и среда, и фаза – нерастворимые друг в другежидкости). Из воды и масла можно приготовить
эмульсию длительным встряхиванием смеси. Это
хорошо известные вам молоко, лимфа,
водоэмульсионные краски и т.д.
12.
Суспензии (среда – жидкость, фаза – нерастворимое вней твердое вещество).Чтобы приготовить суспензию,
надо вещество измельчить до тонкого порошка,
высыпать в жидкость и хорошо взболтать. Со
временем частица выпадут на дно сосуда. Очевидно,
чем меньше частицы, тем дольше будет сохраняться
суспензия.
13.
Аэрозоли-взвеси в газе (например, в воздухе) мелких частиц жидкостей илитвердых веществ. Различаются пыли, дымы, туманы. Первые два вида аэрозолей
представляют собой взвеси твердых частиц в газе (более крупные частицы в
пылях), последний – взвесь капелек жидкости в газе. Например: туман, грозовые
тучи – взвесь в воздухе капелек воды, дым – мелких твердых частиц. А смог,
висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой
дисперсной фазой. Жители населенных пунктов вблизи цементных заводов
страдают от всегда висящей в воздухе тончайшей цементной пыли,
образующейся при размоле цементного сырья и продукта его обжига – клинкера.
Для химии наибольшее значение имеют дисперсные системы, в которых средой
является вода и жидкие растворы. Природная вода всегда содержит растворенные
вещества. Природные водные растворы участвуют в процессах почвообразования и
снабжают растения питательными веществами. Сложные процессы
жизнедеятельности, происходящие в организмах человека и животных, также
протекают в растворах.
14.
Коллоидные системы (в переводе с греческого “колла” – клей,“еидос” вид клееподобные) – это такие дисперсные системы, в
которых размер частиц фазы от 100 до 1 нм. Эти частицы не
видны невооруженным глазом, и дисперсная фаза и дисперсная
среда в таких системах отстаиванием разделяются с трудом.
Коллоидные растворы, или золи. Это большинство жидкостей
живой клетки (цитоплазма, ядерный сок – кариоплазма,
содержимое органоидов и вакуолей). И живого организма в целом
(кровь, лимфа, тканевая жидкость, пищеварительные соки и
т.д.) Такие системы образуют клеи, крахмал, белки, некоторые
полимеры.
15.
Коллоидные растворымогут быть получены в результате химических реакций;
например, при взаимодействии растворов силикатов калия или
натрия (“растворимого стекла”) с растворами кислот
образуется коллоидный раствор кремниевой кислоты. Золь
образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность.
Коллоидные растворы внешне похожи на истинные растворы. Их
отличают от последних по образующейся “светящейся
дорожке” – конусу при пропускании через них луча света. Это
явление называют эффектом Тиндаля.
16.
Коллоидные растворымогут быть получены в результате химических реакций;
например, при взаимодействии растворов силикатов калия или
натрия (“растворимого стекла”) с растворами кислот
образуется коллоидный раствор кремниевой кислоты. Золь
образуется и при гидролизе хлорида железа (III) в горячей воде.
Характерное свойство коллоидных растворов – их прозрачность.
Коллоидные растворы внешне похожи на истинные растворы. Их
отличают от последних по образующейся “светящейся
дорожке” – конусу при пропускании через них луча света. Это
явление называют эффектом Тиндаля.
Пропускание луча света через
растворы:
а – истинный раствор хлорида натрия;
б – коллоидный раствор гидроксида
железа (III).
17.
Частицы дисперсной фазы коллоидных растворовнередко не оседают даже при длительном хранении изза непрерывных соударений с молекулами
растворителя за счет теплового движения. Они не
слипаются и при сближении друг с другом из-за
наличия на их поверхности одноименных
электрических зарядов. Это объясняется тем, что
вещества в коллоидном, т.е., в мелкораздробленном,
состоянии обладают большой поверхностью.
18.
Гели или студни представляют собой студенистые осадки,образующиеся при коагуляции золей. К ним относят большое
количество полимерных гелей, столь хорошо известные вам
кондитерские, косметические и медицинские гели (желатин,
холодец, мармелад, хлеб, мясо, джем, желе, мармелад, кисель, сыр,
творог, простокваша, торт “Птичье молоко”) и конечно же
бесконечное множество природных гелей: минералы (опал), тела
медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и
т.д.
19.
Студни − это структурированные системы со свойствами эластичныхтвердых тел. Студнеобразное состояние вещества можно
рассматривать как промежуточное между жидким и твердым
состоянием. На процесс студнеобразования существенно влияет природа
растворенных веществ, форма их частиц, концентрация, температура,
время процесса и примеси других веществ, особенно электролитов. На
основании свойств студни делят на две большие группы:
a) эластичные, или обратимые, получаемые из высокомолекулярных
веществ;
b) хрупкие, или необратимые, получаемые из неорганических гидрофобных
золей.
20.
Для студней характерен ряд свойств твердых тел: онисохраняют форму, обладают упругими свойствами и
эластичностью. Однако их механические свойства определяются
концентрацией и температурой. При нагревании студни
переходят в вязкотекучее состояние. Этот процесс называется
плавлением. Он обратим, так как при охлаждении раствор снова
образовывает студень. Многие студни способны разжижаться и
переходить в растворы при механическом воздействии
(перемешивание, встряхивание). Этот процесс обратим, так как
в состоянии покоя через некоторое время раствор образовывает
студень. Свойство студней многократно изотермически
разжижаться при механических воздействиях и образовывать
студень в состоянии покоя называется тиксотропией.
21.
Растворы высокомолекулярных веществ.Полимеры, подобно низкомолекулярным веществам, в
зависимости от условий получения раствора (природа
полимера и растворителя, температура и др.) могут
образовывать как коллоидные, так и истинные
растворы. Следствие больших размеров молекул и
особенностей их строения, растворы ВМС обладают
рядом специфических свойств:
22.
1. Равновесные процессы в растворах ВМС устанавливаются медленно.2. Процессу растворения ВМС, как правило, предшествует процесс набухания.
3. Растворы полимеров не подчиняются законам идеальных растворов, т.е.
законам Рауля и Вант-Гоффа.
4. При течении растворов полимеров возникает анизотропия свойств
(неодинаковые физические свойства раствора в разных направлениях) за счет
ориентации молекул в направлении течения.
5. Высокая вязкость растворов ВМС.
6. Молекулы полимеров, благодаря большим размерам, проявляют склонность
к ассоциации в растворах. Время жизни ассоциатов полимеров более
длительное, чем ассоциатов низкомолекулярных веществ.
23.
Набухание – это увеличение массы и объема полимера за счетпроникновения молекул растворителя в пространственную
структуру ВМС. Различают два вида набухания: неограниченное,
заканчивающееся полным растворением ВМС (например,
набухание желатины в воде, каучука в бензоле, нитроцеллюлозы в
ацетоне) и ограниченное, приводящее к образованию набухшего
полимера – студня (например, набухание целлюлозы в воде,
желатина в холодной воде, вулканизованного каучука в бензоле).























 Химия
Химия