Похожие презентации:
Электронное строение атомов
1. Электронное строение атомов
2. Задачи:
• познакомиться со строением электроннойоболочки атома (уровни, подуровни,
орбитали);
• научиться определять количество и виды
энергетических уровней в атоме;
• научиться рассчитывать число электронов на
уровнях, подуровнях и орбиталях;
• познакомиться с алгоритмом
составления схемы строения атома.
3. Электронная оболочка
Каждый электрон имеет свою формуэлектронного облака(подуровень,
орбиталь), запас энергии и
спин(собственный вращательный
момент).
Максимальная плотность электронного
облака соответствует электронной
орбитали – месту, где вероятность
обнаружить ē максимальна
4.
5. Электронная оболочка
• Состоит из энергетических уровней илиэлектронных слоев.
• Число энергетических уровней в атоме
равно номеру периода.
• Энергетические уровни обозначают:
+ х ) ) ) и т. д.
↑
заряд ядра
6.
• Энергетические уровни бывают:внутренние и внешние
+ х ) ) ) → внешний уровень
↑
внутренние уровни
Пример:
• Р – фосфор, 3 период → 3 энергетических
уровня
Р: + 15 ) ) )
7. Количество электронов на уровнях
• Nе (внутр) = 2n2,где n - номер уровня.
• Nе (внешн) = № (группы)
- для элементов главных подгрупп.
Пример:
1 2 3
Р: + 15 ) ) )
2 8 5
8. Строение энергетических уровней
• Каждый энергетический уровень состоит изподуровней.
• Число подуровней в уровне равно номеру
уровня.
• 1 уровень – 1 подуровень → s
• 2 уровень – 2 подуровня → s, p
• 3 уровень – 3 подуровня → s, p, d.
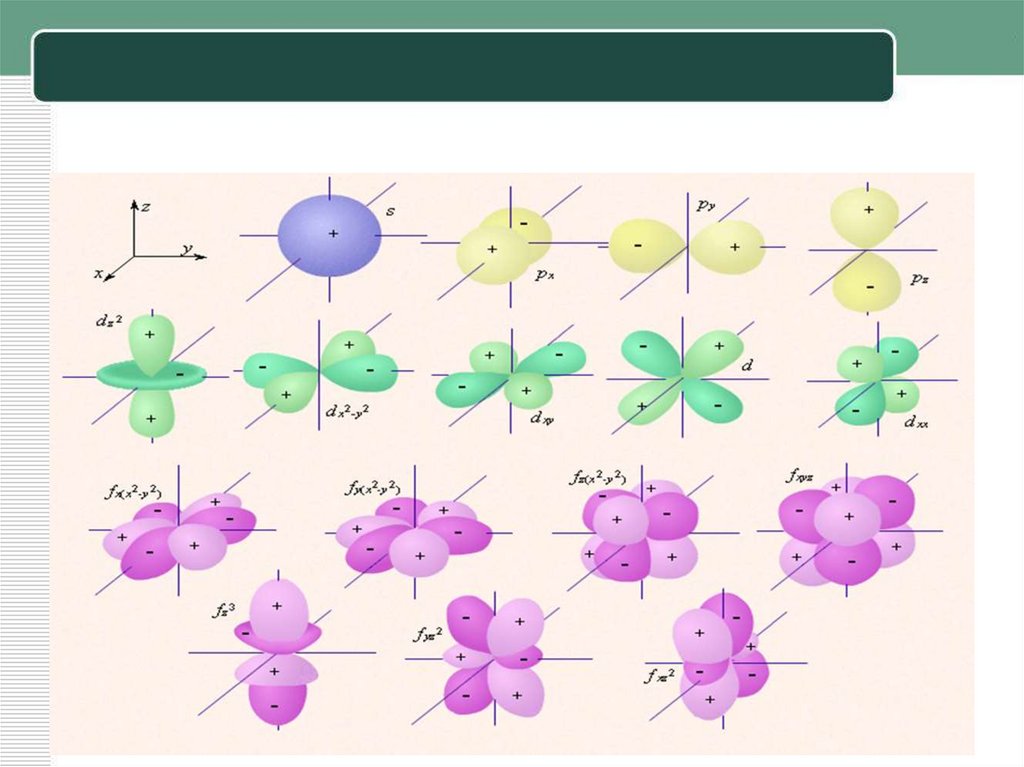
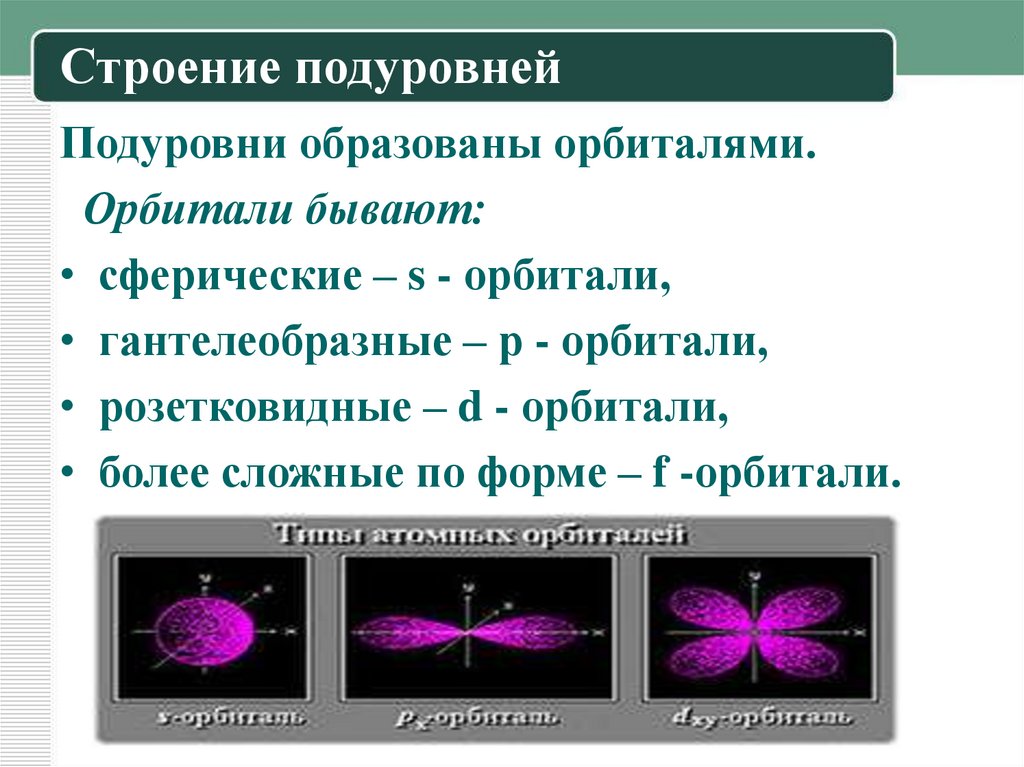
9. Строение подуровней
Подуровни образованы орбиталями.Орбитали бывают:
• сферические – s - орбитали,
• гантелеобразные – р - орбитали,
• розетковидные – d - орбитали,
• более сложные по форме – f -орбитали.
10. Количество орбиталей на подуровнях
• s -подуровень - 1 орбиталь• p - подуровень – 3 орбитали
• d - подуровень - 5 орбиталей
• f - подуровень - 7 орбиталей
На каждой орбитали может находиться
только два электрона.
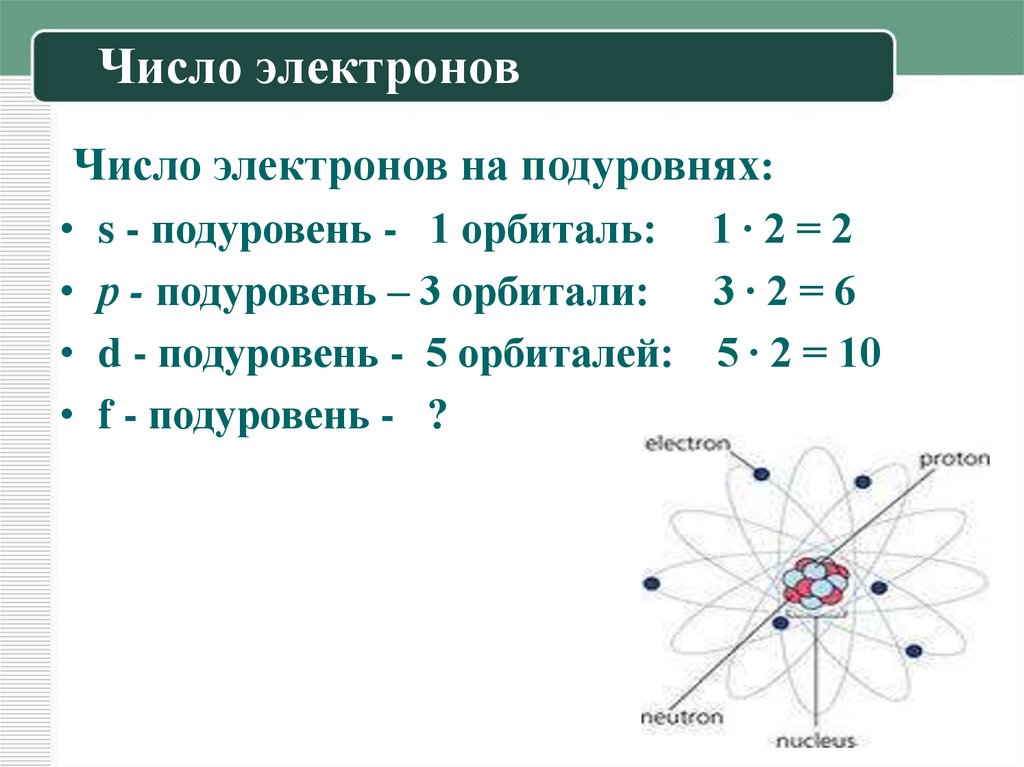
11. Число электронов
Число электронов на подуровнях:• s - подуровень - 1 орбиталь: 1 ∙ 2 = 2
• р - подуровень – 3 орбитали: 3 ∙ 2 = 6
• d - подуровень - 5 орбиталей: 5 ∙ 2 = 10
• f - подуровень - ?
12. ЗАПОМНИМ
Электроны, расположенные напоследней электронной оболочке,
называются внешними.
Число внешних электронов для
химических элементов главных подгрупп
равно номеру группы, в которой
находится элемент и называются
валентными
13. Принцип наименьшей энергии - определяет последовательность заполнения орбиталей электронами
В основном состоянии атома каждыйэлектрон располагается так, чтобы его
энергия была минимальной.
В этом случае устойчивость электронной системы
будет максимальной и связь электронов с ядром –
наибольшей.
В большинстве атомов и ионов энергия орбиталей
увеличивается в ряду:
1s < 2s <2р< 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d <
6p < 7s < 5f < 6d < 7p
28.09.2025
14. Принцип запрета Паули (1925 г, В. Паули)
Из этого принципа следует, что• на каждой орбитали может быть не более двух
электронов;
• Эти электроны должны иметь
противоположные (антипараллельные) спины;
допускается заполнение
не допускается заполнение , и .
На основании этого принципа определяется
максимальная заселенность каждого уровня: 2п2.
28.09.2025
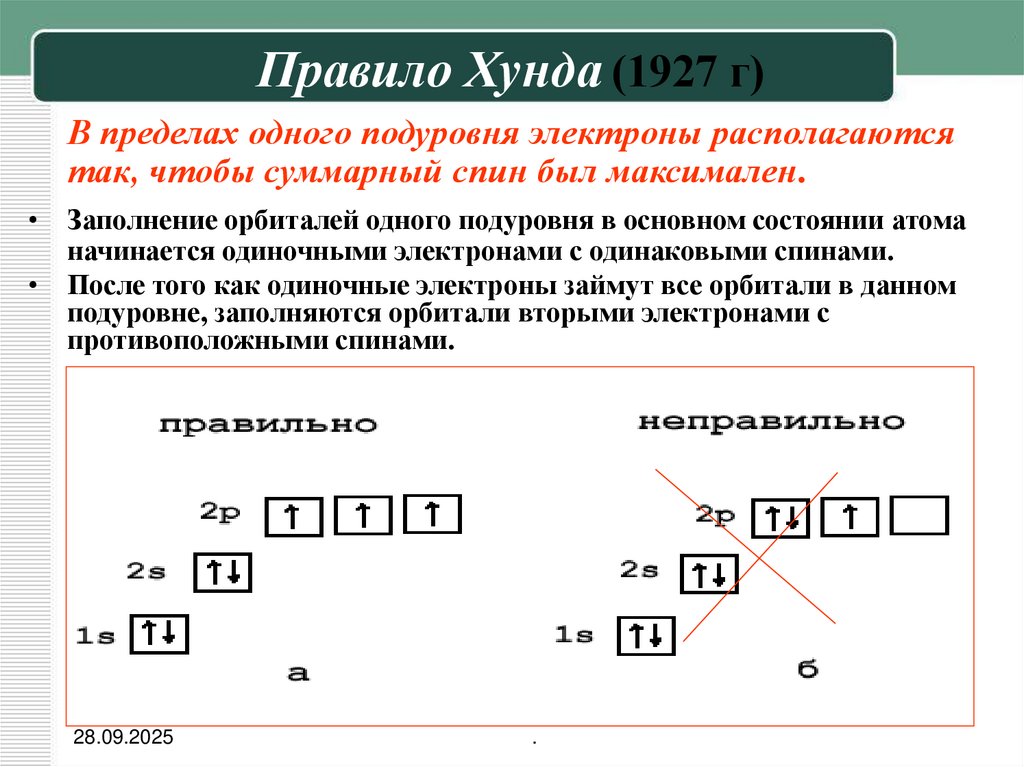
15. Правило Хунда (1927 г)
В пределах одного подуровня электроны располагаютсятак, чтобы суммарный спин был максимален.
• Заполнение орбиталей одного подуровня в основном состоянии атома
начинается одиночными электронами с одинаковыми спинами.
• После того как одиночные электроны займут все орбитали в данном
подуровне, заполняются орбитали вторыми электронами с
противоположными спинами.
28.09.2025
.
16. Способы изображения электронного строения атомов
3.Электронно-графическая схема10Ne
ПОКАЗЫВАЕТ РАСПРЕДЕЛЕНИЕ
ЭЛЕКТРОНОВ ПО УРОВНЯМ,
ПОДУРОВНЯМ,
ОРБИТАЛЯМ И СПИНЫ ЭЛЕКТРОНОВ
2.Электронная формула:
↑↓ ↑↓ ↑↓
↑↓
↑↓ 2s
1s
22s22p6;
Ne
1s
10
ПОКАЗЫВАЕТ РАСПРЕДЕЛЕНИЕ ЭЛЕКТРОНОВ
ПО УРОВНЯМ И ПОДУРОВНЯМ.
1.Электронная схема:
10Ne 2ē, 8ē;
ПОКАЗЫВАЕТ РАСПОЛОЖЕНИЕ ЭЛЕКТРОНОВ
ПО УРОВНЯМ.
28.09.2025
2p
17. Схема строения атома (алгоритм)
• Запишем знак химического элемента.• По порядковому номеру определим заряд
ядра атома, укажем его.
• По номеру периода определим число
энергетических уровней, отобразим их.
• Определим количество электронов на
каждом уровне. Укажем их.
18. Электронная формула атома
Показывает, на каких уровнях иподуровнях располагаются
электроны, сколько их на каждом
подуровне.
1s22s22p63s23p63d104s24p4
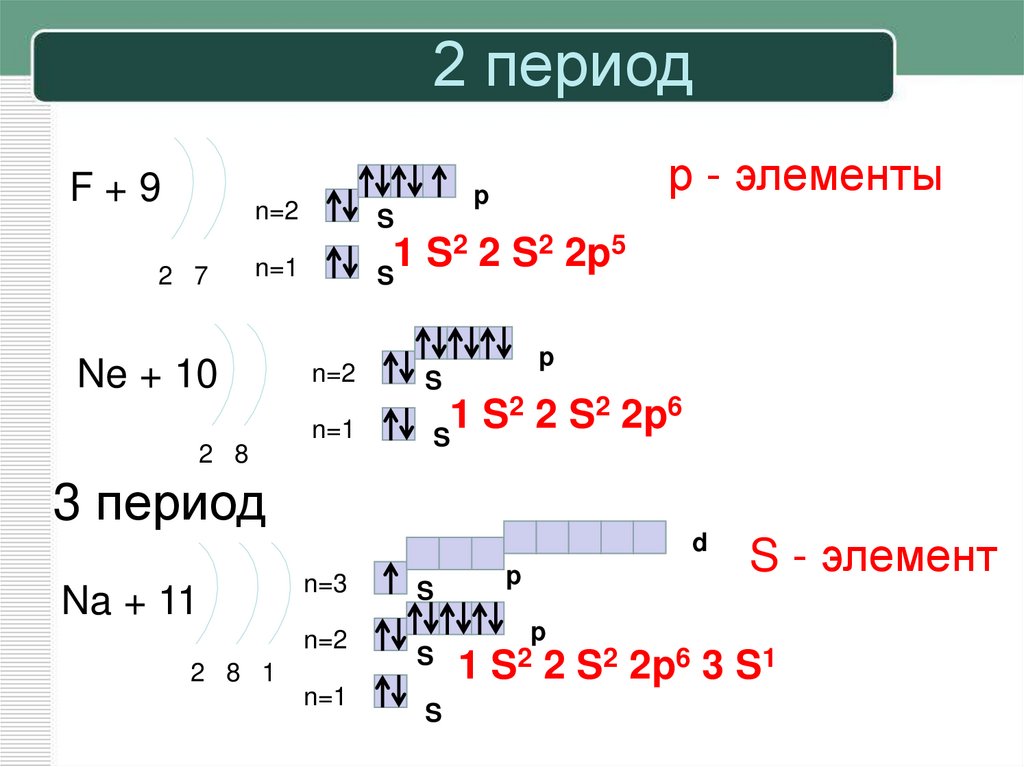
19. 2 период
F+92 7
р - элементы
p
n=2
S
n=1
2 2 S2 2p5
1
S
S
Ne + 10
p
n=2
S
n=1
2 2 S2 2p6
1
S
S
2 8
3 период
d
Na + 11
p
S - элемент
n=3
S
n=2
p
S
1 S2 2 S2 2p6 3 S1
2 8 1
n=1
S
20.
Домашнее задание:• § 1,
• Задачник















 Химия
Химия








