Похожие презентации:
Строение вещества. Химическая связь, её виды; механизмы образования ковалентной связи. Водородная связь
1.
Строение вещества. Химическаясвязь, её виды; механизмы
образования ковалентной связи.
Водородная связь.
F
F
2.
Элементы VIIА-группы называют благородными газами. Дажепростые
вещества,
образованные
этими
элементами,
существуют в виде отдельных атомов. Такая особенность
объясняется тем, что атомы этих элементов имеют
завершённый внешний электронный слой.
Как атомам остальных химических
элементов заполнить свой внешний
электронный слой?
3.
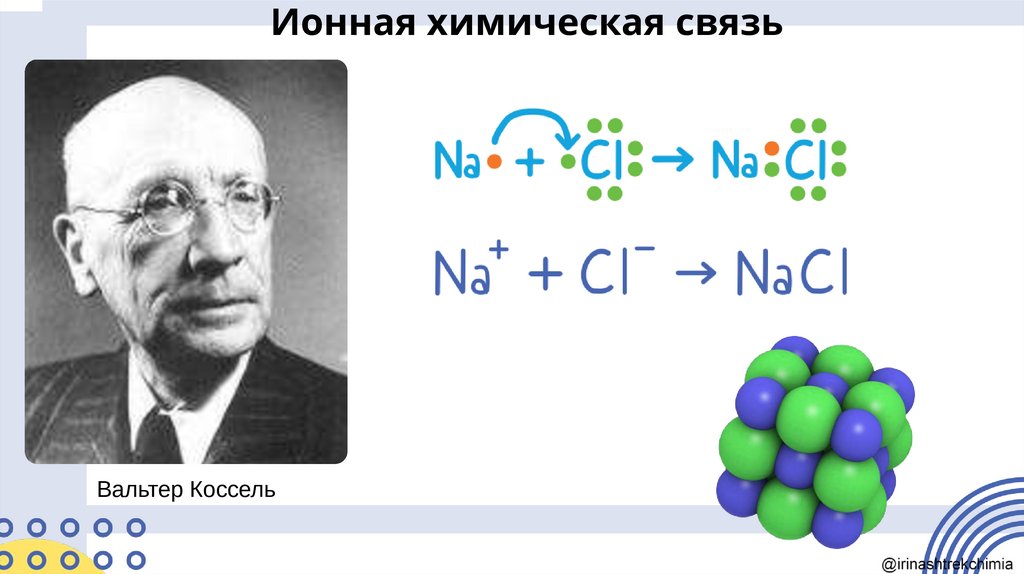
Ионная химическая связьКАТИОНЫ
ПОЛОЖИТЕЛЬНО
ЗАРЯЖЕННЫЕ
ИОНЫ
АНИОНЫ
ОТРИЦАТЕЛЬНО
ЗАРЯЖЕННЫЕ
ИОНЫ
Связь, образованная за счёт электростатического
притяжения между катионами и анионами, в
которые превращаются атомы или группы атомов
в результате отдачи и присоединения электронов,
называется ионной
Шарль Огюстен де Кулон
4.
Ионная химическая связьВальтер Коссель
5.
Ионная кристаллическая решёткамедный купорос
пищевая сода
поваренная соль
1.В узлах - ионы
2.Ионная связь
3.Вещества твёрдые
4.Хрупкие
5.Не летучие
6.С высокими
температурами
плавления
7.Растворимые в воде
8.Электропроводны
6.
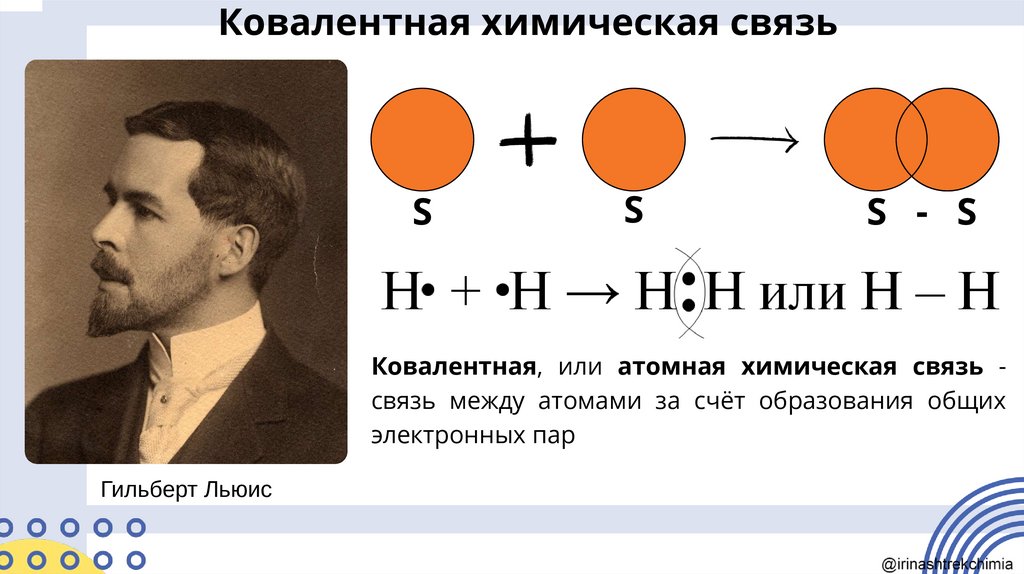
Ковалентная химическая связьS
S
S - S
Ковалентная, или атомная химическая связь связь между атомами за счёт образования общих
электронных пар
Гильберт Льюис
7.
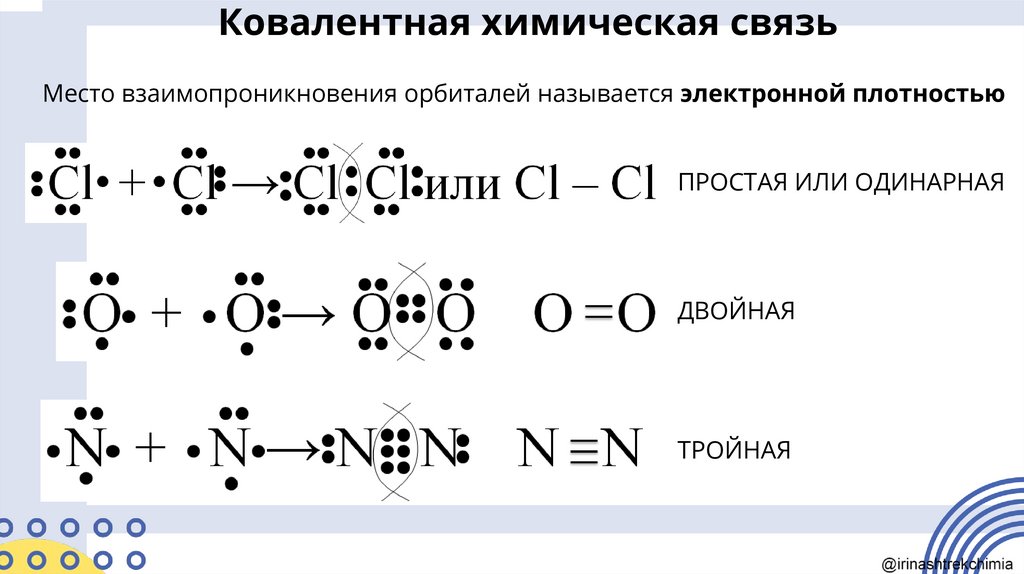
Ковалентная химическая связьМесто взаимопроникновения орбиталей называется электронной плотностью
ПРОСТАЯ ИЛИ ОДИНАРНАЯ
ДВОЙНАЯ
ТРОЙНАЯ
8.
Ковалентная химическая связьКовалентная связь между атомами
ковалентной неполярной связью
одного
элемента
называется
Способность атомов химических элементов оттягивать к себе общие
электронные
пары
ковалентной
связи
называется
электроотрицательностью
УМЕНЬШЕНИЕ ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ
9.
Ковалентная химическая связьКовалентная
связь
между
двумя
атомами
с
различной
электроотрицательность называется ковалентной полярной связью
УГЛОВАЯ ФОРМА
ЛИНЕЙНАЯ ФОРМА
10.
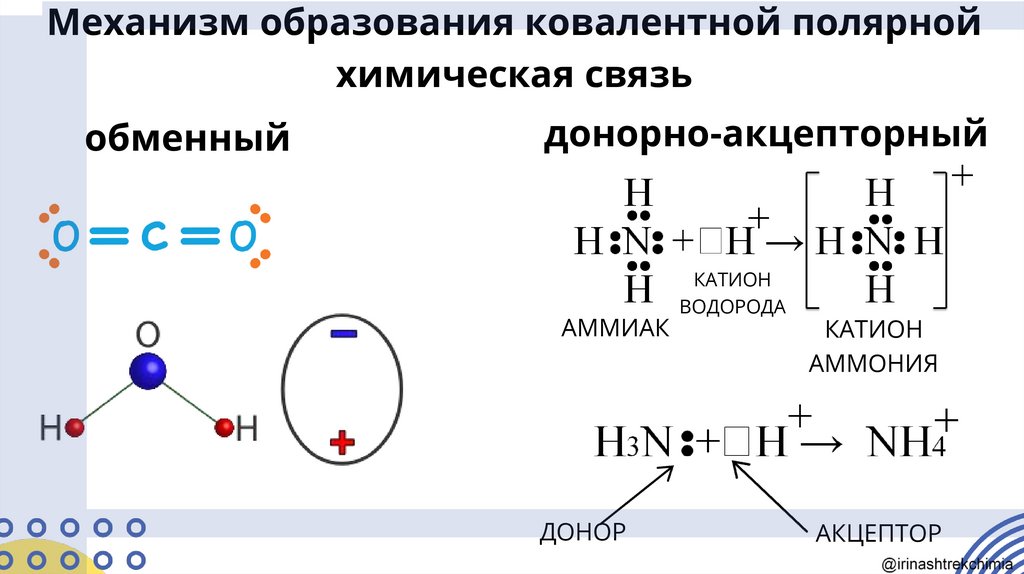
Механизм образования ковалентной полярнойхимическая связь
обменный
донорно-акцепторный
АММИАК
ДОНОР
КАТИОН
ВОДОРОДА
КАТИОН
АММОНИЯ
АКЦЕПТОР
11.
Молекулярная кристаллическая решёткасахар
сухой лёд CO2
белый фосфор
йод
1.В узлах - молекулы
2.Ковалентные связи
3.Вещества хрупкие
4.Легкоплавкие
5.Непрочные
6.С низким температурами
плавления и кипения
7.Летучи
12.
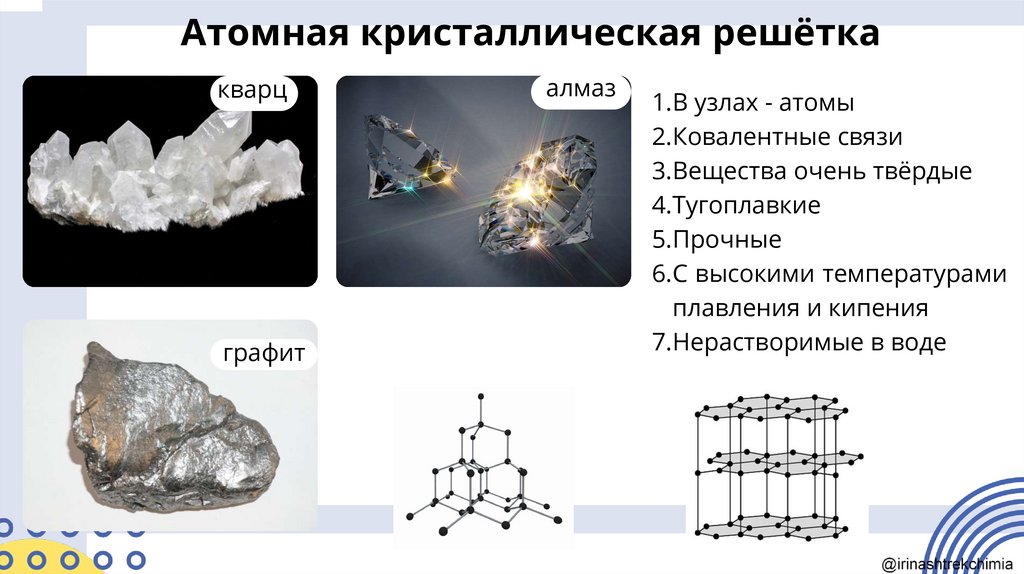
Атомная кристаллическая решёткакварц
графит
алмаз
1.В узлах - атомы
2.Ковалентные связи
3.Вещества очень твёрдые
4.Тугоплавкие
5.Прочные
6.С высокими температурами
плавления и кипения
7.Нерастворимые в воде
13.
Характеристика связиДлина связи — расстояние между ядрами
соответствующее наименьшей энергии молекулы.
связанных
атомов,
Энергия связи — энергия, которую необходимо затратить, чтобы разрушить
связь. Такое же количество энергии выделяется при образовании
химической связи. Энергия ковалентной связи имеет значение
приблизительно от 200 до 1000 кДж/моль.
Прочность связи H—Hal уменьшается от фтора к иоду.
14.
Металлическая химическая связьСвязь в металлах и сплавах между ион-атомами, осуществляемая
совокупностью валентных электронов, называется металлической
связью
ЭЛЕКТРОННЫЙ ГАЗ
Пауль Друде
15.
Металлическая кристаллическая решёткажелезо
алюминий
магний
1.В узлах - атом-ионы
2.Металлическая связь
3.Вещества прочные
4.Теплопродные
5.Электропроводные
6.С высокими
температурами плавления
7.Пластичные
8.Ковкие
9.Металлический блеск
16.
СплавыСплавы - это металлические материалы, получаемые из расплавов двух
или более веществ, одно из которых металл
ЧУГУН
Fe + C
БРОНЗА
Cu + Sn
ЛАТУНЬ
Cu + Zn
МЕЛЬХИОР
Cu + Ni
ДЮРАЛЮМИНИЙ
Al, Cu, Mg, Mn
17.
Водородная химическая связьВодородная связь образуется между атомом водорода, связанным
ковалентной связью с электроотрицательным атомом одной молекулы и
атомами фтора, кислорода, азота другой молекулы, имеющими
неподелённые электронные пары.
Силы Ван-дер-Ваальса (Вандерваа́льсовы
си́лы) — силы межмолекулярного (и
межатомного) взаимодействия с энергией
10—20 кДж/моль.
Йоханнес Дидерик
Ван-дер-Ваальс
18.
Водородная химическая связьАномальные свойства воды
межмолекулярная
Если бы водородных связей не было,
вода закипала бы при температуре - 80
градусов, а замерзала бы при - 100
градусов
Температура воды подо льдом
опускается ниже +4 градусов
Снежинки
связей
-
результат
не
водородных
19.
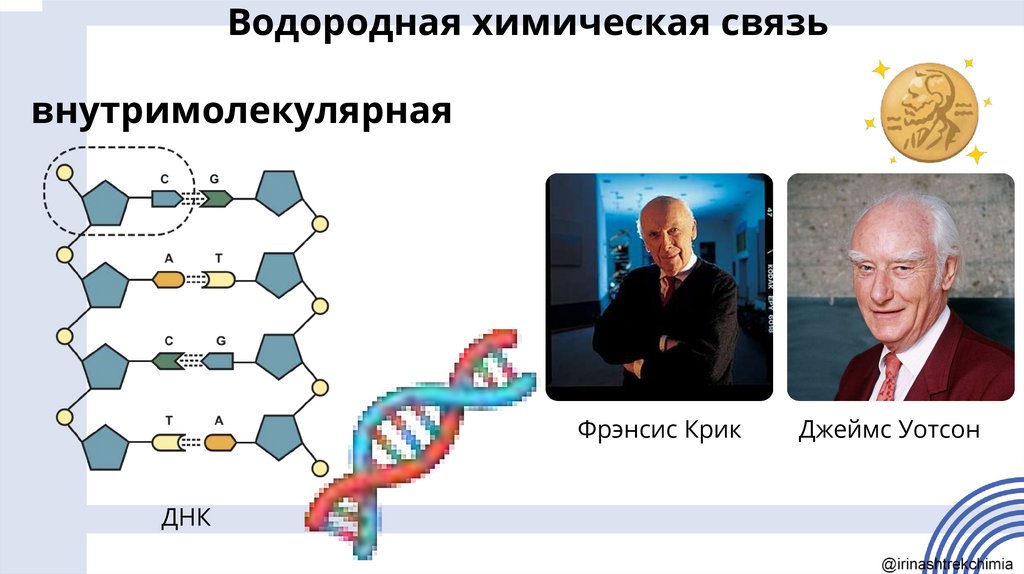
Водородная химическая связьвнутримолекулярная
Фрэнсис Крик
ДНК
Джеймс Уотсон













 Химия
Химия








