Похожие презентации:
Строение вещества. Химическая связь
1.
СТРОЕНИЕ ВЕЩЕСТВАХимическая связь
2.
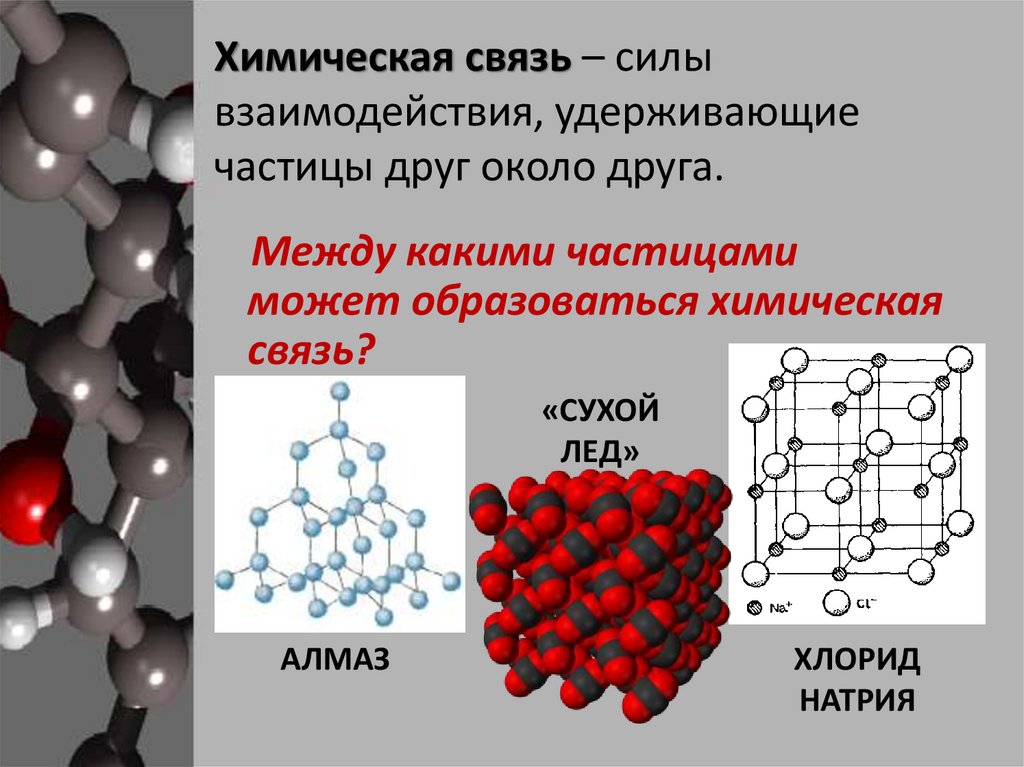
Химическая связь – силывзаимодействия, удерживающие
частицы друг около друга.
Между какими частицами
может образоваться химическая
связь?
«СУХОЙ
ЛЕД»
АЛМАЗ
ХЛОРИД
НАТРИЯ
3.
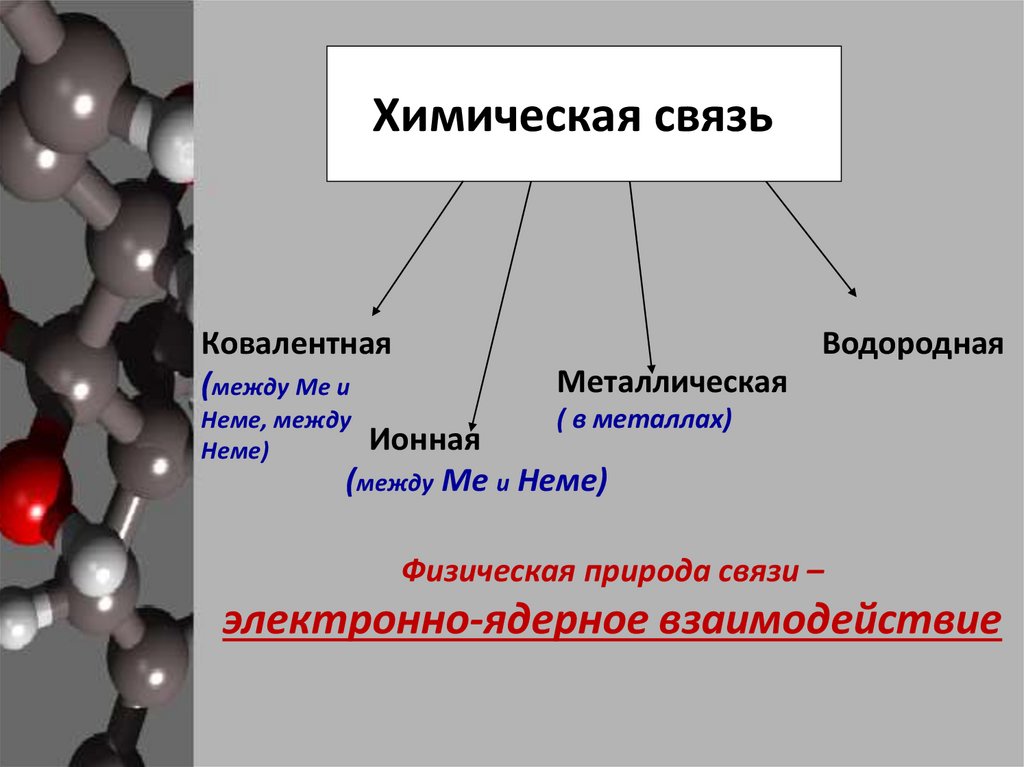
Химическая связьКовалентная
(между Ме и
Неме, между
Неме)
Водородная
Металлическая
( в металлах)
Ионная
(между Ме и Неме)
Физическая природа связи –
электронно-ядерное взаимодействие
4.
Ионная связь • это связь, образующаяся междукатионами и анионами за счет их
электростатического притяжения.
Характерна для соединений,
образованных типичными
металлами и типичными
неметаллами.
Ионные соединения – соли, щелочи,
оксиды щелочных и
щелочноземельных металлов и др.
5.
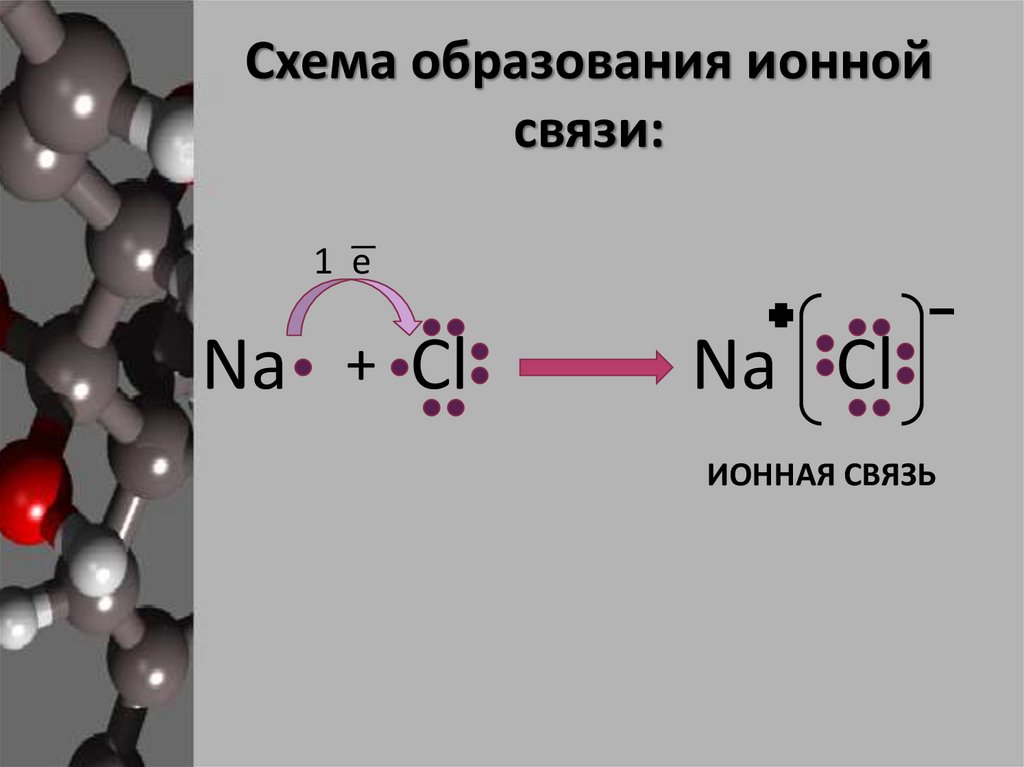
Схема образования ионнойсвязи:
1 е
Na + Cl
Na Cl
ИОННАЯ СВЯЗЬ
6.
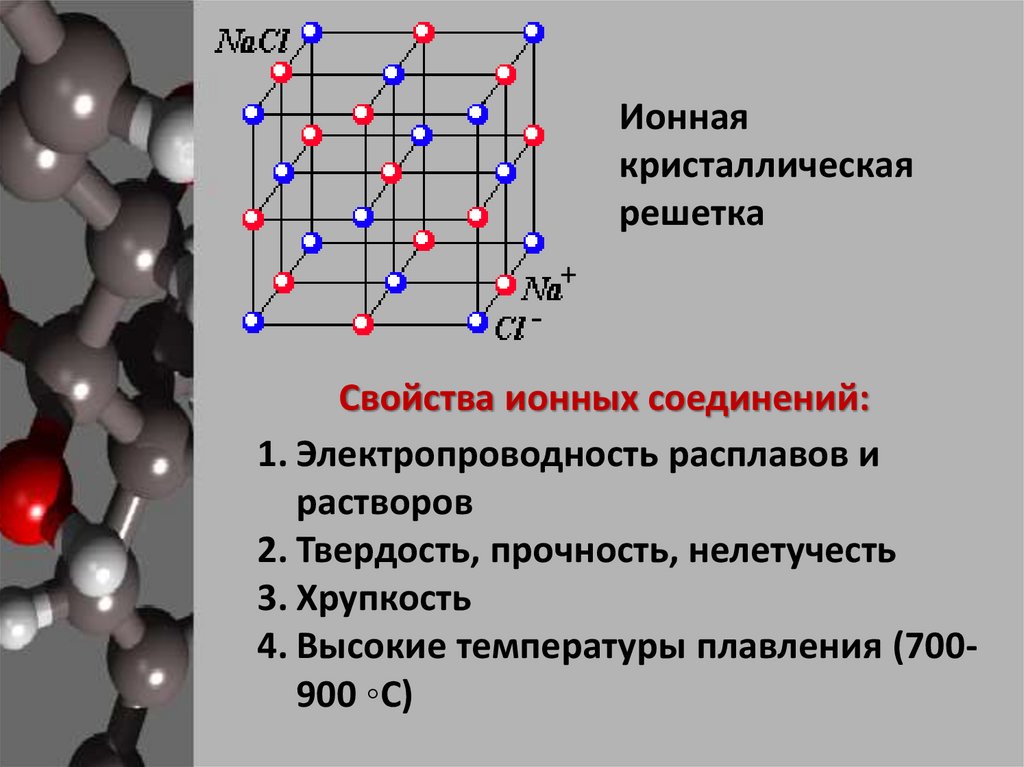
Ионнаякристаллическая
решетка
+
Свойства ионных соединений:
1. Электропроводность расплавов и
растворов
2. Твердость, прочность, нелетучесть
3. Хрупкость
4. Высокие температуры плавления (700900 ◦С)
7.
Какие из приведенных веществотносятся к ионным?
BaCl2, HCl, CaO, NaNO3,
AlCl3, NH4Cl, H2SO4,
NaOH, CO2, LiF
8.
Ковалентная связь • связь, возникающая междуатомами за счет образования
общих электронных пар.
• При образовании ковалентной
связи происходит перекрывание
электронных облаков атомов,
сопровождающееся выделением
энергии.
9.
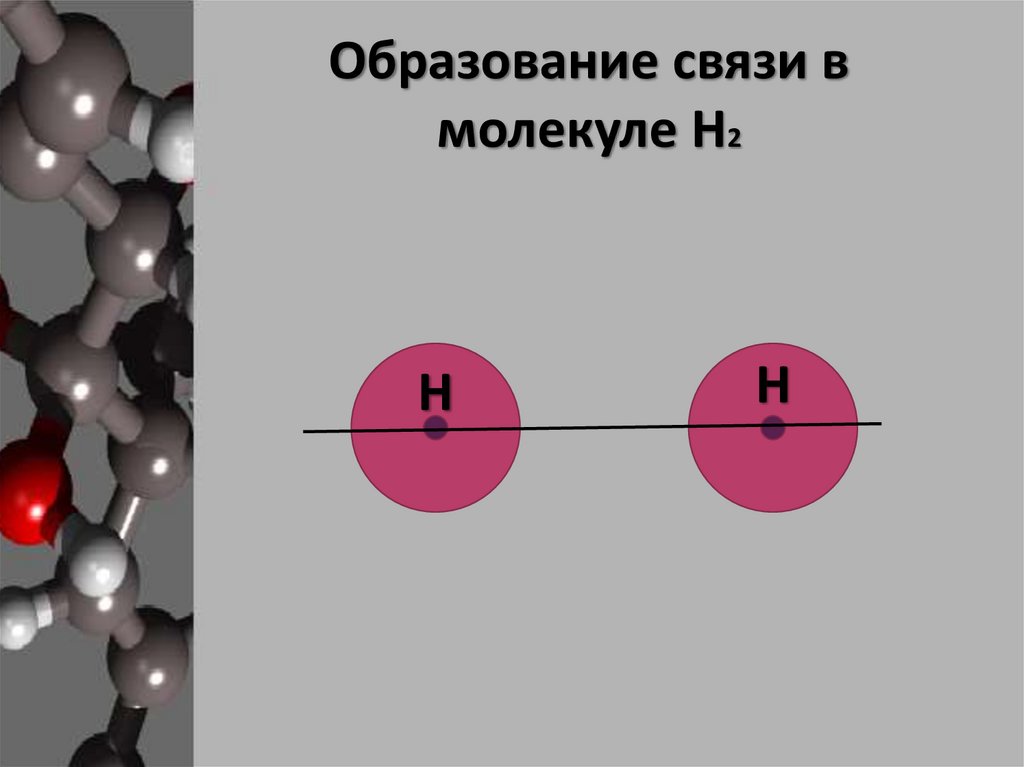
Образование связи вмолекуле Н2
Н
Н
10.
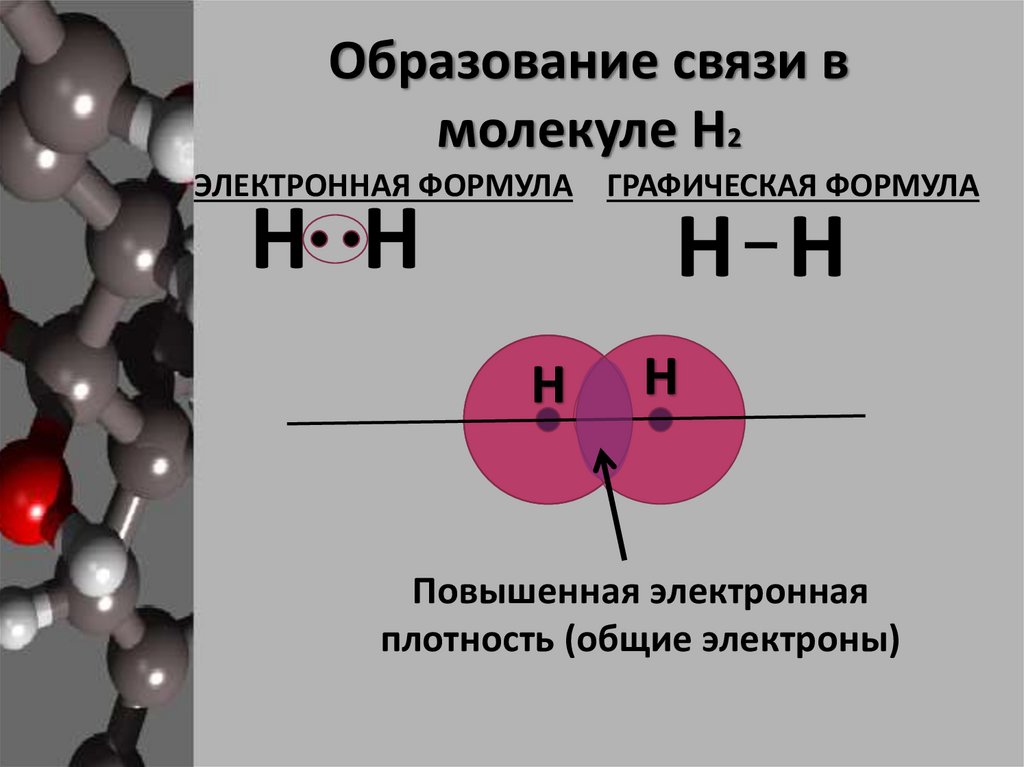
Образование связи вмолекуле Н2
ЭЛЕКТРОННАЯ ФОРМУЛА ГРАФИЧЕСКАЯ ФОРМУЛА
Н Н
Н Н
Н
Н
Повышенная электронная
плотность (общие электроны)
11.
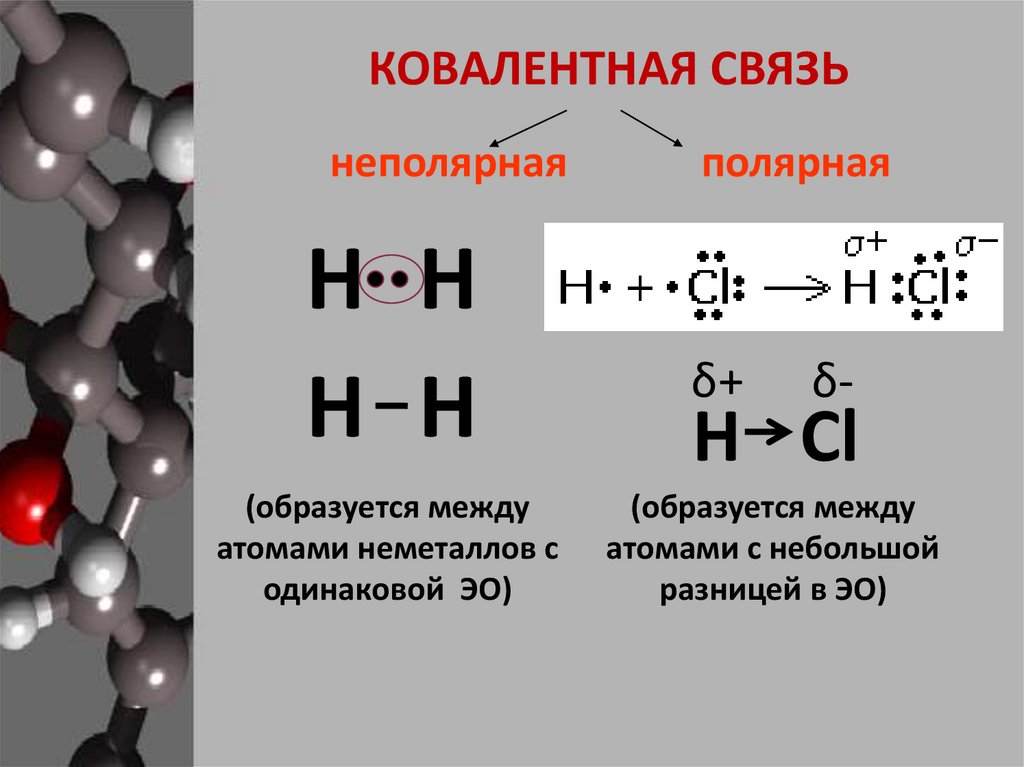
КОВАЛЕНТНАЯ СВЯЗЬнеполярная
Н Н
Н Н
(образуется между
атомами неметаллов с
одинаковой ЭО)
полярная
δ+
δ-
Н Cl
(образуется между
атомами с небольшой
разницей в ЭО)
12.
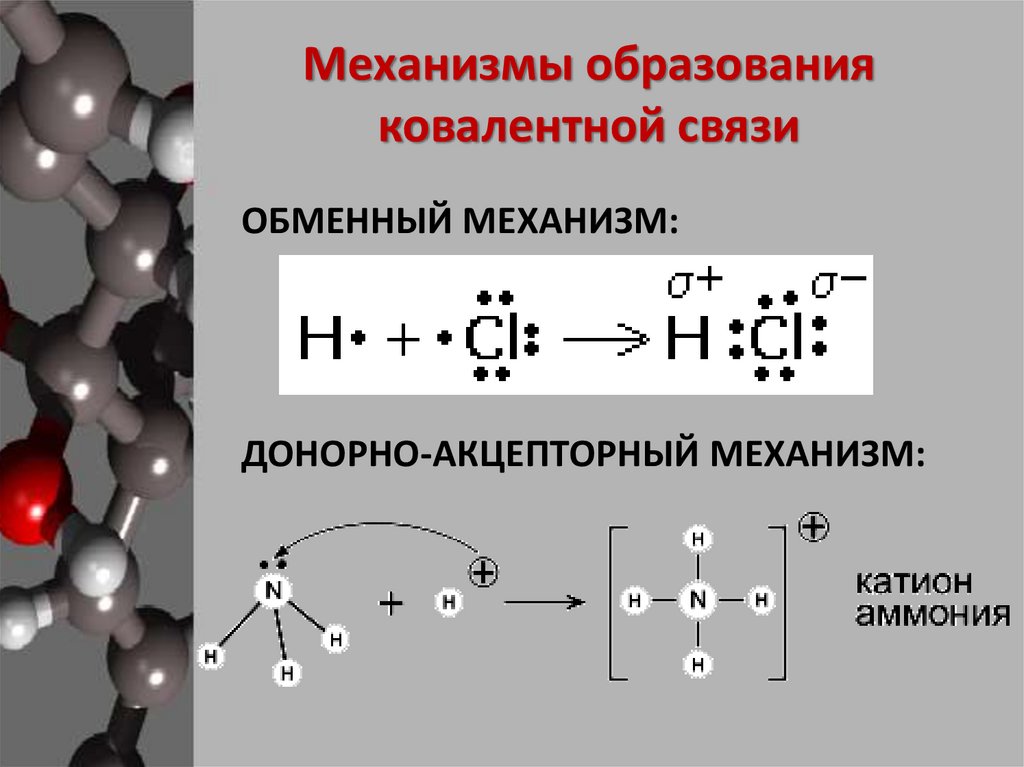
Механизмы образованияковалентной связи
ОБМЕННЫЙ МЕХАНИЗМ:
ДОНОРНО-АКЦЕПТОРНЫЙ МЕХАНИЗМ:
13.
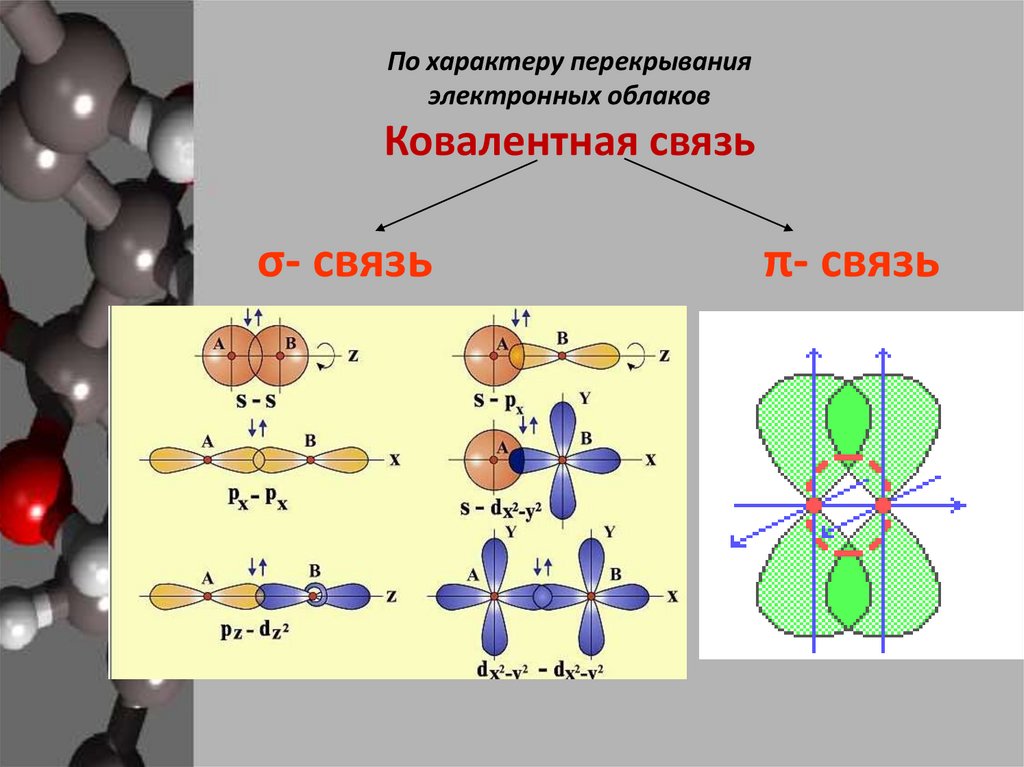
По характеру перекрыванияэлектронных облаков
Ковалентная связь
σ- связь
π- связь
14.
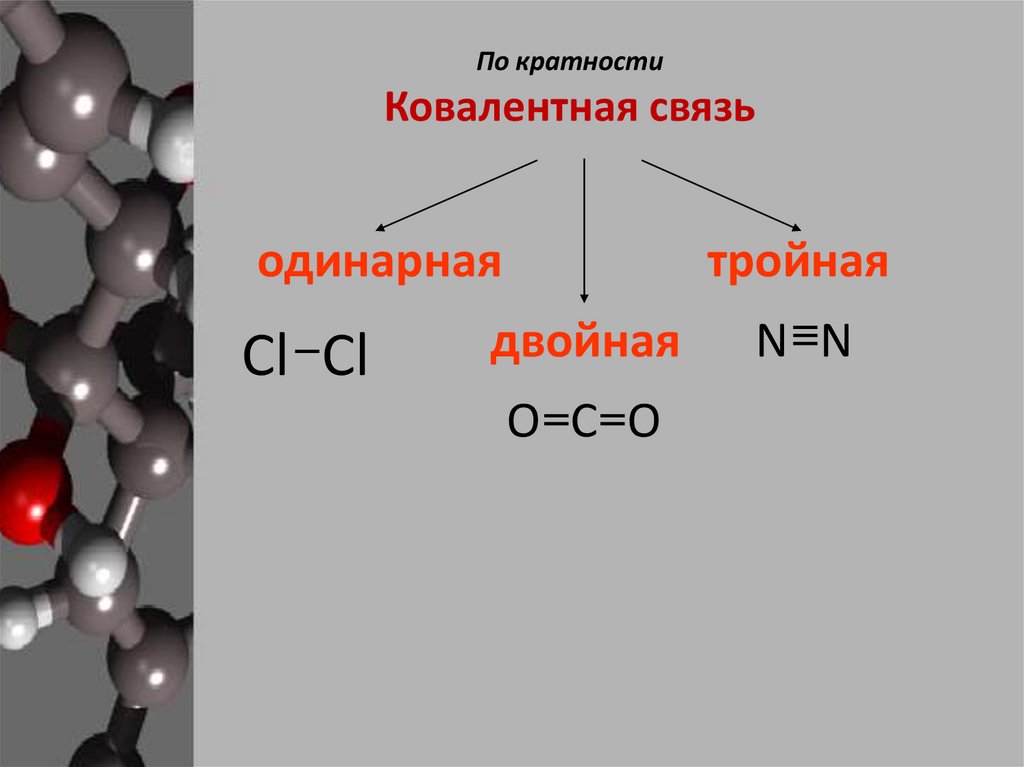
По кратностиКовалентная связь
одинарная
Сl Сl
тройная
двойная
О C О
N N
15.
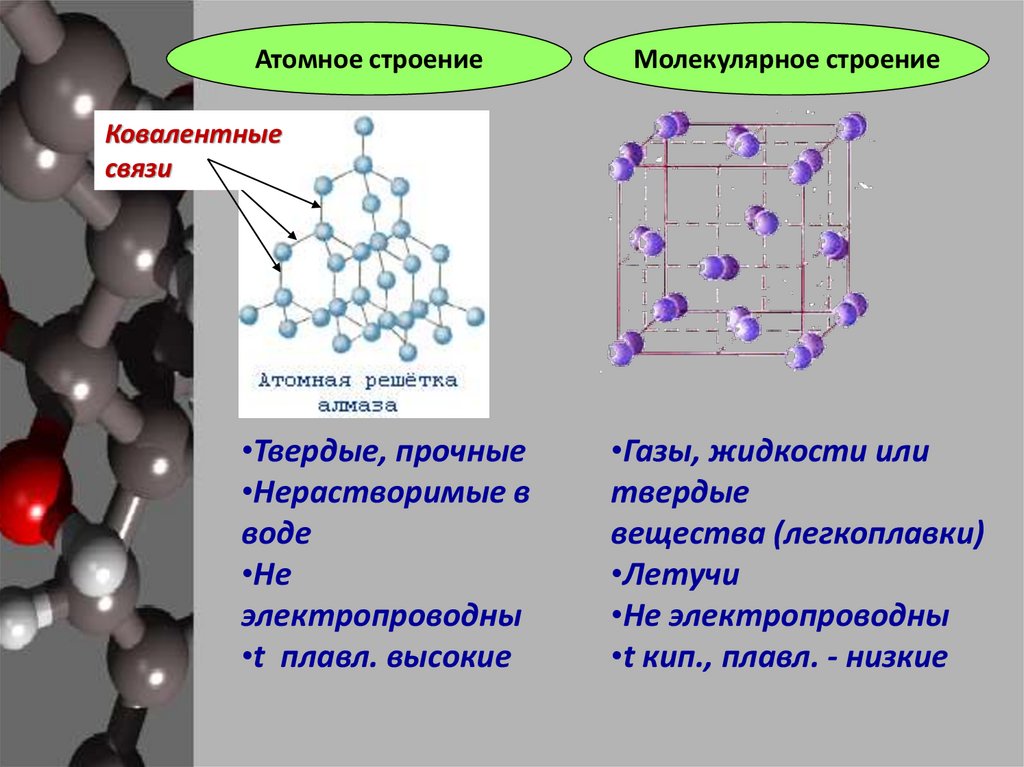
Атомное строениеМолекулярное строение
Ковалентные
связи
•Твердые, прочные
•Нерастворимые в
воде
•Не
электропроводны
•t плавл. высокие
•Газы, жидкости или
твердые
вещества (легкоплавки)
•Летучи
•Не электропроводны
•t кип., плавл. - низкие
16.
Атомное строениеМолекулярное строение
КОРУНД
Al2O3
КВАРЦ
SiO2
КРИСТАЛЛЫ ЛЬДА
Н2О
АЛМАЗ
СЕРА – S8
17.
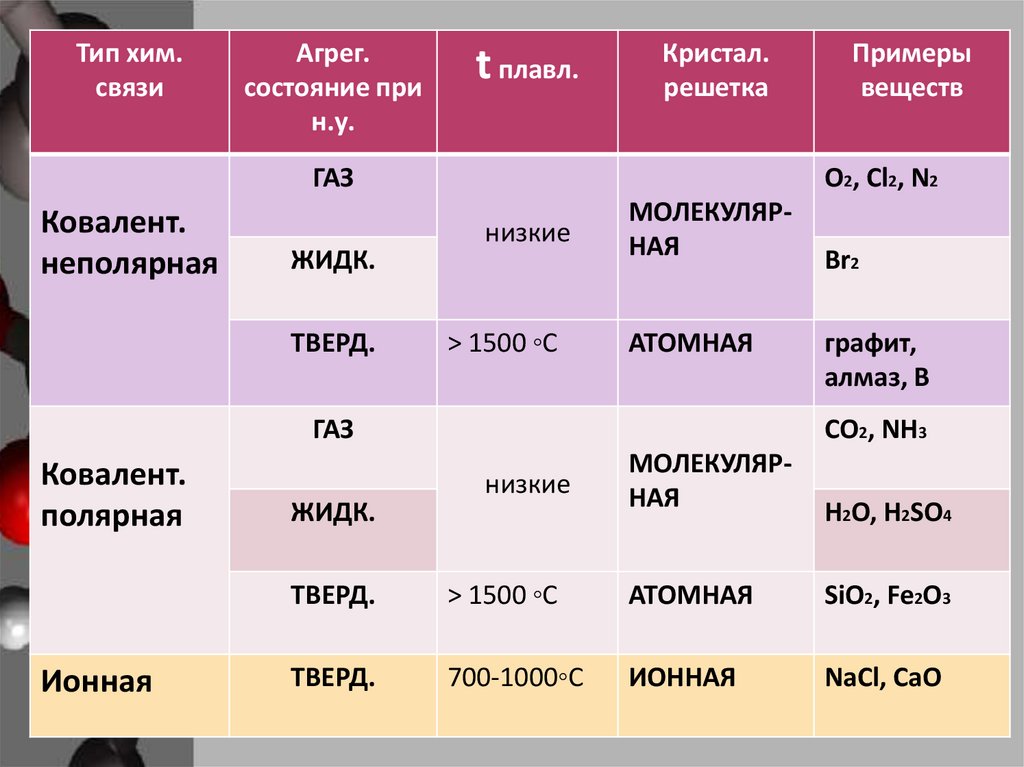
Тип хим.связи
Агрег.
состояние при
н.у.
t плавл.
Кристал.
решетка
ГАЗ
Ковалент.
неполярная
ЖИДК.
ТВЕРД.
О2, Сl2, N2
низкие
> 1500 ◦С
МОЛЕКУЛЯРНАЯ
АТОМНАЯ
ГАЗ
Ковалент.
полярная
Ионная
ЖИДК.
Примеры
веществ
Br2
графит,
алмаз, В
СО2, NH3
низкие
МОЛЕКУЛЯРНАЯ
H2O, H2SO4
ТВЕРД.
> 1500 ◦С
АТОМНАЯ
SiO2, Fe2O3
ТВЕРД.
700-1000◦С
ИОННАЯ
NaCl, CaO
18.
Определите тип химической связи ивид кристаллической решетки в
веществах:
ВaO, H2S, NaBr, NH3,
С(графит), O2, P2O5, Br2,
MgF2, HNO3
19.
Металлическая связь • связь между ион-атомами металлови делокализованными электронами
в простых веществах металлах и их
сплавах. МЕТАЛЛИЧЕСКАЯ КРИСТ.
РЕШЕТКА
20.
Металлическая крист. решетка иметаллическая связь определяют
характерные физические свойства
металлов:
металлический блеск;
пластичность;
высокую электропроводность;
высокую теплопроводность.
21.
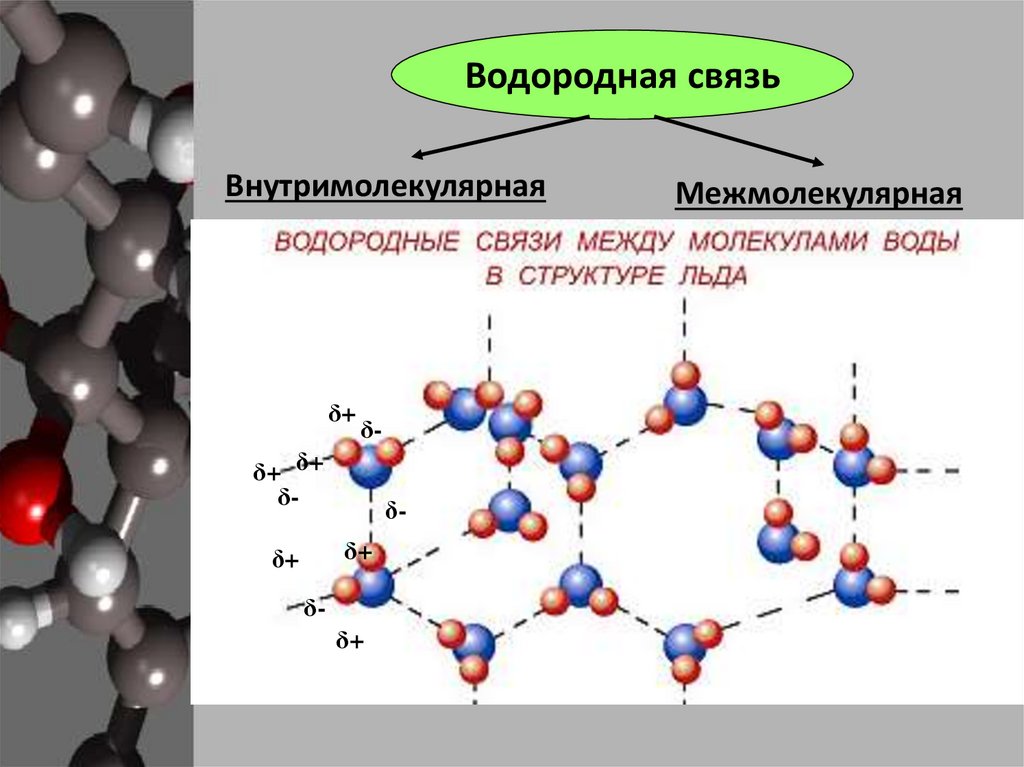
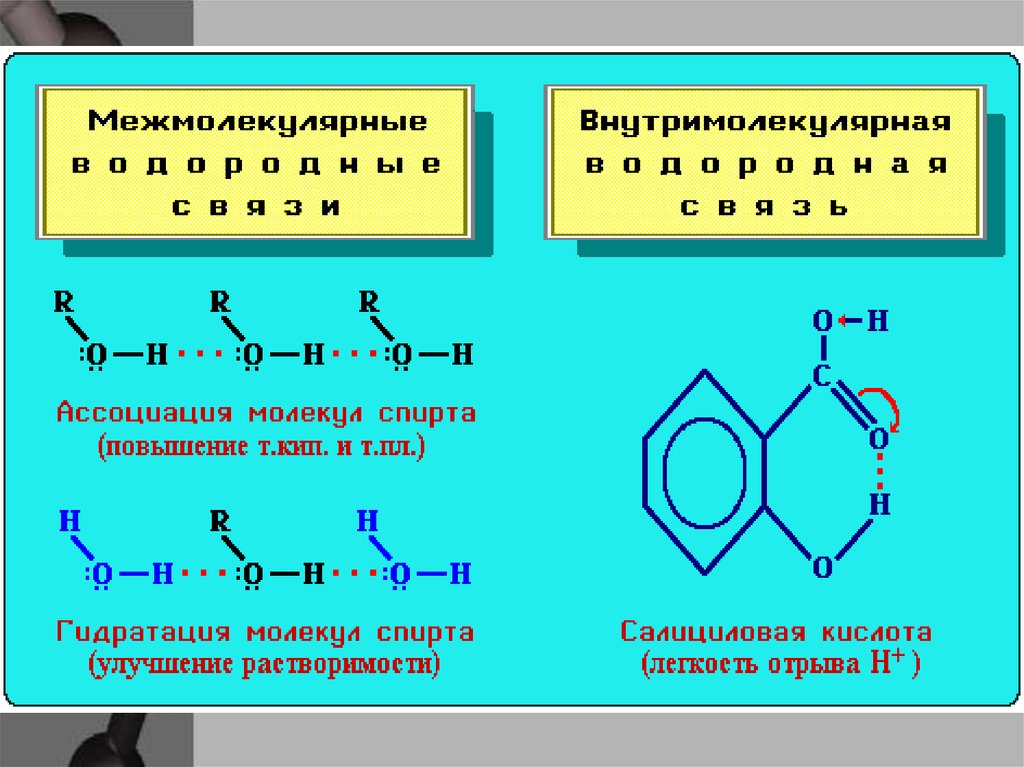
Водородная связь • связь между положительнополяризованным атомом
водорода одной молекулы (или ее
части) и атомами наиболее
электроотрицательных элементов
(F, O, N, Cl) другой молекулы (или ее
части).
22.
Водородная связьВнутримолекулярная
δ+
δ-
δ+ δ+
δ-
δδ+
δ+
δ-
δ+
Межмолекулярная









 Химия
Химия








