Похожие презентации:
Правила работы в лаборатории. Лабораторная посуда и оборудование
1.
ОТКРЫТОЕ ЗАНЯТИЕКОНСПЕКТЫ ЗАНЯТИЙ
2.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Задание 25
Чек-лист по темам 25 задания:
Правила работы в лаборатории
Лабораторная посуда и оборудование
Правила безопасности при работе с едкими, горючими и токсичными веществами, средствами
бытовой химии
Научные методы исследования химических веществ и превращений
Методы разделения смесей и очистки веществ
Понятие о металлургии: общие способы получения металлов
Общие научные принципы химического производства (NH3, H2SO4, HNO3, CH3OH)
Химическое загрязнение окружающей среды и его последствия
Природные источники углеводородов и их переработка
Высокомолекулярные соединения
Реакции полимеризации и поликонденсации
Полимеры. Пластмассы, волокна, каучуки
Часть 1. Методы разделения смесей и очистка веществ
Смеси
гомогенная
гетерогенная
газ + газ
жидкость + жидкость
тв. в-во + тв. в-во
газ + жидкость
твёрдое + жидкость (суспензия)
твёрдое + газ (дым)
нет границы раздела фаз
есть граница раздела фаз
А как понять, растворяются ли друг в друге какие-то конкретные вещества или нет? Очень просто:
ПОДОБНОЕ РАСТВОРЯЕТСЯ В ПОДОБНОМ!
То есть: полярное растворяется в полярном, а неполярное — в неполярном.
С полярностью мы с вами сталкивались на теме «химические связи», поэтому сразу проведём
следующую логическую цепочку: полярность отражает то, насколько велика РАЗНИЦА
ЭЛЕКТРООТРИЦАТЕЛЬНОСТЕЙ между атомами элементов (самыми электроотрицательными при
этом являются F, O, N), то есть насколько сильно один или несколько атомов перетягивают на себя
электронную плотность в молекуле.
Сделаем вывод: как правило (!), если в молекуле присутствует атом о-о-очень
электроотрицательного элемента (F, O, N, Cl, Br), который исходя из этого сильно стягивает на
себя электронную плотность в соединении, то такая молекула полярна (её отрицательно
заряженный полюс находится у самого электроотрицательного атома, положительно заряженный
— на другой стороне молекулы). Если такого атома в молекуле нет — чаще всего она неполярна.
Конспект занятия
1
из
16
3.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Способы разделения смесей
Делительная воронка
Магнит
Способны притягиваться к магниту: Fe, Ni.
Делим несмешивающиеся друг с другом жидкости.
Процесс разделения с помощью магнитного поля --- магнитная
сепарация.
Жидкость с меньшей плотностью «всплывает», с большей --стекает в сосуд. Закрываем кран, когда одна из них полностью
стекла в сосуд.
Примеры: смесь серы и железа, смесь опилок никеля и меди.
Примеры: вода и масло, вода и бензол.
нефть
вода
Fe
S
Обработка водой
Воронка для фильтрования
Делим (чаще всего) воду и нерастворимое в ней твёрдое
вещество.
Разделяем этим способом два твёрдых вещества: одно из них
Вода спокойно проходит через фильтровальную бумажку,
нерастворимое твёрдое вещество остаётся на бумажке.
Если мы обработаем водой смесь NaCl и CaCO3, то первый
Примеры: мел и вода, диоксид кремния и вода.
Примеры: LiCl и кварцевый песок, С и NaCl.
фильтруемая смесь
растворимо в воде, а другое --- нет.
растворится в воде, а второй осядет на дно.
LiCl + SiO2
бумажный фильтр
воронка для фильтрования
→
LiCl (р-р)
SiO2 (осадок)
Выпаривание
Отстаивание
Разделяем растворитель (чаще всего воду) и растворимое в
нём вещество.
Нагреваем раствор — растворитель начинает испаряться и
«улетает» в виде пара, а на дне сосуда остаётся твёрдое
вещество, которое было в нём растворено.
Примеры: вода и NaCl, вода и CuSO4.
Разделяем так любую (практически) гетерогенную смесь!
Просто ждём
Например, если мы имеем смесь песка и воды, то через
некоторое время песок осядет на дно.
Примеры: вода и песок, вода и масло.
H2O
NaCl
NaCl
Конспект занятия
H2O
→
NaCl
SiO2 (песок)
→
→
F тяжести
2
из
16
4.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
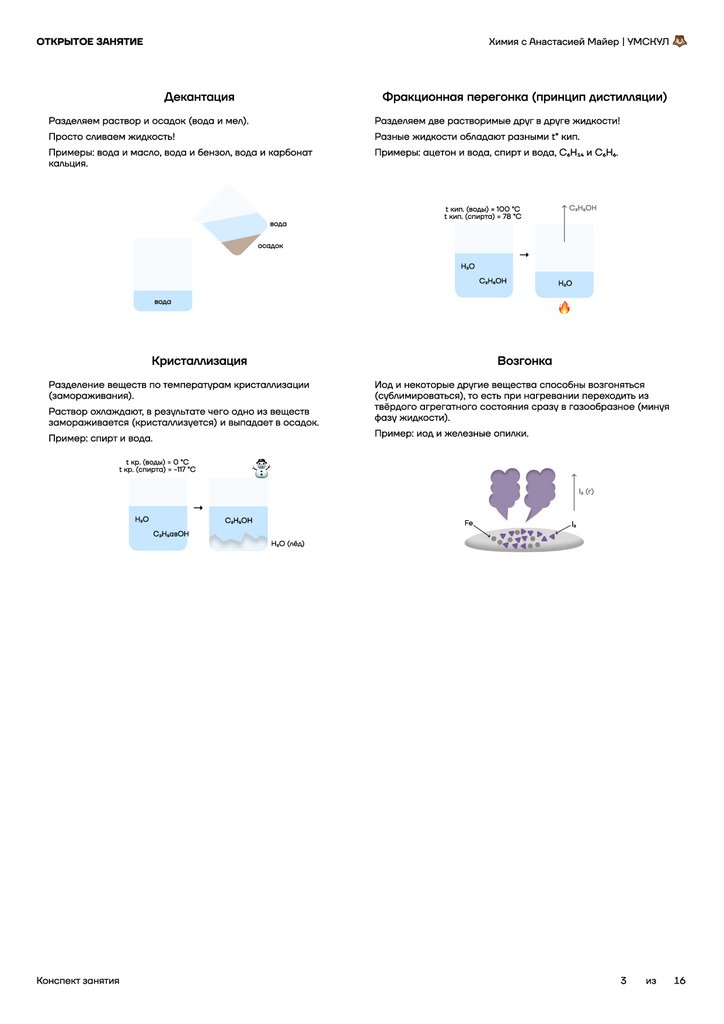
Декантация
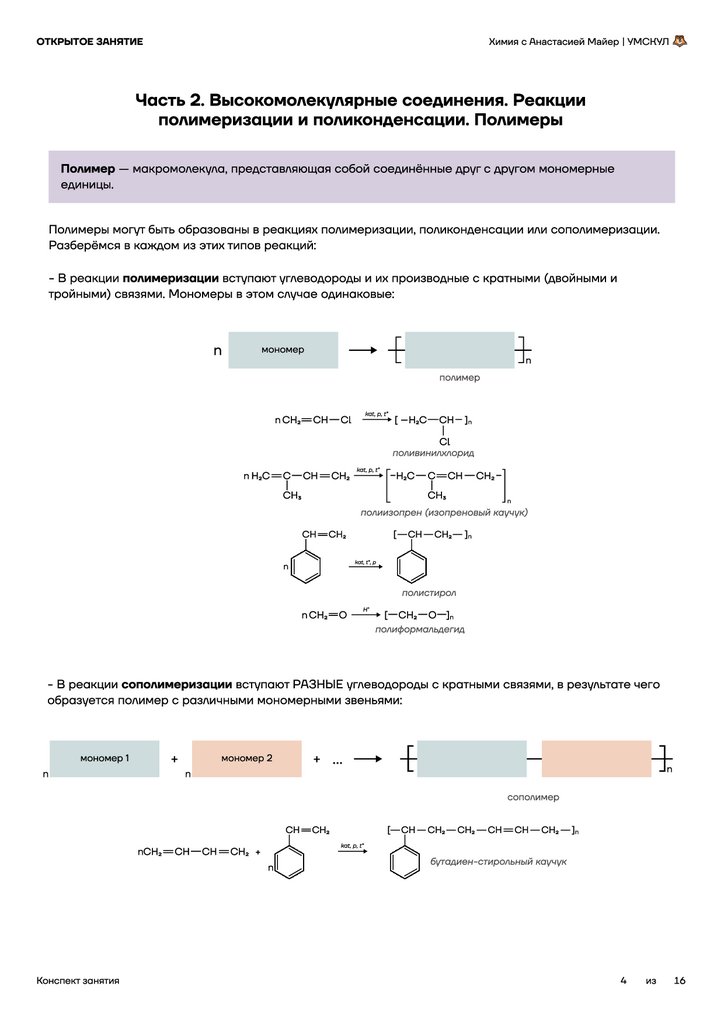
Фракционная перегонка (принцип дистилляции)
Разделяем раствор и осадок (вода и мел).
Разделяем две растворимые друг в друге жидкости!
Просто сливаем жидкость!
Разные жидкости обладают разными t° кип.
Примеры: вода и масло, вода и бензол, вода и карбонат
кальция.
Примеры: ацетон и вода, спирт и вода, C6H14 и C6H6.
вода
t кип. (воды) = 100 °C
t кип. (спирта) = 78 °C
осадок
C2H5OH
→
H2O
C2H5OH
H2O
вода
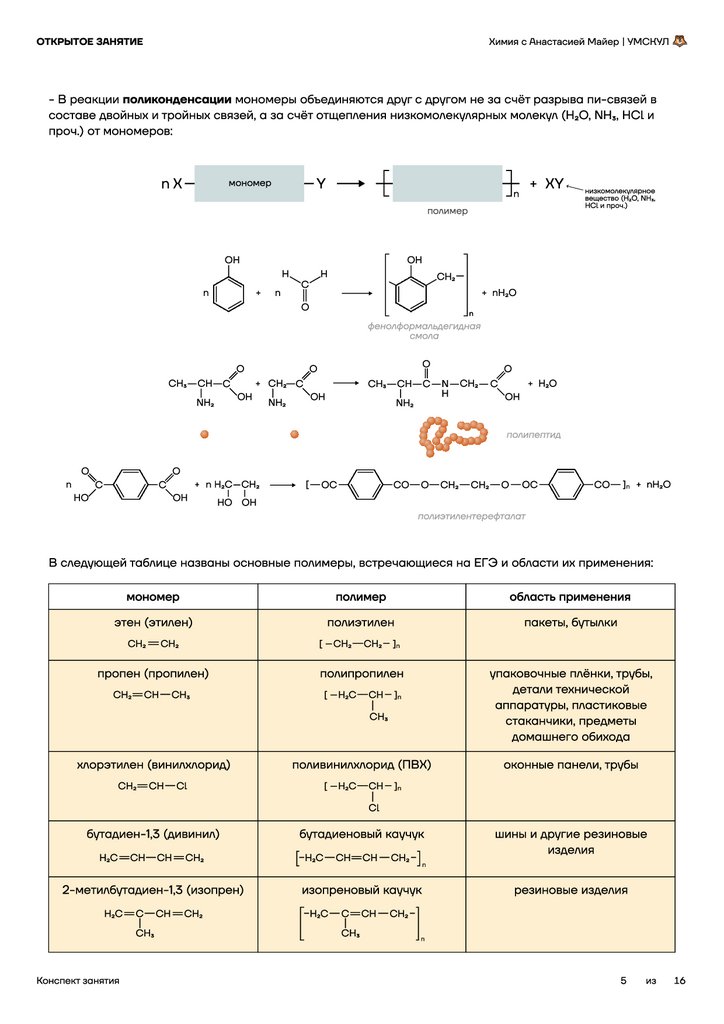
Кристаллизация
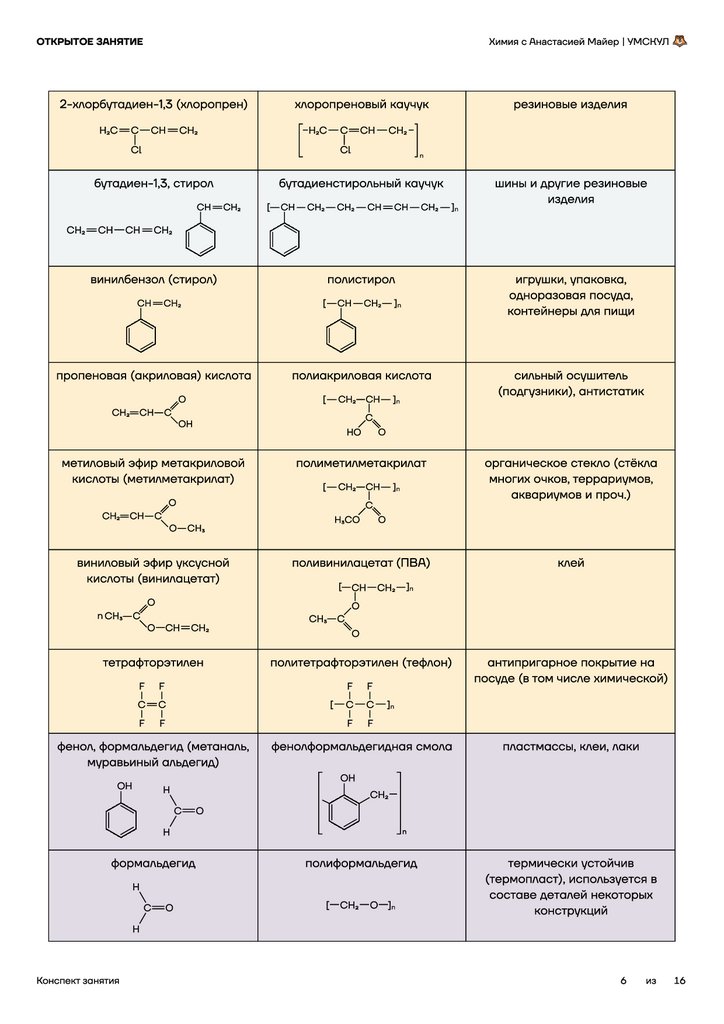
Возгонка
Разделение веществ по температурам кристаллизации
(замораживания).
Раствор охлаждают, в результате чего одно из веществ
замораживается (кристаллизуется) и выпадает в осадок.
Пример: спирт и вода.
Иод и некоторые другие вещества способны возгоняться
(сублимироваться), то есть при нагревании переходить из
твёрдого агрегатного состояния сразу в газообразное (минуя
фазу жидкости).
Пример: иод и железные опилки.
t кр. (воды) = 0 °C
t кр. (спирта) = -117 °C
I2 (г)
→
H2O
C2H5OH
Fe
C2H5авOH
I2
H2O (лёд)
Конспект занятия
3
из
16
5.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Часть 2. Высокомолекулярные соединения. Реакции
полимеризации и поликонденсации. Полимеры
Полимер — макромолекула, представляющая собой соединённые друг с другом мономерные
единицы.
Полимеры могут быть образованы в реакциях полимеризации, поликонденсации или сополимеризации.
Разберёмся в каждом из этих типов реакций:
- В реакции полимеризации вступают углеводороды и их производные с кратными (двойными и
тройными) связями. Мономеры в этом случае одинаковые:
n
[
мономер
n СH2
СH
kat, p, t°
Сl
[
]
n
H2С
СH
]ₙ
Cl
n H2С
С
СH
СH2
kat, p, t°
H2С
СH3
С
СH
СH2
СH3
CH
[
CH2
CH
ₙ
CH2
]ₙ
kat, t°, p
n
n CH2
О
H⁺
[
CH2
О
]ₙ
- В реакции сополимеризации вступают РАЗНЫЕ углеводороды с кратными связями, в результате чего
образуется полимер с различными мономерными звеньями:
мономер 1
мономер 2
+
n
+
[
...
n
CH
nСН2
СH
СH
[
CH2
CH
]
n
CH2
CH2
CH
CH
CH2
]ₙ
kat, p, t°
СH2 +
n
Конспект занятия
4
из
16
6.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
- В реакции поликонденсации мономеры объединяются друг с другом не за счёт разрыва пи-связей в
составе двойных и тройных связей, а за счёт отщепления низкомолекулярных молекул (H2O, NH3, HCl и
проч.) от мономеров:
nX
[
Y
мономер
] + XY
n
OH
OH
H
n
низкомолекулярное
вещество (H2O, NH3,
HCl и проч.)
+
n
H
С
СH2
+ nH2O
О
n
фенолформальдегидная
смола
О
CH3
CH
+ CH2 C
C
OH
NH2
О
О
CH
CH3
OH
NH2
C
NH2
О
N
H
CH2
+ H2O
C
OH
полипептид
О
n
О
C
+ n H2C CH2
C
НО
ОН
[
OC
CO
O
CH2
CH2
O
OC
CO
]ₙ + nH2O
HO OH
полиэтилентерефталат
В следующей таблице названы основные полимеры, встречающиеся на ЕГЭ и области их применения:
мономер
полимер
область применения
этен (этилен)
полиэтилен
пакеты, бутылки
СН2
[
СН2
пропен (пропилен)
СH2
СH
СН2
СН2
]ₙ
полипропилен
СH3
[
H2С
СH
упаковочные плёнки, трубы,
детали технической
аппаратуры, пластиковые
стаканчики, предметы
домашнего обихода
]ₙ
CH3
хлорэтилен (винилхлорид)
СH2
СH
поливинилхлорид (ПВХ)
Сl
[
H2С
СH
оконные панели, трубы
]ₙ
Cl
бутадиен-1,3 (дивинил)
H2С
СH
СH
СH2
2-метилбутадиен-1,3 (изопрен)
H2С
С
СH3
Конспект занятия
СH
СH2
бутадиеновый каучук
H2С
СH
СH
СH2
ₙ
изопреновый каучук
H2С
С
СH3
СH
шины и другие резиновые
изделия
резиновые изделия
СH2
ₙ
5
из
16
7.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
хлоропреновый каучук
2-хлорбутадиен-1,3 (хлоропрен)
С
H2С
СH
СH2
С
H2С
Сl
CH
СH
СH
ₙ
бутадиенстирольный каучук
CH2
[
CH
CH2
CH2
пропеновая (акриловая) кислота
CH2
]ₙ
полиакриловая кислота
CH2
C
полиметилметакрилат
[
CH2
О
]ₙ
CH
C
C
H3CO
CH3
виниловый эфир уксусной
кислоты (винилацетат)
[
CH
CH2
клей
]ₙ
O
C
CH
О
CH2
тетрафторэтилен
F
F
С
С
F
F
CH3
C
О
политетрафторэтилен (тефлон)
[
фенол, формальдегид (метаналь,
муравьиный альдегид)
F
F
С
С
F
F
пластмассы, клеи, лаки
OH
СH2
С
О
H
формальдегид
n
полиформальдегид
H
О
антипригарное покрытие на
посуде (в том числе химической)
]ₙ
фенолформальдегидная смола
H
С
органическое стекло (стёкла
многих очков, террариумов,
аквариумов и проч.)
О
поливинилацетат (ПВА)
О
OH
О
НO
метиловый эфир метакриловой
кислоты (метилметакрилат)
O
]ₙ
CH
сильный осушитель
(подгузники), антистатик
C
OН
CH
игрушки, упаковка,
одноразовая посуда,
контейнеры для пищи
]ₙ
CH2
CH
[
О
CH
n CH3
CH
полистирол
[
CH2
CH
CH2
CH
шины и другие резиновые
изделия
СH2
винилбензол (стирол)
CH2
СH2
Сl
бутадиен-1,3, стирол
СН2
СH
резиновые изделия
[
CH2
О
]ₙ
термически устойчив
(термопласт), используется в
составе деталей некоторых
конструкций
H
Конспект занятия
6
из
16
8.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
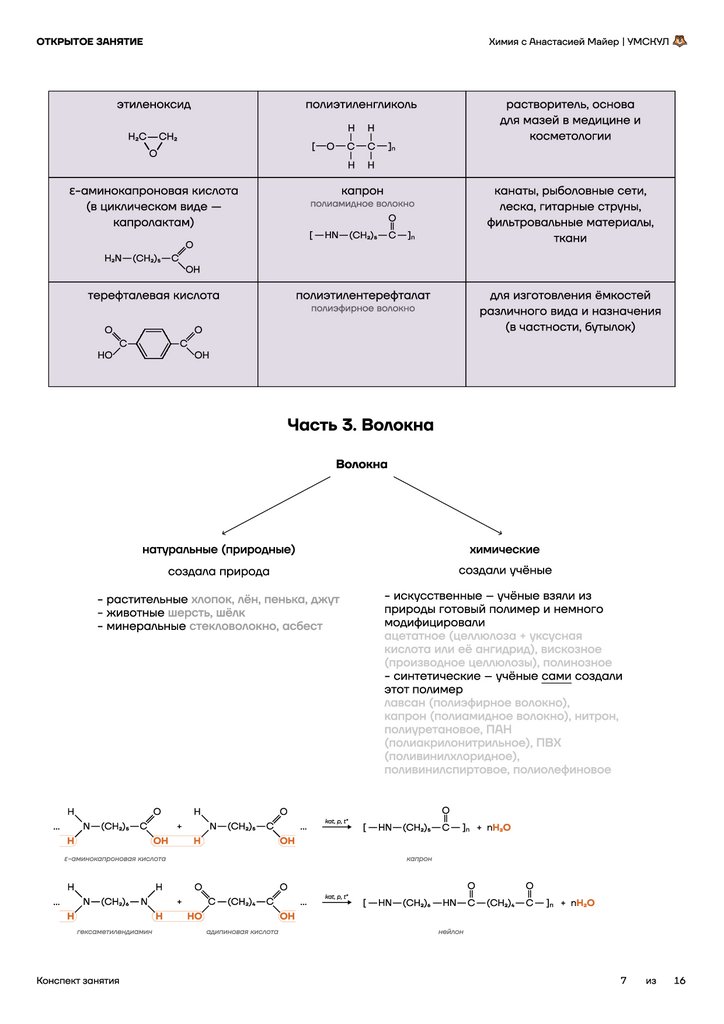
этиленоксид
H2C
полиэтиленгликоль
СH2
[
O
C
H
H
]ₙ
канаты, рыболовные сети,
леска, гитарные струны,
фильтровальные материалы,
ткани
О
[
HN
(CH2)5
C
]ₙ
OН
терефталевая кислота
О
НO
H
С
полиамидное волокно
О
(CH2)5
H
С
капрон
ε-аминокапроновая кислота
(в циклическом виде —
капролактам)
H2N
O
растворитель, основа
для мазей в медицине и
косметологии
полиэтилентерефталат
для изготовления ёмкостей
различного вида и назначения
(в частности, бутылок)
полиэфирное волокно
О
C
C
OН
Часть 3. Волокна
Волокна
натуральные (природные)
химические
создала природа
создали учёные
- растительные хлопок, лён, пенька, джут
- животные шерсть, шёлк
- минеральные стекловолокно, асбест
- искусственные -- учёные взяли из
природы готовый полимер и немного
модифицировали
ацетатное (целлюлоза + уксусная
кислота или её ангидрид), вискозное
(производное целлюлозы), полинозное
- синтетические -- учёные сами создали
этот полимер
лавсан (полиэфирное волокно),
капрон (полиамидное волокно), нитрон,
полиуретановое, ПАН
(полиакрилонитрильное), ПВХ
(поливинилхлоридное),
поливинилспиртовое, полиолефиновое
H
...
О
N
(CH2)5
C
H
+
H
OН
H
H
H
О
...
N
(CH2)6
H
Конспект занятия
N
НO
(CH2)5
C
...
kat, p, t°
О
[
HN
(CH2)5
C
]ₙ + nH2O
OН
О
C
+
H
О
N
(CH2)4
C
...
kat, p, t°
О
[
HN
(CH2)6
HN
C
О
(CH2)4
C
]ₙ + nH2O
OН
7
из
16
9.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Часть 4. Природные источники углеводородов и их переработка
Самым главным источником углеводородов является нефть, добываемая из нефтяных скважин.
Основными её компонентами являются углеводороды: в основном, алканы, циклоалканы и арены
(алкены, алкадиены и алкины гораздо более реакционноспособны, поэтому в свободном виде в нефти
практически не существуют).
1. Первичная переработка нефти — физическая. Фракционная перегонка.
Цель первичного этапа переработка
нефти — её разделение на фракции.
Как мы уже знаем, смесь
углеводородов, хорошо растворимых
друг в друге, можно разделить только
фракционной перегонкой, то есть
разделить по температурам кипения.
Этот процесс происходит в
ректификационной колонне, а в
результате перегонки образуется
несколько фракций нефти,
характеризующихся (как мы уже
поняли) разными температурами
кипения: бензин, лигроин, керосин,
газойль.
Смесь карбенов, нефтяных смол, металлосодержащих органических веществ, которая остаётся на дне
ректификационной колонны, называется мазутом.
2. Вторичная переработка нефти --- химическая. Пиролиз, крекинг, ароматизация, изомеризация.
Цель вторичного этапа переработки нефти заключается в том, чтобы повысить качество топлива,
получаемого на выходе, в частности, бензина.
Но как это сделать? Дело в том, что качество бензина зависит от так называемого октанового числа: чем
разветвлённее углеводород, тем выше октановое число, а значит, выше качество бензина и его
устойчивость к детонации (взрыву). При этом ароматические углеводороды всегда предполагают более
хорошие показатели качества и высокие октановые числа.
Следовательно, во вторичном этапе переработки нефти используются такие типы реакций, как:
- пиролиз и крекинг (получение более реакционноспособных углеводородов с кратными связями):
C16H34
t°
C8H18 + C8H16
- изомеризация (получение разветвлённых изомеров углеводородов):
H3С
CH2
CH2
CH3
CH3
AlCl3
H3С
CH
CH3
- ароматизация (получение ароматических углеводородов):
C6H14
Конспект занятия
Pt, t°
+ 4H2
Pt, t°
+ 3H2
8
из
16
10.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
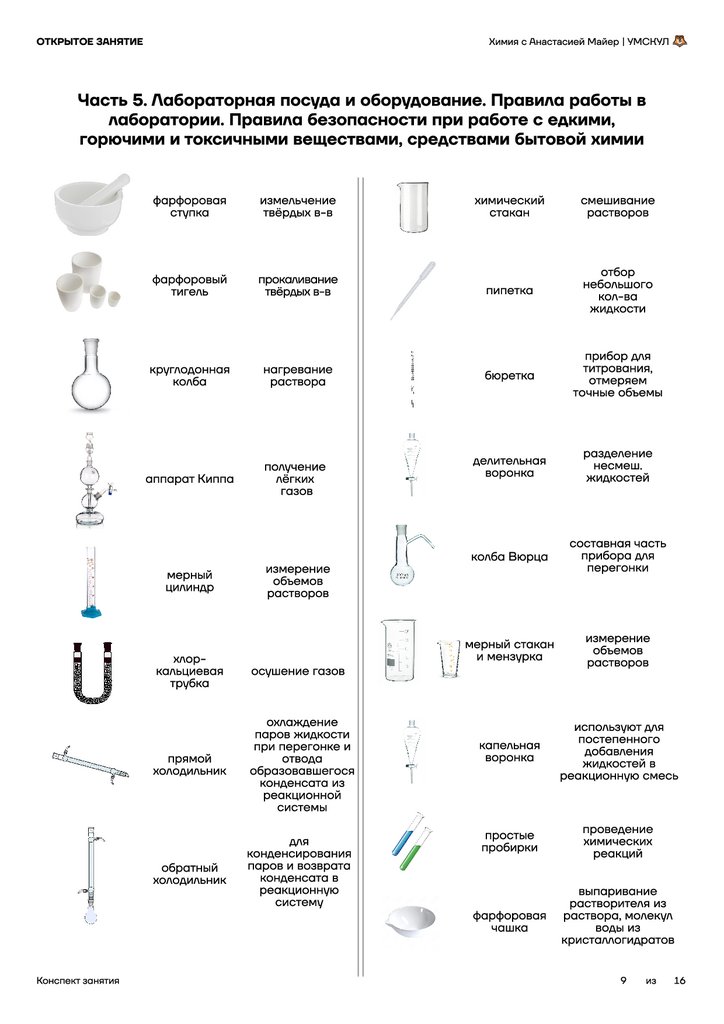
Часть 5. Лабораторная посуда и оборудование. Правила работы в
лаборатории. Правила безопасности при работе с едкими,
горючими и токсичными веществами, средствами бытовой химии
фарфоровая
ступка
измельчение
твёрдых в-в
фарфоровый
тигель
химический
стакан
смешивание
растворов
прокаливание
твёрдых в-в
пипетка
отбор
небольшого
кол-ва
жидкости
круглодонная
колба
нагревание
раствора
бюретка
прибор для
титрования,
отмеряем
точные объемы
аппарат Киппа
получение
лёгких
газов
делительная
воронка
разделение
несмеш.
жидкостей
колба Вюрца
составная часть
прибора для
перегонки
мерный стакан
и мензурка
измерение
объемов
растворов
капельная
воронка
используют для
постепенного
добавления
жидкостей в
реакционную смесь
простые
пробирки
проведение
химических
реакций
мерный
цилиндр
Конспект занятия
измерение
объемов
растворов
хлор-
кальциевая
трубка
осушение газов
прямой
холодильник
охлаждение
паров жидкости
при перегонке и
отвода
образовавшегося
конденсата из
реакционной
системы
обратный
холодильник
для
конденсирования
паров и возврата
конденсата в
реакционную
систему
фарфоровая
чашка
выпаривание
растворителя из
раствора, молекул
воды из
кристаллогидратов
9
из
16
11.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
шпатель
отбор небольшой
порции твёрдого
вещества
стеклянная
палочка
перемешивание
Техника безопасности в лаборатории
⋅ желательно не работать в лаборатории одному;
⋅ тишина, чистота, порядок;
⋅ запрещены хранение и принятие пищи, курение;
⋅ средства индивидуальной защиты;
⋅ халат, перчатки, очки и прочее;
⋅ проводить опыты в соответствующих условиях;
⋅ сливать использованные реактивы в отдельный слив.
Ну и что ты опять пролил на себя?
щёлочь
кислоту
решение
H3BO3
NaHCO3
ЦВЕТА ГОРЕНИЯ ПЛАМЕНИ
Li⁺
Na⁺
K⁺
Rb⁺
Cs⁺
Ca²⁺
Sr²⁺
Ba²⁺
Cu²⁺
Pb²⁺
BO3³⁻
малиновый
жёлтый
фиолетовый
тёмно-
красный
небесно-
голубой
кирпичнокрасный
карминовокрасный
жёлто-
зелёный
зелёный
бледно-
голубой
зелёный
Конспект занятия
10
из
16
12.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Задание №25: часть 2. Задание №24
Часть 6. Общие научные принципы химического производства
(NH3, H2SO4, HNO3, CH3OH).
Промышленное производство отличается от лабораторного своими объёмами, из-за чего требует более
дешёвого сырья для получения нужных веществ. В качестве исходного материала чаще всего служат
воздух, вода, горная порода (минералы), нефть, уголь, природный газ (главная составляющая — метан),
древесина (составляющие — целлюлоза и лигнин).
Конспект занятия
ректификация
воздуха
пиролиз метана
(из природного газа)
N2
H2
турбокомпрессор
смешивание реагентов,
сжатие смеси, t°
колонна синтеза
возвращение N2 и H2 в начало
1) Производство аммиака NH3
Аммиак синтезируется из простых веществ —
азота (получают ректификацией воздуха) и
водорода (получают пиролизом метана,
добытого из природного газа).
Сначала азот и водород смешивают друг с другом.
Полученную смесь сжимают и нагревают в
турбокомпрессоре (т. к. повышение давления и
температуры повышает скорость реакции и выход
продукта). Далее происходит непосредственно
синтез аммиака из азота и водорода в колонне
синтеза. Реакция обратимая, экзотермическая и
каталитическая: в качестве катализатора
используется платина или губчатое железо.
Далее производят охлаждение образовавшейся
смеси, состоящей из аммиака и
непрореагировавших азота и водорода, в
холодильнике и её разделение в сепараторе,
после чего азот и водород возвращают в начало
по принципу циркуляции.
Процесс получения аммиака непрерывный, для
оптимизации производства в процессе него
используются принципы циркуляции и
теплообмена*.
* Принцип циркуляции: непрореагировавшие азот
и водород каждый раз возвращаются в начало,
что обеспечивает практически 100%-ный выход.
* Принцип теплообмена: реакция азота с
водородом экзотермическая, то есть протекает с
выделением теплоты, которая тем временем
нагревает исходную смесь, что способствует
повышению скорости реакции.
Синтез из простых веществ:
N2 + 3H2 = 2NH3 + Q
Реакция: обратимая,
каталитическая,
экзотермическая.
холодильник
охлаждение смеси N2, H2, NH3
t°↓
сеператор
разделение смеси
NH3
11
из
16
13.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
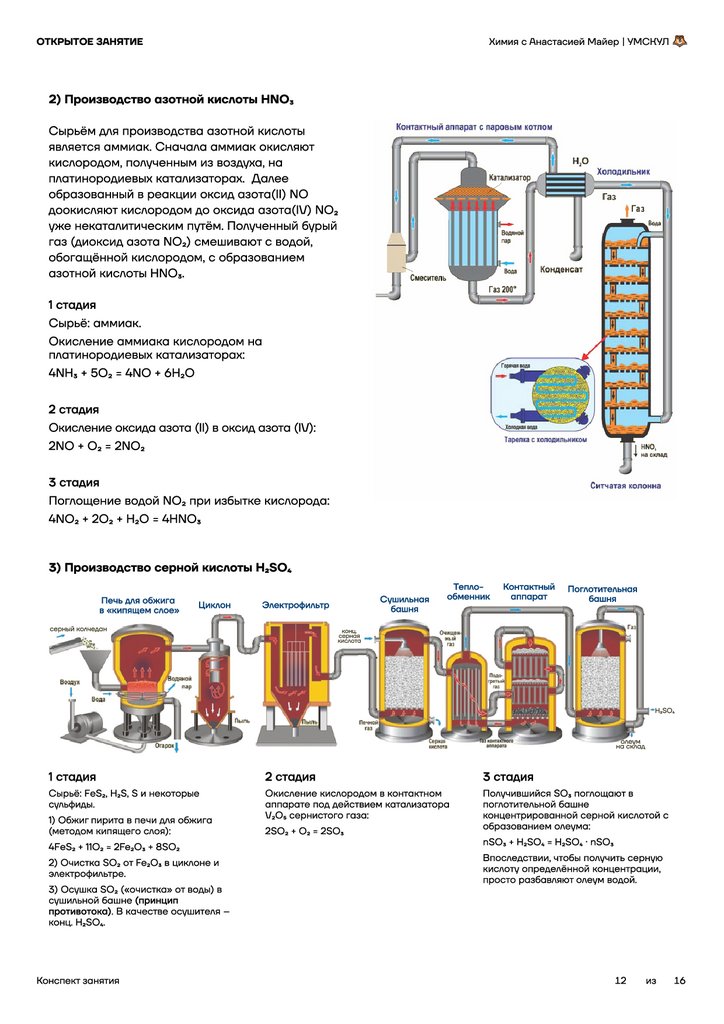
2) Производство азотной кислоты HNO3
Сырьём для производства азотной кислоты
является аммиак. Сначала аммиак окисляют
кислородом, полученным из воздуха, на
платинородиевых катализаторах. Далее
образованный в реакции оксид азота(II) NO
доокисляют кислородом до оксида азота(IV) NO2
уже некаталитическим путём. Полученный бурый
газ (диоксид азота NO2) смешивают с водой,
обогащённой кислородом, с образованием
азотной кислоты HNO3.
1 стадия
Сырьё: аммиак.
Окисление аммиака кислородом на
платинородиевых катализаторах:
4NH3 + 5O2 = 4NO + 6H2O
2 стадия
Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
3 стадия
Поглощение водой NO2 при избытке кислорода:
4NO2 + 2O2 + H2O = 4HNO3
3) Производство серной кислоты H2SO4
Печь для обжига
в «кипящем слое»
Циклон
Сушильная
башня
Электрофильтр
серный колчедан
Тепло-
обменник
Контактный
аппарат
Поглотительная
башня
конц.
серная
кислота
H2SO4
Газ контактного
аппарата
1 стадия
Сырьё: FeS2, H2S, S и некоторые
сульфиды.
1) Обжиг пирита в печи для обжига
(методом кипящего слоя):
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2) Очистка SO2 от Fe2O3 в циклоне и
электрофильтре.
3) Осушка SO2 («очистка» от воды) в
сушильной башне (принцип
противотока). В качестве осушителя –
конц. H2SO4.
Конспект занятия
олеум
на склад
2 стадия
3 стадия
Окисление кислородом в контактном
аппарате под действием катализатора
V2O5 сернистого газа:
Получившийся SO3 поглощают в
поглотительной башне
концентрированной серной кислотой с
образованием олеума:
2SO2 + O2 = 2SO3
nSO3 + H2SO4 = H2SO4 ⋅ nSO3
Впоследствии, чтобы получить серную
кислоту определённой концентрации,
просто разбавляют олеум водой.
12
из
16
14.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
* Метод кипящего слоя позволяет увеличить площадь соприкосновения реагентов (частичек пирита и
кислорода) и тем самым повысить скорость реакции.
зона
протекания
реакции
подача
воздуха
* Принцип противотока, использующийся в осушительной и поглотительной башнях, говорит о том, что
реагенты движутся навстречу друг другу (т. е. в противоположных направлениях). При этом
обеспечивается более эффективный теплообмен, благодаря чему скорость реакции и выход продукта
повышаются.
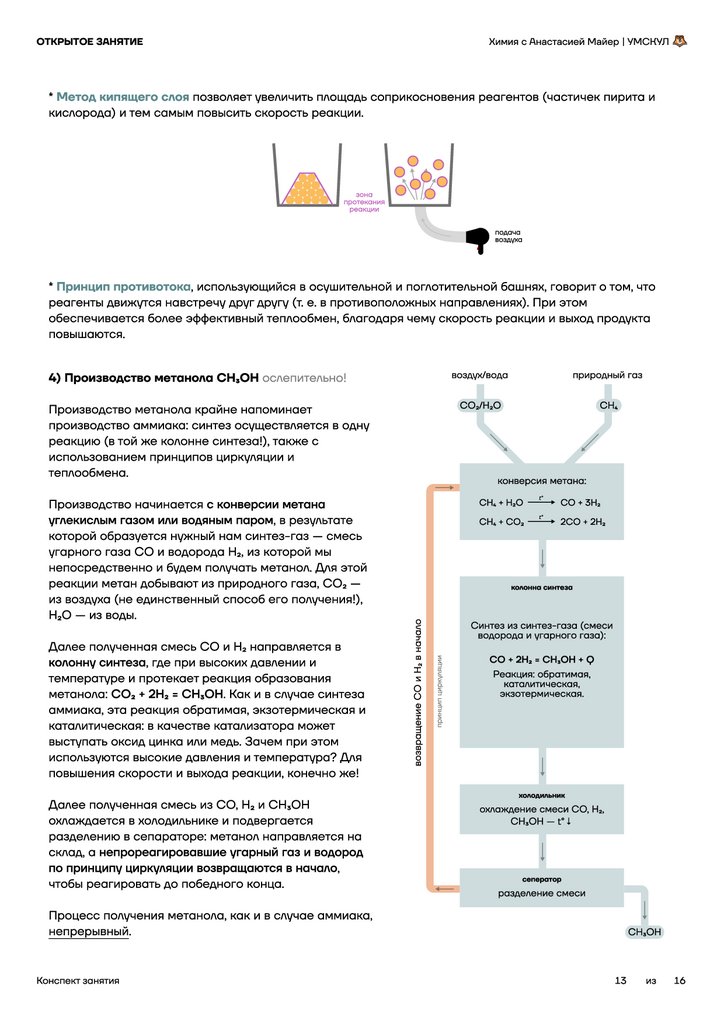
4) Производство метанола CH3OH ослепительно!
Производство метанола крайне напоминает
производство аммиака: синтез осуществляется в одну
реакцию (в той же колонне синтеза!), также с
использованием принципов циркуляции и
теплообмена.
Конспект занятия
природный газ
CO2/H2O
CH4
конверсия метана:
CH4 + H2O
t°
СO + 3H2
CH4 + CO2
t°
2СO + 2H2
колонна синтеза
возвращение CO и H2 в начало
Производство начинается с конверсии метана
углекислым газом или водяным паром, в результате
которой образуется нужный нам синтез-газ — смесь
угарного газа CO и водорода H2, из которой мы
непосредственно и будем получать метанол. Для этой
реакции метан добывают из природного газа, CO2 —
из воздуха (не единственный способ его получения!),
H2O — из воды.
Далее полученная смесь CO и H2 направляется в
колонну синтеза, где при высоких давлении и
температуре и протекает реакция образования
метанола: CO2 + 2H2 = CH3OH. Как и в случае синтеза
аммиака, эта реакция обратимая, экзотермическая и
каталитическая: в качестве катализатора может
выступать оксид цинка или медь. Зачем при этом
используются высокие давления и температура? Для
повышения скорости и выхода реакции, конечно же!
Далее полученная смесь из CO, H2 и CH3OH
охлаждается в холодильнике и подвергается
разделению в сепараторе: метанол направляется на
склад, а непрореагировавшие угарный газ и водород
по принципу циркуляции возвращаются в начало,
чтобы реагировать до победного конца.
Процесс получения метанола, как и в случае аммиака,
непрерывный.
воздух/вода
Синтез из синтез-газа (смеси
водорода и угарного газа):
CO + 2H2 = CH3OH + Q
Реакция: обратимая,
каталитическая,
экзотермическая.
холодильник
охлаждение смеси CO, H2,
CH3OH — t°↓
сеператор
разделение смеси
СH3OH
13
из
16
15.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Часть 7. Уже пройденный материал. Получение и применение
некоторых органических и неорганических веществ. Аллотропные
модификации
Применение некоторых веществ
H2O2, I2 (в р-рах)
- дезинфектанты
H2O2 — отбеливающее средство (осветление
волос!)
Азотная кислота HNO3
Производство динамита и взрывчатки
(нитроглицерин, 2,4,6-тринитротолуол)
Поваренная соль NaCl
Консервирование продуктов
Алюминий Al
Авиа- и машиностроение (очень лёгкий!)
N-, P-, K-содержащие соединения (в частности
селитры – нитраты активных металлов и аммония,
а также фосфаты, гидрофосфаты кальция,
суперфосфат)
Удобрения
NaHCO3 (пищевая сода)
- Пищевая промышленность
- Разрыхлитель теста + чистящее средство
NH3⋅H2O
NH3
- Медицина
- Сырьё для получения азотной кислоты и азотных
удобрений (селитр)
SiO2, Na2CO3, CaCO3
Производство стекла, керамических изделий
Ацетон, бензол, гексан, CCl4 (неполярный!),
спирты
Растворители
O2, C, CO, H2, Al, Mg, Ca
Металлургия (в том числе получение стали и
чугуна)
O3, Cl2
NaClO, Ca(ClO)2
Дезинфекция и очистка воды
Благородные (инертные) газы
Создание инертной атмосферы
Активированный уголь
- Адсорбент в фильтрах
- Адсорбент в медицине (адсорбирует токсины и
проч. при отравлениях)
- Катализатор для получения бензола из
ацетилена
CH3COOH
- Консервирование
- Волокна (ацетилцеллюлоза)
Этилен, хлор, хлорэтилен, бензол, стирол и проч.
Пластмассы
C2H5OH
- Основной компонент алкогольных напитков
- Растворитель (полярный)
- Топливо
Конспект занятия
14
из
16
16.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Глицерин
- Парфюмерия
- Пищевая промышленность
Пальмитат натрия или калия
Стеарат натрия или калия
Мыла (натриевые соли – твёрдые мыла, калиевые
– жидкие)
Углеводороды
Топливо
Изопрен, хлоропрен, бутадиен-1,3
S
Каучуки
Вулканизация каучука
C2H2 (ацетилен)
Сварка и резка металлов
Лимонная кислота
Удаление накипи
Анилин
Производство красителей
ПВХ (поливинилхлорид)
Оконные панели, трубы
Полистирол
Игрушки, упаковка, одноразовая посуда,
контейнеры для пищи
Поликарбонат
Линзы, компакт-диски, фары, компьютеры, очки,
светотехнические изделия
Метан
Топливо (в том числе для газовых плит)
Карбамид
Производство удобрений
Этилацетат
Растворитель
Этиленгликоль
Антифриз
Аллотропные модификации
Углерод
Графит (атомная КР), алмаз (атомная КР), фуллерен (молекулярная
КР), карбин, графен и проч.
Кислород
Кислород O2, озон O3 (донорно-акцепторный механизм!).
Фосфор
Белый (молекулярная КР), красный (атомная КР), чёрный (атомная
КР).
Белый – самый активный (его даже хранят под водой, чтобы ни с кем
не реагировал и не самовозгорался), чёрный – самый неактивный.
Сера
Ромбическая, моноклинная, пластическая.
Сурьма
Серая, чёрная, жёлтая, взрывчатая.
Олово
Белое, серое.
Мышьяк
Жёлтый, серый, чёрный (аналогично фосфору, мышьяк стоит в таблице
Менделеева в одной группе с ним!).
Конспект занятия
15
из
16
17.
Химия с Анастасией Майер | УМСКУЛОТКРЫТОЕ ЗАНЯТИЕ
Получение некоторых веществ
* электролиз расплава Al2O3
в криолите Na3[AlF6]
возможно постепенное восстановление
Fe2O3 → Fe3O4 (FeO·Fe2O3) → FeO → Fe
Li Rb K Ba Sr Ca Na Mg Al Mn Cr Zn Fe Cd Co Ni Sn Pb
ТОЛЬКО электролиз
расплавов галогенидов
(электрометаллургия)
2NaCl (расплав, эл. ток) =
= 2Na + Cl2
Sb Bi Cu Hg Ag Pd Pt Au
1) электролиз растворов солей (электрометаллургия)
2CuSO4 + 2H2O (р-р, эл. ток) = 2Cu + O2 + 2H2SO4
2) восстановление из оксидов сильным восстановителем при высокой
температуре (пирометаллургия)
CuO + CO (t) = Cu + CO2
3) вытеснение из растворов солей более активным металлом
(гидрометаллургия)
Fe + CuSO4 = FeSO4 + Cu
O2, N2
Ректификация воздуха
CO2
Выделение из дымовых газов
F2
Электролиз расплавов фторидов
H2, O2
Электролиз воды
Cl2
Электролиз растворов хлоридов
P4, CO
2Ca3(PO4)2 + 10C + 6SiO2 = P4 + 10CO + 6CaSiO3
Si
Восстановление коксом из диоксида кремния
Fe
Из гематита Fe2O3, пирита FeS2
Cu
Из халькопирита CuFeS2
Al
Электролиз расплава Al2O3 в криолите Na3[AlF6]
Na
Электролиз расплавов гидроксида и хлорида натрия
C2H5OH
Спиртовое брожение
Бензин
Крекинг нефтепродуктов
Динамит/взрывчатка
Конспект занятия
(H)
Нитрование глицерина/толуола
16
из
16









 Химия
Химия








