Похожие презентации:
Карбонильные соединения. Альдегиды и кетоны
1.
Карбонильные соединения.Классификация, номенклатура, изомерия.
Физические свойства.
Способы получения: окисление и дегидрирование спиртов, озонолиз алкенов, гидролиз
геминальных дигалогенопроизводных углеводородов, декарбоксилирование карбоновых
кислот и их солей, гидратация алкинов по Кучерову, ацилирование аренов реакцией
Фриделя –Крафтса.
Электронное строение и физические параметры карбонильной группы, полярность и
поляризуемость связи С=О и общая характеристика реакционной способности карбонильных
соединений.
Реакции нуклеофильного присоединения AN. Сравнение реакционной способности
альдегидов и кетонов.
Реакции нуклеофильного присоединения C-, N-, O- и S-нуклеофилов.
Реакции нуклеофильного замещения кислорода карбонильной группы азотистыми
основаниями (аммиаком, аминами, гидроксиламином, гидразином, фенилгидразином).
Реакции конденсации альдегидов и кетонов с С-нуклеофилами: альдольно-кротоновая
конденсация.
Реакции мягкого окисления альдегидов: реакция серебряного зеркала с аммиачным
раствором оксида серебра, окисление реактивом Фелинга (гидроксид меди II).
Восстановление карбонильных соединений: каталитическое гидрирование, восстановление
карбонильной группы активными металлами (метод Клеменсена) и комплексными гидридами
металлов.
Реакции электрофильного замещения в ароматическом ряду – нитрования,
галогенирования, сульфирования. Качественные реакции альдегидов и кетонов.
Основные представители: формальдегид, уксусный альдегид, ацетон, бензойный
альдегид, применение.
2.
Альдегиды и кетоны – углеводороды,которые
содержат
в
молекуле
функциональную группу: карбонильная
O
C
Если карбонильная группа связана с одним
углеводородным радикалом – альдегиды, с
двумя – кетоны
O
R C
H
альдегиды
Общая формула: CnH2nO
O
R C R
кетоны
3.
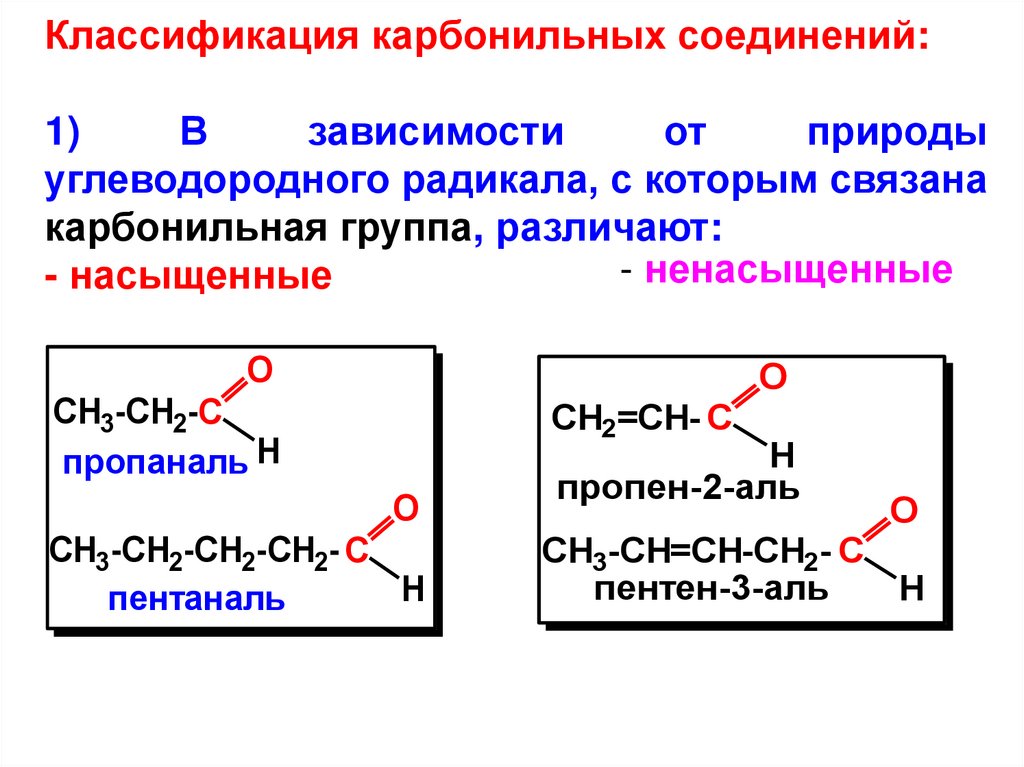
Классификация карбонильных соединений:1)
В
зависимости
от
природы
углеводородного радикала, с которым связана
карбонильная группа, различают:
- ненасыщенные
- насыщенные
O
O
CH3-CH2-C
пропаналь H
CH2=CH- C
O
CH3-CH2-CH2-CH2- C
H
пентаналь
H
пропен-2-аль
O
CH3-CH=CH-CH2- C
пентен-3-аль
H
4.
O-ароматические
С
H
бензальдегид
- жирноароматические, которые содержат
карбонил в боковой цепи
2
1
CH2 С
O
H
2-фенилэтаналь
5.
НоменклатураРациональная:
к
названию
углеводородных
радикалов
добавляется
название основы – уксусный альдегид или
O
кетон
CH3 O
СH3 CH C CH3
метилизопропилкетон
CH2
H
фенилуксусный
альдегид
O
CH2 CH CH2 С
С
H
винилуксусный альдегид
6.
Систематическая:название
альдегидов
производят
от
соответствующего
углеводорода, добавляя суффикс –аль, атом
углерода
альдегидной
группы
начинает
нумерацию
-кетонов производят от соответствующего
углеводорода, добавляя суффикс –он, а
нумерацию ведут с той стороны, где ближе
карбонильная группа
O
6
5
4
2
3
1
СH2 CH CH2 C CH2 CH3
гексен-5-он-3
5
4
3
2
1 O
СH3 CH CH2 CH C
H
OH
Cl
7.
Изомерия обусловлена:-строением углеводородного ради-кала,
связанного с карбонильной группой
-положением карбонильной группы для
кетонов
O
O
CH3-CH2-CH2-CH2-C
H
O
CH3-CH-CH2-C
CH3
H
CH3-CH2-C-CH2-CH3
O
CH3-C-CH2-CH2-CH3
8.
Способы получения1. Окисление алкенов кислородом воздуха
в присутствии катализатора PdCl2 (реакция
Вакера)
O2
H2C CH2 + PdCl2 + H2O
O
CH3 C + Pd + HCl
H
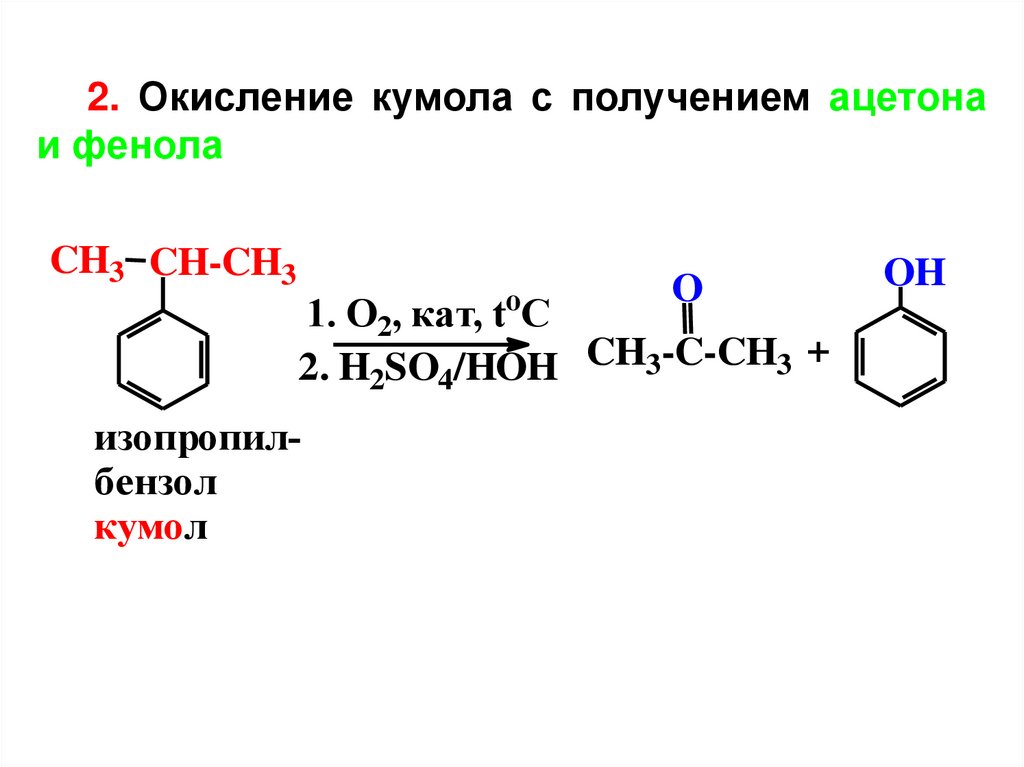
9.
2. Окисление кумола с получением ацетонаи фенола
CH3 CH-CH3
O
1. O2, кат, toC
2. H2SO4/HOH CH3-C-CH3 +
изопропилбензол
кумол
OH
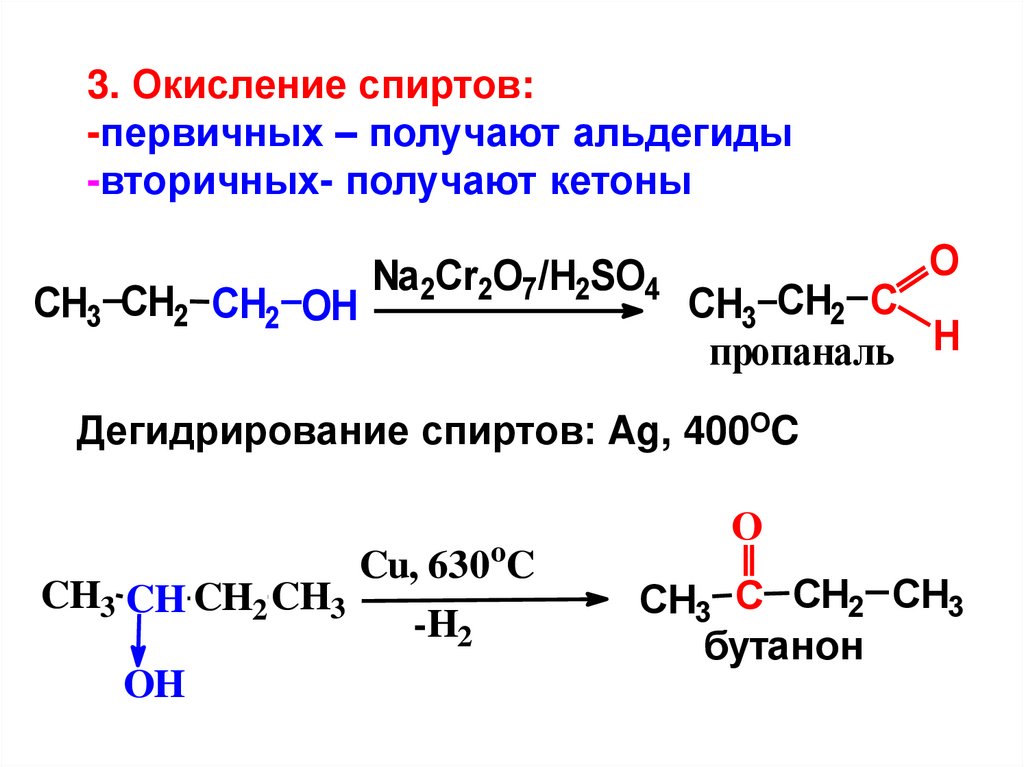
10.
3. Окисление спиртов:-первичных – получают альдегиды
-вторичных- получают кетоны
CH3 CH2 CH2 OH
Na2Cr2O7/H2SO4
O
CH3 CH2 C
пропаналь H
Дегидрирование спиртов: Ag, 400OC
Cu, 630oC
CH3 CH CH2 CH3
-H2
OH
O
CH3 C CH2 CH3
бутанон
11.
4.Гидролиз
мещенных УВ
геминальных
2HBr
R-C CH
toC
дигалогенза-
Br
R-C CH3
2H2O
Br
OH
R-C CH3
OH
гемдиол
-H2O
O
R C СH3
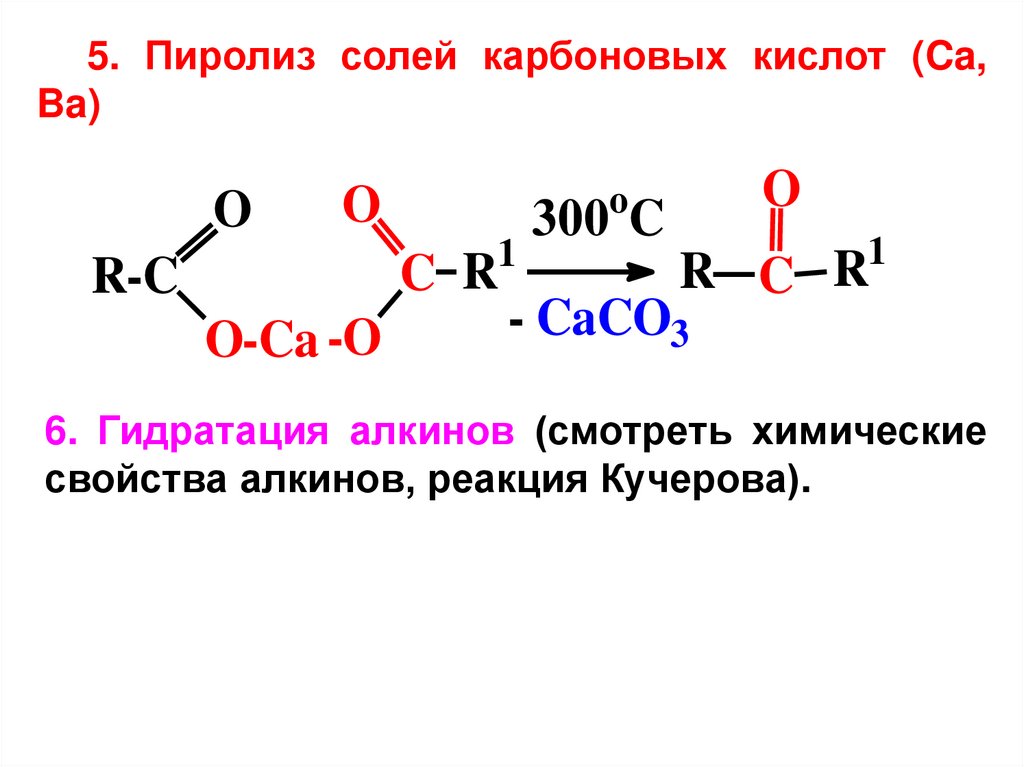
12.
5. Пиролиз солей карбоновых кислот (Ca,Ba)
O
O
1
C R
R-C
O-Ca -O
O
o
300 C
1
R C R
- CaCO3
6. Гидратация алкинов (смотреть химические
свойства алкинов, реакция Кучерова).
13.
7. Оксосинтез алкеновH2C CH2 + C=O + H2
Co
CH3 CH2 C
o
t ,p
O
H
Гомологи этилена дают смесь альдегидов с
нормальной и разветвленной цепью:
CH3 HC CH2 + C=O + H2
O
O
Co
CH3 CH2 CH2 C + CH3 CH C
o
t ,p
H
H
CH
3
14.
ФИЗИЧЕСКИЕ СВОЙСТВАФормальдегид – газ.
ацетальдегид, ацетон- жидкости растворимы в воде за счет образования с ней
водородных связей.
С увеличением длины цепи растворимость снижается, ароматические кетоны
и альдегиды плохо или не растворимы в
воде.
Альдегиды и кетоны имеют более
низкие Т.кип, чем спирты и кислоты, так
как не образуют ассоциатов.
15.
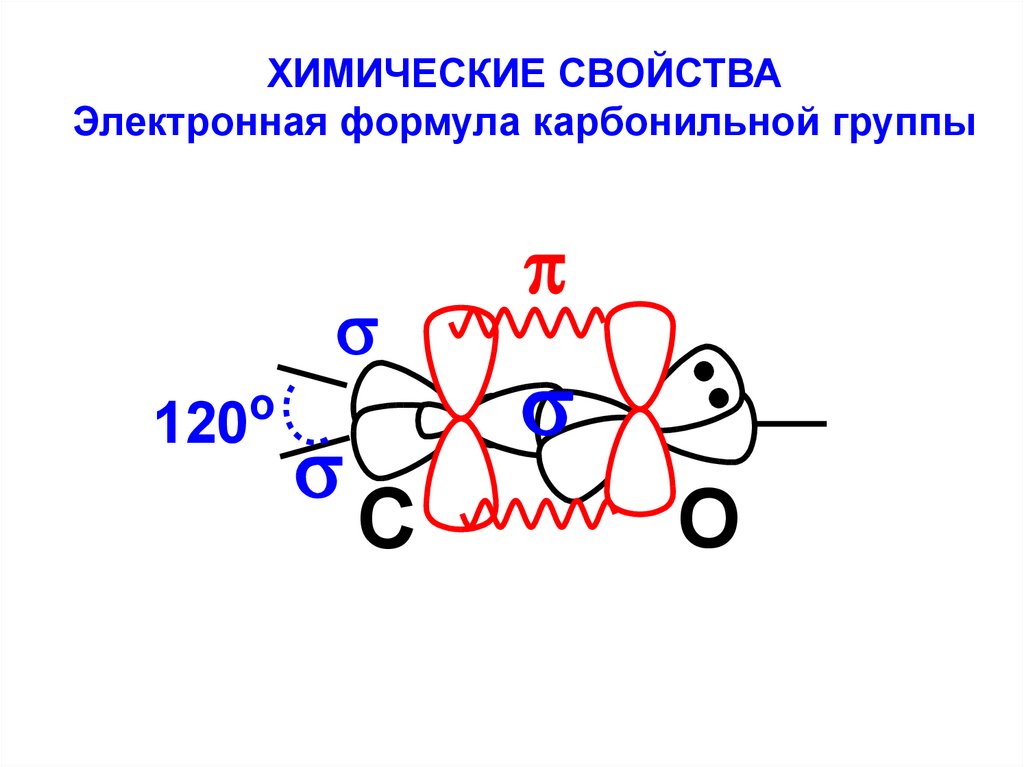
ХИМИЧЕСКИЕ СВОЙСТВАЭлектронная формула карбонильной группы
120
o
C
O
16.
Отличие С=О связи от С=С связи1) высокая полярность
2)Есвязи С=О > Е связиС=С
3) длина связи
0,121нм <0,134 нм
n-основный
центр
R
CH
H
C
O
H(R)
α -СН-кислотный электрофильный
центр
центр
17.
Для карбонильных соединенийхарактерны:
1.Реакции нуклеофильного
присоединения (AN);
2.Реакции замещения кислорода группы
С=О на азот N-содержащими
нуклеофилами.
3. Реакции окисления и восстановления;
4. Реакции конденсации.
5. Реакции по углеводородному
заместителю и ароматическому кольцу
18.
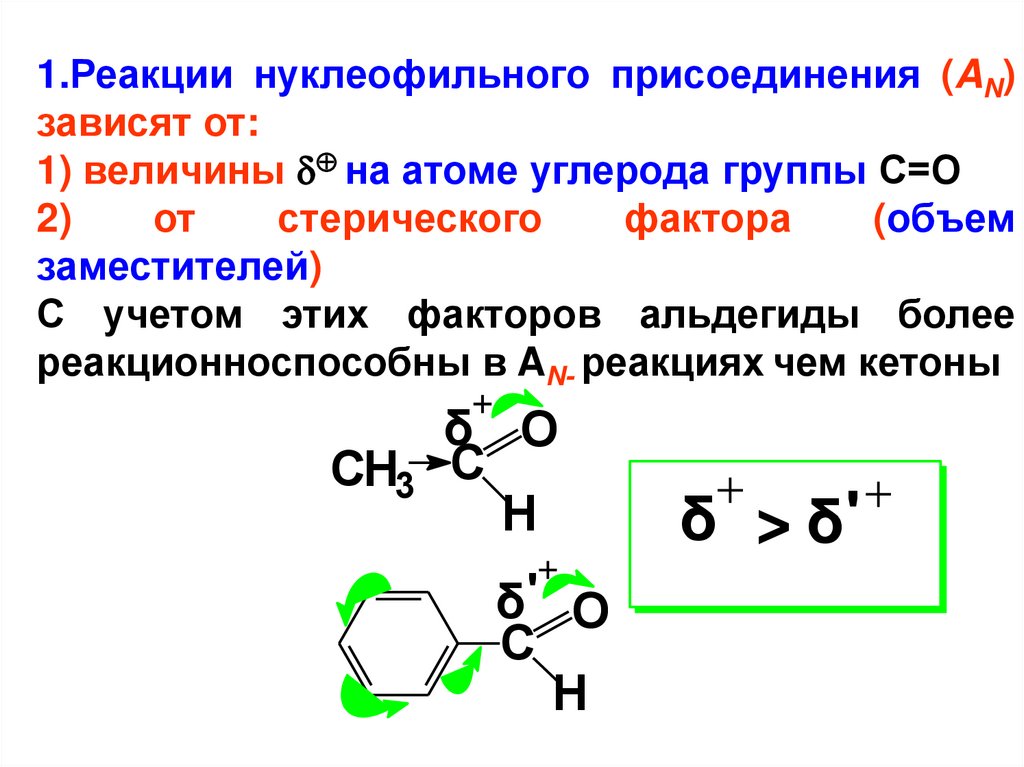
1.Реакции нуклеофильного присоединения (AN)зависят от:
1) величины на атоме углерода группы С=О
2)
от
стерического
фактора
(объем
заместителей)
С учетом этих факторов альдегиды более
реакционноспособны в AN- реакциях чем кетоны
δ O
CH3 С
H
δ' O
С
H
δ > δ'
19.
Стерические факторы: объемные заместителизатрудняют подход Nu и снижают скорость
реакции.
CH3 O CH3
CH3 C C C CH3
CH3
CH3
20.
21.
22.
23.
1) Реакции с Н2О.CH3
CH3-CH2
CH3
HOH
CH3-CH2 C
С O
бутанон-2
OH
OH
гем-диол
бутанона
2). Реакция со спиртами.
O
C2H5OH
СH3 С
H
OH
CH3 C OC2H5
H
1-этоксиэтанол
(полуацеталь)
24.
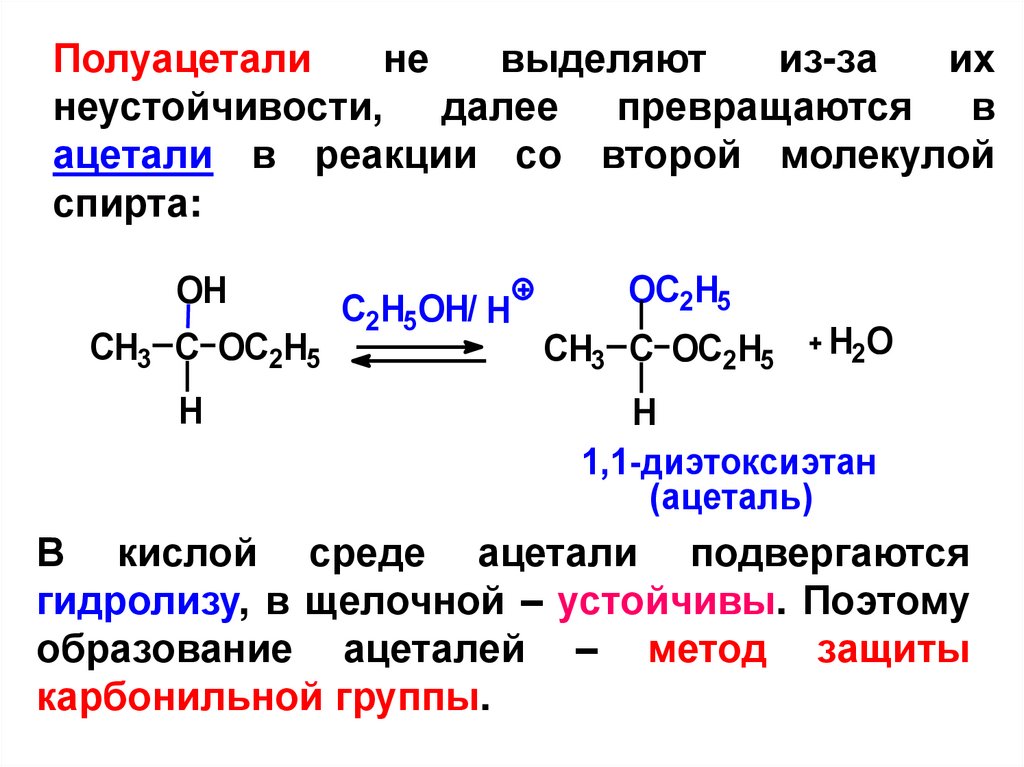
Полуацеталине
выделяют
из-за
их
неустойчивости, далее превращаются в
ацетали в реакции со второй молекулой
спирта:
OH
CH3 C OC2H5
H
C2H5OH/ H
OC2H5
CH3 C OC2H5
H2O
H
1,1-диэтоксиэтан
(ацеталь)
В кислой среде ацетали подвергаются
гидролизу, в щелочной – устойчивы. Поэтому
образование ацеталей – метод защиты
карбонильной группы.
25.
3). Реакции AN с гидросульфитом натрия.Образование гидросульфитных производных
(α-гидрокси-сульфонатов
натрия).
Качественная реакция на альдегиды и
метилкетоны- осадок белого цвета
O
С2H5 C
H
ONa
O S
OH
OH O
C2H5 C S ONa
H O
гидросульфитное
производное пропаналя
26.
27.
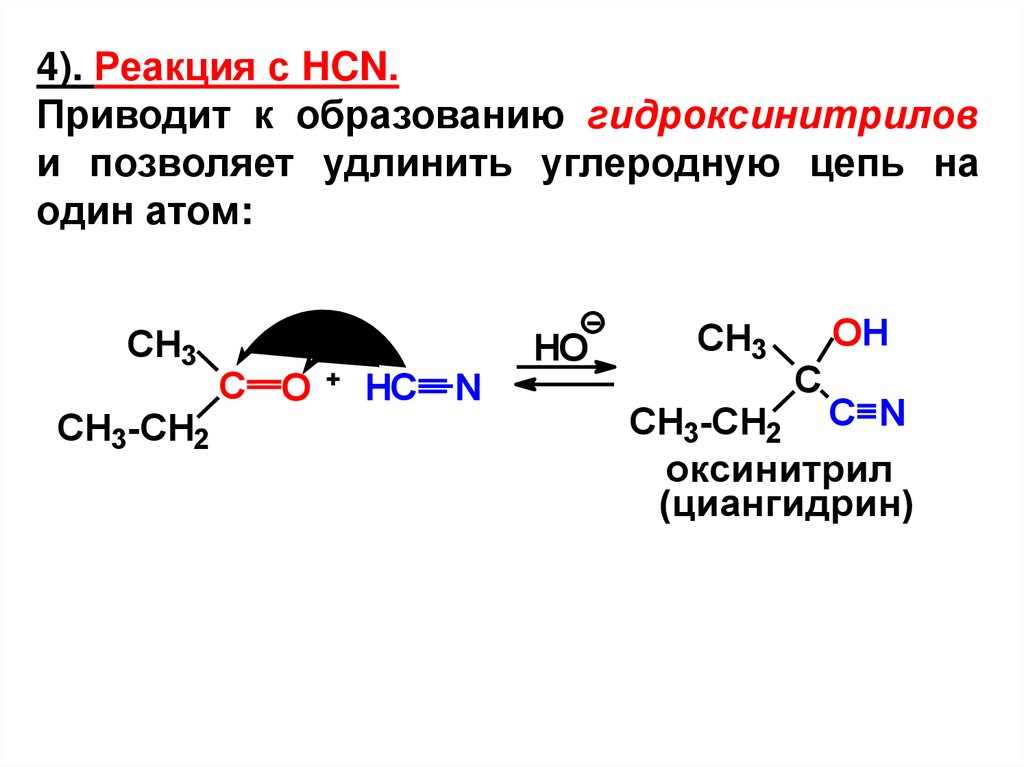
4). Реакция с HCN.Приводит к образованию гидроксинитрилов
и позволяет удлинить углеродную цепь на
один атом:
CH3
CH3-CH2
С O
HC N
HO
CH3
OH
C
CH3-CH2 C N
оксинитрил
(циангидрин)
28.
5)Реакции
соединениями.
с
O
H С
магнийорганическими
OMgBr
CH3 MgBr
H C CH3
H
H
CH3-CH2-OH + Mg(OH)Br
первичный спирт
H2O
29.
CH3 СH2O
O CH -CH MgBr
3
2
H
OH
CH3 CH CH2-CH3
вторичный спирт
OMgBr
CH3 C CH2-CH3
H
Mg(OH)Br
30.
RR1 C R2
R1 C R2
R MgBr
O
H2O
OMgBr
R
R1 C R2
Mg(OH)Br
OH
третичный спирт
31.
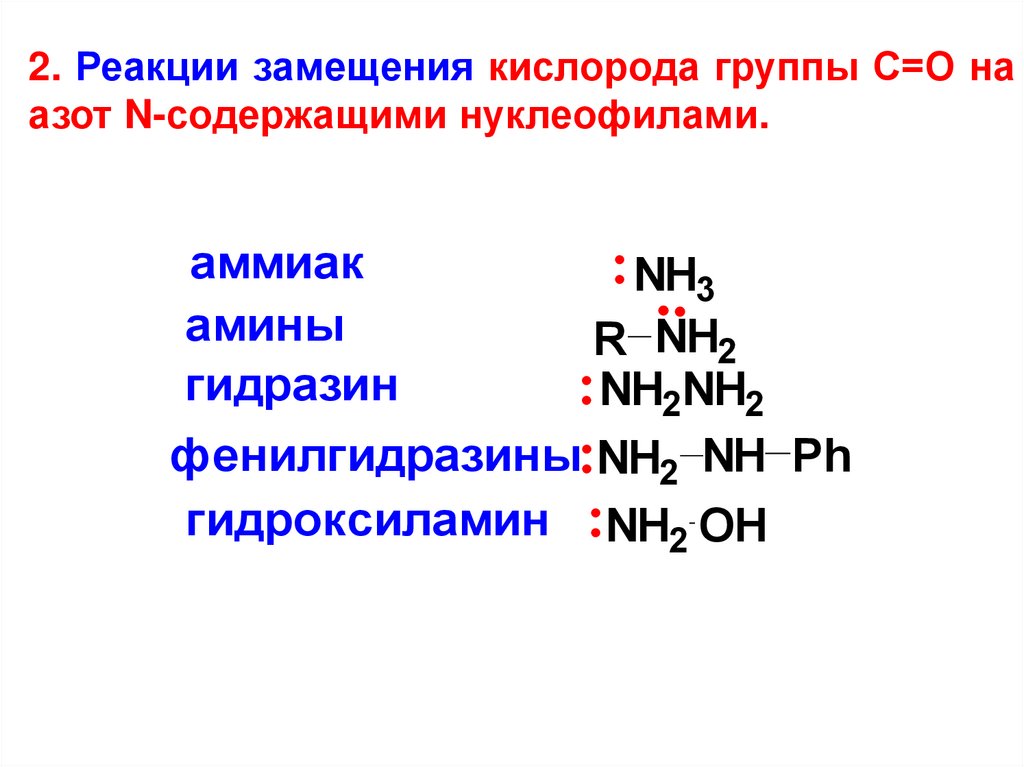
2. Реакции замещения кислорода группы С=О наазот N-содержащими нуклеофилами.
аммиак
амины
гидразин
NH3
R NH2
NH2NH2
фенилгидразины NH2 NH Ph
гидроксиламин NH2 OH
32.
1). Реакция с аммиаком и аминами.Реакция приводит к иминам, которые
неустойчивы, полимеризуются:
R
R
H
С O H2-NH
R C NH
полимер
R
H2O имин
С аминами образуются N-замещенные имины,
которые являются более стабильными, чем
продукты с аммиаком.
R
С O
NH2 R'
R
альдегид или кетон
R=Alk,Ar
H
H2O
R
R C NR
имин
33.
OС
H
NН2
СH N
H2O
бензальанилин
Гидролиз замещенных иминов приводит к
регенерации исходных альдегида и амина.
34.
2). Реакция с гидразинами - образуютсягидразоны:
R
O
C
H
N
NH2NH2
R
C
NH2
H2O
H
гидразон альдегида
Арилгидразоны имеют четкие Т.пл. и
используются
для
идентификации
карбонильных соединений.
35.
3). Реакция с гидроксиламином.R
С O
NH2 OH
H
R
H2O
альдегид гидроксиламин
или кетон R
R C NOH
оксимы
36.
37.
3. Реакции восстановления альдегидов икетонов: получение спиртов - первичных или
вторичных
O
R C-CH3
H2,Ni
OH
R CH-CH3
Восстановление комплексными гидридами
металлов: алюмогидрид лития LiAlH4,
борогидрид натрия NaBH4
O
OH
C-CH3
LiAlH4
ацетофенон
CH-CH3
1- фенилэтанол
38.
Нарядус
С=О
группой
могут
восстанавливаться С=С, C≡C, C=N, C≡N,
нитрогруппа, сложноэфирная группа.
39.
2) Окисление альдегидов.Альдегиды окисляются легче кетонов.
Ag2O- реакция “серебряного” зеркала;
Cu(OH)2- реакция “медного зеркала”
а) Мягкое окисление альдегидов
O
CH3C
H
Ag2O
Cu(OH)2
CH3C
CH3C
O
OH
O
Ag
Cu2O
OH красный
осадок
40.
41.
б)Жесткое
окисление
альдегидов
KMnO4,H2SO4 или Na2CO3, K2Cr2O7, СrO3 в кислоты.
Кетоны окисляются с трудом и в
зависимости
от
окислителя
превращаются в соединения разных
классов.
Окисление
кетонов
сопровождается в основном разрывом
углеродного скелета.
42.
4. Реакции конденсации.К этим реакциям относят реакции
присоединения или замещения атома
кислорода карбонильной группы с
образованием новой С-С связи. В
реакциях
участвуют
карбонильные
соединения и С-Н кислоты, в качестве
которых могут выступать и
сами
карбонильные соединения:
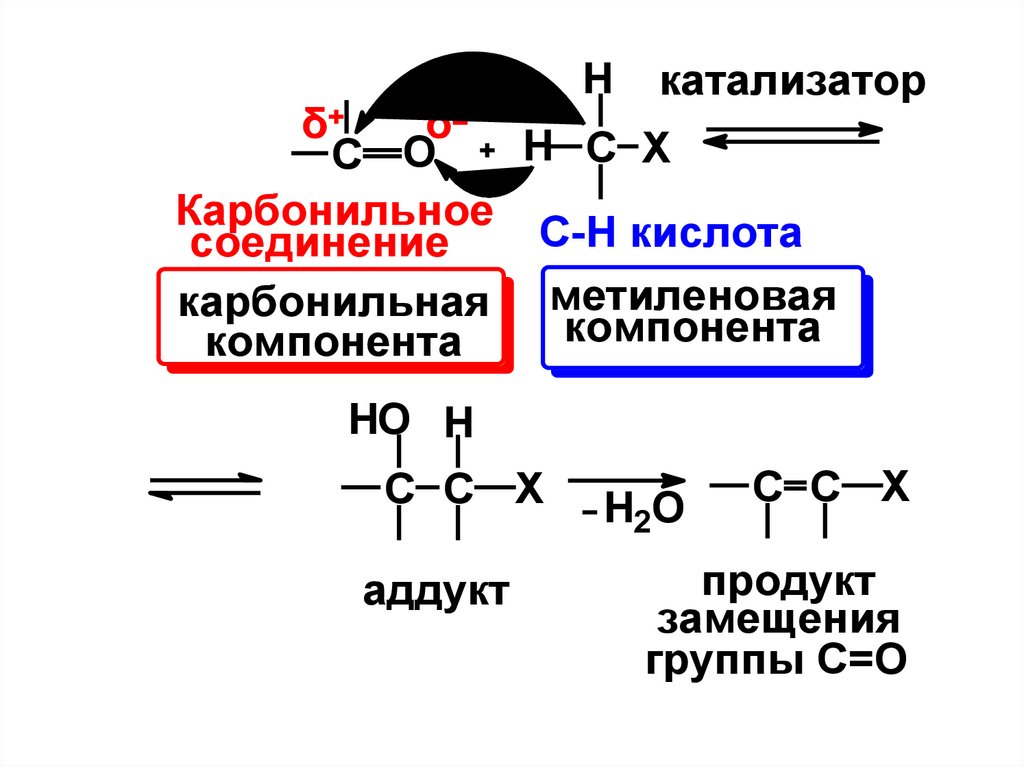
43.
Hδ
катализатор
δ
H C X
C O
Карбонильное
С-Н кислота
соединение
карбонильная метиленовая
компонента
компонента
HO H
C C X
аддукт
H2O
C C X
продукт
замещения
группы С=О
44.
Карбонильная компонента: альдегиды икетоны жирного и алифатического ряда.
Метиленовая компонента: обладающие С-Н
кислотностью альдегиды, кетоны, сложные
эфиры, ангидриды кислот, нитросоединения
и др.
45.
1) Альдольная и кротоновая конденсации.Альдольная конденсация. Реакция протекает
при действии на альдегиды или кетоны
разбавленных щелочей. При этом одна
молекула альдегида представляет собой
карбонильную
компоненту,
а
другая
–
метиленовую.
Альдольная
конденсация
–
обратимая
реакция, обратный процесс называется
альдольным расщеплением
Если
альдольная
конденсация
сопровождается отщеплением воды (это часто
происходит при повышенной температуре), то
такая
реакция
называется
кротоновой
конденсацией.
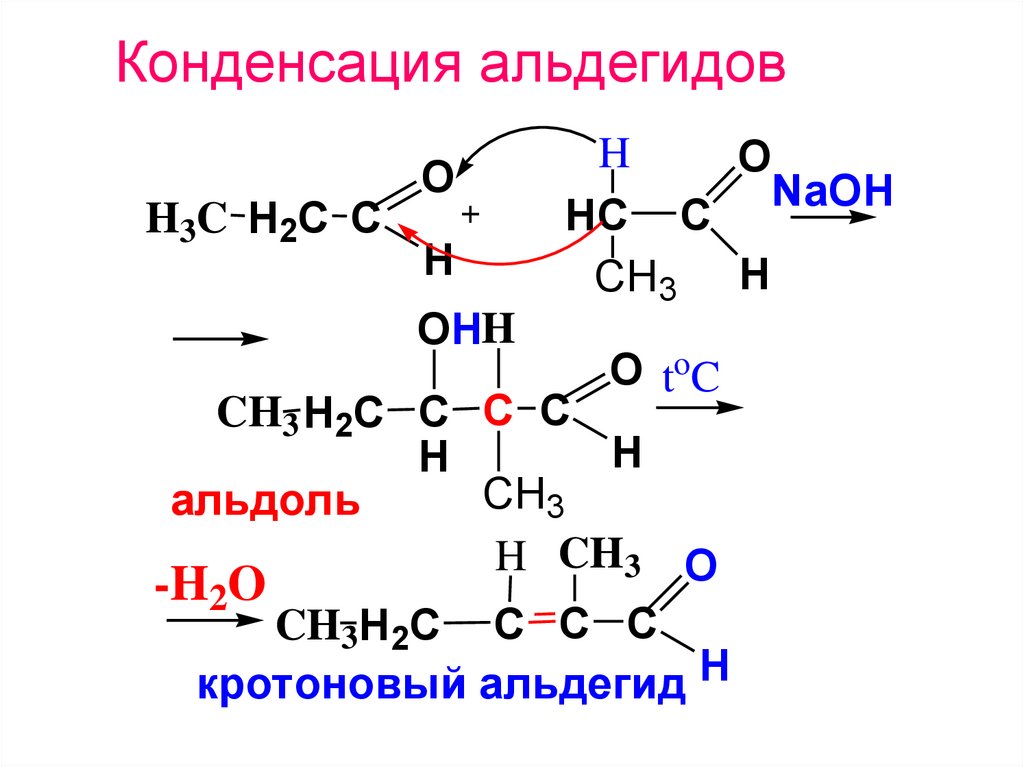
46. Конденсация альдегидов
H3C H2C CO
H
OHH
H
O
NaOH
HC C
CH3 H
O to C
CH3 H2C C C C
H
H
CH3
альдоль
H CH3 O
-H2O
CH3H2C C C C
кротоновый альдегид H
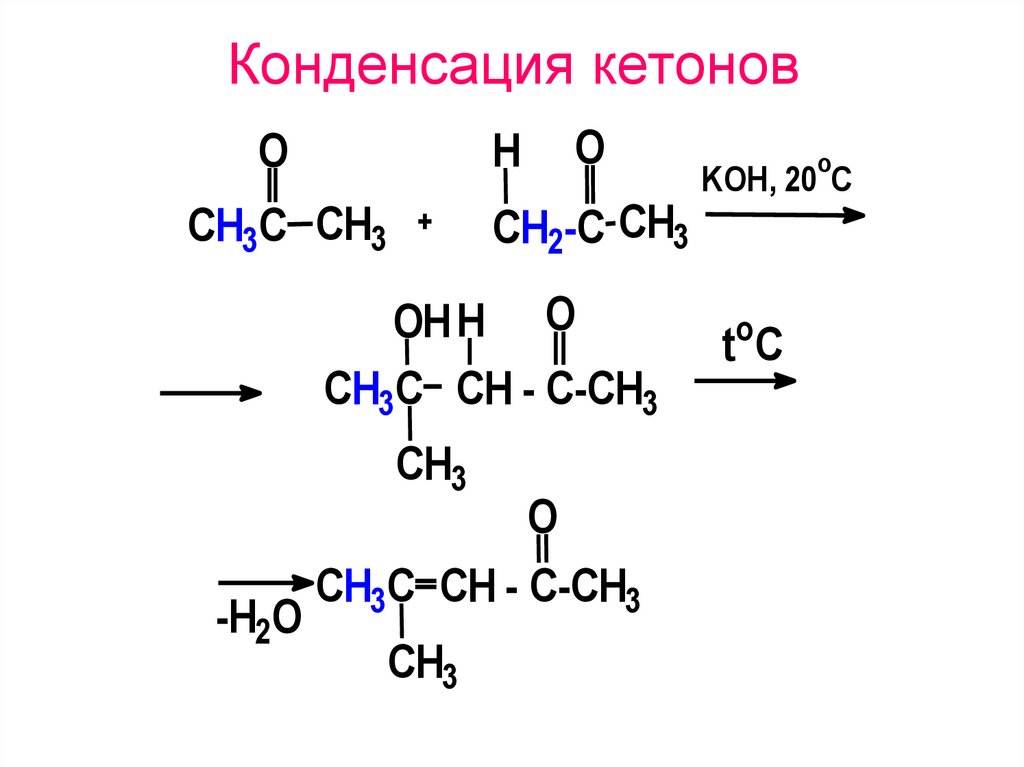
47. Конденсация кетонов
OH
O
CH2-C CH3
CH3C CH3
OH H O
CH3C CH - C-CH3
CH3
-H2O
O
CH3C CH - C-CH3
CH3
o
KOH, 20 C
toC
48.
OС
o
KOH,
20
C
O
CH3C
H
H
бензальдегид ацетальдегид
(карбонильная (метиленовая
компонента)
компонента)
O
CH CH C
H
коричный альдегид, 60%
H2O
49.
2).Диспропорционированиесамоокисление и самовосстановление реакция Канниццаро:
O
O
С
H
CH2OH
60%KOH,20oC
бензальдегид
бензиловый
спирт
С
OK
бензоат
калия
50.
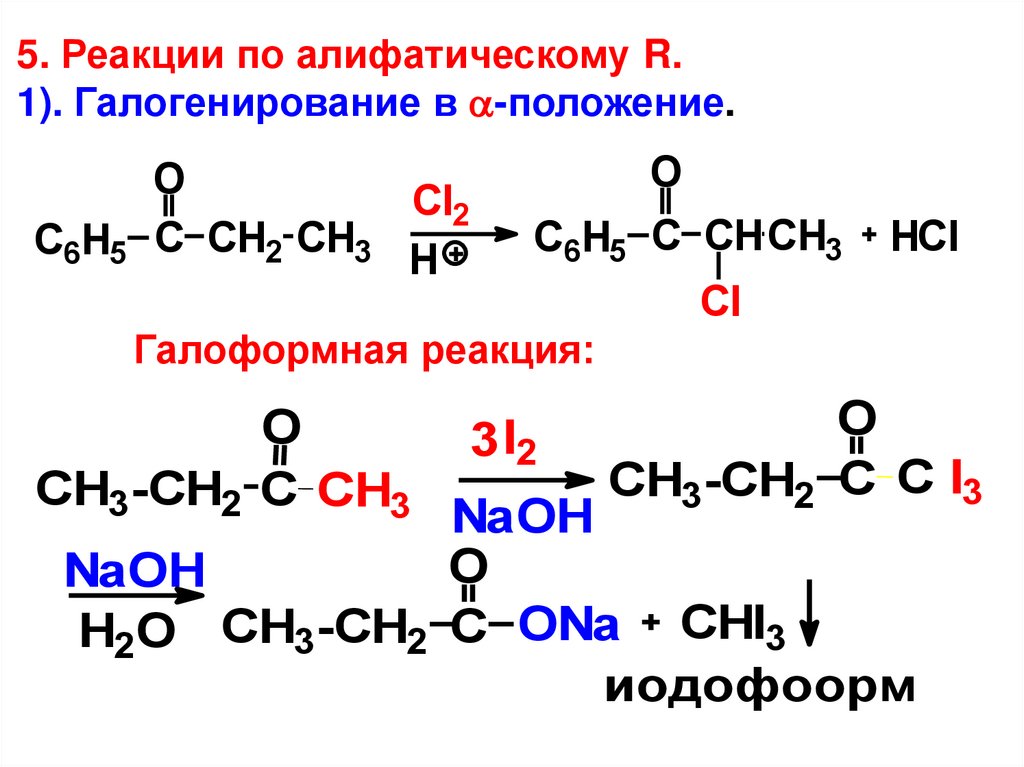
5. Реакции по алифатическому R.1). Галогенирование в -положение.
O
Сl2
С6H5 C CH2 CH3 H
O
С6H5 C CHCH3
HCl
Cl
Галоформная реакция:
O
CH3-СH2 C CH3
3 I2
O
CH3-СH2 C C I3
NaOH
O
NaOH
H2O CH3-СH2 C ONa CHI3
иодофоорм
51.
52.
2) Реакции по ароматическому кольцуH
H
C
O
Br2
AlBr3
C
O
HBr
Br
H
KNO3
H2SO4
C
O
H2O
NO2
53.
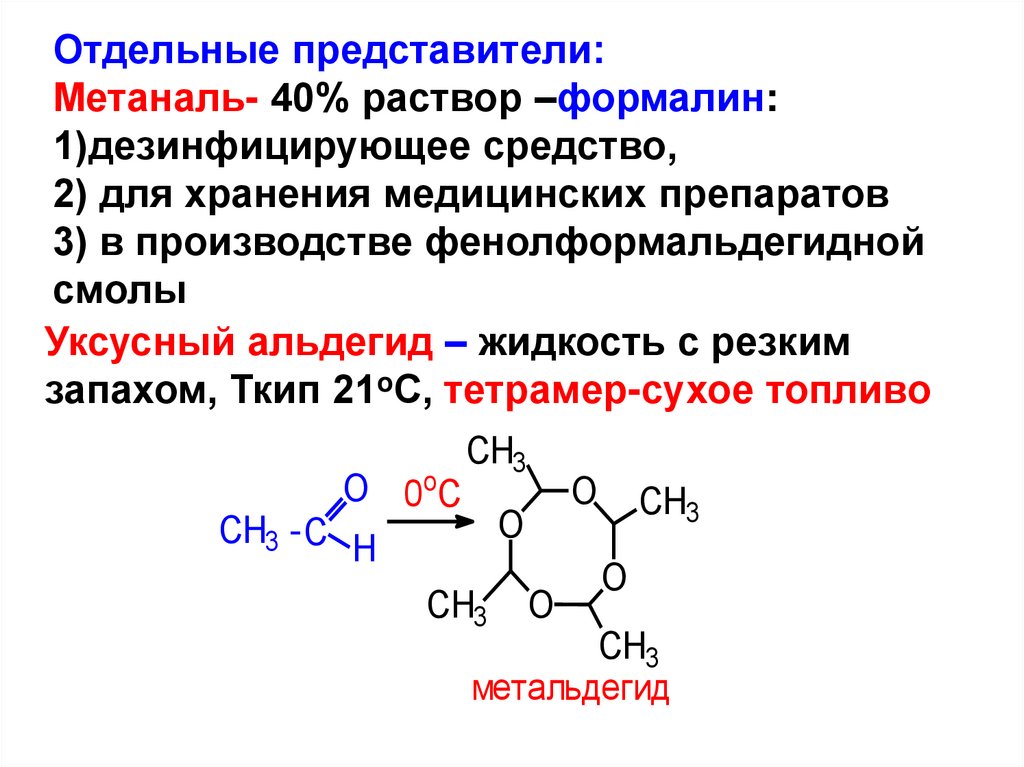
Отдельные представители:Метаналь- 40% раствор –формалин:
1)дезинфицирующее средство,
2) для хранения медицинских препаратов
3) в производстве фенолформальдегидной
смолы
Уксусный альдегид – жидкость с резким
запахом, Ткип 21oС, тетрамер-сухое топливо
CH3
O 0oC
O CH3
O
CH3 - C
H
O
CH3 O
CH3
метальдегид
54.
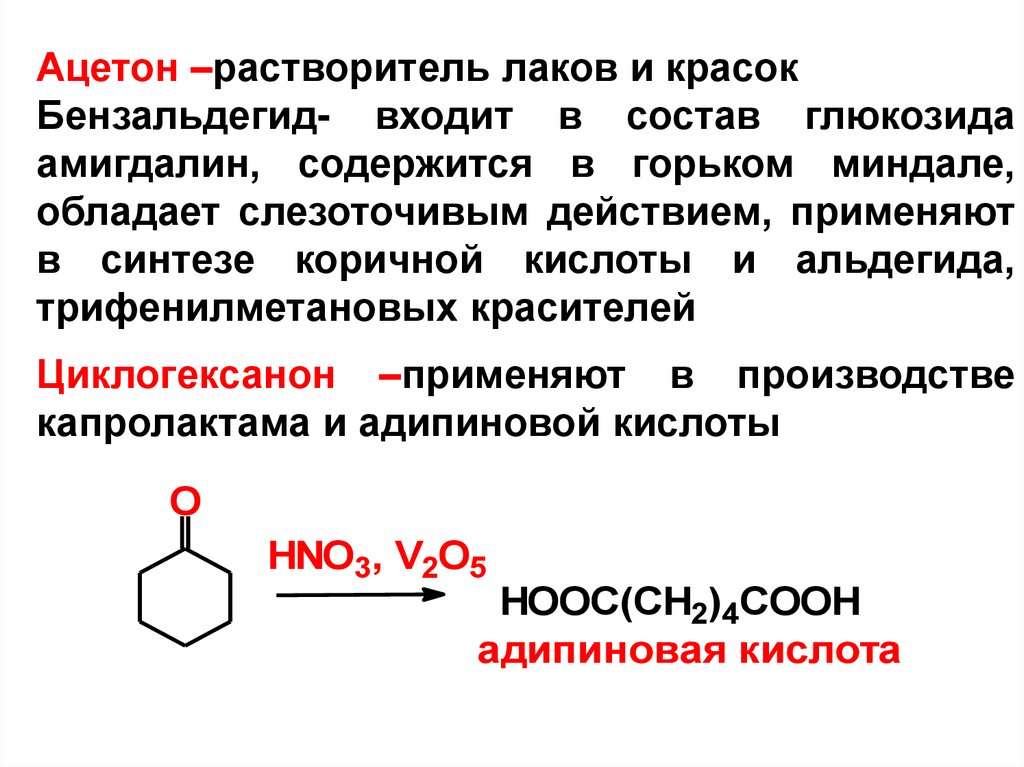
Ацетон –растворитель лаков и красокБензальдегид- входит в состав глюкозида
амигдалин, содержится в горьком миндале,
обладает слезоточивым действием, применяют
в синтезе коричной кислоты и альдегида,
трифенилметановых красителей
Циклогексанон –применяют в производстве
капролактама и адипиновой кислоты
O
HNO3, V2O5
HOOC(CH2)4COOH
адипиновая кислота







































 Химия
Химия








