Похожие презентации:
Задача 1 химтур
1.
ЗАДАЧА №1 “РАЗЛОЖИТЬНА ПОЛОЧКЕ”
МАОУ Лицей №93
Команда:
“Дикетопиперазинчики”
2.
УСЛОВИЯ ЗАДАЧИ:Пероксид водорода является важным инструментом криминалистической лаборатории. Он
применяется для обнаружения следов крови, не видимых невооружённым глазом, например,
высохших или смытых пятен. При нанесении смеси люминола, щёлочи и перекиси на такое
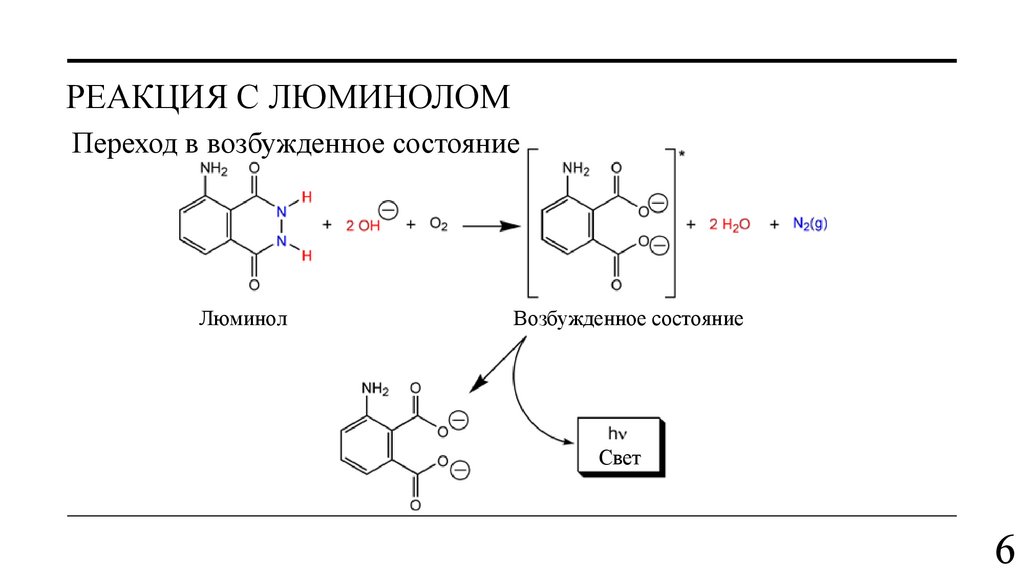
пятно, последняя разлагается с образованием кислорода, вызывающего хемилюминесценцию
люминола. Но насколько такой метод селективен?
Может ли криминалист случайно подвергнуть перекись воздействию каких-либо условий в ходе
расследования и сделать ложный вывод о наличии следов крови? Предложите три
принципиально различных способа активации разложение перекиси. Приведите механизм и
функциональные зависимости скорости разложения от условий. Возможно ли сравнить
предложенные вами способы активации? Если да, то по каким параметрам, если нет, то почему?
2
3.
ЦЕЛЬ:Предложить три различных способа активации разложения
перекиси водорода
3
3
4.
ЗАДАЧИ:- Изучить свойства пероксида водорода;
- Изучить механизм разложения перекиси водорода;
- Рассмотреть зависимость скорости разложения от условий;
- Предложить способы активации разложения перекиси
водорода;
- Исследовать возможность сравнения способов активации
разложения перекиси водорода
4
5.
ПРЕДВАРИТЕЛЬНЫЕ ПРОБЫИсследования в ультрафиолетовых лучах и все химические методы
Гем (катализатор) разлагает H₂O₂ :
H₂O₂ + Fe(II)(гем) → Fe(III)(гем) + •OH + OH⁻
5
6.
РЕАКЦИЯ С ЛЮМИНОЛОМПереход в возбужденное состояние
Люминол
Возбужденное состояние
Свет
6
7.
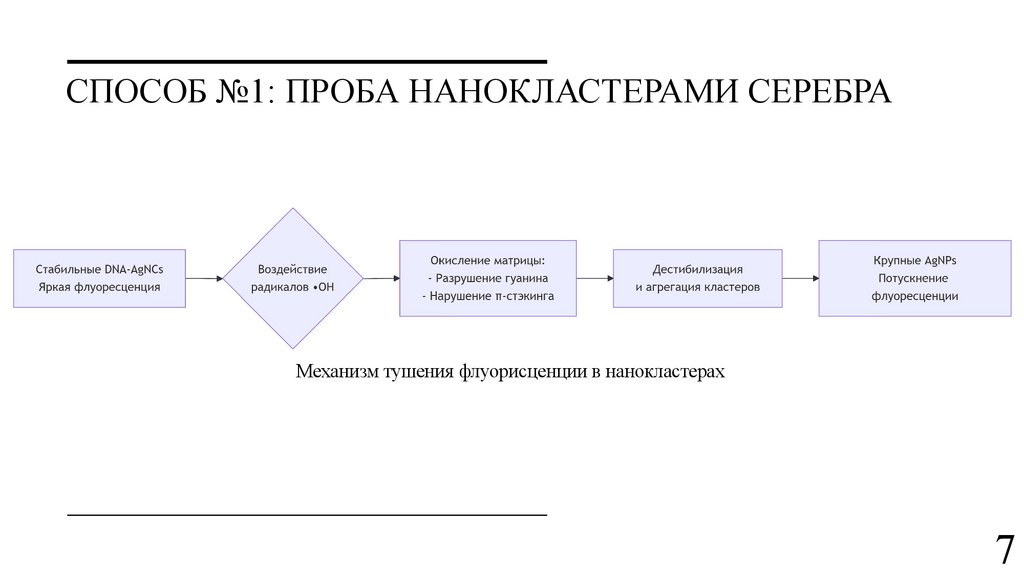
СПОСОБ №1: ПРОБА НАНОКЛАСТЕРАМИ СЕРЕБРАМеханизм тушения флуорисценции в нанокластерах
7
8.
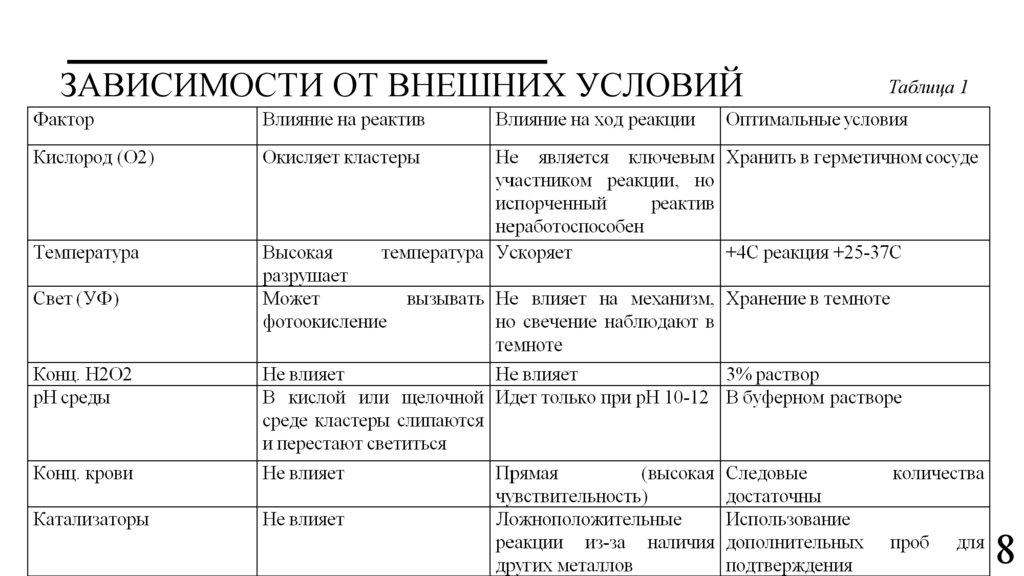
ЗАВИСИМОСТИ ОТ ВНЕШНИХ УСЛОВИЙТаблица 1
8
9.
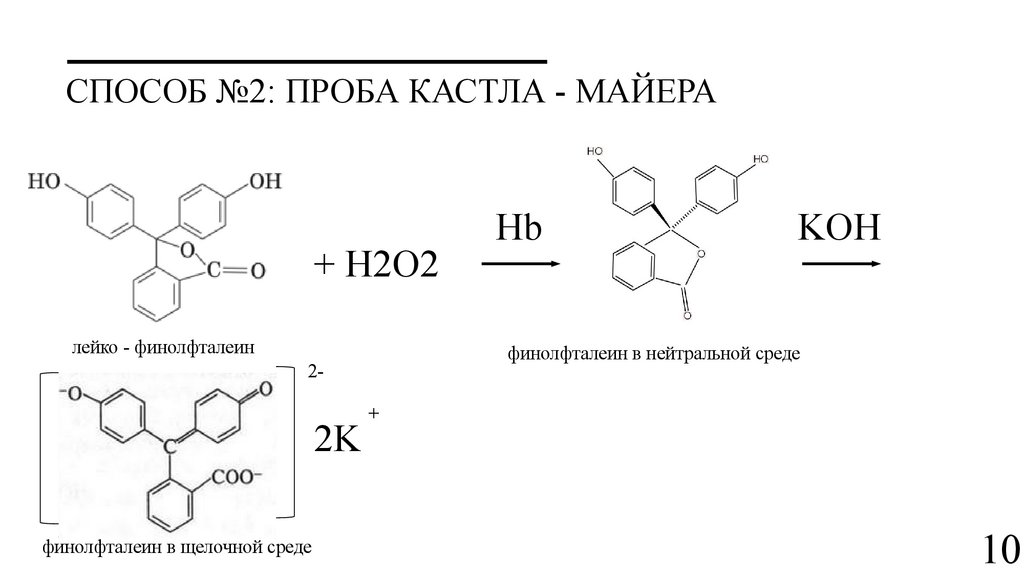
СПОСОБ №2: ПРОБА КАСТЛА - МАЙЕРАВосстановление фенолфталеина
C₂₀H₁₄O₄ + Zn + 2NaOH → C₂₀H₁₆O₄ + Na₂ZnO₂ + H₂O
или
C₂₀H₁₄O₄ + Na₂S₂O₄ + 2H₂O → C₂₀H₁₆O₄ + 2NaHSO₃
Окисление фенолфталеина при положительной реакции
C₂₀H₁₆O₄ + 2•OH → C₂₀H₁₄O₄ + 2H₂O
9
10.
СПОСОБ №2: ПРОБА КАСТЛА - МАЙЕРА+ H2O2
лейко - финолфталеин
финолфталеин в щелочной среде
KOH
финолфталеин в нейтральной среде
2-
2K
Hb
+
10
11.
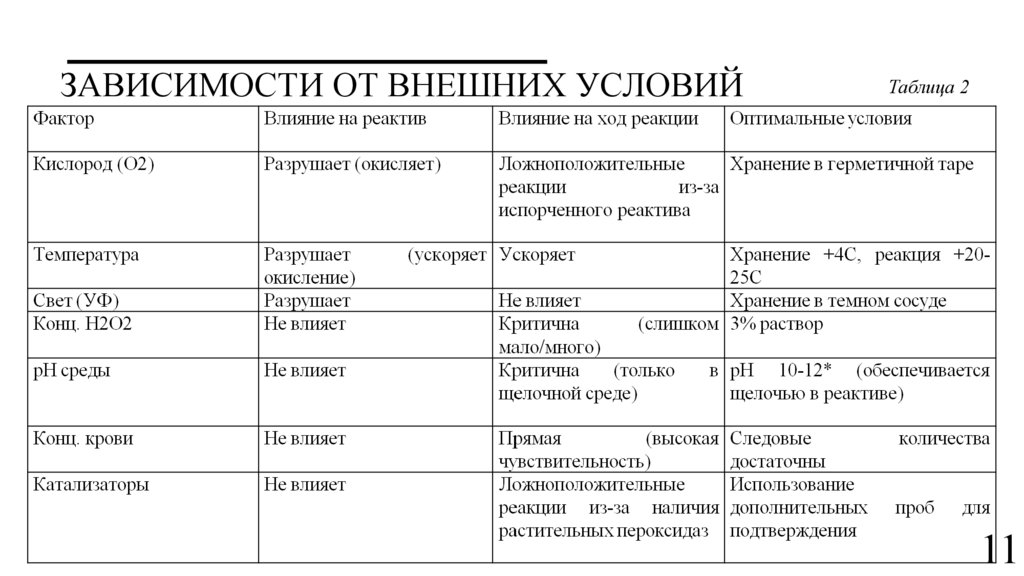
ЗАВИСИМОСТИ ОТ ВНЕШНИХ УСЛОВИЙТаблица 2
11
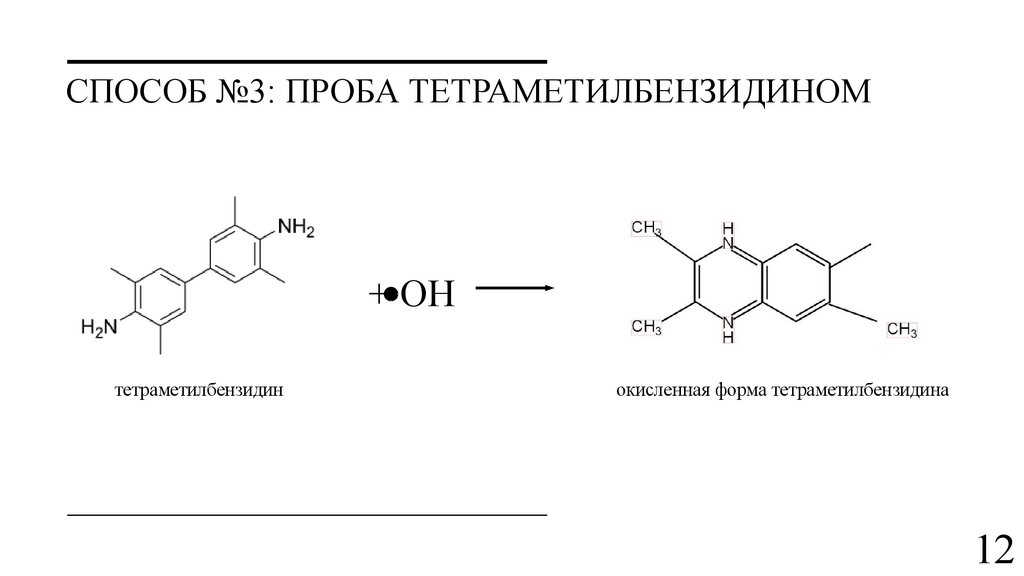
12.
СПОСОБ №3: ПРОБА ТЕТРАМЕТИЛБЕНЗИДИНОМ+ OH
тетраметилбензидин
окисленная форма тетраметилбензидина
12
13.
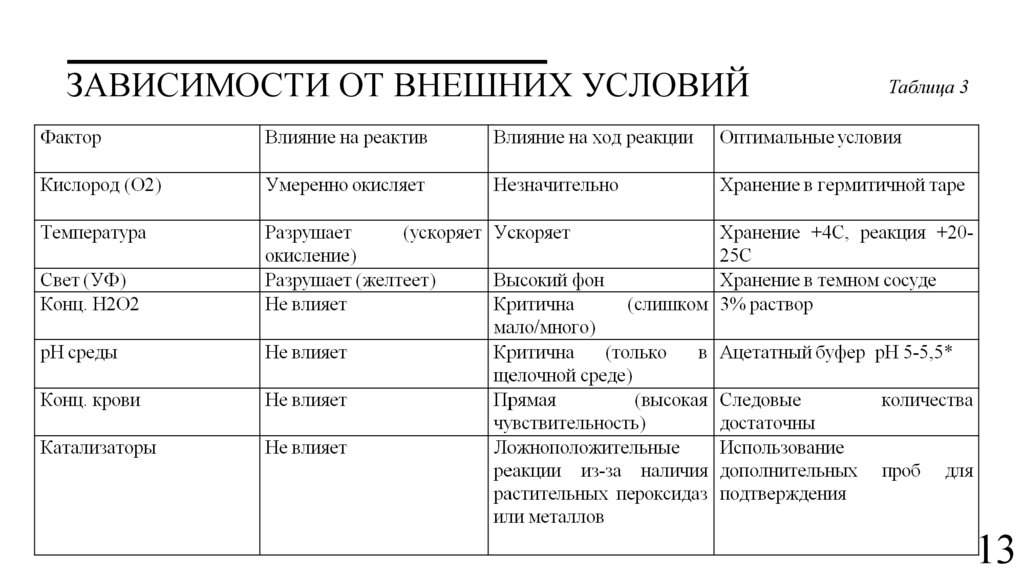
ЗАВИСИМОСТИ ОТ ВНЕШНИХ УСЛОВИЙТаблица 3
13
14.
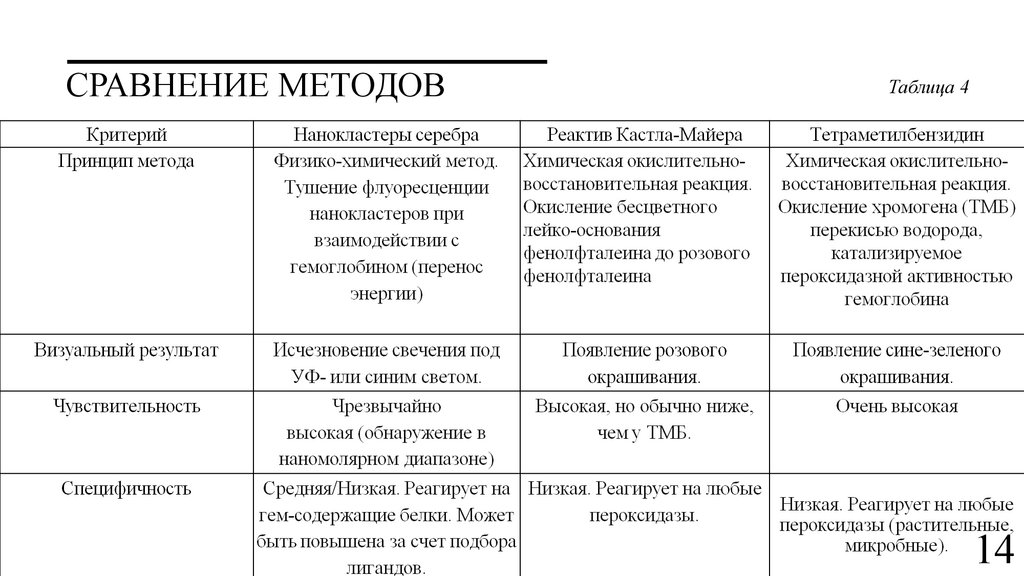
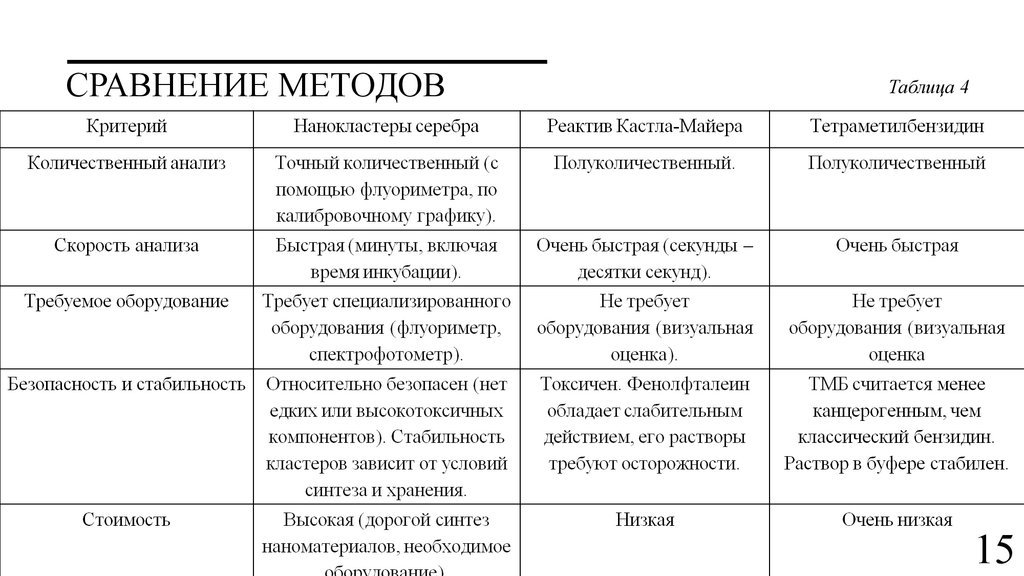
СРАВНЕНИЕ МЕТОДОВТаблица 4
14
15.
СРАВНЕНИЕ МЕТОДОВТаблица 4
15
16.
СПИСОК ЛИТЕРАТУРЫ1. The chemical and spectroscopic methods / Quickenden, I. T, Cooper, D. P. — Текст :
непосредственный // Journal of Forensic Sciences. — 2001. — № 46(3). — С. 545-553.
2. Li, Y. A novel fluorometric and turn-off sensor for detection of blood based on DNA-templated
silver nanoclusters / Y. Li. — Текст : непосредственный // Sensors and Actuators B: Chemical. —
2019. — № 286. — С. 191-197.
3. J. Amer. Chem / E. H. White, O. Zafiriou, H. Kagi, J. Hill. — Текст : непосредственный // . —
1964. — № 5. — С. 940.
4. Химия вицинальных диаминов / Люсе, Дени, Галль Ле [и др.]. — Текст :
непосредственный // Angewandte Chemie International Edition. — 1998. — № 37 (19). — С.
2580–2627.
5 Обоснование использования 3,3',5,5'-тетраметилбензидина в качестве хромогенного
субстрата в колориметрическом анализе / X. Чжан, Q. Ян, Y. Ланг, X. Цзян. — Текст :
непосредственный // Аналитическая химия. — 2020. — № 92 (18). — С. 12400–12406.
16
17.
ССЫЛКИ НА ИЗОБРАЖЕНИЯ1.
2.
3.
4.
5.
https://
cdn.budzdorov.ru/media/catalog/product/cache/afad95d7734d2fa6d0a8ba78597182b7/5/0/50
07955-d-9-f-6-d9f6e5cc7bda9f30fd13cd3641fef287137faddb_5007955.jpg
https://elementy.ru/images/bookclub/ohimia_6.gif
https://litvek.com/icl/i/17/406417/image_390.jpg
https://avatars.mds.yandex.net/i?id=7aef051526493a5cf787bdc198c17db2ac673d9c-5233220-im
ages-thumbs&n=13
6.
17
18.
ПРИЛОЖЕНИЕ №1Протекание реакции, даной в задаче:
Молекула пероксида водорода взаимодействует с восстановленной формой железа в геме,
выступая в роли окислителя.
H₂O₂ + Fe(II)(гем) → Fe(III)(гем) + •OH + OH⁻
Вторая молекула пероксида водорода взаимодействует с окисленной формой железа, выступая
в роли восстановителя, что замыкает каталитический цикл.
H₂O₂ + Fe(III)(гем) → Fe(II)(гем) + HOO• + H⁺
Катализатор [Fe] регенерируется, а в системе накапливаются активные радикальные частицы
(•OH и O₂•⁻), которые инициируют окисление люминола.