Похожие презентации:
Водородная химическая связь. Инструкция к уроку
1. ИНСТРУКЦИЯ К УРОКУ
1. Число пишем в тетради 7.10 и темуВодородная химическая связь
2. Выписать слайды 3, 4 (схемой), 5-9, 10-13,
14-15, 16, 17, 18
3. Домашнее задание &7 читать, в начале
урока небольшая проверочная работа по
этому конспекту. Если не будет конспекта,
то минус 1б за проверочную работу.
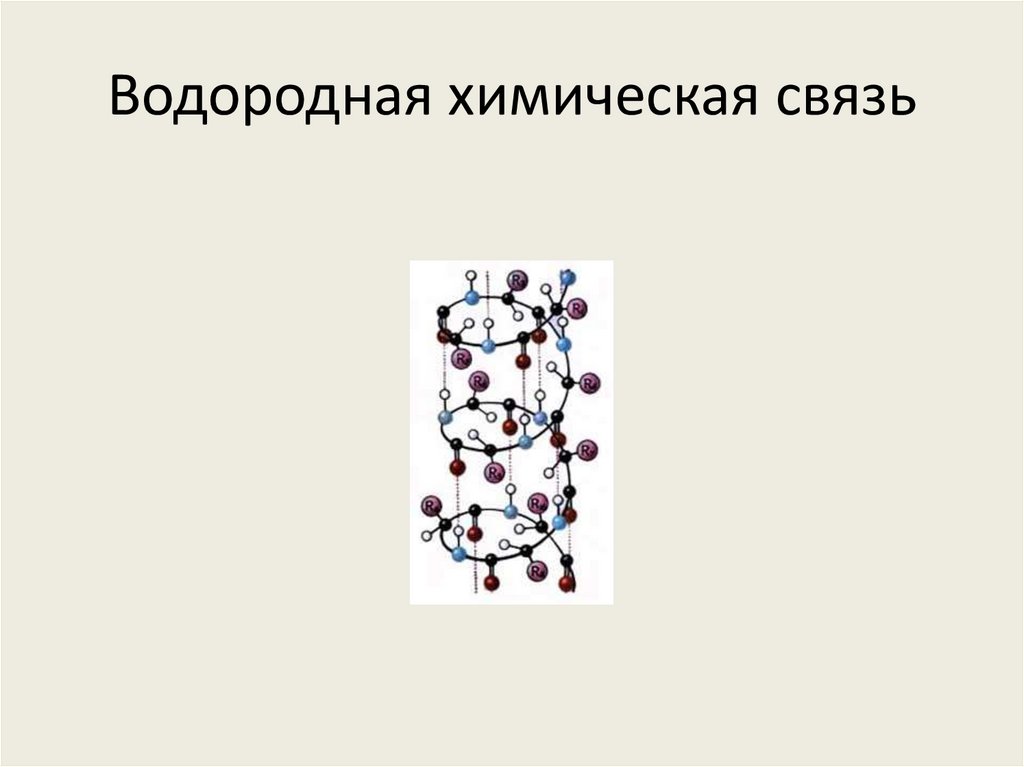
2. Водородная химическая связь
3. Химическую связь между атомами водорода одной молекулы (или её части) и атомами наиболее электоротрицательных элементов (фтор,
кислород, азот) другой молекулы (или еёчасти) называют водородной.
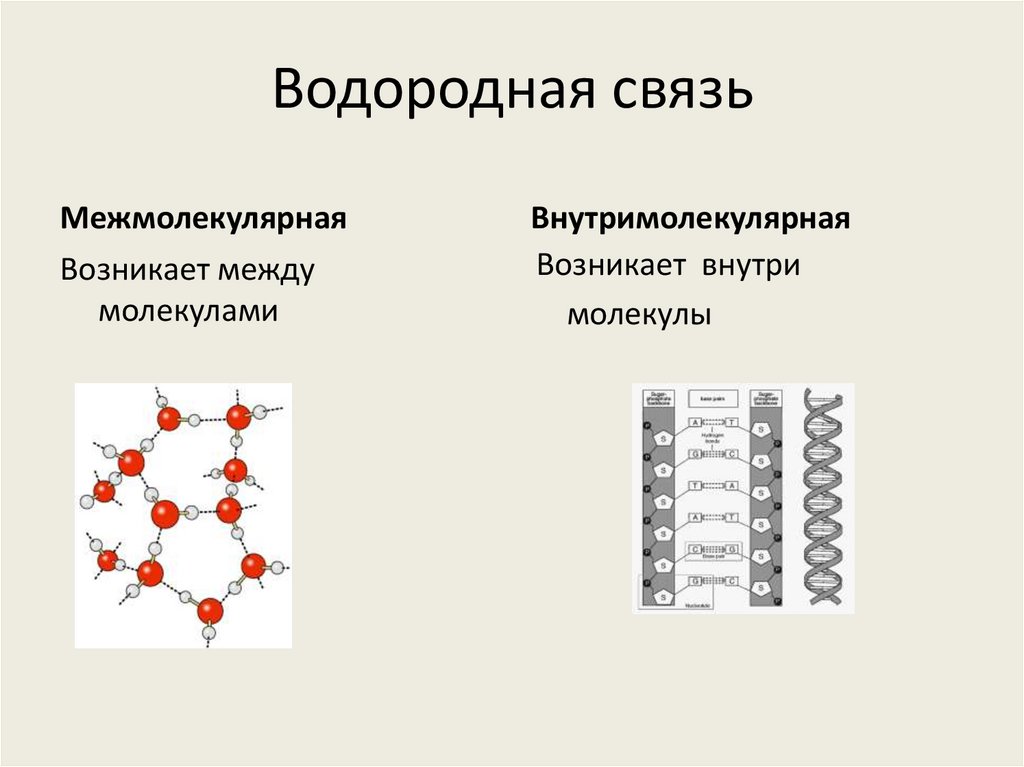
4. Водородная связь
МежмолекулярнаяВозникает между
молекулами
Внутримолекулярная
Возникает внутри
молекулы
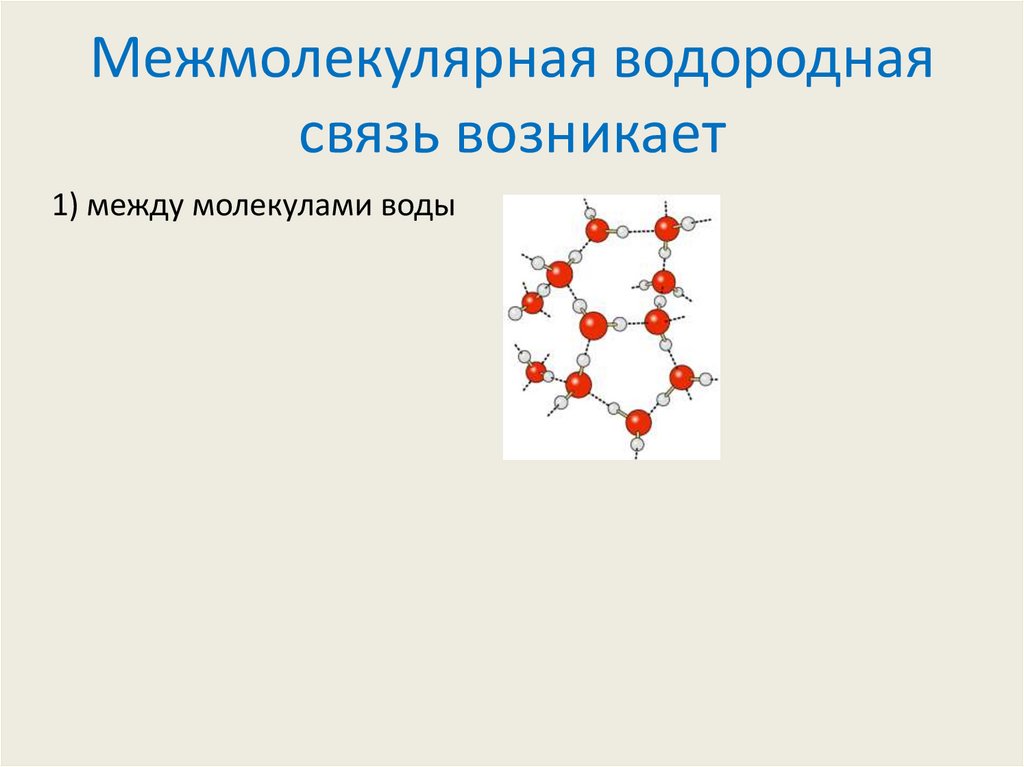
5. Межмолекулярная водородная связь возникает
1) между молекулами воды6. Межмолекулярная водородная связь
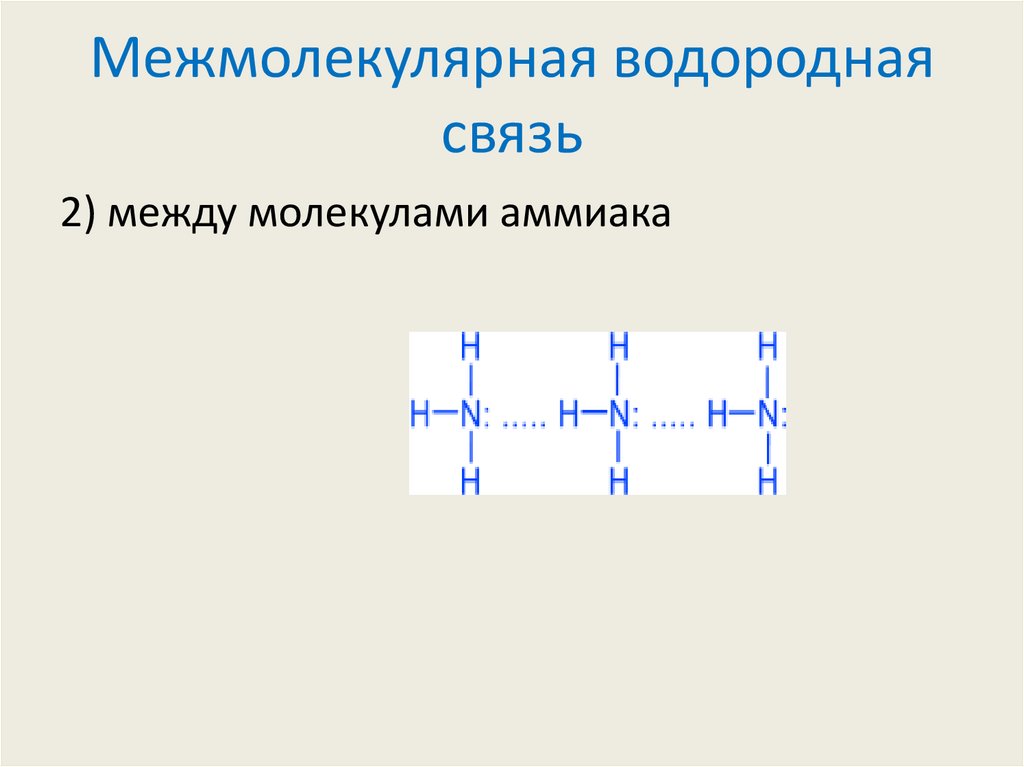
2) между молекулами аммиака7. Межмолекулярная водородная связь
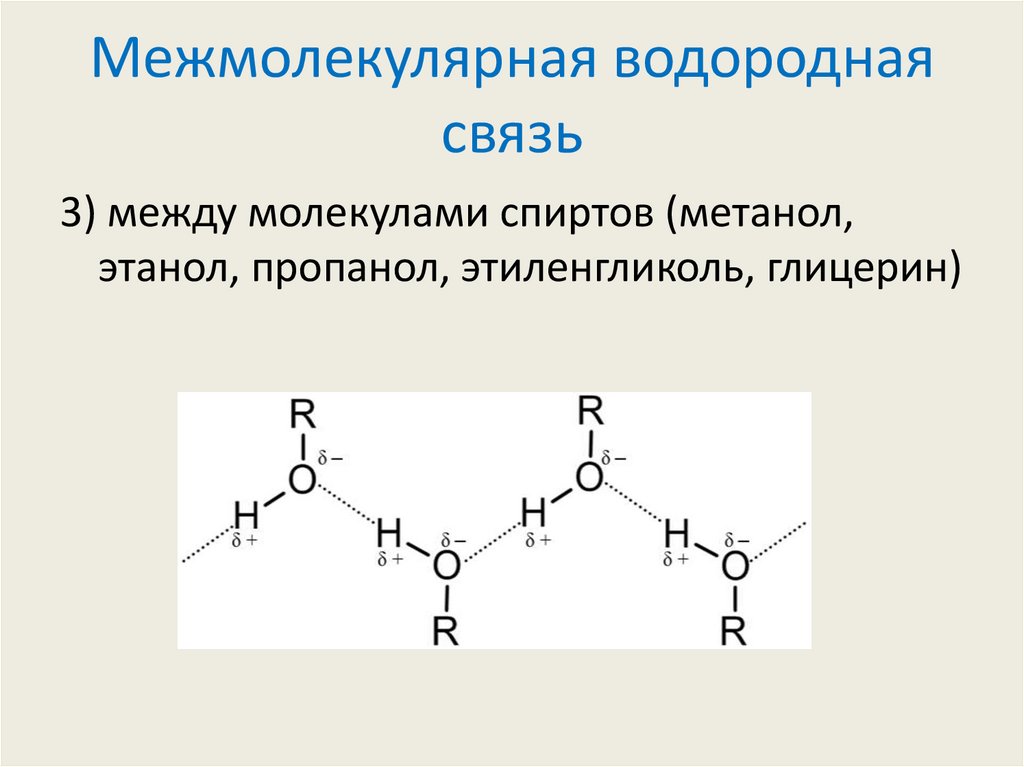
3) между молекулами спиртов (метанол,этанол, пропанол, этиленгликоль, глицерин)
8. Межмолекулярная водородная связь
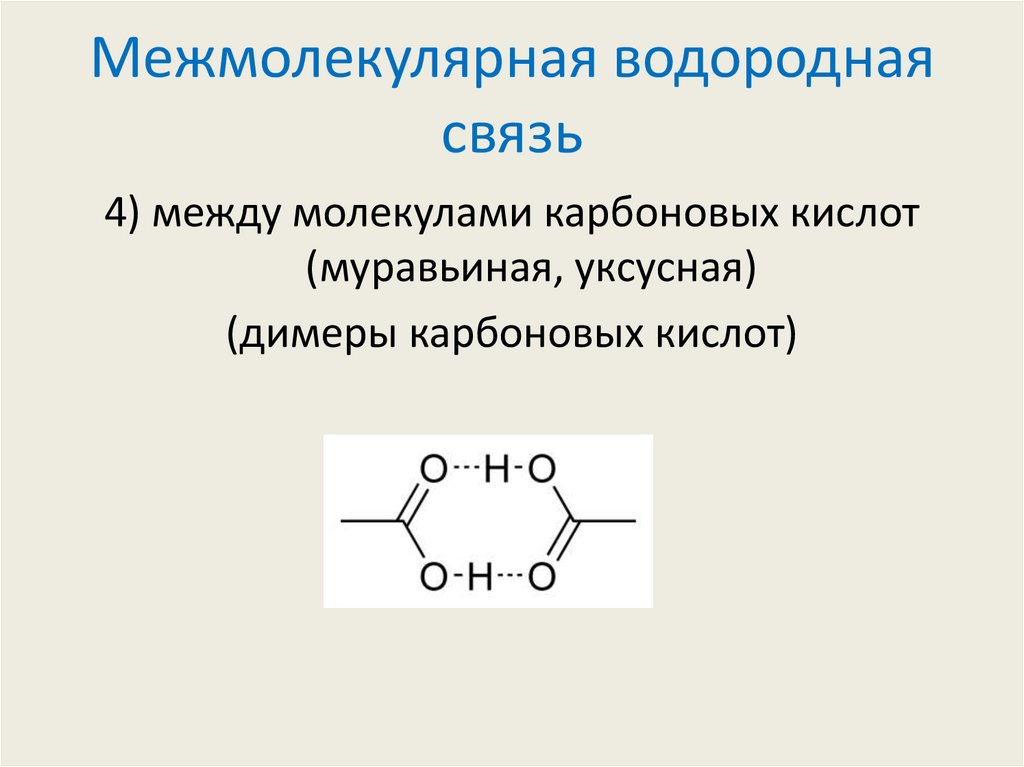
4) между молекулами карбоновых кислот(муравьиная, уксусная)
(димеры карбоновых кислот)
9. Межмолекулярная водородная связь
5) между молекулами фтороводородаН – Fδ- … δ+ H – F δ- … δ+Н – F δ- …
10. Особые свойства веществ, образованных межмолекулярной водородной связью
1) вещества с низкой молекулярной массой –жидкости или легко сжижаемые газы
(вода, метанол, этанол, муравьиная кислота,
уксусная кислота, фтороводород, аммиак)
11. Особые свойства веществ, образованных межмолекулярной водородной связью
2) некоторые спирты и кислотынеограниченно растворимы в воде
12. Особые свойства веществ, образованных межмолекулярной водородной связью
3) аномально высокие температуры кипенияи плавления
Мr (H2O) = 18
Mr (С2Н5ОН) = 42
t кип. (H O) = 1000 С
t кип. (С2Н5ОН) = 780С
t пл. (H O) = 00 С
2
2
13. Особые свойства веществ, образованных межмолекулярной водородной связью
5) водородные связи способствуютобразованию кристаллов в виде снежинок
или измороси
14. Внутримолекулярная водородная связь возникает
1) внутри молекул белков (водородная связьудерживает витки спирали пептидной
молекулы)
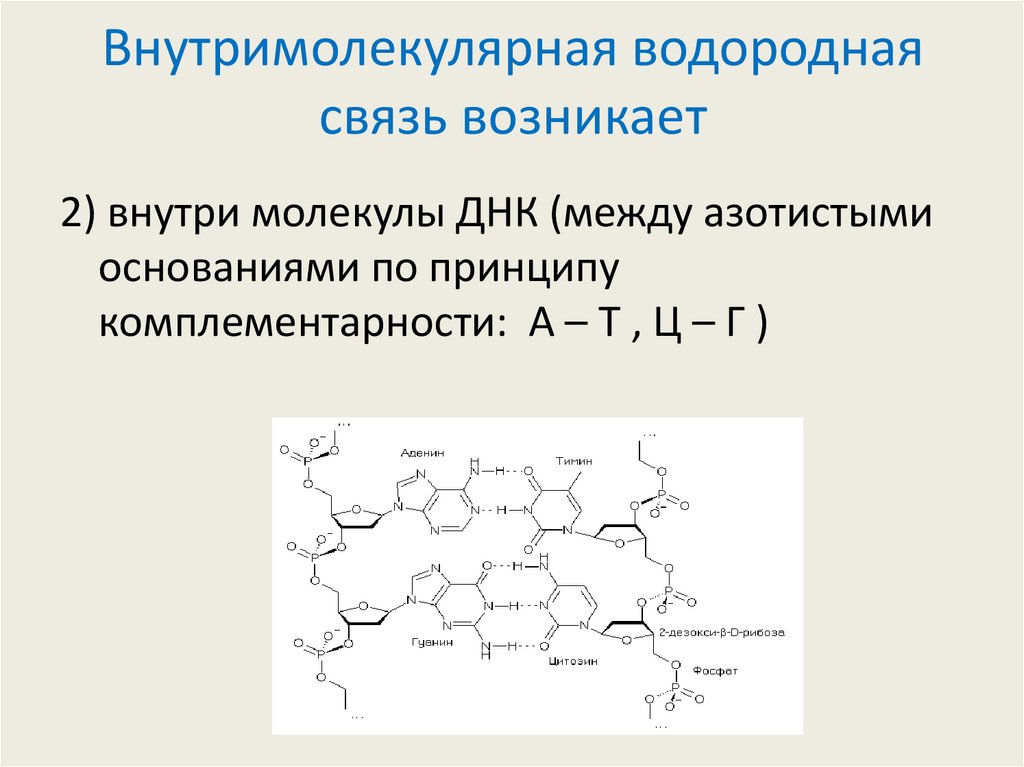
15. Внутримолекулярная водородная связь возникает
2) внутри молекулы ДНК (между азотистымиоснованиями по принципу
комплементарности: А – Т , Ц – Г )
16. Значение внутримолекулярной связи
• Способствует образованию молекул белкови ДНК
• Определяет функционирование ДНК и РНК
(репликация, транскрипция, трансляция)
17. Механизм образования водородной связи
Электростатическоепритяжение атома
водорода, имеющего
частично положительный
заряд, и атома кислорода
(фтора или азота),
имеющего частично
отрицательный заряд
Н δ+ – Fδ⁻ . . . Hδ+ – F δ-
Донорно-акцепторное
взаимодействие между
почти свободной орбиталью
атома водорода и
неподеленной электронной
парой атома кислорода
(фтора или азота)
18. Факторы, разрушающие водородную связь в белковой молекуле (денатурирующие факторы)
ВибрацииЭлектромагнитное излучение
Высокие температуры
Химические вещества











 Химия
Химия








