Похожие презентации:
lantul_respirator-122295
1. Oxidarea biologică Lanţul respirator Fosforilarea oxidativă
2. OBIECTIVELE
Oxidarea biologică. Dehidrogenarea substratelor - sursa energetică pentru sintezaATP - ului. Enziniele dehidrogenăni.
Lanţul respirator (schema). Complexele enzimatice. Acceptorii principali de
electroni şi protoni, structura lor chimică.
Potenţialul de oxido-reducere a componentelor lanţului respirator. Fosforilarea
oxidativă. Locurile de fosforilare. Produsele finale ale oxidării.
Reglarea intensităţii funcţionării lanţului respirator. Coeficientul P/O,
controlul respirator.
Decuplarea produselor de oxidare şi fosforilare, principalii agenţi decuplanţi. Rolul
biologic al produsului de decuplare, respiraţia liberă.
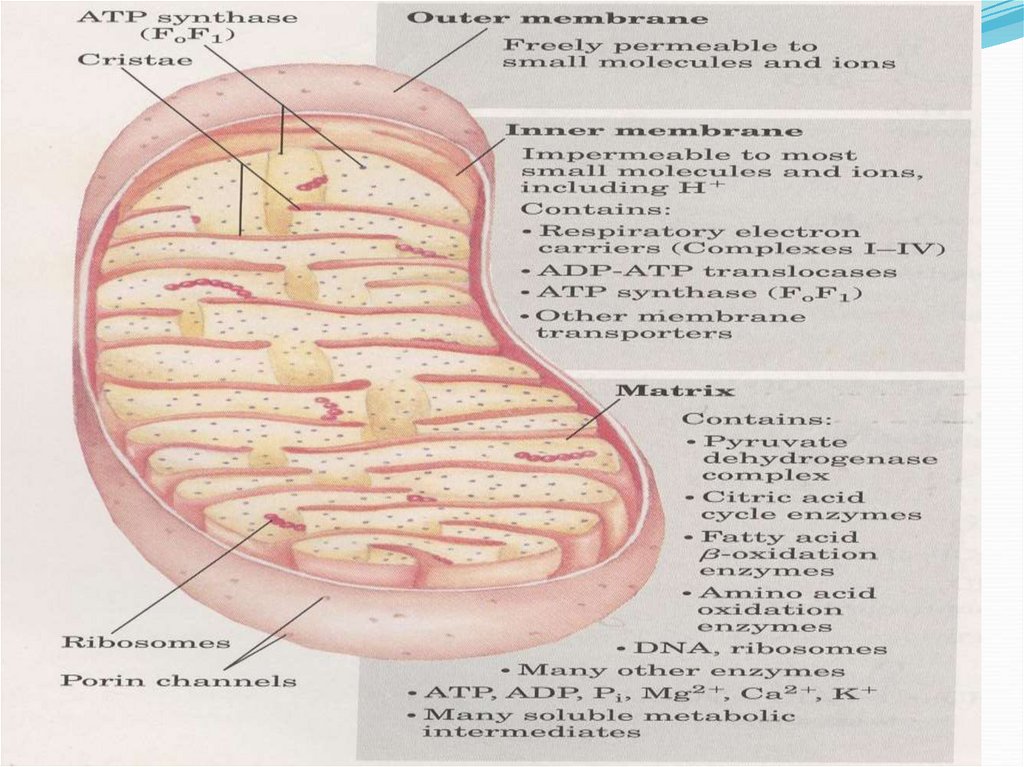
Mitocondriile, structura şi permeabilitatea selectivă a membranelor pentru diferiţi
compuşi.
Ipotezele principale, care explică procesele fosforilării oxidative. Ipoteza lui
Mitchell.
Oxidarea microzomală, rolul citocromului P450 în reacţiile de oxido-reducere.
Vitaminele şi rolul lor în procesele de oxidare biologică.
Noţiune de radicali liberi. Oxidarea peroxidică a acizilor graşi nesaturaţi din
membrane. Sistemele de protecţie a celulei de acumilarea radicalilor liberi.
3. Oxidarea biologică
Oxidarea biologică (OB) reprezintă totalitateareacţiilor de oxido-reducere ce decurg în celule şi
ţesuturi.
Rolul: asigură organismul cu energie
accesibilă în formă de ATP.
OB are loc prin reacţii de dehidrogenare →
donarea atomilor de H2 sub formă de protoni şi
electroni: H2→2H+ +2 ē.
Are loc sub acţiunea E → dehidrogenaze, ale
căror Co sunt NAD+ şi FAD
4. Dehidrogenarea substratelor: enzimele dehidrogenării NAD dependente.
1.Izocitrat +NAD→ alfa-cetoglutarat
+NADH+H
E- izocitratDH
2. Alfa-cetoglutarat +NAD → succinil Coa
+NADH+H
E-alfacetoglutaratDH
3.Malat +NAD →OA+NADH+H
E-malatDH
4. DOP
5. Dehidrogenarea substratelor Enzimele NAD dependente
Lactat +NAD →Piruvat +NADH+HE-lactatDH
Gliceraldehidfosfat +NAD +H3PO4→1,3
difosfoglicerat +NADH+H
E- GAP DH
Hidroxiacil CoA +NAD →cetoacil Co-A +NADH+H
E-hidroxiacil -CoA DH
Dezaminarea Glu
Oxidarea 3 hidroxibutiratului
Catabolismul alcoolului
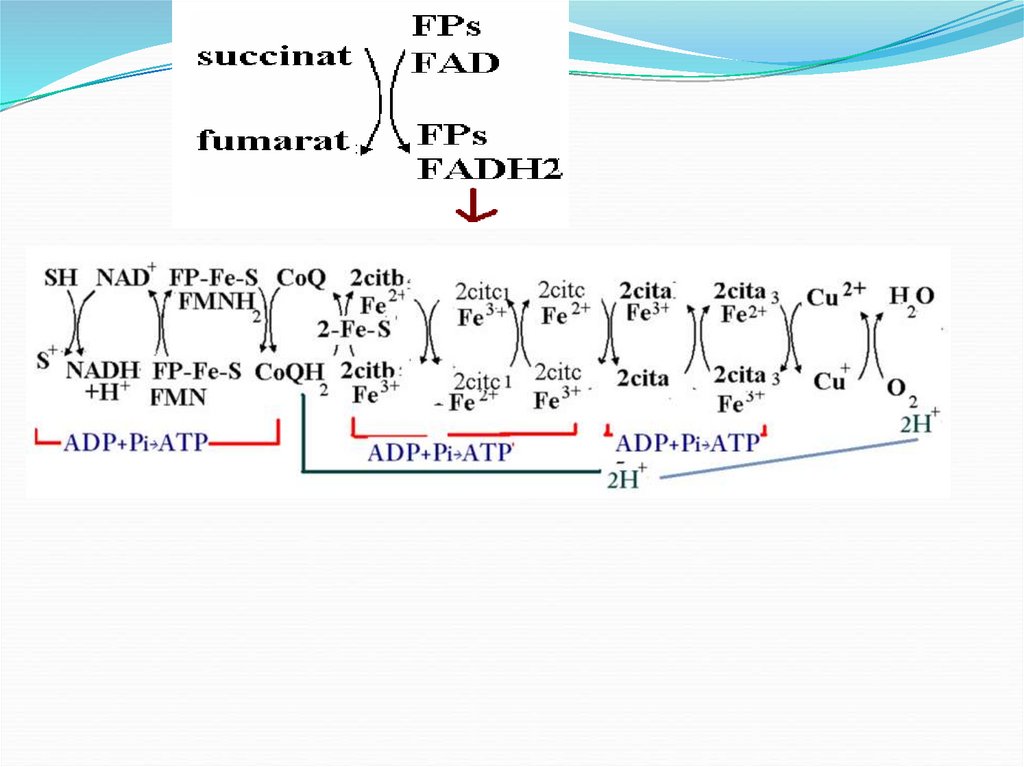
6. SUBSTRATELE FAD dependente
Succinat +FAD →Fumarat +FADH2E- succinat DH
Acil CoA + FAD →enoil-CoA+FADH2
E- acil CoA DH
Glicerol 3 P + FAD → GAP+ FADH2
NADH+H+ şi FADH2 rezultaţi în reacţiile de
oxidare a acestor substrate transferă p şi ē în
lanţul respirator.
7. Lanţul respirator (LR)
LR - un ansamblu (complex) de enzimeşi sisteme de oxido-reducere, ce
participă la transferul H+ şi ē de la Co
reduse (NADH, FADH2) la O2 cu
formarea H2O.
Este ultima etapă a degradării aerobe.
Este localizat în membrana internă a
MC
8. Funcţia LR:
1.Energetică – transferul electronilor în LR esteînsoțit de eliberarea energiei,ce e folosită la
sinteza ATP
2.Prin transferul protonilor şi electronilor → Co se
reoxidează, putând asigura dehidrogenări în
continuare.
9. Componentele LR
Nicotinamid adenin dinucleotidul (NAD+);Flavin proteinele ce au drept grupări
prostetice flavinmononucleotidul (FMN) sau
flavin adenin dinucleotidul (FAD);
Fier-sulf (Fe-S) proteinele;
Coenzima Q (CoQ) sau ubichinona;
Citocromii b,c1,c,a,a3
Citocromoxidaza - reacţionează direct cu oxigenul
molecular
10. Componentele LR
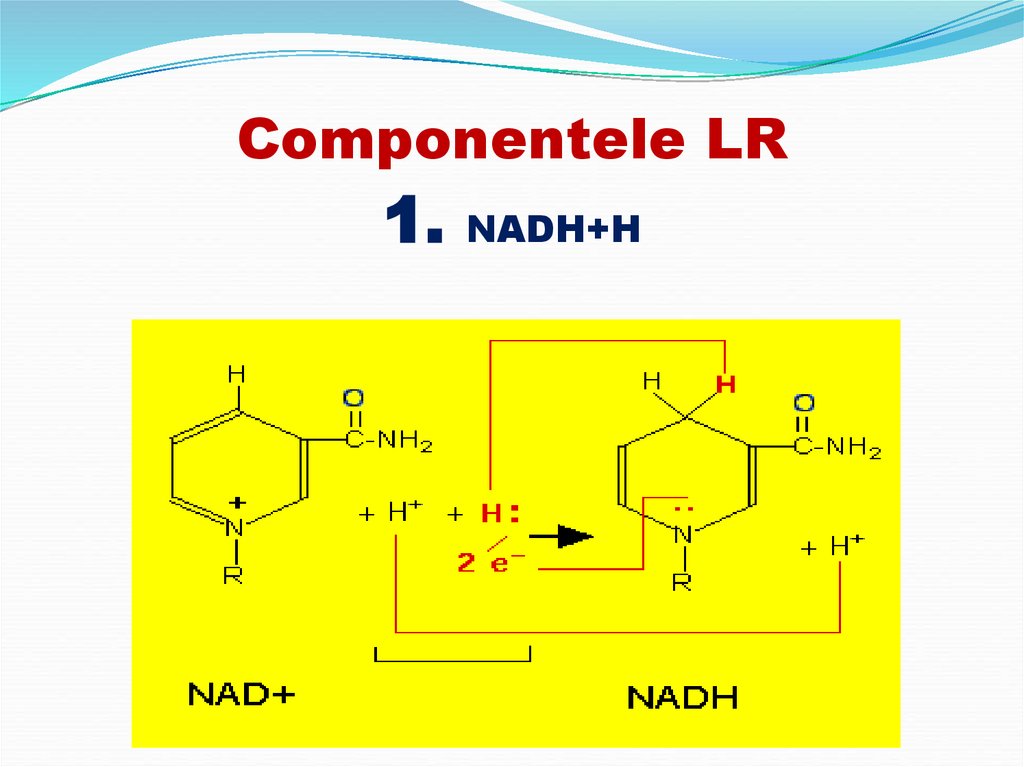
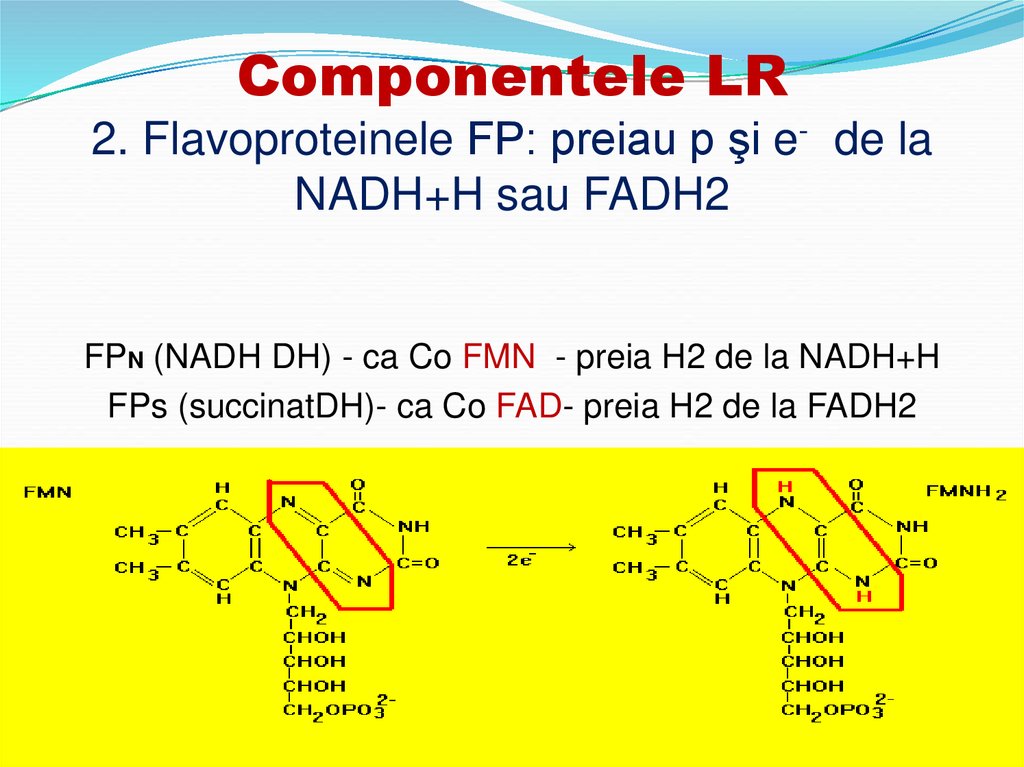
1. NADH+H11. Componentele LR 2. Flavoproteinele FP: preiau p şi e- de la NADH+H sau FADH2
FPN (NADH DH) - ca Co FMN - preia H2 de la NADH+HFPs (succinatDH)- ca Co FAD- preia H2 de la FADH2
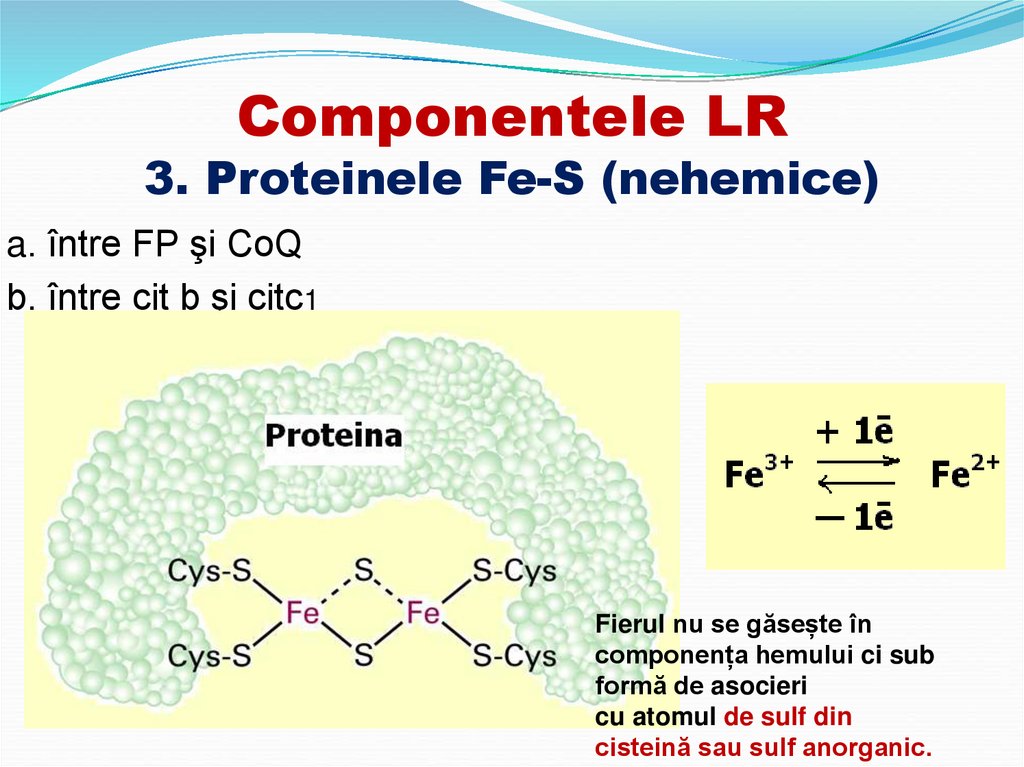
12. Componentele LR 3. Proteinele Fe-S (nehemice)
a. între FP şi CoQb. între cit b şi citc1
Fierul nu se găsește în
componența hemului ci sub
formă de asocieri
cu atomul de sulf din
cisteină sau sulf anorganic.
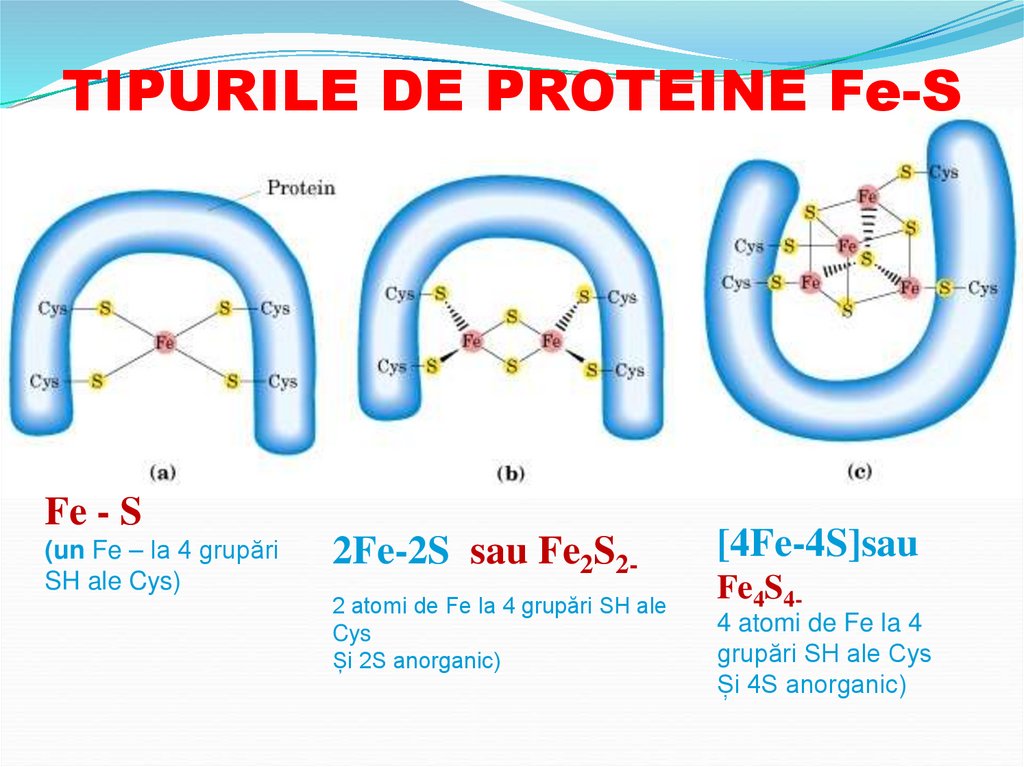
13.
TIPURILE DE PROTEINE Fe-SFe - S
(un Fe – la 4 grupări
SH ale Cys)
2Fe-2S sau Fe2S22 atomi de Fe la 4 grupări SH ale
Cys
Și 2S anorganic)
[4Fe-4S]sau
Fe4S44 atomi de Fe la 4
grupări SH ale Cys
Și 4S anorganic)
14. Componentele LR
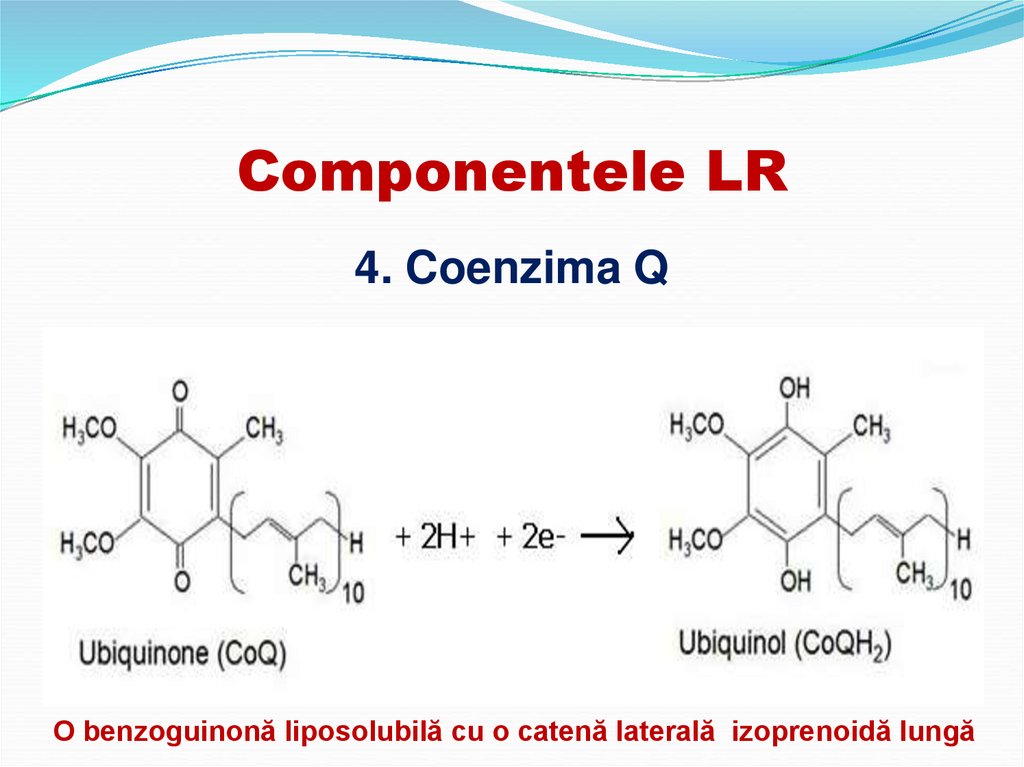
4. Coenzima QO benzoguinonă liposolubilă cu o catenă laterală izoprenoidă lungă
15. Componentele LR 5. Citocromii
b560, b562, b 566, c1, c, a şi a3Citocomii au ca grupare
prostetică hemul.
Diferă între ei prin:
• structură,
• proprietăți și
• potențialul redox.
• Citocromoxidaza (аа3) conține
cupru
Cu2+ + 1e ↔ Cu+ – 1e
16.
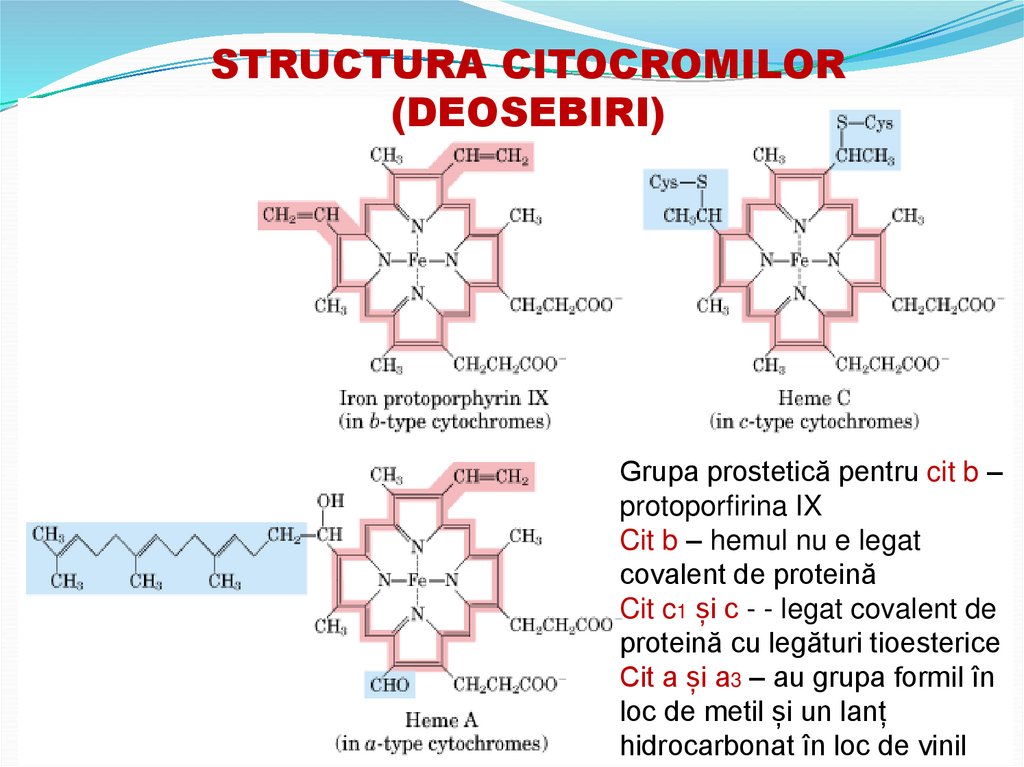
STRUCTURA CITOCROMILOR(DEOSEBIRI)
Grupa prostetică pentru cit b –
protoporfirina IX
Cit b – hemul nu e legat
covalent de proteină
Cit c1 și c - - legat covalent de
proteină cu legături tioesterice
Cit a și a3 – au grupa formil în
loc de metil și un lanț
hidrocarbonat în loc de vinil
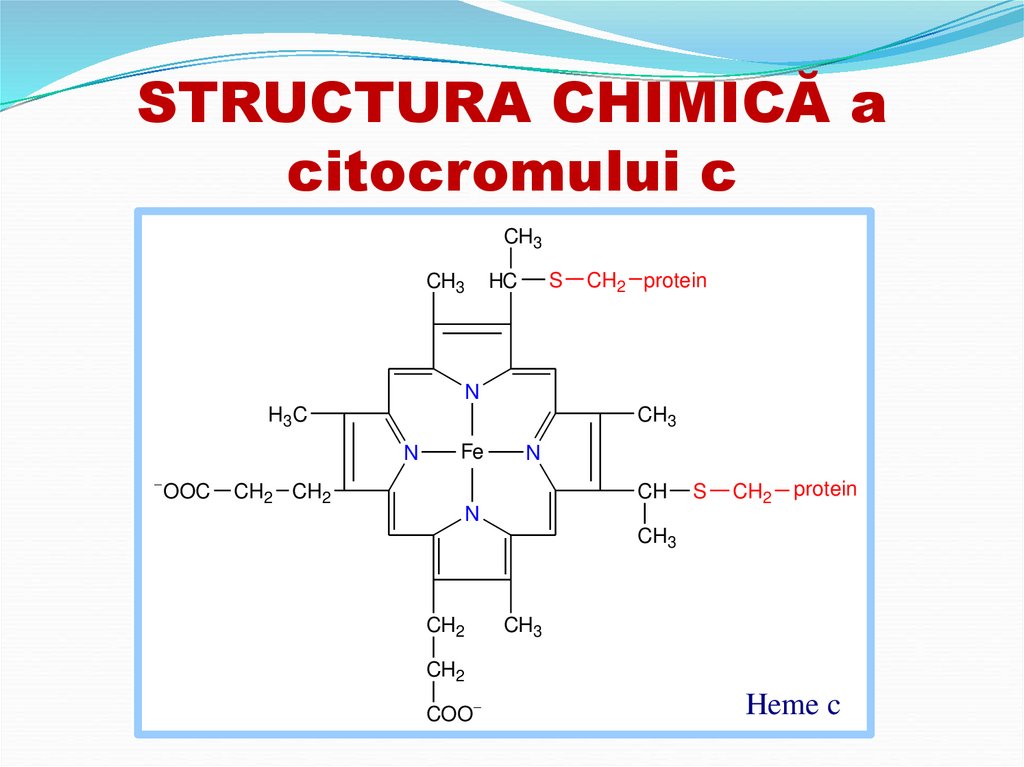
17. STRUCTURA CHIMICĂ a citocromului c
CH3CH3
S
HC
CH2 protein
N
H3C
CH3
N
OOC
CH2 CH2
Fe
N
CH
N
S
CH2
protein
CH3
CH2
CH3
CH2
COO
Heme c
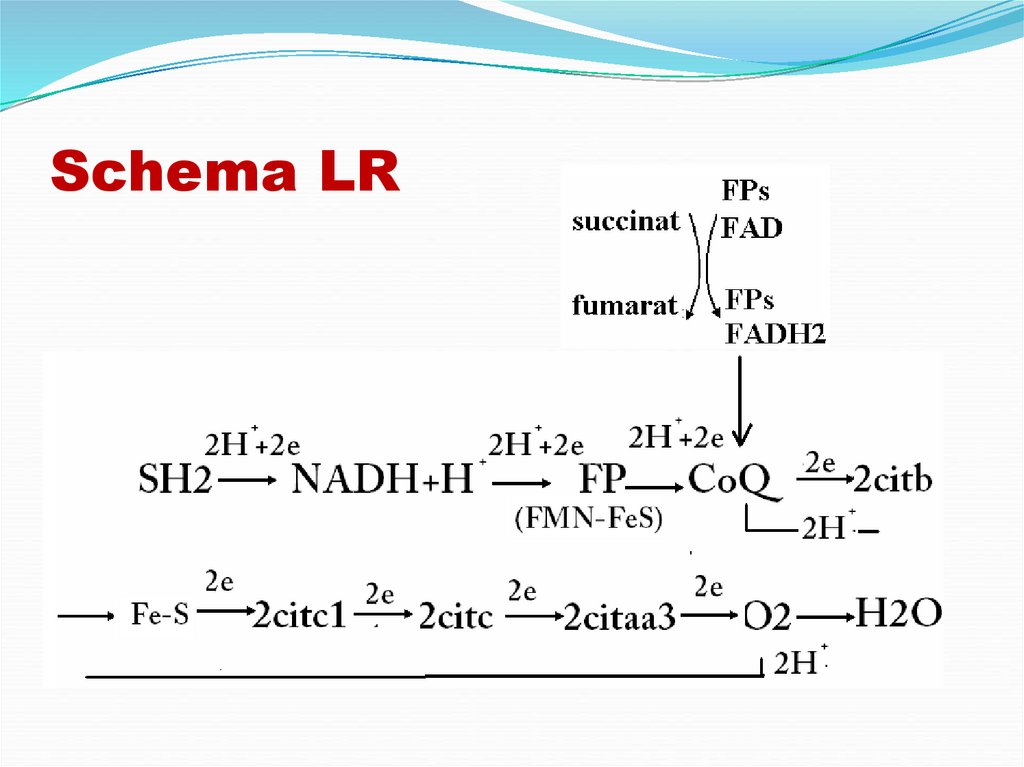
18. Schema LR
19. Potenţialul oxidoreducător (redox)
1. Fiecare verigă a LR poate exista în 2 forme – redusăşi oxidată, deci,
Formează o pereche oxidoreducătoare
1. Fiecare sistem redox (O/R) este alcătuit dintr-un
donor şi acceptor
2. Caracteristica lor principală este potenţialul
oxidoreducător (redox), care se măsoară în volţi.
3.
El este măsura valorică a capacităţii de oxidare sau
reducere a compusului
20. Potenţialul redox
Cu cât potenţialul redox este mai electronegativcu atât este mai înaltă capacitatea de a ceda ē,
şi invers,
cu cât potenţialul este mai electropozitiv, cu atât
este mai înaltă capacitatea sistemului de a
adiţiona electroni.
Sistemele redox sunt aranjate în ordinea creşterii
potenţialului de oxido-reducere.
21. Potenţialul oxidoreducător al verigilor LR
1.2.
3.
4.
5.
6.
7.
8.
9.
NAD+/NADH.H+ ― -0,32V
FAD/FADH2
– -0,05 V
CoQ/CoQH2
― +0,04 V
cit.b (Fe3+)/cit.b (Fe2+) ― +0,12V
cit.c1 (Fe3+)/cit.c1 (Fe2+) ― +0,22V
cit.c (Fe3+)/cit.c (Fe2+) ― +0,25V
cit.a (Fe3+)/cit.a (Fe2+) ― +0,29V
cit.a3 (Fe3+)/cit.a3 (Fe2+) ― +0,55V
½O2/H2O
― +0,82V
22. Potenţialul oxidoreducător
transferul în trepte permite eliberarea energiei în“pachete” a cărei valoare este în jurul lui –7,3 kcal/mol (cât
necesită sinteza unui mol de ATP din ADP şi H3PO4).
4 H+ + 4 ē + O2 → 2 H2O + ΔG0
ΔG0 = ― 52,6 kcal
Cantitatea energiei eliberate depinde de
potenţialul redox
23. Energia liberă standard
Ştiind potenţialul redox al fiecărei perechi se potcalcula modificarea energiei libere standard.
ΔG = -nFΔE0
n-numărul de ē
F-constanta lui Faraday (23062 cal/V∙mol)
ΔE0-diferenţa de potenţial
ΔG = -2∙23062 [+0,82-(-0,32)] = -52,6 kcal
7,3 x 3 = 21,9
Randamentul utilizării energiei libere – 42%
24. Energia liberă standard
Torentul de ē e orientat în direcţiamicşorării energiei libere a sistemului
Cu cât e mai mare diferenţa potenţialului
dintre 2 redox perechi → cu atât mai mare
e diminuarea energiei libere la transferul ē.
25. FOSFORILAREA OXIDATIVĂ
reprezintă sinteza ATP din ADP şiPi (cuplată cu LR), pe seama
energiei eliberate la transferul
echivalenţilor reducători în LR de la
coenzimele reduse la O2.
26. FOSFORILAREA OXIDATIVĂ
Deoarece transferul de ē are loc treptat,energia se eliberează „în pachete” – în
trepte .
Pentru a se forma ATP diferenţa de
potenţial trebuie să fie nu mai mică de
0,22V.
Funcţionarea cuplată a LR şi FO este
asigurată de 5 complexe
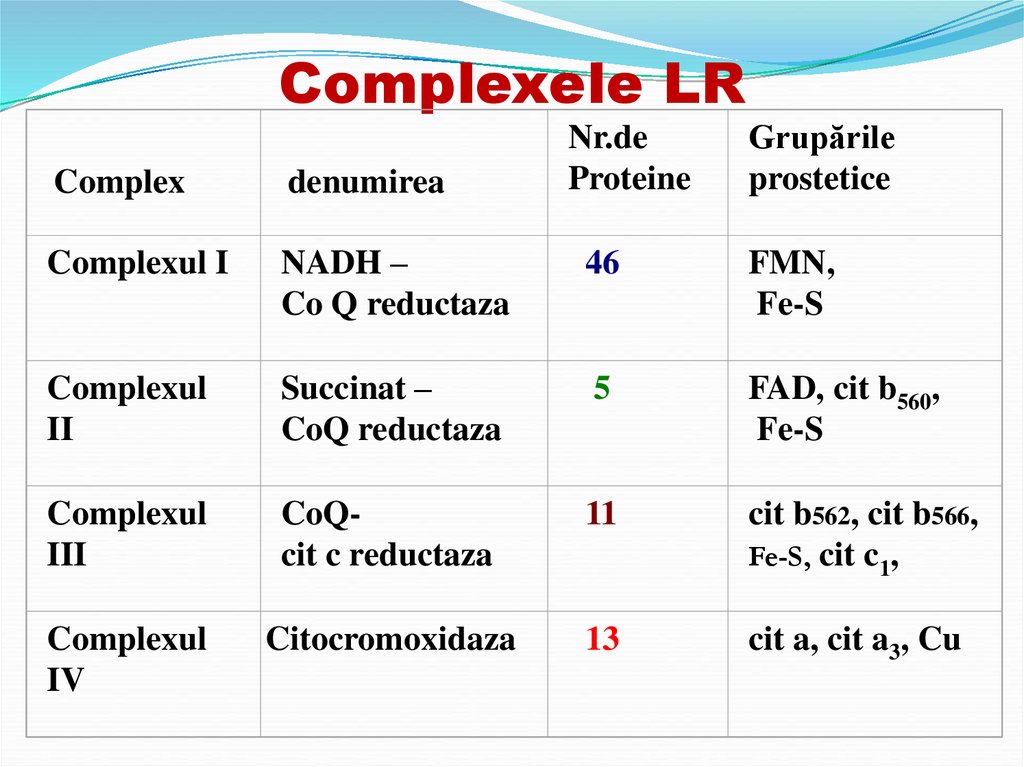
27. Complexele LR
Nr.deProteine
Grupările
prostetice
Complex
denumirea
Complexul I
NADH –
Co Q reductaza
46
FMN,
Fe-S
Complexul
II
Succinat –
CoQ reductaza
5
FAD, cit b560,
Fe-S
Complexul
III
CoQcit c reductaza
11
cit b562, cit b566,
Fe-S, cit c1,
Complexul
IV
Citocromoxidaza
13
cit a, cit a3, Cu
28. Complexul I- NADH → CoQ – reductază
Variația de potenţial 0,42 V,1mol ATP
G
o`
19 ,4 kcal/mo l
Inhibitorii: rotenona (otravă pentru peşti), Na
amitalul (barbituricelor) - blochează transferul de
hidrogen de la centrii Fe-S la ubichinonă
piericidină (antibiotic) – cu structură asemănătoare
CoQ, cu care intră în competiţie
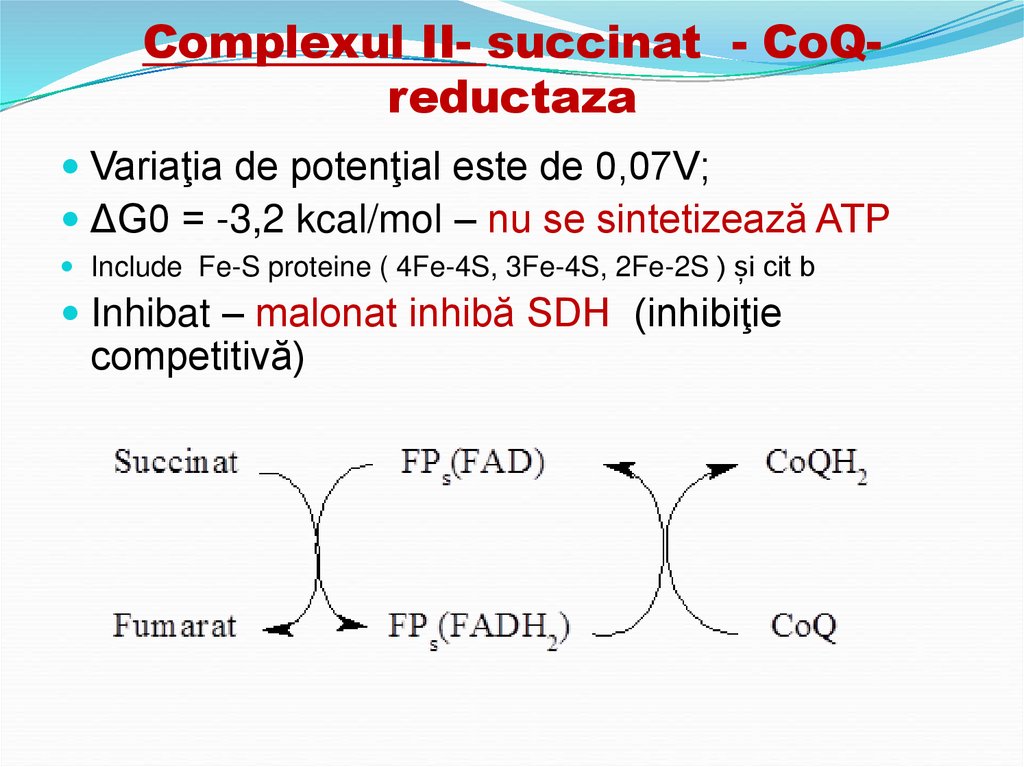
29. Complexul II- succinat - CoQ-reductaza
Complexul II- succinat - CoQreductazaVariaţia de potenţial este de 0,07V;
ΔG0 = -3,2 kcal/mol – nu se sintetizează ATP
Include Fe-S proteine ( 4Fe-4S, 3Fe-4S, 2Fe-2S ) și cit b
Inhibat – malonat inhibă SDH (inhibiţie
competitivă)
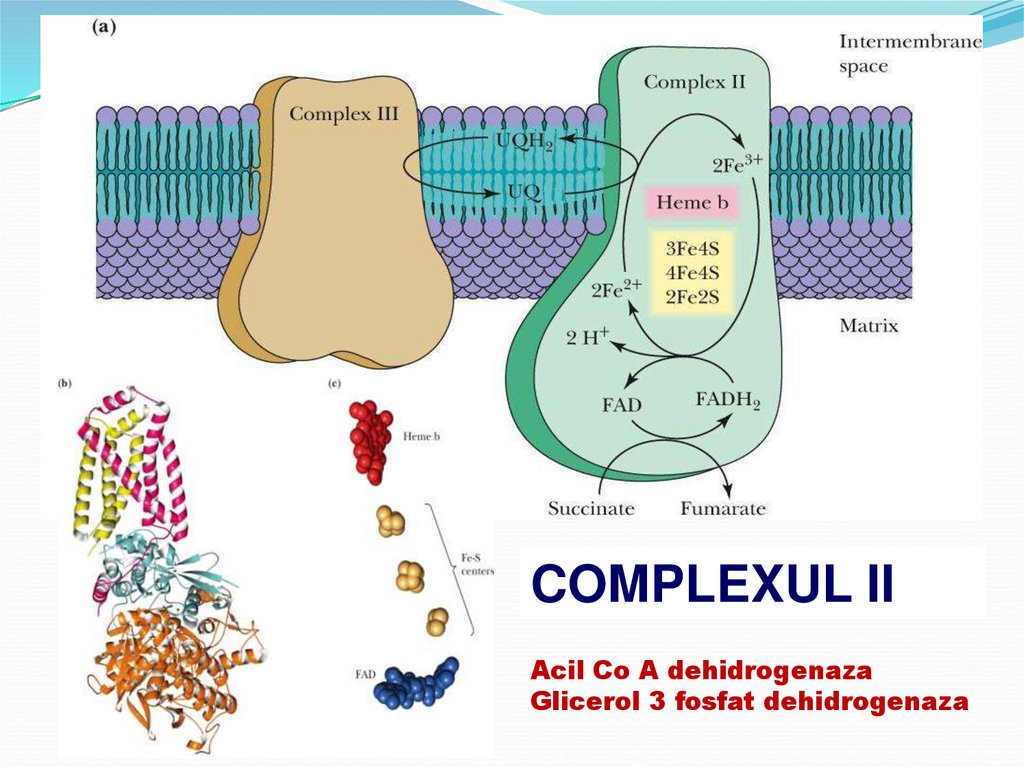
30.
COMPLEXUL IIAcil Co A dehidrogenaza
Glicerol 3 fosfat dehidrogenaza
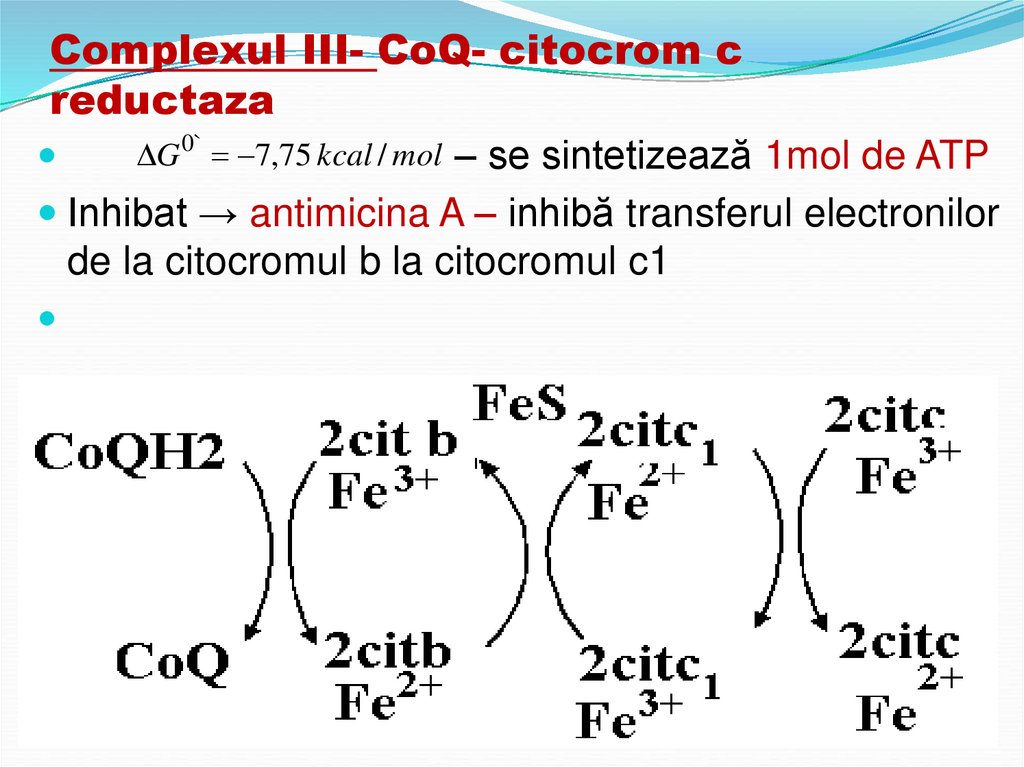
31. Complexul III- CoQ- citocrom c reductaza
G 0` 7,75 kcal / mol – se sintetizează 1mol de ATPInhibat → antimicina A – inhibă transferul electronilor
de la citocromul b la citocromul c1
32. Complexul IV- citocromoxidază
Catalizează adiţia a 4ē la O2 molecular (a 2ē la ½O).O2 + 4ē + 4H+ → 2H2O
Căderea de potenţial de 0,54V.
ΔG = -24,8 kcal → se sintetizează 1mol de ATP
Inhibat: CO, cianuri, hidrogenul sulfurat (H2S),şi azida
de sodiu (NaN3)
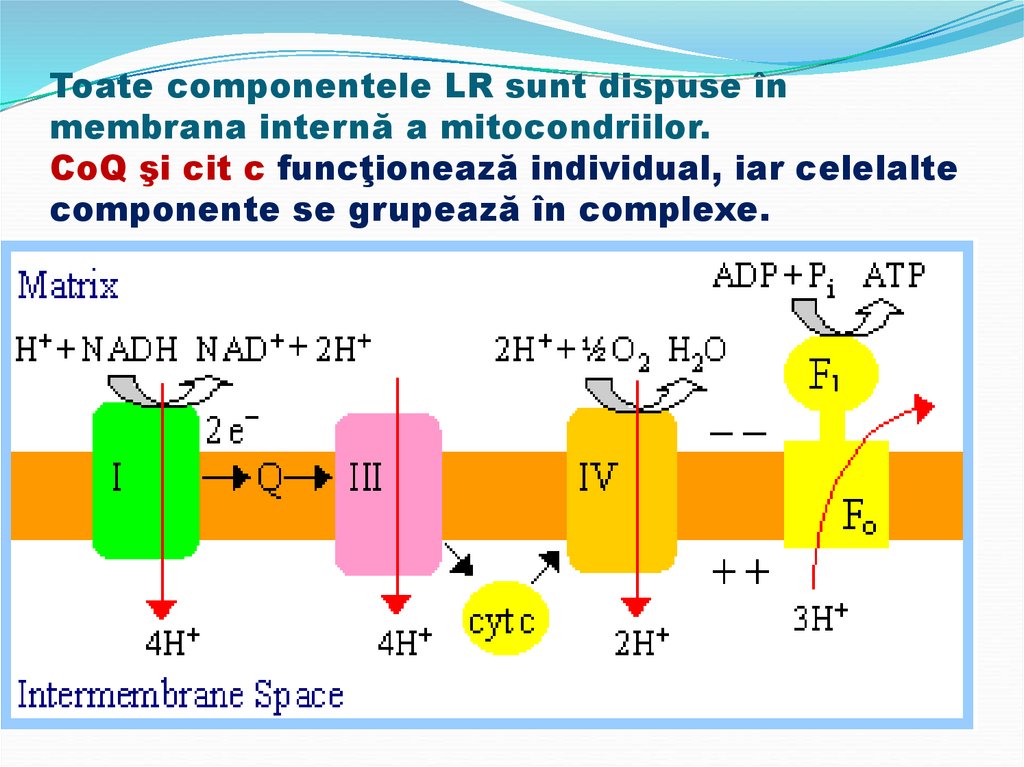
33. Toate componentele LR sunt dispuse în membrana internă a mitocondriilor. CoQ şi cit c funcţionează individual, iar celelalte
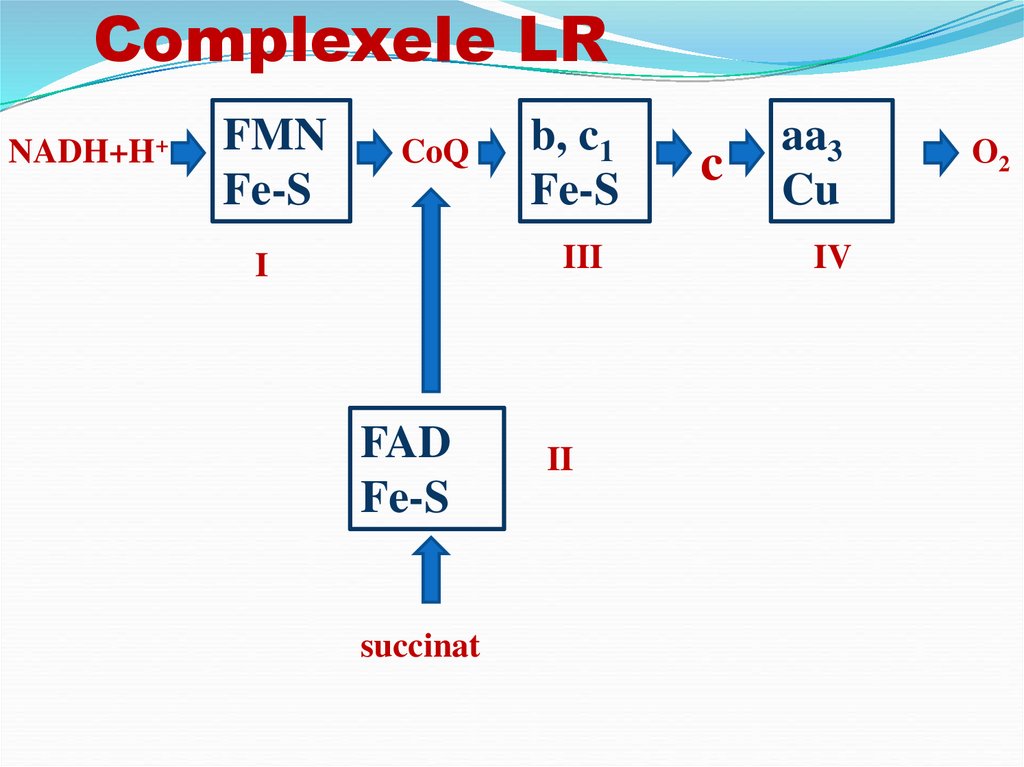
componente se grupează în complexe.34.
Complexele LRNADH+H+
FMN
Fe-S
CoQ
b, c1
Fe-S
III
I
FAD
Fe-S
succinat
II
c
aa3
Cu
IV
O2
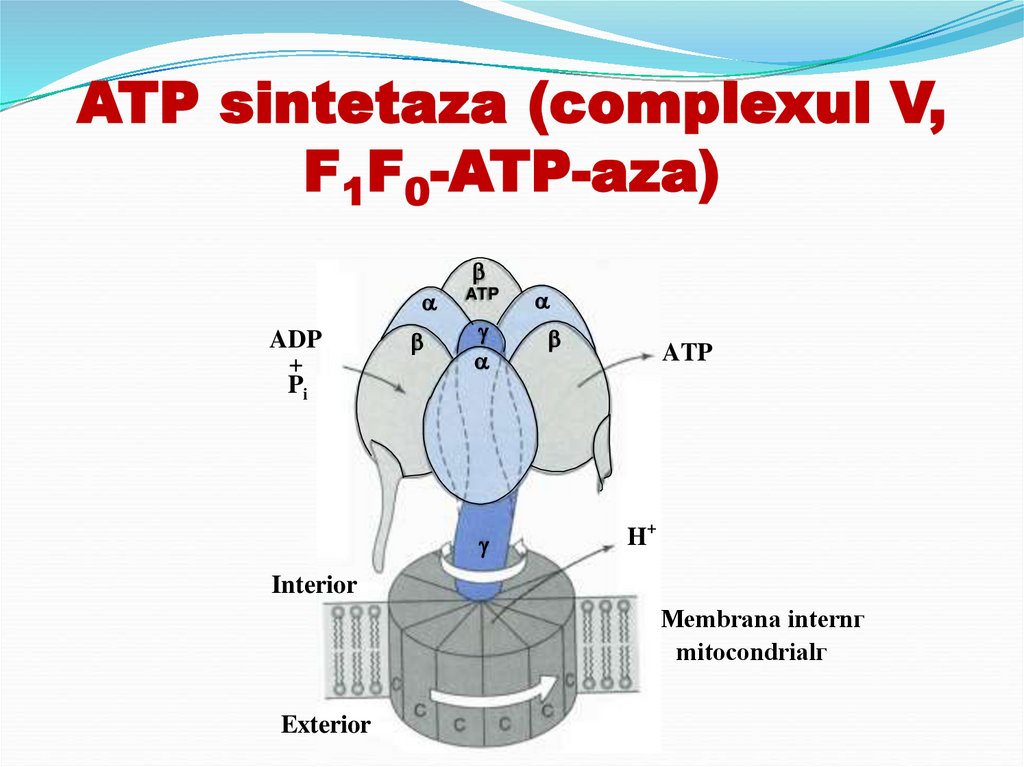
35. Complexul V – ATP-sintetază
Complexul V – ATPsintetazăF0 → canal de protoni - străbate membrana
F1- partea catalitică - se află în intregime în
internă a MC, constă din 4 tipuri de proteină ce
formează un sistem de pori transmembranari prin care
trec protonii
matrixul MC (formă de sferă).
a. e alcătuită din cinci tipuri de proteine ααα (α3), βββ
(β3), γ, δ, ε.
b. la acest nivel are loc reacţia de condensare a
ADP + Pi →ATP+H2O
Inhibată: oligomicină (F0), atractilatul (glicozidă)
36. ATP sintetaza (complexul V, F1F0-ATP-aza)
ADP+
Pi
ATP
ATP
H+
Interior
Membrana internг
mitocondrialг
Exterior
37.
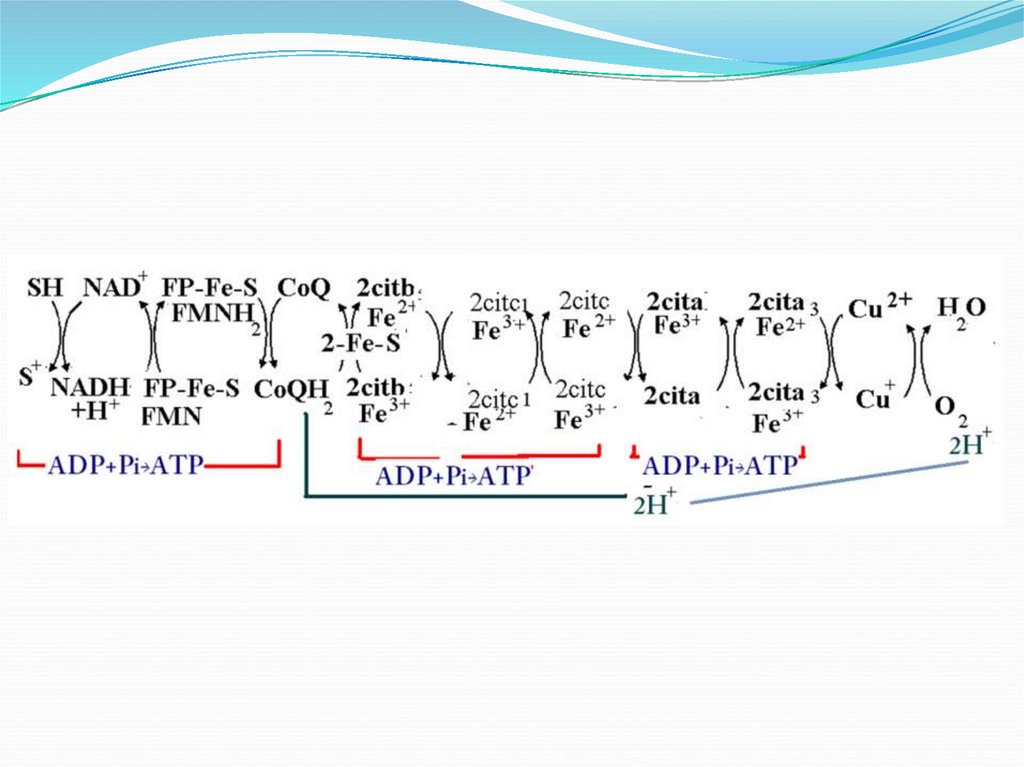
38. Puncte de fosforilare
Locusurile unde are loc sinteza ATPse numesc puncte de fosforilare.
În LR deosebim 3 puncte de
fosforilare:
1. NADH+H----CoQ
2. Cit b----citc
3. cita--cita3
39.
40. Bilanţul general în procesele LR-FO.
Bilanţul general în procesele LRFO.NADH + H+ + ½O2 + 3ADP + 3Pi
→ NAD+ + 3ATP + 4H2O
FADH2 + ½O2 + 2ADP + 2Pi →
FAD + 2ATP + 3H2O
41.
42. Ipoteze principale cu privire la procesele de FO. Ipoteza lui Mitchell
Prin ce mecanism energia eliberată în LR estecuplată cu formarea ATP?
Teoria chimică, numită şi a intermediatorilor
comuni (produşi intermediatori macroergici,
precursori de ATP).
Teoria conformaţională (energia este preluată de
o proteină într-o conformaţie activă, ce
stimulează ATP).
Teoria chemiosmotică (Mitchell, 1961).
43.
Piter D. MItchell(1920-1992)
Premiul Nobel
în chimie, 1978
pentru teoria chemiosmotică a cuplării
oxidării cu fosforilarea
în lanţul respirator
44. Teoria chemiosmotică
postulează:energia care determină sinteza ATP din
ADP şi Pi îşi are originea în gradientul de
protoni ce se stabileşte între suprafaţa
internă şi externă a membranei interne
mitocondriale în timpul transportului de
electroni.
45. Ipoteza lui Mitchell
la transferul electronilor în LR se pompeazăprotonii din matrixul MC în spaţiu intermembranar.
Pentru fiecare pereche de e transferați la O2 în
spaţiul intermembranar sunt pompați 4 protoni
(4H+) de către complexul I; 4 protoni (4H+) de
complexul III și 2 protoni de complexul IV
46. Ipoteza lui Mitchell
Protonii nu pot reveni înapoi deoarece membranainternă a MC nu este permiabilă
apare gradientul de protoni
Concentrație mai mare de Н+ pe fața externă a
membranei interne a MC și mai mică pe fața
internă a membranei interne a MC
partea externă a membranei interne a MC→
pozitivă, dar cea internă – negativă
47. Gradientul de protoni
are 2 gradiente:1. Gradientul electric (apăre potenţialul de
membrană - ∆ψ (0,14V) - partea externă a
membranei interne a MC→ pozitivă, dar cea
internă – negativă
2 gradientul chimic de pH (∆ pH) - partea
externă a membranei interne a MC→ pH –ul
mai acid față de cea internă
Împreună potențialul electric și gradientul
protonic alcătuiesc potențialul electrochimic ∆µН+
48.
Gradientul de protonidetermină FORŢA PROTON-MOTRICE (Δp)
Δp = Δψ – 2,303(RT/F)· ΔpH,
unde: ψ – potenţialul membranar;
R – constanta gazelor;
T – temperatura
F – constanta Faraday
49. Ipoteza lui Mitchell
Protonii acumulaţi în spaţiul intermembranar vorreveni înapoi în matrix prin ATP sintetază (F0)
Această translocare se realizează cu eliberare de
energie;
Energia eliberată va servi la sinteza de ATP
Acest flux de protoni este forţa morice care
determină la nivelul subunităţii F1 sinteza de ATP din
ADP+Pi
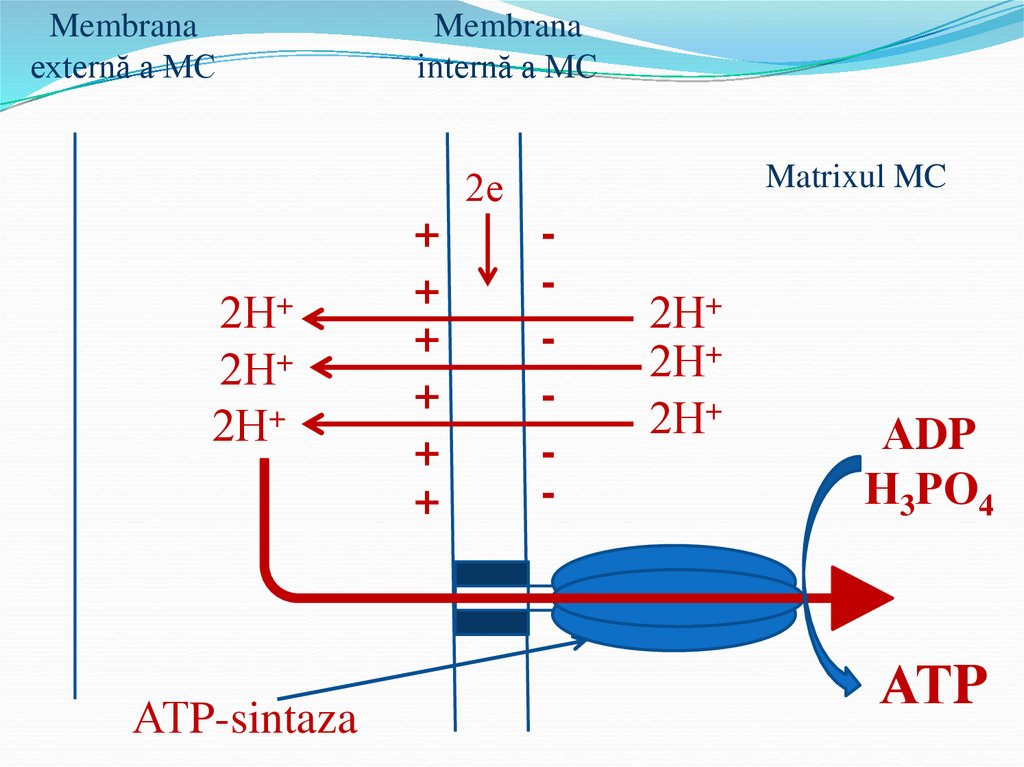
50.
Membranaexternă a MC
Membrana
internă a MC
Matrixul MC
2е
2Н+
2Н+
2Н+
АТP-sintaza
+
+
+
+
+
+
-
2Н+
2Н+
2Н+
АDP
Н3РО4
АТP
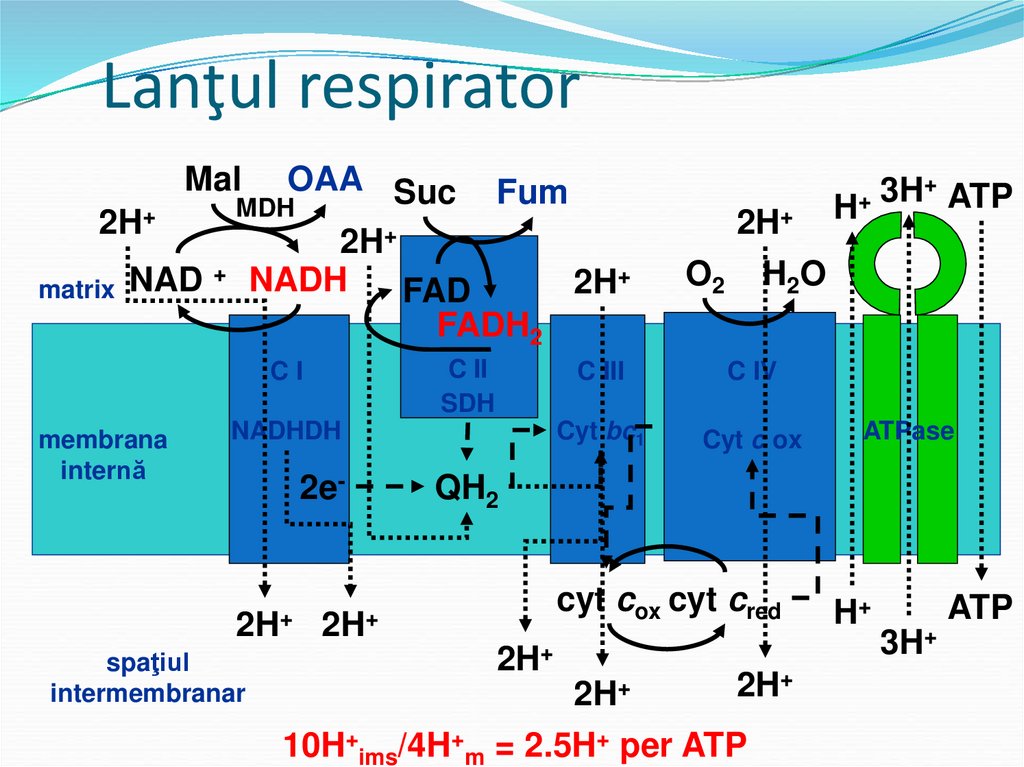
51. Lanţul respirator
MalOAA Suc Fum
MDH
2H+
2H+
+ NADH
+
2H
matrix NAD
FAD
FADH2
C II
SDH
CI
membrana
internă
NADHDH
2e-
2H+
spaţiul
intermembranar
2H+
O2 H2O
C III
C IV
Cyt bc1
Cyt c ox
+
3H
ATP
+
H
ATPase
QH2
cyt cox cyt cred
2H+
2H+
2H+
2H+
10H+ims/4H+m = 2.5H+ per ATP
H+
ATP
3H+
52. Datele experimentale ce confirmă:
S-a confirmat generarea gradientului deprotoni în cele 3 puncte ale LR. Anume –
gradientul de protoni se utilizează la sinteza
ATP.
S-a demonstrat ca pH matrixului mitocondrial
creşte, iar cel al mediului extern al membranei
MC – scade (acid).
S-a argumentat că transferul H+ din MC în
timpul transportului de ē şi revenirii lor prin
ATP-sintetaza sunt comparabile cu viteza lor
din cadrul FO în MC intacte.
53. CÂT de fosforilare
Raportul între numărul de moli de ATP produşi şiO2 consumat este numit „cât de fosforilare”
P/O.
De la NADH+H pînă la O2 - P/O = 3/1 – ramura
lungă,
De la FADH2 pînă la O2 - P/O = 2/1 – ramura
medie.
P/O reflectă cuplarea transportului H+ şi ē
(respiraţia) şi fosforilarea (sinteza ATP).
Coeficient indică ce cantitate de P anorganic
(H3PO4) se transformă în P organic (ATP) la
transportul unei perechi de H+ şi ē în LR.
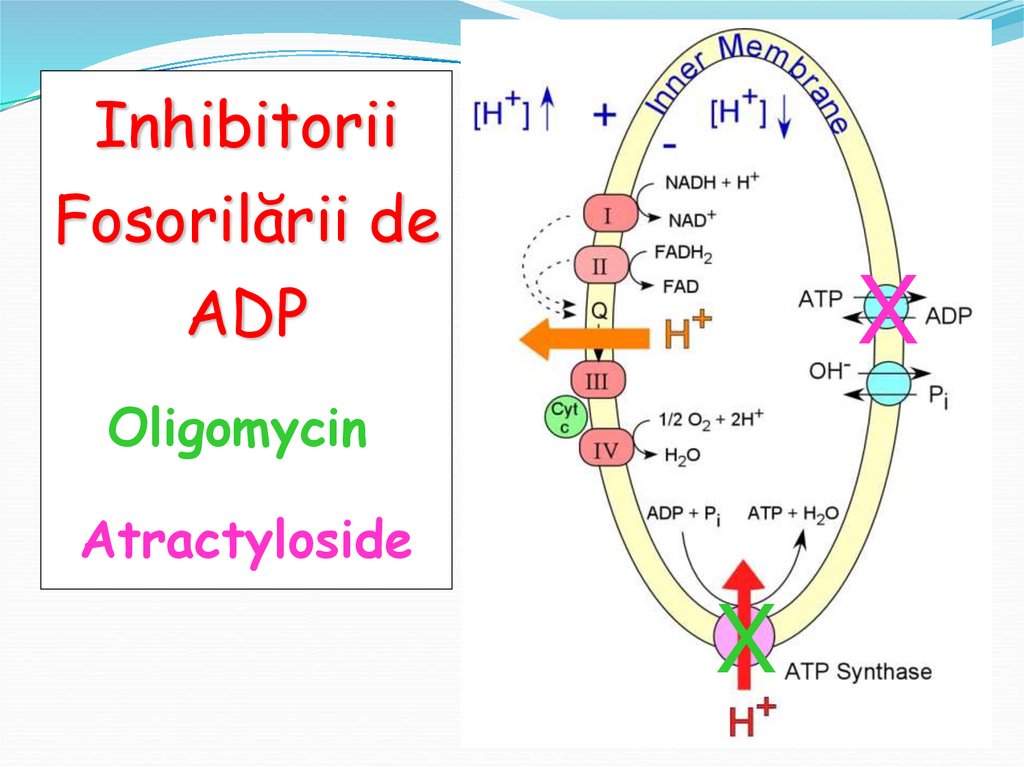
54. Inhibitorii ai fosforilării
acţionează asupra ATP-sintetazei.Oligomicina blochează pătrunderea
H+ prin FO (închide canalul) cu
încetul slăbeşte respiraţia →
întrerupere.
55.
InhibitoriiFosorilării de
ADP
X
Oligomycin
Atractyloside
X
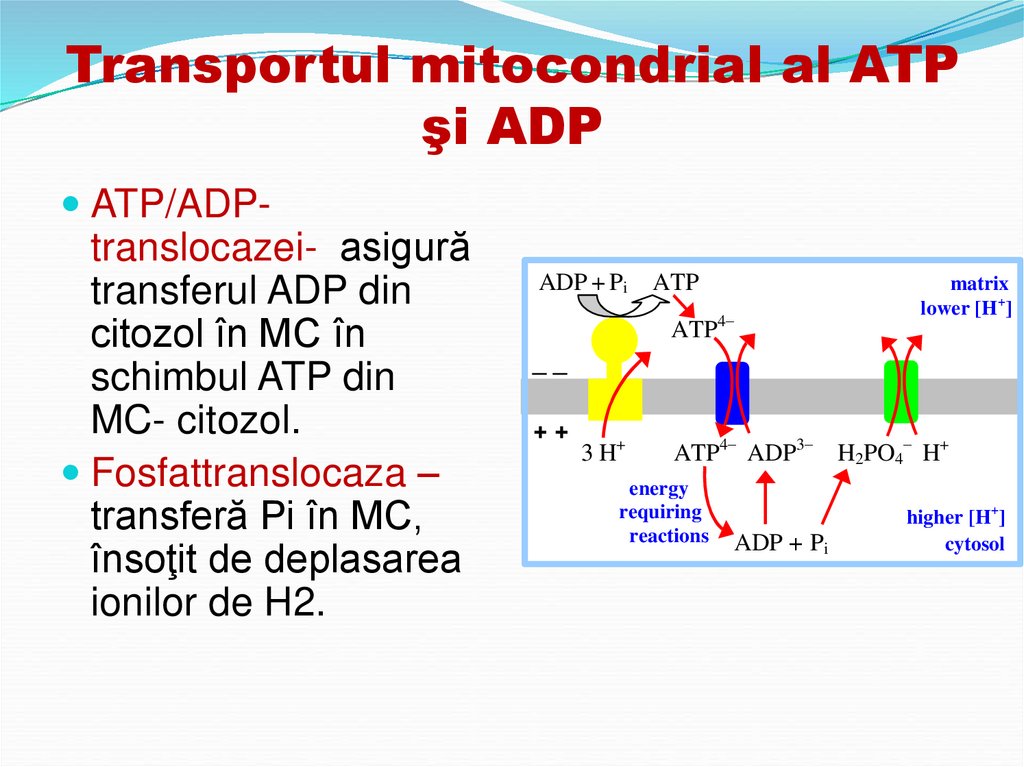
56. Transportul mitocondrial al ATP şi ADP
ATP/ADPtranslocazei- asigurătransferul ADP din
citozol în MC în
schimbul ATP din
MC- citozol.
Fosfattranslocaza –
transferă Pi în MC,
însoţit de deplasarea
ionilor de H2.
ADP + Pi ATP
ATP4
matrix
lower [H+]
__
++
3 H+
ATP4 ADP3 H2PO4 H+
energy
requiring
reactions
ADP + Pi
higher [H+]
cytosol
57. Controlul respirator
Organismele vii sintetizează ATP înraport cu necesitatea lui – de aceea FO
cuplată cu LR este riguros controlată.
Deoarece LR şi FO – etapa finală a
degradării G, L, P controlul respirator se
poate efectua atât prin compuşi direct
implicaţi în LR şi FO, cât şi prin
intermediatorii degradării celor 3 clase.
58. Controlul respirator
Rolul primordial îi revine ADP.1.în lipsă de ADP rămâne blocat F1 din ATP
- sintază
2. nivelul ADP determină şi intensitatea
transferului de protoni prin F0
3.ADP – reglator alosteric (+) pentru mai
multe E ce sunt implicate în degradarea G,
L şi P.
59. Controlul respirator
Lipsa de ADP - inhibă respiraţia şistopează fosforilarea.
La adăugarea de ADP creşte brusc
consumul de 02 ---- se activeaza
lantul respirator şi ADP se fosforilează
la ATP.
60. La FO contribue:
1. Integritatea membranei interne a MC→ orice leziune duce la pierderea
capacităţii de FO (în timp ce transferul de
ē poate continua).
2. Impermeabilitatea membranei interne
pentru ionii H+ OH- K+ Cl-.
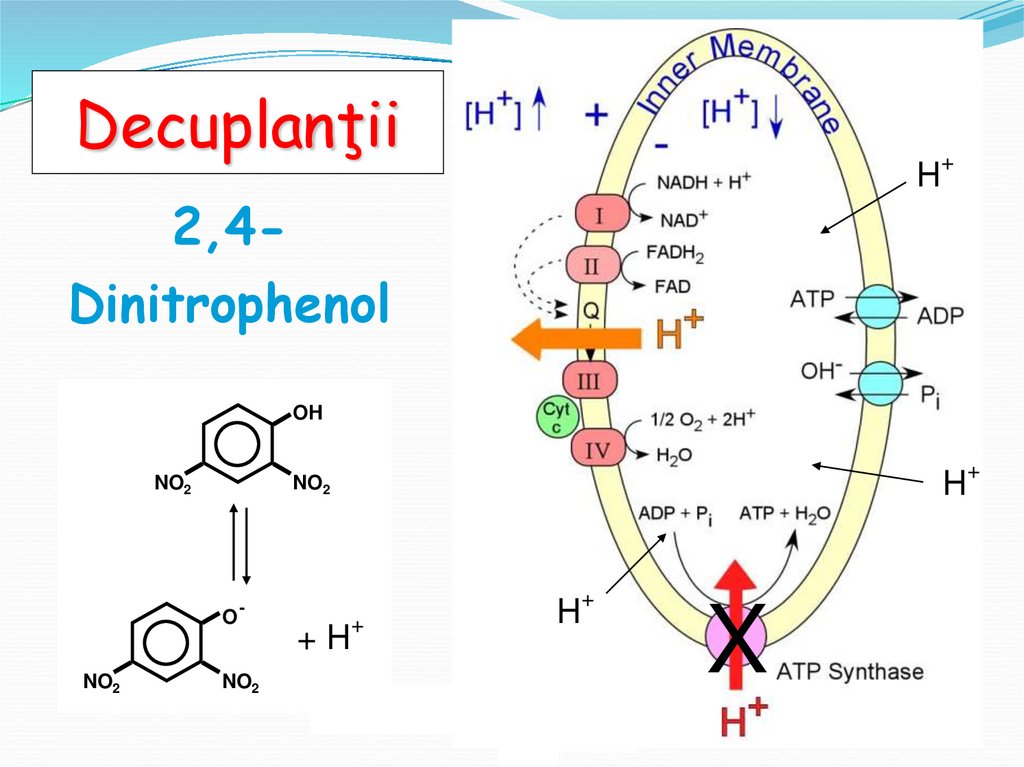
61. Decuplarea LR de FO Agenţi decuplanţi.
Are loc sub acțiunea substanțelor, care transferă protonii(protonofori) sau ioni (ionofori) din spațiul intermembranar în
matrixul MC fără utilizarea ATP-sintazei
Acest tip de substanțe - agenţi decuplanţi (AD)
Decuplanţii fosforilării oxidative nu influenţează
semnificativ reacţiile LR - fluxul de electroni, dar opresc
sinteza de ATP (FO) - dispare gradientul protonic
energia este disipată sub formă de căldură
62.
AGENȚII DECUPLANȚI1. a.g. liberi
2. 2,4 dinitrofenol
3. salicilaţii (antiinflamatoare)
4. dicumarol (anticoagulant)
5. T3 şi T4 (h.gl.tiroide)
sunt acizi slabi, lipofili, care acţionează
ca transportori de protoni prin
membrana internă.
63.
DecuplanţiiH+
2,4Dinitrophenol
OH
NO2
O
NO2
H+
NO2
-
NO2
+ H+
H+
X
64.
Agenții decuplanțimăresc termogeneza
65. AD naturali: Termogenina (UCP-1)
AD naturali:Termogenina (UCP-1)
- o proteină decuplantă prezentă în mitocondriile
din ţesutul adipos brun.
are rolul de a împiedica revenirea protonilor în
matrix prin canalul protonic (FO), ei fiind utilizaţi
pentru a produce căldură în loc de ATP.
Acest proces are loc în mod fiziologic pentru
menţinerea temperaturii corporale la animalele
care hibernează; la noi născuți
ţesutul adipos brun este specializat în producerea
căldurii: conține în cantități mari MC; enzime ale
LR și termogenina
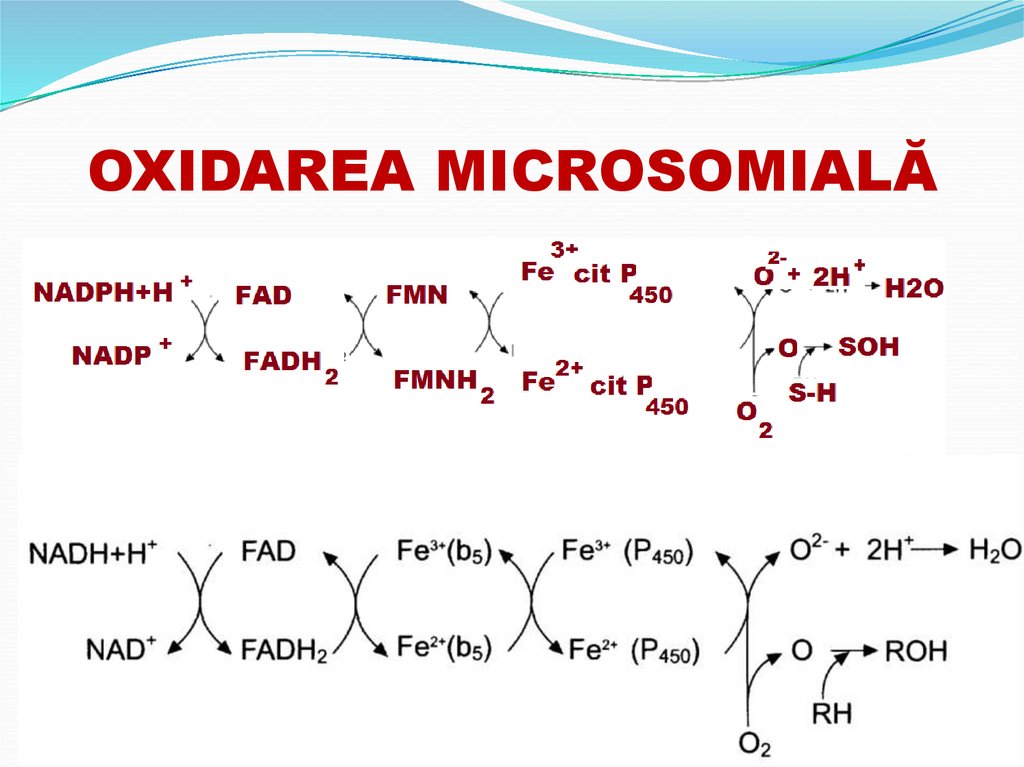
66. OXIDAREA MICROSOMIALĂ
localizată în reticolul endoplasmatic al celulelorhepatice şi suprarenale.
Include hidroxilarea anumitor substanțe
sunt lanţuri scurte de transport al H+ şi ē a căror
sursă sunt NADPH+H
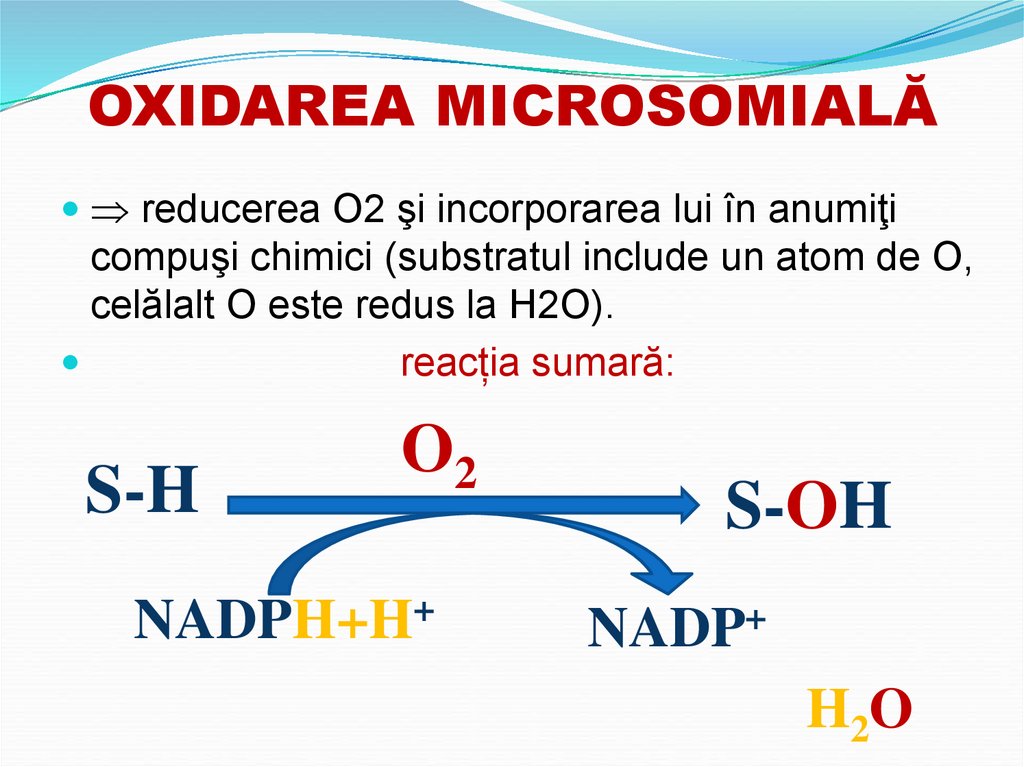
67. OXIDAREA MICROSOMIALĂ
reducerea O2 şi incorporarea lui în anumiţicompuşi chimici (substratul include un atom de O,
celălalt O este redus la H2O).
reacția sumară:
S-H
O2
NADPH+H+
S-OH
NADP+
H2O
68. OXIDAREA MICROSOMIALĂ
69. Rolul OM
Rolul: plastic (sinteza steroizilor și CA) şi dezintoxicare(detoxifierea substanțelor toxice exogene și inactivarea
celor endogene).
În ficat – hidroxilarea medicamentelor, neutralizarea
toxinelor, hormonilor (sunt eliminaţi).
În medulosuprarenale – sinteza noradrenalinei şi
adrenalinei.
În corticosuprarenale – sinteza colesterolului, hormonilor
gluco- şi mineralocorticoizi.
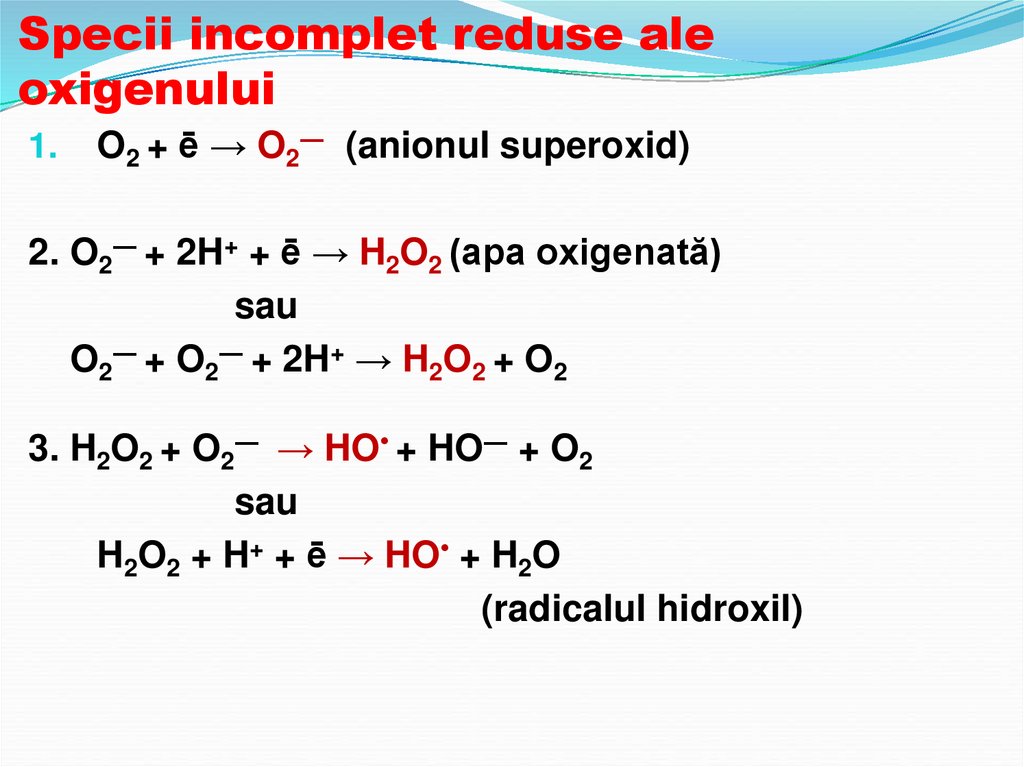
70. Noţiune de radicali liberi
La reducerea incompletă a O2 se formeazăforme reactogene şi agresive ale
substanţei cum ar fi: superoxidanionul,
peroxidul; radicalul hidroxil sau peroxidul
de hidrogen.
71. Specii incomplet reduse ale oxigenului
1.O2 + ē → O2― (anionul superoxid)
2. O2― + 2H+ + ē → H2O2 (apa oxigenată)
sau
O2― + O2― + 2H+ → H2O2 + O2
3. H2O2 + O2― → HO• + HO― + O2
sau
H2O2 + H+ + ē → HO• + H2O
(radicalul hidroxil)
72. Rolul biologic
Sinteza eicosanoizilorReînnoirea membranelor biologice
Apoptoza
Transmiterea semnalelor intra- şi
intercelular
73. EFECTELE NOCIVE
Denaturarea proteinelorModificări în structura nucleotidelor din AN
Peroxidarea lipidelor membranare
Modificarea permeabilității membranare
Creșterea influxului intracelular pentru sodiu, apă și
calciu
Lezarea ADN mitocondrial și afectarea integrității
proteinelor din LR mitocondrial
74. Speciile reactive ale oxigenului
implicate în patogeneza:1.
2.
3.
4.
5.
6.
7.
Cancerogeneză
Infarct miocardic
Ateroscleroză
Hipertensiune arterială
Diabet zaharat
Artrită reumatismală
et.c.
75. Sistemul de protecţie antioxidantă
1.2.
3.
4.
5.
6.
Enzimatic
Catalază
SOD – superoxid dismutaza
Glutation peroxidaza
Glutation-S-transferaza
Glutation reductaza
Etc.
Neenzimatic
1. α-tocoferolul (vit.E)
2. GSH (glutationul)
3. Ac. Ascorbic (vit.
C)
4. Polifenolii
5. Carnozina
6. Etc.
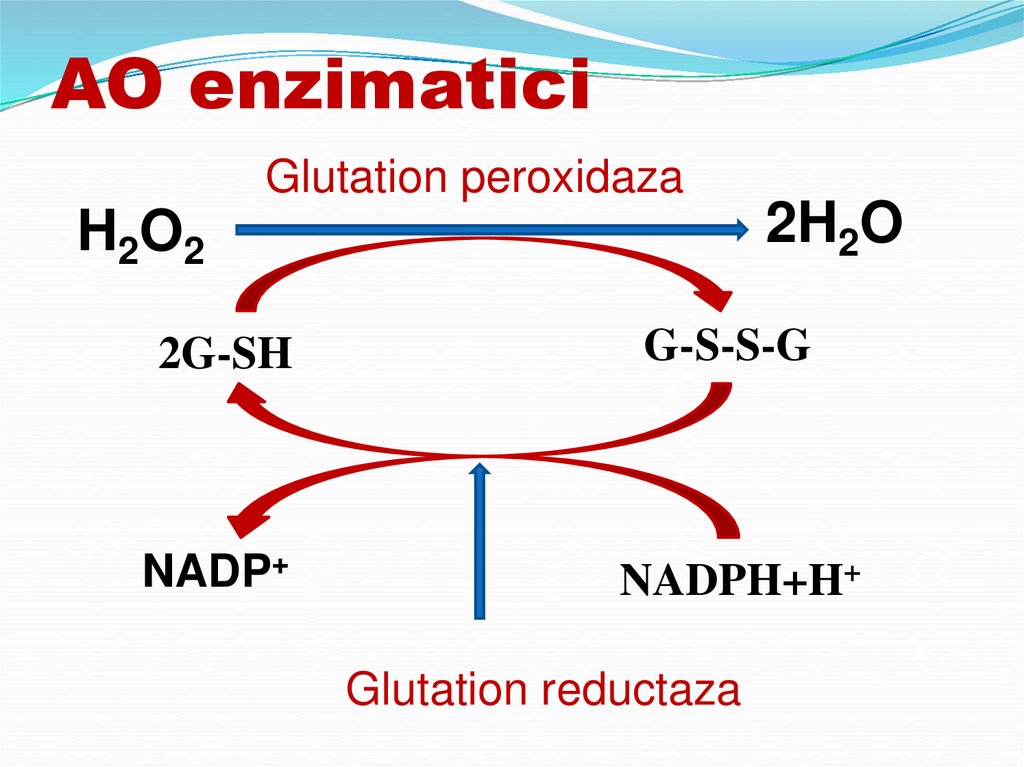
76. AO enzimatici
SOD transformarea О2- în Н2О2О2- + О2- + 2Н+ → Н2О2 + О2
Catalaza
2Н2О2 → 2Н2О + О2
Glutation reductaza
Glutation peroxidaza
77. AO enzimatici
Glutation peroxidazaH2O2
2H2O
2G-SH
G-S-S-G
NADP+
NADPH+H+
Glutation reductaza