Похожие презентации:
Лекция 7-8. Растворы_Гидролиз
1. ДОНСКОЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ КАФЕДРА ХИМИИ
Лекция № 7-81
2. Основные понятия
Раствор - гомогенная система, состоящая из двух илиболее компонентов и продуктов их взаимодействия.
Раствор
состоит из растворенного вещества и
растворителя.
Растворитель- компонент раствора, существующий в
одном агрегатном состоянии с раствором или
преобладающий в растворе.
Состав растворов может изменяться в широких
пределах.
Растворы занимают промежуточное положение между
механическими смесями и химическими соединениями
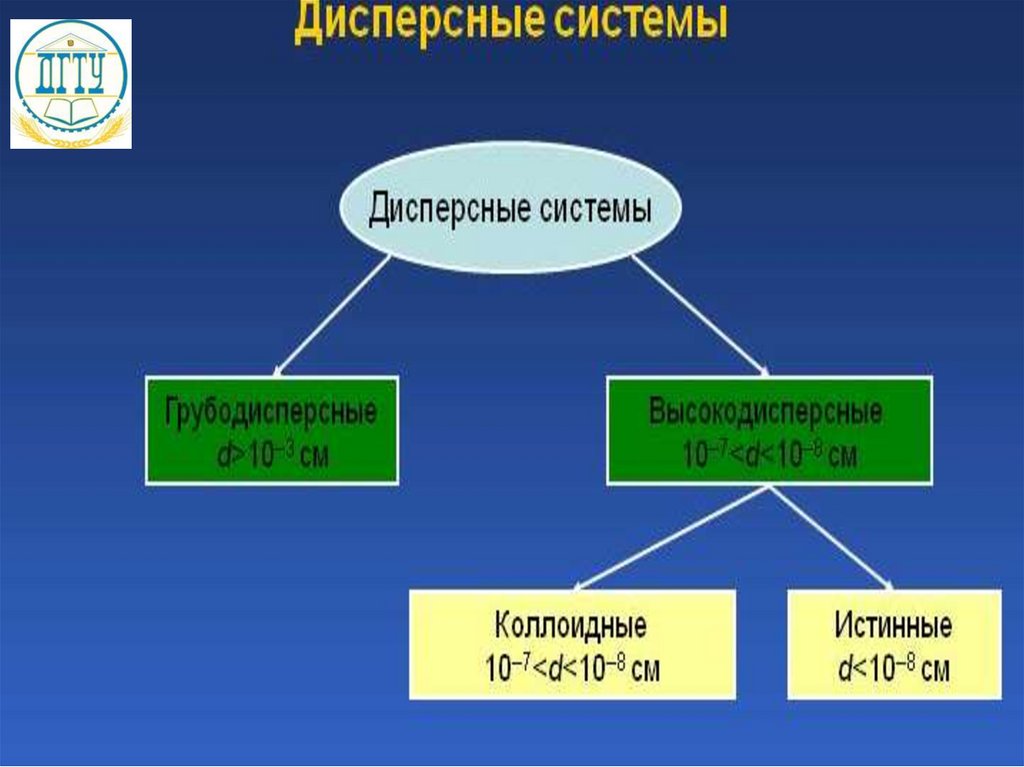
Растворы делят на истинные и коллоидные.
2
3. Основные понятия
Растворы истинные – гомогенные системы, состоящие из двухили более компонентов (растворителя, растворенного вещества
и продуктов их взаимодействия), состав которых в
определенных пределах может непрерывно изменяться.
Коллоидные растворы — мелкодисперные системы, в
которых твёрдое вещество распределено в жидкости.
Растворимость - содержание вещества в насыщенном
растворе. Растворимость выражают массой растворенного
вещества в 100 г воды при 200С.
Величина растворимости характеризует равновесие между
двумя фазами, поэтому на неё влияют все факторы, смещающие
это равновесие (по принципу Ле-Шателье).
При определенных условиях (Т, р) растворение одного
компонента в другом ограничено.
4.
45.
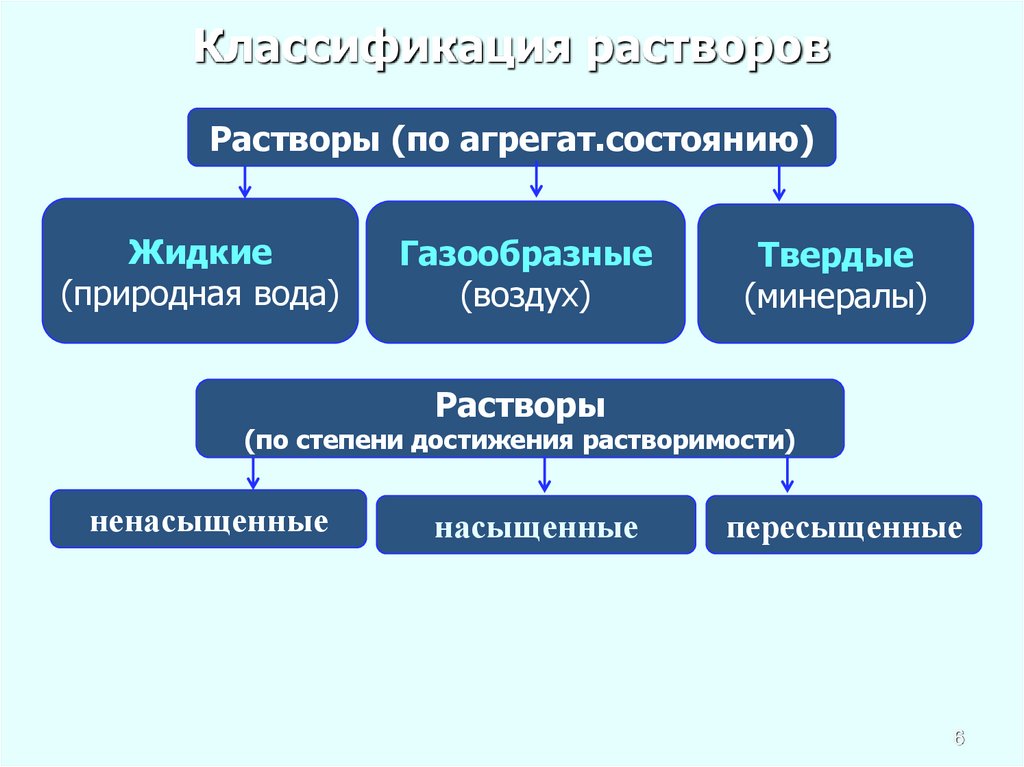
56. Классификация растворов
Растворы (по агрегат.состоянию)Жидкие
(природная вода)
Газообразные
(воздух)
Твердые
(минералы)
Растворы
(по степени достижения растворимости)
ненасыщенные
насыщенные
пересыщенные
6
7.
Раствор, находящийся в равновесии с твердой фазой, являетсянасыщенным.
Ненасыщенный раствор — раствор, в котором концентрация
растворенного вещества меньше, чем в насыщенном растворе, и в
котором при данных условиях можно растворить ещё некоторое его
количество.
Пересыщенный
раствор
(изредка
используется
термин
перенасыщенный) — раствор, содержащий при данных условиях
больше растворённого вещества, чем в насыщенном
растворе. Пересыщенные растворы неустойчивы, избыток вещества
легко выпадает в осадок. Такой раствор нельзя получить путём
растворения в нормальных условиях, обычно пересыщенный
раствор получают охлаждением раствора, насыщенного при более
высокой температуре (пересыщение).
7
8. Концентрация растворов и способы ее выражения
Концентрация раствора – количество растворенного вещества,содержащееся в определенном количестве раствора или растворителя.
Процентная концентрация (массовая доля, ) – количество
граммов растворенного вещества, содержащееся в 100 граммах
раствора.
,% = (mрастворенного вещества / mраствора )·100%
mраствора = mрастворенного вещества + mрастворителя
mраствора = V·ρ, где V- объем раствора; ρ – плотность раствора
Мольная доля (N) – отношение числа молей данного вещества к
общему числу молей в растворе.
N1 = n1 /(n1+n2)
N2 = n2 /(n1+n2)
n1 – число молей растворенного вещества;
n
n2 – число молей растворителя;
Ni 1
N1 + N 2 = 1
i
8
9. Способы выражения концентрации растворов
Молярная концентрация раствора (С, См) – выражается числоммолей растворенного вещества, содержащихся в одном литре раствора,
моль/л (М).
См = mрастворенного вещества / М · V
М – молярная масса растворенного вещества
V – объем полученного раствора
Нормальная концентрация или эквивалентная (Сн, Сэ) –
выражается числом эквивалентов растворенного вещества,
содержащихся в 1 л раствора, (н).
Сн = mрастворенного вещества / МЭ · V
МЭ – молярная масса эквивалента растворенного вещества,
V – объем полученного раствора
9
10.
Моляльная концентрация или моляльностьрастворенного вещества - количество молей вещества,
приходящееся на 1000 г раствора:
Cm = (m1 ∙ 1000 ) / (M ∙m2 ),
где m1– масса растворенного вещества,
m2 – масса растворителя,
M – молярная масса растворенного вещества.
10
11.
Пример.Найдем молярность и нормальность 15 %-ного
(по массе) раствора серной кислоты, если его плотность – 1,10
г/мл.
Решение:
1. Возьмем 1 л раствора и найдем его массу: m(р-ра)=ρ V,
m(р-ра) = 1,10 1000= 1100 (г).
2. Найдем массу серной кислоты в растворе: m2= m(р-ра)
m2=0,15 1100=165 (г).
3. Молярная масса Н2SO4 - 98 г/моль, значит, в 1 литре раствора
содержится: n=m/M=165/98 = 1,68 моль вещества. Это и есть
молярная концентрация.
4. Найдем молярную массу эквивалента Н2SO4:
Мэкв(Н2SO4)=98/2=49 г/моль.
5. В 1 литре содержится nэкв=m/Mэкв.=165/49 =3,37 моль-экв.
6. Нормальность раствора: C = nэкв2 / V=3,37/1=3,37 н.
11
12.
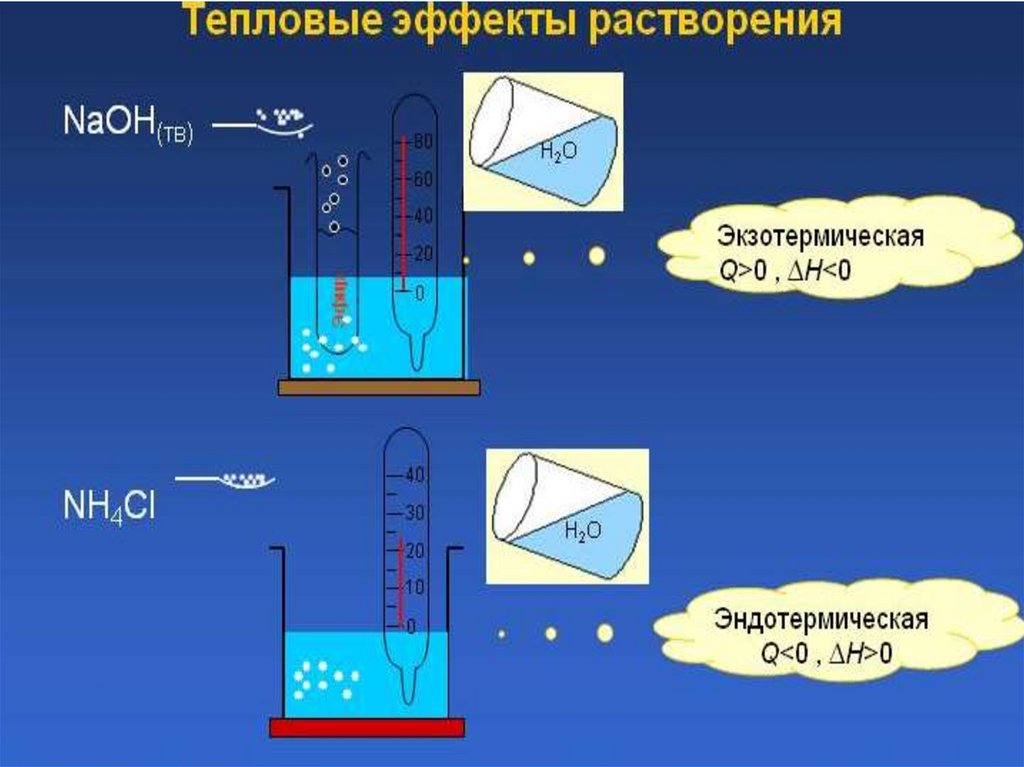
Коллигативныесвойства
– свойства растворов,
зависящие от числа частиц растворённого вещества и
количества растворителя.
К коллигативным свойствам растворов относят:
1) понижение давления насыщенного пара растворителя
над раствором,
2) понижение температуры замерзания раствора по
сравнению
с
температурой
замерзания
чистого
растворителя
3) повышение температуры кипения раствора по
сравнению
с
температурой
кипения
чистого
растворителя
3) осмотическое давление.
12
13. Понижение давления пара растворителя над раствором
Первый закон Рауля:Давление насыщенного пара растворителя над раствором (р)
прямо пропорционально мольной доле растворителя в данном
растворе (N1):
p = N1·p0
где p - давление пара над раствором;
p0 - давление пара над чистым растворителем.
Первый закон Рауля:
относительное понижение ( p/ро) парциального давления
насыщенного пара растворителя равно мольной доле частиц
растворённого вещества (N2):
13
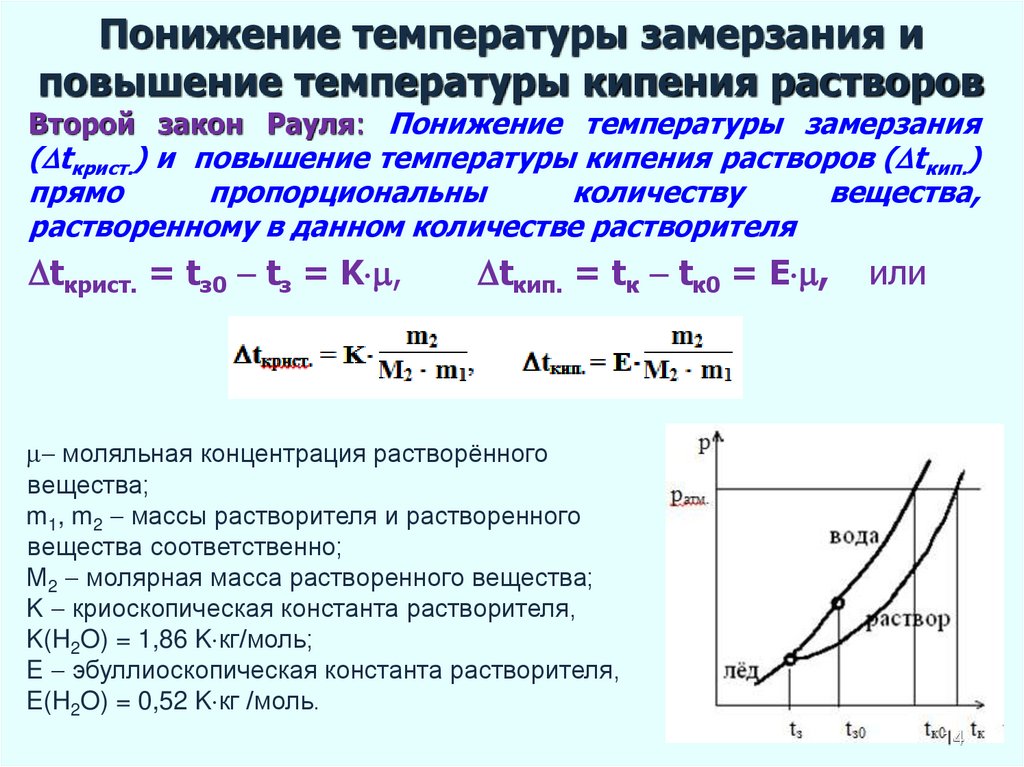
14. Понижение температуры замерзания и повышение температуры кипения растворов
Второй закон Рауля: Понижение температуры замерзания( tкрист.) и повышение температуры кипения растворов ( tкип.)
прямо
пропорциональны
количеству
вещества,
растворенному в данном количестве растворителя
tкрист. = tз0 tз = K ,
tкип. = tк tк0 = E ,
или
моляльная концентрация растворённого
вещества;
m1, m2 массы растворителя и растворенного
вещества соответственно;
М2 молярная масса растворенного вещества;
K криоскопическая константа растворителя,
K(H2O) = 1,86 K кг/моль;
E эбуллиоскопическая константа растворителя,
E(H2O) = 0,52 K кг /моль.
14
15. Закон Генри
Масса газа, растворяющегося при постояннойтемпературе в данном объеме жидкости, прямо
пропорциональна парциальному давлению газа.
с= к р,
где к – коэффициент Генри; р – парциальное давление газа.
Коэффициент Генри показывает, во сколько раз увеличивается
концентрация газа в жидкости при увеличении давления на
единицу.
Следствие из закона Генри:
Объем газа, растворяющийся при постоянной температуре в
данном объеме жидкости, не зависит от его парциального
давления.
15
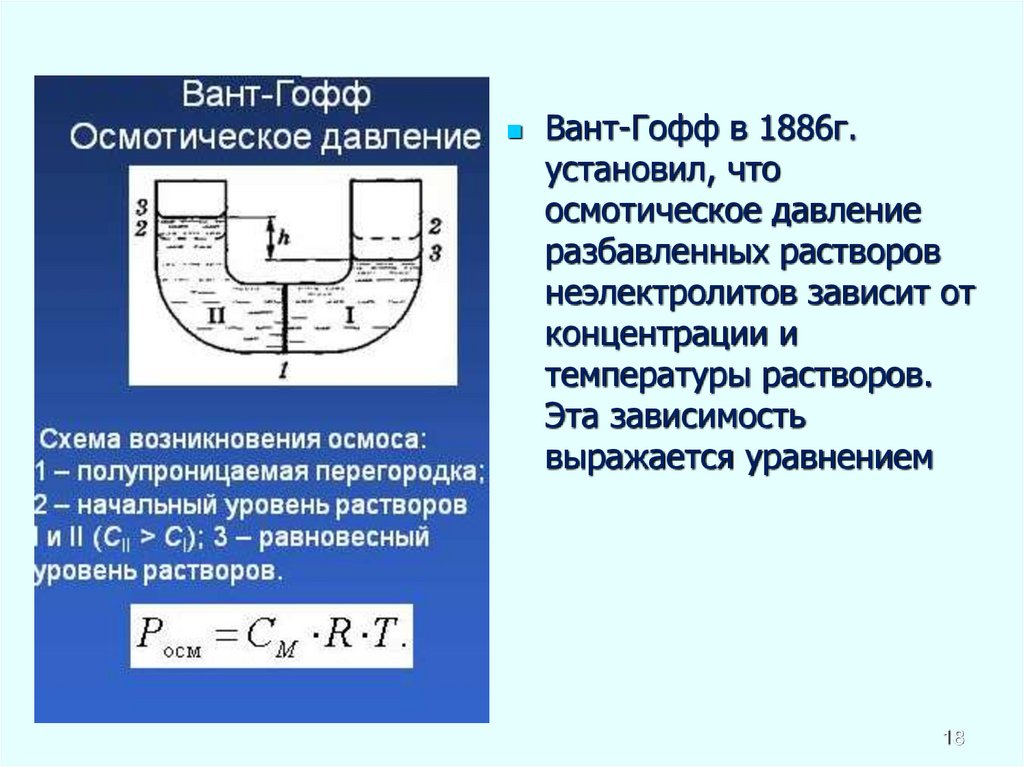
16. Осмотическое давление раствора
Осмос – самопроизвольный односторонний переход вещества черезполупроницаемую мембрану, разделяющую два раствора различной
концентрации.
Осмотическое давление (pосм.) - давление, которое необходимо приложить
к раствору, чтобы предотвратить перемещение растворителя в раствор
через мембрану, разделяющую раствор и чистый растворитель.
Закона Вант-Гоффа: осмотическое давление идеального раствора
равно тому давлению, которое оказывало бы растворенное вещество,
если бы оно, находясь в газообразном состоянии при той же
температуре, занимало бы тот же объем, который занимает раствор
16
17. Осмос
Явление, связанное со способностью проходить черезмембрану, в частности, только молекул растворителя,
называется осмосом, а вызываемое им изменение
давления по обе стороны мембраны – осмотическим
давлением.
Осмотическое давление Росмотич. – внутреннее давление
растворенного вещества, численно равное тому внешнему
давлению, которое нужно приложить, чтобы прекратить
осмос; оно зависит от температуры и концентрации.
17
18.
Вант-Гофф в 1886г.установил, что
осмотическое давление
разбавленных растворов
неэлектролитов зависит от
концентрации и
температуры растворов.
Эта зависимость
выражается уравнением
18
19.
Ван-Гофф показал, что осмотический законсправедлив только для веществ типа сахарозы, а для
растворов солей, кислот и оснований он не
применим.
Для согласия теории и эксперимента необходимо
вводить поправочный коэффициент i - изотонический
коэффициент (р=icRT), который показывает, во
сколько раз измеренное осмотическое давление
больше
рассчитанного
по
вышеприведенному
уравнению.
Это отношение числа всех частиц в растворе к числу
растворенных молекул:
19
20. Теория электролитической диссоциации
В 1887 г. шведский учёныйС. Аррениус предложил теорию
электролитической диссоциации
для объяснения особенностей поведения
водных растворов веществ.
Сванте Аррениус
(1859-1927)
20
21.
их растворыили расплавы
их растворы
или расплавы
ПРОВОДЯТ
НЕ ПРОВОДЯТ
электрический
электрический
ток
ток
Вид химической связи
Ионная или
ковалентная
сильно полярная
Ковалентная
неполярная
или мало полярная
21
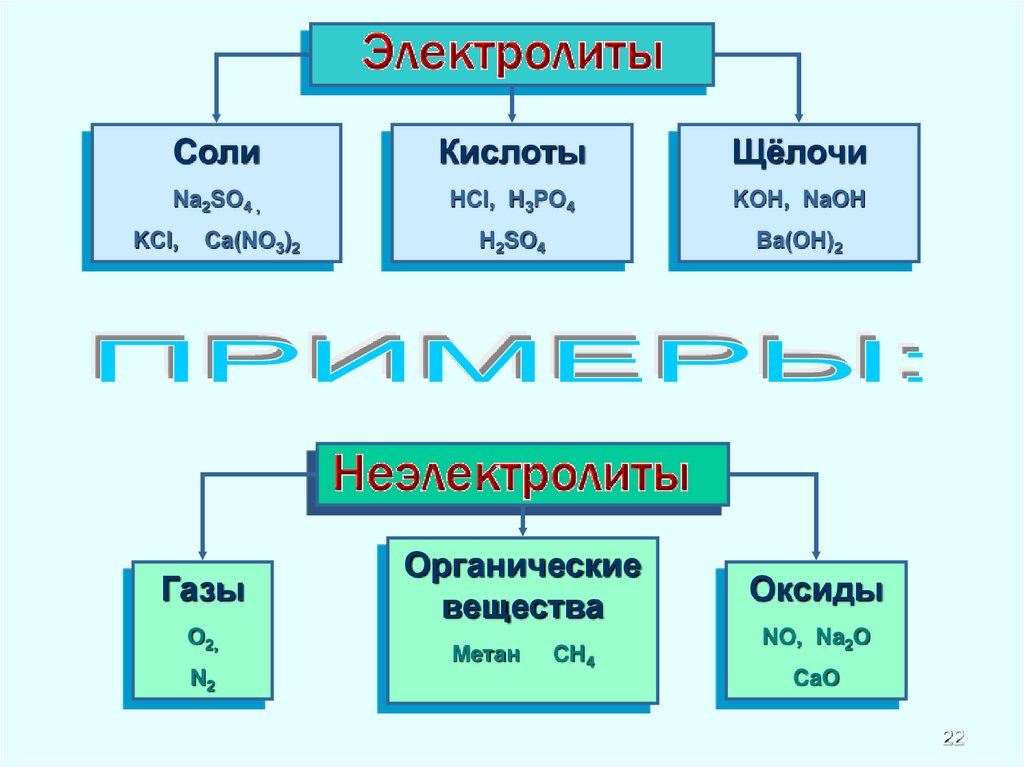
22.
CолиКислоты
Щёлочи
Na2SO4 ,
HCl, H3PO4
KOH, NaOH
H2SO4
Ba(OH)2
KCl,
Ca(NO3)2
Газы
O2,
N2
Органические
вещества
Метан
CH4
Оксиды
NO, Na2O
CaO
22
23.
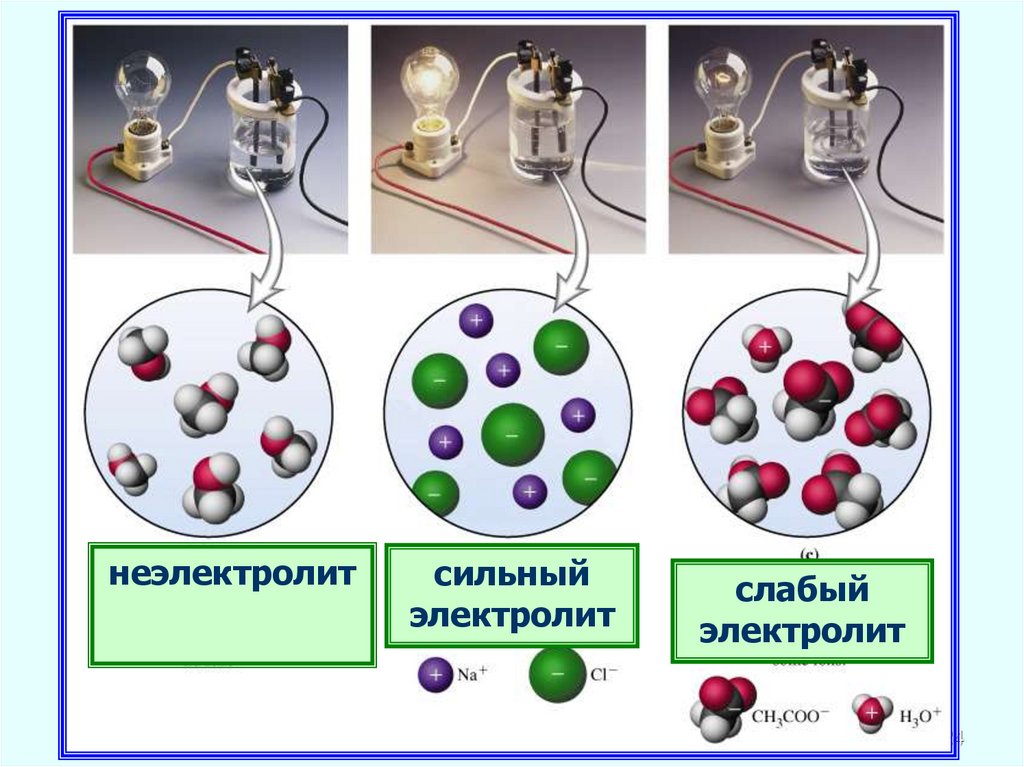
2324.
неэлектролитсильный
электролит
слабый
электролит
24
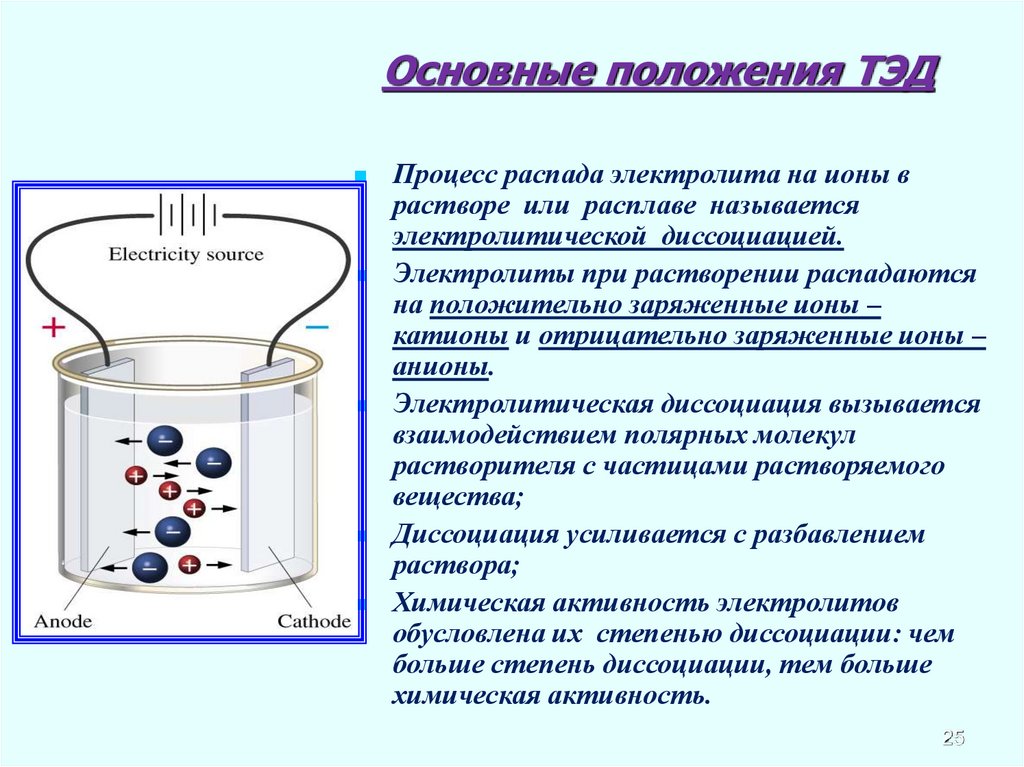
25. Основные положения ТЭД
Процесс распада электролита на ионы врастворе или расплаве называется
электролитической диссоциацией.
Электролиты при растворении распадаются
на положительно заряженные ионы –
катионы и отрицательно заряженные ионы –
анионы.
Электролитическая диссоциация вызывается
взаимодействием полярных молекул
растворителя с частицами растворяемого
вещества;
Диссоциация усиливается с разбавлением
раствора;
Химическая активность электролитов
обусловлена их степенью диссоциации: чем
больше степень диссоциации, тем больше
химическая активность.
25
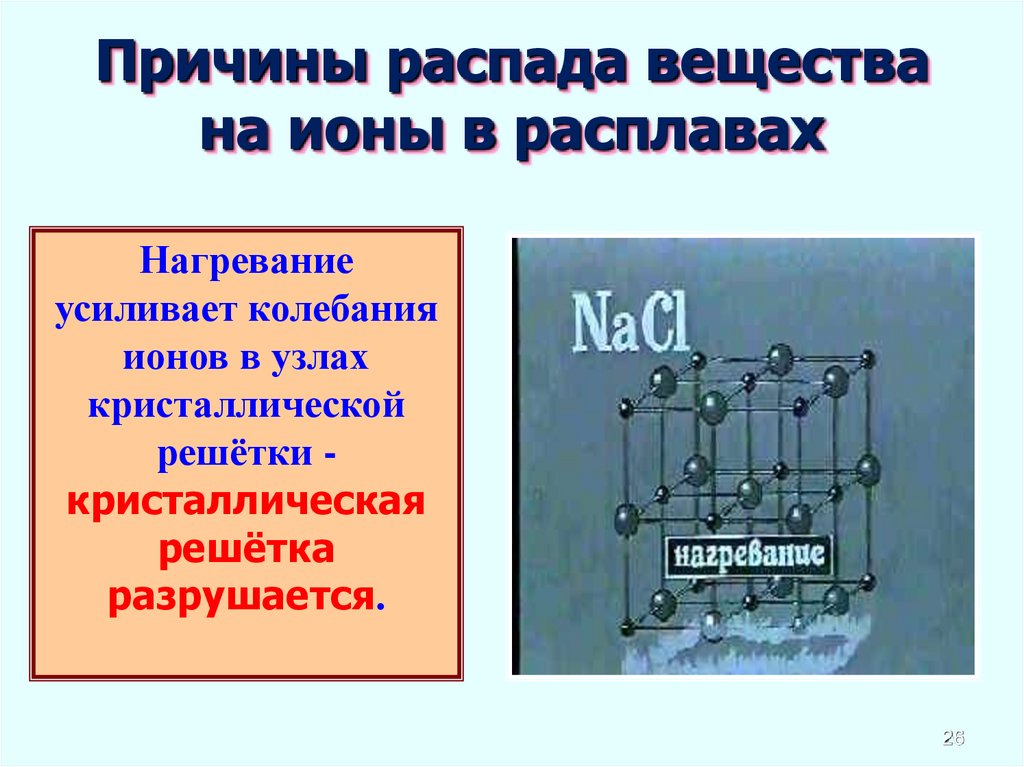
26.
Причины распада веществана ионы в расплавах
Нагревание
усиливает колебания
ионов в узлах
кристаллической
решётки кристаллическая
решётка
разрушается.
26
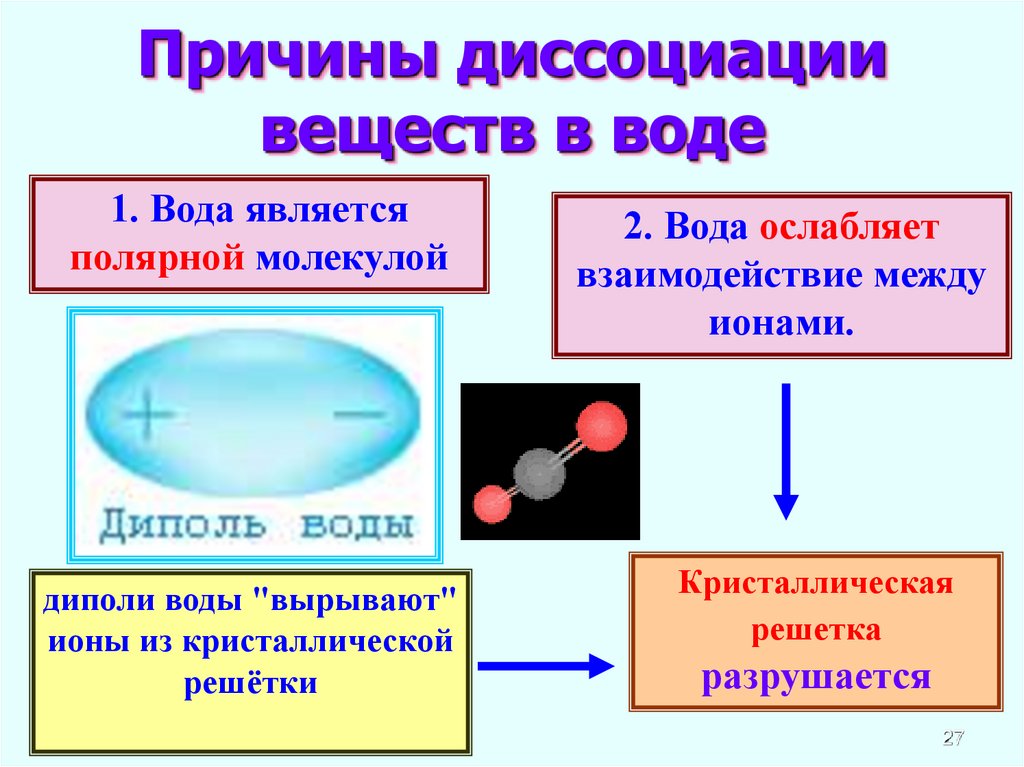
27.
Причины диссоциациивеществ в воде
1. Вода является
полярной молекулой
диполи воды "вырывают"
ионы из кристаллической
решётки
2. Вода ослабляет
взаимодействие между
ионами.
Кристаллическая
решетка
разрушается
27
28.
Диссоциация ионныхсоединений
28
29.
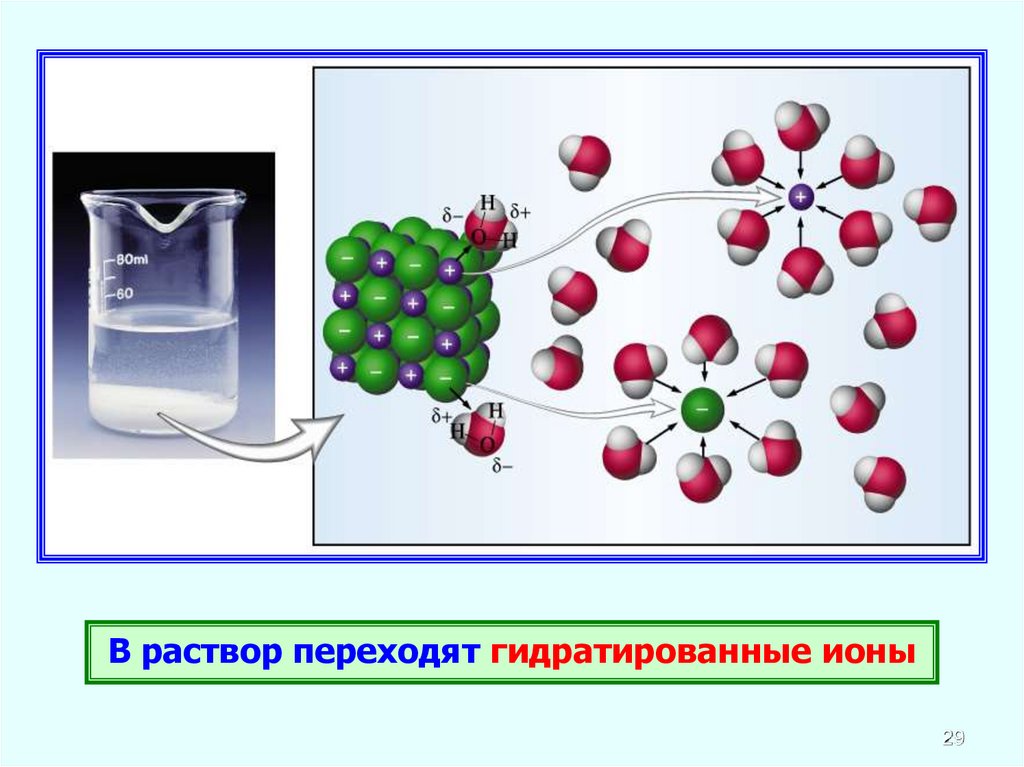
В раствор переходят гидратированные ионы29
30.
Диссоциация соединений сковалентной полярной связью
30
31.
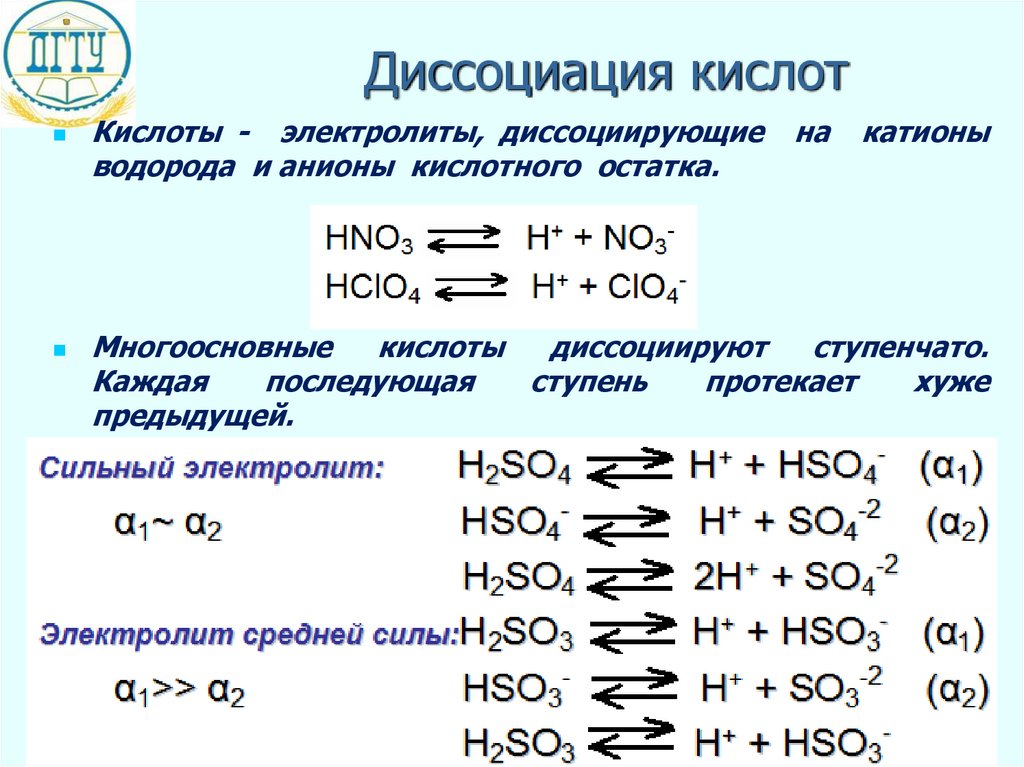
Диссоциация кислотКислоты - электролиты, диссоциирующие
водорода и анионы кислотного остатка.
на
катионы
Многоосновные
кислоты
диссоциируют
ступенчато.
Каждая
последующая
ступень
протекает
хуже
предыдущей.
31
32. Диссоциация оснований
Основания – электролиты, при диссоциации которых вкачестве анионов образуются только гидроксид-ионы.
Многокислотные основания диссоциируют ступенчато.
32
33.
Соли – это электролиты, которые диссоциируютна катионы металла или аммония NH4+ и анионы
кислотных остатков.
33
34.
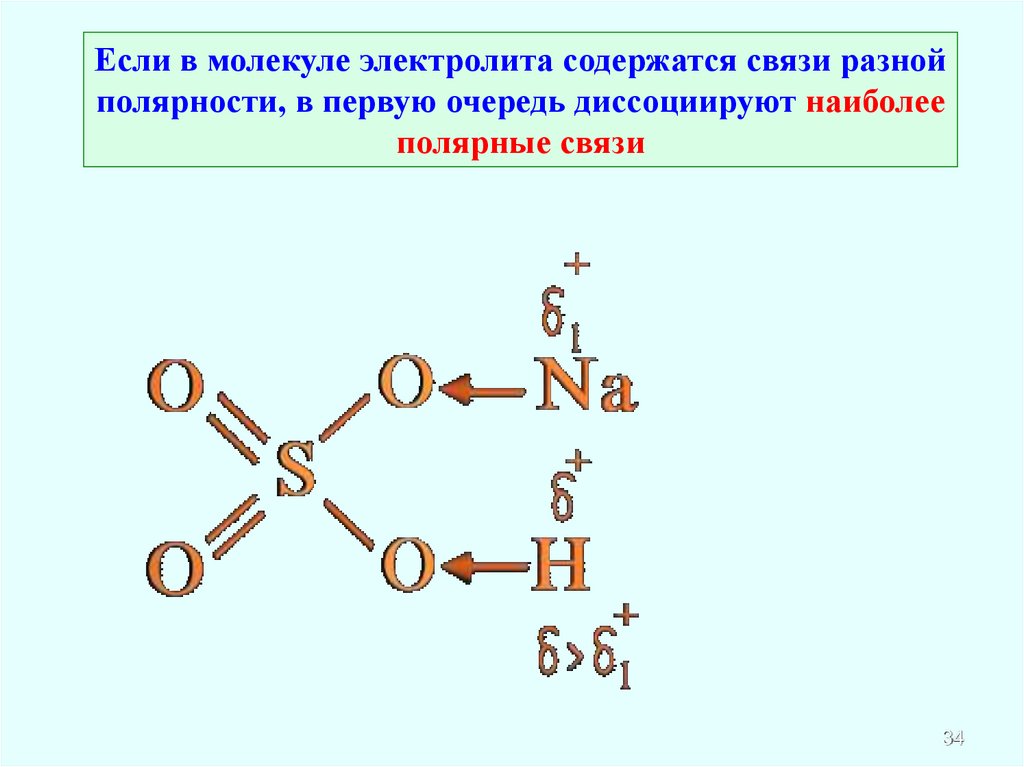
Если в молекуле электролита содержатся связи разнойполярности, в первую очередь диссоциируют наиболее
полярные связи
34
35. Количественная характеристика процесса диссоциации
Степень диссоциации – отношение числараспавшихся на ионы молекул к общему числу
молекул в растворе.
35
36.
Степень диссоциации связана сизотоническим коэффициентом:
– для электролитов, диссоциирующих
на два иона
=i-1
- для электролитов, диссоциирующих на
три иона
=(i-1)/2
- для электролитов, диссоциирующих на
n ионов
=(i-1)/(n-1).
36
37.
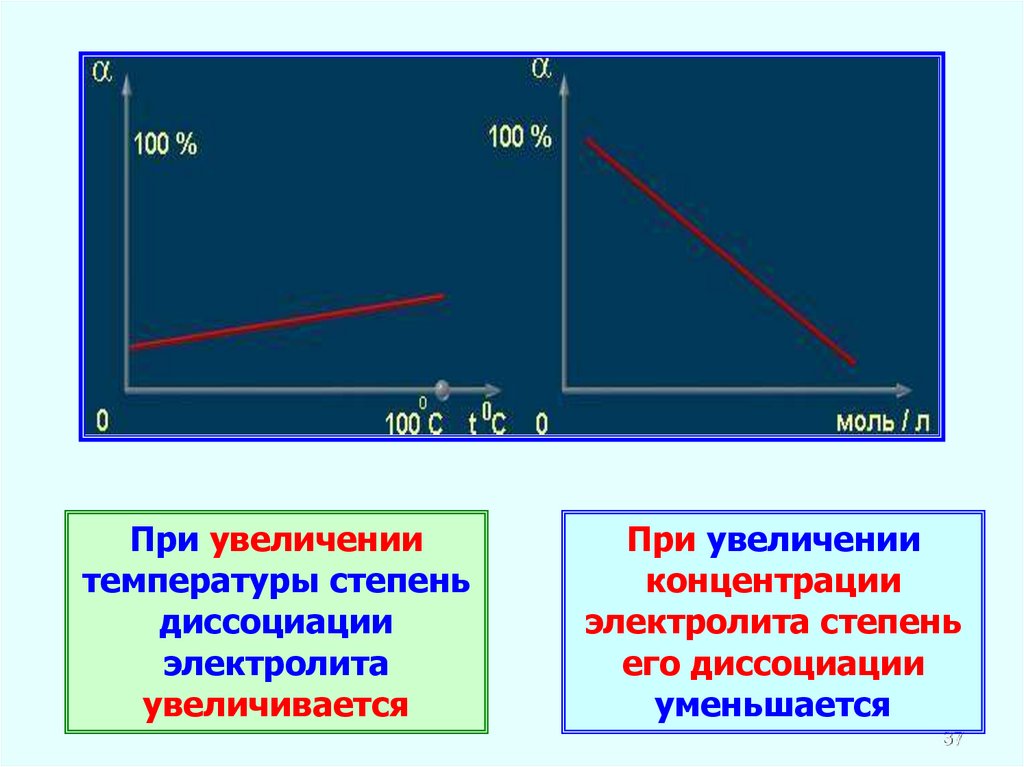
При увеличениитемпературы степень
диссоциации
электролита
увеличивается
При увеличении
концентрации
электролита степень
его диссоциации
уменьшается
37
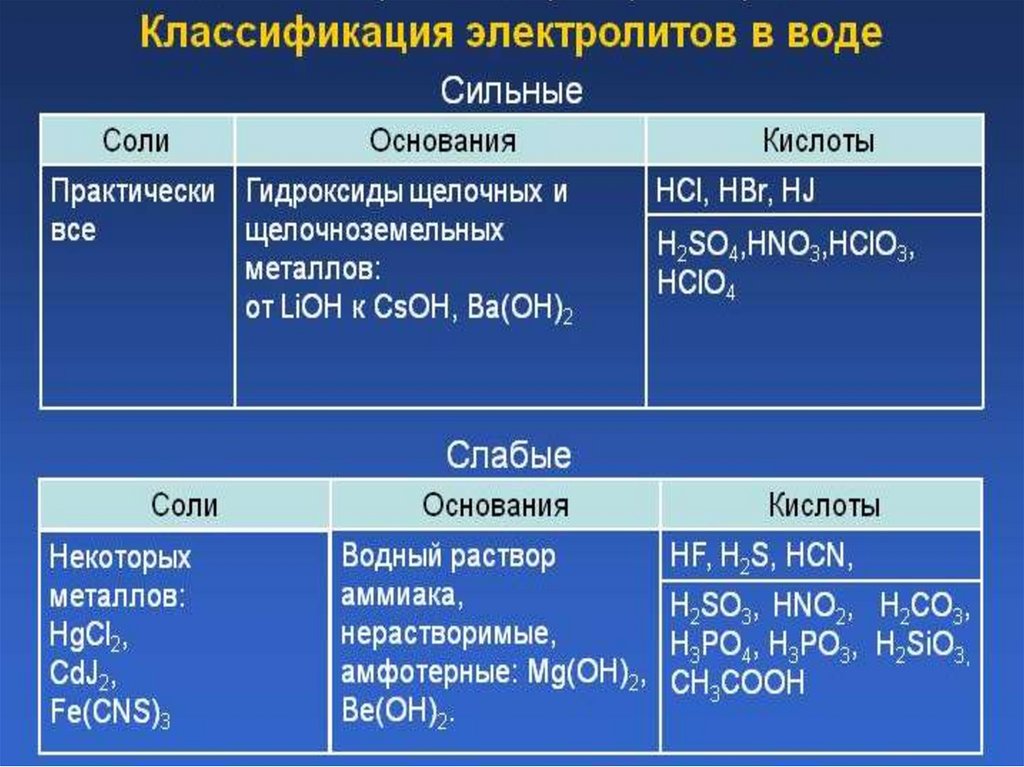
38.
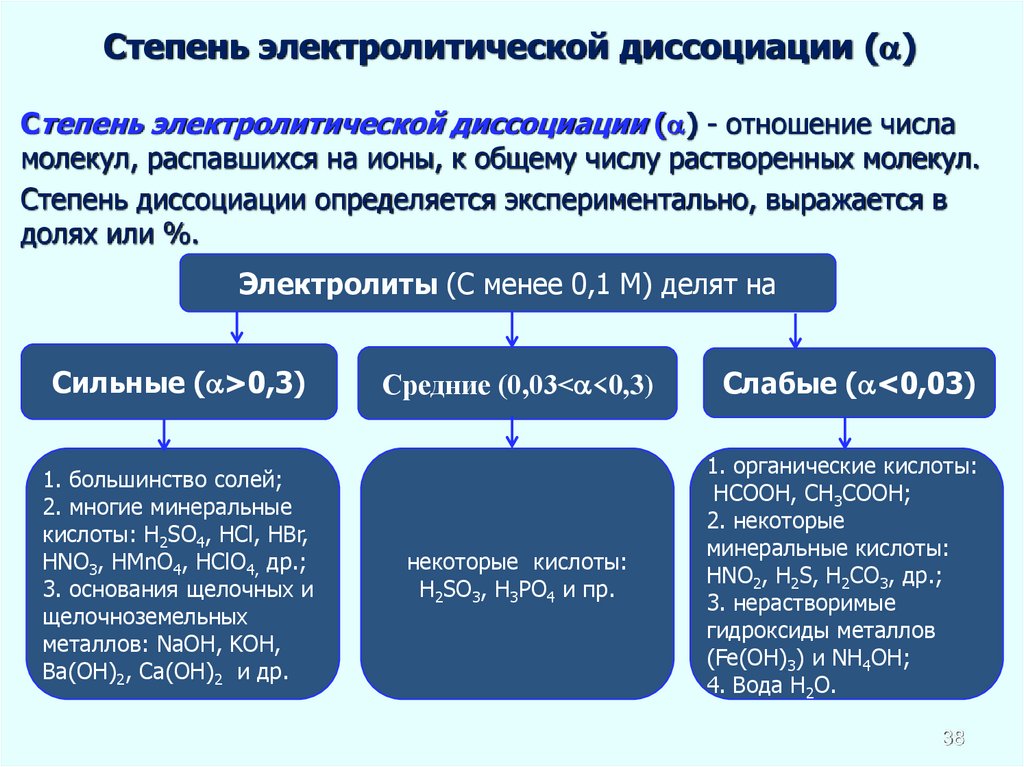
Степень электролитической диссоциации ( )Степень электролитической диссоциации ( ) - отношение числа
молекул, распавшихся на ионы, к общему числу растворенных молекул.
Степень диссоциации определяется экспериментально, выражается в
долях или %.
Электролиты (С менее 0,1 М) делят на
Сильные ( >0,3)
1. большинство солей;
2. многие минеральные
кислоты: H2SO4, HCl, HBr,
HNO3, HMnO4, HClO4, др.;
3. основания щелочных и
щелочноземельных
металлов: NaOH, KOH,
Ва(ОН)2, Са(ОН)2 и др.
Средние (0,03< <0,3)
Слабые ( <0,03)
некоторые кислоты:
H2SO3, H3РO4 и пр.
1. органические кислоты:
НСООН, СН3СООН;
2. некоторые
минеральные кислоты:
HNO2, H2S, Н2СО3, др.;
3. нерастворимые
гидроксиды металлов
(Fe(OH)3) и NH4OH;
4. Вода H2O.
38
39.
Константа диссоциацииХарактеризует способность
слабого электролита распадаться на ионы
39
40.
СЛАБЫЕ ЭЛЕКТРОЛИТЫДля АaВb aАx+ + bВy- константа диссоциации:
[Аx+]a ∙ [Вy-]b
Кд =
[АaВb]
Связь константы и степени диссоциации
[А+] ∙ [В-]
Для АВ А++В- константа диссоциации :
К =
д
[АВ]
Пусть C молярная концентрация раствора, - степень диссоциации, тогда
концентрация продиссоциировавших частиц (А+ и В-) будет равна C, а
непродиссоциировавших (АВ) (1- ) C. Тогда
Кд =
( C) ∙ ( C)
(1- ) C
=
2 C
1-
Для разбавленных растворов малая величина ( «1), 1- ≈1.
Закон разбавления Оствальда:
Kд ≈ C 2
По принципу Ле-Шателье эндотермический процесс диссоциации
протекает более глубоко при увеличении температуры и связывании
продуктов реакции.
40
41.
СИЛЬНЫЕ ЭЛЕКТРОЛИТЫТеория сильных электролитов
(Дебай, Гюккель, 1923 г.)
В
растворах
сильных
электролитов
действуют
электростатические
силы
притяжения
между
разноименными ионами и силы отталкивания между
одноименными.
Вокруг каждого иона образуется ионная атмосфера,
состоящая из ионов противоположного знака. Каждый из
ионов этой атмосферы находится в окружении другой
ионной атмосферы.
Активность электролита (или его ионов):
Модель ионной
атмосферы
А=f С
где С - аналитическая концентрация электролита;
f - коэффициент активности, включающий поправку на силы взаимодействия
(справочная величина)
Рассчитаем активность ионов Н+ в 1 М растворе соляной кислоты:
А = f С = 0,814 1 = 0,814 моль/л
41
42.
Условия протекания реакцииионного обмена
Реакции в растворах электролитов протекают
до конца если:
• Образуется или растворяется осадок
AgNO3 + NaCl --> AgCl(осадок) + NaNO3
• Выделяется газ
K2S + 2HCl --> H2S(газ) + 2KCl
• Образуется малодиссоциирующее вещество
(например Н2О)
HCl + NaOH --> NaCl + H2O
42
43.
4344.
где- новая константа, так называемое ионное произведение воды.
44
45.
4546.
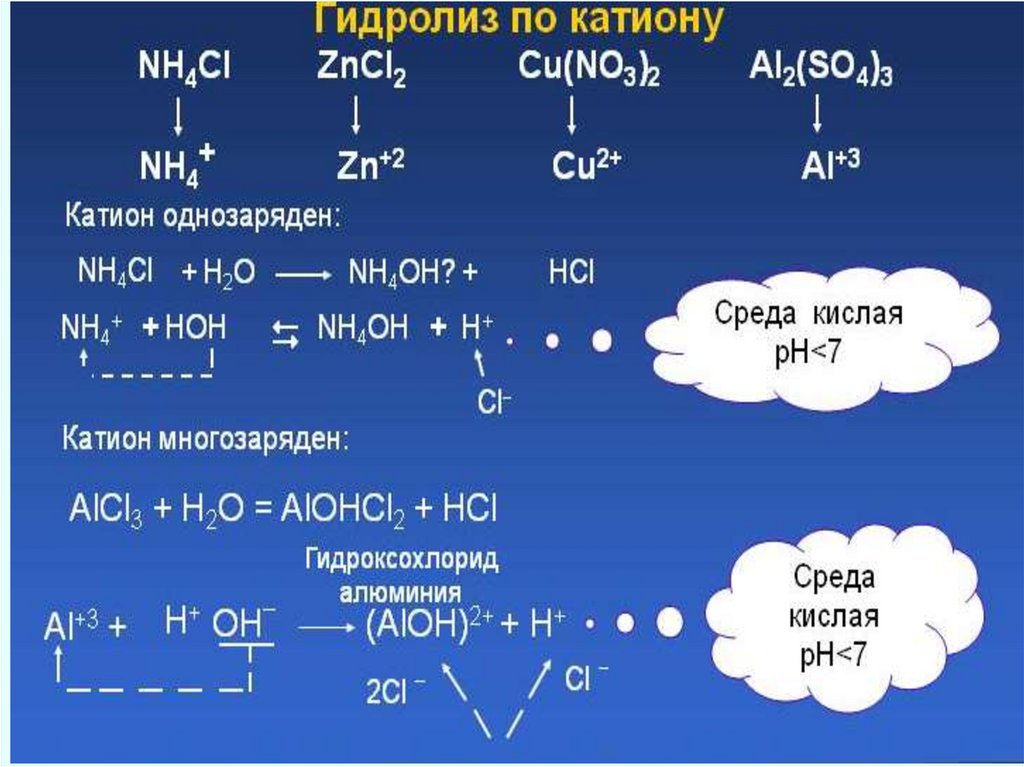
Гидролиз солейГидролиз
обменное
химическое
взаимодействие между составными частями
соли и составными частями воды,
в
результате которого образуется слабый
электролит.
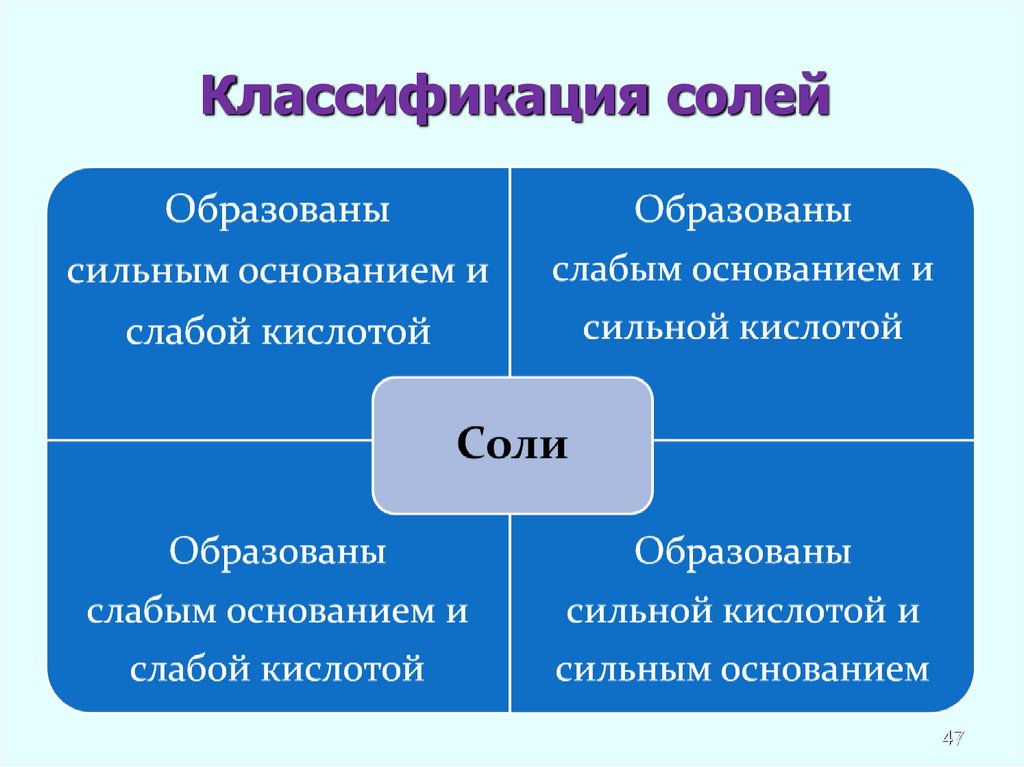
Любая соль – продукт взаимодействия
основания и кислоты. В зависимости от силы
основания и кислоты выделяют четыре типа
солей.
46
47.
Классификация солей47
48.
4849.
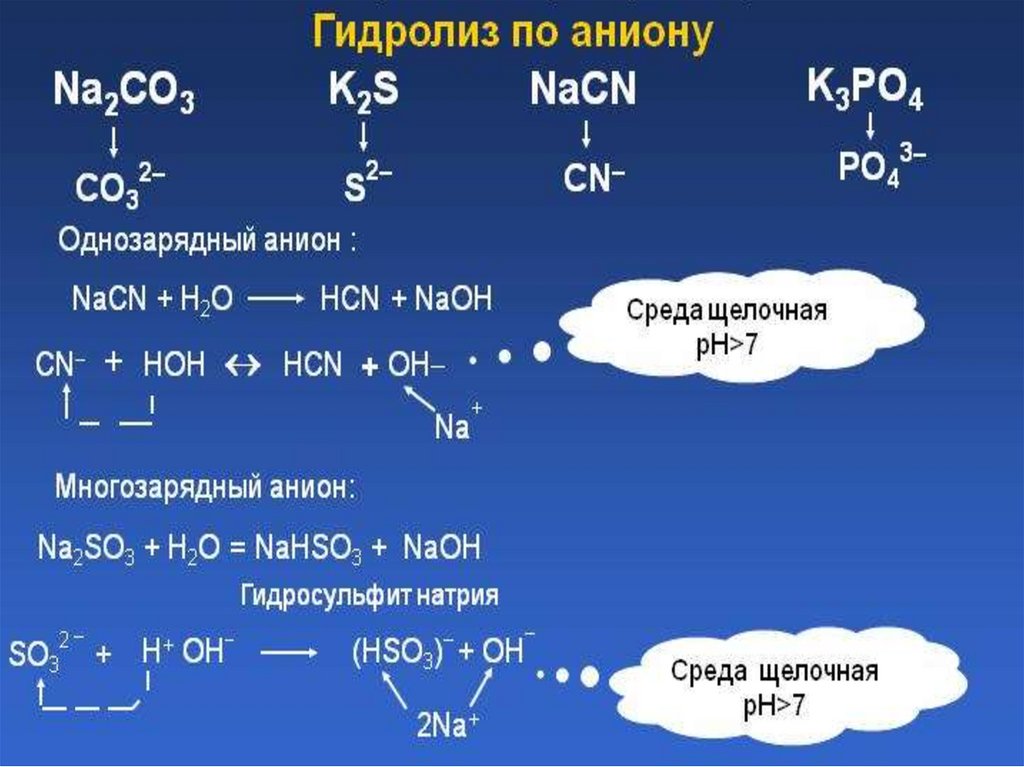
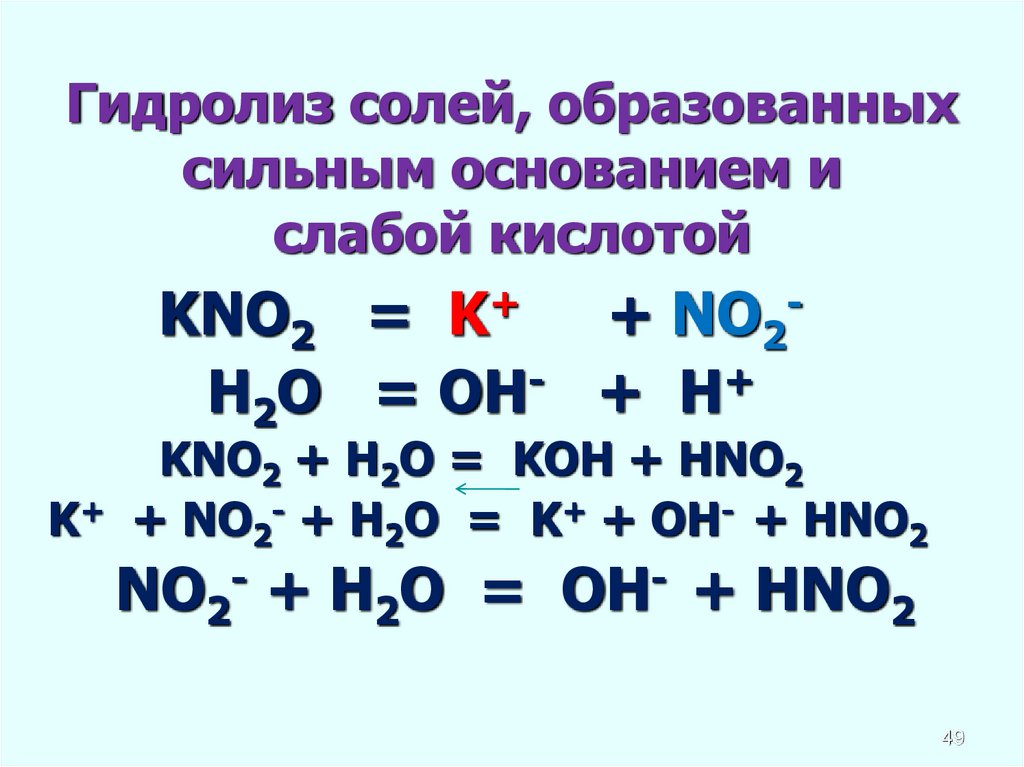
Гидролиз солей, образованныхсильным основанием и
слабой кислотой
KNO2 = K+ + NO2H2O = OH- + H+
KNO2 + H2O = KOH + HNO2
K+ + NO2- + H2O = K+ + OH- + HNO2
NO2- + H2O = OH- + HNO2
49
50.
5051.
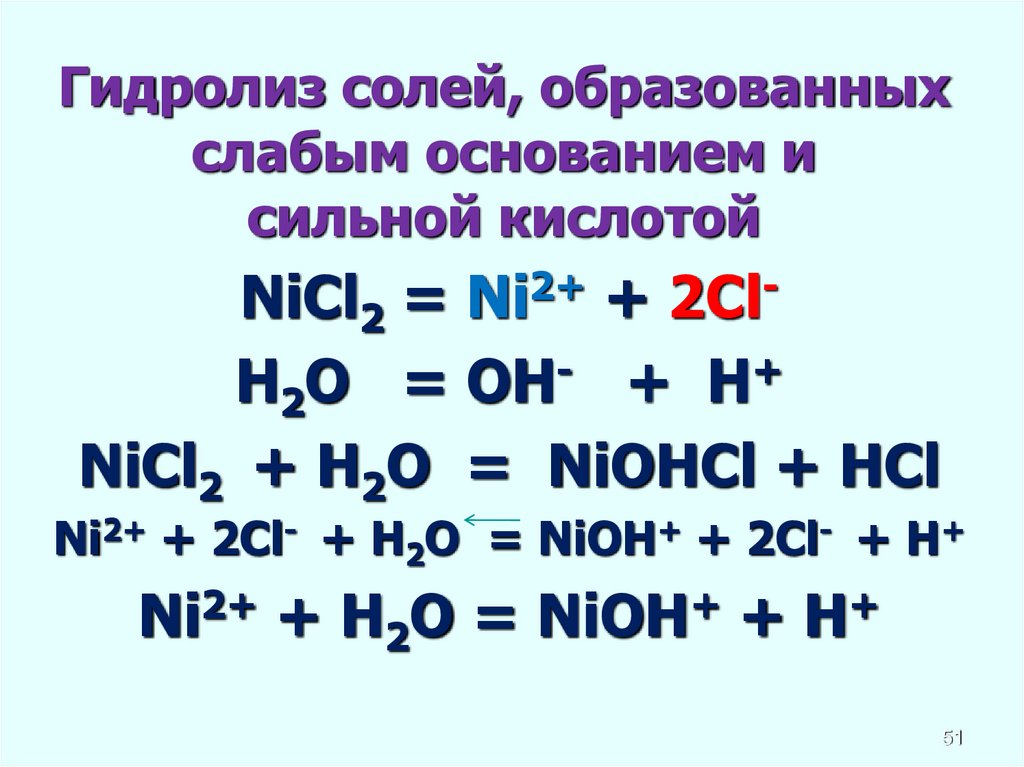
Гидролиз солей, образованныхслабым основанием и
сильной кислотой
NiCl2 = Ni2+ + 2ClH2O = OH- + H+
NiCl2 + H2O = NiOHCl + HCl
Ni2+ + 2Cl- + H2O = NiOH+ + 2Cl- + H+
Ni2+ + H2O = NiOH+ + H+
51
52.
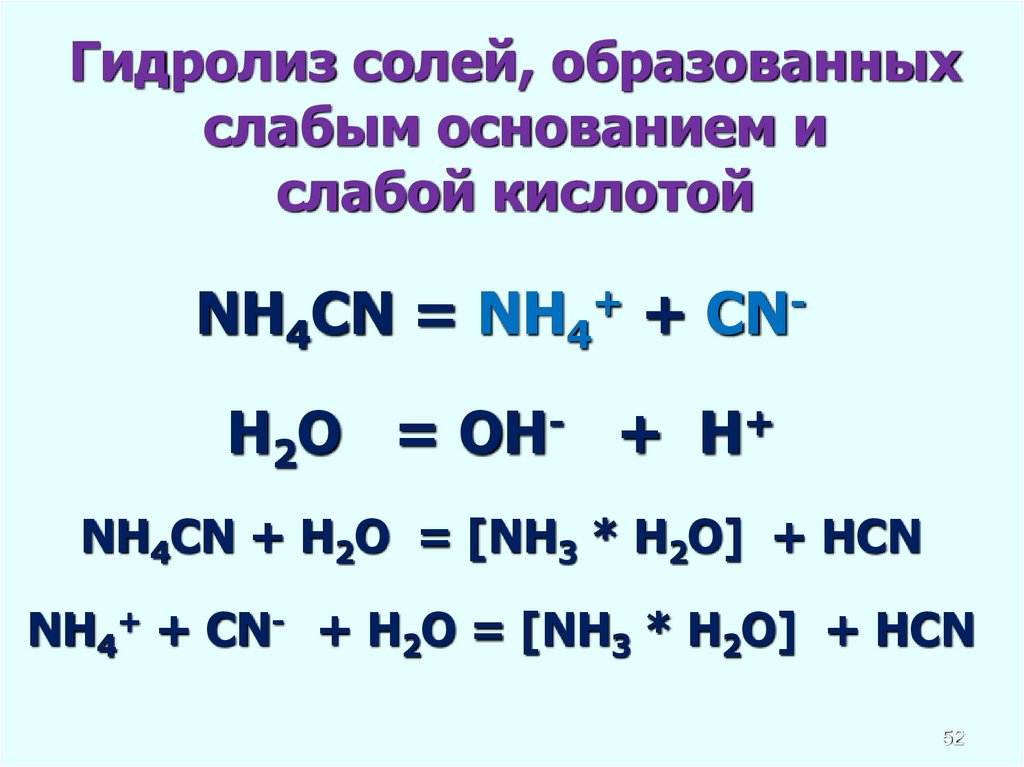
Гидролиз солей, образованныхслабым основанием и
слабой кислотой
NH4CN = NH4+ + CNH2O = OH- + H+
NH4CN + H2O = [NH3 * H2O] + HCN
NH4+ + CN- + H2O = [NH3 * H2O] + HCN
52
53.
5354.
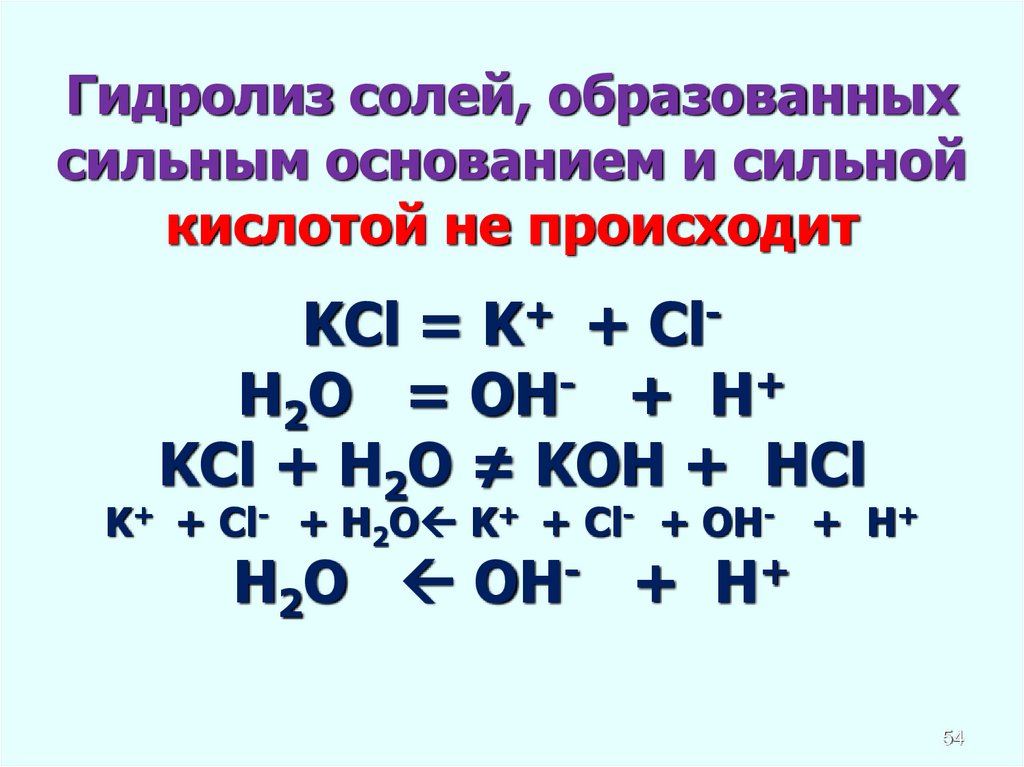
Гидролиз солей, образованныхсильным основанием и сильной
кислотой не происходит
KCl = K+ + ClH2O = OH- + H+
KCl + H2O ≠ KOH + HCl
K+ + Cl- + H2O K+ + Cl- + OH- + H+
H2O OH- + H+
54
55.
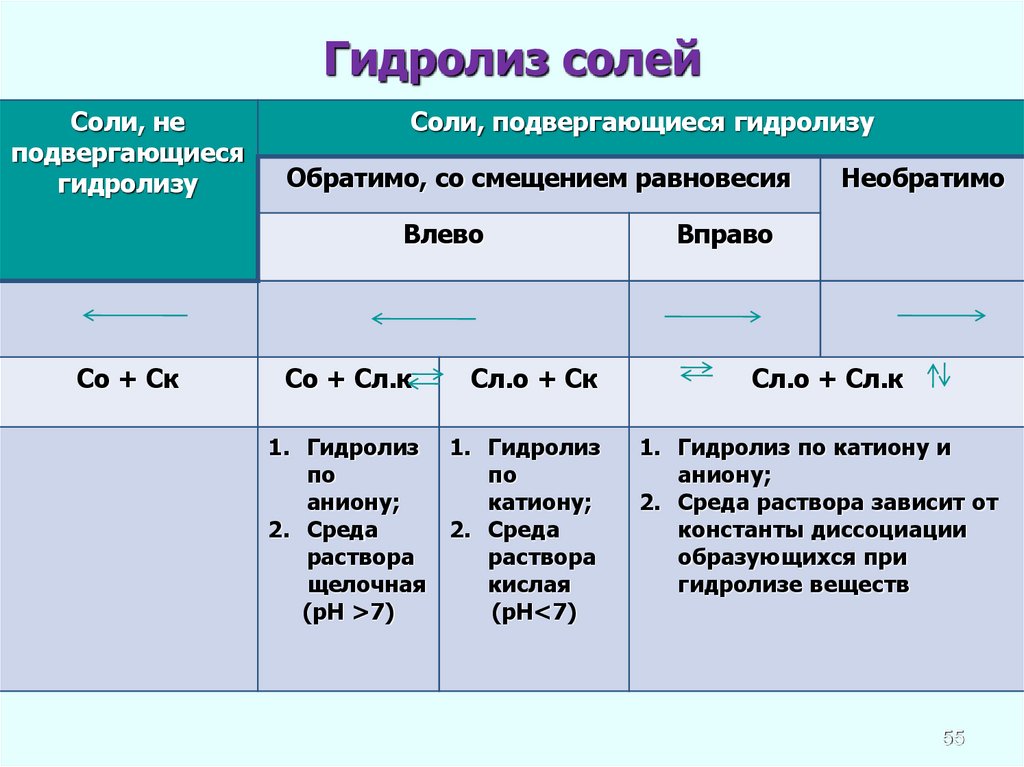
Гидролиз солейСоли, не
подвергающиеся
гидролизу
Соли, подвергающиеся гидролизу
Обратимо, со смещением равновесия
Влево
Со + Ск
Со + Сл.к
Сл.о + Ск
1. Гидролиз 1. Гидролиз
по
по
аниону;
катиону;
2. Среда
2. Среда
раствора
раствора
щелочная
кислая
(рН >7)
(рН<7)
Необратимо
Вправо
Сл.о + Сл.к
1. Гидролиз по катиону и
аниону;
2. Среда раствора зависит от
константы диссоциации
образующихся при
гидролизе веществ
55





























 Химия
Химия








