Похожие презентации:
Химическое равновесие и условия его смещения
1. Химическое равновесие
2. Главное глазами не увидишь. А. де Сент-Экзюпери
Цель занятия: изучитьобратимость химических
реакций, химическое
равновесие
и условия его смещения.
3. Эпиграф
Бытие и небытие порождают друг друга,трудное и лёгкое создают друг друга,
длинное и короткое взаимно соотносятся,
высокое и низкое взаимно определяются,
звуки, сливаясь, переходят в гармонию,
предыдущее и последующее следуют друг за
другом.
Лао-цзы
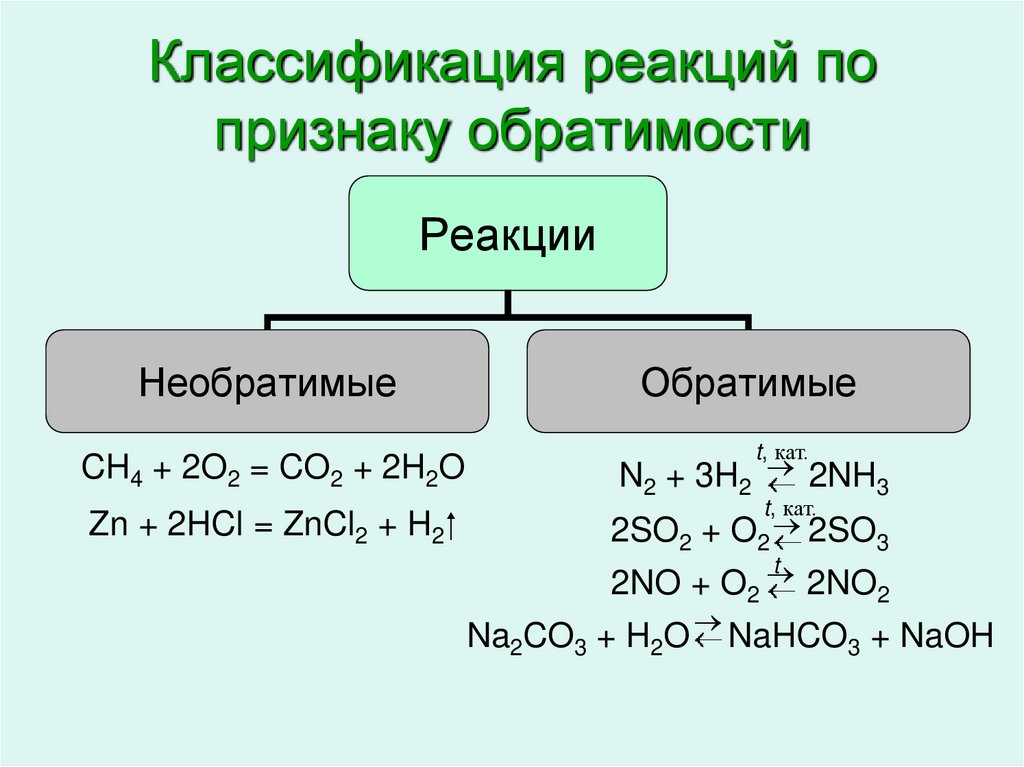
4. Классификация реакций по признаку обратимости
РеакцииНеобратимые
CH4 + 2O2 = CO2 + 2H2O
Zn + 2HCl = ZnCl2 + H2
Обратимые
t, кат.
N2 + 3H2 2NH3
t, кат.
2SO2 + O2 2SO3
t
2NO + O
2NO
2
2
Na2CO3 + H2O NaHCO3 + NaOH
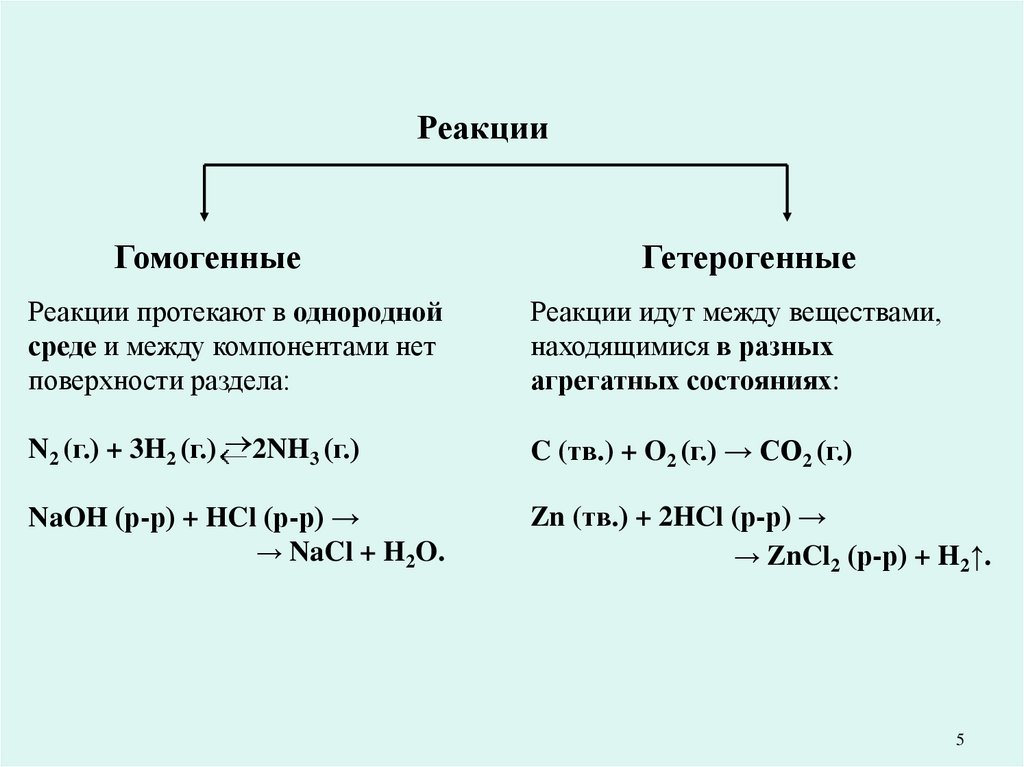
5.
РеакцииГомогенные
Гетерогенные
Реакции протекают в однородной
среде и между компонентами нет
поверхности раздела:
Реакции идут между веществами,
находящимися в разных
агрегатных состояниях:
N2 (г.) + 3H2 (г.) 2NH3 (г.)
C (тв.) + O2 (г.) → CO2 (г.)
NaOH (р-р) + HCl (р-р) →
→ NaCl + H2O.
Zn (тв.) + 2HCl (р-р) →
→ ZnCl2 (р-р) + H2↑.
5
6. Понятие «равновесие»
Равновесие – этоустойчивое
соотношение между
чем-либо.
(С.И. Ожегов.
Толковый словарь.)
7. Равновесие в изобразительном искусстве - БАЛАНС
Равновесие в изобразительном искусстве БАЛАНСВ.М. Васнецов «Богатыри»
8. Равновесие в музыке – ГАРМОНИЯ
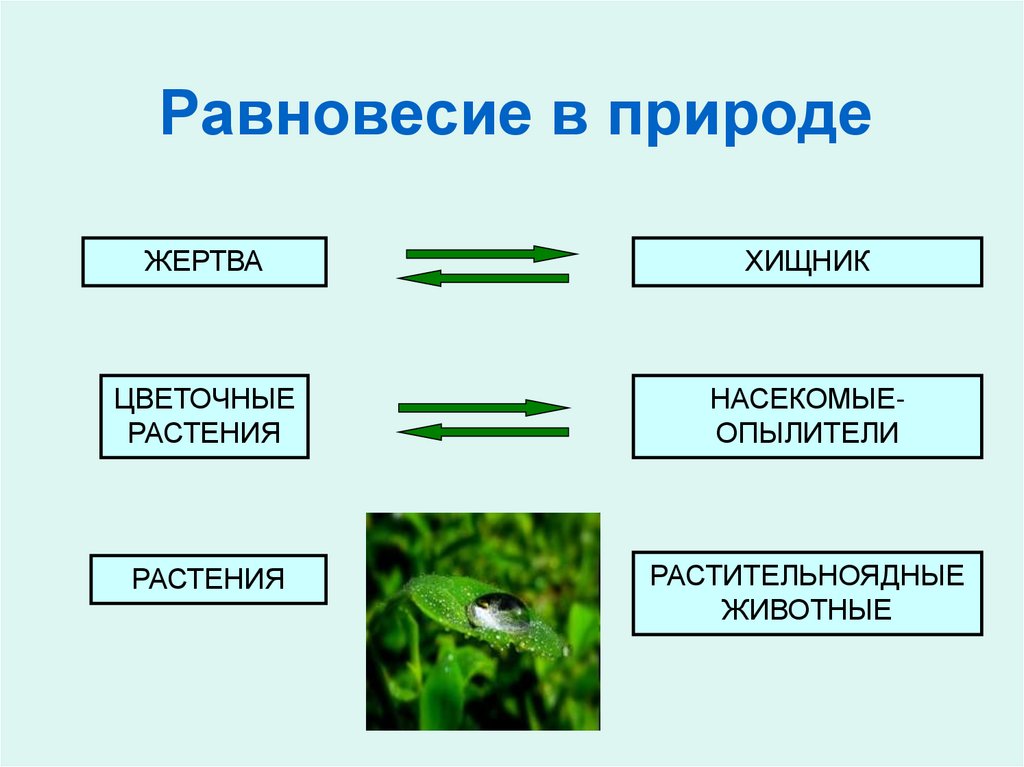
9. Равновесие в природе
ЖЕРТВАХИЩНИК
ЦВЕТОЧНЫЕ
РАСТЕНИЯ
НАСЕКОМЫЕОПЫЛИТЕЛИ
РАСТЕНИЯ
РАСТИТЕЛЬНОЯДНЫЕ
ЖИВОТНЫЕ
10.
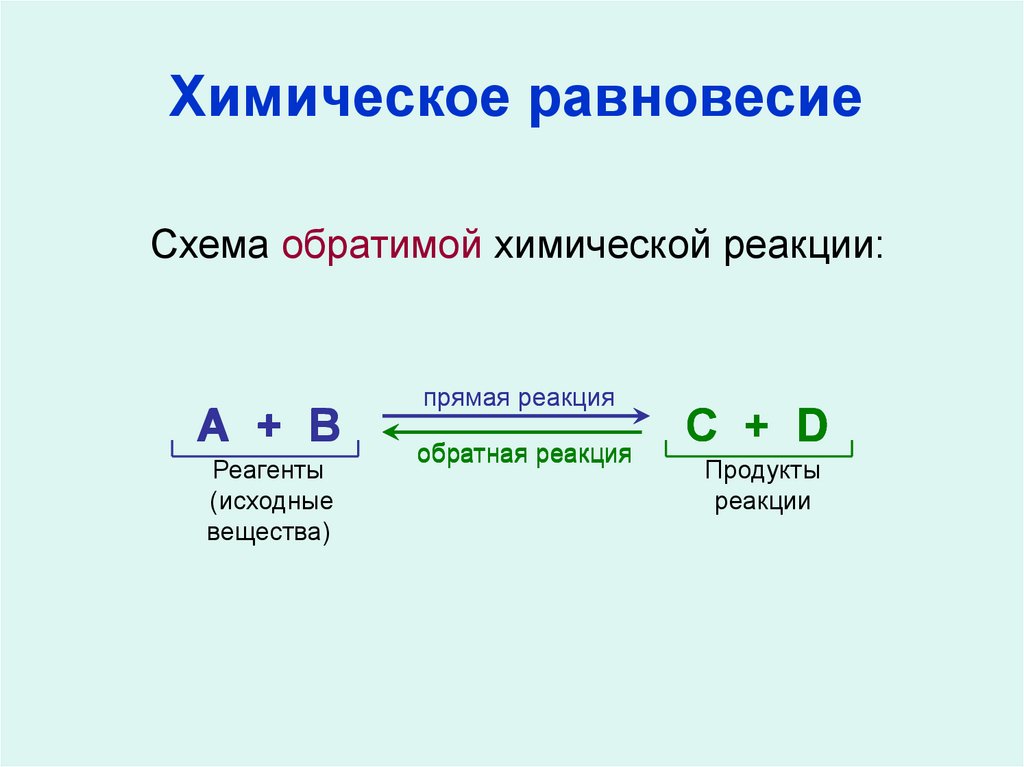
11. Химическое равновесие
Схема обратимой химической реакции:А + В
Реагенты
(исходные
вещества)
прямая реакция
обратная реакция
С + D
Продукты
реакции
12. Химическое равновесие:
динамическое состояниехимической системы, когда при
неизменных условиях скорость
прямой реакции равна скорости
обратной реакции.
13. Принцип Ле Шателье
Смещение равновесия – переход из одногосостояния в другое вследствие нарушения
равенства скоростей прямой и обратной
реакций.
vпрям > vобр – равновесие смещается вправо;
vпрям < vобр – равновесие смещается влево.
Анри Ле Шателье
Если на систему, находящуюся в равновесии, оказывается
внешнее воздействие (изменяется концентрация реагентов,
температура, давление), то равновесие смещается в сторону
ослабления этого взаимодействия.
14. 1. Влияние температуры
• При повышении температурыхимическое равновесие смещается
в направлении эндотермической
реакции;
• при понижении температуры –
в направлении экзотермической
реакции.
15.
• Куда сместится равновесиевследствие увеличения
температуры?
• N2 + O2 2NO – 180 кДж
16.
Ответ.• N2 + O2 2NO – 180 кДж.
Вправо, т.к. равновесие смещается в
сторону эндотермической реакции.
17. 2. Влияние давления
• При повышении давления равновесиесмещается в направлении образования
веществ, занимающих меньший объем;
• при понижении давления равновесие
смещается в направлении образования
веществ, занимающих больший объем;
• если реакция протекает без изменения
объема, то изменение давления в системе не
влияет на химическое равновесие.
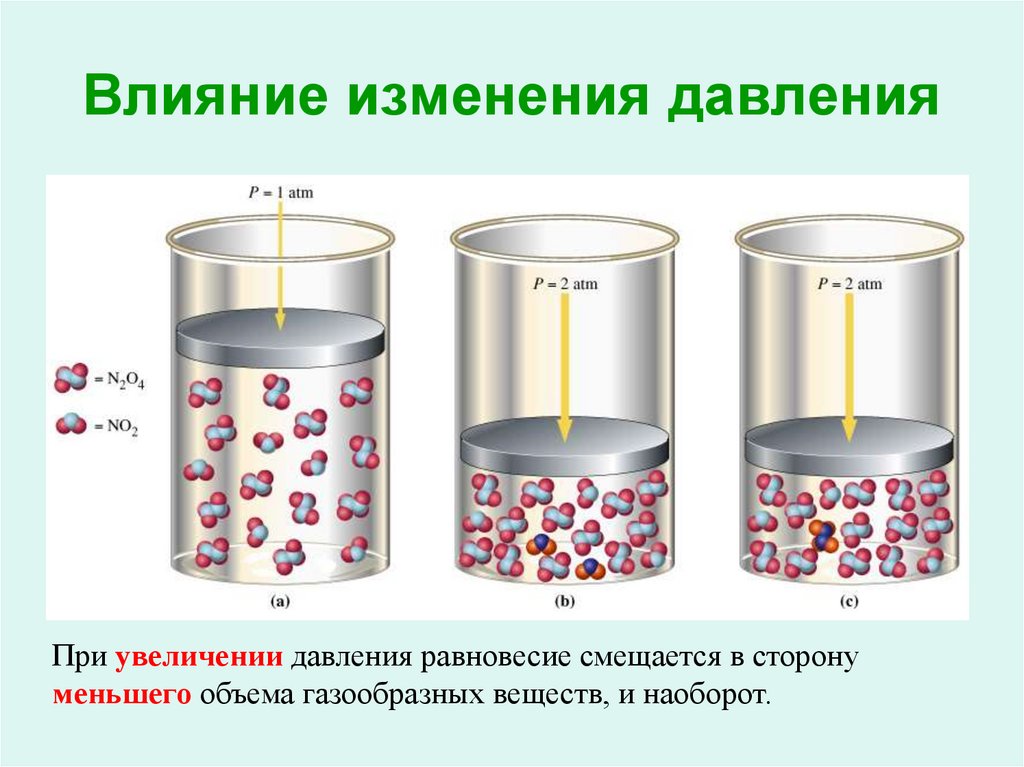
18. Влияние изменения давления
При увеличении давления равновесие смещается в сторонуменьшего объема газообразных веществ, и наоборот.
19. Влияние изменения давления
N2 (г.) + 3H2 (г.)t, кат.
4V
2NH3 (г.)
2V
p
При увеличении давления равновесие смещается в сторону
меньшего объема газообразных веществ, и наоборот.
20.
Куда сместится равновесиев результате увеличения
давления?
2NO2 N2O4
бурый
бесцветный
21.
Ответ.Вправо, т.к. при повышении давления
равновесие смещается в сторону
уменьшения объема.
2NO2 N2O4
бурый
бесцветный
22. 3. Влияние концентрации
• При повышении концентрации исходныхвеществ равновесие сдвигается в
направлении образования продуктов
реакции;
• при повышении концентрации одного из
продуктов реакции равновесие сдвигается в
сторону образования исходных веществ;
• удаление из системы одного из продуктов
реакции смещает равновесие в сторону его
образования.
23. Влияние изменения концентрации веществ
aA + bBdD + f F
c(A), c(B) равновесие смещается ВПРАВО
c(D), c(F) равновесие смещается ВПРАВО
c(A), c(B) равновесие смещается ВЛЕВО
c(D), c(F) равновесие смещается ВЛЕВО
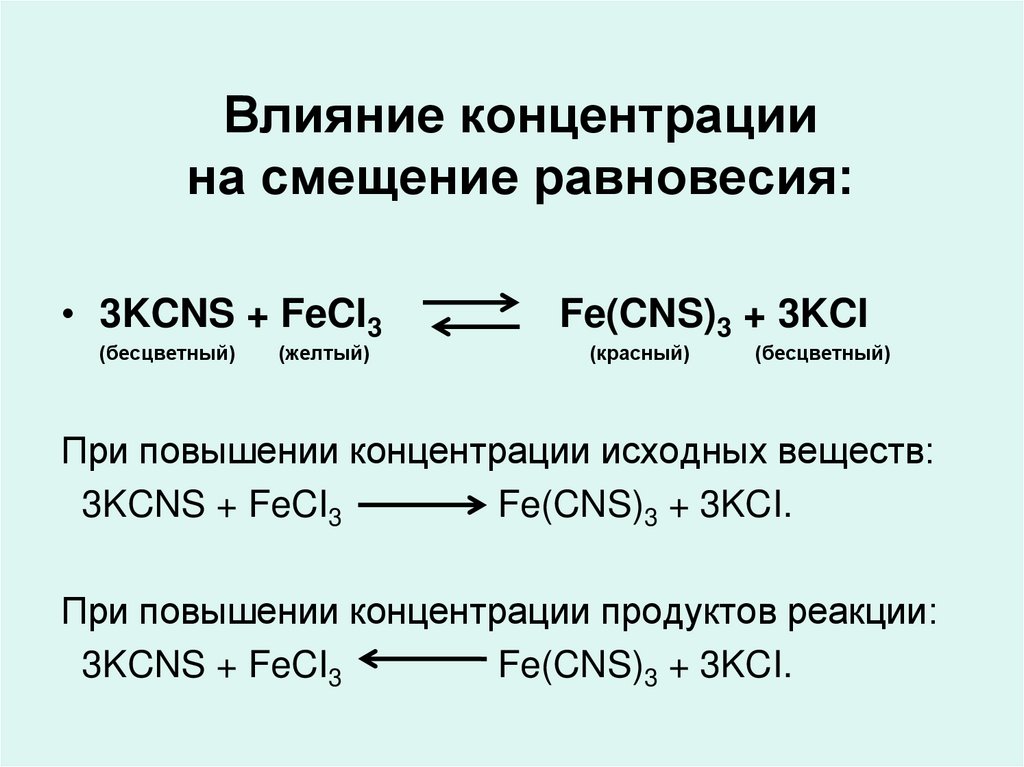
24. Влияние концентрации на смещение равновесия:
• 3KCNS + FeCI3(бесцветный)
(желтый)
Fe(CNS)3 + 3KCI
(красный)
(бесцветный)
При повышении концентрации исходных веществ:
3KCNS + FeCI3
Fe(CNS)3 + 3KCI.
При повышении концентрации продуктов реакции:
3KCNS + FeCI3
Fe(CNS)3 + 3KCI.
25. ВЫВОДЫ
• При увеличении концентрации исходных веществ химическоеравновесие смещается в сторону образования продуктов
реакции.
• При увеличении концентрации продуктов реакции химическое
равновесие смещается в сторону образования исходных
веществ.
• При повышении давления химическое равновесие смещается в
сторону той реакции, при которой объем образующихся
газообразных веществ меньше.
• При повышении температуры химическое равновесие
смещается в сторону эндотермической реакции;
• При понижении температуры химическое равновесие
смещается в сторону экзотермической реакции.
26. Задание: разберите приведенные условия смещения химического равновесия, объясните выбор правильного ответа. 1. При изменении
Закрепление знанийЗадание: разберите приведенные условия смещения
химического равновесия, объясните выбор
правильного ответа.
1. При изменении давления химическое равновесие
не смещается в реакции:
а) СО(г.) + Сl2(г.) ↔ СОСl2(г.);
б) СО2(г.) + С ↔ 2СО(г.);
в) 2СО(г.) + О2(г.) ↔ 2СО2(г.);
г) С + О2 (г.) ↔ СО2(г.).
Ответ. г.
27.
2. Химическое равновесие сместится в однусторону при повышении давления и понижении
температуры в системе:
а) N2(г.) + ЗН2(г.) ↔ 2NH3(г.) + Q;
б) Н2(г.) + Cl2(г.) ↔ 2HCl(г.) + Q;
в) N2(г.) + О2(г.) ↔ 2NO(г.) – Q;
г) С2H2(г.) ↔ 2С(тв.) + Н2(г.) – Q.
Ответ. а.
28.
3. При понижении давления химическоеравновесие смещается в сторону
образования исходных веществ
в системе:
а) 2CO(г.) + O2(г.) ↔ 2CO2(г.) + Q;
б) N2(г.) + O2(г.) ↔ 2NO(г.) – Q;
в) SO2Сl2(г.) ↔ SO2(г.) + Cl2(г.) – Q;
г) H2(г.) + Cl2(г.) ↔ 2HCl(г.) + Q.
Ответ. а.
29.
Мы изучили обратимость химических реакций,химическое равновесие и условия его
смещения, научились находить равновесные
процессы в окружающей нас природе.
И самое главное, поняв всю ценность этих
знаний, вы сможете использовать их во благо.
30. СИНКВЕЙН
1. Назовите самое главное словосегодняшнего урока (существительное).
2. Опишите его (прилагательные).
3. Назовите действие или состав
существительного (глаголы или
существительные).
4. Сформулируйте свое отношение к теме.
5. Приведите слова, с которыми ассоциируется
у вас понятие «равновесие».

























 Химия
Химия








