Похожие презентации:
Тема 9 Кислоты
1.
ВажнейшиеВажнейшие классы
классы
неорганических
неорганических соединений.
соединений.
КИСЛОТЫ
КИСЛОТЫ
Составители: к.х.н. Махмутова Г.Ф.,
к.х.н. Ефимова И.Г.
2.
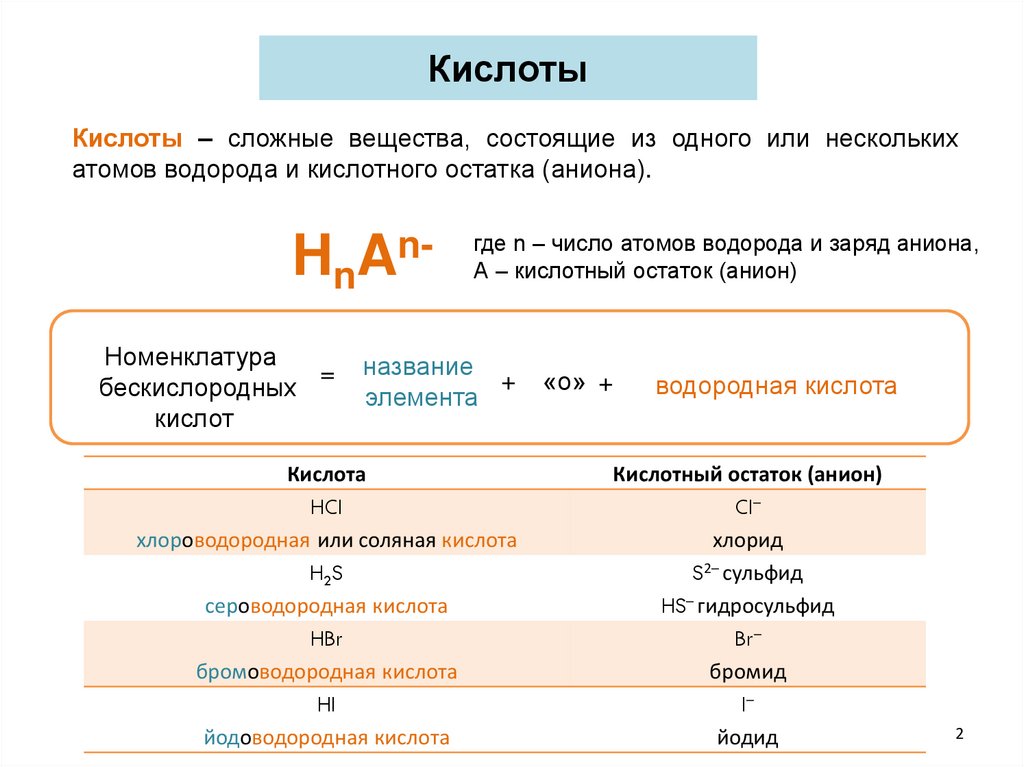
КислотыКислоты – сложные вещества, состоящие из одного или нескольких
атомов водорода и кислотного остатка (аниона).
HnAnНоменклатура
=
бескислородных
кислот
где n – число атомов водорода и заряд аниона,
А – кислотный остаток (анион)
название
+
элемента
Кислота
HCl
хлороводородная или соляная кислота
H2S
сероводородная кислота
HBr
бромоводородная кислота
HI
йодоводородная кислота
«о» +
водородная кислота
Кислотный остаток (анион)
Cl–
хлорид
S2– сульфид
HS– гидросульфид
Br–
бромид
I–
йодид
2
3.
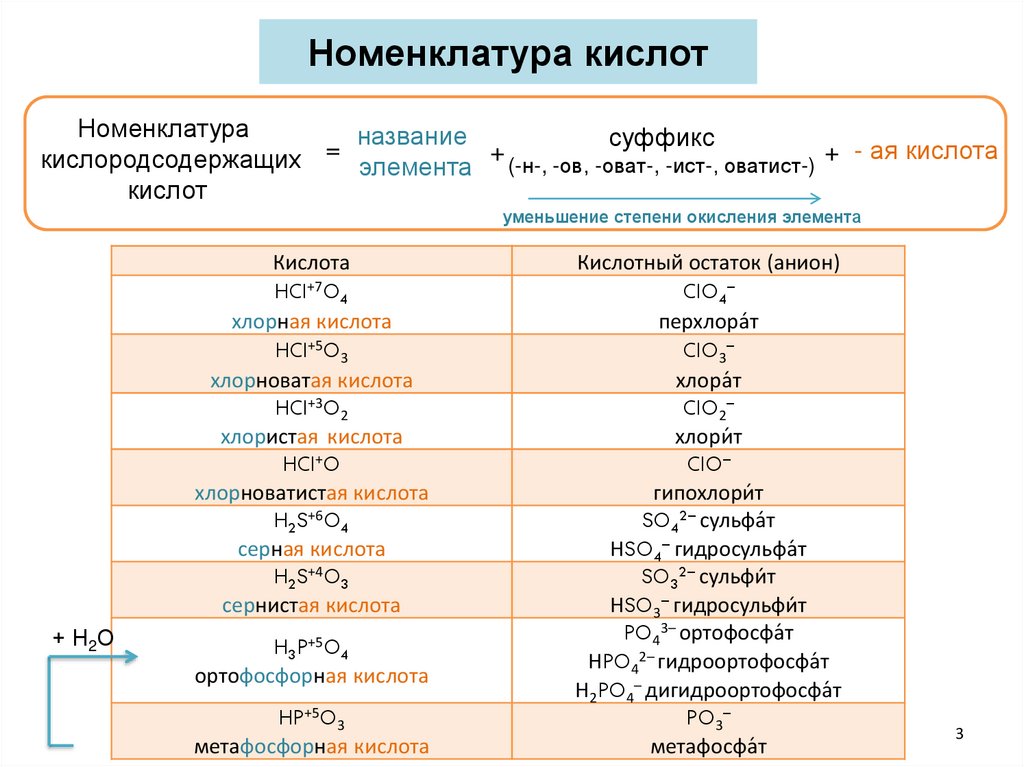
Номенклатура кислотНоменклатура
название
суффикс
=
+
+ - ая кислота
кислородсодержащих
элемента (-н-, -ов, -оват-, -ист-, оватист-)
кислот
уменьшение степени окисления элемента
Кислота
HCl+7O4
хлорная кислота
HCl+5O3
хлорноватая кислота
HCl+3O2
хлористая кислота
HCl+O
хлорноватистая кислота
H2S+6O4
серная кислота
H2S+4O3
сернистая кислота
+ Н2О
H3P+5O4
ортофосфорная кислота
HP+5O3
метафосфорная кислота
Кислотный остаток (анион)
ClO4–
перхлора́т
ClO3–
хлора́т
ClO2–
хлори́ т
ClO–
гипохлори́ т
SO42– сульфа́т
НSO4– гидросульфа́т
SO32– сульфи́ т
НSO3– гидросульфи́ т
PO43– ортофосфа́т
НPO42– гидроортофосфа́т
Н2PO4– дигидроортофосфа́т
PO3–
метафосфа́т
3
4.
Классификация кислот1. По содержанию кислорода:
- бескислородные (HBr, HCl, H2S, HCN и др.),
- кислородсодержащие (HNO3, H2SO4, HClO3 и др.).
2. По числу атомов водорода:
Число атомов водорода (n) определяет основность кислот:
n = 1 – одноосновная (HCl),
n = 2 – двухосновная (H2SO4),
n = 3 – трёхосновная (H3PO4).
3. По силе:
Для кислот с формулой HxЭOy, чем больше разница (y-x), тем сильнее кислота. К
сильным относят кислородсодержащие кислоты при (y-x) ≥ 2.
- сильные (HNO3 ((y-x) = 2), H2SO4 ((y-x) = 2), HClO4 ((y-x) = 3), HBr, HCl, и другие);
- средние (H3PO4 ((y-x) = 1), H2SO3 ((y-x) = 1), HF и другие);
- cлабые (H2S, HClO ((y-x) = 0), HCN и другие).
4
5.
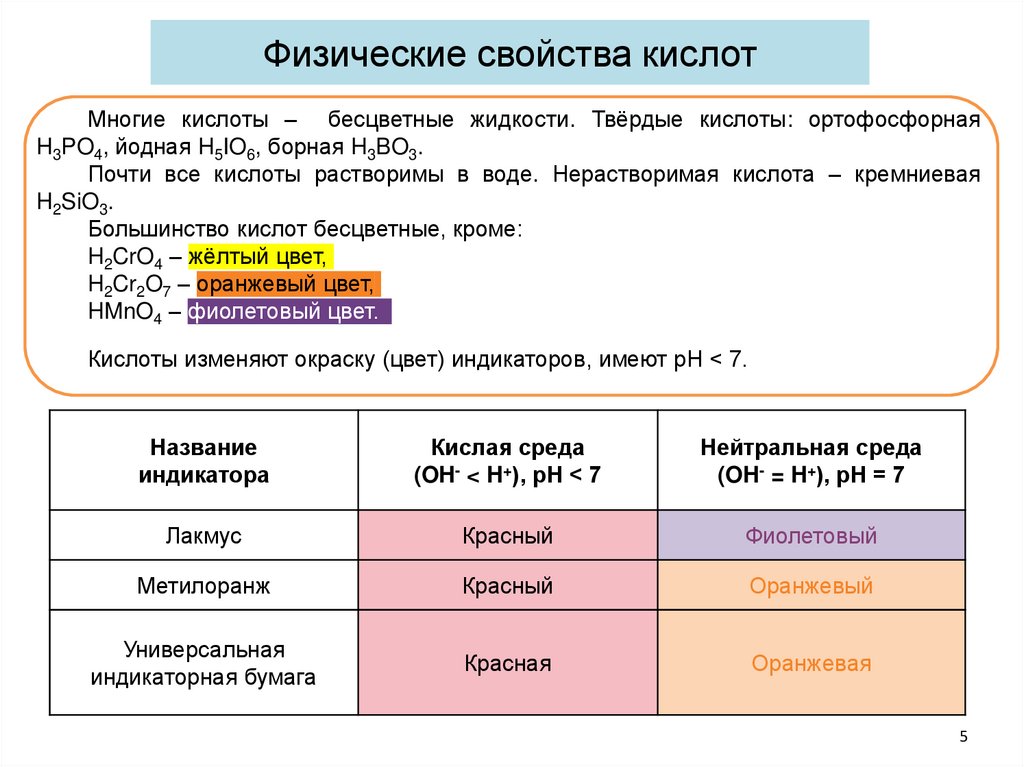
Физические свойства кислотМногие кислоты – бесцветные жидкости. Твёрдые кислоты: ортофосфорная
H3PO4, йодная H5IO6, борная H3BO3.
Почти все кислоты растворимы в воде. Нерастворимая кислота – кремниевая
H2SiO3.
Большинство кислот бесцветные, кроме:
H2CrO4 – жёлтый цвет,
H2Cr2O7 – оранжевый цвет,
HMnO4 – фиолетовый цвет.
Кислоты изменяют окраску (цвет) индикаторов, имеют рН < 7.
Название
индикатора
Кислая среда
(OH- < H+), рН < 7
Нейтральная среда
(OH- = H+), рН = 7
Лакмус
Красный
Фиолетовый
Метилоранж
Красный
Оранжевый
Универсальная
индикаторная бумага
Красная
Оранжевая
5
6.
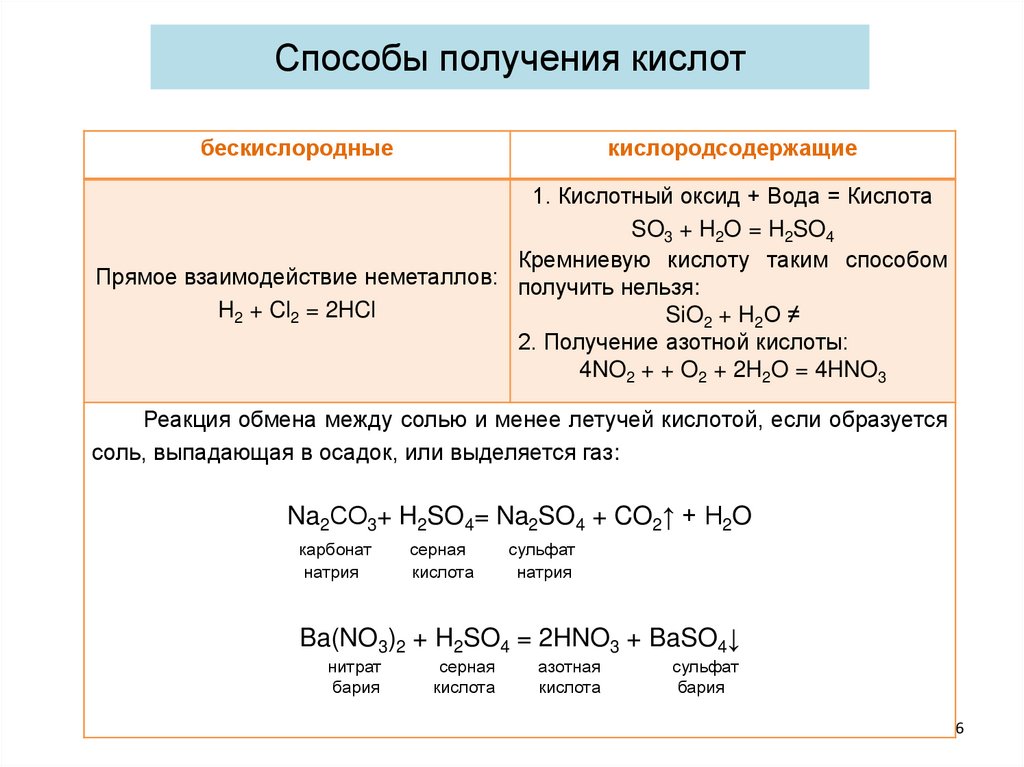
Способы получения кислотбескислородные
кислородсодержащие
1. Кислотный оксид + Вода = Кислота
SO3 + H2O = H2SO4
Кремниевую кислоту таким способом
Прямое взаимодействие неметаллов: получить нельзя:
H2 + Cl2 = 2HCl
SiO2 + H2O ≠
2. Получение азотной кислоты:
4NO2 + + O2 + 2H2O = 4HNO3
Реакция обмена между солью и менее летучей кислотой, если образуется
соль, выпадающая в осадок, или выделяется газ:
Na2СО3+ H2SO4= Na2SO4 + CO2↑ + H2O
карбонат
натрия
серная
кислота
сульфат
натрия
Ba(NO3)2 + H2SO4 = 2HNO3 + BaSO4↓
нитрат
бария
серная
кислота
азотная
кислота
сульфат
бария
6
7.
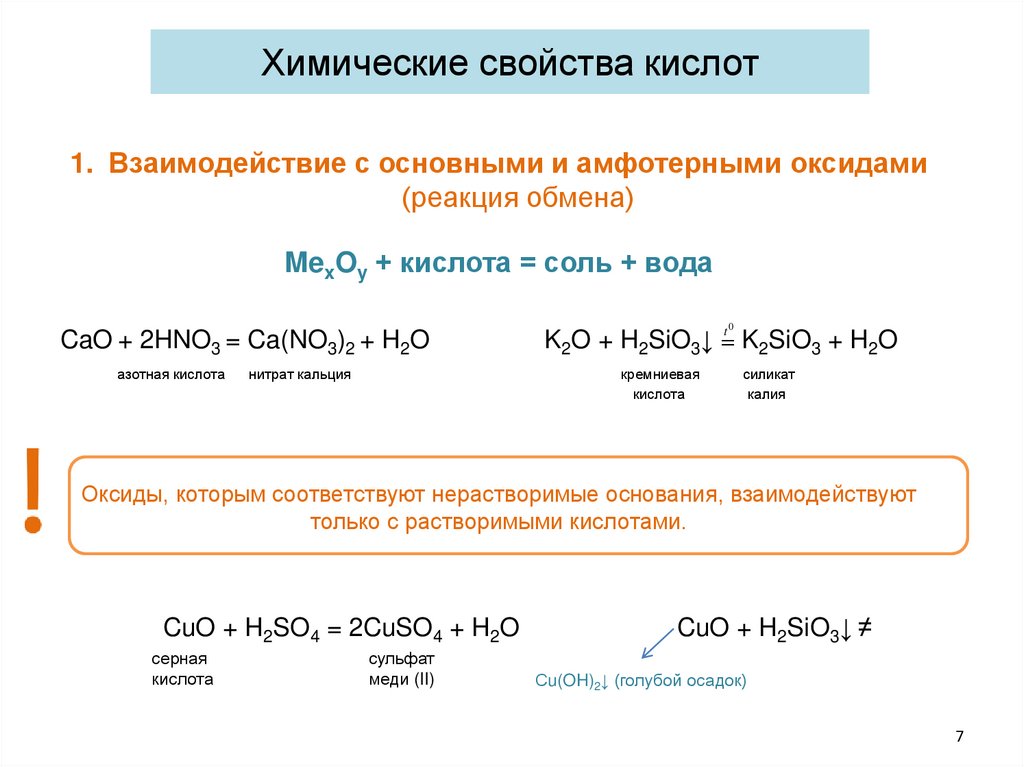
Химические свойства кислот1. Взаимодействие с основными и амфотерными оксидами
(реакция обмена)
MexOy + кислота = соль + вода
CaO + 2HNO3 = Ca(NO3)2 + H2O
азотная кислота
нитрат кальция
t0
K2O + H2SiO3↓ = K2SiO3 + H2O
кремниевая
кислота
силикат
калия
Оксиды, которым соответствуют нерастворимые основания, взаимодействуют
только с растворимыми кислотами.
CuO + H2SO4 = 2CuSO4 + H2O
серная
кислота
сульфат
меди (II)
CuO + H2SiO3↓ ≠
Сu(OH)2↓ (голубой осадок)
7
8.
Химические свойства кислот2. Взаимодействие с основаниями
основание + кислота = соль + вода
Ca(OH)2 + 2HNO3 = Ca(NO3)2 + 2H2O (реакция нейтрализации)
азотная кислота
нитрат кальция
3KOH + H3PO4 = K3PO4 + 3H2O (реакция нейтрализации)
ортофосфорная ортофосфат калия
кислота
С нерастворимыми основаниями реагируют только растворимые кислоты
Fe(OH)2↓ + 2HCl = FeCl2 + H2O
Fe(OH)2↓ + H2SiO3↓ ≠
хлороводородная хлорид
кислота
железа (II)
Al(OH)3↓ + 3CH3COOH = (CH3COO)3Al + 3H2O
уксусная кислота
ацетат алюминия
8
9.
Химические свойства кислот3. Разложение некоторых кислородсодержащих кислот
при нагревании
(исключение H2SO4)
Запомните! Неустойчивые кислоты (угольная и сернистая) – разлагаются
на газ (кислотный оксид) и воду без нагревания:
H2CO3 ⇄ H2O + CO2↑
H2SO3 ⇄ H2O + SO2↑
Азотистая кислота (HNO2) разлагается самопроизвольно:
2HNO2 → NO + H2O + NO2
Азотная и ортофосфорная кислоты при нагревании разлагается сложнее:
t0
4HNO3 = 4NO2↑ + O2↑ + 2H2O
9
10.
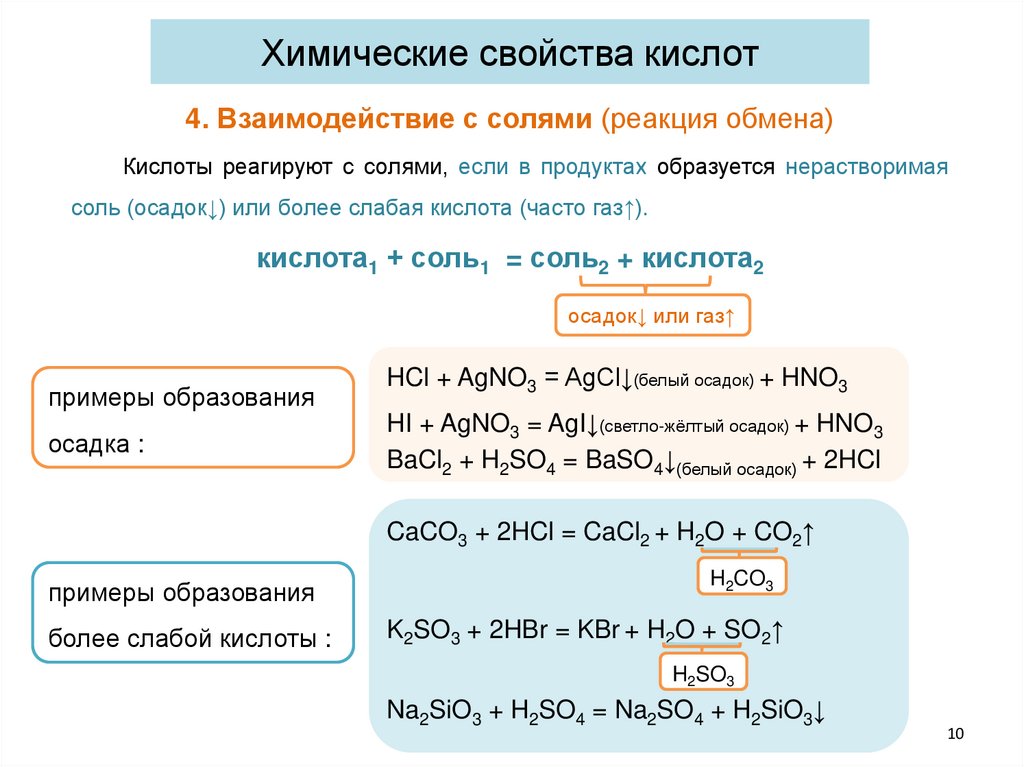
Химические свойства кислот4. Взаимодействие с солями (реакция обмена)
Кислоты реагируют с солями, если в продуктах образуется нерастворимая
соль (осадок↓) или более слабая кислота (часто газ↑).
кислота1 + соль1 = соль2 + кислота2
осадок↓ или газ↑
примеры образования
осадка :
HCl + AgNO3 = AgCl↓(белый осадок) + HNO3
HI + AgNO3 = AgI↓(светло-жёлтый осадок) + HNO3
BaCl2 + H2SO4 = BaSO4↓(белый осадок) + 2HCl
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
примеры образования
более слабой кислоты :
H2CO3
K2SO3 + 2HBr = KBr + H2O + SO2↑
H2SO3
Na2SiO3 + H2SO4 = Na2SO4 + H2SiO3↓
10
11.
Химические свойства кислот5. Взаимодействие с металлами
(окислительно-восстановительная реакция)
Все кислоты реагируют с металлами в ряду активности до водорода (H2)
(исключение HNO3, H2SO4(КОНЦ)):
РЯД АКТИВНОСТИ МЕТАЛЛОВ / ЭЛЕКТРОХИМИЧЕСКИЙ РЯД НАПРЯЖЕНИЙ
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H) Sb Bi Cu Hg Ag Pt Au
Ме (до H2) + Кислота = Соль + H2↑
кислоты:
Ме (после H2) + Кислота≠
H2SO4(разб), HCl, HBr, HF, H2S, HNO2, H2SiO3 и др.
Fe + 2HCl = FeCl2 + H2↑
Cu + 2HCl ≠
Zn + H2SO4(разб) = ZnSO4 + H2↑
11
12.
Химические свойства кислот5. Взаимодействие с металлами
(окислительно-восстановительная реакция)
HNO3, H2SO4(КОНЦ) взаимодействуют с металлами по следующей схеме:
Al – Pb
Cu – Ag
Pt, Au, Ir
активные металлы
металлы средней
активности
малоактивные
металлы
благородные
металлы
HNO3
разбавленная
cоль+H2O+NH4NO3
cоль+H2O+N2
(или N2O)
cоль+H2O+NO
не реагирует
HNO3
концентрированная
cоль+H2O+N2O
cоль+H2O+NO2
cоль+H2O+NO2
не реагирует
H2SO4
концентрированная
cоль+H2O+H2S
cоль+H2O+S
cоль+H2O+SO2
не реагирует
Металлы
Кислота
Li – Mg
Запомните! При взаимодействии азотной кислоты и концентрированной серной
кислоты с металлами водород никогда не выделяется. Продукты зависят от металла и
концентрации кислот.
Ag + 2HNO3(конц) = AgNO3 + NO2↑ + Н2О
Cu + 2H2SO4(конц) = CuSO4 + SO2↑ + 2Н2О
Pt + H2SO4 (конц) ≠
12
13.
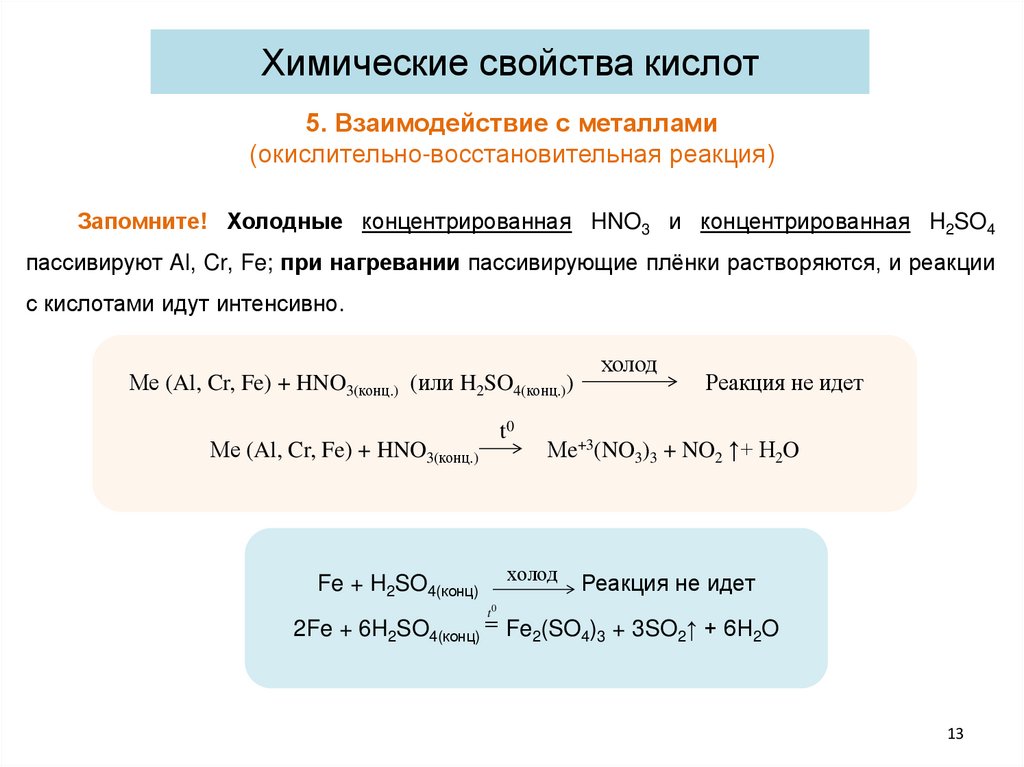
Химические свойства кислот5. Взаимодействие с металлами
(окислительно-восстановительная реакция)
Запомните! Холодные концентрированная HNO3 и концентрированная H2SO4
пассивируют Al, Cr, Fe; при нагревании пассивирующие плёнки растворяются, и реакции
с кислотами идут интенсивно.
Ме (Al, Cr, Fe) + HNO3(конц.) (или H2SO4(конц.))
t0
Ме (Al, Cr, Fe) + HNO3(конц.)
Fe(или
+ HH2SO
Ме (Al, Cr, Fe) + HNO3(конц.)
2SO4(конц)
4(конц.))
холод
Реакция не идет
Мe+3(NO3)3 + NO2 ↑+ H2O
холод
Реакция
идет
Реакция не
не идет
t0
2Fe + 6H2SO4(конц) = Fe2(SO4)3 + 3SO2↑ + 6H2O
13
14.
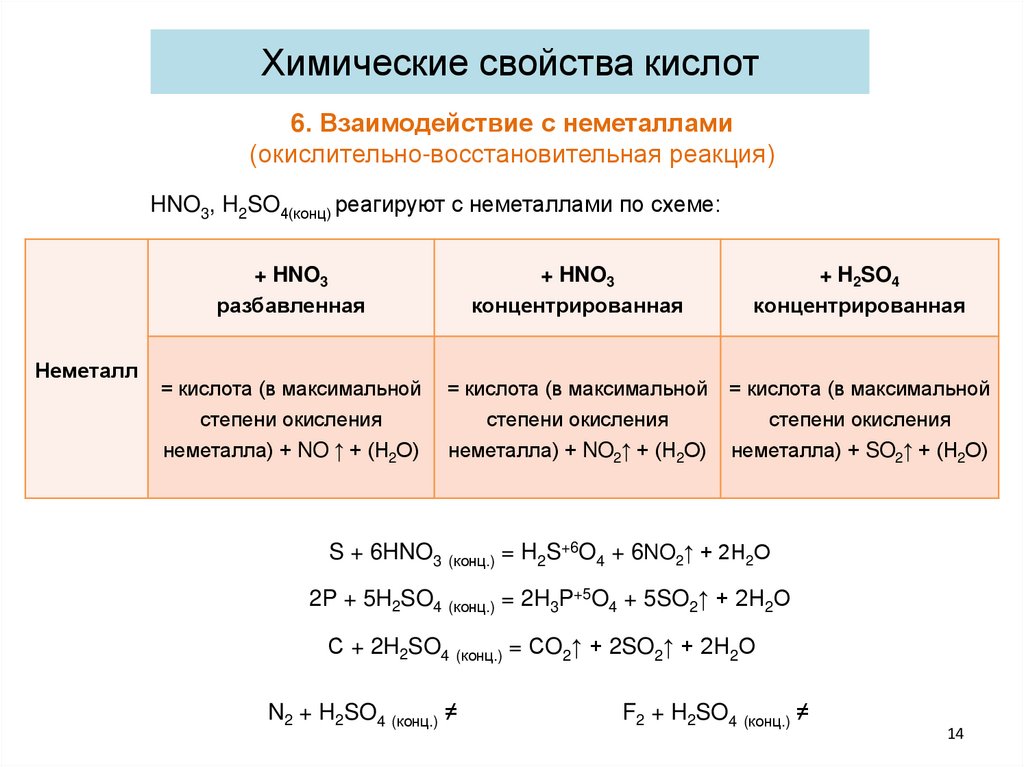
Химические свойства кислот6. Взаимодействие с неметаллами
(окислительно-восстановительная реакция)
HNO3, H2SO4(конц) реагируют с неметаллами по схеме:
+ HNO3
разбавленная
Неметалл
= кислота (в максимальной
степени окисления
неметалла) + NO ↑ + (Н2О)
+ HNO3
концентрированная
+ H2SO4
концентрированная
= кислота (в максимальной = кислота (в максимальной
степени окисления
степени окисления
неметалла) + NO2↑ + (Н2О) неметалла) + SO2↑ + (Н2О)
S + 6HNO3 (конц.) = H2S+6O4 + 6NO2↑ + 2Н2О
2P + 5H2SO4 (конц.) = 2H3P+5O4 + 5SO2↑ + 2Н2О
С + 2H2SO4 (конц.) = СO2↑ + 2SO2↑ + 2Н2О
N2 + H2SO4 (конц.) ≠
F2 + H2SO4 (конц.) ≠
14
15.
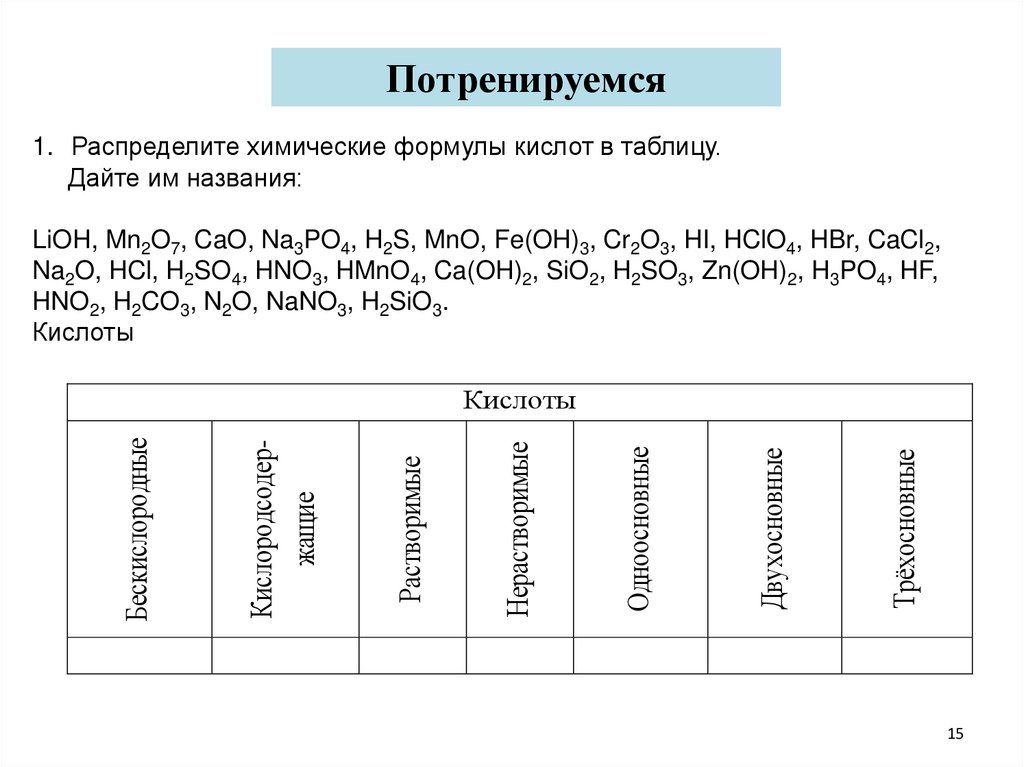
Потренируемся1. Распределите химические формулы кислот в таблицу.
Дайте им названия:
LiOH, Mn2O7, CaO, Na3PO4, H2S, MnO, Fe(OH)3, Cr2O3, HI, HClO4, HBr, CaCl2,
Na2O, HCl, H2SO4, HNO3, HMnO4, Ca(OH)2, SiO2, H2SO3, Zn(OH)2, H3PO4, HF,
HNO2, H2CO3, N2O, NaNO3, H2SiO3.
Кислоты
Трёхосновные
Двухосновные
Одноосновные
Нерастворимые
Растворимые
Кислородсодержащие
Бескислородные
Кислоты
15
16.
Потренируемся2. Составьте уравнения реакций, расставьте коэффициенты, назовите
продукты реакции:
1) Fe + HCl →
9) ZnO + HCl →
2) Na + H2SO4 →
10) CaO + HNO3 →
3) Al + H2S →
11) Fe2O3 + H2SO4 →
4) Ca + H3PO4 →
12) KOH + HNO3 →
5) Na2O + H2CO3 →
11) NaOH + H2SO3 →
6) Ca(OH)2 + H2S →
12) H2SO4 + K2CO3 →
7) Al(OH)3 + HF →
13) HNO3 + CaCO3 →
8) HCl + Na2SiO3 →
16
17.
Домашнее задание1. Выберите два вещества, из которых алюминий не вытесняет водород.
1) H2SO4(конц.)
2) H2SO4(разб.)
3) CH3COOH
4)HNO3
5) HI
2. Выберите два взаимодействия веществ, в результате которых водород не
выделяется.
1) Zn и H2SO4(разб.)
2) Al и NaOH(конц.) 3) Cu и HNO3(конц.)
4) Zn и NaOH(конц.)
5) Al и HNO3(конц.)
3. Выберите две пары металлов, каждый из которых не реагирует с
разбавленной серной кислотой.
1) медь и серебро
2) железо и олово
3) железо и хром
4) платина и золото
5) медь и цинк
17









 Химия
Химия








