Похожие презентации:
Клас Хим реак (1)
1. Классифиция химических реакций
2. Химическая реакция процесс превращения исходных веществ (реагентов) в конечные вещества (продукты)
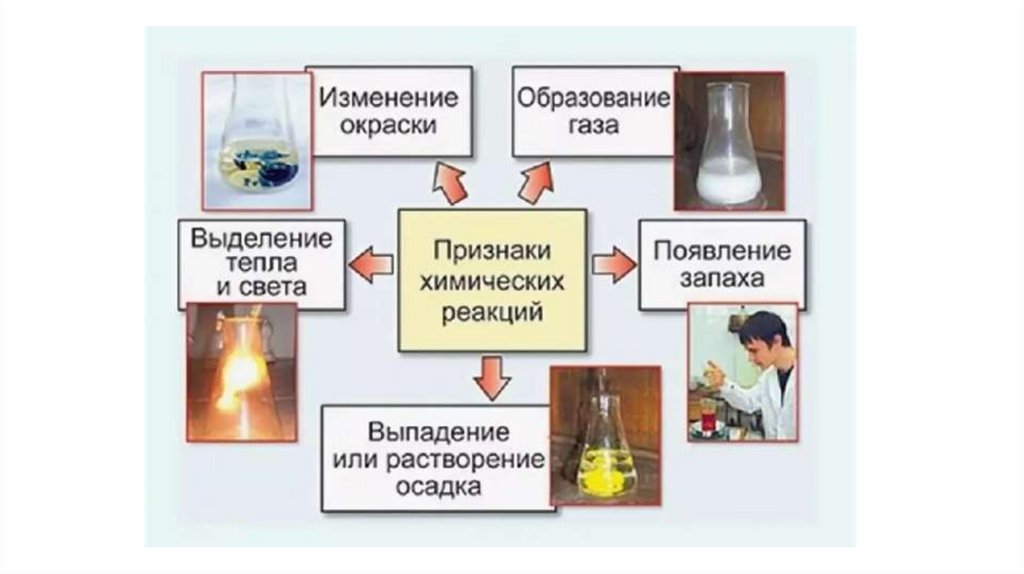
Признаками протекания химических реакций являются:● изменение цвета,
● выделение газа,
● выпадение осадка,
● появление запаха,
● выделение или поглощение энергии
3.
4.
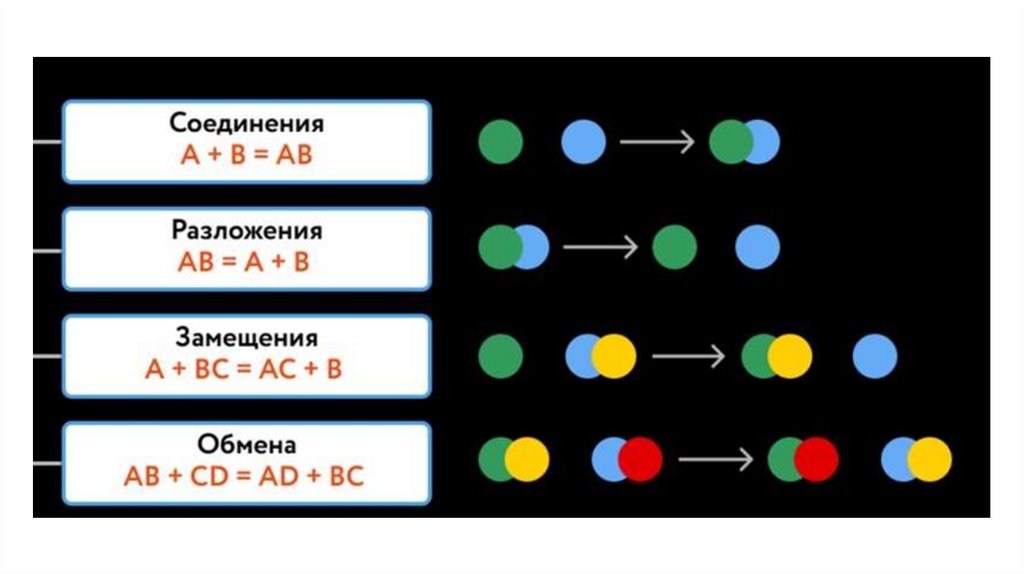
По числу и составу исходныхвеществ:
● реакция СОЕДИНЕНИЯ
● реакция РАЗЛОЖЕНИЯ
● реакция ЗАМЕЩЕНИЯ
● реакция ОБМЕНА
5.
6.
7.
По тепловому эффекту:● Экзотермические (+Q): реакции,
протекающие с выделением тепла
● Эндотермические (-Q):реакции,
протекающие с поглощением тепла
8.
От агрегатного состояния:● Гомогенные реакции: реакции в
пределах одной фазы (агрегатного
состояния)
● Гетерогенные реакции: реакции на
границе раздела фаз
9.
10.
11.
По признаку обратимости:Обратимые:
*большинство химических реакций являются обратимыми:
при одних условиях (P, t, kat) они идут в одном направлении,
при других – в обратном, а при некоторых промежуточных –
протекают одновременно в двух взаимно противоположных
направлениях.
Необратимые:
*идущие до конца и не изменяющие своего направления при
изменении температуры и давления, в результате которых
образуются стабильные конечные продукты.
12.
13.
Так же примером обратимых реакций служат реакции термического разложения гидроксидакальция, синтез аммиака:
Ca(OH) ↔ CaO + H2O – Q
N2+3H2 ↔ 2NH3 + Q
Реакцию, идущую слева направо называют прямой, а справа налево – обратной.
Если прямая реакция экзотермическая, то обратная – эндотермическая. Причем, по закону
сохранения энергии, количество теплоты, выделившееся в результате прямой реакции, равно
количеству теплоты, поглощенному при обратном процессе, а наоборот.
14.
Химические реакции принято считать необратимыми, если:Один из продуктов реакции выводится из сферы реакции в виде:
А) газа BaCO3 =t= BaO +CO2↑
Б) осадка Pb(NO3)2 + 2NaCl = PbCl2 ↓+ 2NaNO3
В) А так же воды, слабой кислоты или основания
KOH +HCl = KCl + H2O
CH3COONa + HNO3 = NaNO3 + CH3COOH
Г) выделяется большое количество тепла, например, реакция
горения:
C +О2 = CO2 +Q= + 393,5 кДж
15.
По наличию или отсутствию катализатора: каталитические инекаталитические
● Каталитические
Катализатор - вещество, участвующее в реакции и изменяющее её скорость,
но остающееся неизменным после того, как химическая реакция закончилась.
16.
Ингибитор - вещество, замедляющее или останавливающеереакцию.
Чаще всего они применяются для защиты металлов от
коррозии
Коррозия цинка в воде:
Zn+2H2O=Zn(OH)2+H2
Добавляем ингибитор Na2B4O7·10Н2О,выделение водорода
уменьшается, а значит и реакция замедляется














 Химия
Химия








