Похожие презентации:
11_Презентация _Классификации химических реакций в неорганической и органической химии
1. О чем пойдет речь на уроке?
«Она идет» , «онапрошла», никто ни
скажет, что пришла.
2. Что такое химическая реакция?
- это процесс, в результате которого изодних веществ образуются другие,
отличающиеся от них по составу и (или)
строению.
3. ?
Вокруг нас и внутри нас непрерывноосуществляются тысячи разнообразных
химических реакций.
Как сориентироваться в
многообразии химических реакций?
4. КЛАССИФИКАЦИЯ
По числу и составу реагирующих и образующихся веществПо изменению степени окисления атомов элементов
По использованию катализатора
По направлению
• По тепловому эффекту
По механизму
По виду энергии, инициирующей реакцию
По фазовому составу
5. Оформляем таблицу:
Признакиклассификации
химических
реакций
Названия типов
химических
реакций,
соответствующих
признакам их
классификации
Примеры
химических
реакций между
неорганическими
и органическими
веществами
6. I. по числу и составу реагирующих и образующихся веществ:
• Реакции, идущие без изменения состававеществ.
• В неорганической химии к таким
реакциям относят процессы получения
аллотропных
модификаций
одного
химического элемента, например:
• превращение графита в алмаз при
давлении 6 ГПа и температуре 1500 °C в
присутствии катализатора
7. Реакции, идущие с изменением состава вещества
Определите по схемам окаких реакциях идет речь?
Определите тип химической
реакции:
• A + B = AB
• 2Na + 2H2O = 2NaOH + H2
• AB = A + B
• 2NH4Cl + Ca(OH)2 = CaCl2 +
• A + BC =AC + B 2NH3 + 2H2O
• AB+CD = AD+CB • 2SO2 + O2 = 2SO3
• 2KMnO4=K2MnO4+MnO2+ O2
8.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙ1. Классификация органических реакций по изменению
числа частиц в ходе реакции
1. 1.Реакции замещения:
общая схема:
R–X+Y→R–Y+X
пример:
CH4 + Br2 → CH3Br + HBr
1.2. Реакции присоединения:
общая схема:
C=C
+ XY →
– C– C–
X
примеры:
CH2 = CH2 + HCl → CH3 – CH2 – Cl
CH2 = CH2 + Br2 → BrCH2 – CH2Br
Y
9.
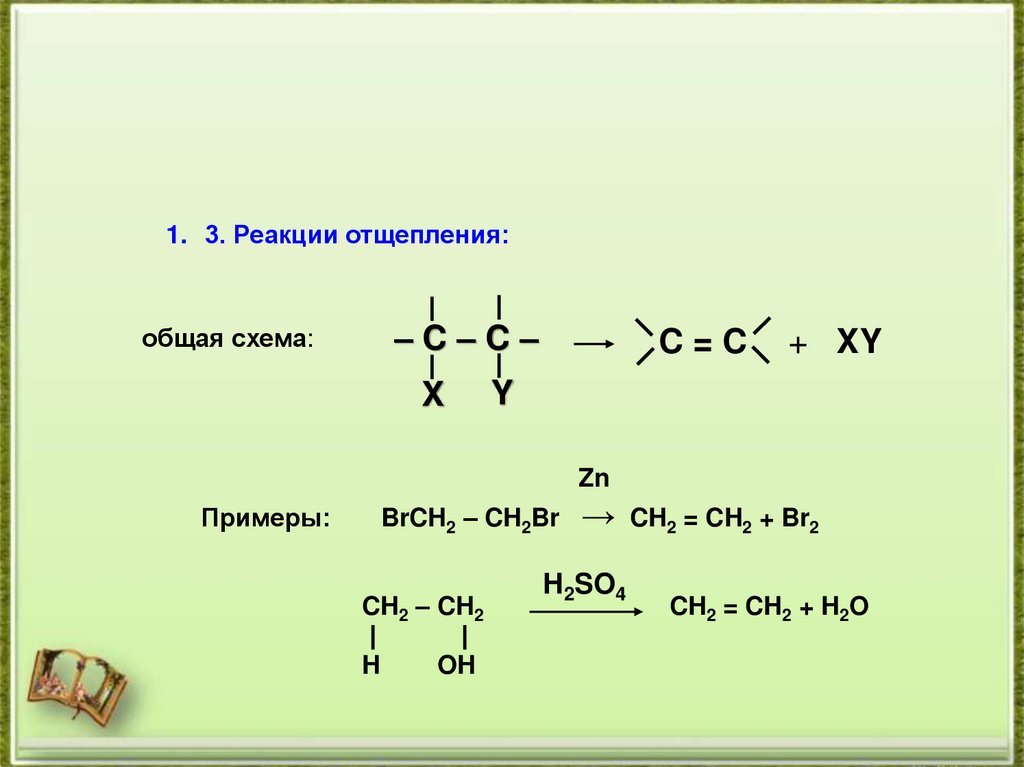
1. 3. Реакции отщепления:–C–C–
общая схема:
X
C=C
+ XY
Y
Zn
Примеры:
BrCH2 – CH2Br
CH2 – CH2
H
OH
→ CH2 = CH2 + Br2
H2SO4
CH2 = CH2 + H2O
10. II. По изменению степеней окисления химических элементов
1. Окислительно-восстановительныереакции – это
реакции, идущие с
изменением
степеней
окисления
элементов.
Все реакции замещения, а также
реакции соединения и разложения, в
которых участвует хотя бы одно
простое вещество.
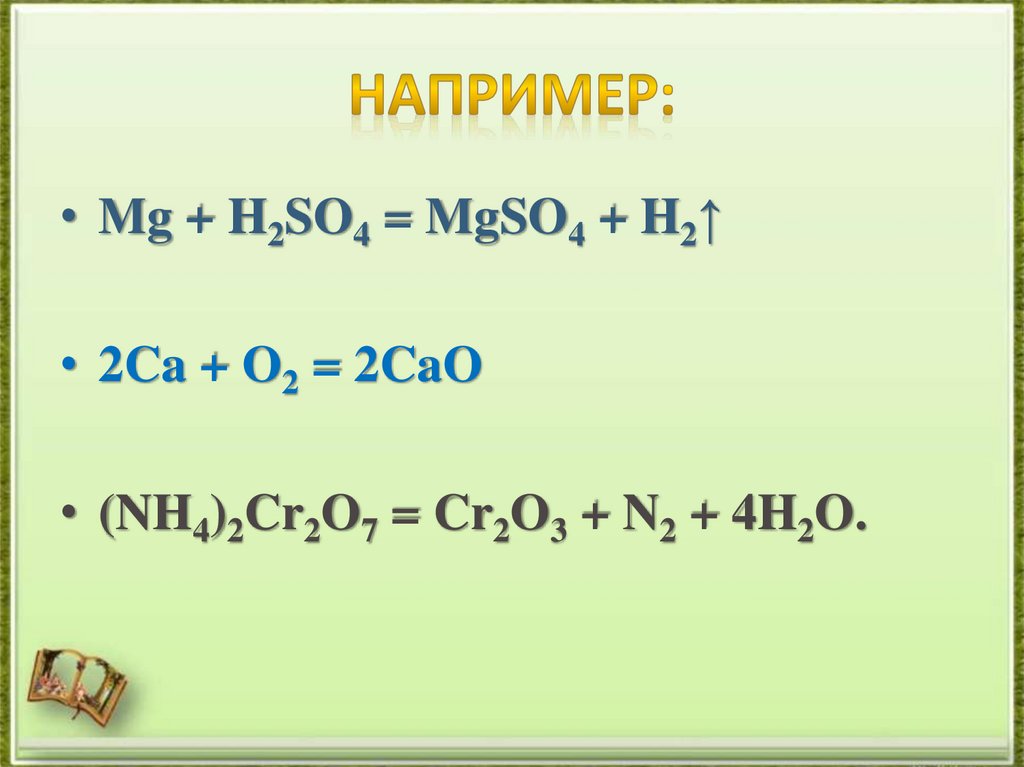
11. Например:
• Mg + H2SO4 = MgSO4 + H2↑• 2Ca + O2 = 2CaO
• (NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
12. III. По использованию катализатора:
• Некаталитическиереакции – реакции,
идущие без участия
катализатора:
t
2HgO = 2Hg + O2↑
• Каталитические
реакции – реакции,
идущие с участием
катализатора:
MnO2
2H2O2 = 2H2O + O2↑
13. IV. По направлению:
• Необратимые реакциипротекают в данных
условиях только в одном
направлении:
• Обратимые
реакции в данных
условиях
протекают
одновременно в
BaCl +H SO =2HCl+BaSO ↓ двух направлениях:
2
РИО
2
4
4
N2O4 2NO2
14. V. По тепловому эффекту:
• Эндотермическиереакции протекают с
поглощением энергии:
• Экзотермические
реакции протекают с
выделением энергии:
N2 + O2 = 2NO – Q кДж
CH4+ 2O2=CO2+2H2O + Q
кДж
• Когда в природе
протекает данная
реакция?
Где протекает данная
реакция?
15. VI. По механизму:
• Ионные реакции –идут между уже
имеющимися или
образующимися в ходе
реакции ионами:
• C2H4 + HBr = C2H5Br
• Радикальные реакции
– идут между
образующимися в ходе
реакции радикалами и
молекулами:
• CH4+Cl2 =CH3Cl+HCl
16.
КЛАССИФИКАЦИЯ ОРГАНИЧЕСКИХ РЕАКЦИЙКлассификация реакций по их механизму:
В этом случае ориентируются на способ разрыва
ковалентной связи. Этих способов два:
Гомологический (радикальный) разрыв ковалентной связи:
А : В → А• + •В
радикалы
Гетероциклический (ионный) разрыв ковалентной связи:
А : В → А+ + (:В)–
ионы
17. VII. По виду энергии, инициирующей реакцию:
1. Фотохимическиереакции
инициируются
световой энергией.
2. Радиационные
реакции
инициируются
излучениями
большой
энергии
–
рентгеновскими
лучами,
ядерными
излучениями.
3. Электрохимические реакции инициируются
электрическим током (электролиз).
4. Термохимические
реакции
инициируются
тепловой энергией.
18. VIII. По фазовому составу:
• Гетерогенныереакции – реакции, в
которых
реагирующие
вещества и продукты
находятся в разных
агрегатных
состояниях.
• Гомогенные реакции –
реакции, в которых
реагирующие
вещества и продукты
находятся в одном
агрегатном
состоянии (в одной
фазе).
19. Определите тип реакции:
NiC2H4+H2 ↔ C2H6 + Q
Классифицируйте эту реакцию по
разным признакам.


















 Химия
Химия








