Похожие презентации:
Классификация химических реакций (11 класс)
1.
Классификация химических реакцийУрок химии
11 класс
2.
ХИМИЧЕСКИЕ РЕАКЦИИХимические реакции – химические процессы, в
результате которых из одних веществ образуются
другие, отличающиеся от них по составу и (или)
строению.
При химических реакциях обязательно происходит
изменение веществ, при котором рвутся старые и
образуются новые связи между атомами.
Признаки химических реакций:
1) Выделяется газ
2) Выпадет осадок
3) Происходит изменение окраски веществ
4) Выделяется или поглощается тепло, свет
3.
КЛАССИФИКАЦИЯ ХИМИЧЕСКИХРЕАКЦИЙ
• По числу и составу реагирующих и
образующихся веществ;
• По направлению (признаку обратимости);
• По признаку изменения степеней окисления
атомов элементов;
• По тепловому эффекту;
• По фазовому составу (агрегатному состоянию
веществ);
• По использованию катализатора;
4.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
1. С + O2 = СO2 + Q
2. СН4 + 2О2= СO2 +2Н2О+Q
3. N2 + O2 = 2NO – Q
4. C2Н6 = С2Н4 + Н2 -Q
5.
1. По тепловому эффекту• Экзотермические протекают с выделением
теплоты
С + O2 = СO2 + Q
СН4 + 2О2= СO2 +2Н2О+Q
• Эндотермическиепротекают с
поглощением теплоты
N2 + O2 = 2NO – Q
C2Н6 = С2Н4 + Н2 –Q
К ним относятся почти все реакции
соединения.
Экзотермические
реакции,
которые
протекают
с
выделением
света, относят к реакциям горения.
К ним относятся почти все реакции
разложения.
6.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
1. N2 + 3H2 ↔ 2NH3
2. CH3COOH + CH3OH ↔ CH3COOCH3 + H2O
3. Ba(NO3)2 + K2SO4 = BaSO4 ↓ + 2KNO3
4. Na2CO3 + 2HCl = 2NaCl + H2O + CO2↑
7.
2. По направлению(по признаку обратимости)
• Обратимые-
• Необратимые-
протекают одновременно в
двух направлениях
N2 + 3H2 ↔ 2NH3
CH3COOH + CH3OH ↔
CH3COOCH3 + H2O
протекают только в одном
направлении
Ba(NO3)2 + K2SO4 = BaSO4 ↓ +
2KNO3
Na2CO3 + 2HCl = 2NaCl + H2O +
CO2↑
Признаки необратимости:
• образование осадка
• выделение газа,
• образование
малодиссоциирующего
вещества (например воды)
8.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
1. Fe(тв) + CuSO4(р-ор) = FeSO4(р-ор) +Cu(тв)
2. CaC2(тв) + 2H2O(ж) = CH = CH(г) + Ca(OH)2(рор)
3. H2(г) + Cl2(г) = 2HCl(г)
4. CH3COOH(р-ор) + NaOH(р-ор) =
CH3COONa(р-ор) + H2O(ж)
9.
3. По фазовому составу (поагрегатному состоянию веществ)
• Гетерогенные реакции
• Гомогенные реакции
протекают в неоднородной
среде, на поверхности
раздела фаз (т-г, т-ж, ж-г)
Fe(тв) + CuSO4(р-ор) =
FeSO4(р-ор) +Cu(тв)
CaC2(тв) + 2H2O(ж) =
CH = CН(г) + Ca(OH)2(р-ор)
протекают между
веществами в однородной
среде, где нет
поверхности раздела фаз
H2(г) + Cl2(г) = 2HCl(г)
CH3COOH(р-ор) +NaOH(р-ор)
= CH3COONa(р-ор)+H2O (ж)
10.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
1. SO3 + H2O = H2SO4
2. HCOOH + CH3OH = HCOOCH3 + H2O
3. Fe + 2HCl = FeCl2 + H2
4. CH4 + 2O2 = CO2 + 2H2O
11.
4. По признаку изменения степенейокисления
• Окислительновосстановительные реакции
реакции, идущие
с изменением степеней окисления
элементов.
0
+1 -1
+2 -1
0
Fe + 2HCl = FeCl2 + H2
-4 +1
0
+4 -2
+1 -2
CH4 + 2O2 = CO2 + 2H2O
К ним относится множество реакций,
в том числе все реакции
замещения, а также те реакции
соединения и разложения, в
которых участвует хотя бы одно
простое вещество:
• Не окислительновосстановительные реакции
реакции, идущие без изменения
степеней окисления элементов.
+6 -2
+1 -2
+1 +6 -2
SO3 + H2O = H2SO4
+1
+2 -2 -2 +1
-2 +1 -2 +1
+1 +2 -2 -2 -2 +1
HCOOH + CH3OH = HCOOCH3 +
+1 -2
H2O
К ним относятся все реакции
ионного обмена , многие
реакции соединения, а также
многие реакции разложения
12.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
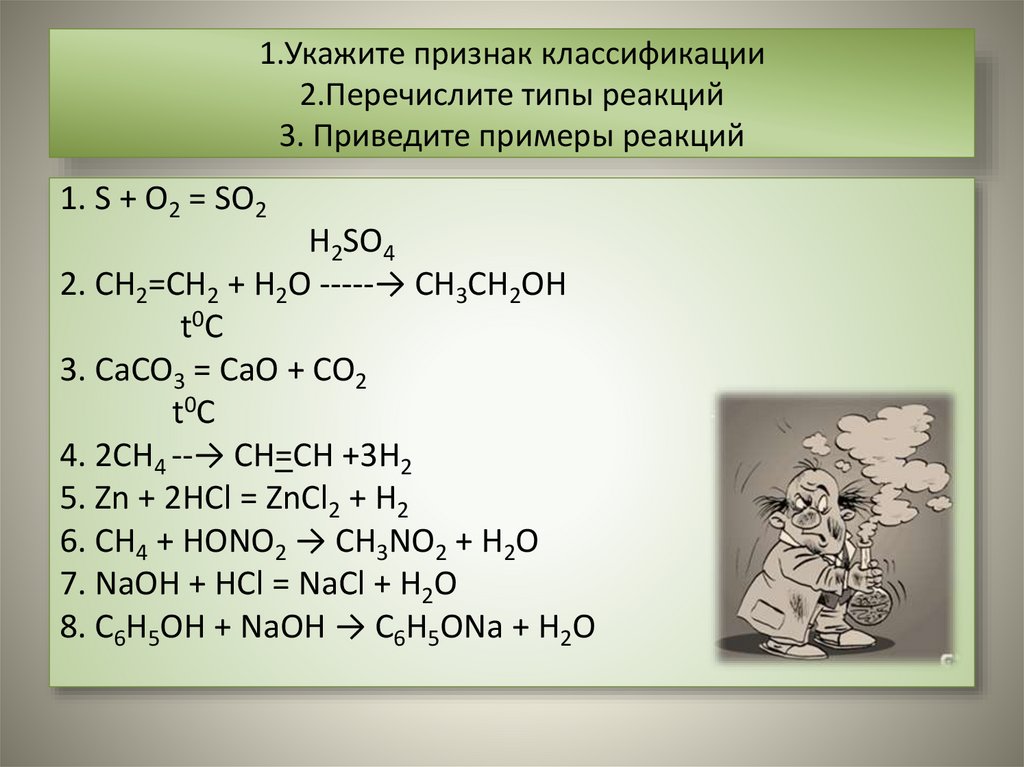
1. S + O2 = SO2
H2SO4
2. CH2=CH2 + H2O -----→ CH3CH2OH
t0C
3. CaCO3 = CaO + CO2
t0C
4. 2CH4 --→ CH=CH +3H2
5. Zn + 2HCl = ZnCl2 + H2
6. CH4 + HONO2 → CH3NO2 + H2O
7. NaOH + HCl = NaCl + H2O
8. C6H5OH + NaOH → C6H5ONa + H2O
13.
5. По числу и составу исходных иконечных веществ
• Реакции соединения
• Реакции замещения
это такие реакции, при которых из двух и
более веществ образуется одно
сложное вещество.
S + O2 = SO2
H2SO4
CH2=CH2 + H2O -----→ CH3CH2OH
это такие реакции, в результате которых
атомы простого вещества замещают
атомы какого-нибудь элемента в
сложном веществе.
• Реакции разложения
• Реакции обмена
это такие реакции, при которых из
одного сложного вещества
образуется несколько новых веществ.
t 0C
CaCO3 = CaO + CO2
t0C
2CH4 --→ CH=CH +3H2
это такие реакции, при которых два
сложных вещества обмениваются
своими составными частями
Zn + 2HCl = ZnCl2 + H2
CH4 + HONO2 → CH3NO2 + H2O
NaOH + HCl = NaCl + H2O
C6H5OH + NaOH → C6H5ONa + H2O
14.
5.*По числу и составу исходных иконечных веществ
• Реакции, идущие без изменения состава
веществ
В неорганической химии к таким реакциям можно
отнести
процессы
получения
аллотропных
модификаций
одного
химического
элемента,
например:
С (графит) <=> С (алмаз)
3О2 (кислород) <=> 2О3 (озон)
Sn (белое олово) <=> Sn (серое олово)
S (ромбическая) <=> S (пластическая)
Р (красный) <=> Р (белый)
15.
1.Укажите признак классификации2.Перечислите типы реакций
3. Приведите примеры реакций
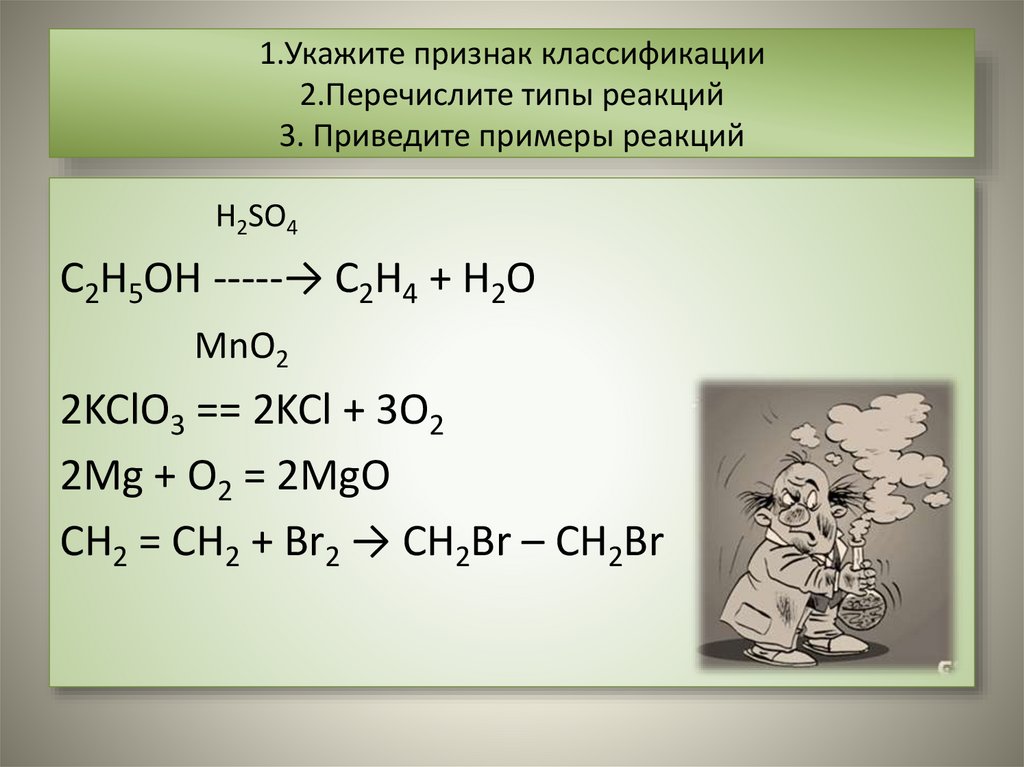
H2SO4
C2H5OH -----→ C2H4 + H2O
MnO2
2KClO3 == 2KCl + 3O2
2Mg + O2 = 2MgO
CH2 = CH2 + Br2 → CH2Br – CH2Br
16.
6. По использованию катализатора• Каталитические –
• Некаталитические –
реакции, идущие с участием
катализатора:
H2SO4
C2H5OH -----→ C2H4 + H2O
MnO2
2KClO3 == 2KCl + 3O2
реакции, идущие без участия
катализатора:
2Mg + O2 = 2MgO
CH2 = CH2 + Br2 →
CH2Br – CH2Br
17.
Самостоятельная работаВАРИАНТ № 1
1. Напишите уравнения реакций, с помощью
которых можно осуществить данные
превращения:
C CH4 CO2 H2CO3 K2CO3 CaCO3
Укажите типы написанных реакций (если
возможно) по следующим признакам
классификации:
• По фазовому составу
• По использованию катализатора
• По направлению
• По тепловому эффекту
• По числу и составу реагирующих и
образующихся веществ;
*Реакции ионного обмена рассмотрите в полном и
сокращенном ионном виде
• По признаку изменения степеней окисления
атомов элементов;
*В ОВР расставьте коэффициенты методом
электронного баланса
ВАРИАНТ №2
1. Напишите уравнения реакций, с помощью
которых можно осуществить данные
превращения:
Mg MgO Mg(OH)2 Mg(NO3)2 Mg3(PO4)2
MgSO4
Укажите типы написанных реакций (если
возможно) по следующим признакам
классификации:
• По фазовому составу
• По использованию катализатора
• По направлению
• По тепловому эффекту
• По числу и составу реагирующих и
образующихся веществ;
*Реакции ионного обмена рассмотрите в
полном и сокращенном ионном виде
• По признаку изменения степеней
окисления атомов элементов;
*В ОВР расставьте коэффициенты методом
электронного баланса
18.
Самостоятельная работаВАРИАНТ №1
2. Напишите уравнения
реакций, с помощью
которых можно
осуществить следующие
превращения:
CaC2 C2H2 C2H6
C2H5Cl C2H5OH C2H4
Для каждой реакции
укажите ее тип
(соединения, разложения,
замещения или обмена)
ВАРИАНТ №2
2. Напишите уравнения
реакций, с помощью
которых можно
осуществить следующие
превращения:
CH4 C2H2 C6H6 C6H5Cl
C6H5OH C6H5ONa
Для каждой реакции укажите
ее тип
(соединения, разложения,
замещения или обмена)
















 Химия
Химия








