Похожие презентации:
476b6b4b393c4a58a7c24e74a07bb2ff
1. АЛКАНЫ
Алка́ны (иначе предельные насыщенныеуглеводороды,
парафины,
алифатические
соединения) — ациклические углеводороды
линейного
или
разветвленного
строения,
содержащие только одинарные связи.
CnH2n+2
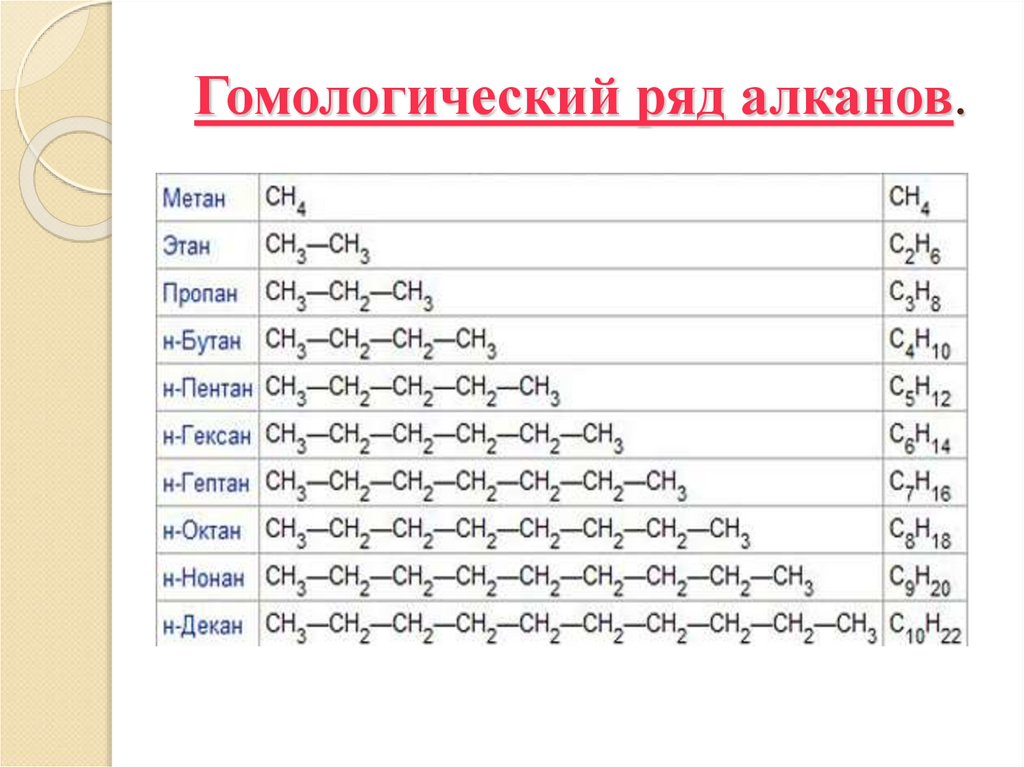
2. Гомологический ряд алканов.
3. Строение алканов.
Алканы являются насыщеннымиуглеводородами и содержат максимально возможное
число атомов водорода.
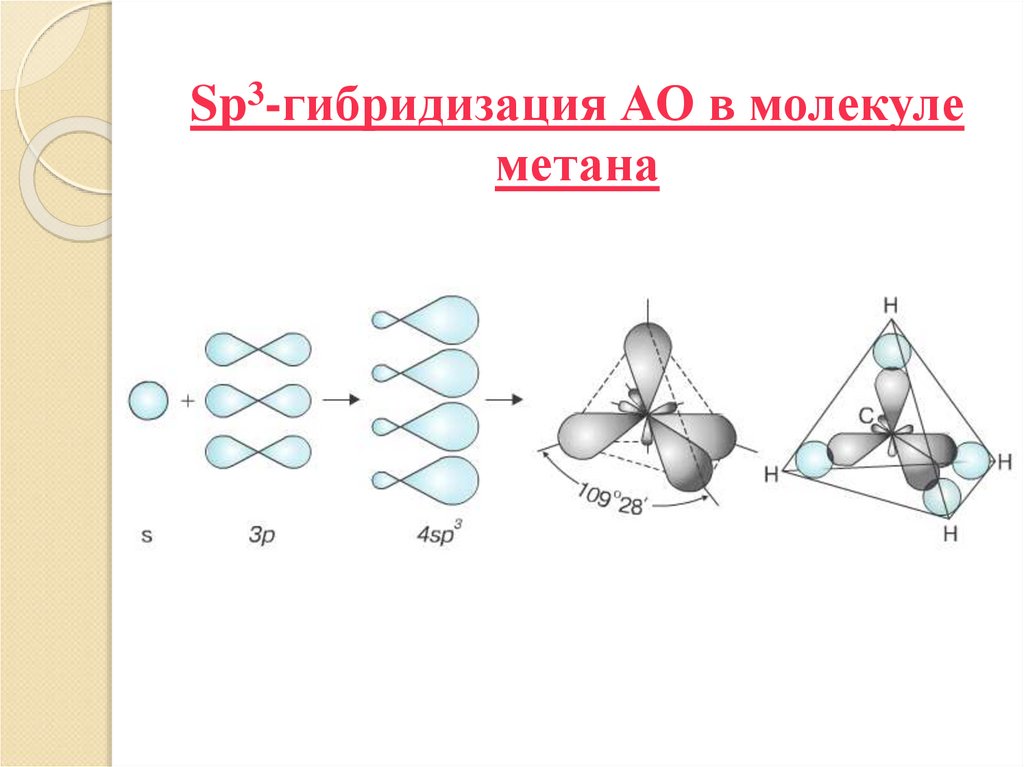
Каждый атом углерода в молекулах алканов
находится в состоянии sp3-гибридизации
Все 4 гибридные орбитали атома С равны по
форме и энергии, 4 электронных облака направлены
в вершины тетраэдра под углами 109°28′
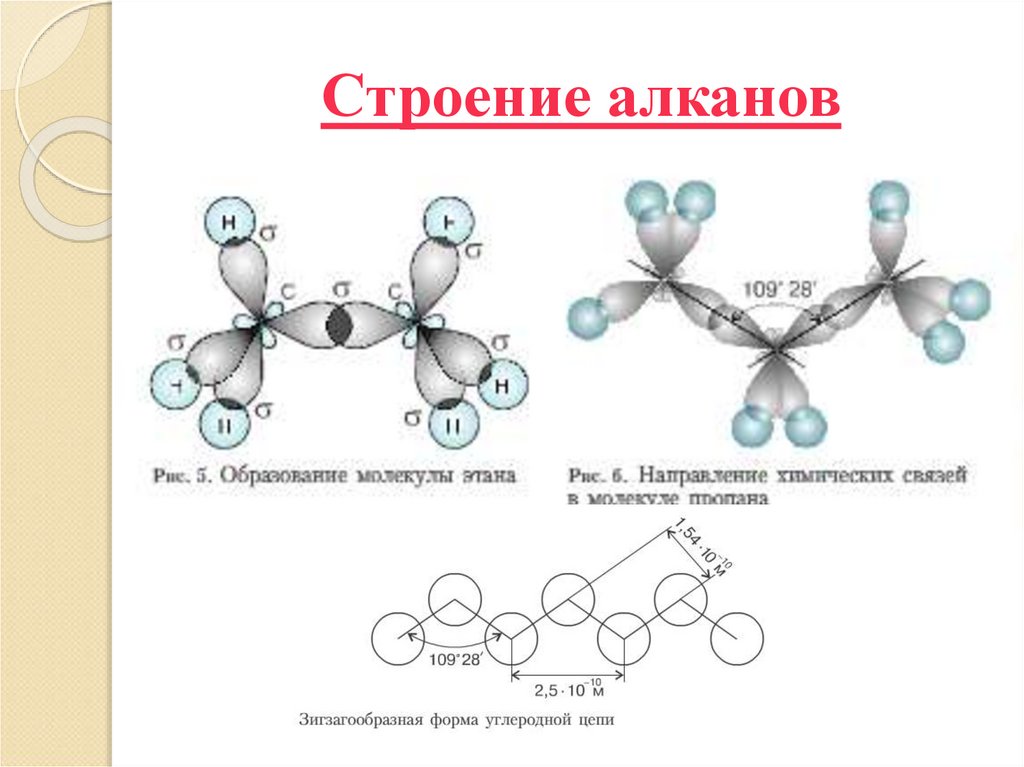
Тип углеродной связи — σ-связи, связи
малополярны и плохо поляризуемы. Длина
углеродной связи — 0,154 нм.
За счёт одинарных связей между атомами С
возможно свободное вращение атомов вокруг этой
связи.
4. Sp3-гибридизация АО в молекуле метана
5. Строение алканов
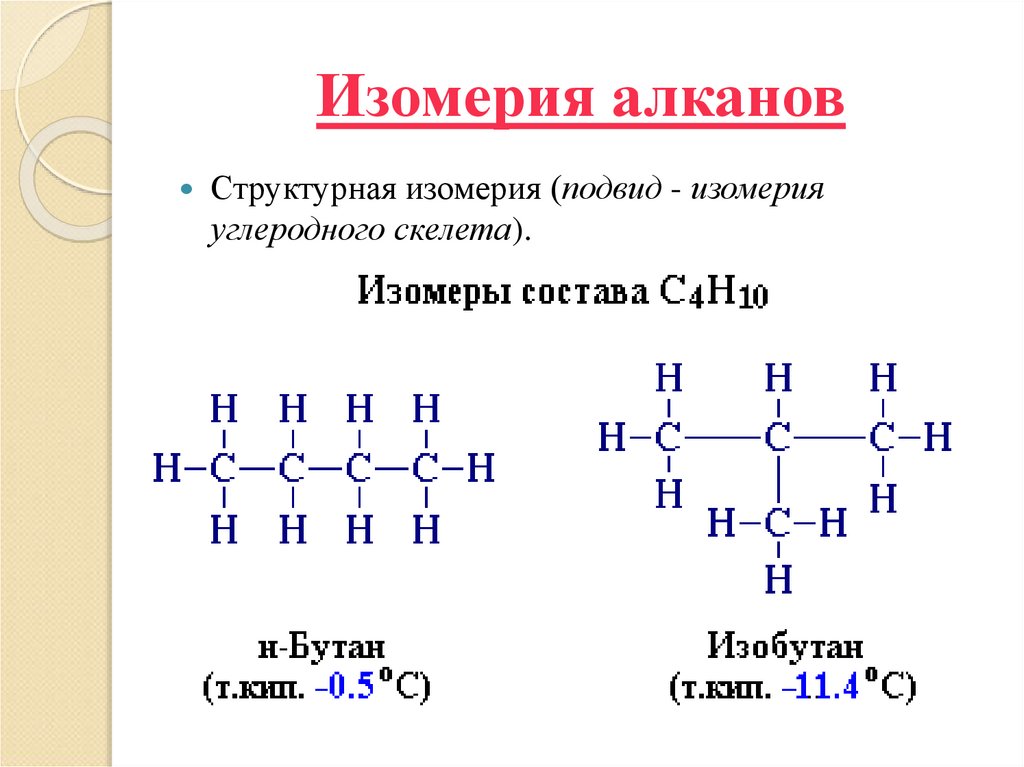
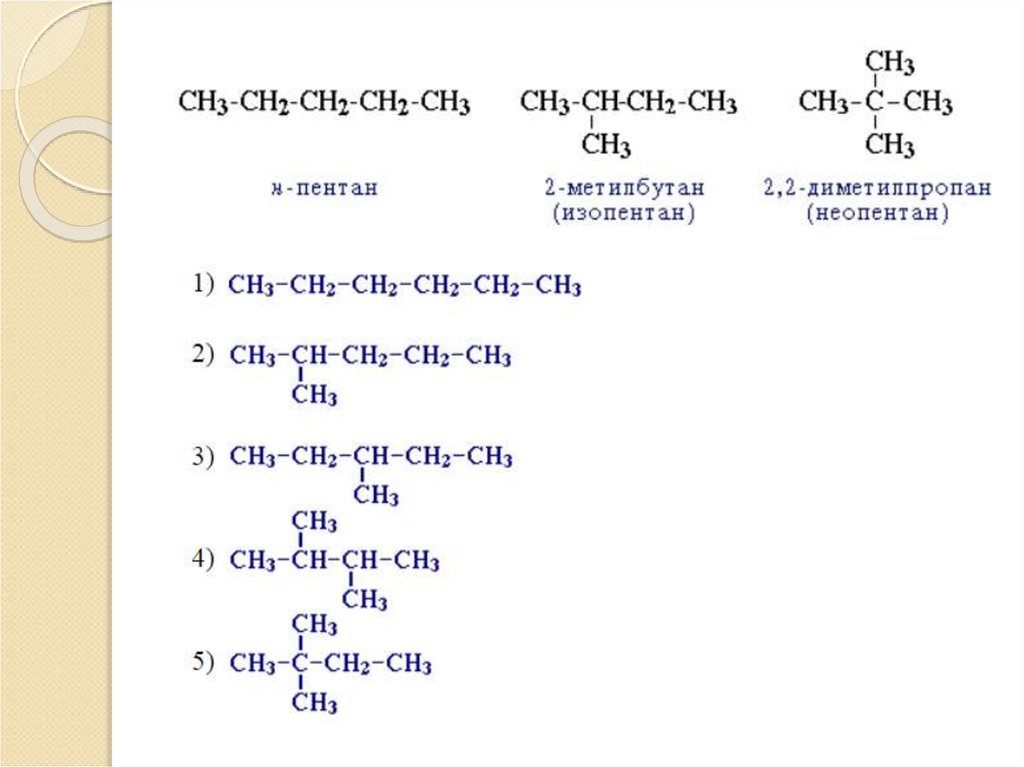
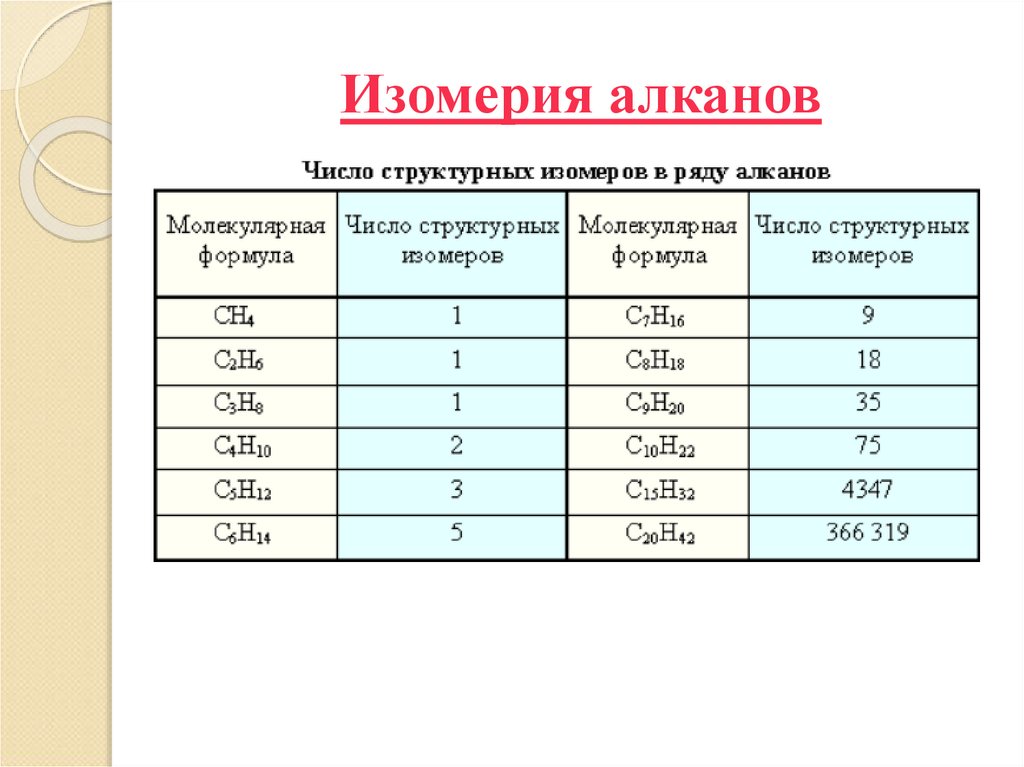
6. Изомерия алканов
Структурная изомерия (подвид - изомерияуглеродного скелета).
7.
8. Изомерия алканов
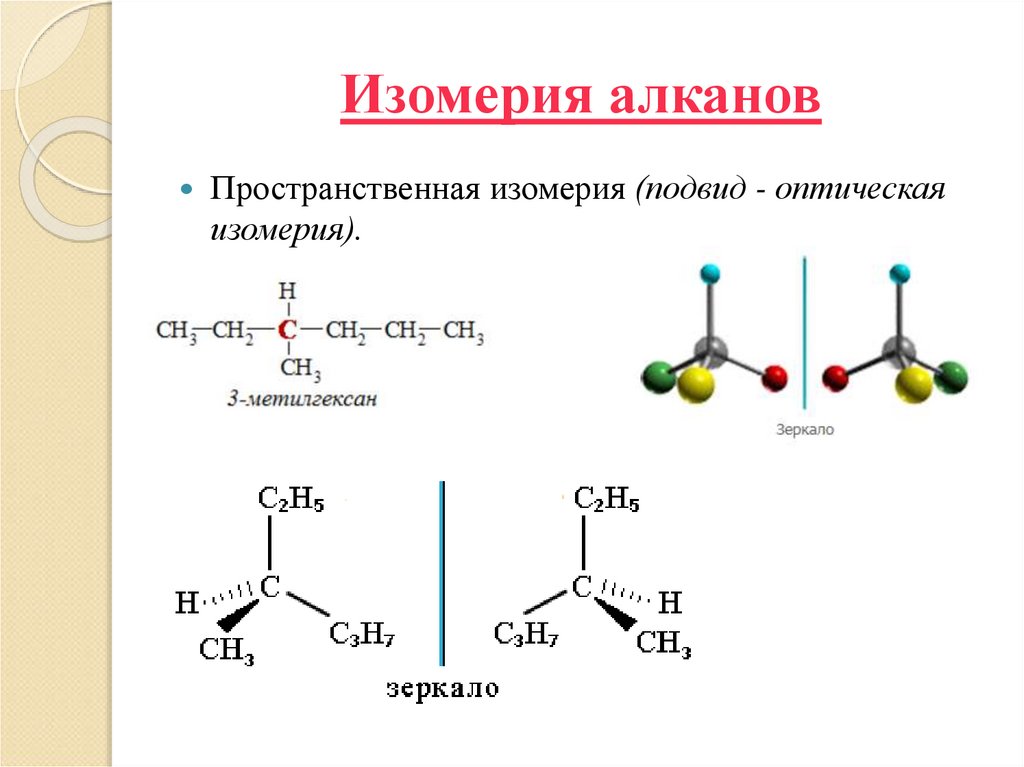
9. Изомерия алканов
Пространственная изомерия (подвид - оптическаяизомерия).
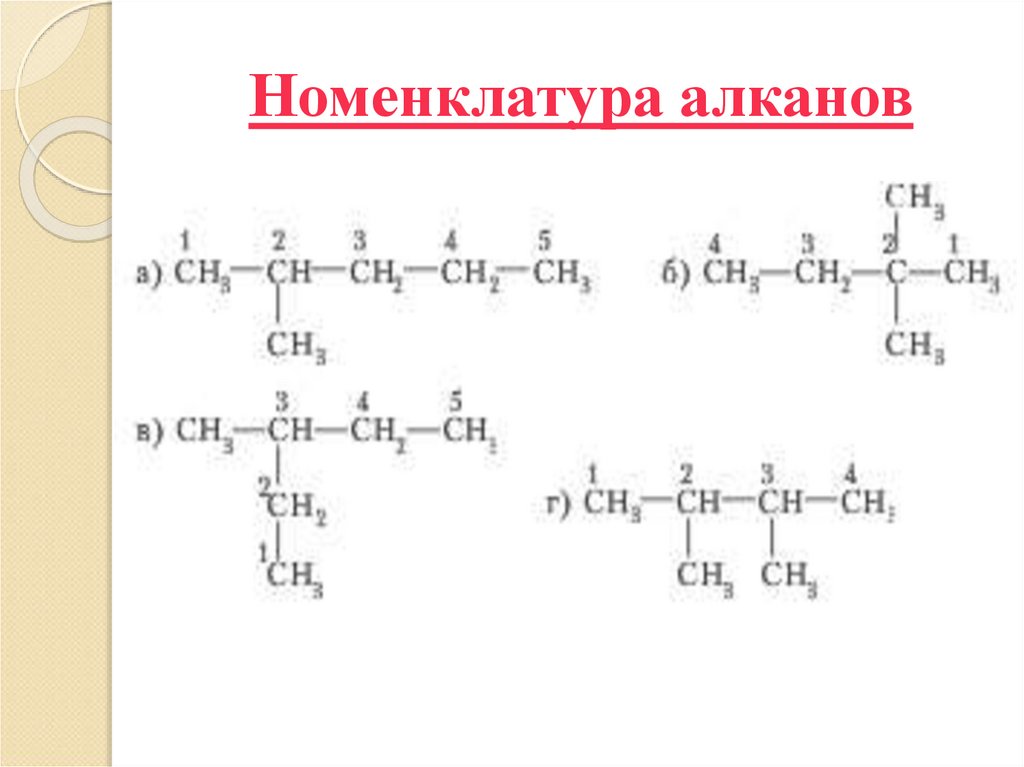
10. Номенклатура алканов
11. Номенклатура алканов
1. н-гексан2. 2-метилпентан
3. 3-метилпентан
4. 2,3-диметилбутан
5. 2,2-диметилбутан
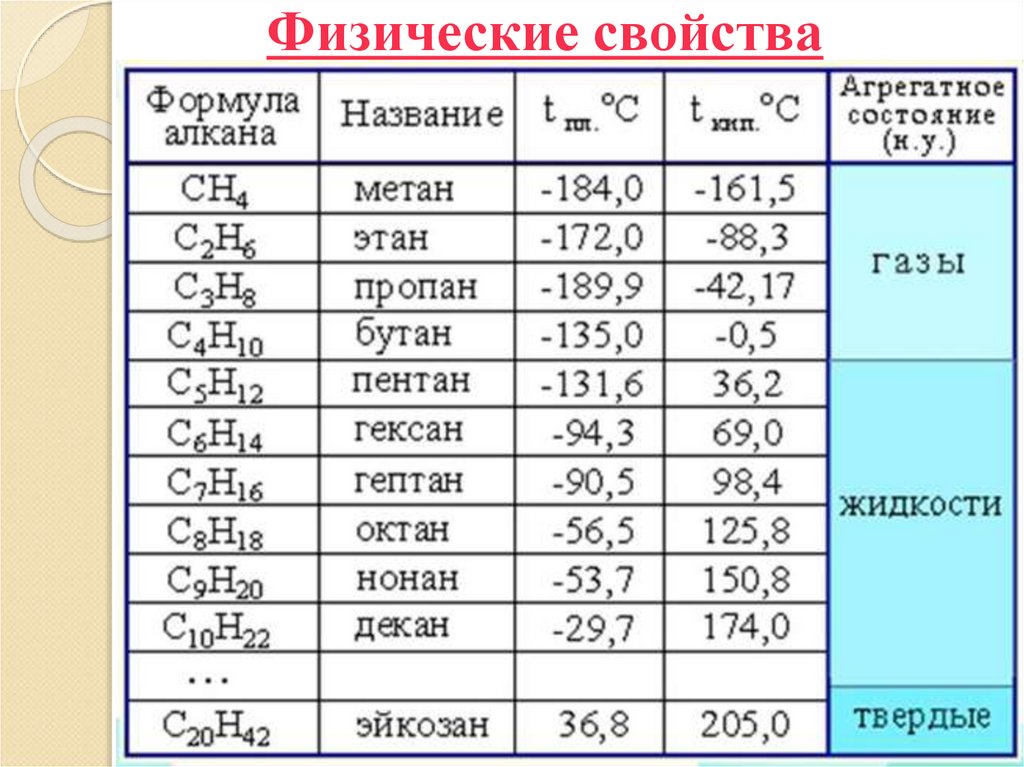
12. Физические свойства
13. Физические свойства
С ростом молекулярной массы и длины главнойуглеродной цепи увеличиваются плотности,
температуры плавления и кипения (рис.10 стр.76)
При нормальных условиях (P =101.325кПа и t =0 ºС)
неразветвлённые алканы с CH4 до C4H10 — газы; с
C5H12 до C13H28 — жидкости; после — твёрдые
вещества (при ст. усл. с С17 твердые).
Температуры плавления и кипения понижаются от
менее разветвленных к более разветвленным.
бесцветны, легче воды и нерастворимы в ней,
хорошо растворяются в органических растворителях
(жидкие алканы сами используются как
растворители), диэлектрики.
Газообразные и твердые алканы не пахнут,
некоторые жидкие алканы обладают характерным
«бензиновым» запахом.
14. Химические свойства
1. Реакции радикального замещенияА) Галогенирование
Галогенирование алканов проходит поэтапно — за один
этап замещается не более одного атома водорода:
CH4 + Cl2→ CH3Cl + HCl (хлорметан)
CH3Cl + Cl2 → CH2Cl2 + HCl (дихлорметан)
CH2Cl2 + Cl2 → CHCl3 + HCl (трихлорметан)
CHCl3 + Cl2 → CCl4 + HCl (тетрахлорметан).
*Такие реакции называют цепными.
За изучение механизма этих реакций русский академик
Н.Н.Семёнов получил Нобелевскую премию (1956).
15.
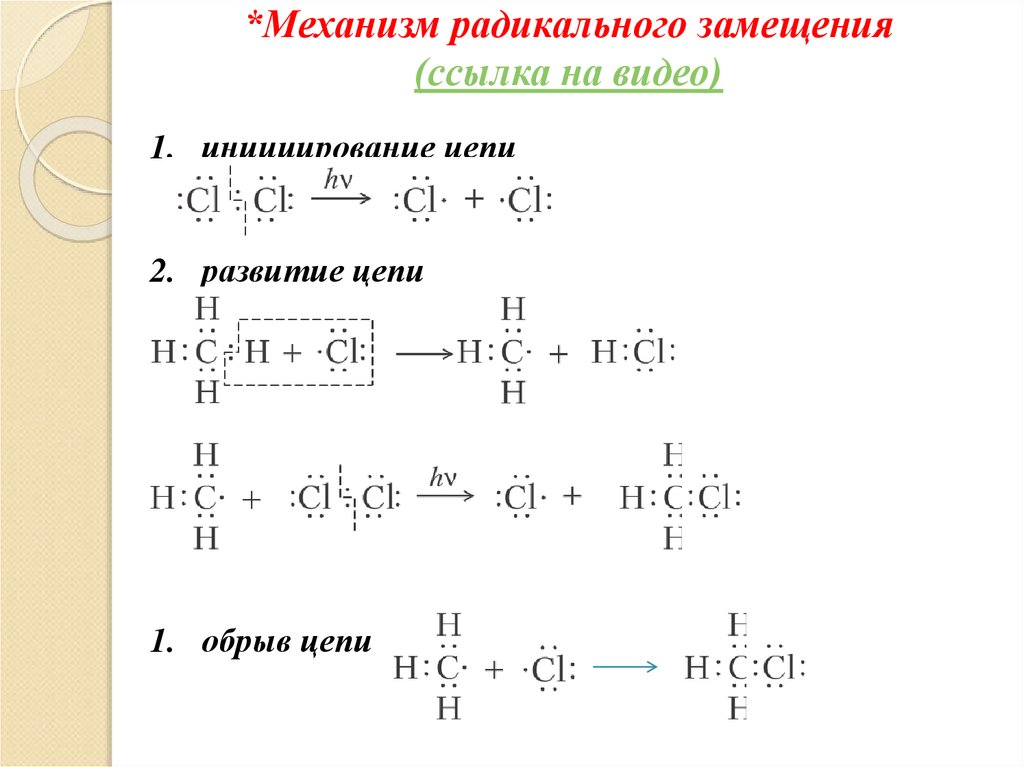
*Механизм радикального замещения1. Под действием света молекула хлора распадается
на радикалы (инициирование цепи);
2. Радикалы хлора атакуют молекулы алкана, забирая
у них атом водорода, в результате этого
образуются метильные радикалы ·СН3, которые
сталкиваются с молекулами хлора, разрушая их и
образуя новые радикалы (развитие цепи);
3. Объединение радикалов в неактивные молекулы
(рекомбинация и обрыв цепи).
*В первую очередь галогенируется наименее
гидрированый атом углерода (третичный атом, затем
вторичный, первичные атомы галогенируются в
последнюю очередь)
*каждая последующая стадия идет легче чем
предыдущая
16.
*Механизм радикального замещения(ссылка на видео)
1. инициирование цепи
2. развитие цепи
1. обрыв цепи
17.
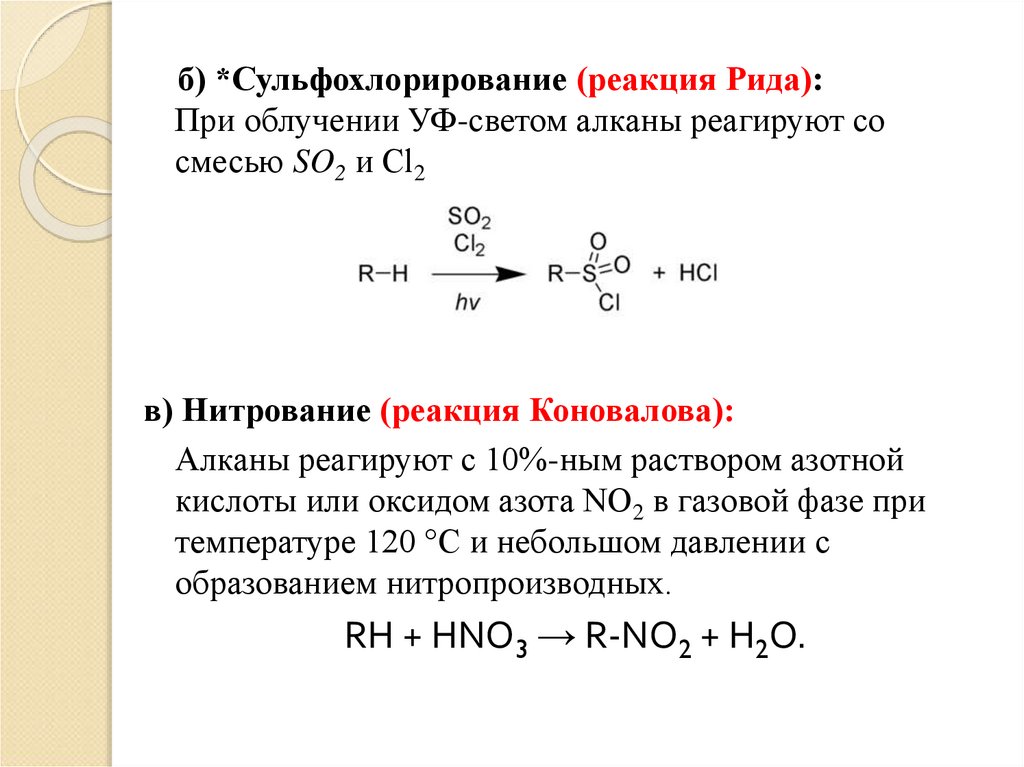
б) *Сульфохлорирование (реакция Рида):При облучении УФ-светом алканы реагируют со
смесью SO2 и Cl2
в) Нитрование (реакция Коновалова):
Алканы реагируют с 10%-ным раствором азотной
кислоты или оксидом азота NO2 в газовой фазе при
температуре 120 °C и небольшом давлении с
образованием нитропроизводных.
RH + HNO3 → R-NO2 + H2O.
18.
2. Реакции окисленияА) Горение (ссылка на видео)
СnН2n+2 + (1,5n + 0,5)O2 → nCO2+ (n +1)H2O
Б) *Каталитическое окисление
При мягком окислении СН4 в присутствии
катализаторов при t от 200 до 500°C и повышенном
давлении могут образоваться:
метиловый спирт: 2СН4 + О2 → 2СН3ОН;
формальдегид: СН4 + О2 → СН2О + Н2O;
муравьиная кислота: 2СН4 + 3О2 → 2НСООН + 2Н2O.
19.
3-4 Дегидрирование и крекингДля метана пиролиз:
◦ CH4 → С + 2H2 (при 1000°C)
◦ 2CH4 → C2H2 + 3H2 (при 1500°C)
Для гомологов метана:
◦ C2H6 → C2H4 + H2 (Pt, Ni, Cr2O3, 400-600°C)
◦ C16H34 → C8H18+ C8H16 (400-500°C)
5. Изомеризация
CH3–CH2–CH2–CH2–CH3
AlCl3 4000
CH3– CH–CH2–CH3
CH3
*С перманганатом калия (KMnO4) и бромной
водой (Br2) алканы не взаимодействуют.
20.
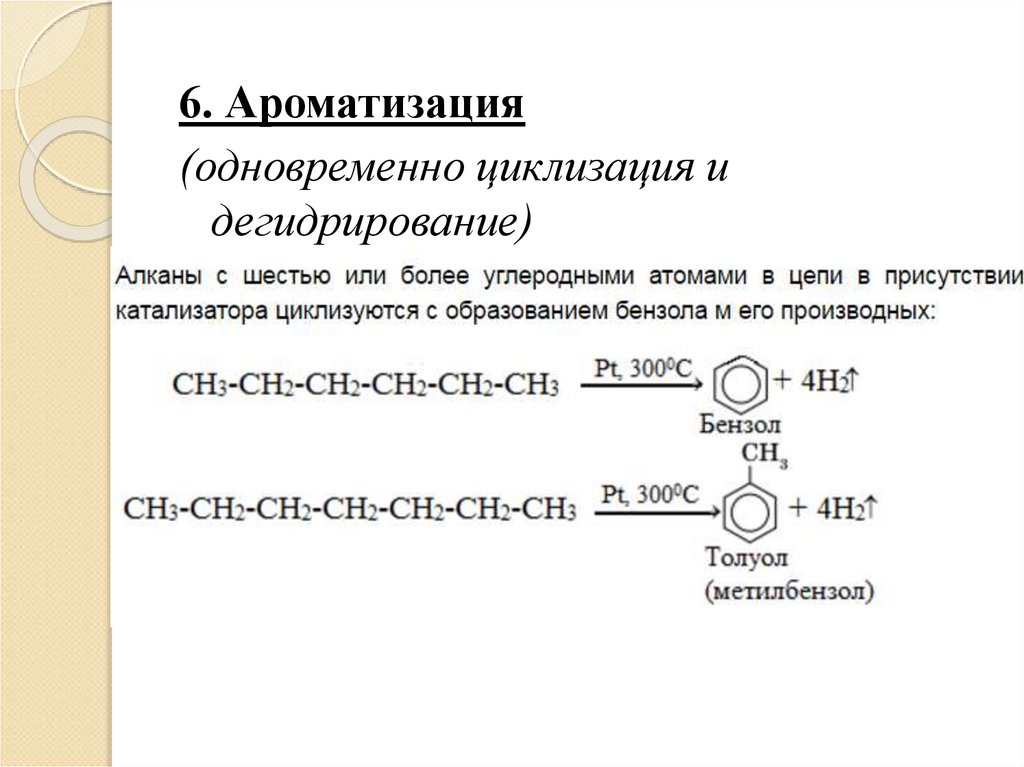
6. Ароматизация(одновременно циклизация и
дегидрирование)
21. Нахождение в природе
Метан– образуется в природе в результате
разложения остатков растений и животных без доступа
воздуха.
Метан, этан, пропан, бутан содержатся в природном
газе и в газах, выделяющихся при добыче нефти.
В составе попутного нефтяного газа обнаруживаются
пары пентана и гексана.
жидкие
и твердые предельные углеводороды
содержатся в нефти и различных видах угля.
А так же …
22. Нахождение в природе
23. Нахождение в природе
феромоновферомонов
24. Нахождение в природе
25. Нахождение в природе
26. Получение в промышленности
1. Из природного сырья (нефть, газ) – перегонка2. Крекинг нефтепродуктов и изомеризация
C16H34 → C8H18 + C8H16
C8H18 → C4H10 + C4H8
C4H10 → C2H6 + C2H4
3. Гидрирование алкенов и алкинов
H2C = CH2 + H2 (Pt, Ni, Pd) → CH3 – CH3
4.*Синтез Фишера-Тропша (смесь CO и Н2 называют
синтез-газом) nCO + (2n+1)H2 → CnH2n+2 + nH2O
*Синтез-газ получают конверсией метана или угля (УХР
см. на стр.74 учебника)
5. *Газификация твердого топлива (при повышенных
температуре и давлении с участием
катализатора Ni) C+2H2 → CH4
27. Получение в лаборатории
6. Реакция Вюрца2R—Br + 2Na → R—R + 2NaBr
2CH3 – CH2Br + 2Na → C4H10 + 2NaBr
Реакция идёт при температуре − 80 °C. При
взаимодействии R и R` возможно образование смеси
продуктов (R—R, R`—R`, R—R`)
7. Гидролиз карбидов
Al4C3 + 12H2O → 3CH4↑ + 4Al(OH)3↓
8. Декарбоксилирование натриевых солей карбоновых
кислот (реакция Дюма)
CH3COONa + NaOH → CH4↑ + Na2CO3
9. Электролиз водных растворов солей карбоновых
кислот (Реакция Кольбе)
2R–COONa + 2H2O → H2 + 2NaOH + 2CO2 + R–R
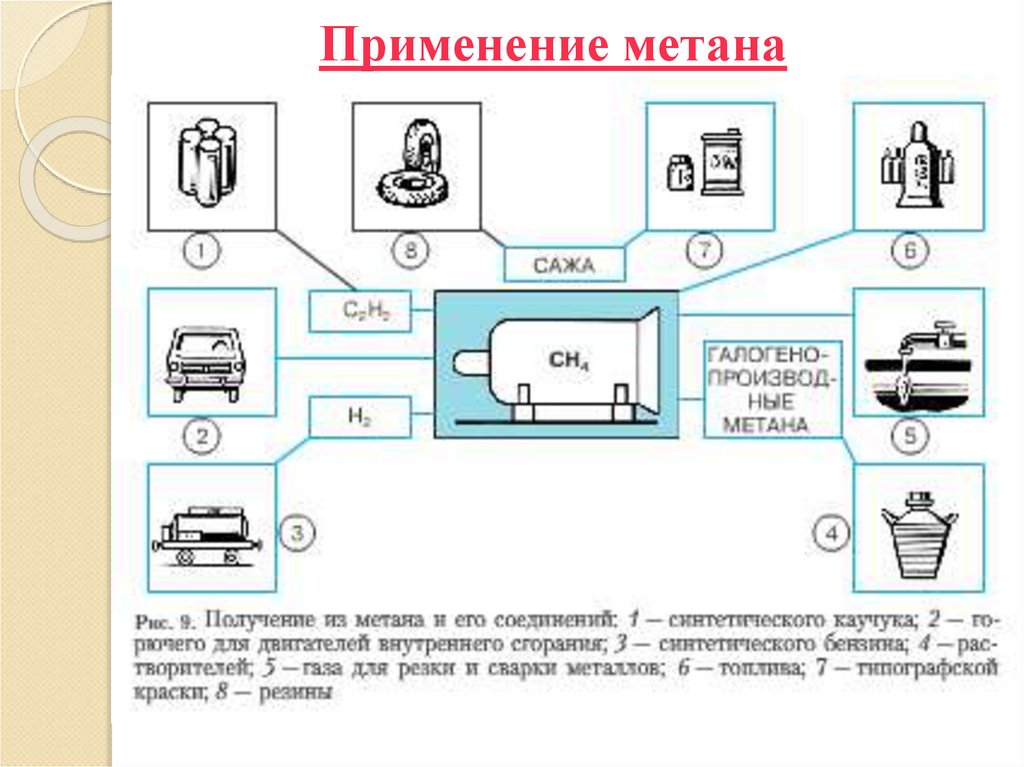
28. Применение метана
29. Применение алканов
30. Применение алканов
31. Домашнее задание
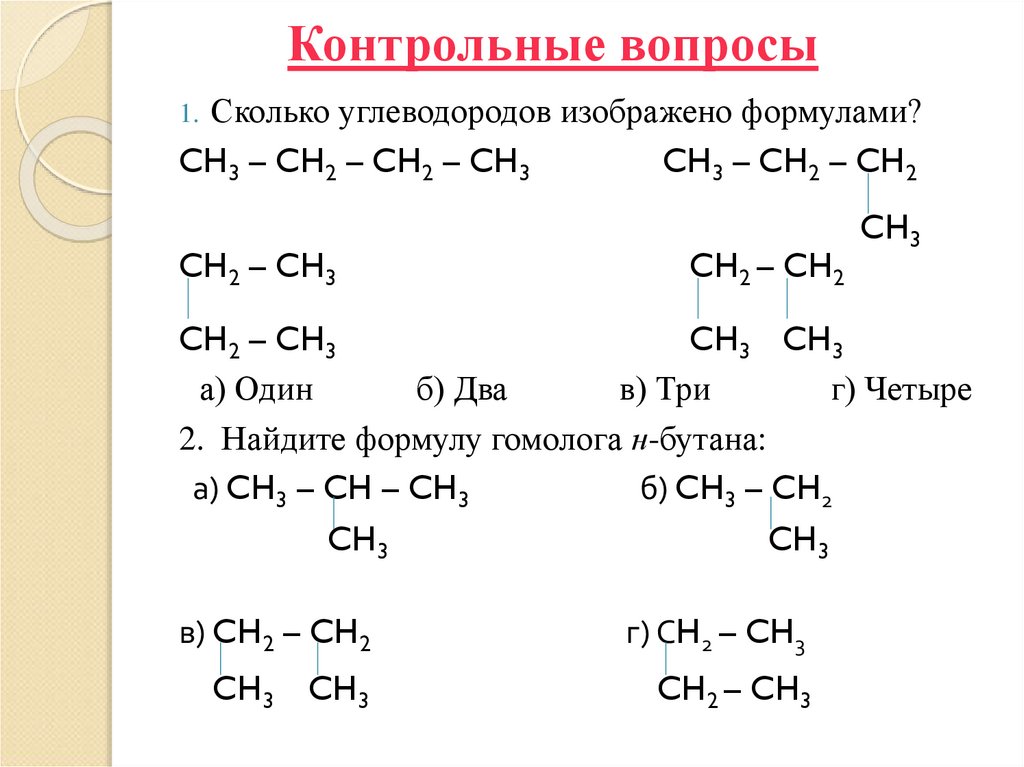
§10 ?3-6 стр.8632. Контрольные вопросы
1. Сколько углеводородов изображено формулами?CH3 – CH2 – CH2 – CH3
CH2 – CH3
CH3 – CH2 – CH2
CH2 – CH2
CH3
CH2 – CH3
CH3 CH3
а) Один
б) Два
в) Три
г) Четыре
2. Найдите формулу гомолога н-бутана:
а) CH3 – CH – CH3
б) CH3 – CH2
CH3
CH3
в) CH2 – CH2
CH3
CH3
г) СH2 – CH3
CH2 – CH3
33. Контрольные вопросы
3. Вставьте в текст пропущенные термины и символы.Алканами называются углеводороды, в молекулах
которых все атомы связаны…связями. Их общая
формула…. Все атомы углерода в алканах находятся
в состоянии … – гибридизации. Оси гибридных
орбиталей направлены к вершинам …, угол между
связями составляет…. Относительно одинарных С
– С связей… свободное вращение.
4. Исключите лишнее вещество:
а) C3H8,
б) C6H12, в) C4H10, г) CH4.
5. Для алканов характерна изомерия:
а) углеродного скелета, б) положение кратной связи,
в) положение функциональной группы,
г) геометрическая.
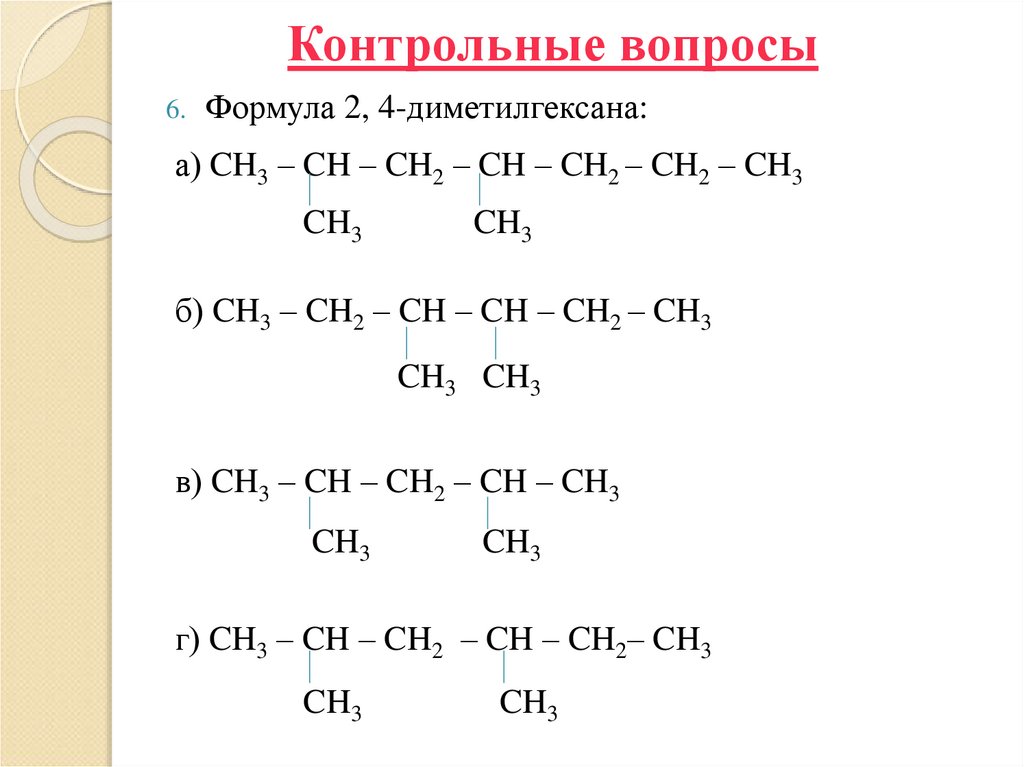
34. Контрольные вопросы
6. Формула 2, 4-диметилгексана:а) CH3 – CH – CH2 – CH – CH2 – CH2 – CH3
CH3
CH3
б) CH3 – CH2 – CH – CH – CH2 – CH3
CH3 CH3
в) CH3 – CH – CH2 – CH – CH3
CH3
CH3
г) CH3 – CH – CH2 – CH – CH2– CH3
CH3
CH3
35. Контрольные вопросы
7. Название углеводорода с формулойCH3 – CH2 – CH2 – CH – CH3:
CH3
а) 4-метилпентан,
б) 2-метилпропан,
в) 3-метилпентан,
г) 2-метилпентан.
8. Углеводороды с формулами C6 H12 и C6H14 являются:
а) изомерами,
б) гомологами,
в) верного ответа в перечисленных нет.
36. Контрольные вопросы
9. Метан в промышленности получают главным образом:а) по реакции Вюрца, б) из природного газа, в) коксованием
каменного угля, г) гидролизом карбида алюминия.
10. Для алканов характерны реакции:
а) присоединение,
б) замещение,
в) полимеризации
11. Какая из реакций алканов протекает при облучении
смеси исходных веществ светом?
а) крекинг, б) дегидрирование, в) хлорирование,
г) горение.
12. Составьте уравнение реакции, при помощи которых
можно осуществить следующие превращения:
C → CH4 → CH3Cl → C2H6 → C2H5Cl
37.
Ответы1.А
2. Б
3.одинарными, алканами, sp3, 109028', тетраэдр
4. Б
5. А
6. Г
7. Г
8. В
9. Б
10. А
11. В
12…






















 Химия
Химия








