Похожие презентации:
Лекція_№15_Алюміній_04f39626_ae5d_462d_9984_2730e8b34e93
1.
Алюміній:загальна характеристика,
властивості , добування,
застосування.
Алюміній оксид, алюміній
гідроксид, їх амфотерність.
2.
Головну підгрупу третьої групи складають типові елементи(Бор і Алюміній), а також елементи підгрупи Галію (Галій,
Індій і Талій).
Атоми елементів головної підгрупи третьої групи на
зовнішньому електронному шарі мають по три електрони.
Для того, щоб мати завершений зовнішній електронний шар,
їм вигідніше віддати три валентні електрони, ніж приєднати
п‘ять.
Тому ці елементи — типові метали, найбільш характерний
ступінь окиснення яких – (+3).
Відновні (металічні) властивості елементів підгрупи
посилюються зі зростанням радіуса атома.
Із цієї закономірності вибивається лише Талій, що пов'язано з
наявністю в нього заповненого електронного f-підрівня
3.
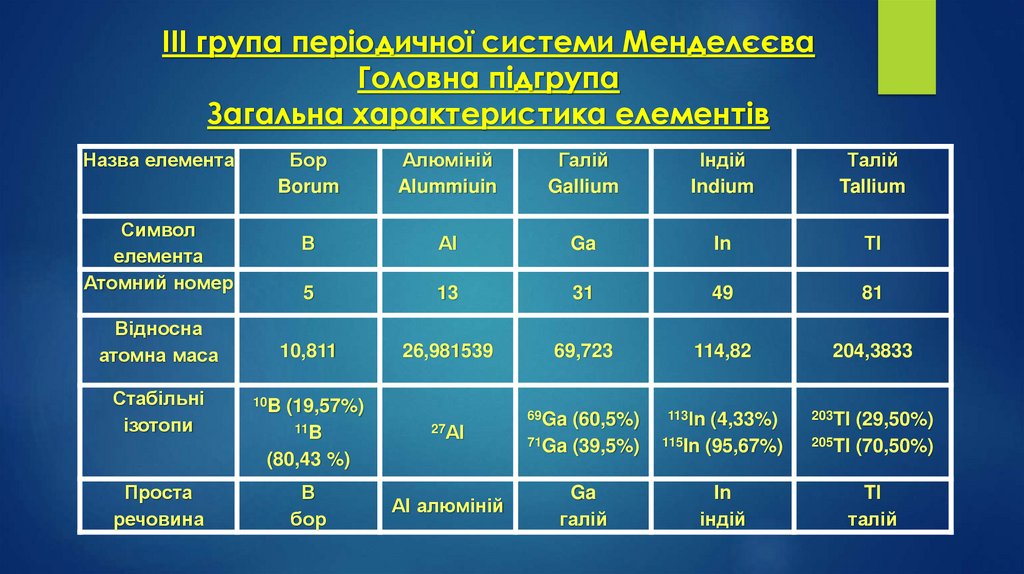
IІІ група періодичної системи МенделєєваГоловна підгрупа
Загальна характеристика елементів
Назва елемента
Символ
елемента
Атомний номер
Відносна
атомна маса
Стабільні
ізотопи
Бор
Borum
Алюміній
Alummiuin
Галій
Gallium
Індій
Indium
Талій
Tallium
В
Аl
Ga
In
Тl
5
13
31
49
81
10,811
26,981539
69,723
114,82
204,3833
69Ga (60,5%)
113Іn (4,33%)
203Tl (29,50%)
71Ga (39,5%)
115In (95,67%)
205Tl (70,50%)
Ga
галій
In
індій
Tl
талій
10B (19,57%)
11B
27Аl
(80,43 %)
Проста
речовина
В
бор
Аl алюміній
4.
Хімічна активність елементів у підгрупі посилюєтьсязверху вниз. У цьому ж напрямку відбувається посилення
металічних властивостей. Це пов'язане зі збільшенням атомного
радіуса й ослабленням притягання зовнішніх валентних електронів
до ядра.
Бор — елемент-неметал, однак ознаки його неметалічності значно
ослаблені. Він утворює сполуки як. кислотного, так і основного
характеру з перевагою останніх.
Схильний до комплексоутворення, причому типовими для Бору є
аніонні комплекси.
Алюміній — амфортерний метал, хімічна активність якого у
звичайних умовах знижується в результаті пасивування —
утворення захисної оксидної плівки А12О3.
Сполуки Алюмінію, що містять Оксиген (оксиди й гідроксиди),
рівною мірою характеризуються основними й кислотними
властивостями, тобто є амфотерними.
5.
Положення Алюмінію в періодичній системі,будова його атома
Алюміній розташований у IIIA групі. На
зовнішньому енергетичному рівні атом
Алюмінію містить три електрони, він може лише
віддавати електрони, тому стабільний ступінь
окиснення Алюмінію у сполуках — (+3).
Аналізуючи інші елементи IIIA групи, можна
визначити напівметалічність Бору, металічні
властивості Галію, що дозволяє припустити
проміжні (від металічних до неметалічних)
властивості Алюмінію та амфотерність його
сполук.
6.
Фізичні властивості алюмінію:Алюміній — парамагнітний сріблясто-білий метал;
Парамагне́тики (англ. paramagnets, paramagnetic
materials, ) — речовини з невеликою
позитивною магнітною сприйнятливістю, які у
зовнішньому магнітному полі намагнічуються
вздовж поля і дещо підсилюють його.
ковкий, легко витягується в дріт, добре піддається
формовці й утворює фольгу;
tпл. = 660 °С, tкип. = 2520 °С;
належить до групи легких металів, густина
2,7 г/см3;
виявляє високу тепло- й електропровідність (65 %
від електропровідності міді), а також високу
світловідбивну здатність.
Алюміній
7.
Поширеність у природіАлюміній є найпоширенішим металічним
елементом на Землі. Його вміст у земній корі становить 8 % (за
масою) — це перше місце серед металічних елементів і третє
серед усіх елементів.
Через високу хімічну активність у вигляді простої речовини
Алюміній у природі не трапляється.
Він міститься у складі багатьох сполук, які
утворюють ґрунти, — глиноземів (Al2O3) і бокситів (Αl2Ο3 • xΗ2Ο)
Алюмосиліка́ти (від алюміній і силікат) —
становлять основну масу земної кори. Їх можна розглядати як
солі, утворені оксидами Алюмінію,Силіцію, лужних та
лужноземельних металів. При вивітрювання багатьох
алюмосилікатів утворюється глина. До них належать:
Польовий шпат : K2O•Al2O3•6SiO2
Каолініт : Al2O3•2SiO2•2H2O
Слюда : K2O•3Al2O3•6SiO2•2H2O
Нефелін ( Na,K)2 [Al2Si2O8]
8.
Природні сполуки АлюмініюТакож Алюміній є у складі багатьох мінералів, зокрема
коштовного каміння .Різне забарвлення цих мінералів зумовлене
невеликими домішками оксидів певних металічних елементів (у
рубінів — Cr, у сапфірів —Ti та Fe тощо). Мінерал складу Al2O3,
має високу твердість.
Каолініт,його дрібнозерниста різновидність, містить велику
кількість домішок – наждак, застосовуєтья як абразивний
матеріал.
Корунд має коштовні різновиди:
• червоний рубін(містить домішку хром (ІІІ) оксиду)
• синій сапфір( містить домішки оксидів Феруму,
Титану,Кобальту)
Польовий шпат
Рубін
Смара́гд
Be3Al2Si6O18
Сапфір
9.
Незважаючи на поширеність у природі,Алюміній не міститься в живих організмах і не
бере участі в метаболізмі.
В Україні є великі поклади алюмінієвої руди у
вигляді бокситів і глинозему в Приазов'ї, на
Закарпатті та в межах Українського
кристалічного щита — тектонічної смуги, яка
простягається вздовж середньої течії Дніпра
на відстань понад 1000 км і завширшки 250 км
Боксит
Кріоліт
Нефелін
10.
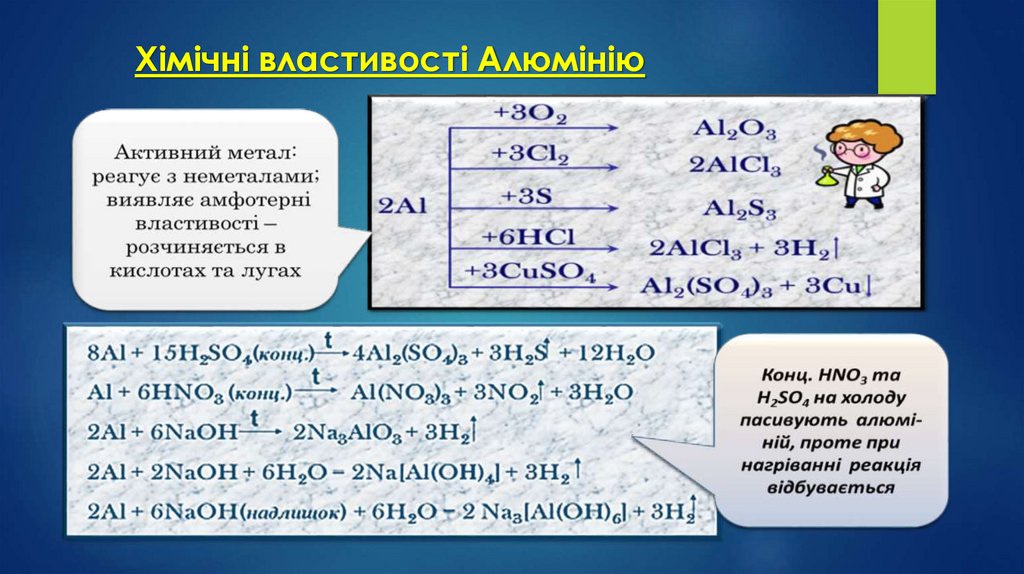
Хімічні властивості АлюмініюАлюміній належить до активних елементів — у ряді напруг він
займає місце після лужноземельних металів.
Відновні властивості алюмінію виражені досить сильно.
Амфотерний.
Безпосередньо алюміній не взаємодіє з водою й неметалами,
оскільки на повітрі він пасивується. Утворена плівка оксиду
алюмінію дуже міцна, хоча має товщину всього 2-3 нм.
Після видалення плівки алюміній активно реагує з водою,
витісняючи водень:
2Аl + Н2О = 2Аl(ОН)3↓ + Н2↑
На повітрі порошок алюмінію горить.
Окиснювання ілюструється наступною реакцією:
4Аl + 3О2 = 2Аl2О3 + Q
Утворення Аl2О3 супроводжується виділенням великої
кількості енергії
11.
Хімічні властивості Алюмінію12.
Хімічні властивості АлюмініюПорошкоподібний алюміній активно взаємодіє
галогенами за звичайних умов, а із сіркою, фосфором та іншими неметалами —
за нагрівання.
Наприклад, із йодом реакція відбувається за кімнатної
температури, але за наявності каталітичної кількості води . Під час
взаємодії алюмінію з йодом виділяється велика кількість теплоти,
під дією якої йод частково сублімує, утворюючи хмару випарів йоду
фіолетового кольору .
2Al + 3І2 = 2AlІ3
Алюміній — активний метал, тому витісняє інші метали з їхніх сполук, зокрема з
оксидів. Ці реакції використовують для одержання деяких металів
алюмотермічним способом:
3MnO2 + 4Al = 3Mn + 2Al2O3
Взаємодія з кислотами.
Як і всі активні метали, алюміній витісняє водень із розбавлених розчинів кислот:
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al + 3H2SO4(poзб.) = Al2(SO4)3 + 3H2↑
13.
Хімічні властивості АлюмініюРозчинення алюмінію в сульфатній кислоті відбувається набагато
складніше, ніж у хлоридній.
Так, холодна H2SO4 пасивує алюміній, розведена вступає з ним у
реакцію відповідно до рівняння, наведеного вище, а концентрована
H2SO4 відновлюється до SO2:
2Аl + 6H2SO4 = Al2(SO4)3 + 3SO2↑ + 6H2O
З нітратною кислотою різних концентрацій алюміній
реагує по-різному.
Дуже розбавлена HNO3 не розчиняє алюміній.
З розведеною HNO3 алюміній взаємодіє з утворенням NО.
З концентрованою HNO3 реакція йде тільки при нагріванні з
виділенням NО2:
Аl + 4HNO3(дуже розб.) →
Al + 4HNO3(розб.) = Al(NO3)3 + NO↑ + 2Н2О
Al + 6HNO3(конц.) = Al(NO3)3 + 3NO2↑ + 3H2O
14.
Алюміній оксид Al2O3Біла тугоплавка речовина, нерозчинна у воді, tпл = 2050 °C.
У природі А12О3 зустрічається у вигляді мінералу корунду,
забарвлені кристали якого є дорогоцінними каменями (сапфір,
рубін).
За хімічними властивостями він належить до амфотерних
оксидів:
з кислотами реагує як основний оксид, у реакціях з лугами
виявляє властивості кислотних оксидів:
Al2O3+6HCl = 2AlCl3+3H2O;
Al2O3+6NaOH+3H2O = 2Na3[Al(OH)6].
При сплавлянні алюміній оксиду з основним оксидом або лугом
утворюються алюмінати відповідного металічного елемента і
вода.
Al2O3+CaO = Ca(AlO2)2;
Al2O3+2NaOH = 2NaAlO2+H2O.
15.
Алюмінієвмісні мінерали:а — берил; б — аквамарин;
в — рубін;
г — сапфір;
д — смарагд; е — корунд;
є — топаз
16.
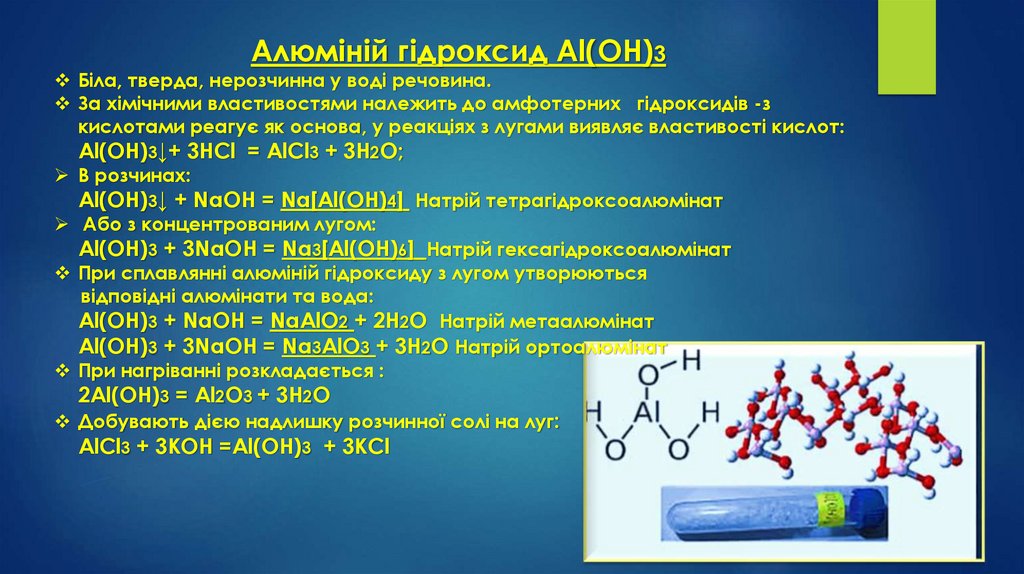
Алюміній гідроксид Al(OН)3Біла, тверда, нерозчинна у воді речовина.
За хімічними властивостями належить до амфотерних гідроксидів -з
кислотами реагує як основа, у реакціях з лугами виявляє властивості кислот:
Аl(ОН)3↓+ 3НСl = АlСl3 + 3Н2О;
В розчинах:
Аl(ОН)3↓ + NaOН = Na[Al(OH)4] Натрій тетрагідроксоалюмінат
Або з концентрованим лугом:
Аl(ОН)3 + 3NaOН = Na3[Al(OH)6] Натрій гексагідроксоалюмінат
При сплавлянні алюміній гідроксиду з лугом утворюються
відповідні алюмінати та вода:
Аl(ОН)3 + NaOH = NaAlО2 + 2Н2О Натрій метаалюмінат
Аl(ОН)3 + 3NaOH = Na3AlО3 + 3Н2О Натрій ортоалюмінат
При нагріванні розкладається :
2Аl(ОН)3 = Аl2О3 + 3Н2О
Добувають дією надлишку розчинної солі на луг:
АlСl3 + 3KOH =Аl(ОН)3 + 3KCl
17.
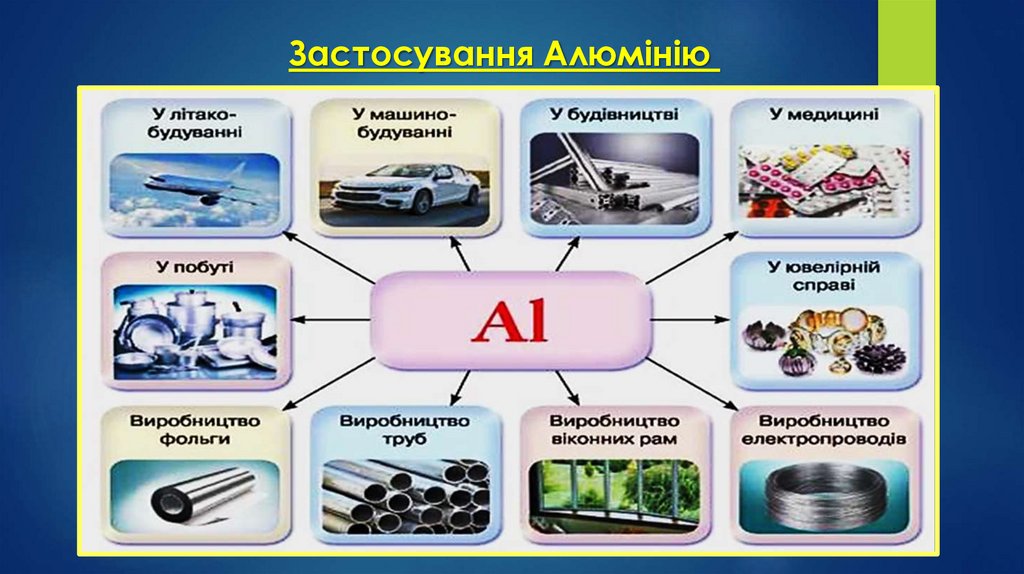
Застосування АлюмініюУ металургії для одержання інших менш активних металів методом
алюмотермії.
Алюміній є цінним конструкційним матеріалом.
Авіаційна промисловість - дюралюмінієм обшивають корпуси літаків
Пилоподібний алюміній та деякі його сполуки використовують як
тверде ракетне пальне.
З алюмінію виготовляють столові прибори, посуд, бляшанки, кухонні
гаджети
Через свою високу відбивну здатність та легкість напилення алюміній
є ідеальним матеріалом для виготовлення дзеркал.
Суміш алюмінію з ферум(ІІІ) оксидом — терміт — використовують
для зварювання залізничних рейок та труб.
18.
Застосування Алюмінію19.
1. Суміш порошків алюмінію й міді масою 20 г обробилирозбавленим розчином сульфатної кислоти. Під час
реакції виділився водень об'ємом 6,72 л (н. у.). Обчисліть
масові частки металів у суміші.
2. Обчисліть масу бокситу AI2О3 • 3Н2О, що містить 20 %
домішок, яка необхідна для одержання алюмінію масою
10,8 кг.
3. Обчисліть масу алюмінію, яку можна добути з
алюміній оксиду масою 51 кг. Вихід продукту реакції від
теоретично можливого становить 95 %.
20.
Список необхідної літературиОсновна:
1.Попель П. П. Хімія: підруч. Для 11 кл. Закладів загальної
середньої освіти (рівень стандарту) П. П. Попель, Л. С. Крикля.
— Київ: ВЦ «академія», 2018.
2. Чернобельська Г.М., Чертков И.Н. Хімія – М.: Медицина, 1993.
3.Сухан В.В., Табунська Т.В., Хімія (посібник для вступників до
вузів) – К.: Либідь 1993.
3.Електронний підручник з хімії:
https://sites.Google.Com/view/allhemi/ №42, тест.
Тести:
https://naurok.com.ua/test/start/2726972
https://naurok.com.ua/test/start/2130950
Додаткова:
1. Луцевич Д.Д., Березан О.В. Конспект – довідник з хімії. – К.: Вища школа 1997.
2. Ярошенко О.Г., Новицька В.І. Збірник задач і вправ з хімії. – К.: Станіца 1996.
3. Буринська Н.М. Основи загальної хімії. 11 клас. 1997.
















 Химия
Химия








