Похожие презентации:
Галогены (солеобразующие)
1. Галогены (солеобразующие)
2.
• Общая характеристика галогеновГалогены – это естественная группа
элементов,
расположенных в главной
подгруппе 7 группы.
Фтор (F), хлор(Cl), бром (Br), йод (I), астат
(At)
Галогены имеют степень окисления
+1,+3,+5,+7, -1
У фтора только -1
В природе наиболее распространён- хлор.
Астат получен искусственным путём.
3.
Строение атомовF
+9
CI
2
7
2
8
2
8 18 7
+17
Br
7
1) Увеличиваются заряды
атомных ядер
2) Увеличивается число
энергетических уровней
3) Увеличивается радиус
атома,сродство к электрону
уменьшается
4) Число электронов на внешнем
уровне постоянно
+35
I
+53
2
8
18 18 7
Неметаллические-окислительные
свойства ослабевают,
металлические -восстановительные
усиливаются !!!
4.
Электронные формулыF
1S22S22P5
2
S
CI
1S22S22P63S23P5
Br …4S24P5
I
P
5
…5S25P5
Вывод: галогены - р - элементы
На внешнем энергетическом
уровне 7 электронов, один из них
неспаренный .
5.
FCl
Br
Увеличение
окислительных
свойств
I
Увеличение радиуса атома
Увеличение
восстановительных свойств
6.
Br2Простые
вещества
F2
I2
CI2
7.
?Химическая связь
.. ..
.. ..
.
.
:Г
+
Г:
→
:Г(:)
Г:
.. ..
.. ..
КН
Кристаллическая
решетка
молекулярная
8.
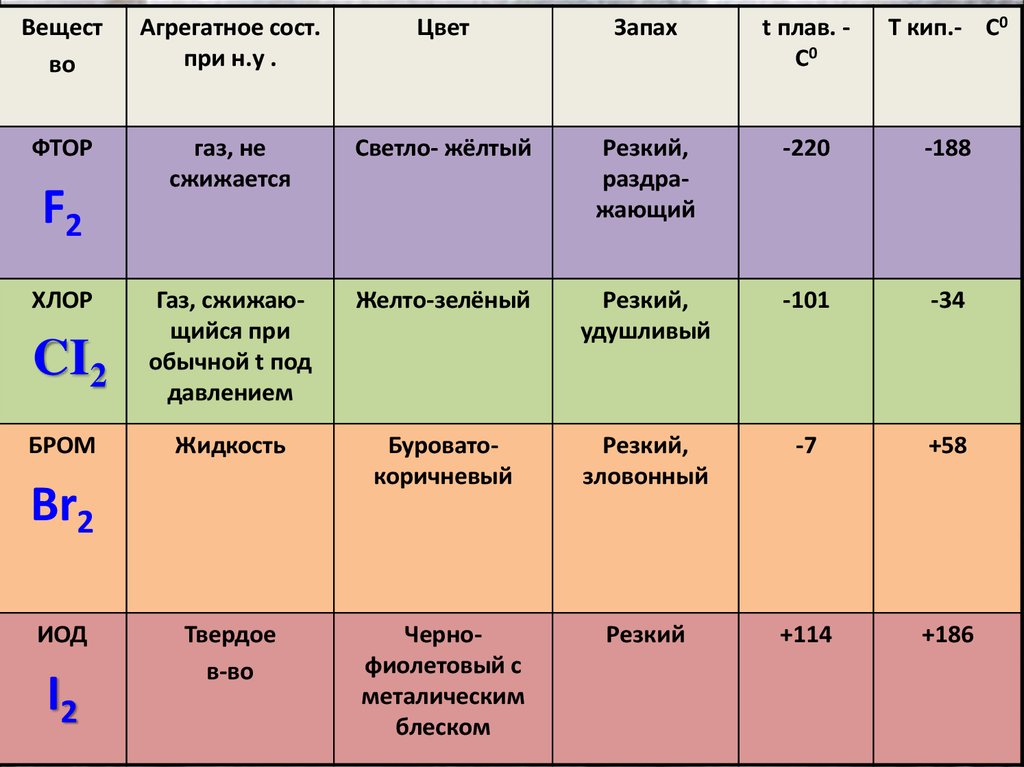
Вещество
Агрегатное сост.
при н.у .
Цвет
Запах
t плав. C0
T кип.- C0
ФТОР
газ, не
сжижается
Cветло- жёлтый
Резкий,
раздражающий
-220
-188
Желто-зелёный
Резкий,
удушливый
-101
-34
CI2
Газ, сжижающийся при
обычной t под
давлением
БРОМ
Жидкость
Буроватокоричневый
Резкий,
зловонный
-7
+58
Твердое
в-во
Чернофиолетовый с
металическим
блеском
Резкий
+114
+186
F2
ХЛОР
Br2
ИОД
I2
9.
Химические свойства галогенов1.Взаимодействие с металлами
+1
-1
2 Na0 + CI20 = 2 NaCI
CI20 окислитель
Получаются соли:
фториды,хлориды,бромиды,иодиды.
10.
2.Взаимодействие с водородом+1 -1
Н20 + Г20 = 2Н Г
+1 -1
Н20 + F20 = 2Н F + Q
Н20 + CI20 = 2Н CI + Q
Н20 + Br20 = 2НBr
Н20 + I20 = 2Н I - Q
11.
3.Взаимодействие с водойCI2 + H2O = HCI + HCIO
Соляная
кислота
Хлорноватистая
кислота
2F2 + 2Н2 О = 4НF + О2
плавиковая кислота
12.
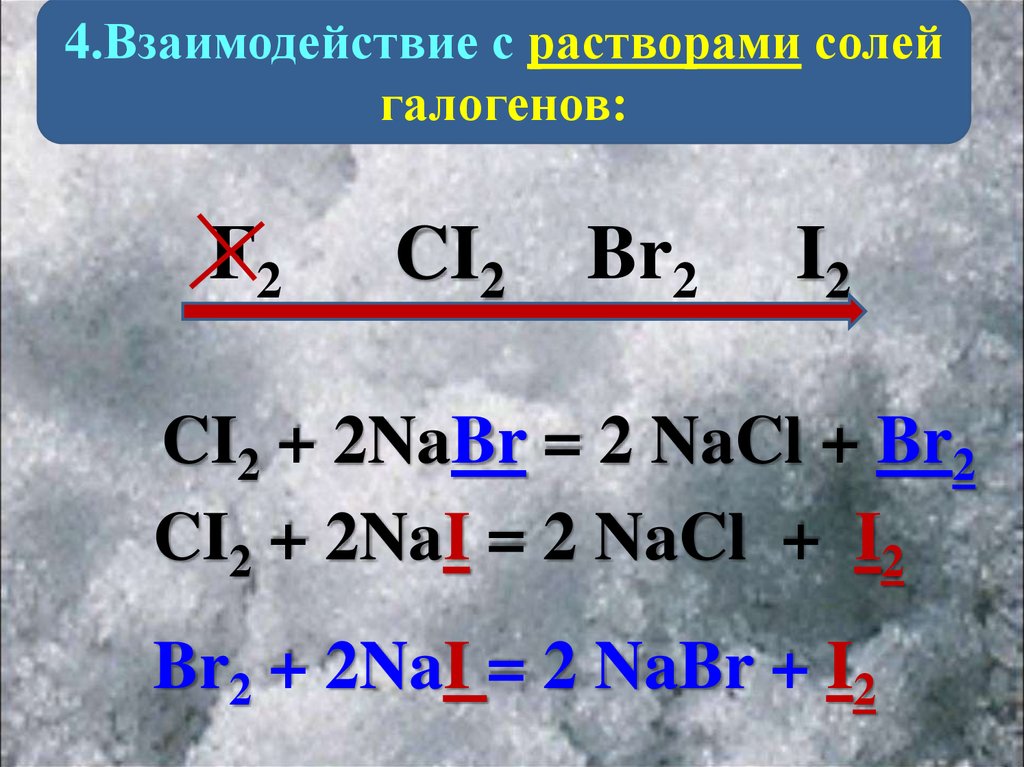
4.Взаимодействие с растворами солейгалогенов:
F2
CI2
Br2
I2
CI2 + 2NaBr = 2 NaCl + Br2
CI2 + 2NaI = 2 NaCl + I2
Br2 + 2NaI = 2 NaBr + I2
13.
ПолучениеВ лаборатории*
+4
-1
+2
0
МnO2 + 4HCI = MnCI2 + CI2 + 2H2O
Mn+4 + 2e → Mn+2 окислитель
восстанавливается
(О.В.)
2CI-1 – 2e → CI20 восстановитель,
окисляется
(В.О.)
14.
В промышленностиПолучают электролизом расплавов или
растворов их солей.
2NaCl
Расплав
элект ролиз
2Na+Cl2
15. Получение
Применение галогеновДезинфицирующие реагенты
на основе хлора













 Химия
Химия








